-
Medical journals
- Career
Vztah antikoagulační a antigregační terapie u nemocných s chronickým subdurálním hematomem k závažnosti předoperačního stavu a výsledku chirurgické léčby
Authors: D. Hrabovský 1; J. Chrastina J 1,2; V. Feitová 3; M. Zvarová 4; I. Říha 1,2; Z. Novák 1,2
Authors‘ workplace: Neurochirurgická klinika LF MU FN u sv. Anny v Brně, přednosta: prof. MUDr. Z. Novák, CSc. 1; CEITEC MU Brno, ředitel: prof. RNDr. J. Koča, DrSc. 2; Klinika zobrazovacích metod LF MU FN u sv. Anny v Brně, přednosta: MUDr. J. Vaníček, Ph. D. 3; Oddělení klinické hematologie FN u sv. Anny v Brně, primářka: MUDr. M. Zvarová 4
Published in: Rozhl. Chir., 2014, roč. 93, č. 11, s. 536-544.
Category: Original articles
Overview
Úvod:
Chronický subdurální hematom je potenciálně závažné onemocnění postihující především nemocné vyššího věku, často se závažnými komplikujícími onemocněními a rozsáhlou medikací včetně antiagregační a antikoagulační terapie. U symptomatických nemocných je nutná operace – nejčastěji evakuace hematomu z trepanace s drenáží subdurálního prostoru. Cílem studie je rozbor vlivu předoperační antikoagulační nebo antiagregační terapie u nemocných s chronickým subdurálním hematomem na tíži předoperační klinické symptomatologie a výsledek operační léčby včetně četnosti komplikací a reoperací. Materiál a metodika: Práce retrospektivně analyzuje soubor 132 nemocných, operovaných v letech 2008–2013 na pracovišti autorů pro chronický subdurální hematom. U nemocných byly sledovány následující parametry charakterizující předoperační stav: věk, podávaná antikoagulační nebo antiagregační léčba, jiné poruchy hemokoagulace, interval mezi pravděpodobným úrazem a operací, délka trvání příznaků, stav nemocného před výkonem (Glasgow Coma Scale) a přítomnost zřejmé fatické poruchy nebo motorického deficitu alespoň středního stupně. V peri a pooperačním průběhu byl hodnocen typ výkonu, přítomnost recidivy hematomu, způsob reoperace, pooperační komplikace a výsledný stav nemocného hodnocený pomocí Glasgow Outcome Scale. Výsledky: Do souboru bylo zařazeno 64 nemocných (42 mužů, 22 žen) bez antiagregační, antikoagulační a jiné medikace ovlivňující hemokoagulaci a s normálními laboratorními parametry (kontrolní soubor), 20 nemocných (13 mužů, 7 žen) s účinnou warfarinizací a 37 nemocných s antiagregační terapií (30 mužů, 7 žen). Nemocní s antiagregační terapií a warfarinizovaní pacienti byli významně starší než pacienti v kontrolním souboru. U warfarinizovaných nemocných statistické hodnocení prokázalo významně kratší dobu trvání klinických příznaků a významně horší předoperační klinický stav při hodnocení pomocí Glasgow Coma Scale. S jedinou výjimkou byly u všech nemocných primárně indikovány trepanace s drenáží, u nemocných s antiagregační terapií nebo na warfarinu po adekvátní hematologické přípravě. I když byla četnost reoperací pro recidivu hematomu a pooperačních komplikací nejvyšší u warfarinizovaných nemocných, rozdíl proti kontrolnímu souboru nedosahoval statistické významnosti. Hodnocení klinického výsledku s odstupem alespoň 2 měsíců po operaci prokazuje srovnatelný podíl dobrých výsledků (Glasgow Outcome Scale 4,5) ve všech skupinách − 82,8 % v kontrolním souboru, 80 % u warfarinizovaných a 83,8 % nemocných s antiagregační terapií. Závěr: Získaná data neprokázala statisticky významný negativní vliv antikoagulační nebo antiagregační terapie na výsledky neurochirurgické léčby po adekvátní předoperační přípravě u nemocných s chronickým subdurálním hematomem při hodnocení podle Glasgow Outcome Scale. Výsledky prokazují nejvyšší četnost komplikací a recidiv chronických subdurálních hematomů u nemocných na warfarinu, i když rozdíl nedosahuje statistické významnosti. Klíčová slova: chronický subdurální hematom − antiagregační léčba − antikoagulační léčbaÚvod
Chronický subdurální hematom (CHSDH) je potenciálně závažné onemocnění, které postihuje především nemocné vyšší věkové kategorie [1,2]. Četnost je přibližně 2−3 nemocní/100 000 obyvatel/rok [3,4].
Na začátku kaskády pochodů vedoucích ke vzniku CHSDH stojí krvácení mezi mozek a tvrdou plenu. Zdrojem tohoto krvácení mohou být přemosťující žíly mezi mozkem a žilními splavy, kdy především u nemocných s mozkovou atrofií (vyšší věk, alkoholismus, ale i dehydratace s redukcí objemu mozkové tkáně) stačí i malý úraz nebo i prudký pohyb k poranění již napjaté cévy. Z netraumatických příčin je možné zmínit například poruchy srážlivosti krve včetně iatrogenních, onemocnění mozkových cév, karcinomatózní meningitidu a také vznik CHSDH po neurochirurgických operacích.
V tvrdé pleně v okolí subdurálního krvácení dochází ke zmnožení a aktivaci fibroblastů, které následně spolu s kapilárami pronikají do krevní sraženiny. Méně rozsáhlé hematomy se takto resorbují. U krvácení většího rozsahu dochází ke vzniku dvou vrstev pouzdra CHSDH. Silnější zevní stěna je tvořena granulační tkání s nově vytvořenými kapilárami bez souvislé endoteliální vrstvy. Vnitřní list je tvořen tenkou avaskulární membránou. Nárůst objemu CHSDH je způsoben opakovanými drobnými krváceními do dutiny mezi oběma listy při zvětšené permeabilitě novotvořených kapilár a lokální fibrinolýze. Nárůst hematomu díky vyšší osmolaritě jeho tekutého obsahu nebyl prokázán [5,6].
Patologicko-anatomicky se tedy CHSDH skládá z několika komponent: pouzdro se silnějším cévnatým zevním a slabším vnitřním listem, tekutá složka hematomu někdy s krevními koaguly různého stáří po opakovaných krváceních a pablány až charakteru sept v dutině hematomu.
Z klinického hlediska je charakteristickým rysem rozvoj příznaků s odstupem po malém kraniocerebrálním poranění, které se často nedaří anamnesticky identifikovat. I přes potíže s přesnou identifikací vyvolávajícího traumatu se definice CHSDH opírá právě o časový odstup od úrazu, kdy je u chronického subdurálního hematomu uváděn interval více než 3 týdny [3]. Příznaky jsou dány nejen lokálním útlakem mozku, ale také zvýšeným nitrolebním tlakem a přesuny mozkové tkáně, které mohou vést až k její herniaci (nejčastěji temporální konus při herniaci mediálních částí spánkového laloku do oblasti tentoriální incizury). Jedná se především o bolesti hlavy, poruchy hybnosti, řeči a chůze, psychické změny a poruchy vědomí, tedy příznaky řady neurologických nebo psychiatrických onemocnění, což může zvláště při chybějícím údaji o traumatu vést k prodlevě při stanovení diagnózy [7].
CHSDH je nejčastěji diagnostikován pomocí CT vyšetření, které je možné bez větších obtíží provést i u nemocných s nutnou podporou životních funkcí. Méně často je CHSDH překvapivým nálezem při vyšetření MRI indikovaném pro podezření na jiné neurologické onemocnění.
U symptomatických nemocných s CHSDH je metodou první volby operační terapie, nejčastěji trepanace s evakuací tekuté složky hematomu a dočasným zavedením drenáže do subdurálního prostoru. Některé situace ovšem vyžadují jiná řešení. Jako příklad je možné uvést transkutánní trepanaci na lůžku u rizikových nemocných, endoskopickou fenestraci sept v dutině hematomu a resekci pouzdra hematomu z kraniotomie [8]. Při diskuzi o možnostech konzervativní terapie je nutné uvést, že spontánní regrese CHSDH je vzácná − 2,4–18,0 % nemocných [9].
Vzhledem k tomu, že CHSDH nejčastěji postihuje nemocné vyšší věkové kategorie, do popředí vystupuje problém komplikujících onemocnění a souběžné medikace včetně antiagregační a antikoagulační terapie. Pro ilustraci je možné uvést, že v České republice dosahuje počet nemocných dispenzarizovaných pro ischemickou chorobu srdeční 750 000 a 280 000 osob je sledováno pro stav po cévní mozkové příhodě. Oba tyto příklady vyžadují podávání antiagregační nebo antikoagulační terapie [10].
Literární data prokazují, že již samo podávání antikoagulační i antiagregační terapie je spojeno s vyšším rizikem vzniku CHSDH [11]. Tato medikace také může vést k silnějším krvácením z kapilár v pouzdru hematomu zodpovědném za jeho progresi, což může být příčinou rychlejšího rozvoje klinické symptomatologie a závažnějšího stavu. Lze také předpokládat, že antikoagulační a antiagregační terapie s ovlivněním procesu hemostázy může vést u nemocných s CHSDH ke zvýšenému výskytu operačních a pooperačních komplikací s horším konečným výsledkem léčby. Proto je cílem této retrospektivní studie rozbor vlivu předoperační antikoagulační nebo antiagregační terapie na klinický stav a výsledky léčby nemocných s CHSDH, hodnocené podle funkčního výsledku, četnosti recidiv a komplikací.
Materiál a metodika
V práci retrospektivně analyzujeme soubor 132 nemocných operovaných na pracovišti autorů pro CHSDH v období let 2008−2013. Nemocní byli vyhledáni v informačním systému nemocnice, z něhož byla získána i data ve vztahu k průběhu hospitalizace a výsledkům ambulantních kontrol. Kritéria pro zařazení nemocného do souboru mimo operovaného subdurálního hematomu byla: známý odstup od identifikovaného úrazu hlavy přesahující alespoň 3 týdny, nebo trvání relevantní klinické symptomatologie nad 3 týdny. Pokud nebyla identifikována pravděpodobná úrazová příčina a doba trvání příznaků nebyla známa nebo byla kratší než 3 týdny, o zařazení rozhodoval popis radiologického obrazu a peroperační nález hodnocený podle operačního protokolu (charakter tekutiny, přítomnost pouzdra, pablán a závěr operujícího chirurga). Do souboru nebyli zařazeni nemocní, u nichž nebylo možné zjistit jejich stav s odstupem alespoň dvou měsíců od operace. Stejně tak nebyli zařazeni nemocní, u kterých byl příčinou CHSDH předchozí neurochirurgický výkon v nitrolebí.
Pokud se týče operační techniky, metodou volby bylo provedení trepanací v počtu odpovídajícím rozsahu hematomu, evakuace jeho tekuté části, výplachy dutiny, fenestrace vnitřního listu pouzdra a zavedení subdurální drenáže.
Rozsah předoperační přípravy u nemocných s antiagregační a antikoagulační terapií byl stanoven individuálně, dle organizačních možností i ve spolupráci s hematologem. U antikoagulovaných nemocných byl aplikován K vitamin (60 % nemocných), mražená plazma (80 % nemocných), oba preparáty (50 % nemocných) a Prothromplex − komplex koagulačních faktorů II, VI, IX, X – u 10 % nemocných. Pro trepanaci považujeme za dostačující hodnotu INR okolo 1,5–1,7. U nemocných s antiagregační terapií byl před výkonem podáván Dicynone a u 10,3 % nemocných i mražená plazma.
Po trepanaci je drenáž ponechávána obvykle po dobu 4–5 dnů, poté je provedeno CT vyšetření a následně odstranění drénu. Po tuto dobu je nemocný kryt antibiotiky. Drén může být napojen na mírný podtlak nebo několikrát denně manuálně aspirován. Spádovou drenáž u nemocných s CHSDH nepoužíváme.
U nemocných byly sledovány následující parametry charakterizující klinický stav před operačním výkonem: věk, pohlaví, předoperačně podávaná antikoagulační/antiagregační terapie, jiné příčiny poruch hemokoagulace, interval mezi pravděpodobným úrazem a operací, doba trvání příznaků, stav nemocného před výkonem hodnocený pomocí Glasgow Coma Scale a přítomnost zřejmé fatické poruchy nebo hybného deficitu alespoň středního stupně (střední paréza – výraznější snížení svalové síly a omezená aktivní hybnost, která umožňuje vykonávat účelné pohyby, ale s menší silou, případně s částečnou pomocí druhostranných končetin nebo druhé osoby, těžká paréza – neumožňuje vykonávat účelné pohyby končetinou ani za pomoci druhé osoby) [12]. Pro hodnocení perioperačního období a konečného výsledku léčby byl zaznamenán typ výkonu, přítomnost recidivy hematomu a způsob reoperace, pooperační komplikace a výsledný funkční stav nemocného, hodnocený pomocí Glasgow Outcome Scale (GOS 5 − bez deficitu, soběstačný, GOS 4 − s neurologickým deficitem, ale soběstačný, GOS 3 – při vědomí, ale nesoběstačný, GOS 2 − vegetativní stav, GOS 1 − úmrtí).
Statistické hodnocení včetně uspořádání do tabulek bylo provedeno v Institutu biostatistiky a analýz Masarykovy univerzity. Pro kategoriální proměnné je v tabulkách uváděna jejich absolutní a relativní četnost a pro hodnocení statistické významnosti rozdílu byl využit Fischerův exaktní test. U spojitých proměnných je uveden medián (5. a 95. percentil) a průměrná hodnota (SD). P-hodnota pro srovnávací statistiku je určena pomocí Mann-Whitneyho testu.
Výsledky
Do souboru bylo zařazeno 64 nemocných (42 mužů a 22 žen) bez antiagregační, antikoagulační a jiné medikace ovlivňující koagulaci a s normálními hemokoagulačními parametry, 20 nemocných (13 mužů a 7 žen) s účinnou warfarinizací, 37 nemocných s antiagregační terapií (30 mužů a 7 žen) a 11 nemocných (10 mužů a 1 žena) s jinou medikací ovlivňující hemokoagulaci, patologickými koagulačními parametry nebo trombopenií. Ve všech skupinách je tedy zřetelná převaha mužů. Vzhledem k malému rozsahu poslední skupiny a její nehomogenitě (nemocní s koagulopatií při hepatopatii, s nízkomolekulárním heparinem a valproáty v medikaci, leukemičtí pacienti) nebyli tito pacienti do srovnávací statistické analýzy zařazeni.
Parametry hodnotící klinický stav nemocných před operací a srovnání antigregovaných a warfarinizovaných nemocných s kontrolním souborem ukazují Tab. 1 (nemocní s antiagregací) a Tab. 2 (warfarinizovaní nemocní).
Table 1. Srovnání předoperačních nálezů − nemocní s antiagregací a kontrolní soubor Tab. 1: Pre-surgical findings – comparing antiaggregated patients and control group 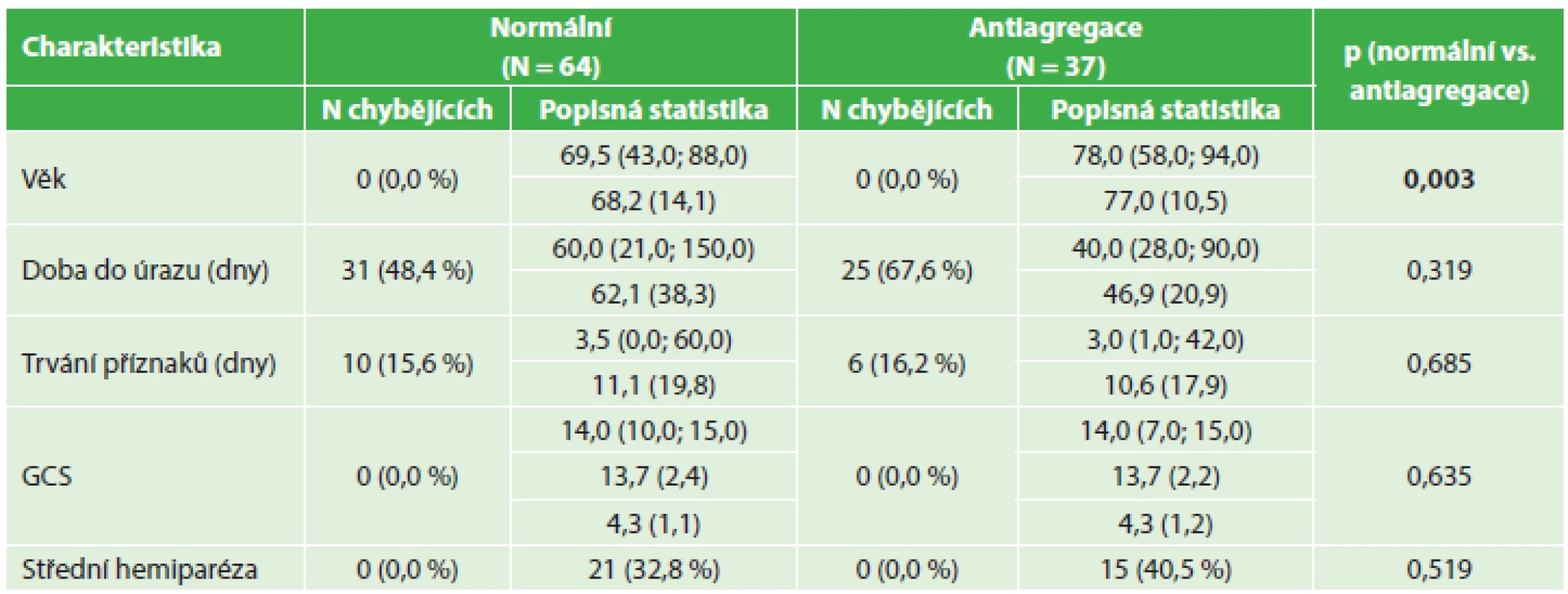
Table 2. Srovnání předoperačních nálezů − warfarinizovaní nemocní a kontrolní soubor Tab. 2: Pre-surgical findings – comparing anticoagulated patients and control group 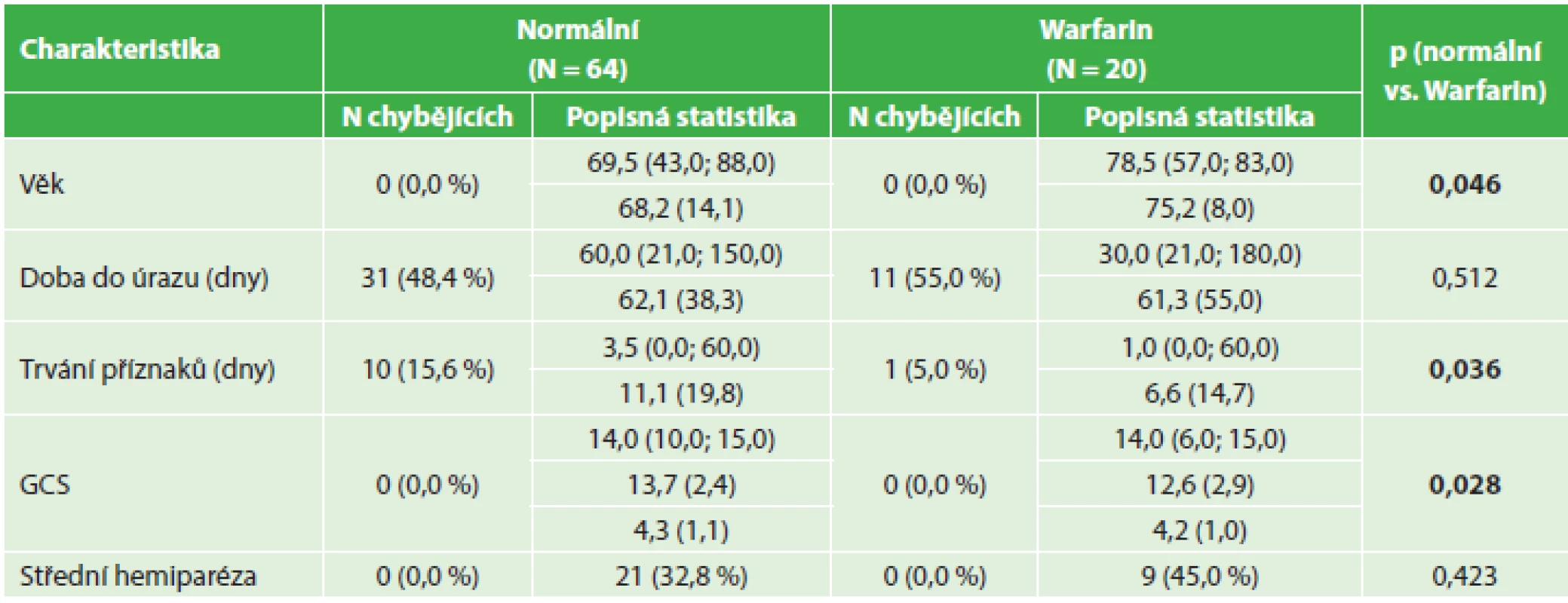
Úrazový děj jednoznačně zodpovědný za vznik hematomu byl identifikován u 51,6 % nemocných s normální hemokoagulací, 45 % warfarinizovaných nemocných a u nižšího počtu nemocných s antiagregační terapií – 32,4 % (v tabulkách je počet nemocných, u nichž nebyl identifikován úrazový zodpovědný děj nebo není možné přesně stanovit délku klinických příznaků, označen jako N chybějících).
Nemocní s antiagregační terapií i s warfarinem byli významně starší než pacienti v kontrolním souboru. U warfarinizovaných nemocných dále statistické hodnocení prokázalo významně kratší dobu trvání klinických příznaků před výkonem a tito nemocní také byli před operačním výkonem v horším stavu při hodnocení pomocí GCS. I když podíl nemocných s klinicky zřejmou fatickou poruchou nebo alespoň středně těžkou hemiparézou byl vyšší u warfarinizovaných nemocných (45 %) a nemocných s antiagregační terapií (40,5 %) než v kontrolním souboru (32,8 %), tento rozdíl nedosahoval statistické významnosti. Medián doby trvání příznaků u warfarinizovaných nemocných (1 den) byl ve srovnání s kontrolním souborem (3,5 dne) statisticky významně nižší.
Jako primární výkon byla u převážné většiny nemocných indikovaná trepanace (jedna nebo více) se zavedením drenáže. U jednoho nemocného se závažnou progredující poruchou vědomí byla ihned po provedení trepanací s evakuací minima tekuté části hematomu nutná konverze výkonu na kraniotomii pro velmi silný zevní i vnitřní list pouzdra hematomu s trvající kompresí mozku.
Tab. 3 (nemocní s antiagregací) a Tab. 4 (warfarinizovaní nemocní) hodnotí průběh perioperačního a pooperačního období uvedených skupin ve srovnání s kontrolním souborem.
Table 3. Srovnání výsledků léčby - nemocní s antiagregací a kontrolní soubor Tab. 3: Comparison of treatment outcomes – antiaggregated patients and control group 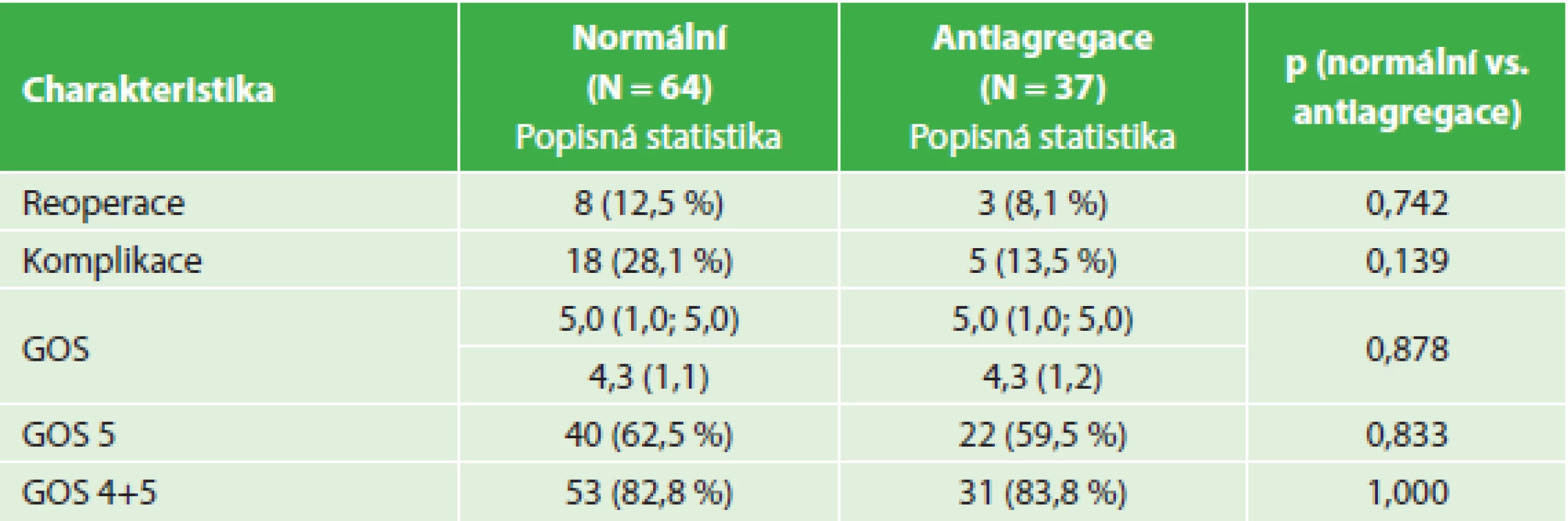
Table 4. Srovnání výsledků léčby – warfarinizovaní nemocní a kontrolní soubor Tab. 4: Comparison of treatment outcomes – anticoagulated patients and control group 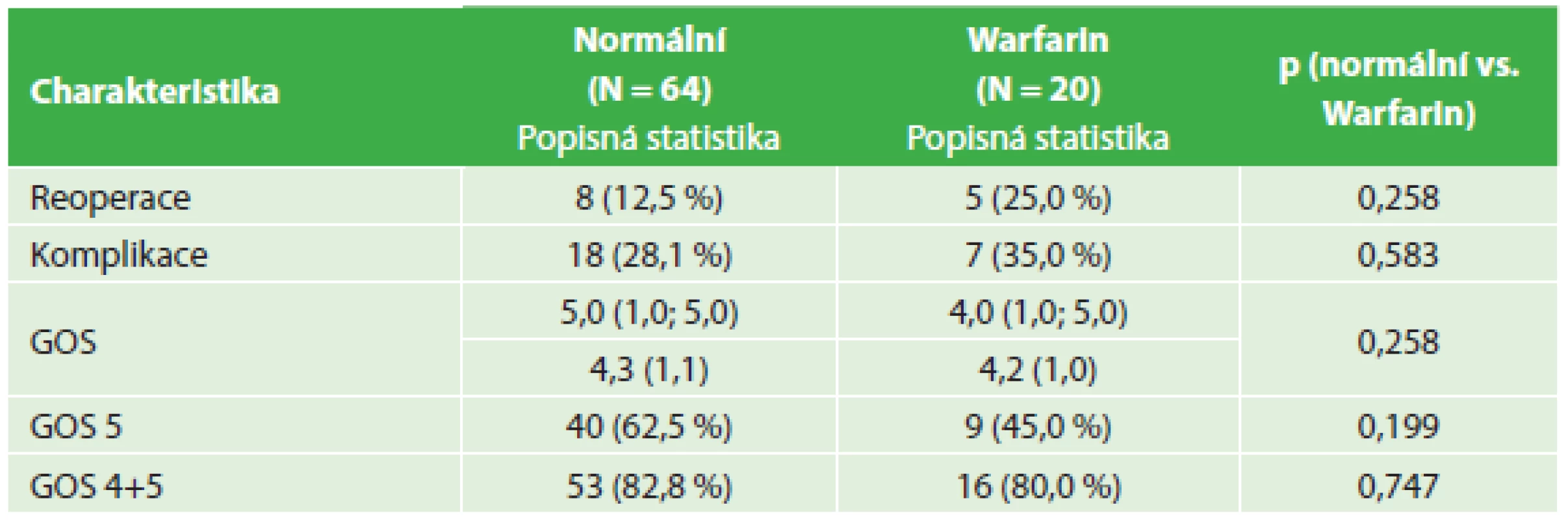
I když četnost nutných reoperací pro recidivu hematomu byla nejvyšší u warfarinizovaných nemocných, rozdíl proti kontrolnímu souboru nedosahoval statistické významnosti. Při operaci recidivy CHSDH byla nejčastěji prováděna další trepanace s drenáží (10 nemocných). Ve skupině warfarinizovaných nemocných byl tento výkon proveden ve čtyřech případech a u jednoho nemocného byla indikována resekce pouzdra hematomu z kraniotomie. Cílem výkonu z kraniotomie je resekce zevního i vnitřního listu pouzdra, samozřejmě za předpokladu bezpečnosti pro nemocného. Ve skupině nemocných s antiagregační terapií u dvou dostačovala trepanace s drenáží a u jednoho nemocného byla provedena endoskopická revize subdurálního prostoru s resekcí membrán. U čtyř nemocných z kontrolního souboru byla provedena nová trepanace a drenáž, u dvou nemocných bylo po trepanaci pro recidivu hematomu nutné provést kraniotomii pro infekční komplikaci a u dvou byla pro recidivu hematomu provedena kraniotomie. U všech nemocných s kraniotomií bylo po uzavření dury možné kostní ploténku replantovat.
Při hodnocení pooperačních komplikací (nejčastěji amentní stavy, plicní infekt, kardiální selhání, komplikace spojené s hojením operační rány, závažná hyponatremie, zánětlivé komplikace, epileptické záchvaty, plicní embolie) byla jejich incidence nejvyšší u warfarinizovaných nemocných, ovšem rozdíl proti kontrolní skupině nebyl statisticky významný.
Hodnocení stavu nemocných pomocí GOS s odstupem alespoň dvou měsíců po operaci prokazuje srovnatelný podíl nemocných s dobrým výsledkem léčby (GOS 4,5) ve všech hodnocených skupinách (82,8 % kontrolní soubor, warfarinizovaní 80 % a s antiagregací 83,8 %). Počet nemocných s výborným výsledkem (GOS 5) je nejnižší ve skupině warfarinizovaných nemocných, ale tento rozdíl nedosahuje statistické významnosti (62,5 % kontrolní soubor, warfarinizovaní 45 % a s antiagregací 59,5 %).
Diskuze
Příčiny zakrvácení do subdurálního prostoru, vedoucí ke vzniku CHSDH, mohou být úrazové a neúrazové. Úrazový děj, často zcela minimálního rozsahu, nemusí být u nemocných anamnesticky identifikován ani retrospektivně při cíleném dotazu. V souboru Aspergena se spolupracovníky se sice úrazový mechanismus podařilo zjistit u 60 % nemocných, ovšem 16 % nemocných možnost úrazu popírala [1]. Podobná data uvádí Kageyama se spolupracovníky, kteří identifikovali úrazový děj u 57 % nemocných s CHSDH [13]. Těmto údajům odpovídají i vlastní výsledky u nemocných s normální hemokoagulací, kde byl úrazový mechanismus zjištěn u 51,6 % nemocných. Počet nemocných s prokázaným úrazovým dějem byl nižší u warfarinizovaných nemocných (45 %) a výrazně nižší u nemocných s antiagregační terapií (32,4 %). Jednou z možných interpretací těchto rozdílů je, že zvláště u nemocných s antiagregační terapií může být příčinou zakrvácení do subdurálního prostoru i zcela minimální úraz nebo například pouze prudší pohyb. Dále lze díky ovlivnění trombocytárních funkcí při antiagregační terapii předpokládat výraznější opakovaná krvácení z patologických cév v zevním listu pouzdra CHSDH, která jsou příčinou progrese jeho rozsahu. Ke vzniku CHSDH nedochází u všech nemocných s prokázaným neoperovaným subdurálním hematomem. Laviv se spolupracovníky pozorovali vznik CHSDH u 43 z 95 nemocných s neoperovaným akutním subdurálním hematomem. Faktory spojenými s vyšším rizikem vzniku CHSDH byly mimo očekávané větší tloušťky hematomu také ischemická choroba srdeční, hypertenze, podávání clopidogrelu, antikoagulační terapie nebo více než jednoho antiagregačního preparátu [14].
Hodnocení předoperačního stavu nemocných pomocí GCS v jednotlivých skupinách prokázalo významně horší předoperační stav u nemocných s warfarinem. U těchto nemocných je také při srovnání s ostatními skupinami nápadně nižší medián doby trvání příznaků (jeden den). Vysvětlením může být mimo jiné časnější provedení kontrolního CT vyšetření u warfarinizovaných nemocných s neurologickým deficitem nebo psychickými změnami díky snadno detekovatelným změnám koagulace při warfarinizaci, které diagnostický proces směřují do problematiky nitrolebního krvácení. Podobně může být vysvětlením kratší doby příznaků před operací i horší klinický stav při přijetí podle GCS, což v kombinaci s patologickou hodnotou INR vzbuzuje naléhavé podezření na nitrolební krvácení s nutným akutním CT vyšetřením.
Diagnostickou metodou volby při podezření na CHSDH je CT vyšetření. CT obraz odpovídá různým strukturám, tvořícím CHSDH (hyperdenzní zevní a vnitřní list pouzdra, různý podíl hyperdenzních membrán a starších koagul v dutině hematomu a hypo nebo izodenzní tekutý obsah). Podle struktury CHSDH a jeho denzity ve srovnání s mozkovou tkání rozlišují Park se spolupracovníky čtyři typy CHSDH – hypodenzní, izodenzní homogenní, typ vrstvený a typ smíšený, kdy nejčastější jsou typ izodenzní a smíšený [15]. Právě izodenzní typ CHSDH je na nekontrastním CT obtížně odlišitelný od mozkové tkáně. Vodítkem pro jeho identifikaci může být přetlak středočárových struktur při jednostranném nálezu (Obr. 1). Při oboustranném hematomu může tento příznak chybět. Za této situace je možné při klinickém podezření identifikovat oboustranný chronický subdurální hematom po aplikaci kontrastní látky, při angiografickém vyšetření (odtlačení cév na povrchu mozku od vnitřního povrchu kalvy) nebo pomocí MRI. Nález při MRI vyšetření u jednotlivých typů subdurálních hematomů (akutní, subakutní, chronický) je dán měnícím se podílem oxyhemoglobinu, methemoglobinu a hemosiderinu. Díky přítomnosti oxyhemoglobinu jsou akutní subdurální hematomy při vyšetření T1WI izointenzní s mozkovou tkání a hyperintenzní v T2 WI. Případná krevní koagula jsou hyperintenzní v T1 WI a hypointenzní v T2 WI. U subakutních a chronických hematomů jsou jejich radiologické charakteristiky dány přítomností methemoglobinu, kdy u chronických subdurálních hematomů methemoglobinu ubývá díky jeho ředění, vstřebávání a rozpadu. Důsledkem přítomnosti methemoglobinu je zkrácení T1 času a hyperintenzita v T1 WI u subakutních hematomů a následně nízká nebo středně zvýšená intenzita u CHSDH, ovšem tento nález nemusí být konstantní. V T2 WI je subakutní subdurální hematom spíše hyposignální a chronický hematom získává hypersignální charakter [16].
Image 1. CT obraz izodenzního hematomu pokrývajícího celou pravou hemisféru mozku; na možnost komprese mozku upozorňuje přetlak pravé postranní komory Fig. 1: CT image of isodense chronic subdural haematoma extending over the entire right hemisphere; the shift of the right ventricle compression should lead to the suspicion of brain compression 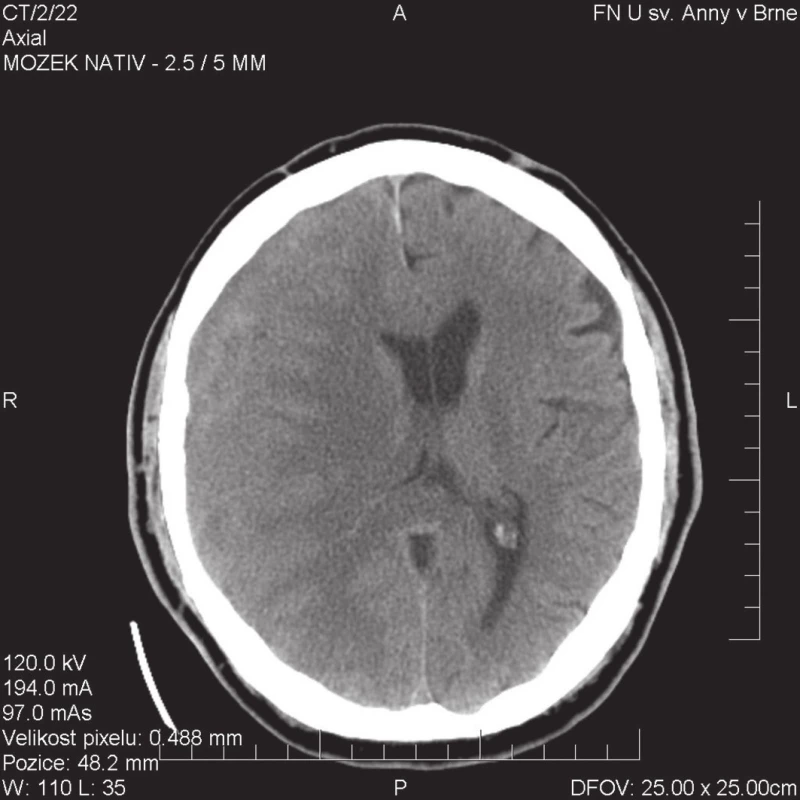
I když je chronický subdurální hematom velmi častou neurochirurgickou diagnózou, jsou i v současnosti některé body léčebné strategie předmětem diskuze. První otázkou je volba optimálního výkonu z hlediska minimalizace komplikací u polymorbidních nemocných (tedy co nejjednodušší a nejkratší výkon – trepanace) a snížení rizika recidivy onemocnění (tedy resekce obou listů pouzdra hematomu a jeho sept z kraniotomie). Podle práce Van Den Vekena se spolupracovníky představuje u CHSDH trepanace s drenáží výkon s optimální rovnováhou mezi riziky výkonu a možností recidivy hematomu [17].
Almenawer se spolupracovníky vyhledali v databázích MEDLINE, EMBASE, CINAHL, Google Scholar a Cochrane Library práce zabývající se možnostmi neurochirurgické terapie u nemocných s CHSDH publikované v letech 1970−2013. 250 vyhledaných sdělení (16 randomizovaných studií) zahrnovalo 34 829 nemocných a k tomuto rozsáhlému souboru autoři přidali vlastní soubor 834 pacientů. Analýza získaných výsledků potvrdila, že primární ošetření subdurálního hematomu z kraniotomie je zatíženo vyšším rizikem komplikací.
Autoři dále srovnávali výsledky léčby CHSDH pomocí transkutánního návrtu lebky provedeného na lůžku s trepanacemi prováděnými běžným způsobem v komfortu operačního sálu a překvapivě mezi uvedenými technikami neprokázali rozdíl v mortalitě nebo četnosti recidiv hematomu [8].
Od rutinně zaváděné drenáže subdurálního prostoru po provedené trepanaci je očekáváno snížení počtu recidiv operovaných CHSDH, což potvrzují i Singh a Wada se spolupracovníky [18,19].
Jinou možnost operačního řešení CHSDH představuje kraniotomie malého rozsahu (minikraniotomie), která spojuje redukci operační zátěže při limitovaném cíleném výkonu se zlepšením zrakové kontroly výkonu proti trepanaci. Touto problematikou se zabývali například Van Der Veken se spolupracovníky, kteří po provedené minikraniotomii dosáhli zlepšení u 84 % operovaných nemocných. Relativně nízká četnost recidiv (8,7 %) je sice vyvážena vyšší četností komplikací (34,1 %), ovšem podíl chirurgických komplikací je nízký (6,3 %). Příčinou poměrně vysoké četnosti komplikací a nemocniční mortality (13,5 %) v souboru operovaných nemocných s průměrným věkem 73,9 roku byly především interní a neurologické problémy, například arteriální hypertenze, srdeční nebo renální selhání, neurodegenerativní onemocnění a koagulopatie [17].
Tento výčet výkonů primárně prováděných pro chronický subdurální hematom je logické zakončit osteoplastickou kraniotomií rozsahu přiměřeného ploše hematomu s resekcí vnějšího a vnitřního listu pouzdra hematomu, evakuací jeho tekuté složky a resekcí pablán v dutině hematomu. Výkon je většinou prováděn jako sekundární pro recidivující CHSDH po primární trepanaci, ovšem Callovini se spolupracovníky tento výkon indikovali jako primární u nemocných s netekutým organizovaným vícevrstevnatým CHSDH (Obr. 2). O rozsahu výkonu rozhodovali na základě MRI vyšetření, kdy jsou organizované hematomy většinou hyperintenzní v T1WI a vyšetření v T2WI prokazuje v dutině hematomu hypointenzní síťovou nebo pavučinovou strukturu. Autoři dosáhli dobrého výsledku u 84 % operovaných. U 6 % byl pooperační průběh komplikován akutním subdurálním hematomem [20].
Image 2. CT obraz septovaného CHSDH s minimem tekuté složky, nutné řešit primární kraniotomií Fig. 2: CT image of septated CHSDH with minimum fluid component, primary craniotomy needed 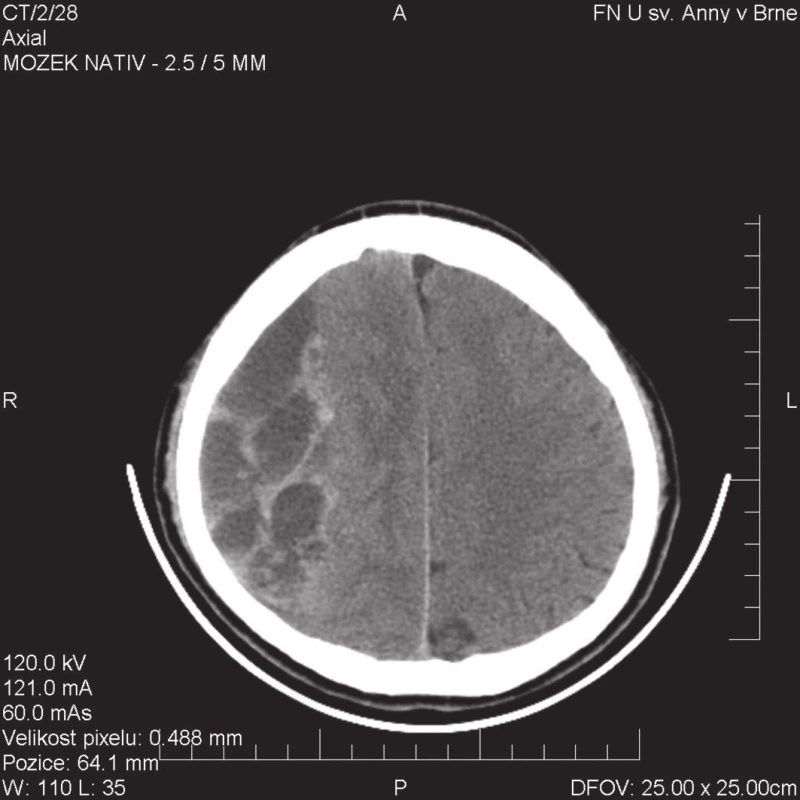
V prezentovaném souboru byla u všech nemocných s jedinou výjimkou indikována jedna nebo vícečetné trepanace s drenáží subdurálního prostoru. Kraniotomie jako primární výkon byla indikována u jediného nemocného v závažném stavu při kompresi mozku rozsáhlým CHSDH s velmi silným pouzdrem (tedy odpovídající nemocnému popisovanému v práci Calloviniho se spolupracovníky, i když MRI nebylo možné provést). U tohoto nemocného evakuace minimálního množství tekuté složky nevedla k dostatečné dekompresi mozku.
Četnost pooperačních recidiv CHSDH se uvádí ve velmi širokém rozmezí − 2,3–33 % [21]. Při hodnocení možných zodpovědných faktorů je nutné vzít do úvahy nejen chirurgickou problematiku, ale také skutečnost, že chronické subdurální hematomy postihují nejčastěji nemocné vyšší věkové kategorie s řadou komplikujících onemocnění a s omezenými možnostmi reexpanze mozkové tkáně při její dlouhodobé kompresi. Podle práce Okana se spolupracovníky je četnost recidiv CHSDH vyšší u nemocných s oboustrannými hematomy a stavem po mozkovém infarktu. Na druhé straně není podle autorů četnost recidiv významně ovlivněna podáváním protidestičkové nebo antikoagulační terapie [22]. Tento výsledek nepotvrzují Wada se spolupracovníky, kteří u nemocných s CHSDH a antiagregační terapií prokázali větší četnost recidiv při operaci ihned po přerušení antiagregační terapie (32 %) ve srovnání s kontrolním souborem nemocných bez antiagregační léčby (11 %). Četnost recidiv klesala, pokud bylo možné operaci CHSDH provést s odstupem po přerušení antiagregační terapie [19]. Tento pokles četnosti recidiv CHSDH při odložení operace u nemocných s antiagregační terapií po přerušení léčby ovšem nepotvrzuje již citovaná práce Okana se spolupracovníky [22]. Dalším faktorem zodpovědným za vyšší četnost recidiv CHSDH je podle očekávání přítomnost sept [21].
I když se pro ošetření recidivujícího CHSDH logicky nabízí resekce z kraniotomie, rizika výkonu u starších polymorbidních nemocných a nemocných s koagulopatiemi nutí uvažovat i o jiných způsobech ošetření. Ve vlastním souboru nová trepanace dostačovala u 10 nemocných (62,5 %) s recidivujícími CHSDH, ale u dalších 2 nemocných po trepanaci pro recidivu CHSDH bylo nutné provést kraniotomii pro infekční komplikaci (12,5 %). I vyšší riziko infekčních komplikací po opakovaných trepanacích u rizikových nemocných představuje podnět pro úvahu o jiných možnostech léčby recidiv CHSDH.
Nedávno publikované sdělení prokázalo výraznou regresi i velmi rozsáhlých CHSDH při celkovém podávání antifibrinolytik. Podstatou této léčby je redukce drobných hemoragií z méněcenných kapilár v zevním listu pouzdra hematomu a ovlivnění fibrinolýzy jako faktorů zodpovědných za nárůst rozsahu hematomu [13]. Hashimoto se spolupracovníky u tří nemocných s recidivujícími CHSDH a u dalších dvou nemocných operovaných pro CHSDH s vysokým rizikem recidivy provedli endovaskulární embolizaci arteria meningica media s cílem uzavření cévního zásobení tvrdé pleny a zevního listu pouzdra chronického subdurálního hematomu. K embolizaci periferního větvení a. meningica media použili 15–20 % N-butyl - 2 cyanoakrylát nebo polyvinylalkohol. Výsledkem zákroku byla u všech nemocných redukce rozsahu hematomu bez nutné operace pro další recidivu [23].
Pro zhodnocení vlastních výsledků je vhodné uvést i kritéria multicentrické studie Coultera se spolupracovníky, do které autoři navrhují zařadit všechny nemocné ve věku nad 16 let s primárními i recidivujícími CHSDH. Hodnotící kritéria jsou přítomnost recidivy onemocnění s nutností reoperace do 60 dnů od primárního výkonu, morbidita a mortalita za hospitalizace na neurochirurgii, doba pobytu na neurochirurgii, klinický stav při propuštění z neurochirurgie hodnocený pomocí modifikované Rankinovy škály (mRankin) a nutnost další péče po propuštění z neurochirurgie, tedy typ zařízení, kam jsou nemocní z neurochirurgie předáváni. Jako cílová kritéria byla stanovena: četnost recidiv pod 20 %, nízká hodnota mRankin (v rozmezí 4 až 6, 4 – schopen chůze jen s pomocí, není schopen bez pomoci zvládnout své tělesné potřeby, 5 inkontinentní, na lůžku, vyžaduje trvalou péči, 6 – smrt; při snaze o analogii s GOS je snad možné srovnat mRankin 4 s GOS 3 – při vědomí, nesoběstačný) při propuštění z neurochirurgie pod 30 %, mortalita na neurochirurgii pod 5 % a morbidita na neurochirurgii pod 10 % [24].
V analyzovaném souboru byla četnost špatných výsledků (GOS 3 a méně) u nemocných s antiagregační terapií 16,2 %, u warfarinizovaných nemocných 20 % a v kontrolním souboru 17,2 %. Četnost špatných výsledků je i s přihlédnutím k určité odlišnosti mezi GOS 3 a mRankin 4 jako hraničnímu kritériu nižší než autory navrhovaná hranice. Při hodnocení výsledku pro jednotlivé skupiny je dále nutné uvést, že warfarinizovaní nemocní s hraničně vyšším podílem špatných výsledků byli při hodnocení pomocí GCS před operačním výkonem ve významně horším stavu než nemocní z kontrolního souboru. Výsledky tedy nepotvrzují statisticky významný vliv předoperační warfarinizace nebo antiagregační terapie na výsledek chirurgické léčby u nemocných s CHSDH. Hypoteticky je pro vysvětlení možné uvést práci Fortuny se spolupracovníky. Tito autoři podobný paradox (lepší výsledky u antiagregovaných nemocných ve srovnání s kontrolním souborem) uvádějí i po akutním kraniocerebrálním poranění a za příčinu považují zrušení hyperkoagulačního stavu po úraze, pokles rizika trombózy a negativních dopadů reperfúze díky trvajícímu efektu antiagregační terapie [25]. Především je ale nutné zdůraznit pozornost věnovanou adekvátní předoperační přípravě nemocných.
Četnost reoperací byla nejvyšší u warfarinizovaných nemocných (25 %), kde překračovala cílovou hodnotu 20 %, navrženou autory studie, ovšem rozdíl proti kontrolní skupině (12,5 %) nedosahuje statistické významnosti. Ve skupině nemocných s antiagregační terapií je četnost reoperací pro recidivu 8,1 %, což je nižší než navrhovaných 20 %. Možným vysvětlením pro překvapivě nižší četnost operovaných recidiv CHSDH u nemocných s antiagregační terapií ve srovnání s kontrolním souborem může být také opatrnější přístup u minimálně symptomatických nemocných při obtížném zrušení antiagregační terapie.
Četnost pooperačních komplikací je vysoká především u nemocných s warfarinem (35 %) a v kontrolním souboru (28,1 %). Zde je ovšem vhodné uvést, že chirurgické komplikace (například infekce operační rány, moková píštěl a hraničně epileptické záchvaty) představují pouze část výše uvedených počtů. U warfarinizovaných nemocných je četnost chirurgických komplikací 5 %, u nemocných s antiagregační terapií 3 % a v kontrolním souboru 4,7 %.
Při souhrnném hodnocení výsledků léčby je možné konstatovat, že mezi skupinami nemocných s CHSDH při warfarinizaci, antiagregační terapii a souborem nemocných s CHSDH při normální hemokoagulaci a bez medikace ovlivňující koagulaci nebyly prokázány statisticky významné rozdíly v parametrech popisujících výsledky léčby. Jedná se o podíl nemocných s dobrými (GOS 4,5) a výbornými (GOS 5) výsledky léčby, četnost recidiv CHSDH s nutnou reoperací a výskyt pooperačních komplikací. Jak již uvedeno výše, jednou z příčin může být pozornost věnovaná předoperační hematologické přípravě u nemocných s antiagregační nebo antikoagulační terapií.
I když je trepanace pro CHSDH poměrně jednoduchý extracerebrální výkon, je nutné zmínit riziko krvácení do rozsáhlé dutiny CHSDH po evakuaci jeho tekuté složky a možnost prokrvácení mozkového parenchymu při jeho přesunech po uvolnění komprese. Lze předpokládat, že riziko nejen výše uvedených nejzávažnějších krvácivých komplikací je vyšší u nemocných s poruchami hemokoagulace a korekce těchto poruch (včetně zrušení účinků medikace ovlivňující hemokoagulaci) může vést ke snížení možnosti jejich vzniku.
Zásady zrušení účinku antikoagulační a antiagregační medikace je možné shrnout do tří bodů: vynechání léku, podání antidota a substituce koagulačních faktorů. Antidotem warfarinu je vitamin K (v akutní fázi nejčastěji v intravenózní formě), jehož efekt se ale projeví až za 6−24 hodin po podání a možným rizikem je vznik rezistence k warfarinu. Ze substituční terapie je možné zmínit mraženou plazmu, faktory protrombinového komplexu a faktor VIIa.
Z antiagregačních preparátů jsou nejčastěji podávány preparáty kyseliny acetylosalicylové, clopidogrel a dnes již méně užívaný ticlopidin. Mechanismem protidestičkového efektu acetylsalicylové kyseliny je inhibice cyklooxygenázové dráhy, což vede k inhibici syntézy tromboxanu A2 a dysfunkci agregace krevních destiček. Při podání Ticlodipinu a Clopidogrelu dochází k vazbě těchto léků na Adenosin difosfát receptory na trombocytární buněčné membráně, což inhibuje vazbu fibrinogenu na povrch destiček. Antiagregační efekt je výraznější než po podání acetylsalicylové kyseliny [26]. Účinky antitrombocytární terapie přetrvávají po dobu života destiček (cca 10 dnů). Před operačním výkonem podáváme ke kompenzaci porušené funkce trombocytů Dicynone (etamsilát), který zlepšuje součinnost cévní stěny a trombocytů, a mraženou plazmu. Další možností je podávání trombokoncentrátů (bez ohledu na počet trombocytů), faktoru rFVIIa a eventuálně i desmopressinu, což je u CHSDH v srovnání s terapií u akutních traumat mozku u nemocných s antiagregační terapií výjimečné [27].
Literární data zabývající se nutnými postupy léčby před operací nemocných s CHSDH a antiagregační terapií jsou nejednoznačná. Na jedné straně je podle Okana se spolupracovníky časná operace CHSDH u nemocných na protidestičkové terapii bezpečná i bez přerušení medikace nebo podání trombonáplavu [22]. Na druhé straně Mascarenhas se spolupracovníky na základě rozboru dvou kazuistik (rozsáhlý CHSDH zhojený po vysazení protidestičkové terapie a fatální hemoragická komplikace po jednoduchých trepanacích pro CHSDH u nemocného s clopidogrelem) navrhují opatrnější postupy. Při malém akutním subdurálním hematomu s rizikem přechodu do hematomu chronického je nutné vysazení protidestičkové terapie. Pokud je u nemocného s CHSDH a antiagregační terapií možná konzervativní léčba a vysazení léků, může již tento postup vést k dobrému výsledku. Pokud je operační výkon odložitelný, autoři navrhují provedení operace po metabolizaci podávaných léků a obnovení funkce destiček. Při akutním výkonu provádějí výkon po adekvátní hematologické přípravě [28].
Závěr
Porovnání předoperačního stavu nemocných s antiagregační terapií a nemocných warfarinizovaných s kontrolním souborem prokázalo významně horší klinický předoperační nález hodnocený pomocí Glasgow Coma Scale a kratší dobu trvání předoperačních klinických příznaků u warfarinizovaných nemocných. Získaná data neprokázala statisticky významný negativní vliv antikoagulační nebo antiagregační terapie na výsledky neurochirurgické léčby u nemocných s chronickým subdurálním hematomem, pokud se hodnotil funkční výsledek léčby podle GOS, četnost recidiv a komplikací léčby. U nemocných na warfarinu byla sice popsána nejvyšší četnost komplikací i recidiv subdurálních chronických hematomů, ale tento rozdíl nedosahoval statistické významnosti. Za hlavní příčinu neprokázaného negativního vlivu antikoagulační a antiagregační medikace na výsledky chirurgické léčby u nemocných s CHSDH považujeme provádění jednoduchého šetrného výkonu po patřičné hematologické přípravě.
MUDr. Jan Chratina, Ph.D.
Nebovidy u Brna 109
664 48 Nebovidy u Brna
e-mail: jan.chrastina@fnusa.cz
Sources
1. Aspegren OP, Astrand R, Lundgren MI, Romner B. Anticoagulationn therapy a risk factor for the development of chronic subdural haematoma. Clin Neurol Neurosurg 2013;115 : 981−984.
2. Mulligan P, Rarore B, Liu S, Olson JJ. Neurological and functional outcomes of subdural haematoma evacuation in patients over 60 years of age. J Neurosci Rural Pract 2013;4 : 250–56.
3. Málek V. Chronický subdurální hematom. Neurologie pro praxi 2003;6 : 307–11.
4. Weir B. Results of burr hole and open or closed suction drainage for chronic subdural hematomas in adults. Can J Neurol Sci 1983;10 : 22–26.
5. Náhlovský J, et al. Neurochirurgie. Praha, Galén 2006.
6. Plas J, et al. Neurochirurgie. Praha, Galén 2000.
7. Gautschi OP, Gallay MN, Kress TT, Korte WC, Hildebrandt G. Chronic subdural haematoma – assesment and management. Praxis (Bern 1994) 2010;99 : 1269–77.
8. Almenawer SA, Farrokhyar F, Hong C, et al. Chronic subdural hematoma management: a systematic review and meta – analysis of 34 829 patients. Ann Surg 2014;259 : 449–57.
9. Horikoshi T, Naganuma H, Fukasawa I, Uchida M, Nukui H. Computed tomography characteristics suggestive of spontaneous resolution of chronic subdural hematoma. Neurol Med Chir (Tokyo) 1998;38 : 527−33.
10. Bultas J. Antitrombotická léčba při anamnéze krvácivé příhody. Remedia 2008;18 : 284–86.
11. De Bonis P, Revisi G, de Waure C, et al. Antiplatelet/anticoagulant agents and chronic subdural haematoma in the elderly. PLoS One 2013;8:e 68732.
12. Bartko D, Drobný M. Neurológia. Učebnice pre lekárské fakulty. Martin, Osveta 3. doplněné vydání 1990.
13. Kageyama H, Toyoka T, Tsuzuki N, Oka K. Non surgical treatment of chronic subdural haematoma with transexamic acid. Clinical article. J Neurosurg 2013;119 : 332–37.
14. Laviv Y, Rappaport ZH. Risk factors for development of significant chronic subdural hematoma following konservative treatment of acute subdural hemorrhage. Br J Neurosurg 2014; May 19,1−6 [E pub ahead of print].
15. Park HR, Lee KS, Shim JJ, Yoon SM, Bae HG, et al. Multiple densities of the chronic subdural hematoma in CT scans. J Korean Neurosurg Soc 2013;54 : 38–41.
16. Senturk S, Guzel A, Bilici A, et al. CT and MR imaging of chronic subdural haematomas: a comparative study. Swiss Med Wkly 2010;140 : 335–40.
17. Van Den Veken J, Duerinck J, Buyl R, Van Rompaey K, Herrengodts P, et al. Mini-craniotomy as the primary surgical intervention for the treatment of chronic subdural hematoma – a retrospective analysis. Acta Neurochirurgica (Wien) 2014;156 : 981 – 87.
18. Singh AK, Suryanarayanan B, Choundhary A, Prasat A, Singh S, et al. A prospective randomized study of the use of drain versus no drain after burr hole evacuation of chronic subdural hematoma. Neurol India 2014;62 : 169−74.
19. Wada M, Yamakami I, Higuchi Y, et al. Influence of antiplatelet therapy on postoperative recurrence of chronic subdural haematoma: a multicenter retrospective study in 719 patients. Clin Neurol Neurosurg 2014;120 : 49–54.
20. Callovini GM, Bolonini A, Callovini G, Gammone V. Primary enlarged craniotomy in organized chronic subdural hematomas. Neurol Med Chir (Tokyo) 2014;54 : 349–56.
21. Ohba S, Kinoshita Y, Nakagawa T, Murakami H. The risk factors for recurrence of chronic subdural haematoma. Neurosurg Rev 2013;36 : 145–9.
22. Okano A, Oya S, Fujisawa N, et al. Analysis of risk factors for chronic subdural haematoma recurrence after burr hole surgery: optimal management of patients on antiplatelet therapy. Br J Neurosurg 2014;28 : 204–8.
23. Hashimoto T, Ojasni T, Watanabe D, et al. Usefulness of embolization of the middle meningeal artery for refractory chronic subdural hematomas. Surg Neurol Int 2013;4 : 104.
24. Coulter IC, Kolias AG, Marcus HJ, et al. UK Neurosurgical Research Network, British Neurosurgical Trainee Research Collaborative. Proposal for a prospective multi-center audit of chronic subdural haematoma management in the United Kingdom and Ireland. Br J Neurosurg 2014;28 : 199–203.
25. Fortuna GR, Mueller EW, James LE, Shutter LA, Hitler KL. The impact of previous antiplatelet and anticoagulant pharmacotherapy on outcome in elderly patiens with hemorrhagic brain injury. Surgery 2008;144 : 598–603.
26. Santa - Cruz RA, Steinhubl SR. Clopidogrel: How good is it and how does it work? Curr Cardiol Rep 2004;6 : 264–68.
27. McMillian WD, Rogers FB. Management of prehospital antiplatelet and anticoagulant therapy in traumatic head injury. J Trauma 2009;66 : 942−50.
28. Mascarenhas L. Illustration of the impact of antiplatelet drugs on the genesis and management of chronic subdural hematoma. Neurochirurgie 2012;58 : 47–51.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 11-
All articles in this issue
- Komplikace v chirurgii
- Efekt dekomprese krční míchy při spondylogenní myelopatii na korové funkce mozku
- Vztah antikoagulační a antigregační terapie u nemocných s chronickým subdurálním hematomem k závažnosti předoperačního stavu a výsledku chirurgické léčby
- Pilonidální sinus – diagnóza na pomezí všeobecné a plastické chirurgie
- Cerebral salt wasting syndrom (CSWS) – nezvyklá kazuistika z chirurgického pracoviště
- Karcinóm sigmy v inkarcerovanej slabinovej prietrži
- 3D High Resolution anorektální manometrie ve funkčním hodnocení anorekta
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cerebral salt wasting syndrom (CSWS) – nezvyklá kazuistika z chirurgického pracoviště
- Pilonidální sinus – diagnóza na pomezí všeobecné a plastické chirurgie
- Karcinóm sigmy v inkarcerovanej slabinovej prietrži
- Komplikace v chirurgii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

