-
Medical journals
- Career
Farmakologické ovlivnění modelového aneuryzmatu břišní aorty – experiment na zvířeti, prvotní výsledky
Authors: K. Houdek 1; J. Moláček 1; V. Třeška 1; Z. Tonar 2; V. Křížková 2; L. Eberlová 2; J. Baxa 3; J. Kobr 4
Authors‘ workplace: Chirurgická klinika LF UK a FN v Plzni, přednosta: Prof. MUDr. V. Třeška, CSc. 1; Ústav histologie a embryologie LF UK v Plzni, vedoucí: Doc. MUDr. M. Králíčková, Ph. D. 2; Klinika zobrazovacích metod LF UK a FN v Plzni, přednosta: Doc. MUDr. B. Kreuzberg, CSc. 3; Dětská klinika LF UK a FN v Plzni, přednosta: Doc. MUDr. J. Kobr, Ph. D. 4
Published in: Rozhl. Chir., 2012, roč. 91, č. 9, s. 475-480.
Category: Original articles
Práce vznikla v rámci programového projektu lékařského výzkumu a vývoje podpořeného IGA MZ. Číslo projektu: NS10235-3/2009
Overview
Úvod:
Cílem práce je ovlivnit růst a histologické změny ve stěně experimentálně navozeného aneuryzmatu břišní aorty u velkého laboratorního zvířete (prase domácí) podáváním atorvastatinu (inhibitoru 3-hydroxy-3-methyl-glutaryl-koenzym A reduktázy).Materiál a metodika:
V uvedené experimentální práci srovnáváme rychlost růstu experimentálního aneuryzmatu u prasete ve skupině ovlivňované podáváním statinu (n=14) a ve skupině farmakologicky neovlivněné (n=13). Srovnáváme i histologické změny ve stavbě aortální stěny v obou skupinách a v aortální stěně bez aneuryzmatu (n=6).Výsledky:
Během 4týdenního sledování jsme neprokázali statisticky významný rozdíl v rychlosti růstu aneuryzmat mezi uváděnými skupinami. Histologická skladba stěny aneuryzmatu se v obou skupinách lišila. Ve skupině zvířat farmakologicky ovlivněné se složení stěny blížilo složení stěny aorty bez aneuryzmatu.Závěr:
Předložené výsledky dokazují, že statiny ovlivňují skladbu aortální stěny. Navozené změny mohou vést ke stabilizaci stěny aneuryzmatu. Domníváme se, že pacienti s menšími aneuryzmaty, kteří nejsou indikováni k chirurgické nebo endovaskulární léčbě, by mohli být léčeni statiny. Tato léčba by mohla stabilizovat stěnu aneuryzmatu, což by mohlo zpomalovat růst a předcházet ruptuře aneuryzmatu.Klíčová slova:
aneuryzma – statiny – experimentální modelÚvod
Aneuryzma břišní aorty a především jeho ruptura je onemocnění s velkým rizikem úmrtí pacienta ještě před přijetím do nemocnice. I přes neustále probíhající multioborový výzkum není ještě zcela objasněna etiopatogeneze tohoto onemocnění. Vše nasvědčuje tomu, že se jedná o multifaktoriální etiologii [1, 2]. Velmi podstatnou roli hrají aktivované matrixmetaloproteinázy a zánětlivá reakce probíhající ve stěně aorty, přičemž mezi sebou oba procesy navzájem souvisejí [1, 2 , 3, 4]. Tyto pochody pak vedou k přestavbě a změně kvality cévní stěny. V současné době je možná pouze operační a radioinvazivní léčba tohoto onemocnění a neustále jsou hledány možnosti konzervativní léčby. Jako jedna z možností farmakologického ovlivnění průběhu onemocnění je diskutováno využití statinů, které by mohly ovlivňovat zánětlivou reakci ve stěně aneuryzmatu, která má bezpochyby úlohu v etiopatogenezi vývoje aneuryzmatu [5, 6, 7]. Cílem předkládaného projektu bylo potvrdit tuto hypotézu na experimetálním modelu aneuryzmatu břišní aorty u velkého zvířete (prase domácí).
Materiál a metodika
První část projektu (vytvoření modelového aneuryzmatu) probíhala na vybaveném experimentálním pracovišti Lékařské fakulty v Plzni, Univerzity Karlovy. Práce probíhala v souladu s Evropskými konvencemi na ochranu zvířat a byla schválena etickou komisí. Pro experiment bylo použito 30 zvířat (prase domácí, věk 70–75 dní, průměrná váha 24,6 kg). Všechna zvířata byla intubována, ventilována a operována v celkové anestezii.
Ze střední laparotomie byla vypreparována břišní aorta. K vytvoření modelového aneuryzmatu byla použita sterilní plastiková manžeta obcházející aortu, která byla nasazena těsně subrenálně a způsobující stenózu aorty o 20 %, a dále byl použit roztok prasečí pankreatické elastázy a fyziologického roztoku v ředění 1 : 1, který byl aplikován kanylou přímo do zaklampovaného úseku subrenální aorty (od renálních tepen po bifurkaci aorty) po dobu 15 minut. Po probuzení z anestezie byla zvířata extubována [8]. Dle našich předchozích zkušeností je právě tato kombinace metod vhodná k vytvoření modelového aneuryzmatu. Delší doba aplikování roztoku elastázy, resp. přerušení průtoku krve vedlo v předchozích experimentech k vysokému výskytu pooperační paraplegie nejspíše jako důsledek míšní ischemie [8]. Tato komplikace se ani u jednoho zvířete v představovaném experimentu nevyskytla.
Polovině zvířat bylo krmivo od 1. dne obohaceno o atorvastatin v dávce 1,0 mg/kg/den (Atorvastatin Ratiopharm 20 mg, KRKA, d.d., Novo Mesto, Slovenia). Výběr zvířat nebyl ničím ovlivněn. Již zveřejněné práce často diskutují právě účinky atorvastatinu a je to také jeden z nejčastěji používaných statinových preparátů [3, 4, 7, 9]. Dvě zvířata zemřela během operace a anestezie v důsledku oběhové nestability (prasečí kardiovaskulární aparát velmi reaguje na změny způsobené vlivem anestezie a na tlakové změny při nasazení cévních svorek a při obnovení krevního průtoku) a jedno zvíře muselo být utraceno 10 dní po operaci pro celkově špatný zdravotní stav a neprospívání (pneumonie). Takto byla získána skupina zvířat ovlivněných atorvastatinem (n=14) a skupina kontrol neovlivněných atorvastatinem (n=13). Sledování zvířat probíhalo 4 týdny. Na konci druhého a čtvrtého týdne byla všem zvířatům provedena ultrazvuková kontrola (Sonoace 9900, Medison, Korea, lineární sonda 5–9 MHz, translumbální přístup) a byla měřena velikost aneuryzmatu (maximální příčný rozměr) a průměr aorty nad aneuryzmatem. K vyloučení statistických chyb vlivem možných interindividuálních rozdílů v šíři aorty mezi jednotlivými zvířaty byl při statistickém hodnocení užíván absolutní rozdíl těchto dvou hodnot. Po ultrazvukové kontrole na konci čtvrtého týdne byla všechna zvířata reoperována opět v celkové anestezii. Byly zresekovány subrenální aorty s aneuryzmaty a zvířata byla v hluboké anestezii utracena kardioplegickým roztokem 7,5% chloridu draselného.
Z každého vzorku aorty byl odebrán totožný cirkulární úsek stěny aneuryzmatu v místě maximálního průměru, který byl zbaven okolní vazivové tkáně a zbytků krve a byl standardními histologickými metodami fixován, zalit do parafínového bločku a barven v 4–5 μm silných řezech. Z každého bločku byly 2 řezy barveny Verhoeffovým hematoxylinem a zeleným trichromem [10] (Obr. 1), aby byly patrné všechny vrstvy stěny aorty a k rozlišení elastinových a kolagenových vláken a buněk cévní hladké svaloviny (VSMC). Další řezy byly zpracovány imunohistochemicky k rozpoznání jednotlivých fenotypů VSMC. K rozlišení kontraktilního a syntetického fenotypu VSMC jsme použili aktin a desmin (kontraktilní fenotyp) a vimentin (syntetický fenotyp) (Obr. 2). Srovnávací vzorky aort bez aneuryzmatu byly získány z prasat stejného stáří jako sledované skupiny s aneuryzmaty. Tato prasata byla prvotně využita pro jinou experimentální práci, která nezasahovala oblast kardiovaskulárního systému a prasata nebyla mimo anestezii nijak farmakologicky ovlivňována.
Image 1. Srovnání histologických preparátů; barvení trichrom; žluté šipky ukazují černě nabarvená vlákna elastinu Fig. 1: Comparison of histological sections; trichrome staining; yellow arrows show black coloured elastin fibres 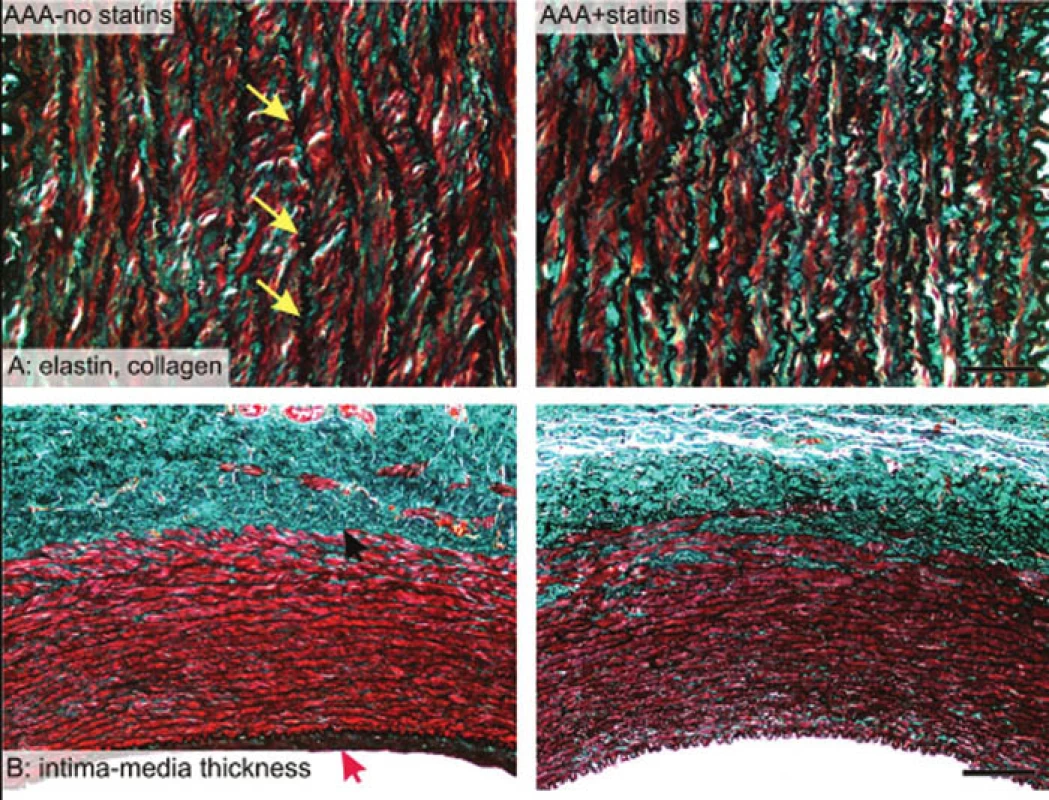
Image 2. Srovnání imunohistochemických preparátů Fig. 2: Immunohistochemistry – comparison of sections 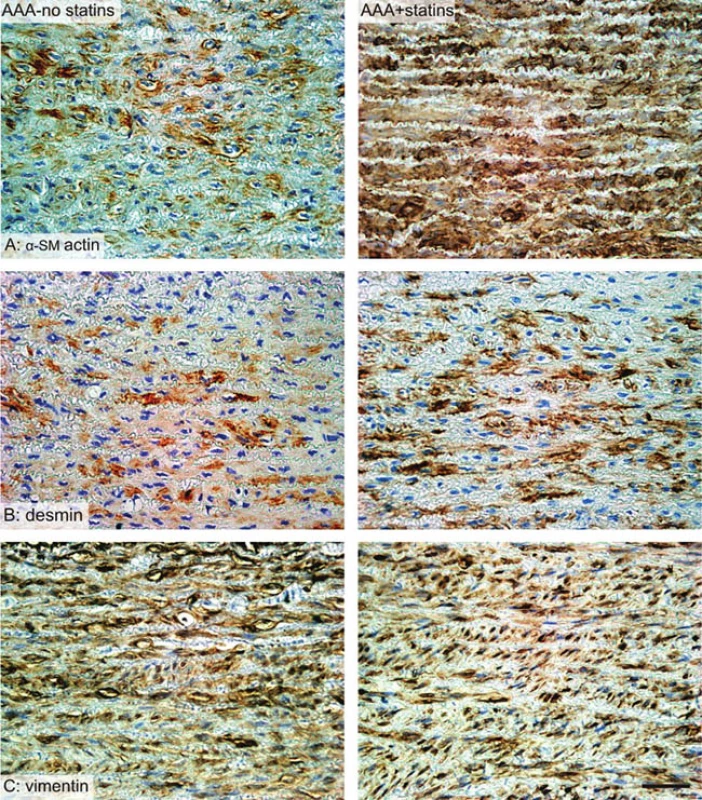
Ke kvantitativní analýze byly použity stereologické metody a software Ellipse (ViDiTo, Košice, Slovakia), podobně jako u předchozích studií aneuryzmat břišní aorty [11] a studiích na prasečích modelech [12].
Míra destrukce elastinových vláken byla vyhodnocena z řezů barvených Verhoeffovým hematoxylinem a zeleným trichromem (Obr. 1) pomocí dvou parametrů: plošný podíl elastinu v intimě a medii AA (elastin, intima+media) a délková hustota elastinových vláken v intimě a medii LA (elastin, intima+media) ve dvou rovinách. Obě metody jsou založeny na počítání elastinových vláken a membrán ve stereologické mřížce [12].
Stejné metody i řezy byly použity pro odhad plošného podílu kolagenu v intimě a medii AA (collagen, intima+media). Stejné řezy, ale při jiném zvětšení, byly použity i pro měření tloušťky intimy a medie (Obr. 1).
Přítomnost buněk exprimujících aktin, desmin a vimentin v intimě a medii byla vyjádřena a kvantifikována opět jako plošný podíl příslušných, při imunohistochemii pozitivních populací buněk AA (actin, intima+media), AA (desmin, intima+media) a AA (vimentin, intima+media).
Veškerá zjištěná data a měření byla zpracována statisticky za použití softwaru Statistica Base 9 (StatSoft, Inc., Tulsa, OK, USA). Cílem bylo zjistit odlišnosti ve všech sledovaných parametrech mezi skupinou ovlivněnou statinem a skupinou neovlivněnou a srovnání obou skupin se stěnou aorty bez aneuryzmatu. Vzhledem k rozdělení dat byly použity neparametrické testy Wilcoxonův párový test a Mannův-Whitneyův test. Jako statisticky významné rozdíly byly považovány výsledky s dosaženou hladinou významnosti p<0,05.
Výsledky
Ve váze zvířat nebyly v průběhu experimentu žádné rozdíly mezi oběma skupinami.
Výsledky ultrazvukových měření jsou zobrazeny v Grafu 1. a Obr. 1 srovnává histologické preparáty obou skupin.
Graph 1. Velikosti aneuryzmat dle sonografických měření Graph 1: Size of aneurysms, measured by ultrasound 
Průměr aorty
Ve skupině kontrolních zvířat jsme pozorovali větší nárůst maximálního průměru aorty po 28 dnech než po 14 (p=0,001, Graf 1). Ve skupině zvířat ovlivněných atorvastatinem jsme nepozorovali nárůst maximálního průměru aorty po dobu experimentu. Pokud jsme srovnali nárůst průměru aorty mezi oběma skupinami 14. den a poté i 28. den, nepozorovali jsme ani při jednom srovnání statisticky významný rozdíl.
Elastin, kolagen a tloušťka stěny
Ve skupině ovlivněné statinem byly oba sledované parametry charakterizující síť elastinových vláken vyšší než ve skupině kontrol (p<0,001, Graf 2). Tloušťka intimy a medie byla naopak ve skupině kontrol větší než ve skupině ovlivněné (p=0,003, Graf 3). Větší tloušťka stěny aneuryzmat u zvířat neovlivněných atorvastatinem byla způsobena utvářením neointimy a zesílením medie.
Graph 2. Srovnání a kvantifikace histologických parametrů – elastin Graph 2: Comparison and quantification of histological parameters – elastin 
Graph 3. Srovnání síly stěny aneuryzmatu Graph 3: Aneurysmal wall thickness 
Exprese aktinu, desminu a vimentinu ve stěně aneuryzmatu
Ve vzorcích ze skupiny statinem ovlivněných zvířat jsme nalezli vyšší expresi aktinu než ve skupině kontrol (p=0,013, Graf 4). Opačná situace byla při expresi vimentinu, která byla vyšší ve skupině kontrol (p=0,012, Graf 5). V expresi desminu nebyly mezi skupinami rozdíly (Graf 4).
Graph 4. Srovnání a kvantifikace histologických parametrů – aktin, desmin Graph 4: Comparison and quantification of histological parameters – actin, desmin 
Graph 5. Srovnání a kvantifikace histologických parametrů – kolagen, vimentin Graph 5: Comparison and quantification of histological parameters – collagen, vimentin 
Složení aortální stěny
Mimo výše zmíněných nálezů jsme ve skupině kontrol nalézali na preparátech neointimu. Na preparátech ze skupiny ovlivněné statiny se neointima neformovala. V obou skupinách jsme v adventicii nalézali lymfoidní folikly. V obou skupinách s aneuryzmaty byla zánětlivá infiltrace srovnatelná a v obou skupinách výraznější než ve stěně aorty bez aneuryzmatu. Stejné výsledky jsme zaznamenali pro neutrofilní granulocyty i makrofágy (Graf 6). Na žádném ze zkoumaných vzorků jsme nenalezli trombus, depozita lipidů, ložiska medionekrózy, intramurálního hematomu, disekce ani ruptury. Elastinová vlákna byla částečně porušena i v adventicii, ale protože na odebraných vzorcích nebyla adventicie zachovaná vždy v celé tloušťce, nebyly tyto změny kvantifikovány.
Graph 6. Srovnání a kvantifikace histologických parametrů – zánětlivá infiltrace ve stěně – makrofágy, neutrofilní granulocyty Graph 6: Comparison and quantification of histological parameters – inflammatory cells in the wall of aneurysm – macrophages, neutrophilic granulocytes 
Diskuze
Model experimentálního aneuryzmatu
K vytvoření experimentálního aneuryzmatu byl použit model vycházející z předchozích prací našeho pracoviště. Nejlépe dochází k rozvoji aneuryzmatu právě při použití kombinace obou metod – poststenotické dilatace a účinku elastázy. Domníváme se, že elastáza navozuje změny a aktivuje kaskády zánětlivé reakce podobně jako matrixmetaloproteinázy, což bylo doloženo srovnáním hladin adhezivních molekul [8]. Domníváme se, že vzhledem k předpokládanému účinku statinu právě v oblasti zánětlivé reakce (její inhibice) byl námi použitý model zvolen správně.
Zvětšování průměru aorty u zvířat neovlivněných statinem
Rozměry byly měřeny s přesností na milimetry, což nemuselo být dostatečně senzitivní k detekci změn. Všechna zvířata byla v průběhu celého experimentu ve stejných časových intervalech vážena. Zvířata v obou skupinách rostla během experimentu stejně, a podávaný atorvastatin tedy neovlivňoval prospívání zvířat a celkový růst zvířat není tudíž faktor, který by ovlivňoval výsledky růstu aneuryzmat. Vzhledem k omezené délce trvání experimentu a sledování zvířat si netroufáme dělat jen na základě výsledku měření velikosti aneuryzmat jednoznačné závěry. Proto bylo nutné zkoumat i histopatologické změny, které jsou uvedeny výše a které podporují hypotézu, že by statiny mohly stabilizovat stěnu aneuryzmatu a brzdit tak další progresi velikosti aneuryzmatu.
Větší množství elastinu u zvířat léčených statinem
Přínosný efekt atorvastatinu na elastin přítomný v extracelulární matrix arterií byl již publikován [9]. Mechanismus účinku je pleiotropní a dává se do souvislosti s antioxidativními vlastnostmi statinu [9], prostřednictvím inhibičního efektu na vyzrávání makrofágů [7], stejně jako s inhibičním efektem na matrixmetaloproteinázy [3, 4]. Tento efekt atorvastatinu na kvalitnější elastinovou síť, který jsme potvrdili v našem projektu, by mohl mít i klinický význam. Dle publikovaných prací je míra elasticity a distenzibility aortální stěny prediktivním faktorem k indikaci a správnému časování plánované chirurgické léčby i malých aneuryzmat [13]. Efekt atorvastatinu na elastinová vlákna a síť v aortální stěně tyto publikované výsledky významně podporuje.
Změna v syntetický fenotyp VSMC, nejsou-li podávány statiny
Naše výsledky odpovídají výsledkům Wagnera (2010) [14], který na prasečím modelu potvrdil, že lovastatin brání procesu snížené tvorby kontraktilních proteinů. Tento efekt společně s tvorbou neointimy nejspíše vysvětluje i zesílení stěny ve skupině statinem neovlivněných zvířat. Přestože je stěna aneuryzmatu v této skupině silnější, s ohledem na histologickou stavbu předpokládáme, že takováto stěna je méně stabilní. Lze předpokládat i určitý stupeň ischemie, proto bude ještě doplněno srovnání množství a distribuce vasa vasorum a míra neovaskularizace ve stěně aorty mezi skupinami.
Prasečí model vs. AAA u lidí
Anatomie a fyziologie lidského a prasečího organismu jsou velmi podobné. Z tohoto pohledu je prasečí model velmi vhodný i v oblasti kardiovaskulární. V experimentu byly použity vyšší dávky atorvastatinu, než je běžné u lidí. Proto určitě zůstává otázka, zda by se všechny pozitivní efekty atorvastatinu dostavily i při odpovídajících dávkách jako v humánní medicíně. V současné době již řada pacientů profituje z užívání statinů v sekundární prevenci aterosklerózy. Další experimentální a klinické práce snad v budoucnu ukážou, zda jsou malá aneuryzmata břišní aorty správnou indikací k léčbě statiny.
Závěr
Na základě výsledků naší experimentální práce se domníváme, že léčba malých aneuryzmat abdominální aorty pomocí statinů by byla vhodná. Tuto hypotézu se pokusíme podpořit ještě proteomickou analýzou odebraných vzorků aortální stěny, nicméně bude nutná velká randomizovaná studie k potvrzení této hypotézy.
Zkratky
VSMC – buňky hladké cévní svaloviny
MUDr. Karel Houdek
Větrná 774
330 12 Horní Bříza
e-mail: houdekk@fnplzen.cz
Sources
1. Treska V, Kocova J, Boudova L et al. Inflammation in the wall of abdominal aortic aneurysm and its role in the symptomatology of aneurysm. Cytokines Cell Mol Ther 2002;7 : 91–97.
2. Michel JB, Martin-Ventura JL, Egido J et al. FAD EU consortium: Novel aspects of the pathogenesis of aneurysms of the abdominal aorta in humans. Cardiovasc Res 2011;90 : 18–27.
3. Wilson WR, Evans J, Bell PR et al. HMG-CoA reductase inhibitors (statins) decrease MMP-3 and MMP-9 concentrations in abdominal aortic aneurysms. Eur J Vasc Endovasc Surg 2005;30 : 259–262.
4. Sluijter JP, de Kleijn DP, Pasterkamp G. Vascular remodeling and protease inhibition – bench to bedside. Cardiovasc Res 2006;69 : 595–603.
5. Moll FL, Powell JT, Fraedrich G et al. Management of abdominal aortic aneurysms clinical practice guidelines of the European society for vascular surgery. Eur J Vasc Endovasc Surg 2011;41:S1–S58.
6. Gajendragadkar PR, Cooper DG, Walsh SR et al. Novel uses for statins in surgical patients. Int J Surg 2009;7 : 285–290.
7. Shiraya S, Miyake T, Aoki M et al. Inhibition of development of experimental aortic abdominal aneurysm in rat model by atorvastatin through inhibition of macrophage migration. Atherosclerosis 2009;202 : 34–40.
8. Moláček J, Třeška V, Kobr J et al. Optimization of the model of abdominal aortic aneurysm – experiment in an animal model. J Vasc Res 2009;46 : 1–5.
9. Briones AM, Rodríguez-Criado N, Hernanz R et al. Atorvastatin prevents angiotensin II-induced vascular remodeling and oxidative stress. Hypertension 2009;54 : 142–149.
10. Kočová J. Overall staining of connective tissue and the muscular layer of vessels. Fol Morphol 1970;18 : 293–295.
11. Tonar Z, Witter K, Křížková V et al. Stereological tools for quantitative microscopy of the aortic wall with focus on the abdominal aortic aneurysma. In: Méndez-Vilas A, Díaz J (Eds.). Microscopy: Science, Technology, Applications and Education. Applications in Biology and Medicine. Formatex Research Centre, Badajoz 2010 : 926–935.
12. Witter K, Tonar Z, Matějka VM et al. Tissue reaction to three different types of tissue glues in an experimental aorta dissection model: a quantitative approach. Histochem Cell Biol 2010;133 : 241–259.
13. Hoegh A, Lindholt JS. Basic science review. Vascular distensibility as a predictive tool in the management of small asymptomatic abdominal aortic aneurysms. Vasc Endovascular Surg 2009;43 : 333–338.
14. Wagner RJ, Martin KA, Powell RJ et al. Lovastatin induces VSMC differentiation through inhibition of Rheb and mTOR. Am J Physiol Cell Physiol 2010;299:C119–127.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2012 Issue 9-
All articles in this issue
- Abdominální komplikace u pacientů po implantaci mechanické srdeční podpory
- Vývoj operativy onemocnění jater a žlučových cest
- SILS apendektómia pre akútnu apendicitídu – dvojročné skúsenosti
- Farmakologické ovlivnění modelového aneuryzmatu břišní aorty – experiment na zvířeti, prvotní výsledky
- Divertikul veľkej kurvatúry žalúdka ako príčina anemizácie
- Obrovský gastrointestinální stromální tumor – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obrovský gastrointestinální stromální tumor – kazuistika
- Divertikul veľkej kurvatúry žalúdka ako príčina anemizácie
- Vývoj operativy onemocnění jater a žlučových cest
- SILS apendektómia pre akútnu apendicitídu – dvojročné skúsenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

