-
Medical journals
- Career
Endosonografie jícnu v diagnostice a léčbě tumorů jícnu
Authors: M. Stašek 1; I. Tozzi Di Angelo 2; R. Aujeský 1; K. Vomáčková 1; R. Vrba 1; Č. Neoral 1
Authors‘ workplace: I. chirurgická klinika LF UP a FN Olomouc, přednosta: doc. MUDr. Č. Neoral, CSc. 1; II. interní klinika LF UP a FN Olomouc, přednosta: Doc. MUDr. V. Procházka, PhD. 2
Published in: Rozhl. Chir., 2012, roč. 91, č. 7, s. 357-361.
Category: Review
Overview
Vyšetření endoskopickou ultrasonografií (EUS) u tumorů jícnu je široce užívanou metodou s nutností dalšího studia jejího přínosu a indikace. EUS hraje důležitou roli ve stagingu a managementu další terapie.
Přehledový článek dává aktuální pohled na význam endosonografie dle současné světové literatury. Zdůrazňujeme současné technické možnosti, důležitost endosonografie pro management časného karcinomu jícnu, T-staging primárního tumoru, výhody pro stanovení N-stádia, potenciál pro detekci generalizovaného onemocnění ve srovnání s CT a PET/CT a možnosti histologické evaluace. Zvláště zmiňujeme vliv endosonografie pro management mezenchymálních tumorů jícnu.
Endosonografii považujeme za zlatý standard pro diagnózu submukózních tumorů jícnu. Má zvláštní význam pro evaluaci časného karcinomu jícnu a detekci postižení lymfatických uzlin v oblasti truncus celiacus. Je též komplementární metodou pro diagnostiku vyšších stádií karcinomů jícnu. Přínos metody však vyžaduje další vědecké zhodnocení.Klíčová slova:
endosonografie jícnu – časný karcinom jícnu – staging karcinomu jícnu – submukózní tumor jícnuÚvod
Tumory jícnu lze rozdělit na tumory vycházející z epitelových struktur a tumory vycházející ze struktur stěny jícnu, většinou submukózní či intramurální lokalizace. Přístup k jejich terapii je s ohledem na předpokládanou etiologii a prokázaný rozsah onemocnění rozdílný a správná diagnostika umožňující dosáhnutí adekvátního stagingu onemocnění významně přispívá k rozhodnutí o optimální taktice léčby.
Jednou z metod, která obohacuje možnosti diagnostiky, je endosonografie jícnu. Historie endosonografie začíná publikací DiMagna a kolektivu v roce 1980 [1]. Záhy byla užita pro diagnostiku karcinomu i subepiteliálních lézí jícnu a získala v ní své místo.
Technika a přístrojové vybavení
Základními technickými variantami jsou [2, 3] zobrazení radiální, lineární a vyšetření pomocí minisond. Endosonograf pracuje s frekvencemi 5, 7,5 a 12–20 MHz, které umožňují detailnější zobrazení než transabdominální ultrazvuk, s narůstající frekvencí však klesá penetrace ultrazvuku do tkáně. Tato není překážkou díky maximálnímu přiblížení sondy zobrazované struktuře. Vodivého prostředí a tím maximálně kvalitního endosonografického obrazu lze dosáhnout přímým kontaktem či balonkem na sondě endosonografu naplněným bezplynovou vodou až do množství 10 ml či přímou instilací vody do dutého orgánu.
První užívanou metodou endoskopického ultrazvuku byla radiální endosonografie s mechanickou sondou, jejíž nevýhodou je pouze diagnostický výkon bez možnosti histologického či cytologického upřesnění. Významným technologickým pokrokem bylo zavedení do praxe elektronické radiální endosonografie s možností barevného mapování a dopplerometrického vyšetření cév.
Lineární systém umožňuje odběr aspirační tenkojehlové biopsie (FNAB – fine needle aspiration biopsy) nebo tzv. tru-cut biopsii s možností cytopatologické analýzy a v indikovaných případech i provedení terapeutických zákroků pod endosonografickou kontrolou.
Minisondy zaváděné pracovním kanálem endoskopu pracují s frekvencemi 12–30 MHz a podávají detailní informace o struktuře stěny vyšetřovaného orgánu.
Incidence komplikací endosonografie je obecně nízká [4], jako nejvážnější komplikaci lze označit perforaci GIT [5], která byla zjištěna dle literárních údajů v méně než 0,1 % případů.
EUS u karcinomu jícnu
Mezi hlavní indikace EUS u karcinomu jícnu patří verifikace hloubky invaze se stanovením T-stadia a zhodnocení závažnosti a rozsahu patologické lymfadenopatie mediastina a oblasti tripus Halleri. Stanovení T-stadií pomocí EUS má význam jak pro rozhodnutí o indikaci endoskopické terapie u časných stadií tumoru, tak i pro stanovení pokročilých T3 stadií, která jsou indikována k neoadjuvantní chemoradioterapii. Nelze opomenout ani přínos endosonografie pro detekci lokoregionálních patologických nálezů, jako jsou zejména přítomné jícnové varixy, které mohou zásadně ovlivnit přístup k endoskopické nebo chirurgické terapii [6].
EUS u časného karcinomu jícnu
- ad a) Spinocelulární karcinom jícnu (SCC)
Indikace k endoskopické terapii u SCC záleží pochopitelně na více faktorech, ať už sem řadíme věk s celkovými či lokálními komorbiditami, plocha postižení a podíl zasažené cirkumference stěny jícnu, informovaný souhlas pacienta, compliance. Přínos EUS spočívá v určení hloubky invaze s prokázanou nejvyšší přesností proti ostatním vyšetřovacím modalitám. Vztah hloubky invaze a lokálního metastatického potenciálu [7] je literárně potvrzen: postižení m1-m2 má výskyt metastáz 0–3 %, m3 9–12 %, s nárůstem invaze do submukózy – sm1 15–26 %, sm2–3 až 45 % (viz Obr. 1, Obr. 2). Při nízkém riziku metastatického postižení a ploše postižení jícnu na méně než 2/3 až 1/2 cirkumference jícnu lze indikovat endoskopickou mukózní resekci, při invazi do submukózy je podmínkou arteficiální elevace tumoru submukózní injekcí, tzv. lifting, který umožňuje potenciálně kurativní řešení i u pacientů rizikových či odmítajících operační řešení. Dle studie Rampada a kol. [8], která je věnována rozlišení hloubky invaze u povrchních karcinomů (adeno - i spinocelulární karcinom), je potvrzena obtížnost rozlišení mezi invazí mukózy a submukózy, která má v souboru 55 pacientů přesnost 70–80 % a lze předpokládat, že přesnost detekce hloubky invaze narůstá od distálního jícnu vzhůru.
Image 1. Vrstvy stěny jícnu v histologickém hodnocení – schéma Fig. 1: Oesophageal wall layers in histological evaluation – diagram 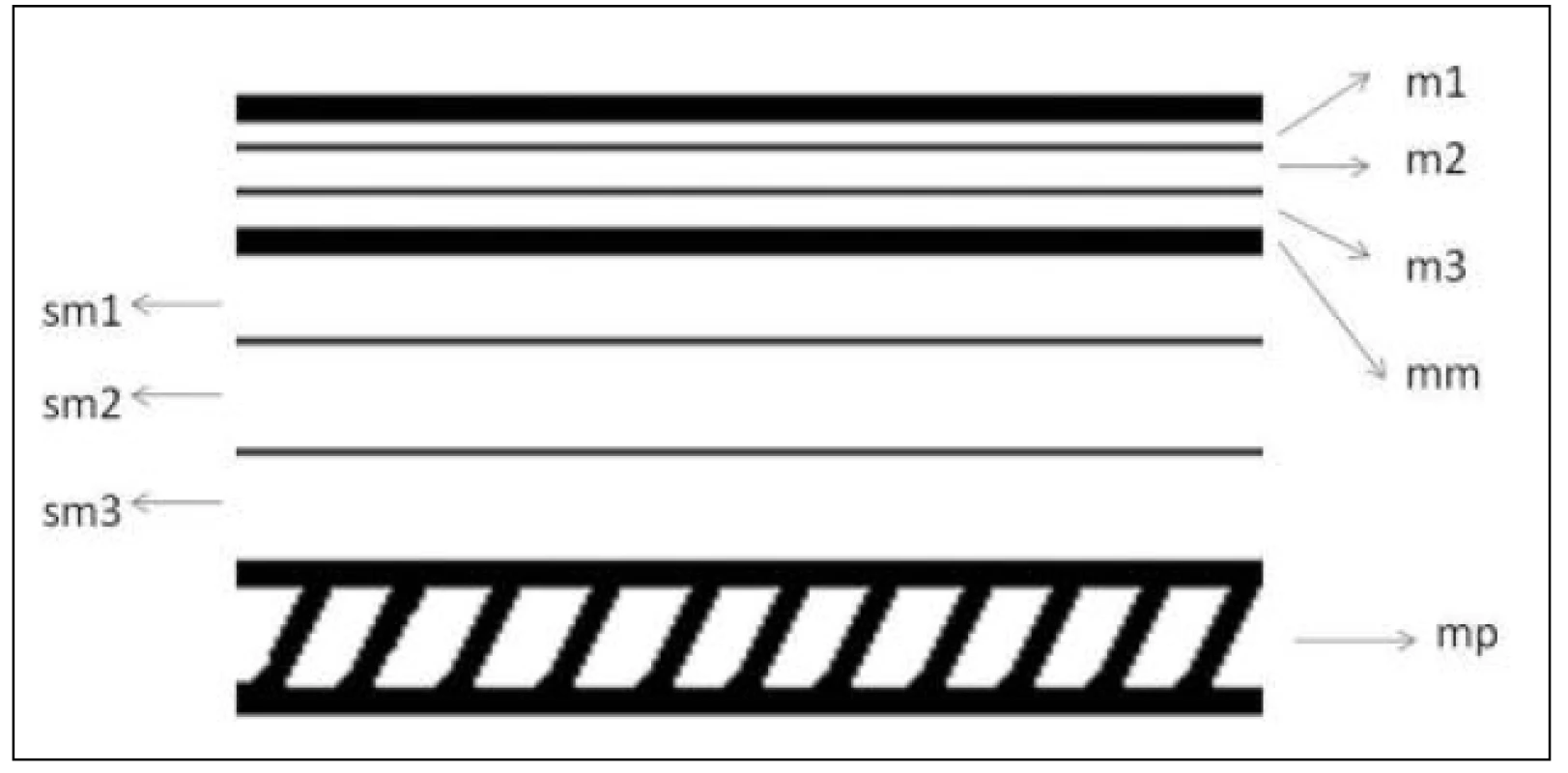
Legenda – m – mucosa, mm – lamina muscularis mucosae, sm – submucosa, mp – lamina muscularis propria; čísla 1–3 označují třetiny vrstvy Key – m – mucosa, mm – lamina muscularis mucosae, sm – submucosa, mp – lamina muscularis propria; numbers 1–3 label the different thirds of the layer Image 2. Vrstvy stěny jícnu v echoendoskopickém obraze – schéma Fig. 2: Oesophageal wall layers in an endoscopic ultrasound picture – diagram 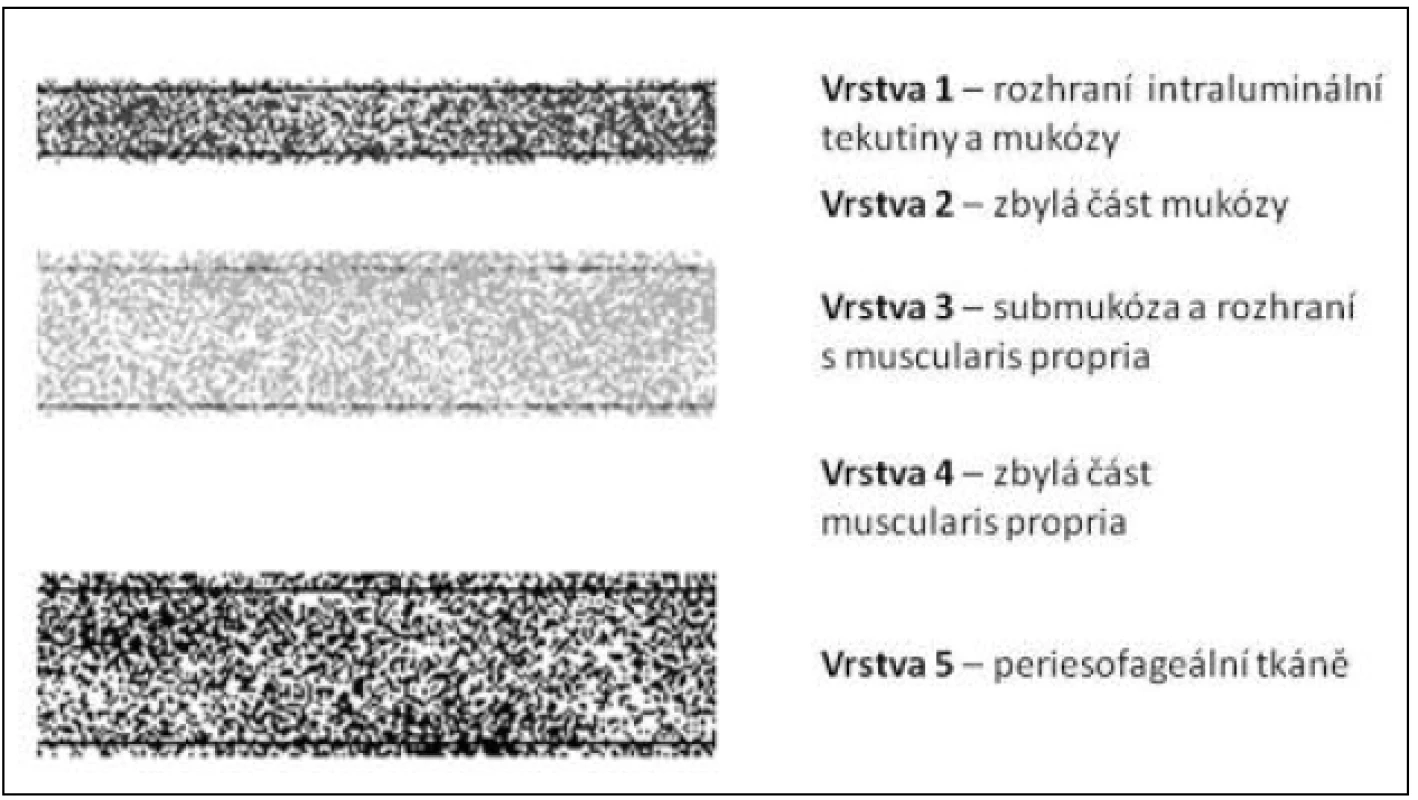
- ad b) Adenokarcinom jícnu
Adenokarcinom jícnu je částečně preventabilní onemocnění u správně diagnostikovaných a dispenzarizovaných pacientů s Barrettovým jícnem. I přes pravidelné sledování resekáty jícnu u pacientů s high-grade dysplazií obsahují histologicky potvrzený invazivní adenokarcinom až v 35 % [9]. Časný adenokarcinom v terénu Barrettova jícnu má nižší metastatický potenciál než spinocelulární karcinom: invaze m1–3 má 0 % detekovaných metastáz, s invazí do sm1–3 narůstá frekvence metastáz na 15–25 % [10]. Největší soubor endoskopicky řešených pacientů s časným adenokarcinomem udává Ell [11], u pacientů s definovaným nízkým rizikem (makroskopické typy I, IIa, IIb a IIc dle pit pattern klasifikace [12], průměr do 2 cm, mukózní lokalizace a histologické typy G1–2) dosahuje kompletní lokální kontroly onemocnění v 97 %. Nedostatkem studie je zatím příliš krátké sledování pacientů. EUS je u adenokarcinomu přínosem pro indikaci endoskopické mukózní resekce, nicméně pro nedostatečnou citlivost je nevhodný pro pravidelné kontroly při dispenzarizaci tumorů jícnu (Obr. 3).
Image 3. Radiální EUS jícnu v korelaci s endoskopickým nálezem při časném adenokarcinomu v terénu Barrettova jícnu – nerovnosti a rigidita stěny jícnu, bez invaze submukózy, provedena endoskopická mukozektomie Fig. 3: Radial oesophageal endoscopic ultrasound in correlation with endoscopic picture in early oesophageal carcinoma in Barrett’s oesophagus – roughness and rigidity of the oesophageal wall, without submucosal invasion, treated by endoscopic musocal resection 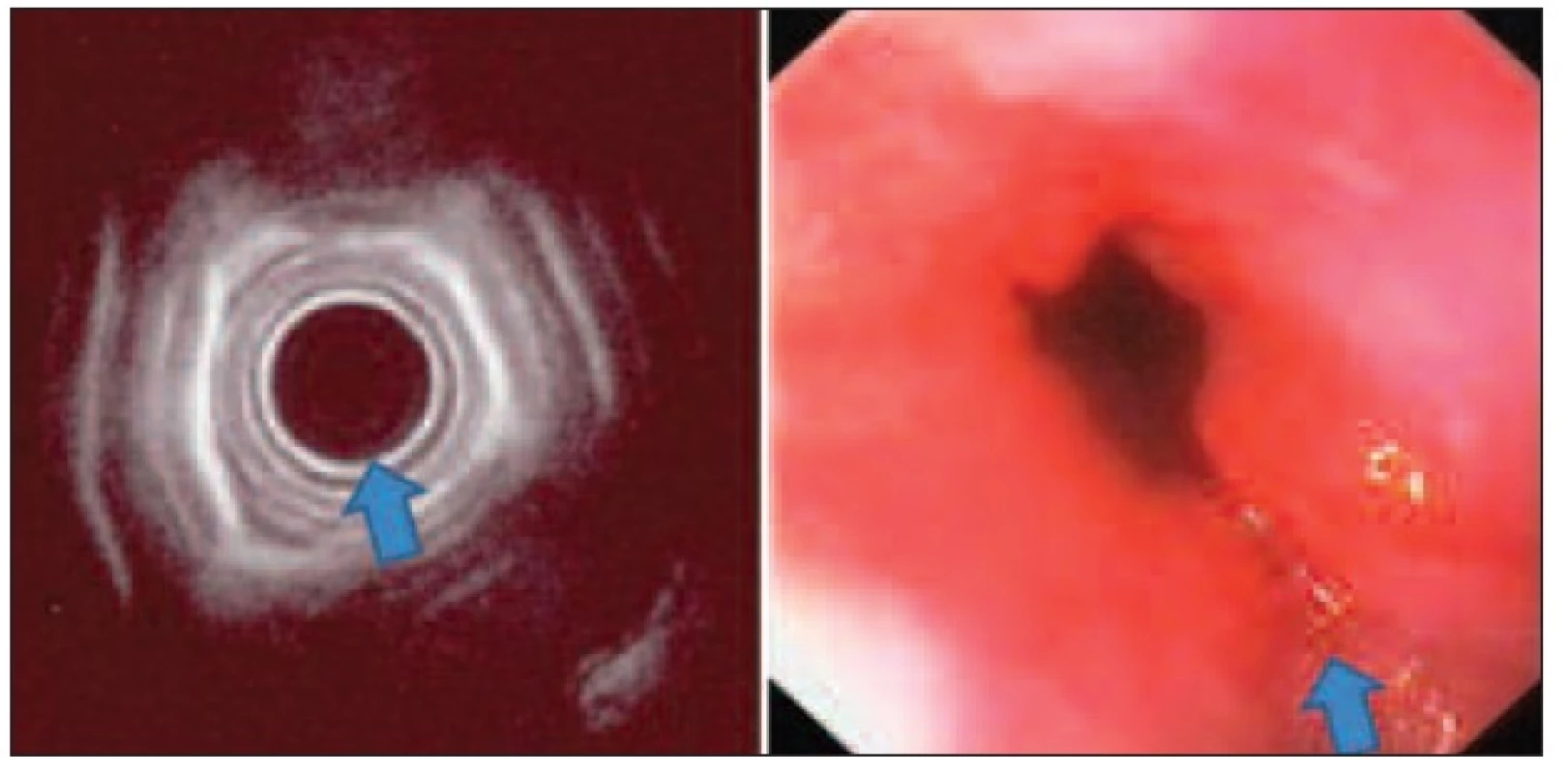
EUS u vyšších T-stadií tumoru jícnu
Pro oba hlavní typy karcinomů jícnu platí i význam EUS pro distinkci T2 a T3–4 stadia [13]. Nález T3–4 tumoru zpravidla znamená neoadjuvantní, případně paliativní radiochemoterapii u obou typů tumorů, byť lepší efekt lze očekávat u spinocelulárního karcinomu. Největším problémem je rozlišení stadií T2 a T3, které nezřídka rozhoduje až definitivní histologické vyšetření. Již neprůchodnost jícnu pro sondu EUS je negativním prognostickým faktorem svědčícím pro větší pokročilost tumoru [14]. Z těchto důvodů může být provedena elektivní endoskopická dilatace tumoru jícnu s možností dokončení EUS [15], v opačném případě lze využít možnosti diagnostiky pomocí minisond. Obecně lze konstatovat, že rozhodnutí pro definitivní zařazení tumoru dle T stadia je kombinací výsledků dalších vyšetření, jak bude uvedeno níže.
Zvláštní indikací pro EUS je nejasné ztluštění stěny jícnu, resp. gastroezofageální junkce, kde EUS navigovaná tru-cut biopsie může přinést rozhodující informaci pro diagnózu endoskopicky obtížně detekovatelného tumoru [16].
Úloha EUS ve stagingu tumorů jícnu ve srovnání s CT a PET/CT
EUS při hodnocení lokálního tumoru může být efektivně doplněno pomocí PET/CT vyšetření [13], které může přispět k určení vyššího stadia tumoru u EUS predikovaných cT1–2 N0 tumorů při průkazu intenzivní metabolické aktivity viabilní nádorové tkáně.
V detekci regionální lymfadenopatie [17] vykazuje EUS senzitivitu 80 % oproti CT (50 %) a PET–CT (57 %), nicméně specificita 70 % nedosahuje kvality CT či PET/CT s 83 %, resp. 85 %. Důvodem je zejména nemožnost spolehlivého rozlišení reaktivních a metastatických uzlin pomocí EUS. Problémem CT je pouhé rozlišení velikosti uzliny, nedokáže se však vyjádřit k přítomnosti metastázy v uzlině normální velikosti [18]. Nedostatek PET/CT spočívá v nedostatečném rozlišení uzlin přilehlých k tumoru, které mohou splývat s primárním tumorem.
Senzitivita detekce metastáz v oblasti truncus celiacus při EUS dosahuje 85 % a specificita až 96 % oproti detekci břišních metastáz pomocí CT s hodnotami senzitivity 42 % a specificity 96 %. Pro zjištění generalizace maligního procesu může být přínosem EUS i detekce maloobjemového ascitu [19] u tumorů zejména v oblasti gastroezofageální junkce a distálního jícnu.
Základní vyšetřovací modalitou s nejvyšším přínosem v diagnostice vzdálených metastáz zůstává PET/CT se senzitivitou 71 % a specificitou 93 %. Výhodou PET/CT oproti EUS zůstává detekce rozsahu postižení vyšetřovaných tkání, jeho nevýhodou je naopak rozlišovací schopnost až od velikosti 6–8 mm.
Kombinací EUS s CT či PET/CT se významně zvyšuje přesnost diagnostiky a každá z těchto metod samostatně může hrát svou zásadní roli v distinkci lokálních a systémových projevů nemoci.
EUS s FNAB u tumorů jícnu
EUS může sloužit jako podpůrná metoda pro odběr cytologického materiálu zejména z lymfatických uzlin z důvodů stanovení stagingu. Je možno s výhodou využít elastografii [20] ke zhodnocení kompresibility uzlin a při snížené elasticitě uzlin indikovat aspirační tenkojehlovou biopsii (FNAB) k cytologickému vyšetření. Klinický význam FNAB je ovšem obecně u karcinomu jícnu limitovaný. Pokud bychom zvažovali provedení FNAB pouze u pacientů, u kterých lze předpokládat změnu postupu na základě EUS, pak by pouze asi 25 % pacientů vyžadovalo FNAB. S tímto přístupem lze předpokládat klinický vliv na management pacienta asi v 13 % případů [21]. Podle studie Reeda a kolektivu [22] však může být EUS významná u pacientů s nálezem časného tumoru (do st. T2), kdy při FNAB uzlin v oblasti truncus celiacus lze dosáhnout senzitivity 72 % a specificity až 97 %, oproti CT se senzitivitou 8 % a specificitou až 100 %. FNAB je schopna potvrdit pozitivitu bioptovaných uzlin až v 88 %. Falešně negativní výsledky bioptovaných uzlin byly ve všech případech zjištěny u tumorů T3 zpravidla jako mikrometastázy, což podporuje indikaci k neoadjuvantní terapii u T3 tumorů. Důvodem snížené výtěžnosti FNAB může být neprůchodnost tumoru s nemožností biopsie a zhodnocení uzlin přes tumorózní masy, větší vzdálenost uzlin (spolehlivost do 2 cm), riziko biopsie z nepostižené části uzliny a kontaminace pracovního kanálu endoskopu s falešně pozitivním výsledkem [23].
Kritika EUS stagingu karcinomů jícnu
V odborné literatuře zaznívá stále více hlasů zpochybňujících význam endosonografie v T-stagingu karcinomu jícnu. V retrospektivní analýze 131 pacientů s časným tumorem jícnu [24] byl zjišťován přínos EUS, který byl hodnocen jako „bez klinického významu“. Pro zhodnocení invaze u časného karcinomu je za nejspolehlivější diagnostickou a terapeutickou metodu označována endoskopická resekce, která dává kromě možnosti zobrazení i detailní informaci o invazi do submukózy, pozitivitě resekčních linií a stupni diferenciace, případně lymfovaskulární invaze.
Metaanalýza dat detekce těžké dysplazie a adenokarcinomu jícnu pomocí EUS [25] shrnuje výsledky 12 studií, které udávají pouze 56% konkordanci mezi EUS a definitivním histologickým stadiem z mukózního bioptického vzorku či chirurgického resekátu u konkrétního pacienta.
V neposlední řadě považujeme EUS za vysoce expert-dependentní vyšetřovací metodu s vysokými nároky na kvalitu přístroje a zkušenosti vyšetřujícího.
Diskutabilní otázkou je zhodnocení účinnosti neoadjuvantní radiochemoterapie. V této indikaci je považována endosonografie za nevhodnou [26, 27], přestože zhodnocení tloušťky tumoru může být užitečným prognostickým faktorem přežití [28]. Podobné informace lze ovšem získat i z jiných zobrazovacích modalit.
EUS jícnu u intramurálních lézí jícnu
Mezi hlavní cíle EUS jícnu u intramurálních lézí jícnu, zejména mezenchymálních tumorů jícnu [29], patří posouzení vztahu ke stěně jícnu (extra - či intramurální), upřesnění zdrojové vrstvy, definice ohraničení léze, posouzení echogenity, velikosti a hloubky léze (endoskopické odstranění možné, pokud nedosahuje léze do muscularis propria), objasnění vztahu k okolním orgánům a detekce lokoregionální lymfadenopatie. Endosonografie samotná přináší zpravidla dostatek potřebných informací (Obr. 4). Provedené tru-cut biopsie či FNAB, které mají relativně nízkou senzitivitu i specificitu, jsou nezřídka nepřesné a zavádějící [30]. Provedená biopsie znamená navíc riziko poranění mukózy s možností vzniku umbilikace a jizvení, která při operačním řešení nese riziko perforace. Při pozitivním nálezu však histologie a imunohistochemie tumoru (CD117 – c-Kit protein, S100 protein, vimentin, specifická neuronální enoláza, laminin, myelinové proteiny, SMA, pancytokeratin, MelanA, HMB-45, chromogranin, synaptofyzin, CD56, CD 34) získaná při tru-cut biopsii může hrát zásadní roli pro stanovení další terapie.
Image 4. EUS tumoru stěny jícnu bez známek lokoregionálních uzlin, těsný vztah k aortálnímu oblouku a průdušnici, T3N0; tumor označen křížkem Fig. 4: Endoscopic ultrasound of oesophageal wall tumour, without signs of locoregional lymph node involvement, close relation to the aortic arch and the trachea, T3N0; tumour marked by a cross 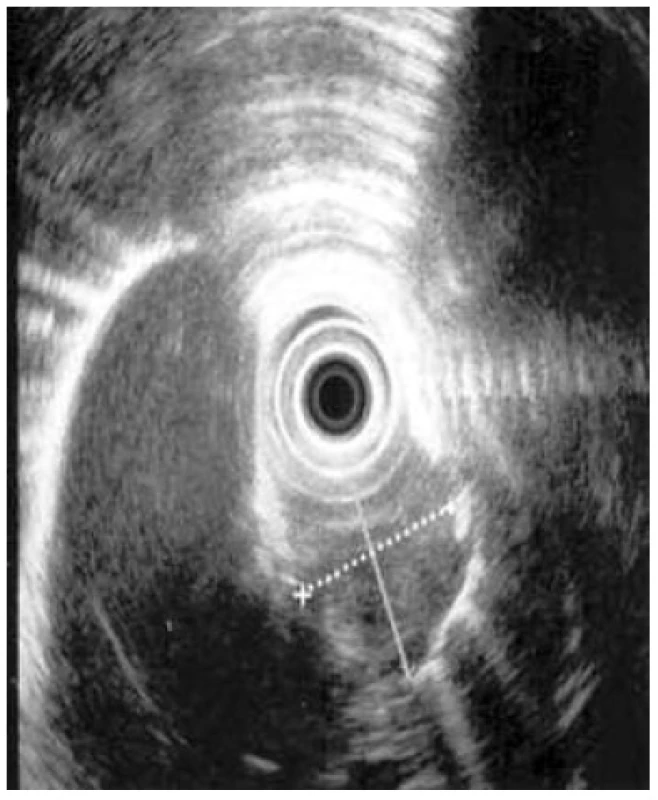
Základními taktickými možnostmi v terapii intramurálních tumorů jícnu jsou pravidelné sledování, endoskopická terapie a indikace chirurgického výkonu, případně v kombinaci s léčbou onkologickou, zejména u indikovaných pacientů s GISTomy. Zejména při volbě pravidelných kontrol (většinou volena u tumorů menších než 1 cm, případně s histologicky či cytologicky pravděpodobnou benignitou se stabilní velikostí bez klinické symptomatologie a zvláště u rizikových pacientů) a indikací endoskopické terapie [31] (terapie injekční, laserová abraze, endoskopická mukózní resekce různými technikami či submukózní disekce) hraje EUS klíčovou roli. Hlavní význam pro chirurgickou terapii je v detekci hluboké invaze kontraindikující endoskopickou terapii, potvrzení maligního vzhledu léze a v možné peroperační endosonografické asistenci využitelné i při navigaci endoskopické terapie.
Závěr
Endosonografie jícnu je dnes považována za vhodnou pomocnou vyšetřovací metodu v stagingu, dispenzarizaci a terapii tumorů jícnu. Přes sporné výsledky řady studií lze předpokládat přínos EUS v indikaci endoskopické, chirurgické a onkologické terapie epiteliálních malignit jícnu. EUS považujeme za zlatý standard diagnostiky u mezenchymálních intramurálně lokalizovaných tumorů jícnu, kde významně napomáhá v rozhodování o managementu léčby. Základními nedostatky odborné literatury jsou malé soubory pacientů a nedostatečně dlouhá doba sledování nemocných.
MUDr. Martin Stašek
I. chirurgická klinika LF UP a FN Olomouc
I. P. Pavlova 185/6
779 00 Olomouc – Nová Ulice
e-mail: martin.stasek@email.cz
Sources
1. DiMagno EP, Buxton JL, Regan PT et al. Ultrasonic endoscope. Lancet 1980;I:629–31.
2. Gress FG, Savides, TJ, et al. Endoscopic ultrasonography. 2nd edition. Chichester, Blackwell Publishing Limited, 2009.
3. Shami VM, Kahaleh M. Endoscopic ultrasound. New York, Humana Press 2010.
4. Jenssen C, Faiss S, Nürnberg D. Complications of endoscopic ultrasound and endoscopic ultrasound-guided interventions – results of a survey among German centers. Z Gastroenterol 2008;46(10):1177–84.
5. Das A, Sivak MV Jr, Chak A. Cervical esophageal perforation during EUS: a national survey. Gastrointest Endosc 2001,53 : 599–602.
6. Tozzi di Angelo I, Procházka V, Holinka M et al. Radiální endosonografie vs esofagogastroduodenoskopie v detekci jícnových a žaludečních varixů. Gastroent Hepatol 2011;65(3):133–140.
7. Martínek J. Endoskopická resekce. In: Špičák J et al. Novinky v gastroenterologii a hepatologii. Praha, Grada Publishing, 2008.
8. Rampado S, Bocus P, Battaglia G, Ruol A, Portale G, Ancona E. Endoscopic ultrasound: accuracy in staging superficial carcinomas of the esophagus. Ann Thorac Surg 2008;85(1):251–6.
9. Headrick JR, Nichols FR, at al. High-grade esophageal dysplazia: long-term survival and quality of life after esophagectomy. Ann Thorac Surg 2002;73 : 1697–702.
10. Nigro JJ, Hagen JA, DeMeester TR et al. Prevalence and location of nodal metastases in distal esophageal adenocarcinoma confined to the wall: implications for therapy. J Thorac Cardiovasc Surg 1999;117(1):16–23.
11. Ell C, May A, Gossner L et al. Endoscopic mucosal resection of early cancer and high-grade dysplasia in Barrett’s esophagus. Gastroenterology 2000;118(4):670–7.
12. Wasielica-Berger J, Baniukiewicz A et al. Magnification endoscopy and chromoendoscopy in evaluation of specialized intestinal metaplasia in Barrett’s Esophagus. Dig Dis Sci 2011;56(7): 1987–95.
13. Crabtree TD, Yacoub WN, Puri V et al. Endoscopic ultrasound for early stage esophageal adenocarcinoma: implications for staging and survival. Ann Thorac Surg. 2011;91(5):1509–16.
14. Morgan MA, Twine CP, Lewis WG et al. Prognostic significance of failure to cross esophageal tumors by endoluminal ultrasound. Dis Esophagus 2008;21(6):508–13.
15. Jacobson BC, Shami VM, Faigel DO et al. Through-the-scope balloon dilation for endoscopic ultrasound staging of stenosing esophageal cancer. Dig Dis Sci 2007;52(3):817–22.
16. Thomas T, Kaye PV, Ragunath K, Aithal GP. Endoscopic-ultrasound-guided mural trucut biopsy in the investigation of unexplained thickening of esophagogastric wall. Endoscopy 2009;41(4): 335–9.
17. Van Vliet E P M, Heijenbrok-kal, MH, et al. Staging investigations for oesophageal cancer: a meta-analysis. Br J Cancer 2008;98(3):547–557.
18. Choi JY, Lee KH, Shim YM, Lee KS, Kim JJ, Kim SE, Kim BT. Improved detection of individual nodal involvement in squamous cell carcinoma of the esophagus by FDG PET. J Nucl Med 2000;41 : 808–815.
19. Sultan J, Robinson S, Hayes N et al. Endoscopic ultrasonography-detected low-volume ascites as a predictor of inoperability for oesophagogastric cancer. Br J Surg 2008;95(9):1127–30.
20. Paterson S, Duthie F, Stanley AJ. Endoscopic ultrasound-guided elastography in the nodal staging of oesophageal cancer. World J Gastroenterol 2012;18(9):889–95.
21. Mortensen MB, Pless T, Durup J et al. Clinical impact of endoscopic ultrasound-guided fine needle aspiration biopsy in patients with upper gastrointestinal tract malignancies. A prospective study. Endoscopy 2001;33(6):478–83.
22. Reed CE, Mishra G, Sahai AV et al. Esophageal cancer staging: improved accuracy by endoscopic ultrasound of celiac lymph nodes. Ann Thorac Surg 1999;67(2):319–22.
23. van Hemel BM, Lamprou AA, Weersma R et al. Procedure-related, false-positive cytology results during EUS-guided FNA in patients with esophageal cancer. Gastrointest Endosc 2010; 71(7):1130–3.
24. Pouw RE, Heldoorn N, Herrero LA et al. Do we still need EUS in the workup of patients with early esophageal neoplasia? A retrospective analysis of 131 cases. Gastrointest Endosc 2011;73(4): 662–8.
25. Young PE, Gentry AB, Acosta RD et al. Endoscopic ultrasound does not accurately stage early adenocarcinoma or high-grade dysplasia of the esophagus. Clin Gastroenterol Hepatol 2010;8(12):1037–41.
26. Machlenkin S, Melzer E, Idelevich E et al. Endoscopic ultrasound: doubtful accuracy for restaging esophageal cancer after preoperative chemotherapy. Isr Med Assoc J 2009;11(3):166–9.
27. Kalha I, Kaw M, Fukami N et al. The accuracy of endoscopic ultrasound for restaging esophageal carcinoma after chemo radiation therapy. Cancer 2004;101 : 940–6.
28. Jost C, Binek J, Schuller JC et al. Endosonographic radial tumor thickness after neoadjuvant chemoradiation therapy to predict response and survival in patients with locally advanced esophageal cancer: a prospective multicenter phase ll study by the Swiss Group for Clinical Cancer Research (SAKK 75/02). Gastrointest Endosc 2010;71(7):1114–21.
29. Palazzo L, Landi B. The role of endosonography in submucosal tumours. Best Pract Res Clin Gastroenterol 2009;23(5):679–701.
30. Philipper M, Hollerbach S, Gabbert HE et al. Prospective comparison of endoscopic ultrasound-guided fine-needle aspiration and surgical histology in upper gastrointestinal submucosal tumors. Endoscopy 2010;42(4):300–5.
31. Waxman I, Saitoh Y, Raju GS et al. High-frequency probe EUS-assisted endoscopic mucosal resection: a therapeutic strategy for submucosal tumors of the GI tract. Gastrointest Endosc 2002; 55(1):44–9.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2012 Issue 7-
All articles in this issue
- Výsledky limitované resekce karcinomu gastroezofageální junkce
- Rekonstrukce prsů přenosem autologního tuku
- Perzistence foramen ovale patens a riziko paradoxní embolizace žilních bublin u potápěčů – cave pro sklerotizaci varixů pěnovou metodou
- Chirurgické řešení komplikované jaterní echinokokózy u dvou bulharských občanů na dvou pracovištích v České republice
- Segmentální duodenektomie (D3, D4) pro angiosarkom
- Endosonografie jícnu v diagnostice a léčbě tumorů jícnu
- Descendentní nekrotizující mediastinitida – chirurgická léčba
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chirurgické řešení komplikované jaterní echinokokózy u dvou bulharských občanů na dvou pracovištích v České republice
- Descendentní nekrotizující mediastinitida – chirurgická léčba
- Segmentální duodenektomie (D3, D4) pro angiosarkom
- Endosonografie jícnu v diagnostice a léčbě tumorů jícnu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

