-
Medical journals
- Career
Vzdálený syndrom zraněného gliomu po stereotaktické biopsii – kazuistika
Authors: J. Chrastina; Z. Novák; I. Říha; B. Slaná *; R. Jančálek
Authors‘ workplace: Neurochirurgická klinika LF MU a FN u sv. Anny v Brně, přednosta: prof. MUDr. Zdeněk Novák, CSc. ; I. patologicko anatomický ústav LF MU a FN u sv. Anny v Brně, přednostka: prof. MUDr. Markéta Hermanová, Ph. D. *
Published in: Rozhl. Chir., 2011, roč. 90, č. 3, s. 148-151.
Category: Monothematic special - Original
Overview
Pooperační hemoragie je obávanou komplikací chirurgické resekce a stereotaktické biopsie mozkového tumoru. Popisujeme vzácnou kazuistiku syndromu zraněného gliomu po stereotaktické biopsii mozkového glioblastomu, kdy došlo k drobnému prokrvácení v sytícím se nádorovém uzlu vzdáleném od oblasti původní biopsie.
Klíčová slova:
syndrom raněného gliomu – stereotaxe – glioblastoma multiformeÚVOD
Hemoragie po operaci tumoru mozku je obávanou a závažnou komplikací (četnost 1–5 %). Za rizikové je v tomto ohledu nutné považovat cévnaté gliomy vyššího gradingu s vytvořenou patologickou vaskularizací a fragilitou novotvořených cév. Z tohoto důvodu parciální resekce tumoru s sebou nepřináší redukci rizika pooperační hemoragie. Krvácivé komplikace po parciální resekci tumoru se někdy označují jako syndrom zraněného gliomu – wounded glioma syndrome [1]. Kromě krvácení do poresekční dutiny je nemocný ohrožen prokrvácením zbytku tumoru mimo oblast resekce. Riziko krvácení je spojeno také se stereotaktickou biopsií mozkového tumoru, kdy je krvácení lokalizováno v oblasti odebrané biopsie (četnost 2,6 %, nutnost operační revize nebo konverze na otevřenou operaci u 0,36 % nemocných) [2]. Popisujeme kazuistiku nemocného, když byla po stereotaktické biopsii pozorována drobná hemoragie v nádorovém uzlu, nacházejícím se mimo oblast biopsie.
KAZUISTIKA
Nemocný ve věku 80 let byl vyšetřen a následně přijat k hospitalizaci na neurologickou kliniku pro přibližně 4 měsíce trvající poruchu chování, akcentující se v průběhu 14 dnů před vyšetřením. Podle objektivní anamnézy nebylo možné vyloučit ani opakované epileptické záchvaty. Z anamnestických dat polymorbidního nemocného dále vyjímáme stav po cévní mozkové příhodě před více léty, diabetes mellitus II. typu s nutností inzulinoterapie po dobu 20 let s rozvojem defektu na palci pravé dolní končetiny, ischemickou chorobu srdeční a arteriální hypertenzi. Mimo inzulinoterapie nemocný medikoval Godasal, Prestarium, Agapurin, Diacordin a Digoxin. U nemocného bylo provedeno akutní CT vyšetření mozku nativně a po podání kontrastní látky, s nálezem dvou postkontrastně se sytících expanzí frontoparietálně a okcipitálně vpravo. I když tato ložiska na sebe nenavazovala, radiolog a neurochirurgický konziliář zvažovali spíše primární multicentrický tumor mozku než metastatické postižení nebo abscesy mozku (Obr. 1). Mozkový lymfom byl považován za méně pravděpodobný. V neurologickém obraze dominoval těžký organický psychosyndrom a levostranná hemiparéza lehkého stupně.
Image 1. Postkontrastní CT vyšetření se dvěma sytícími se nádorovými uzly Fig. 1. Post-contrast CT examination with two contrast uptaking tumor nodes 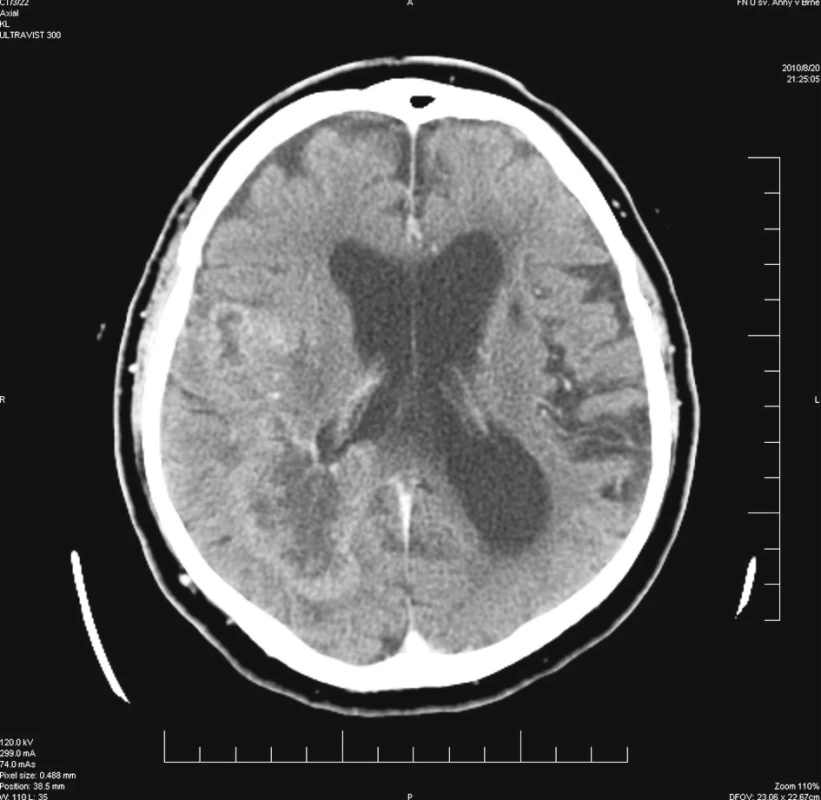
Po neurochirurgické konzultaci byla indikovaná stereotaktická biopsie předpokládaného mozkového tumoru. Nemocný byl přijat na kliniku s odstupem týdne po vysazení Godasalu a převedení nemocného na nízkomolekulární heparin. Vzhledem k ne zcela dostatečné spolupráci s nemocným nebylo možné provést MRI navigovanou stereobiopsii. Přistoupili jsme tedy k stereotaktické biopsii s CT navigací (plánovací software Praezis Plus). Nemocnému byl v lokální anestezii a neuroleptanalgezii nasazen stereotaktický kruh a po podání kontrastní látky nitrožilně byla provedena plánovací CT stereotaktická studie. Cíl byl zvolen v okcipitální lézi vzhledem k jeho snazší dostupnosti a většímu rozsahu (Obr. 2). Po nastavení stereotaktického rámu byla provedena trepanace podle navigace. Na viditelném povrchu mozku nebyla patrna žádná cévní struktura v souladu s předoperačním CT vyšetřením. Následoval nekomplikovaný odběr 4 vzorků na rozhraní sytícího se lemu a okolní bílé hmoty, v sytícím se lemu a na hranici hypodenzního centra léze a sytícího se prstence. Po provedení biopsie nebyl pozorován výtok krve z kanyly a ani v odebraných vzorcích nebyly stopy krve.
Image 2. Plánování stereotaktické biopsie Fig. 2. Planned stereotactic biopsy 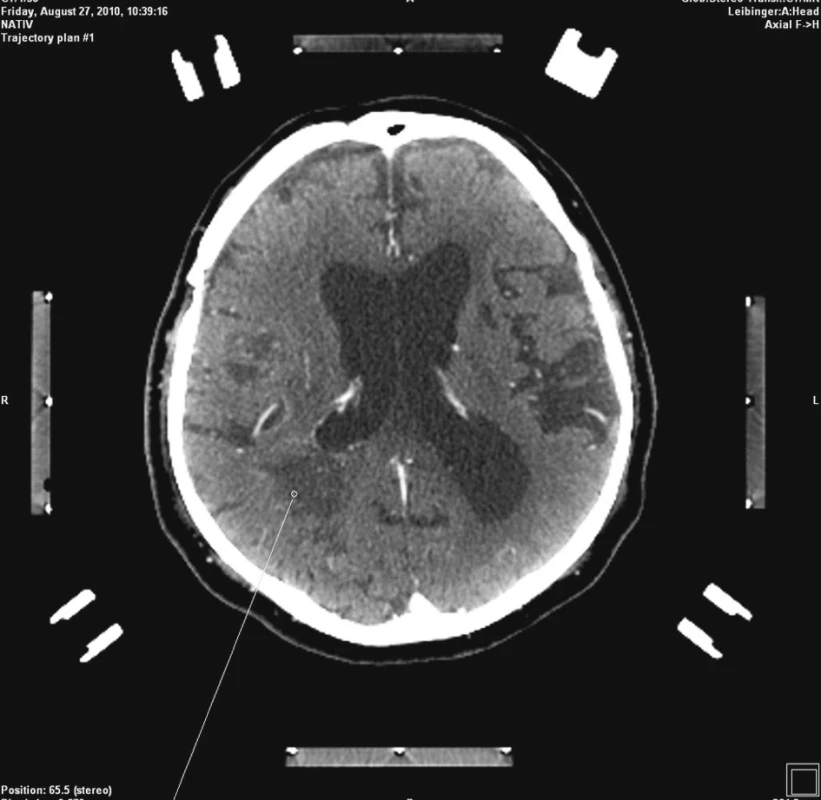
Výkon byl prováděn u nemocného v poloze na boku s mírnou rotací hlavy, aby bylo možné provést pohodlně okcipitální trepanaci. V průběhu výkonu byl nemocný stabilní a neuroleptanalgezie dostačovala pro nekomplikované provedení operace. Bezprostředně po ukončení operačního výkonu byl sňat stereotaktický kruh a nemocný byl převezen na JIP před plánovanou pooperační CT kontrolou. Při vyšetření lékařem JIP bylo popsáno mírné zhoršení levostranné lehké hemiparézy, proto bylo plánované CT urychleno. Vyšetření přineslo překvapivý nález – v oblasti odběru vzorků nebylo známek hemoragie. Ovšem v oblasti bazálně pod frontoparietální expanzí byla prokázána drobná hemoragie velikosti do 1 cm, která ani při zpětné analýze velmi detailních plánovacích scanů nebyla patrna (Obr. 3). V pooperačním průběhu byla přechodně podána hemostyptika a zvýšená pozornost byla věnována dostatečné kontrole krevního tlaku a kompenzaci diabetu. Nemocný byl ve stabilizovaném stavu přeložen na neurologickou kliniku k další terapii. Histologické vyšetření prokázalo multiformní glioblastom.
Image 3. Stav po provedené biopsii – hyperdezní ložisko odpovídající hemoragii mimo oblast biopsie Fig. 3. Post-biopsy condition – a hyperdense focus accordant to bleeding outside the biopsy region 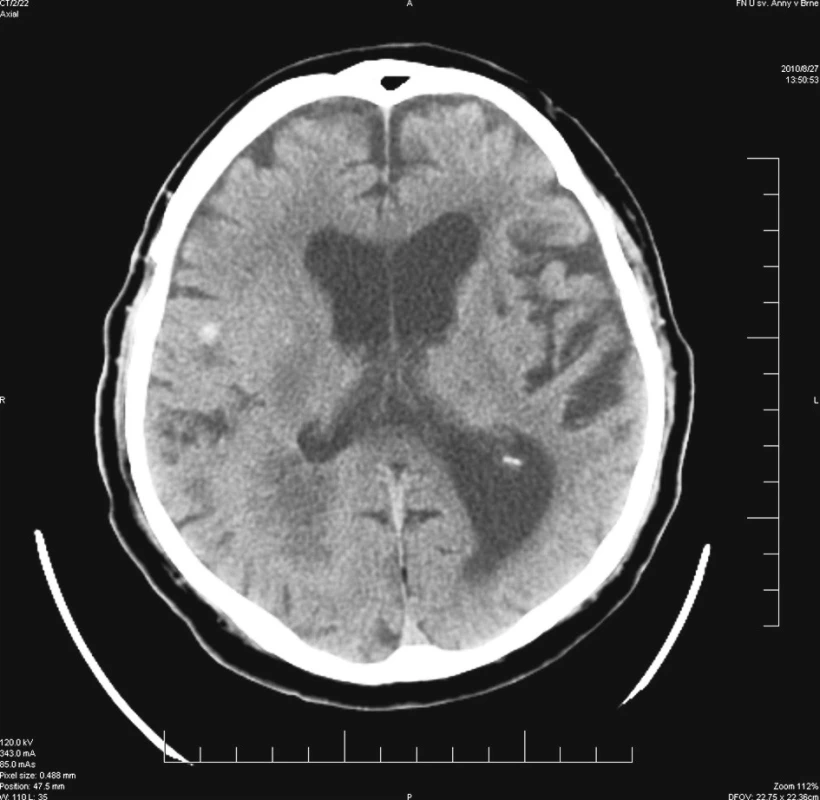
Riziko hemoragické komplikace bylo u nemocného zvýšené pro biologickou charakteristiku tumoru – multiformní glioblastom. Dále je nutné vzít do úvahy i další rizikové faktory – diabetes mellitus s projevy postižení cév dolních končetin (i když v bezprostředním předoperačním průběhu byl nemocný kompenzován), kolísající hypertenze (i když v průběhu operace byl nemocný stabilizovaný) a podávaná antiagregační terapie, i když byl nemocný týden před vlastním operačním výkonem převeden na nízkomolekulární heparin.
DISKUSE
Četní autoři popisují zvýšené riziko hemoragických komplikací stereotaktické biopsie u maligních gliomů [3, 4]. Rychlý růst vaskularizovaného maligního glimu může být dokonce příčinou spontánního krvácení (1,3–15 %) do nádorové tkáně se zhoršením stavu nemocného a diferenciálně diagnostickými problémy [5, 6, 7].
Jak naznačuje i popsaná kazuistika, v patofyziologii pooperačního krvácení je nutné zvažovat i celkové faktory, především obtížně kontrovatelnou hypertenzi, operační polohu hlavy s možným negativním ovlivněním žilního návratu, vaskulopatii a koagulopatii, včetně iatrogenní při farmakoterapii. Tyto rizikové faktory jsou do určité míry předvídatelné a tedy ovlivnitelné – kompenzace krevního tlaku, pečlivá volba operační polohy, vysazení medikace, potenciálně ovlivňující krevní srážení (nejen antiagregační a antikoagulační terapie, ale také například antiepileptická medikace valproáty), a předoperační důsledná kompenzace diabetu (možná dekompenzace při terapii kortikoidy).
Mimo chirurgických a celkových aspektů možnosti vzniku syndromu zraněného gliomu je nutné vzít v potaz i lokální změny hemokoagulace, vyvolané růstem mozkového tumoru. Současná data ukazují, že nádorové buňky při zátěži například hypoxií nebo traumatem mohou produkovat stejné prokoagulační a angiogenetické faktory jako trombocyty, monocytární mikrofágy a buňky hladkého svalstva cévní stěny [8]. Podle stejných dat tkáňová hypoxie při růstu tumoru stimuluje expresi regulátorů krevního srážení nezávisle na původu nádorových buněk. Mimo rychlého růstu tumoru je možné za mechanismus, vedoucí k tkáňové hypoxii, považovat i operační trauma. Reakcí na hypoxii je, jak již zmíněno výše, uvolnění proteinů hrajících úlohu v koagulaci, fibrinolýze a angiogenezi, včetně tkáňového faktoru (TF – Tissue Factor). Úlohou subendoteliálního tkáňového faktoru je aktivace srážecí kaskády vedoucí k trombóze cévy při narušení cévního endotelu. Paradoxně tedy při hypoxii a narušení cévní stěny dochází k aktivaci procesů, vedoucích k trombóze cévy. Ovšem autoregulační mechanismy vedou i produkci faktorů, které jsou odpovědné za rozpuštění krevního koagula – v akutní fázi se jedná především o fibrinolýzu s uvolněním plazminogenu [7]. Dochází tedy k dynamické rovnováze anti - a prokoagulačních vlivů. Tato produkce pro a antikoagulačních faktorů není ovšem pouze lokální a může vést i ke vzdáleným projevům a celkovým koagulopatiím, ve smyslu hyper nebo hypokoagulace [9], což může být příčinou vzdáleného krvácení po částečné resekci tumoru nebo jeho biopsii. Stejným mechanismem autoři vysvětlují i vznik Trosseauova syndromu (migrující tromboflebitidy) [8].
Dalšími změnami, vyvolanými chronickou hypoxií, je indukce faktorů, zodpovědných za vznik nových cév, které by mohly vytvářet kolaterální řečiště (VEGF, angiogenin, angiopoietin 2). Tyto novotvořené cévy jsou ovšem velmi fragilní a jejich narušení může vést ke krvácivým projevům. K riziku krvácení napomáhá i exprese enzymů, zodpovědných za degradaci extracellulární matrix (proteázy a kolagenázy). Právě destrukce extracellulární matrix vede ke vzniku prázdných prostorů s možností zakrvácení.
Vzdálený syndrom zraněného gliomu popsal Koebbe u 2 nemocných po parciální resekci tumoru mozku [10]. V pooperačním průběhu došlo u obou nemocných ke krvácení do nádorové tkáně vzdálené od oblasti resekce. U obou nemocných nebyly známy rizikové faktory. Autoři považují vzdálený syndrom zraněného gliomu za samostatnou klinickou jednotku, kdy tumorem indukovaná koagulopatie vede k hypokoagulačnímu stavu nejvíce postihujícímu právě mozkovou tkáň. Za možné vysvětlení prokrvácení částí nádoru vzdálených od míst resekce považují jejich zvýšené prokrvení, kdy v místě původní resekce je snížené cévní zásobení díky chirurgické manipulaci – zvláště koagulaci cévních struktur v resekční ploše. Jako další vysvětlení nabízejí zvýšení krevního průtoku po resekci rozsáhlé nádorové masy a poruše autoregulace cévního zásobení při otoku mozku. Jiným možným vysvětlením je narušení žilní drenáže s následnou hyperémií a hemoragickou transformací odpovídající oblasti. Autoři tedy zohledňují především lokální faktory, spojené s operačním výkonem a chirurgickou manipulací v operačním poli.
Z těchto lokálních faktorů je nutné při stereotaktické biopsii vzít do úvahy cévní struktury v přístupové cestě nejen z hlediska jejich porušení při biopsii s rizikem krvácení. Je nutné volit trajektorii pro biopsii mimo povrchové žilní struktury. U nemocného nebyla v průběhu výkonu koagulována žádná mozková céva.
I přes veškerá výše zmíněná opatření zůstává pooperační krvácení závažným rizikem resekčních i bioptických operací mozkových tumorů. Pro minimalizaci možných funkčních následků pooperačního krvácení je důležitá jeho včasná diagnostika. Zdůrazňujeme nutnost pečlivého pooperačního sledování nemocného po provedené operaci mozkového tumoru. Velmi atraktivní možností při vzniku krvácení je možnost využití preparátu NovoSeven.
U stereotaktické biopsie prováděné obvykle v lokální anestezii a neuroleptanalgézii je možné sledovat základní neurologický stav nemocného i peroperačně. Standardem na pracovišti autorů je včasné provedení kontrolního pooperačního CT vyšetření s přihlédnutím ke stavu nemocného a organizačním faktorům (transfer z JIP na CT pracoviště). Velmi elegantním řešením je provedení peroperačního CT přímo na operačním sále. Kromě urychlení diagnostiky a řešení komplikace je další výhodou skutečnost, že odpadají organizační opatření spojená s transferem nemocného a přímo na operačním sále je možné verifikovat korektní místo odběru [11]. Jinou možností je využití peroperačního MRI. I když se jedná o finančně i organizačně mnohem náročnější technologii, přínos přesahuje diagnostiku peroperačních komplikací [12, 13], jak v domácích podmínkách ukazují zkušenosti autorů z ÚVN.
ZÁVĚR
Popisujeme vzácnou komplikaci stereotaktické biopsie tumoru mozku, která může být příčinou klinického zhoršení stavu nemocného po jinak nekomplikovaném výkonu. Za nejdůležitější považujeme maximální vyloučení identifikovatelných rizikových faktorů a pooperační sledování stavu nemocného.
Podporováno MŠMT MSM 0021622404 a MZČR IGA NS10411-3.
MUDr. Jan Chrastina, Ph.D.
Pekařská 53
656 91 Brno
e-mail: jan.chrastina@fnusa.cz
Sources
1. Greenberg, M. Handbook of Neurosurgery (7th Edition) New York, Thieme Publishers 2010.
2. Lundsford, L. D., Niranjan, A., Khan, A. A., Kondziolka, D. Establishing a benchmark for complications using frame-based stereotactic surgery. Stereotact. Funct. Neurosurg., 2008; 86 : 278–287.
3. Nasser, J. A., Confort, C. I., Ferraz, A., Esperanca, J. C., Duarte, F. Image – guided stereotactic biopsy of central nervous system lesions. Arg. Neuropsiquiatr., 1998; 56 : 206–211.
4. Sawin, P. D., Hitchon, P. W., Follet, K. A., Torner, J. C. Computed imaging – assisted stereotactic brain biopsy: a risk analysis of 225 consecutive cases. Surg. Neurol., 1998; 49 : 640–649.
5. Haninec, P., Houšťava, L., Klener, J. Atypické intracerebrální krvácení do glioblastoma multiforme. Čs. Neurol. Neurochir., 1993; 56/89 : 147–149.
6. Chrastina, J., Novák, Z., Říha, I., Ghallab, K. Primární tumor mozku jako vzácná příčina akutního subdurálního hematomu. Rozhl. Chir., 2009, 88, č.10, 549–553.
7. Oka, K., Tsuda, H., Sakamoto, S., Go, Y., Tomonaga, M. Plasminogen activator and haemorrhage in brain tumors. Plasminogen activator and hemorrhagie in brain tumor. Journal of Neurooncology, 1994; 22 : 183–187.
8. Denko, N. C., Giaccia, A. J. Tumor hypoxia, the physiological link between Trosseau‘s syndrome (carcinoma induced coagulopathy) and metastasis. Cancer Research, 2001; 61 : 795–798.
9. Palmer, J. D., Francis, D. A., Roath, O. S., Francis, J. L., Iannotti, F. Hyperfibrinolysis during intracranial surgery: effect of high dose aprotinin. J. Neurol. Neurosurg. Psychiatry, 1995; 58 : 104–106.
10. Koebbe, J., Sherman, J. D., Warnick, R. E. Distant wounded glioma syndrome: report of two cases. Neurosurgery, 2001 : 48 : 940–943.
11. Gumprecht, H., Lumenta, C. B. Intraoperative imaging using a mobile computer tomography scanner. Min. Invasive Neurosurg., 2003; 46 : 317–322.
12. Bernays, R. L., Kollias, S. S., Khan, N., Brandner, S., Meier, S., Yonekawa, Y. Histological yield, complications and technical consuderations in 114 consecutive frameless stereotactic biopsy procedures aided by open intraoperative MRI imaging. J. Neurosurg., 2002; 97 : 354–362.
13. Muragaki, Y., Iseki, H., Maruyama, T., Kawamata, T., Yamane, F., Nakamura, R., Kubo, O., Takakura, K., Hori, T. Usefulness of intraoperative magnetic resonance imaging for glioma surgery. Acta Neurochir. (Suppl.)., 2006; 98 : 67–75.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 3-
All articles in this issue
- Role VATS v léčení empyému hrudníku
- Vzdálený syndrom zraněného gliomu po stereotaktické biopsii – kazuistika
- Biliární komplikace po velkých resekcích jater
- Jednotná klasifikace plicních lymfatik. Cesta ke status quo
- Přednosti klasického operačního přístupu v chirurgické léčbě plicních metastáz
- Kvalita života po laparoskopické fundoplikaci v závislosti na předoperační symptomatologii
- Vplyv pooperačných komplikácií na prežívanie pacientov s karcinómom pankreasu
- Laparoskopické ošetření poranění tlustého střeva při kolonoskopii
- Nové možnosti diagnostiky karcinómu pankreasu
- Metastáza světlobuněčného renálního karcinomu do ductus choledochus
- Laparoskopická resekce pankreatu v experimentu a klinické praxi
- Laparoskopická distálna pankreatektómia pre neuroendokrinné nádory pankreasu – prvé skúsenosti
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kvalita života po laparoskopické fundoplikaci v závislosti na předoperační symptomatologii
- Laparoskopická distálna pankreatektómia pre neuroendokrinné nádory pankreasu – prvé skúsenosti
- Laparoskopické ošetření poranění tlustého střeva při kolonoskopii
- Vplyv pooperačných komplikácií na prežívanie pacientov s karcinómom pankreasu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

