-
Medical journals
- Career
Incidence a rizikové faktory vzniku střevní ischemie u pacientů po resekci AAA v našem souboru z let 2005–2009
: E. Biroš; R. Staffa
: II. chirurgická klinika LF MU a FN u sv. Anny v Brně, přednosta: prof. MUDr. R. Staffa, Ph. D.
: Rozhl. Chir., 2011, roč. 90, č. 12, s. 682-687.
: Monothematic special - Original
Úvod:
Retrospektivní analýzou zjistit incidenci, rizikové faktory vzniku a terapeutické výsledky ischemického postižení trávicí trubice u pacientů po cévně-chirurgické i endovaskulární léčbě aneuryzmat abdominální aorty (AAA).Materiál a metoda:
Kompletní hospitalizační a ambulantní dokumentace všech pacientů, kteří podstoupili chirurgickou nebo endovaskulární léčbu AAA v letech 2005 až 2009 na naší klinice byla retrospektivně prozkoumána. Byly zdokumentovány všechny případy časné i pozdní manifestace ischemického postižení tlustého nebo tenkého střeva. Na základě uvedené dokumentace byla vyhodnocena incidence, příčiny a terapeutické výsledky této komplikace.Výsledky:
Ve sledovaném období let 2005 až 2009 podstoupilo na II. chirurgické klinice FN u sv. Anny v Brně a LF MU celkově 207 pacientů terapii pro diagnózu AAA. Uvedené číslo zahrnuje jak endovaskulární výkony (celkem 13; 6,3 %), tak jeden roboticky asistovaný výkon a taky celé klinické spektrum manifestace AAA od bezpříznakových forem až po formy rupturovaných aneuryzmat. Komplikace střevní ischemie byla celkově pozorována u 11 pacientů (5,3 %). Ve všech případech byl proveden otevřený cévně-chirurgický výkon. V 6 případech se jednalo o pacienty s nerupturovaným AAA, v 5 případech o pacienty s diagnózou rupturovaného AAA. U 3 pacientů byla ischemie diagnostikována až s několika měsíčním odstupem od revaskularizačního výkonu v klinické podobě postischemické striktúry tlustého střeva (2 případy) nebo kolitidy (1 případ). Z 8 pacientů s akutní manifestací ischemie se v 1 případě jednalo o izolovanou ischemii tenkého střeva, ve 2 případech o rozsáhlou ischemii descendens, sigmatu a taky rekta, a v 5 případech o typické postižení tlustého střeva v rozsahu descendens a sigmatu. Ani jeden pacient s pozdní manifestací ischemie nezemřel. Z 8 akutních forem ischemie trávicí trubice byla resekce ischemické části tlustého střeva +/ - rekta provedena u 6 pacientů. Z nich 3 pacienti zemřeli a 3 pacienti přežili operační výkon a byli dále sledování v naší ambulanci. U 2 pacientů s akutní manifestací IC nebyla resekce ischemické části trávicí trubice provedena. Ani jeden z nich nepřežil. Celková mortalita pacientů s IC v našem souboru představuje 45,5 % (5 z 11 pacientů zemřelo). Při zohlednění jenom pacientů s akutní klinickou symptomatologií je mortalita v našem souboru na úrovni 62,5 % (5 z 8 pacientů zemřelo).Závěr:
Ischemické postižení trávicí trubice nepřestává být závažnou komplikací u pacientů po resekčním výkonu pro AAA. Kromě forem akutní střevní ischemie musíme dalším sledováním pacienta pomýšlet i na možnost pozdní manifestace ischemie ve formě striktúry tlustého střeva nebo kolitidy. Analýza dat našich pacientů ukazuje, že jedním z důležitých faktorů vývoje ischemické kolitidy u pacientů po resekci AAA jsou stavy, které vyžadují aplikaci vazopresorů a zvýšenou potřebu krevních převodů peroperačně.Klíčová slova:
střevní ischemie – ischemická kolitida – postischemická striktúra a kolitida – resekce aneuryzmatu břišní aortyÚvod
Střevní ischemie (IC) je devastující komplikace otevřených i endovaskulárních výkonů pro aneuryzmata abdominální aorty (AAA). Velké retrospektivní studie uvádí incidenci střevní ischemie v rozmezí 2 až 7 % [1, 2] u pacientů operovaných elektivně, se zjevně vyšším zastoupením uvedené komplikace v podskupině pacientů, kteří jsou operováni z důvodu ruptury AAA (rAAA). Sestavy endovaskulárně řešených pacientů (EVAR = Endo-Vascular Aneurysm Repair) se povětšinou shodují v nižší incidenci střevní ischemie po řešení AAA na úrovni 0,5 až 1,4 % [3, 4]. Incidence střevní ischemie se dále zvyšuje rutinním zapojením pooperačního kolonoskopického vyšetření, které je schopno detekce i jinak klinicky inaparatentních případů. Studie s rutinní pooperační kolonoskopií uvádí incidenci IC na úrovní 15 % v případě elektivních výkonů pro AAA [5], a na úrovni až 60 % u pacientů operovaných pro rAAA [2].
Význam střevní ischemie pro klinickou praxi cévního chirurga spočívá v jejím velice nepříznivém efektu na vzestup pooperační morbidity a mortality pacientů, kdy mortalita pacientů s rozvinutou transmurální formou IC je ve studiích uváděna na úrovni 37 až 90 % [4, 6].
Právě vysoká mortalita IC vedla k rozvoji různých metod předoperačního, peroperačního i pooperačního hodnocení míry rizika jejího rozvoje[8]. Lze říci, že kromě pooperační kolonoskopie, nedoznaly uvedené metodiky širší akceptace. I vlastní pooperační kolonoskopie není na většině pracovišť systematicky prováděna, a proto klinická bdělost a předvídavost jsou základními předpoklady včasné detekce a adekvátní terapie této jinak vysoce letální komplikace. Naše práce se zaměřuje na retrospektivní zhodnocení incidence IC v souboru našich pacientů s AAA, detekci příčin, klinického průběhu a jejich terapeutických výsledků.
Materiál a metodika
Tato studie byla provedena jako retrospektivní analýza hospitalizační a ambulantní dokumentace všech pacientů, kteří byli v letech 2005–2009 z důvodu diagnózy asymtomatického AAA, symptomatického AAA nebo rAAA řešeni na našem pracovišti. Cílem studie bylo dohledat jednak včasné formy manifestace IC v rámci pooperačního stonání pacienta, ale i pozdní formy manifestace střevní ischemie v podobě kolitidy nebo postischemické striktúry. Proto u všech pacientů bylo provedeno i dohledání jejich pooperačního ambulantního sledování až do okamžiku poslední kontroly v naší nebo jiné nemocniční ambulanci v rámci FNUSA. Střevní ischemie byla diagnostikována na základě endoskopického nálezu a histologického vyšetření vzorku sliznice tlustého střeva, operačního nálezu, nebo výsledku pitevního protokolu u zemřelého pacienta. U všech pacientů, kteří zemřeli v souvislosti s hospitalizací pro AAA v naší nemocnici, bylo provedeno také dohledání pitevních protokolů za účelem vyloučení skryté střevní ischemie. U pacientů, kteří vyvinuli včasnou nebo pozdní formu střevní ischemie, bylo provedeno dohledání dalších údajů včetně anamnézy, fyzikálního vyšetření, výsledků laboratorních (CRP, krevní obraz) a zobrazovacích vyšetření (US, CT, kolonoskopie), operačních a pitevních protokolů. Bylo provedeno zhodnocení klinické manifestace IC, průběhu léčby a léčebných výsledků.
Výsledky
V průběhu let 2005 až 2009 bylo na II. chirurgické klinice FNUSA v Brně (FNUSA) operováno 207 pacientů pro diagnózu AAA ve všech jejich klinických formách manifestace. U 159 pacientů (76,8 %) je jednalo o diagnózu nerupturovaného AAA. 48 pacientů (23,2 %) podstoupilo operační výkon pro diagnózu rAAA. Endovaskulárně řešených pacientů v tomto období bylo 13, co představuje z celého souboru jenom 6,3 % případů. Dále jeden pacient byl řešen roboticky asistovaným výkonem. U všech zbylých pacientů se jednalo o otevřenou náhradu AAA. V rámci retrospektivní analýzy souboru bylo nalezeno celkem 11 pacientů, u kterých došlo k rozvoji časné nebo pozdní manifestace střevní ischemie. Průměrný věk pacientů s uvedenou komplikací byl 69 let. V 8 případech se jednalo o pacienta mužského pohlaví, ve 3 případech o pacienta ženského pohlaví. Ve všech případech byl proveden otevřený cévně-chirurgický výkon a to u 5 pacientů urgentně pro diagnózu rAAA, v 5 případech elektivně u pacientů s asymptomatickým AAA a u jednoho pacienta se jednalo o semiakutní výkon pro symptomatické AAA.
U 3 pacientů byla ischemie diagnostikována až s několika měsíčním odstupem od revaskularizačního výkonu v klinické podobě postischemické striktúry tlustého střeva (2 případy) nebo kolitidy (1 případ). U této podskupiny pacientů byla pozdní manifestace IC diagnostikována s odstupem 3–4 měsíců. U 2 pacientů byl pooperační průběh zcela bez komplikací a až posléze vzniké projevy váhového úbytku a subileózních stavů nás vedly k dalšímu vyšetřování a provedení kolonoskopie s bioptickou verifikací striktúry kolon na podkladě ischemie. Jeden pacient z uvedené skupiny s „odloženou manifestací IC“ již druhý pooperační den (POD) po elektivní resekci AAA vyvinul známky respirační insuficience, oběhové instability a systémových projevů sepse s vysokou elevací proteinů akutní fáze a leukocytů. Bylo pomýšleno na akutní bronchopneumonii, proto byl zaléčen systémově antibiotiky a neinvazivní ventilací. Břišní nález byl klidný, proto na možnou IC nepomýšleno, nicméně vývoj pooperačního stonání s odstupem možno hodnotit jako konzervativně zaléčenou inkompletní transmurální ischemii se systémovými projevy orgánové dysfunkce. Ze všech 3 pacientů s odloženou manifestací IC byla u dvou s odstupem 3 a 4 měsíců po resekci AAA provedena resekce dle Hartmana pro známky chronické ischemické kolitidy se striktúrou. Třetí pacientka s klinickými projevy ischemické kolitidy s vředy průměru do 8 mm v oblasti rektosigmoideálního přechodu nepodstoupila resekční výkon.
U 8 pacientů s akutní manifestací ischemie se v 1 případě jednalo o izolovanou ischemii tenkého střeva, ve 2 případech o rozsáhlou ischemii descendens, sigmatu a taky rekta, a v 5 případech o typické postižení tlustého střeva v rozsahu descendens a sigmatu. Z 8 akutních forem střevní ischemie byla resekce ischemické části tlustého střeva +/ - rekta provedena u 6 pacientů. Z nich 3 pacienti zemřeli a 3 pacienti přežili operační výkony a byli dále sledování v naší ambulanci. V rámci sledování ani jeden z nich nevyvinul známky infekce cévní protézy. U neoperovaných pacientů s akutní ischemií se v jednom případě jednalo až o diagnózu plynoucí z pitevního ohledání zemřelého (hemoragická infarzace tenkého střeva), který exitoval 8. POD, a v jednom případě vzhledem k celkovému stavu pacienta, jeho výraznou obezitu a rozsah ischemie (lienální flexúra až rektum, výrazný prosak mezokolon) bylo rozhodnuto resekční výkon neprovádět. Ve 3 případech byla diagnóza IC stanovena první POD. U všech pacientů se jednalo o diagnózu rAAA a všichni záhy po operačním výkonu exitovali. U jedné pacientky byla diagnóza IC stanovena kolonoskopicky 3. POD. Podstoupila resekční výkon dle Hartmana a následné pooperační stonání přežila. U všech zbylých pacientů byla diagnóza akutní IC stanovena pozdě: 8., 12. a 15. POD, žel pokaždé již ve stadiu sterkorální peritonitidy. I přes uvedenou nepříznivou klinickou situaci, se nám resekčním výkonem podařilo zachránit 2 pacienty, kteří jsou dlouhodobě sledování v naší ambulanci. Typická symptomatologie průjmů s přítomností nebo bez přítomnosti krve nebo frustní enteroragie se z celého souboru 8 pacientů s akutní formou IC vyskytovala u 4 pacientů. U zbývajících pacientů se jednalo o systémové projevy sepse s orgánovou dysfunkcí, oběhovou nestabilitou a v různé míře vyjádřeným obrazem parézy gastrointestinálního traktu.
Ze sledovaného souboru 11 pacientů ani v jednom případě nebyla provedena reimplantace arteria mesenterica inferior (AMI). Hodnocení zpětného návratu z pahýlu AMI po dokončení revaskularizační části operačního výkonu bylo v operačních protokolech systematicky uváděno. Nebyla použita žádná technická metoda (měření tlaku krve v pahýlu AMI, dopplerometrie kolaterální cirkulace, atd.) ke zhodnocení adekvátnosti kolaterálního oběhu při podvazu AMI. Klinický průběh onemocnění IC, patologický nález a výsledek stonání pacientů uvádí přehledně tabulka 1.
1. Sumarizace klinických průběhů, patologických nálezů a výsledků terapie u pacientů s ischemickou kolitidou Tab. 1. Clinical manifestations, pathological findings and therapeutic results in patients with ischemic colitis. 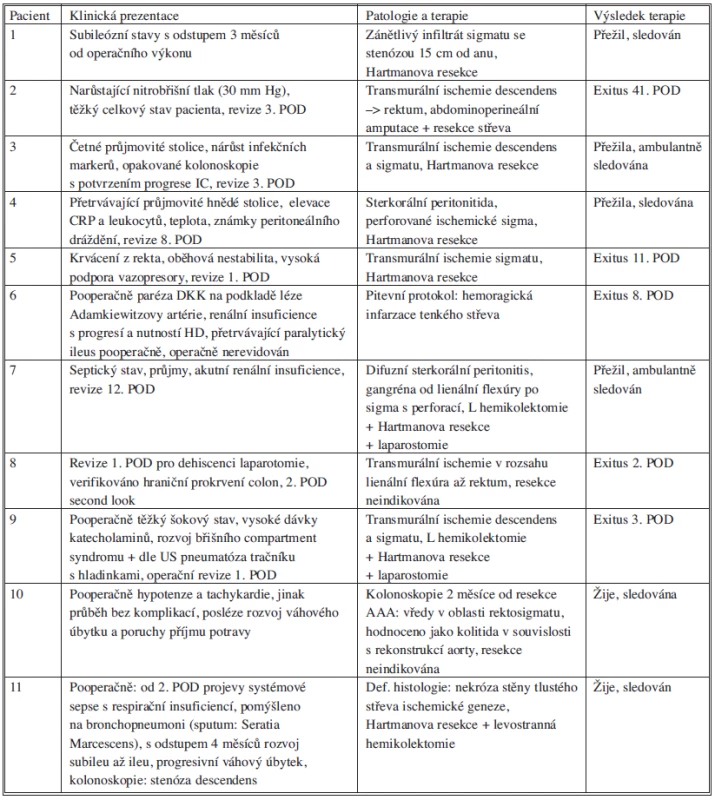
Detailním zpracováním operačních a anesteziologických záznamů bylo provedeno zhodnocení průběhů operačních výkonů ve snaze diagnostikovat základní peroperační rizikové faktory vzniku IC: hypotenze na začátku operačního výkonu, peroperační hypotenze (definována jako systolický tlak s poklesem pod 90 mm Hg po dobu delší než 15 min), potřeba vasopresorů v průběhu operačního výkonu, potřeba krevních převodů a krystaloidů v průběhu operačního výkonu (Tab. 2). Z uvedených parametrů lze za nepříznivé v našem souboru považovat potřebu vasopresorů, která byla vysledována u 7 z 11 pacientů, tedy v 64 % a zvýšenou potřebu krevních převodů v průběhu operačního výkonu (7 j EBR nebo více). Tato druhá skutečnost byla vysledována u 6 pacientů z 11, tedy v 55 %.
2. Zhodnocení peroperačních rizikových faktorů pro vznik ischemické kolitidy Tab. 2. Intraoperative risk factors influencing the development of ischemic colitis. 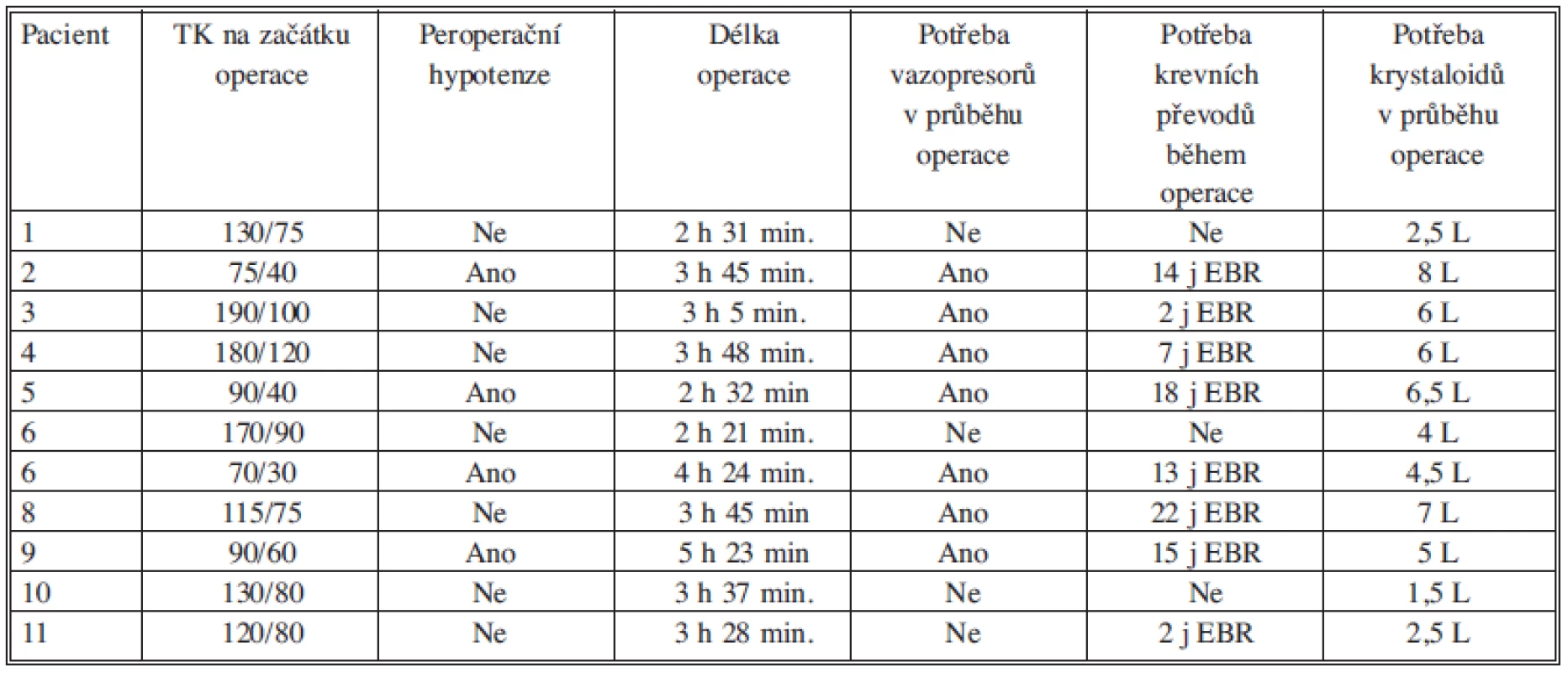
Celková mortalita pacientů s IC v našem souboru představuje 45,5 % (5 z 11 pacientů zemřelo). Při hodnocení pouze pacientů s akutní klinickou symptomatologií je mortalita v našem souboru 62,5 % (5 z 8 pacientů zemřelo), přičemž u všech pacientů až na jednoho se jednalo o diagnózu rAAA. Ze 48 pacientů s diagnózou rAAA vyvinulo IC celkem 5 pacientů, co představuje 10,4% incidenci jejího vývoje pro tuto podskupinu nemocných. Ze 159 pacientů s nerupturovaným AAA vyvinulo IC 6 pacientů, co představuje 3,8 % incidenci jejího vzniku v této subpopulaci nemocných.
Diskuse
Ischemická kolitida nepřestává být problémem, který výrazně zhoršuje prospekt uzdravení u pacientů po elektivním i urgentním ošetření aneuryzmatu abdominální aorty. Incidence ischemické kolitidy v našem souboru na úrovni 5,3 % je zcela v limitech většiny publikovaných studií, u kterých je rozptyl ve výskytu především důsledkem rozdílných způsobů detekce a definice uvedené komplikace se zřetelně vyšší incidencí u prací, které zapojily endoskopickou pooperační monitoraci pacientů [1, 5, 9]. Taky mortalita pacientů v našem souboru z důvodu IC (45,5 %) nevybočuje z rámce literárních údajů [1, 5, 10]. V souladu s literárními zdroji náš soubor pacientů potvrzuje jednoznačně vyšší, téměř trojnásobnou, incidenci IC u pacientů po ošetření rAAA. Za specifikum našich výsledků lze považovat detekci pacientů s „opožděnou” formou manifestace IC s odstupem několika měsíců po resekci aneuryzmatu ve formě ischemické striktúry nebo kolitidy. Uvedená forma manifestace není v literatuře zmiňována. Jednoznačný důkaz kauzální souvislosti s operačním výkonem je u „opožděných” forem obtížné doložit, ale u všech takto postižených pacientů je nápadná manifestace do 4 měsíců od operačního výkonu a taky jednoznačná endoskopická a taky histologická definice nálezů.
Retrospektivní povaha naší práce neumožňovala systematické zhodnocení všech rizikových faktorů pro vznik IC. Práce Levisona z perioperačních faktorů hodnotí jako statisticky signifikantní pro rozvoj IC: hypotenzi na začátku operace (průměrný systolický tlak pod 90 mm Hg), peroperační hypotenzi v délce trvání nad 30 min., tělesnou teplotu na konci operačního výkonu pod 35 °C, potřeba více než 5 litrů tekutin ve včasném pooperačním období a více než 6 jednotek erymasy aplikovaných v průběhu operačního výkonu [11]. Práce Björcka hodnotí jako základní rizikový faktor vývoje IC hemodynamickou nestabilitu pacienta v podobě šoku [1]. I údaje plynoucí z našeho soboru pacientů hodnotí hemodynamickou nestabilitu vyjádřenou v podobě nutnosti peroperační aplikace vazopresorů nebo zvýšeného množství krevních převodů jako důležité rizikové faktory pro vznik IC.
Reimplantace AMI po resekci AAA nebyla ani u jednoho pacienta našeho souboru provedena, proto se nemůžeme vyjádřit k jejímu dopadu na incidenci IC. Prospektivní randomizovaná studie Senekowitsche však nepotvrdila signifikantní redukci perioperační morbidity a mortality z důvodu IC při reimplantaci AMI [5]. Otázkou taky zůstává eventuální dopad systematicky prováděné kolonoskopie na incidenci, ale hlavně terapeutické výsledky pacientů s akutní manifestací IC. Uvedená vyšetřovací modalita byla v této podskupině pacientů použita jenom jednou. V letech 2005 až 2009 jsme na našem pracovišti neprováděli vyšetření hladiny prokalcitoninu, kterou práce Nagata označuje jako velice nadějný skríningový test s vysokou negativní prediktivní hodnotou k vyloučení přítomnosti ischemické kolitidy [12]. Od roku 2010 je však uvedené vyšetření již součástí našeho diagnostického armentária s iniciálně velice slibnými výsledky.
Retrospektivní charakter naší studie společně s malou velikostí souboru pacientů s IC a jeho heterogenita (8 pacientů s akutní manifestací, 3 pacienti s „opožděnou” manifestací) neumožňují širší generalizaci našich závěrů, mohly by však iniciovat jejich verifikaci na multicentrické nebo celonárodní úrovni.
Závěr
Klinická bdělost společně s časnou aplikací endoskopie, počítačové tomografie nebo chirurgické revize představují nadále základní kameny časné diagnostiky ischemické kolitidy. Kromě forem akutní střevní ischemie musíme dalším sledováním pacienta pomýšlet i na možnost pozdní manifestace ischemie ve formě striktúry tlustého střeva nebo kolitidy. Na základě zhodnocení našich pacientů potvrzujeme literární údaje, které považují aplikaci vazopresorů a zvýšenou potřebu krevních převodů peroperačně za jeden z důležitých rizikových faktorů vývoje ischemické kolitidy u pacientů po resekcích AAA.
Seznam použitých zkratek:
IC – střevní ischemie
AAA – aneuryzma abdominální aorty
rAAA – rupturované aneuryzma abdominální aorty
AMI – arteria mesenterica inferior
POD – pooperační den
US – ultrasonografie
DKK – dolní končetiny
HD – hemodialýza
L hemikolektomie – levostranná hemikolektomie
LT – laparotomie
FNUSA – II. chirurgická klinika FN u sv. Anny v Brně a LF MU
MUDr. Ernest Biroš
II. chirurgická klinika FNuSA
Pekařská 53
656 91 Brno
e-mail: ernest.biros@fnusa.cz
Sources
1. Bjorck, M., Bergquist, D., Troeng, T. Incidence and clinical presentation of bowel ischemia after aortoiliac surgery: 2930 operations from a population-based registry in Sweeden. Eur. J. Vasc. Endovasc. Surg., 1996; 12 : 139–144.
2. Zelenock, G., Strodel, W., Knol, J., Messina, L., Wakefield, T., Lindenauer, S., Eckhauser, F., Greenfield, L., Stanley, J. A prospective study of clinically and endoscopically documented colonic ischemia in 100 patients undergoing aortic reconstructive surgery with aggressive colonic and direct pelvic revascularization, compared with historic controls. Surgery, 1989; 106(4): 771–780.
3. Perry, R., Martin, M., Eckert, M., Sohn, V., Steele, S. Colonic ischemia complicating open vs endovascular abdominal aortic aneurysm repair. J. Vasc. Surg., 2008; 48 (2): 272–277.
4. Zhang, W., Kulaylat, M., Anain, P., Dosluoglu, H., Harris, L. Embolization as cause of bowel ischemia after endovascular abdominal aortic repair. J. Vasc. Surg., 2004; 40 (5): 866–872.
5. Senekowitsch, C., Assadian, A., Assadian, O., Hartleb, H., Ptakovsky, H., Hagmüller, G. Replanting the inferior mesentery artery during infrarenal aortic aneurysm repair: influence on postoperative colon ischemia. J. Vasc. Surg., 2006; 43 (4): 689–694.
6. Piotrowski, J., Ripepi, A., Yuhas, J., Alexander, J., Brandt, C. Colonic ischemia: the Achilles heel of ruptured aortic aneurysm repair. Am. Surg., 1996; 62 : 557–561.
7. Schwarze, M., Shen, Y., Hemmerich, J., Dale, W. Age-related trends in utilization and outcome of open end endovascular repair for abdominal aortic aneurysm in the United States, 2001–2006. J. Vasc. Surg., 2009; 50 (4): 722–729.
8. Biroš, E., Staffa, R., Kříž, Z. Reimplantace AMI a akcesorní pravé AR u infrarenálního AAA a současný pohled na indikační kritéria k reimplantaci AMI. Rozhl. Chir., 2010; 9 : 451–455.
9. Ernst, C., Hagihara, P., Daugherty, M., Sachatello, C., Griffen, W. Ischemic colitis following abdominal aortic reconstruction: a prospective study. Surgery, 1976; 80 : 417–421.
10. Champagne, B., Darling, R., Daneshmand, M., Kreienberg, P., Lee, E., Mehta, M. Outcome of aggressive surveillance colonoscopy in ruptured abdominal aortic aneurysm. J. Vasc. Surg., 2004; 39 : 792–796.
11. Levison, J., Halpern, V., Kline, R., Faust, G., Cohen, J. Perioperative predictors of colonic ischemia after ruptured abdominal aortic aneurysm. J. Vasc. Surg., 1999; 29 (1): 40–47.
12. Nagata, J., Kobayashi, M., Nishikimi, N., Komori, K. Serum Procalcitonin as a Negative Screening test for colonic ischemia after Open Abdominal Aortic Surgery. Eur. J. Vasc. Endovasc. Surg., 2008; 35 : 694–697.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 12-
All articles in this issue
- Sacral Nerve Stimulation in the Treatment of Fecal Incontinence – Initial Experience in the Czech Republic and Assessment of Functional Outcomes
- Incidence and Risk Factors of Ischemic Colitis after AAA Repair in Our Cohort of Patients from 2005 through 2009
- IGF1 and Tumor Markers in Different Breast Cancer Stages
- Transrectal Hybrid NOTES versus Laparoscopic Cholecystectomy – A Randomized Prospective Study in a Large Laboratory Animal
- Torsion of Dystopic Spleen – Possible Solutions
- Trends in the Treatment for Liver Metastasis of Colorectal Cancer in Japan
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sacral Nerve Stimulation in the Treatment of Fecal Incontinence – Initial Experience in the Czech Republic and Assessment of Functional Outcomes
- Torsion of Dystopic Spleen – Possible Solutions
- IGF1 and Tumor Markers in Different Breast Cancer Stages
- Incidence and Risk Factors of Ischemic Colitis after AAA Repair in Our Cohort of Patients from 2005 through 2009
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

