-
Medical journals
- Career
Perforace jícnu
Authors: A. Pazdro; T. Haruštiak; M. Šnajdauf; M. Smejkal; J. Schützner; P. Pafko; J. Tvrdoň; R. Lischke
Authors‘ workplace: III. chirurgická klinika FN Praha-Motol, přednosta: doc. MUDr. R. Lischke, Ph. D.
Published in: Rozhl. Chir., 2011, roč. 90, č. 11, s. 647-652.
Category: Monothematic special - Original
Overview
Cíl:
Zhodnocení souboru pacientů s akutní perforací jícnu ošetřených na jednom pracovišti.Materiál a metodika:
Autoři hodnotí soubor 64 po sobě jdoucích nemocných s perforací jícnu ošetřených na našem pracovišti v období mezi lednem 2000 a prosincem 2010. U všech nemocných bylo před rozhodnutím o postupu provedeno CT a RTG vyšetření s podáním kontrastní látky. U vybraných nemocných byla taktéž doplněna endoskopie. Vyřazeni byli nemocní s maligní tracheoezofageální píštělí a nemocní, u kterých perforace vznikla při ošetření maligní stenózy s paliativním úmyslem.Výsledky:
Průměrný věk pacientů v souboru byl 62 let (v rozmezí 24–90), z toho však více jak jedna třetina (34,4 %) byla ve věkové skupině 70 let a více. S iatrogenní perforací jsme přijali 45 (70 %) nemocných, necelou jednu čtvrtinu (n = 15; 23 %) tvořila spontánní perforace jícnu, u třech nemocných se nepodařilo zjistit příčinu perforace (5 %) a u jedné nemocné došlo k perforaci při odstraňování cizího tělesa. Perforace hrudního jícnu u 41 nemocných, ve 20 (31 %) případech v horní a střední třetině a u 21 (33 %) v distální třetině hrudního jícnu. Perforace krčního jícnu jsme zaznamenali u 14 nemocných (22 %) a poranění břišní části pak u 9 pacientů (14 %). 92 % nemocných bylo ošetřeno chirurgicky (n 59). 43 % (n = 27) bylo ošetřeno primární suturou perforace, resekce jícnu s primární rekonstrukcí byla provedena u 4 nemocných, ezofagektomie s terminální ezofagostomií a nutriční jejunostomií (JS) byla u 7 nemocných, 4 nemocní byli ošetřeni pouze chirurgickou drenáží a u 7 nemocných jsme zavedli nekonečnou laváž s nutriční JS. U 9 jsme resekovali postiženou část jícnu se slepým uzávěrem, vždy v hrudníku, a nutriční JS. Neoperačně jsme postupovali u 5 pacientů u kterých byl zaveden stent a perforace zhojena. Celková mortalita v souboru našich pacientů je 23,4 %.Závěr:
Konzervativní postup u pečlivě vybraných pacientů by mohl být alternativou k radikálním a ve své podstatě mutilujícím chirurgickým postupům. Publikované výsledky i naše malé zkušenosti jsou povzbuzující, ale toto téma je stále ještě předmětem studií.Klíčová slova:
perforace jícnuÚVOD
Perforaci jícnu (PJ) jako první pozoroval v roce 1723 a následně popsal prof. Hermann Boerhaave ve své 70stránkové pitevní zprávě vydané o rok později. Správná předoperační diagnostika a úspěšné chirurgické řešení však na sebe nechalo čekat více jak 220 let. Až v roce 1947 publikují Barrett a současně Olsen s Clagettem zprávu o úspěšném chirurgickém ošetření jícnové perforace. V posledních 20 letech zaznamenáváme pozvolný vzestup incidence jícnových perforací, především díky všeobecnému rozmachu endoskopických metod a zaváděním moderních trendů intervenční endoskopie do běžných postupů. Endoskopie se stává hlavní příčinou PJ.
I přes významný rozvoj intenzivní medicíny, diagnostických a léčebných přístupů se stále jedná o klinický problém s extrémní morbiditou a nezanedbatelnou potencionální letalitou. Celková mortalita se pohybuje stále kolem 20 % (v rozmezí 0–80 %) [3].
Příčina a lokalizace poranění a stejně tak i interval mezi perforací a stanovením diagnózy je určující v klinické symptomatologii PJ a je značně variabilní. Až u 60 % pacientů je časový interval mezi perforací a stanovením diagnózy je delší než 24 hodin [11]. Časné stanovení správné diagnózy a zahájení adekvátní léčby jednoznačně snižuje množství komplikací a celkovou mortalitu [32, 25]. Počáteční příznaky jsou často nevýrazné a mohou napodobovat jiná onemocnění jako infarkt myokardu, perforovaný vřed, akutní pankreatitidu, disekci aorty, spontánní pneumotorax nebo jiné plicní onemocnění. Mezi běžné příznaky PJ patří bolesti na prsou, dysfagie, dušnost, podkožní emfyzém, bolesti v epigastriu, teplota, tachykardie a tachypnoe. V případě, že dojde k vzniku některého z těchto příznaků, nebo jejich kombinaci, po endoskopickém vyšetření nebo po zvracení, mělo by nás to vést k podezření na PJ. Macklerovo trias (bolesti na hrudi, zvracení a podkožní emfyzém), používané v anglosaském písemnictví jako typická symptomatologie u jícnových perforací, se vyskytuje u méně jak jedné třetiny nemocných [11]. V případě prodlení, je dominujícím klinickým příznakem septický stav.
MATERIÁL A METODA
Všichni pacienti, kteří přišli na naše pracoviště za posledních 10 let (od ledna 2000 do prosince 2010) s akutní perforací jícnu v jakékoliv etáži, byli zařazeni do našeho retrospektivního souboru. Jednalo se o nemocné jak z našeho fakultního pracoviště tak i z jiných nemocnic. Prakticky žádný z těchto nemocných nebyl primárně chirurgicky ošetřen na jiném pracovišti. Většina z nich byla přeložena do naší nemocnice po 24 hodinách od předpokládaného vzniku perforace. U části pacientů se nám, i přes veškerou snahu a opakované odebírání anamnézy i od příbuzných, nepodařilo zjistit ani přibližný čas ani příčinu vzniku perforace. U této skupiny jsme tak za čas perforace považovali vznik klinické symptomatologie, a pokud ani tento údaj neposkytl náležité vodítko, zařadili jsme je do skupiny s odstupem od perforace větším jak 24 hod. Pacienti přivezení ve vážném stavu, s nutností UPV, byli přijati primárně na oddělení ARO. Ošetření nemocných bylo vždy multidisciplinární s přítomností intenzivisty, invazivního radiologa, endoskopisty a chirurga, ale strategie léčebného postupu byla stanovena po dohodě s chirurgickým týmem. Všichni nemocní, kteří přišli již s provedeným RTG vyšetřením (CT a/nebo pasáž horní části GITu s kontrastní látkou) byla tato dokumentace konzultována s radiologem ve službě a provedeno druhé čtení. Při jakékoliv neshodě či nejasnosti byla indikována kontrolní vyšetření. Všichni nemocní před rozhodnutím o dalším postupu měli provedenou RTG pasáž horní částí GITu s kontrastní látkou a CT s podáním i.v. a p.o. kontrastní látky, zajištěny vitální funkce a kontinuální monitoraci. Vyřazeni byli nemocní s maligní tracheoezofageální píštělí a nemocní u kterých perforace vznikla při ošetření maligní stenózy s paliativním úmyslem. Celkem jsem ošetřili 64 po sobě jdoucích pacientů.
VÝSLEDKY
V desetiletém sledovaném období jsme ošetřili 64 po sobě přicházejících pacientů. Průměrný věk v našem souboru nemocných byl 62 let (v rozmezí 24–90), z toho však více jak jedna třetina (34,4 %) byla ve věkové skupině 70 let a více. Nemocných z našeho pracoviště nebo nemocnice bylo 18 (28 %), odeslaných k ošetření z jiných pracovišť pak 46 (72 %). U necelých dvou třetin byl čas mezi perforací a diagnózou delší než 24 hodin 40 (62,5 %). 24 nemocných (37,5 %) bylo diagnostikováno a ošetřeno do 24 hodin po vzniku perforace. S iatrogenní perforací jsme přijali 45 (70 %) nemocných a nejčastější příčinou bylo endoskopické vyšetření. Necelou jednu čtvrtinu (n = 15; 23 %) tvořila spontánní perforace jícnu, u třech nemocných se nepodařilo zjistit příčinu perforace (5 %) a u jedné nemocné došlo k perforaci při odstraňování cizího tělesa, vidličky, kterou spolkla. Nejčastěji byla perforace diagnostikována v průběhu hrudního jícnu (n = 41), z čehož byla ve 20 (31 %) případech v horní a střední třetině a u 21 (33 %) nemocných pak v distální třetině hrudního jícnu. Perforace krčního jícnu jsme zaznamenali u 14 nemocných (22 %) a poranění břišní části pak u 9 pacientů (14%) (Graf 1). V našem souboru bylo 92 % nemocných ošetřeno chirurgicky (n = 59). 43 % (n = 27) bylo ošetřeno primární suturou perforace, resekce jícnu s primární rekonstrukcí byla provedena u 4 nemocných, ezofagektomie s terminální ezofagostomií a nutriční jejunostomií (JS) byla u 7 nemocných, 4 nemocní byli ošetřeni pouze chirurgickou drenáží a u 7 nemocných jsme zavedli nekonečnou laváž s nutriční JS. U 9 jsme resekovali postiženou část jícnu se slepým uzávěrem, vždy v hrudníku, a nutriční JS. Slepý uzávěr jícnu jsme používali jako metodu volby postavenou proti ezofagektomii s terminální ezofagostomií s úmyslem zachování části funkčního jícnu a zjednodušení následné rekonstrukce. Tento postup jsme v průběhu hodnocení našeho souboru opustili pro vysoké procento reoperací (n = 5) pro únik ze slepě uzavřeného jícnu, i při použití stapleru. Zavedení nekonečné laváže, kterou jsme používali pouze na počátku hodnoceného období, jsme taktéž opustili pro enormní mortalitu spojenou s tímto postupem.
Graph 1. Lokalizace perforace s mortalitou Graph 1. Location of perforations with mortality rates 
Neoperačně jsme postupovali u pěti pacientů v posledním 1,5 roce s výborným efektem. Tato skupina nemocných s perforací jícnu v jeho hrudní části, s únikem ohraničeným na mediastinum, s krátkým odstupem od perforace a bez rozvinutých septických příznaků byla indikována k zavedení povleklého, extrahovatelného stentu. Žádný nemocný nezemřel, u všech došlo úspěšně k zhojení perforace v rozmezí 3–11 týdnů. Okamžitě po primárním ošetření provádíme RTG kontrolu těsnosti, abychom mohli upravit jeho polohu. U nemocných, kde bylo riziko migrace, byl stent opatřen stehem a zavěšen, podobně jako nazogastrická sonda, k nosu. Při výměně stentu (každé 3–4 týdny) nebo při změně klinického stavu, jsme provedli RTG kontrolu stavu perforace a pokud bylo nutné, zavedli jsme další stent nebo upravili jeho polohu až do úplného zhojení.
Celková mortalita v souboru našich pacientů je 23,4 %. Pokud rozdělíme podle lokalizace PJ pak u pacientů s perforací krčního jícnu byla mortalita 21,4 %, u nemocných s perforací hrudního jícnu pak 26,8 %, při perforaci distální třetiny hrudního jícnu byla 9,5 % a u ošetřených perforací abdominálního jícnu nám zemřel jeden nemocný (11,1 %) (Tab. 1). Nejvyšší mortalitu jsme zaznamenali u perforací z neznámého důvodu (33 %), iatrogenní perforace 22,2 % a spontánní perforace s úmrtností 26,7 %.
Table 1. Etiologie perforací jícnu s mortalitou Tab. 1. Etiology of esophageal perforations with mortality rates 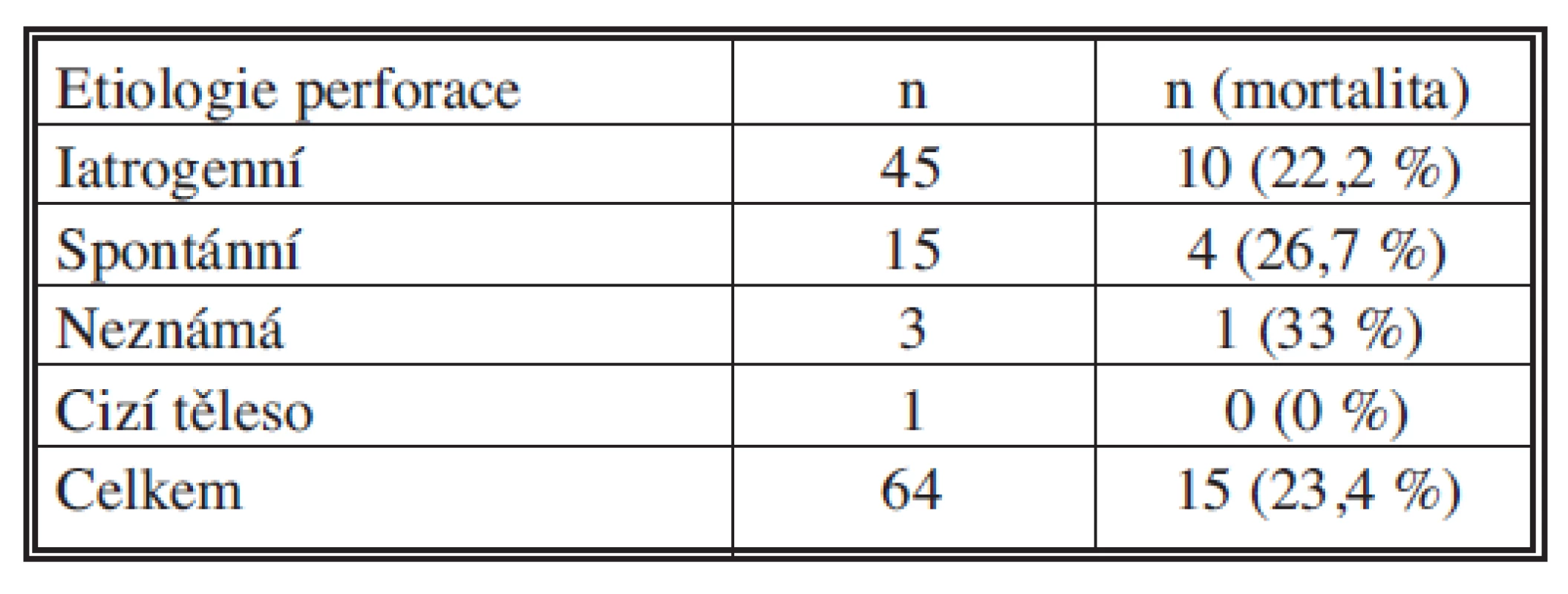
DISKUSE
Nejčastější příčinou PJ je iatrogenní poranění. Z přehledu literatury vyplývá, že endoskopické vyšetření je zodpovědné až za 60 % všech perforací [3]. U diagnostické endoskopie se udává tato komplikace v 0,03 a 0,11 % při provedení flexibilním resp. rigidním endoskopem [16]. U zdravého jícnu se většina perforací vyskytuje v Killianově trojúhelníku. Tato skutečnost odpovídá též našemu souboru, kde jsme iatrogenní příčinu zaznamenali u 70 % našich nemocných. Z dalších možných iatrogenních příčin je nutné jmenovat chirurgické intervence v oblasti jícnu nebo orgánů v jeho blízkosti. Výskyt této komplikace po přední stabilizaci krční páteře je udáván až u 3,4 % [31]. Perforace hrudního jícnu jsou popisovány např. po embolizaci bronchiálních tepen, po plicních resekcích nebo po transplantaci plic [30]. V dolní třetině jícnu komplikuje perforace operace pro refluxní chorobu jícnu či achalázii v 3,9 % respektive 7 % případů [4]. Po chirurgickém výkonu jsme zaznamenali perforaci jícnu u 6 nemocných, ve 4 případech po operaci achalázie či fundoplikaci pro refluxní chorobu jícnu. Ve dvou případech pak perforaci po předchozí přední stabilizaci páteře.
Traumatické poranění jícnu je, v porovnání s ostatními příčinami, relativně vzácnou příčinou a bývá spojena s poraněním jiných orgánů. Pohybuje se od 0–10 % [1, 3, 28]. PJ jsou taktéž popisovány po obtížné endotracheální inkubaci [15], jícnové echokardiografii [15], nebo po zavedení nazogastrické [5] či Blakemoreovy-Senstakenovy sondy [20]. Takovýto případ, stejně jako traumatické poranění jícnu, jsme nezaznamenali.
Spontánní perforace jícnu je nejčastěji zapříčiněna Boerhaavovým syndromem. Ten je v literatuře popsán jako spontánní ruptura dolní třetiny jícnu na podkladě barrotraumatu, které vzniká sekundárně, při náhlém zvýšení intraluminálního tlaku, při zvracení, které je spojeno s absencí relaxace horního jícnového svěrače [18]. Většina současných autorů však, rozšířením původního významu, rozumí pod pojmem Boerhaavův syndrom všechny spontánní perforace na jinak zdravém jícnu, ať se vztahuje ke zvracení nebo nikoliv. Představují 8–56 % všech PJ s nejvyšší mortalitou ze všech spontánních perforací, která přesahuje 28 % (0–67%) [14]. My jsme identifikovali 15 nemocných (23,5 %) se spontánní perforací jícnu s mortalitou v této skupině 26,7 %.
PJ mohou vzácně vzniknout na nemocném jícnu i bez instrumentálního vyšetření. Nejčastější příčinou jsou divertikly, Barrettův jícen nebo infekční ezofagitida (u imunokompromitovaných nemocných) [3]. Jeden nemocný z našeho souboru byl chirurgicky ošetřen pro perforaci krčního jícnu s překvapivým nálezem perforace v Zenkerově divertiklu, bez předchozí instrumentace.
U pacientů s karcinomem jícnu ošetřených s paliativním úmyslem je uváděna PJ v 5 až 8 %, u každého čtvrtého s fatálním průběhem [22]. Maligní tracheoezofageální píštěle se vyskytují v 4,9 % [22].
RTG pasáž horní částí gastrointestinálního traktu (GIT) s podáním vodné kontrastní látky patří k základním kamenům na cestě ke stanovení správné diagnózy. Senzitivita vyšetření pro detekci krční perforace je 50%, u poranění hrudního jícnu 75–80% [8]. V některých případech nemusí vodou ředitelná kontrastní látka zobrazit PJ tehdy řada autorů doporučuje provedení vyšetření s použitím bariové suspenze [3, 10]. Kontrastní RTG vyšetření může být v 10 % falešně negativní. Pokud provedená vyšetření neprokážou únik k.l. mimo lumen jícnu a stále trvá podezření na PJ, je indikováno druhé vyšetření s odstupem několika hodin [10]. Negativní RTG kontrastní vyšetření nemusí být důkazem, že se nejedná o perforaci, v těchto případech vyžaduje správná diagnóza provedení CT, flexibilní ezofagoskopie nebo obojího.
Využití CT vyšetření v diagnostice PJ zaznamenalo v posledních dvou dekádách významný posun. Jeho používání stouplo z 12 % na 96 % za poslední dvě dekády [19]. V současné době jej považujeme za metodu volby pro vysokou senzitivitu metody (92 až 100 %) a přesnější zobrazení okolních struktur než RTG kontrastní vyšetření [6].
Senzitivita endoskopického vyšetření pro detekci PJ je téměř 100% a specificita 83% [13]. Někteří autoři jako Kuppusamyho a kol. používají horní endoskopii zcela rutinně (u 80 % pacientů) [19]. V našem souboru jsme RTG kontrastní vyšetření jícnu a CT měli u všech nemocných před rozhodnutím o dalším postupu léčby. Nezaznamenali jsme žádný případ, kdy by muselo být RTG či CT vyšetření zopakováno pro neprůkazný nález. Endoskopii jsme prováděli v případě rozhodnutí o konzervativním postupu se zavedením stentu, nebo při diagnostických nejasnostech.
Konzervativní léčba zahrnuje striktní vyloučení perorálního příjmu až do provedení RTG kontroly sedmý den hospitalizace, totální parenterální výživu, širokospektrá antibiotika (podávaná až 21 dní) a blokátory protonové pumpy. Opakovaná CT a/nebo RTG vyšetření, pečlivá monitorace vývoje a změn klinického stavu jsou nezbytné ke správné a včasné změně léčebné strategie. U pacientů léčených konzervativně je nutné vždy počítat s nutností chirurgické intervence. Jak uvádí Minnich a kol. v jejich souboru bylo nutné, pro zhoršení stavu a rozvoje známek sepse, u více jak poloviny (54 %) léčených konzervativně zasáhnout chirurgicky [21]. Alltorjay a kol. udává přibližně 20 % případů, které si vyžádali chirurgickou intervenci [2].
Indikace konzervativní léčebné strategie jsou v současnosti již dobře rozpracované, především díky práci tohoto autora [2] a ostatních [29, 14] (Tab. 2).
Table 2. Kritéria neoperačního managementu perforace jícnu (zpracováno podle Altorjay, Chirica a Shaffera) Tab. 2. Criteria of inoperative management of esophageal perforations (according to Altorjay, Chirico and Shaffer) 
Rychlý technologický vývoj jícnových stentů je obecně považován za zásadní pokrok v neoperačním managementu PJ. Cílem je překrytí místa perforace a zabránění pokračování kontaminace s následnými septickými komplikacemi. Většina stentů, používaná v těchto indikacích, je plně potažená a extrahovatelná. Extrakce by měla být provedena za čtyři až šest týdnů po zavedení. Úspěšnost v publikacích s tímto tématem se pohybuje 92–100 %, hojení se pohybuje od 13 do 69 % a úmrtnost od 0 do 33 %. Migrace stentu je nejčastější komplikací (6 až 35%) (7, 9, 17, 24).
Výběr vhodných kandidátů pro endoskopické ošetření PJ stentem je otázka, kterou se zabývá většina v současnosti probíhajících studií. Zdůraznění si zaslouží názor, že podle kritérií uvedených pro použití stentu by výsledek byl stejný s i bez jeho použití [26]. Tuto metodu jsme použili u 5 nemocných s perforací hrudního jícnu s výborným efektem a plnou úspěšností zhojení a bez migrace stentu.
Chirurgická léčba stále patří k základním metodám ošetření perforací jícnu. Volba způsobu chirurgického postupu závisí na lokalizaci perforace, její velikosti, životaschopnosti stěny jícnu, pokročilosti septických příznaků a zda jsou či nejsou přítomny jiné patologie jícnu.
Na našem pracovišti bylo indikováno k chirurgické revizi 92 % nemocných. Počet jednotlivých výkonu je uveden v tabulce 3. Nejčastěji jsme provedli prostou suturu perforačního otvoru (n = 27), na druhém místě pak je resekční výkon na poraněném jícnu (n = 21). Je nutné přiznat, že pokud se jedná o PJ máme vyšší „pohotovost“ k radikálnímu chirurgickému postupu, pokud to stav nemocného to umožní.
Konzervativní chirurgická léčba zahrnuje vždy primární suturu perforace, pokud je možná, nebo posílenou suturu (svalovým lalokem, pleurou či perikardem), chirurgické debridement nekrotických tkání, drenáž, ošetření distálně uložených patologií jícnu a zajištění parenterální nebo enterální stravy.
Prostá drenáž s nebo bez podtlaku je indikována především u perforací krčního jícnu, pokud není možný uzávěr perforace nebo pokud místo perforace není zřejmé. U perforací hrudního a břišního jícnu se nedoporučuje, protože nebrání dalšímu šíření infekce [3].
Exkluze jícnu byla navržena pro léčbu pacientů, u nichž byl zdravotní stav považován za příliš rizikový pro velký chirurgický výkon. Jícen je vyloučen z pasáže provedením krční ezofagostomie s přerušením jícnu staplerem a přerušením kardie dokončíme oboustrannou exkluzi jícnu. Meze tohoto operačního postupu představuje nepředvídatelnost rekanalizace jícnu (8 dní až 1 měsíc) a riziko stenózy pro kterou většina autorů tuto techniku opustila [29].
Ezofagektomie je indikována po selhání konzervativní léčby, při rozsáhlé destrukci stěny nebo v případě, že perforace je komplikací při jiném základním onemocnění jícnu [12]. Někteří autoři, při časně diagnostikované perforaci, doporučují okamžité obnovení kontinuity trávicího traktu interpozicí žaludkem [25]. Tento postup je diskutabilní, protože může zhoršit výsledky.
Ve své práci uvádí Brinster et al. [3] výsledky u 726 pacientů. Mortalita byla 17% (0 až 33%) po konzervativní léčbě, 12% (0 až 31%) po provedení sutury, 36% (0 až 47%) po zavedení jednoduché drenáže, 24% (0 až 80%) po exkluzi jícnu a 17% (0 až 43%) po ezofagektomii.
Table 3. Chirurgické výkony pro PJ v letech 2000–2010 Tab. 3. Surgical procedures for esophageal perforations in 2000–2010 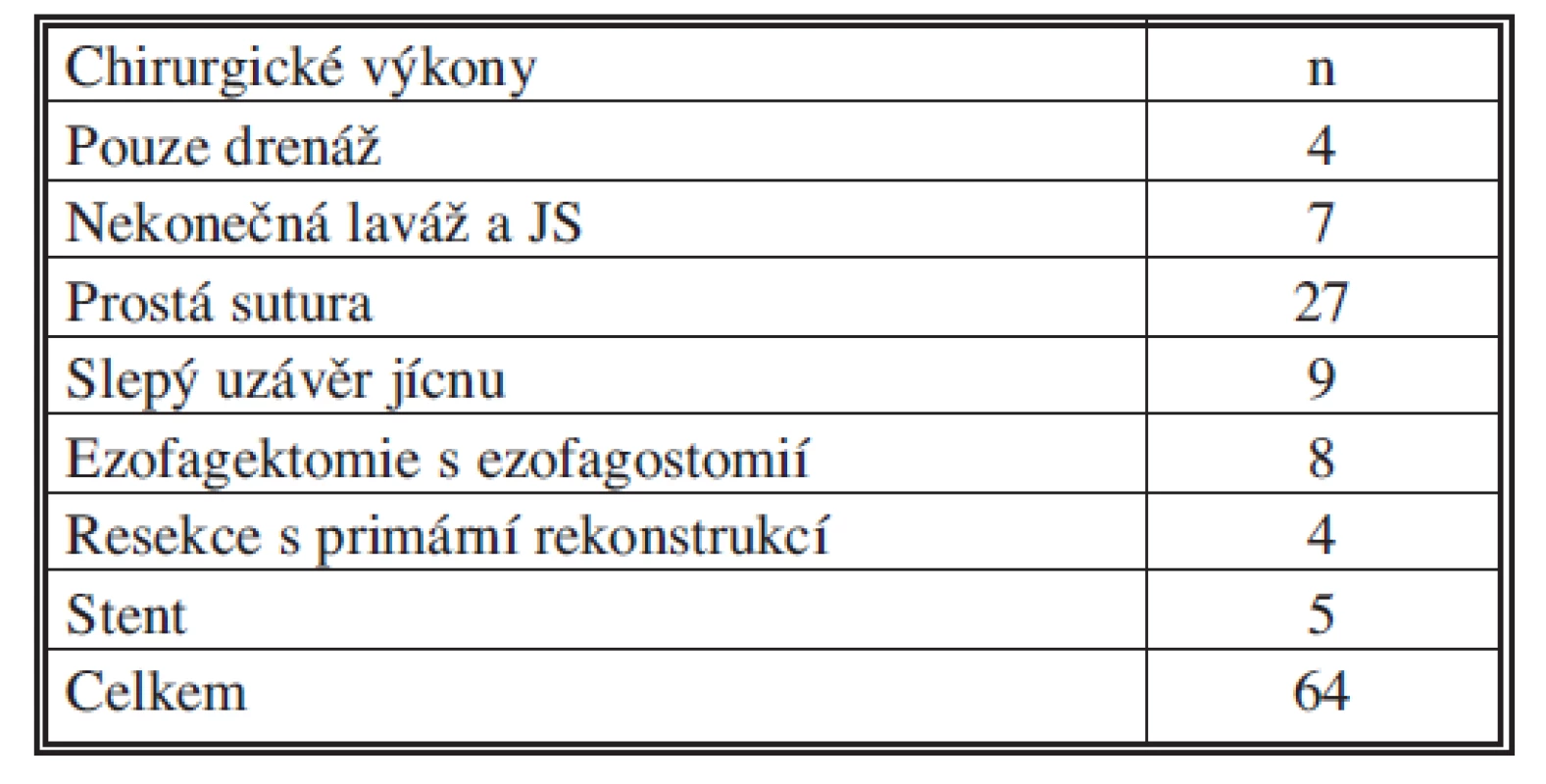
ZÁVĚR
Pod obecný termín perforace jícnu sdružujeme několik naprosto rozdílných klinických a patologických subjektů s velmi rozdílnou prognózou a odlišnou léčebnou strategií. PJ je stále smrtelné onemocnění v jednom z pěti případů. Včasná diagnóza a odpovídající vedení terapie může zlepšit tuto neutěšenou situaci. Chirurgická intervence – sutura perforace nebo posílená sutura a léčba přidružených onemocnění jícnu zůstává základem léčby. U pečlivě vybraných pacientů lze zvolit nechirurgické postupy sdružující konzervativní nechirurgickou léčbu, zavedení stentu a radiologicky vedené drenáže s velmi dobrým efektem. Výsledky autorů, kteří se tomuto tématu věnují, stejně tak jako naše počáteční snaha o tuto terapeutickou modalitu jsou povzbuzením k další práci. Při velkém poškození jícnu nebo pokud selhává konzervativní postup, není možné dále váhat a je nutné nemocného vést k radikálnímu chirurgickému ošetření i za cenu ezofagektomie.
Publikováno s podporou VZ MZ0FNM2005.
MUDr. Alexandr Pazdro
Ratibořská 751
181 00 Praha 8
e-mail: sasa.pazdro@lfmotol.cuni.cz
Sources
1. Abbas, G., Schuchert, M. J., Pettiford, B. L., Pennathur, A., Landreneau, J., Luketich, J. D., et al. Contemporaneous management of esophageal perforation. Surgery, 2009; 146(4): 749–755 [discussion 55–56]
2. Altorjay, A., Kiss, J., Voros, A., Bohak, A. Nonoperative management of esophageal perforations. Is it justified? Ann. Surg., 1997; 225(4): 415–421.
3. Brinster, C. J., Singhal, S., Lee, L., Marshall, M. B., Kaiser, L. R., Kucharczuk, J. C. Evolving options in the management of esophageal perforation. Ann. Thorac. Surg., 2004; 77(4): 1475–1483.
4. Campos, G. M., Vittinghoff, E., Rabl, C., Takata, M., Gadenstatter, M., Lin, F., et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann. Surg., 2009; 249(1): 45–57.
5. de Dominici, F., Rekik, R., Merlusca, G., Deguines, J. B., Gamain, J., Berna, P. Perforation par sonde nasogastrique avec arc aortique droit et aorte descendante ą droite. J. Chir., 2009; 146 : 499–502.
6. de Lutio di Castelguidone, E., Merola, S., Pinto, A., Raissaki, M., Gagliardi, N., Romano, L. Esophageal injuries: spectrum of multidetector row CT findings. Eur. J. Radiol., 2006; 59(3): 344–348.
7. Fischer, A., Thomusch, O., Benz, S., von Dobschuetz, E., Baier, P., Hopt, U. T. Nonoperative treatment of 15 benign esophageal perforations with self-expandable covered metal stents. Ann. Thorac. Surg., 2006; 81(2): 467–472.
8. Foley, M. J., Ghahremani, G. G., Rogers, L. F. Reappraisal of contrast media used to detect upper gastrointestinal perforations: comparison of ionic water-soluble media with barium sulfate. Radiology, 1982; 144 : 231–237.
9. Gelbmann, C. M., Ratiu, N. L., Rath, H. C., Rogler, G., Lock, G., Scholmerich, J., et al. Use of self-expandable plastic stents for the treatment of esophageal perforations and symptomatic anastomotic leaks. Endoscopy, 2004; 36(8): 695–699.
10. Gollub, M. J., Bains, M. S. Barium sulfate: a new (old) contrast agent for diagnosis of postoperative esophageal leaks. Radiology, 1997; 202 : 360–362.
11. Griffiths, E. A., Yap, N., Poulter, J., Hendrickse, M. T., Khurshid, M. Thirty-four cases of esophageal perforation: the experience of a district general hospital in the UK. Dis. Esophagus, 2009; 22(7): 616–625.
12. Gupta, N. M., Kaman, L. Personal management of 57 consecutive patients with esophageal perforation. Am. J. Surg., 2004; 187(1): 58–63.
13. Horwitz, B., Krevsky, B., Buckman, Jr. R. F, Fisher, R. S., Dabezies, M. A. Endoscopic evaluation of penetrating esophageal injuries. Am. J. Gastroenterol., 1993; 88(8): 1249–1253.
14. Chirica, M., Champaulta, A., Drayb, X., Sulpicec, L., Munoz-Bongranda, N., Sarfati, E., Cattana, P. Esophageal perforations. Journal of Visceral Surgery, (2010) 147, e117–e128.
15. Jougon, J., Cantini, O., Delcambre, F., Mihnuti, A., Velly, J. F. Esophageal perforation: life threatening complication of endotracheal intubation. Eur. J. Cardiothorac. Surg., 2001; 20(1): 7–10 [discussion 11].
16. Kavic, S. M., Basson, M. D. Complications of endoscopy. Am. J. Surg., 2001; 181(4): 319–332.
17. Kim, A. W., Liptay, M. J., Snow, N., Donahue, P., Warren, W. H. Utility of silicone esophageal bypass stents in the management of delayed complex esophageal disruptions. Ann. Thorac. Surg., 2008; 85(6): 1962–1967 [discussion 7].
18. Korn, O., Onate, J. C., Lopez, R. Anatomy of the Boerhaave syndrome. Surgery, 2007; 141(2): 222–228.
19. Kuppusamy, M. K., Hubka, M., Felisky, C. D., Carrott, P., Kline, E. M., Koehler, R. P., Low, D. E. Evolving management strategies in esophageal perforation: surgeons using nonoperative techniques to improve outcomes. J. Am. Coll. Surg., 2011 Jul; 213(1): 164–171; discussion 171–172. Epub 2011 Mar 23.
20. Lee, J. G., Lieberman, D. A. Complications related to endoscopic hemostasis techniques. Gastrointest. Endosc. Clin. N. Am., 1996; 6(2): 305–321.
21. Minnich, D. J., Yu, P., Bryant, A. S., Jarrar, D., Cerfolio, R. J. Management of thoracic esophageal perforations. Eur. J. Cardiothorac. Surg., 2011 Oct; 40(4): 931–937. Epub 2011 Feb 25.
22. Morgan, R. A., Ellul, J. P., Denton, E. R., Glynos, M., Mason, R. C., Adam, A. Malignant esophageal fistulas and perforations: management with plastic-covered metallic endoprostheses. Radiology, 1997; 204(2): 527–532.
23. Orringer, M. B., Stirling, M. C. Esophagectomy for esophageal disruption. Ann. Thorac. Surg., 1990; 49(1): 35–42 [discussion 43].
24. Salminen, P., Gullichsen, R., Laine, S. Use of self-expandable metal stents for the treatment of esophageal perforations and anastomotic leaks. Surg. Endosc., 2009; 23(7): 1526–1530.
25. Sawyer, R., Phillips, C., Vakil, N. Short - and long-term outcome of esophageal perforation. Gastrointest. Endosc., 1995; 41 : 130–134.
26. Sepesi, B., Raymond, D. P., Peters, J. H. Esophageal perforation: surgical, endoscopic and medical management strategies. Curr. Opin. Gastroenterol., 2010 Jul; 26(4): 379–383.
27. Shaffer, H. A. Jr., Valenzuela, G., Mittal, R. K. Esophageal perforation. A reassessment of the criteria for choosing medical or surgical therapy. Arch. Intern. Med., 1992; 152 : 757–761.
28. Sung, S. W., Park, J. J., Kim, Y. T., Kim, J. H. Surgery in thoracic esophageal perforation: primary repair is feasible. Dis. Esophagus, 2002; 15(3): 204–209.
29. Urschel, Jr. H. C., Razzuk, M. A., Wood, R. E., Galbraith, N., Pockey, M., Paulson, D. L. Improved management of esophageal perforation: exclusion and diversion in continuity. Ann. Surg., 1974; 179(5): 587–591.
30. Venuta, F., Rendina, E. A., De Giacomo, T., Ciccone, A. M., Mercadante, E., Coloni, G. F. Esophageal perforation after sequential double-lung transplantation. Chest, 2000; 117 : 285–287.
31. Vrouenraets, B. C., Been, H. D., Brouwer-Mladin, R., Bruno, M., van Lanschot, J. J. Esophageal perforation associated with cervical spine surgery: report of two cases and review of the literature. Dig. Surg., 2004; 21(3): 246–249.
32. White, R. K., Morris, D. M. Diagnosis and management of esophageal perforations. Am. Surg., 1992 Feb; 58(2): 112–119.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 11-
All articles in this issue
- Akutní mediastinitida
- Transplantace plic
- Využitie epiteliálnych buniek príjemcu pri allotransplantácii trachey v experimente – prvé výsledky
- Je něco nového v léčbě spontánního pneumotoraxu?
- Je oprávněné provedení pneumonektomie v léčbě plicních metastáz?
- Spontánní pneumomediastinum – kazuistika
- Principy ošetření poranění hrudní stěny
- Penetrující poranění hrudníku a břicha: diagnostický a léčebný postup
- Perforace jícnu
- Četnost metatastického postižení mediastinálních uzlin během plicní metastasektomie
- Perforace pravé komory srdeční úlomkem žebra po tupém úrazu hrudníku
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akutní mediastinitida
- Transplantace plic
- Perforace jícnu
- Je něco nového v léčbě spontánního pneumotoraxu?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

