-
Medical journals
- Career
Endovaskulární léčba stenóz karotických tepen s použitím cerebrální protekce: pětileté zkušenosti
: Miroslav Lojík 1; D. Krajíčková 2; M. Kubíková 2; A. Krajina 1; J. Raupach 1; V. Chovanec 1; J. Schreiberová 3
: Radiologická klinika LF a FN, Hradec Králové, přednosta: prof. MUDr. P. Eliáš, CSc. 1; Neurologická klinika LF a FN, Hradec Králové, přednosta: doc. MUDr. G. Waberžinek, CSc. 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, LF a FN, Hradec Králové přednosta: doc. MUDr. V. Černý, Ph. D., FCCM 3
: Rozhl. Chir., 2007, roč. 86, č. 10, s. 513-520.
: Monothematic special - Original
Cíl práce:
Perkutánní transluminální angioplastika se zavedením stentu a použitím protekčního zařízení je minimálně invazivní léčebnou metodou, jejímž cílem je snížit riziko vzniku cévní mozkové příhody u nemocných se stenózami karotických tepen. Naším záměrem je zhodnotit výsledky endovaskulární léčby u nemocných se zvýšeným rizikem k chirurgické endarterektomii.Soubor nemocných a metodika:
V letech 2001–2006 bylo na našem oddělení ošetřeno celkem 210 stenóz karotických tepen u 204 nemocných. Symptomatickou stenózu mělo 47 % nemocných, asymptomatickou stenózu 53 % nemocných. U asymptomatických nemocných se jednalo o zúžení tepny větší než 70 % a nejčastěji současný uzávěr kontralaterální karotické tepny. U symptomatických nemocných bylo ošetřováno zúžení větší než 50 %.Výsledky:
Technická úspěšnost výkonu byla 99 %, mortalita 0,49 %. Periprocedurální emboligenní komplikace charakteru tranzitorní ischemické ataky se vyskytly u 2,39 % nemocných, komplikace typu „minor stroke“ u 0,47 % nemocných a typu „major stroke“ u 0,47 % nemocných. Souhrnné komplikace invalidizující cévní mozkové příhody a smrti byly 0,96 %. Dlouhodobě je více jak 12 měsíců sledováno 153 nemocných (73 %), během této doby bylo zaznamenáno 7 hemodynamicky významných restenóz (3,9 %), které se ve třech případech manifestovaly jako TIA. Žádný nemocný v průběhu dlouhodobého sledování neprodělal mozkový infarkt a nezemřel.Závěr:
Endovaskulární léčba stenóz karotických tepen s použitím protektivních filtrů je u rizikových nemocných bezpečnou metodou s akceptovatelnými výsledky. Metoda by měla být prováděna pouze v centrech nebo v rámci studií a registrů, je nutné další sledování pro zhodnocení bezpečnosti a efektivity metody ve srovnání s chirurgickou endarterektomií a plnou konzervativní léčbou.Klíčová slova:
stenóza karotické tepny – cerebrální protekce – komplikaceÚVOD
Cílem léčby stenóz karotických tepen je zabránit vzniku cévní mozkové příhody (CMP). Jakákoliv invazivní léčebná metoda však musí prokázat výhodnost pro nemocné ve srovnání svého účinku s přirozeným průběhem nemoci a konzervativní terapií. Při dosažení velmi nízkého operačního rizika je za zlatý standard léčby považována chirurgická endarterektomie (KAE) s prokázanou bezpečností a dlouhodobým efektem. V posledních letech se jako alternativa léčebného postupu do popředí dostává endovaskulární technika ošetření stenóz extrakraniálních mozkových tepen pomocí PTA a stentu (PTAS). Endovaskulární léčbu je proto možné s výhodou využít tam, kde chirurgická léčba může přesáhnout limity rizika komplikací. Nejčastěji jsou endovaskulárně léčeni nemocní s polystenotickým procesem tepen zásobujících mozek nebo významnou komorbiditou, dále nemocní s nevhodnou anatomií pro chirurgickou revaskularizaci. Hlavní limitací endovaskulární léčby jsou periprocedurální komplikace emboligenního charakteru. Bezpečnost endovaskulárních výkonů je proto v současnosti zvyšována používáním kombinované farmakologické a mechanické protekce spočívající v antiagregační a antikoagulační terapii a užívání speciálních protektivních filtrů, které mají zabránit embolizaci do mozkového řečiště během endovaskulárního výkonu. Cílem práce je zhodnotit pětileté zkuše-nosti s touto léčbou u nemocných se zvýšeným rizikem k chirurgické endarterektomii a provést analýzu současného postavení obou metod v terapeutickém rozhodování léčby stenóz krkavic.
SOUBOR NEMOCNÝCH A METODIKA
V období od září 2001 do srpna 2006 (60 měsíců) bylo na našem oddělení ošetřeno metodou PTAS a dočasného protektivního filtru celkem 210 stenóz karotických tepen u 204 nemocných. Soubor zahrnuje 140 mužů s průměrným věkem 63 let (51–79 let) a 64 žen s průměrným věkem 66 let (47–83 let). V 99 případech (47 %) se jednalo o stenózu symptomatickou, ostatních 111 stenóz bylo asymptomatických. Ve skupině pacientů se symptomatickou stenózou se ve většině případů jednalo o ischemické projevy charakteru tranzitorní ischemické ataky (TIA) či drobného inzultu („minor stroke“), u 4 nemocných o projev tranzitorní retinální ischemie typu amaurosis fugax. Pro arteriální hypertenzi se léčilo 167 nemocných (82 %), současnou ischemickou chorobou srdeční (ASA III – IV) trpělo 98 pacientů (48 %). K endovaskulárnímu ošetření byli indikováni nemocní nevhodní k chirurgické léčbě či nemocní se zvýšeným rizikem. Stupeň stenózy byl hodnocen na základě diagnostické angiografie podle kritérií NASCET (North American Symptomatic Carotid Endarterectomy Trial) [3]. U symptomatických nemocných byla ošetřována stenóza větší než 50 %, u skupiny nemocných s asymptomatickým zúžením se nejčastěji jednalo o stenózu tepny významnější než 70 % se současným uzávěrem druhostranné vnitřní karotické tepny nebo o stenózu větší než 80 % u nemocných bez polystenotického postižení. Nemocní byli k výkonu indikováni ordinářem pro cévní neurologii. U dvou nemocných byla PTAS provedena před plánovaným aortokoronárním bypassem a jeden nemocný byl ošetřen po neúspěšném pokusu o karotickou endarterektomii. Indikace v jednotlivých skupinách shrnuje tabulka (Tab. 1).
1. Indikace endovaskulární léčby (n = 210) Tab. 1. Indications for endovascular management (n = 210) 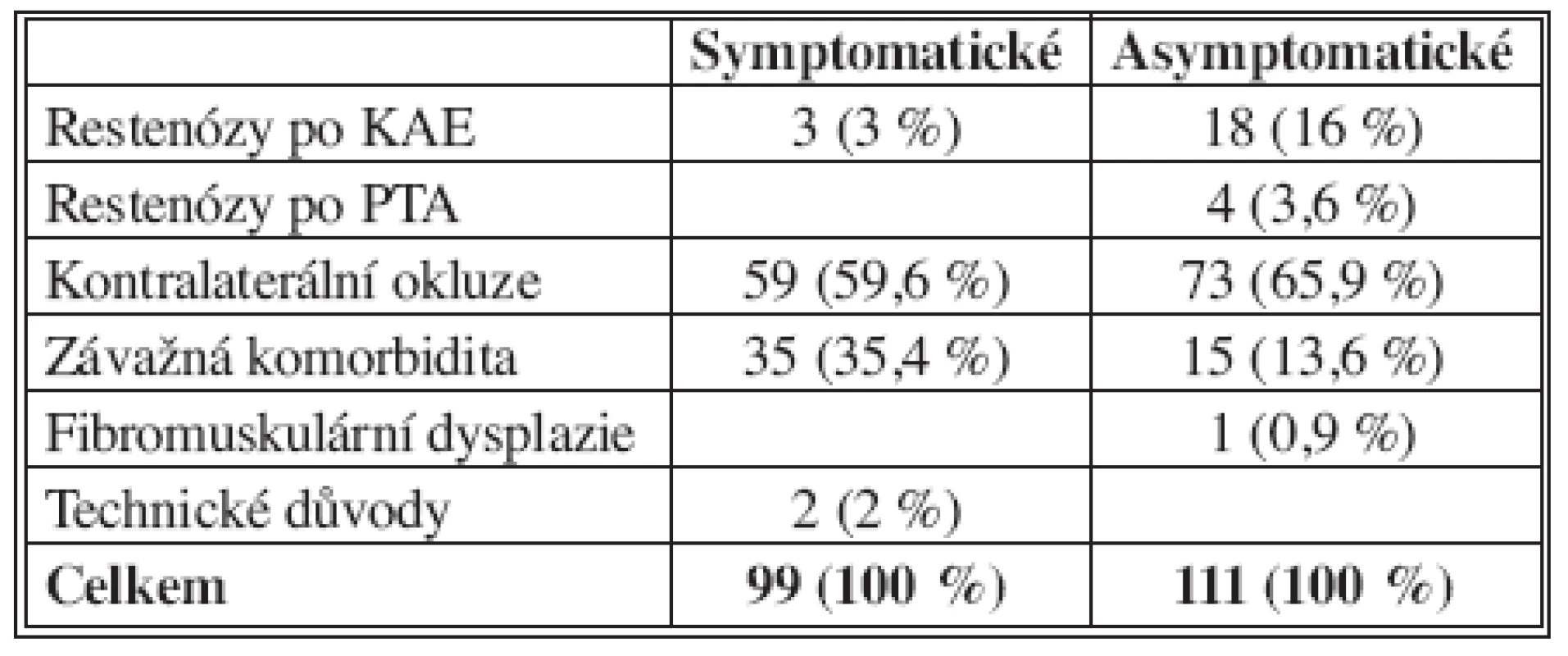
U všech nemocných byla minimálně 3 dny před výkonem zahájena duální antiagregační terapie, spočívající v podávání dávky 100 mg kyseliny acetylsalicylové a 2x 250 mg ticlopidinu/den, od roku 2003 v kombinaci 100 mg kyseliny acetylsalicylové a 75 mg clopidogrelu denně. Duální antiagregační terapie poté pokračovala po dobu 1–3 měsíců po výkonu, podávání kyseliny acetylsalicylové je trvalé. Všichni nemocní před vyšetřením podepsali informovaný souhlas.
Indikace k endovaskulárnímu výkonu byla prováděna neurologem na základě radiologických a klinických kritérií. Bylo-li na základě screeningových vyšetření – ultrasonografie (USG), výpočetní tomografie (CT) nebo magnetické rezonance (MR) vysloveno podezření na významnou stenózu karotické tepny, bylo u všech nemocných provedeno vyšetření mozku pomocí CT nebo MR k ozřejmění stavu cílového orgánu. Poté následovala diagnostická angiografie (AG) k ověření významnosti stenózy a posouzení vhodnosti cév k endovaskulárnímu výkonu.
Vlastní výkon zahrnoval kompletní vyšetření tepen zásobujících mozek od aortálního oblouku po mozkové tepny. Pouze při kvalitním vyšetření aortálního oblouku pomocí MR nebo CT byla prováděna přímo selektivní karotická angiografie. Poté byl do zevní karotické tepny zaveden dlouhý výměnný vodič, po kterém byl do společné karotické tepny umístěn dlouhý zavaděč nebo vodící katétr, který byl kontinuálně proplachován heparinizovaným fyziologickým roztokem (5 000 j. heparinu/500 ml F1/1). Následně bylo protektivním filtrem proniknuto přes stenotický úsek pod lební bázi do vnitřní karotické tepny, kde byl filtr otevřen. Pouze ve dvou případech byla nutná predilatace stenózy balonkem před zavedením filtru. Po predilataci stenózy balonkem o průměru 3 mm (Gazelle, Monorail, Boston Scientific, USA) byl do oblasti bifurkace zaveden samoexpandibilní stent (Carotid Wallstent, Monorail, Boston Scientific, USA; Precise, Cordis, USA; Acculink, Guidant, USA; Nextstent, Boston Scientific, USA; Xact, Abbott Vascular Devices, USA), který byl dodilatován balonkovým katétrem na příslušný průměr cévy. Po kontrolní angiografii karotického a distálního mozkového řečiště byl protektivní filtr pomocí ochranného katétru zavřen a vytažen ven. Všechny filtry jsou připevněny na 0,014palcovém vodiči s ohebným tvarovatelným koncem, v průběhu let jsme použili různé typy ochranných filtrů (Filtre Wire EPI, Boston Scientific, USA; Emboshield filtr, Abbott Vascular Devices, USA; AngioGuard, Cordis, USA; Accunet, Guidant, USA).
Během vlastního zákroku byl každému nemocnému podán bolus 3000–5000 jednotek heparinu intraarteriálně. V letech 2001–2002jsme následujících 48 hodin po zákroku pokračovali v kontinuálním podávání heparinu intravenózně v takové dávce, aby aktivovaný parciální tromboplastinový čas (APTT) nemocného byl 2–3krát prodloužen. Vzhledem k opakovanému krvácení z místa vpichu jsme však později přešli k subkutánnímu podávání nízkomolekulárního heparinu dvakrát denně v tera-peutické dávce podle hmotnosti nemocného po dobu 48 hodin od intervence. Od roku 2002 používáme k uzávěru místa vpichu zařízení k perkutánnímu uzávěru tepen (Angio-Seal, Saint Jude Medical, USA nebo Perclose system, Vascular Abbott Devices, USA). Před vlastní insuflací balónku během zákroku byl nemocným podáván intravenózně atropin v dávce 0,5–1,5 mg jako prevence bradykardie při případné vagové reakci, ke které může dojít podrážděním mechanoreceptorů karotického bulbu. Výkony byly prováděny v monitorované sedaci – analgezii. Sedace byly titrována tak, aby byl zachován kontakt s nemocným a reakce na slovní podnět. Za technicky úspěšný jsme výkon považovali v případě, že se po diagnostické AG podařilo proniknout filtrem přes stenózu, zavést stent, provést dilataci léze, odstranit filtr a dosáhnout rozšíření lumen karotické tepny s reziduální stenózou do 30 % (Obr. 1).
Po výkonu jsou všichni nemocní sledováni neurologem, je prováděno kontrolní USG vyšetření.
1. 70letý muž s recidivujícími TIA z pravé hemisféry, ICHS, plicní fibrózou. Na USG zjištěna 80% stenóza a. carotis interna dx. A) Angiogram pravé karotické tepny se stenózou 80 %. B) Stav po zavedení protektivního filtru do ACI pod lební bázi (šipka), predilatace stenózy 3x 20mm balonkem. C) Stav po zavedení samoexpandibilního stentu a jeho dodilatování 6x 20mm balonkem. D) Výsledný angiogram ukazuje průchodnou ACI bez reziduální stenózy. Fig. 1. A 70-year old male with relapsing TIAs in the right hemisphere, cardiac ischemia, pulmonary fibrosis. On ultrasound examination, 80% stenosis of a. carotis interna dx was detected. A) Angiogram of the right carotid artery with a stenosis of 80 %. B) Status post introduction of a protective filter into the ACI below the skull base (arrow), 3x 20 mm balloon predilatation of the stenosis. C) Status post introduction of a selfexpandible stent and its further 6x 20 mm balloon dilatation. D) The final angiogram depicts unobstructed ACI without any residual stenoses. 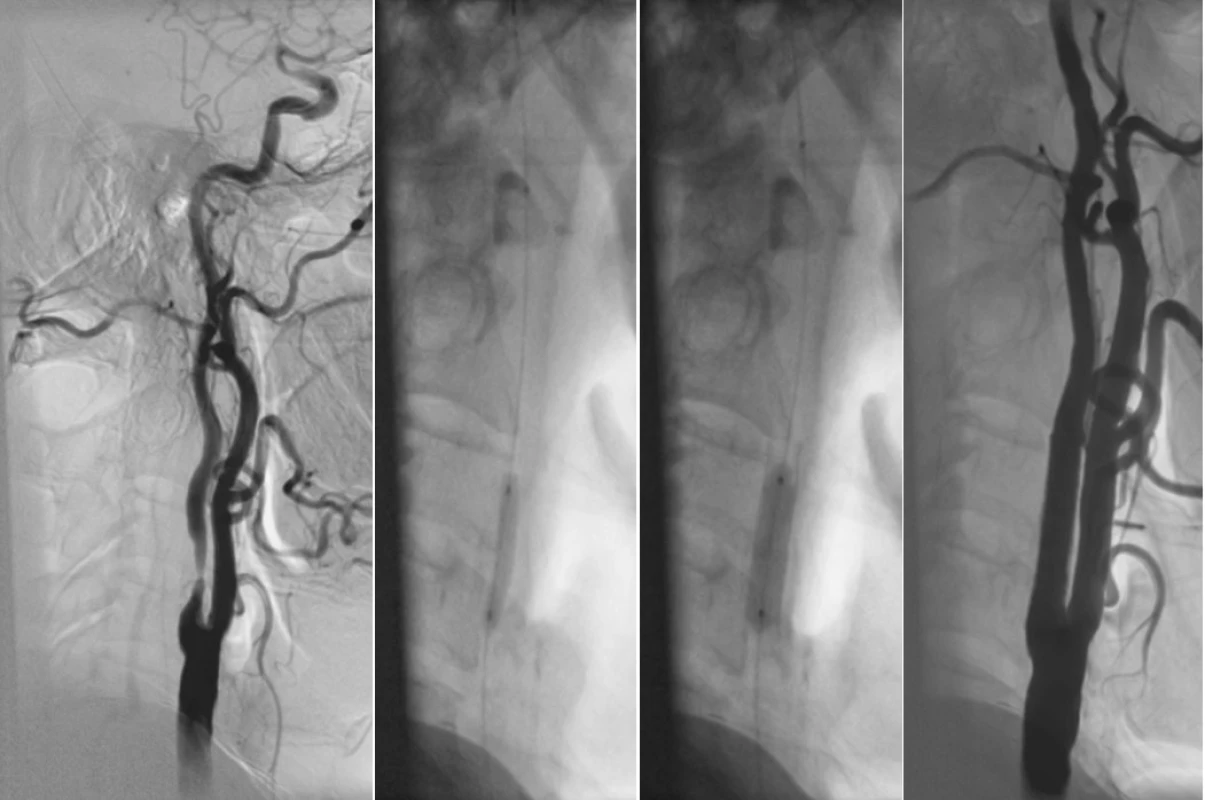
VÝSLEDKY
Technický úspěch endovaskulárního ošetření byl dosažen u 210 z 212 stenóz (99 %). U dvou nemocných se výkon nezdařil pro vinutost karotické tepny s těsnou stenózou, kdy nebylo možno bezpečně a jednoduše proniknout ochranným filtrem přes místo stenózy, proto byl výkon ukončen a nemocní byli ošetřeni chirurgicky. V souvislosti s výkonem bylo zaznamenáno úmrtí jedné nemocné (mortalita 0,49 %). Jednalo se o 72letou ženu, léčenou pro arteriální hypertenzi a dyslipidemii, která 3 roky před výkonem prodělala cévní mozkovou příhodu (CMP) z levého karotického povodí. Zobrazovací vyšetření u nemocné prokázalo uzávěr pravé vnitřní karotické tepny a těsnou stenózu vlevo, k jejímuž ošetření byla indikována. Vlastní intervence proběhla bez komplikací. Za 2 hodiny po výkonu si nemocná začala stěžovat na silnou difuzní bolest hlavy, po dalších 30 minutách byl zjištěn postupný vzestup krevního tlaku, a to až na hodnotu 220/100 mm Hg, který nereagoval na medikamentózní terapii. Přibližně za 3 hodiny od konce výkonu nemocná začala zvracet a po chvíli upadla do hlubokého bezvědomí (Glasgow Coma Scale 3). CT vyšetření mozku prokázalo masivní čtyřkomorový hematocefalus a drobné subarachnoideální krvácení při mozkové bázi, bez průkazu intraparenchymové hemoragie. Vývoj stavu byl nadále nepříznivý a žena 5. den po výkonu zemřela. Následně provedená pitva potvrdila nález z CT vyšetření, zdroj masivního krvácení však nebyl nalezen [31].
Sedm nemocných (3,3 %) prodělalo v souvislosti s výkonem i přes použití protektivního filtru ischemickou CMP. U pěti nemocných (2,39 %) se jednalo o drobnou emboligenní příhodu charakteru tranzitorní ischemické ataky, u jednoho nemocného (0,47 %) byl zaznamenán inzult s manifestací lehké, rychle ustupující pravostranné hemiparézy charakteru „minor stroke“, provedené kontrolní CT vyšetření však neprokázalo mozkový infarkt. U jednoho nemocného (0,47 %) s asymptomatickou stenózou došlo k rozvoji středně těžké cévní mozkové příhody („major stroke“) s přetrvávající levostrannou hemiparézou.
Nejčastější zaznamenanou komplikací byly projevy hemodynamické nestability, které se vyskytly u 32 nemocných (15,7 %). Jednalo se o bradykardii a hypotenzi, které se podařilo kompenzovat do 48 hodin po výkonu. Pouze u jednoho nemocného vedla oběhová nestabilita k těžkému levostrannému srdečnímu selhání, následovanému dalšími komplikacemi (bronchopneumonie, krvácení do trávicího ústrojí), pro které byl pacient dlouhodobě arteficiálně ventilován. Po jejich zvládnutí došlo k úpravě celkového stavu bez klinických či radiologických známek ischemického poškození mozku.
Disekce tepny vnitřní karotidy šířící se kraniálně k bázi byla po PTA a stentu zaznamenána u jedné nemocné, nebyla spojena s neurologickou symptomatikou, byla „zaléčena“ implantací dalšího stentu (Neuroform, Boston Scientific, USA). Výkony v počátečním období do r. 2002 byly relativně často (6,5 %) provázeny komplikací v místě vpichu (krvácení, hematom, pseudoaneruryzma). Krvácení s hematomem muselo být u jednoho nemocného ošetřeno chirurgicky. S přechodem od používání klasického heparinu na nízkomolekulární a zavedením perkutánních šicích technik došlo v pooperačním období ke snížení těchto komplikací na 2,8 %. U jednoho nemocného vzniklo v místě punkce femorální tepny pseudoaneuryzma, které bylo úspěšně ošetřeno kompresí za kontroly USG.
Ve sledovaném souboru došlo tedy k jednomu úmrtí a dvěma případům ischemické CMP na podkladě embolizace do intrakraniálního řečiště, u jednoho nemocného s částečnou a u druhého s úplnou úpravou stavu. Kombinovaný ukazatel mortality a závažné morbidity v našem souboru činí 0,96 %.
U 153 nemocných (73 %), kteří jsou po výkonu více jak 12 měsíců sledovaní spolupracujícím neurologem, jsme restenózu větší jak 60 % zjistili u 7 tepen (3,9 %) v rozmezí 7 měsíců až 4 let po ošetření. Větší část restenóz zůstala během doby sledování asymptomatická, 3 restenózy se manifestovaly TIA. Žádný nemocný v průběhu dlouhodobého sledování neprodělal mozkový infarkt a nezemřel.
DISKUSE
Stenózy karotid způsobené aterosklerózou jsou nejčastější příčinou mozkové ischemie nebo infarktu, v úvahu je nutné brát i nemoci aorty (disekce, aneuryzma, aortitida), arteritidy, fibromuskulární dysplazii, disekce, dolichoektázii, tumory, traumata a emboligenní zdroje ze srdce a aorty. Ačkoliv je ateroskleróza systémové onemocnění, na karotidách se často vyskytuje unifokálně a až 90 % lézí je lokalizováno v rozsahu 2 cm od karotické bifurkace [1]. U stenóz nad 50 % je riziko progrese stenózy při neléčené hypertenzi 9,3 % za rok [2], stupeň stenózy je v souvislosti s rizikem CMP. Ateroskleróza může vést k retinálním nebo hemisferálním příznakům, častější příčinou než hypoperfuze způsobená stenózou je obliterace intrakraniálních tepen embolizacemi z aterosklerotického plátu.
Riziko vzniku CMP je rozdílné u symptomatických a asymptomatických nemocných. Podle studie NASCET [3, 4] je u symptomatických nemocných roční riziko vzniku CMP 11 % (u stenóz 70–79 %), 35 % (u stenóz > 90 %) a dvouleté riziko u stenóz 70–99 % je 26 %. Na-proti tomu u asymptomatických nemocných, podle studií ACAS a ACST [5, 6], je u stenóz do 60 % roční riziko CMP menší než 1 %, u stenóz nad 60 % je riziko 1–2,4 %. U asymptomatických nemocných před aorto-koronárním bypassem se stenózou nad 80 % je perioperační riziko CMP 19 % [7]. Cílem léčby stenóz karotických tepen je prevence vzniku CMP.
Každá invazivní léčba musí prokázat svůj efekt ve srovnání s přirozeným průběhem nemoci nebo konzervativní terapií. Ke konzervativní léčbě jsou podle současných doporučení [8] indikováni nemocní s nízkým rizikem vzniku CMP nebo vysokým rizikem komplikací při revaskularizaci – tzn. asymptomatičtí nemocní se stenózami do 60 % a symptomatičtí se stenózami do 50 %.
Chirurgická endarterektomie je považována za propracovanou metodu léčby symptomatických, hemodynamicky významných stenóz extrakraniálních úseků karotických tepen, jejíž efekt byl prokázán řadou randomizovaných studií [3, 4, 5, 6, 9]. Nesporný je i dobrý dlouhotrvající efekt KAE – restenózy větší než 50 % se objeví méně jak u 5 % nemocných během 1 roku po výkonu, z toho až 95 % restenóz je asymptomatických. U těchto studií je kritizováno, že nemocní i operatéři byli selektováni, nebyla dostupná dnes kvalitní konzervativní terapie (absence statinů, ACE inhibitorů) [10]. Standardní praxe po endarterektomii nezahrnuje rutinní vyšetření nemocného neurologem. Ve velké metaanalýze 16 000 symptomatických nemocných po endarterektomii bylo hodnoceno 30denní riziko CMP a smrti: při hodnocení neurologem byly komplikace zaznamenány v 7,7 %, při provádění operatérem ve 2,3 % [11]. Je prokázáno, že KAE má oproti konzervativnímu postupu vyšší efekt, jedná-li se o symptomatickou stenózu 70 % a více a riziko perioperačních komplikací je nižší než 6 %. U stenóz asymptomatických je tato léčba opodstatněná, jedná-li se o zúžení 80 % a více a rizika operace jsou nižší než 3 % [3].
Indikace PTAS. Endovaskulární léčba je v současnosti indikována u nemocných rizikových ke KAE se symptomatickou stenózou větší než 50 % nebo asymptomatickou stenózou větší než 80 % [8, 12]. V současnosti je zatím nedostatek dat, která byl podporovala indikace k PTAS u rizikových asymptomatických nemocných se stenózou menší než 80 % a u všech nemocných bez zvýšeného rizika ke KAE.
Výhodou endovaskulárního řešení je miniinvazivita zákroku bez nutnosti chirurgického přístupu a celkové nebo svodné anestezie, celkově kratší doba hospitalizace i rekonvalescence. Nevýhodou naproti tomu je finanční náročnost výkonu, obtížná standardizace postupů při rychlém vývoji instrumentária (které se neustále zdokonaluje) a zejména absence dlouhodobých výsledků léčby, které by umožnily její spolehlivější porovnání s jinými metodami. Existují indikace, u kterých je endovaskulární léčba stenóz vnitřní karotické tepny pro nemocné výhodnější a méně riziková než endarterektomie. Při uzávěru druhostranné karotidy u pacientů s insuficientním Willisovým okruhem je riziko ošetření pomocí PTAS a zavedení stentu nižší než u KAE [13]. Již při postižení kontralaterální karotidy je přitom uváděno až trojnásobně vyšší riziko vzniku komplikace při endarterektomii, zatímco při endovaskulárním ošetření se míra rizika komplikací nemění [14]. Rovněž pacienti s významnou komorbiditou, zejména na podkladě ischemické choroby srdeční, kteří jsou kontraindikováni k chirurgickému řešení, mohou být ošetřeni endovaskulárně. Příznivých výsledků dosahuje endovaskulární léčba také u nemocných s restenózami po karotické endarterektomii [15, 16] či u nemocných s neaterosklerotickými lézemi, ať už na podkladě fibromuskulární dysplazie [17] nebo postiradiačních změn ve stěně tepny. Z indikací technického charakteru je PTAS metodou volby u stenóz tepen aortálního oblouku [18] a vysoko uložených stenóz a. carotis interna, u nichž je chirurgické řešení nesnadné. Možnosti zvýšeného rizika chirurgické léčby, formulované na základě konsenzu AHA expertů v roce 1998 [19] a podpořené ACCF/SCAI/-SVMB/SIR/ASITN Clinical Expert Consensus Document z roku 2007, shrnuje tabulka 2.
2. Rizikoví nemocní pro KAE (AHA, 1998) Tab. 2. KAE risk patients (AHA, 1998) 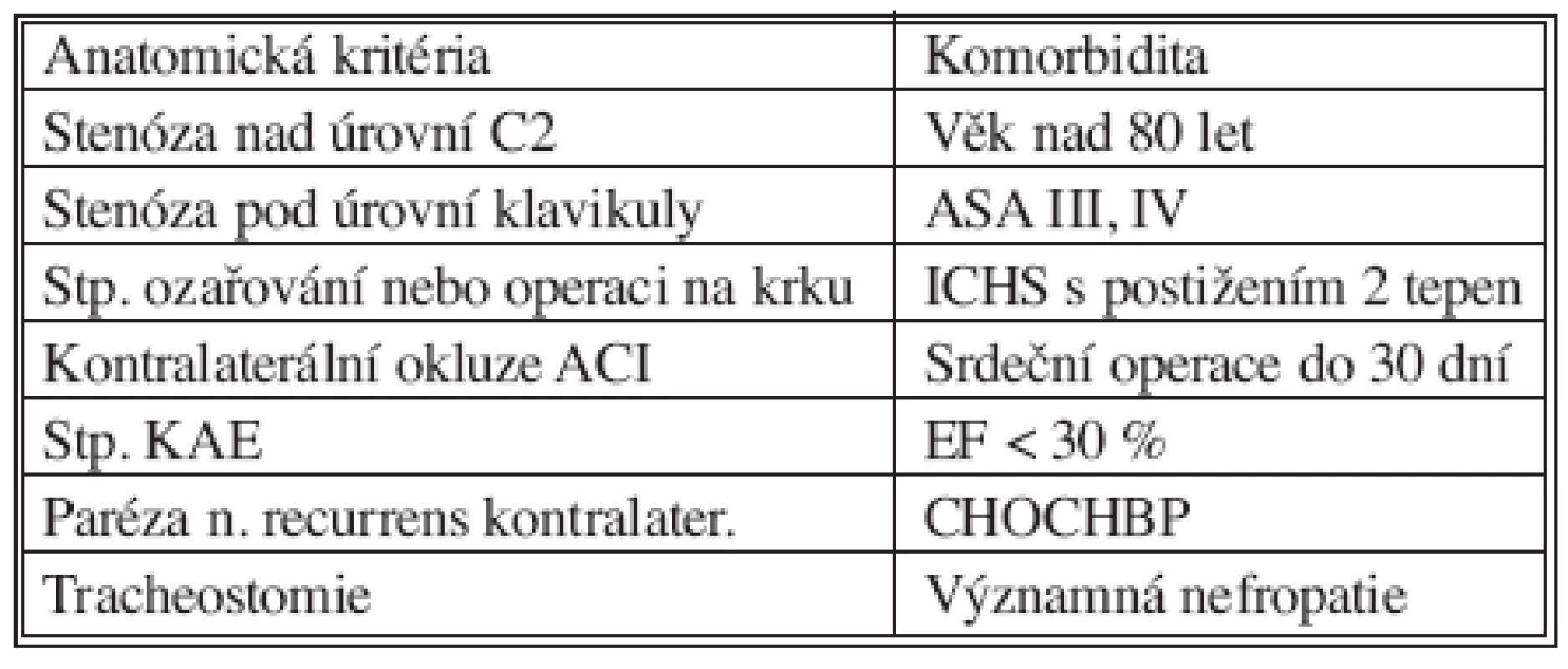
Cerebrální protekce, stenty. Ačkoliv neexistují randomizované studie srovnávající výsledky endovaskulární léčby stenóz karotických tepen pomocí PTAS s cerebrální protekcí a bez ní, je na základě metaanalýzy prokázáno, že zavedení filtrů zlepšilo výsledky PTAS [20]. V současné době, při rychlém vývoji instrumentária, existuje široký sortiment dostupného protekčního zařízení zahrnující okluzní balonky, nebo častěji používané filtry. Při balonkové okluzi (proximální nebo distální) je nezbytností tolerance dočasné zástavy toku v karotické tepně. Filtry umožňují kontinuální zachování toku a karotické tepně, liší se velikostí pórů, typem fixace k vodiči a stupněm symetričnosti. Obdobně u stentů je celá řada specifikací (nitinolové, ocelové, rovné, kónické, balon-expandibilní, samoexpandibilní...). Základní odlišení je v typu konstrukce, kde stenty s ne zcela spojenými oky (open cell stents) jsou dostatečně flexibilní na úkor rizika protruze části plátu mezi oky stentu, na druhé straně stenty s celistvě propojenými oky jsou rigidnější, ale s lepší schopností přitlačení sklerotického plátu do stěny cévy. Podle některých autorů [21] je lepších výsledků (méně emboligenních komplikací) dosahováno u stentů s uzavřenými buňkami v kombinaci s excentrickým typem filtru umožňujícím lepší adaptabilitu filtru ke stěně tepny.
Kontraindikace PTAS. Endovaskulární léčba (obdobně jako KAE) není indikována u nemocných s velkým funkčním deficitem, nebo po dokončené CMP v období do 4 týdnů. Na našem pracovišti indikujeme PTAS až po 6 týdnech po proběhlé CMP. Hlavní limitací výkonu bývají anatomické predispozice, zejména vinuté přístupové tepny, významná tortuozita karotických tepen, cirkulární kalcifikace, viditelný trombus v místě stenózy a dlouhá významná stenóza se zpomaleným tokem v karotické tepně (string sign).
Výsledky PTAS, komplikace. Na základě registru [22] z 53 pracovišť z let 1997–2002 zahrnující 12 392 PTAS u 11 243 nemocných bylo dosaženo technického úspěchu v 98,9 % výkonů, 30denní komplikace typu TIA ve 3,1 %, CMP typu „minor stroke“ ve 2,1 %, „major stroke“ 1,2 %, smrt 0,6 %, CMP a smrt ve 4,7 %. Ve studii CAVATAS [23], kde pouze 22 % nemocných dostalo po PTA stent, se po jednom roce vyskytly restenózy větší než 70 % po PTAS u 18,5 % nemocných, po KAE u 5,2 %. V sériích, kde jsou stenty po PTA používány rutinně, se počet restenóz pohybuje v rozmezí 3–5 % [8]. Predisponujícím faktorem pro vznik restenóz jsou stavy po ozařování na krku (20 %), po KAE (10,5 %) a kombinace obou rizik (22 %) [25]. Všeobecný výskyt komplikací deklarovaný klinickým konsenzem [8] shrnuje tabulka (Tab. 3).
3. Komplikace PTAS. ACCF/SCAI/SVMB/SIR/ASITN Tab. 3. PTAS complications. ACCF/SCAI/SVMB/SIR/ASITN Clinical Expert Consensus Document 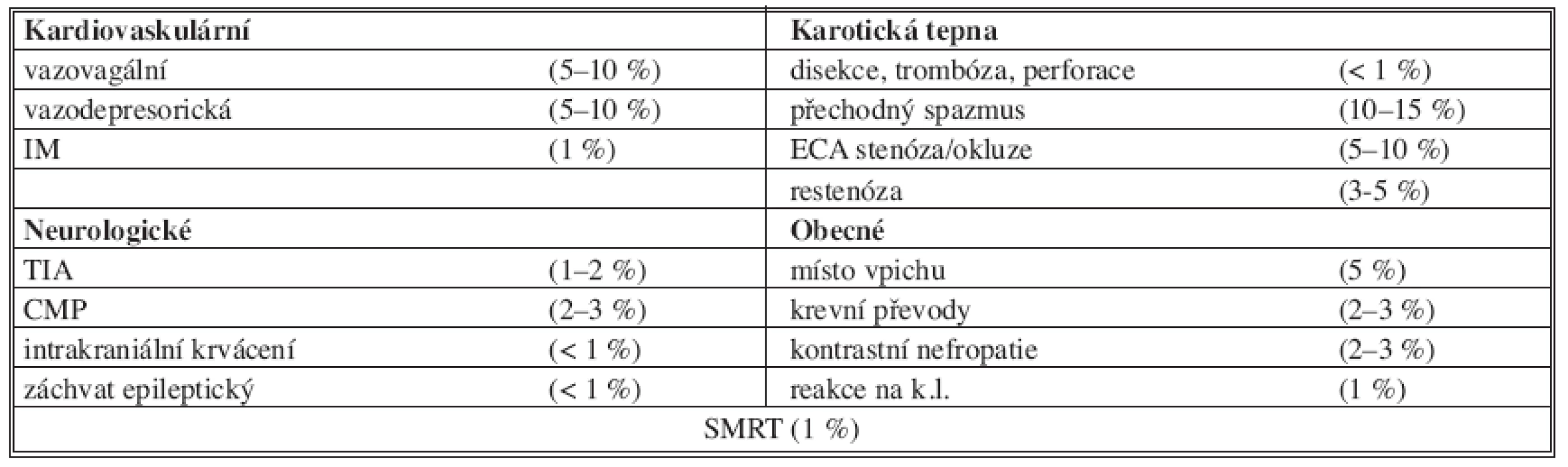
Srovnávací studie KAE – PTAS. Literární dostupnost více než 30 studií a registrů a pokračující průběh pěti randomizovaných studií naznačují, že očekávané dosažení lepších výsledků PTAS ve srovnání s KAE zůstává nadále v očekávání (Tab. 4). Metaanalýzou celkem pěti randomizovaných studií zabývajících se porovnáním karotické endarterektomie a endovaskulární léčby stenóz karotických tepen bylo zjištěno, že není statisticky významný rozdíl mezi chirurgickou a endovaskulární léčbou v rámci závažných periprocedurálních komplikací a komplikace méně významné favorizují endovaskulární řešení. Chybí však stále dlouhodobé výsledky efektivity endovaskulární léčby [26]. Předčasně ukončená studie SAPPHIRE (Stenting and Angioplasty with Protection in Patients at High-Risc for Endarterectomy) [27, 28] je jedinou klinickou multicentrickou prospektivní randomizovanou studií porovnávajícívysoce rizikové nemocné (tj. věk nad 80 let, uzávěr druhostranné karotické tepny, stp. KAE nebo ozařování na krku, významné srdeční nebo plicní onemocnění) mezi KAE a PTAS s použitím cerebrální protekce. Třicetidenní incidence CMP, infarktu myokardu a smrti byla 4,8 % po PTAS a 9,8 % po KAE. Hlavní sledovaný cíl studie (souhrn významné CMP, infarktu myokardu a smrti do 1 roku) byl 12,2 % u PTAS a 20,1 % u KAE - prokázal, že PTAS není horší než KAE, ale neprokázal, že je lepší. Při vynechání infarktu myokardu ze souhrnných komplikací jsou výsledky srovnatelné. Rovněž tříletá incidence CMP po výkonu byla v obou skupinách obdobná. Ve studii SPACE [29, 30], zahrnující symptomatické nemocné se stenózami většími než 50 %, nebyl v souhrnu ipsilaterálních CMP a smrti ve 30 dnech zaznamenán významný rozdíl (6,3 % po KAE, 6,8 % po PTAS). Ve francouzské randomizované studii EVA-3S, srovnávající nemocné se symptomatickými stenózami více než 70 %, se CMP a smrt ve 30 dnech vyskytly statisticky významně méně ve skupině po KAE (3,9 % vs. 9,6 %). Periprocedurální komplikace v endovaskulárně léčené skupině jsou neadekvátně vysoké, lze je vysvětlit tím, že cerebrální protekce byla použita pouze u 92 % nemocných a část operatérů měla nedostatečné zkušenosti s PTAS, nesplňující limity doporučené klinickým konsenzem [8].
4. Randomizované (poslední 2 řádky nerandomizované) studie srovnávací výsledky PTAS a KAE Tab. 4. Randomized (the last two lines include non-randomized) studies comparing PTAS and KAE results 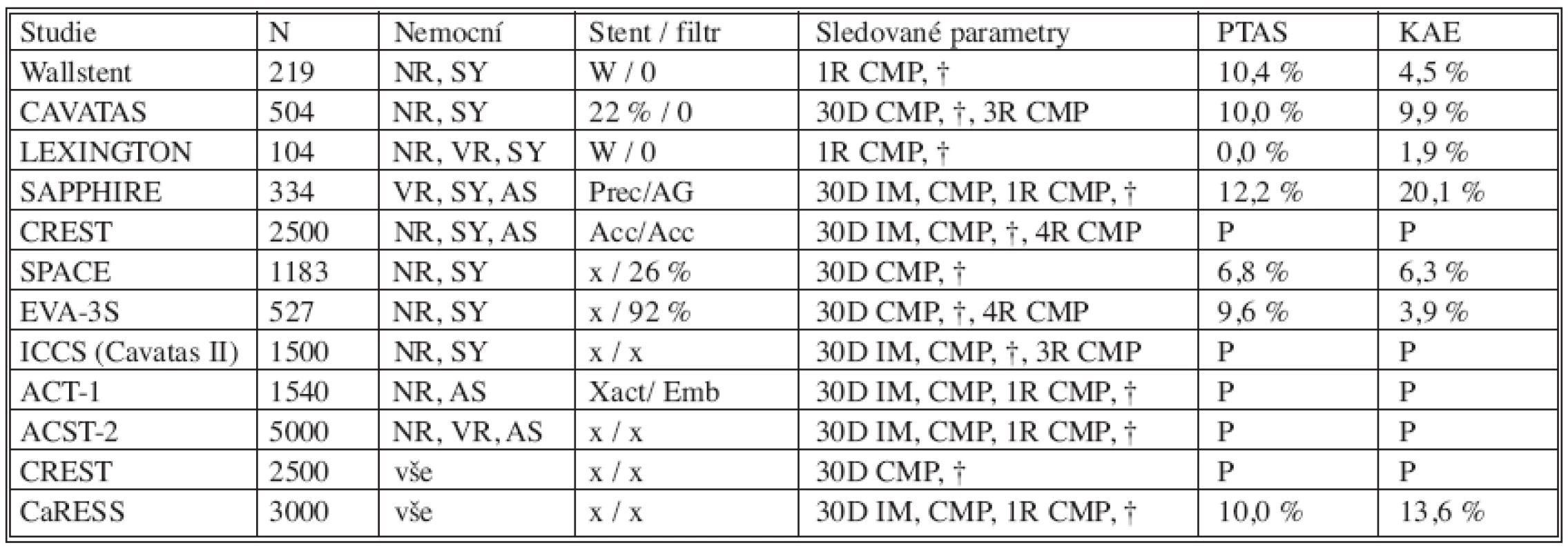
N – počet nemocných, NR – nízké riziko, VR – vysoké riziko, AS – asymptomatický, SY – symptomatický, W – Wallstent, Prec – Precise stent, AG – Angioguard, Acc – Acculink/Accunet, x – není limitováno, Emb – Emboshield filtr, IM – infarkt myokardu, CMP – cévní mozková příhoda, † – smrt, P – probíhající studie. N – number of patients, NR – low risk, VR – high risk, AS – asymptomatic, SY – symptomatic, W – Wallstent, Prec – Precise stent, AG – Angioguard, Acc – Acculink/Accunet, x – not limited, Emb – Emboshield filter, IM – myocardial infarction, CMP – stroke, † – death, P – ongoing study Výsledky léčby u našich nemocných – počty výkonů za rok, technická úspěšnost, periprocedurální komplikace [31], indikační kritéria [32] a nezávislý neurologický audit jsou v souladu s výsledky velkých studií a registrů a doporučeními odborných společností.
ZÁVĚR
- Používání cerebrální protekce zlepšilo výsledky PTAS, na tomto zlepšení se kromě protektivních filtrů podílí i dnes již standardně podávaná duální antiagregační léčba.
- PTAS by se měla provádět pouze v centrech nebo v rámci studií a registrů – doporučeno Pracovní skupinou intervenční neuroradiologie (PSINR), stanovený limit v České republice pro centra je 100 všech neurointervenčních výkonů/rok.
- Žádná studie neprokázala, že PTAS má lepší výsledky než KAE.
- Výsledky PTAS jsou srovnatelné s KAE.
- PTAS je indikována pouze u rizikových nemocných se symptomatickou stenózou větší než 50 % nebo asymptomatickou stenózou nad 80 %.
- V současnosti není dostatek dat pro podporu PTAS u vysoce rizikových nemocných s asymptomatickými stenózami do 80 % a u všech nemocných s nízkým rizikem KAE
- Je nutnost dalších studií srovnávajících PTAS a KAE u málo rizikových nemocných a studií srovnávajících PTAS a konzervativní léčbu u symptomatických nemocných s vysokým rizikem pro KAE.
MUDr. M. Lojík
Radiologická klinika FN
Sokolská 581
500 05 Hradec Králové
Sources
1. Mohr, J. P., Gautier, J. Internal carotid artery disease. In: Mohr, J. P., editor. Stroke_ Pathophysiology, diagnosis, and management. Philadelphia, P. A.: Churchill Livingstone, 2004, s. 75–200.
2. Muluk, S. C., Muluk, V. S., Sugimoto, H., et al. Progression of asymptomatic carotid stenosis: a natural history study in 1004 patient. J. Vasc. Surg, 1999, roč. 29, s. 208–214.
3. North American Symptomatic Carotid Endarterectomy Trial Collaborators: Beneficial effect of carotid endarterectomy in symptomatic patients with high grade carotid stenosis. N. Engl. J. Med., 1991, roč. 325, s. 445–453.
4. Barnett, H. J., Taylor, D. W., Eliasziw, M., et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N. Engl. J. Med., 1998, roč. 339, s. 1415–1425.
5. Executive Committee for the Asymptomatic Carotid Atherosclerosis Study. Endarterectomy for asymptomatic carotid artery stenosis. JAMA, 1995, roč. 273, s. 1421–1428.
6. Halliday, A., Mansfield, A., Marro, J., et al. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet, 2004, roč. 363, s. 1491–1502.
7. Eagle, K. A., Guyton, R. A., Davidoff, R., et al. ACC/AHA 2004 guideline update for coronary artery bypass graft surgery. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1999 Guidelines for Coronary Artery Bypass Graft Surgery) Available at: http://www.cardiosource.com/guidelines/browse.asp?-topicID=7.
8. Bates, E. R., Babb, J. D., Casey, D. E. Jr., Cates, C. U., Duckwiller, G. R., Feldman, T. E., Gray, W. A., Ouriel, K., Peterson, E. D., Rosenfield, K., Rundback, J. H., Safian, R. D., Sloan, M. A., White, C. J., American College of Cardiology Foundation Task Force, American Society on Interventional Therapeutic Neuroradiology, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society for Interventional Radiology. ACCF/SCAI/SVMB/SIR, ASITN 2007 clinical expert consensus document on carotid stenting. J. Am. Coll. Cardiol., 2007, roč. 49, č. 1, s. 126–170.
9. Rothwell, P. M., Warlow, C. P., on behalf of the European Carotid Surgery Trialists‘ Collaborative Group Low risk of ischemic stroke in patients with reduced internal carotid artery lumen diameter distal to severe symptomatic carotid stenosis: cerebral protection due to low poststenotic flow? Stroke, 2000, roč. 31, s. 622–630.
10. Chaturvedi, S. Should the multicenter carotid endarterectomy trials be repeated? Arch. Neurol., 2003, roč. 60, s. 774–775.
11. Rothwell, P. M., Slattery, J., Warlow, C. P. A systematic review of the risks of stroke and death due to endarterectomy for symptomatic carotid stenosis. Stroke, 1996, roč. 27, s. 260–265.
12. Roubin, G. S., Iyer, S., Halkin, A., Vitek, J., Brennan, C. Realizing the potential of carotid artery stenting proposed paradigms for patient selection and procedural technique. Circulation, 2006, roč. 113, s. 2021–2030.
13. Babatasi, G., Massetti, M., Theron, J., Khayat, A. Asymptomatic Carotid Stenosis in Patients Undergoing Major Surgery: Can Percutaneous Carotid Angioplasty be an Alternative? European Journal of Cardio-Thoracic Surgery, 1997, roč. 11, s. 547–553.
14. Yadav, J. S., Roubin, G. S., Iyer, S., et al. Elective Stenting of the External Carotid Arteries. Circulation, 1997, roč. 95, s. 376–381.
15. Yadav, J. S., Roubin, G. S., King, P., Iyer, S., Vitek, J. J. Angioplasty nad Stenting for Restenosis after Carotid Endarterectomy. Stroke, 1996, roč. 27, s. 1733–1740.
16. Becker, G. J. Should Metallic Vascular Stent Be Used to Treat Cerebrovascular Occlusive Diseases? Radiology, 1994, roč. 191, s. 309–312.
17. Belán, A., Veselá, M., Vaněk, I., Weiss, K., Peregrin, J. H.Percutaneous Transluminal Angioplasty of Fibromuscular Dysplasia of the Internal Carotid Artery. Cardiovasc. Intervent. Radiol., 1982, roč. 5, s. 79–81.
18. Laloux, P., Richelle, F., Meurice, H., De Coster, P. Cerebral Blood Flow and Perfusion Reserve Capacity in Hemodynamic Carotid Transient Attacks Due to Innominate Artery Stenosis. J. Nucl. Med., 1995, roč. 36, s. 1268–1271.
19. Biller, J., Feinberg, W. M., Castaldo, J. E., et al. Guidelines for carotid endarterectomy: a statement for healthcare professionals from a Splecial Writing Group of the Stroke Council, American Heart Association. Circulation, 1998, roč. 97, s. 501–509.
20. Kastrup, A, Groschel, K., Krapf, H., et al. Early outcome of carotid angioplasty and stenting with and without cerebral protection devices: a systematic review of the literature. Stroke, 2003, roč. 34, s. 813–819.
21. Hart, J. P., Peeters, P., Verbist, J., Deloose, K., Bosiers, M. Do device characteristics impact outcome in carotid artery stenting? J. Vasc. Surg., 2006, roč. 44, s. 725–730.
22. Wholey, M. H., Al-Mubarek, N., Wholey, M. H. Updated review of the global carotid artery stent registry. Catheter Cardiovasc. Interv., 2003, roč. 60, s. 259–266.
23. CAVATAS Investigators: Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial. Lancet, 2001, roč. 357, s. 1729–1737.
24. McCabe, D. J. H., Pereira, A. C., Clinton, A., Bland J. M., Brown, M. M., on behalf of the CAVATAS Investigators Restenosis After Carotid Angioplastyy, Stenting, or Endarterectomy in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS). Stroke, 2005, roč. 36, s. 281–293.
25. Younis, G. A., Gupta, K., Mortazavi, A., Strickman, N. E. Predictors of Carotid Stent Restenosis. Catheter Cardiovasc. Interv., 2007, roč 69, s. 673–682.
26. Coward, L. J., Featherstone, R. L., Brown, M. M. Safety and Efficacy of Endovascular Treatment of Carotid Artery Stenosis Compared With Carotid Endarterectomy. A Cochrane Systematic Review of the Randomised Evidence. Stroke, 2005, roč. 36, s. 905–911.
27. Yadav, J. S., Wholey, M. H., Kuntz, R. E., Fayad, P., et al. Protected Carotid–Artery Stenting versus Endarterectomy in high Risk-Patients. N. Engl. J. Med., 2004, roč. 351, č. 15, s. 1493–1501.
28. Yadav, J. S., Sneed, D., Ouriel, K., et al. Durability of carotid stenting for the prevention of stroke: 3-year follow-up of the SAPPHIRE trial and the US Carotid Feasibility (abstr). Circulation, 2005, roč. 112, suppl: II-416.
29. Ringleb, P. A., Kunze, A., Allenberg, J. R., et al. The stent-supported percutaneous angioplasty of the carotid artery vs. endarterectomy trial. Cerebrovasc. Dis., 2004, roč. 18, s. 66–68.
30. Ringleb, P. A., Allenberg, J. R., Bruckmann, H., et al. 30 day resuls from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet, 2006, roč. 368, s. 1215–1216.
31. Krajíčková, D., Krajina, A., Nová, M., Raupach, J. Fatal intraventricular hemorrhage after the extracranial carotid artery angioplasty and stent placement. Cardiovasc. Intervent. Radiol., 2005, roč. 28(4), s. 502–505.
32. Krajíčková, D., Krajina, A., Lojík, M., Jakubcová, O. Naše zkušenosti s angioplastikami mozkových tepen. Čes. a slov. Neurol. Neurochir., 2005, roč. 68/101, s. 241–250.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2007 Issue 10-
All articles in this issue
- Interdisciplinary Approach to Treatment of Multiple Arterial Aneurysms in Patient with Eighth Recurrence of Incisional Hernia – A Case Report
- Endovascular Treatment of Carotid Artery Stenosis with Cerebral Protection: 5-year Experience
- Treatment of Vascular Prosthesis Infection and Aorto-enteric Fistula as a Late Complication after Reconstructive Surgery of the Abdominal Aorta – A Case Report
- Biliary Ileus – A Rare Complication of Cholecystolithiasis
- The Role of Interstitial Brachytherapy in Multimodality Management of Solid Tumors
- Surgical Treatment of Breast Cancer in the Masaryk Memorial Cancer Institute
- Tumorous Stem Cells – A Novel View in Oncology?
- New Treatment Approach in Liver Metastates: Hand- Assisted Laparoscopic Radiofrequency Liver Resection
- Autofluorescence Videothoracoscopy – Our Initial Experience
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Biliary Ileus – A Rare Complication of Cholecystolithiasis
- Surgical Treatment of Breast Cancer in the Masaryk Memorial Cancer Institute
- Endovascular Treatment of Carotid Artery Stenosis with Cerebral Protection: 5-year Experience
- Tumorous Stem Cells – A Novel View in Oncology?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

