-
Medical journals
- Career
Sinonazální teratokarcinosarkom
Authors: Maléřová S. 1; A. Kešner 1,2; V. Kratochvíl 1,3; D. Kalfeřt 1; J. Plzák 1
Authors‘ workplace: Klinika otorinolaryngologie a chirurgie hlavy a krku, 1. LF UK a FN v Motole, Praha 1; ORL a chirurgie hlavy a krku, Nemocnice Rudolfa a Stefanie Benešov, a. s. 2; ORL Tererova s. r. o., Praha 3
Published in: Otorinolaryngol Foniatr, 71, 2022, No. 2, pp. 82-85.
Category: Case Reports
doi: https://doi.org/10.48095/ccorl202282Overview
Sinonazální teratokarcinosarkom je vzácný a lokálně agresivní maligní nádor nosu a vedlejších nosních dutin, který má histologické rysy teratomu a karcinosarkomu. Častěji se vyskytuje u mužů, bez jednoznačné věkové predilekce a často lokálně recidivuje. Vzhledem k raritnímu výskytu není definován přesný terapeutický postup. V našem případě popisujeme výskyt a terapeutický postup u sinonazálního teratokarcinosarkomu 56letého muže, který postihl levou nosní dutinu. Diskutována je symptomatologie, diagnostika a terapie tohoto vzácného nádoru.
Klíčová slova:
sinonazální teratokarcinosarkom – protonová terapie – nádory nosu a paranazálních nosních dutin
Úvod
Sinonazální teratokarcinosarkom (SNTCS) je extrémně vzácný maligní nádor nejisté histogeneze. Shanmugaratnamem et al. ho poprvé popsali v roce 1983 jako teratoidkarcinosarkom [1], ale termín teratokarcinosarkom poprvé použili v roce 1984 Heffner a Hyams [2]. Jedná se o maligní, místně agresivní nádor s vysokou mírou recidivy a s velmi nepříznivou prognózou s průměrnou dobou přežití méně než 2 roky [3, 4]. Téměř všechny případy jsou popisovány u dospělých s významnou převahou mužů. Histopatologicky jde o zhoubný novotvar, který má kombinované rysy teratomu a karcinosarkomu pocházející z embryonální buněčné linie. Fenotypicky se SNTCS skládá z benigních neurálních prvků s různým zastoupením maligní epiteliální složky a dvou nebo více maligních mezenchymálních složek, jako jsou fibroblasty, chrupavka, kost nebo hladké svalstvo. Histologická heterogenita je důvodem četných diagnostických chyb, zejména při menším množství odebraného materiálu při biopsii [5]. Klinicky se projevuje nejčastěji jednostrannou nosní obstrukcí, recidivující epistaxí, bolestí hlavy nebo poruchou vizu [6].
Vlastní kazuistika
Šestapadesátiletý muž s přibližně 3–4 měsíce trvajícími obtížemi charakteru rýmy a jednostranné zhoršené nosní průchodnosti byl odeslán ambulantním otorinolaryngologem k histologické verifikaci tumoru levé nosní dutiny. Pacient se léčil s arteriální hypertenzí a diabetem 2. typu na kombinované léčbě (inzulin s perorálními antidiabetiky). V anamnéze udával abúzus cigaret (přibližně 10 cigaret za den). Při klinickém vyšetření byla po anemizaci patrná tumorózní masa ve středním průchodu, vyrůstající nejspíše ze zadních etmoidů, bez prorůstání kontralaterálně. Na předoperační počítačové tomografii (CT) a magnetické rezonanci (MR) byla jasně viditelná tumorózní masa levé nosní dutiny, etmoidů a klínové dutiny velikosti 3 x 2,5 x 1 cm bez infiltrace okolních vedlejších dutin nosních nebo očnice. Na jednom místě nádor kraniálně infiltroval přední rinobazi (obr. 1, 2). Předoperační histologie byla bez průkazu nádorové infiltrace. V únoru 2018 byla provedena endonazální resekce tumoru dutiny nosní s plastikou rinobáze temporální fascií. Nádor postihoval na levé straně přední a zadní etmoidy a klínovou dutinu, bez infiltrace dura mater. Peroperační histologie vyslovila podezření na adenokarcinom. V definitivní histologii byl popsán kompozitní tumor s vysokou celularitou, evidentní karcinom tvořený nezralými buňkami s místy nepravidelných solidních ostrůvků, s tubulární formací a apikální hlenotvorbou. Bylo popisováno sarkomové nádorové stroma. Analýzou imunohistochemického profilu nádoru byla pozitivita CD56, fokální minoritní pozitivita chromograninu a synaptofyzinu, fokální pozitivita CD99 a NB84, Ki67 s vysokou proliferaci kolem 80–90 %. Tento kompozitní tumor byl řešen také v rámci patologického ústavního semináře s definitivní diagnózou sinonazální teratokarcinosarkom, okrajové excize byly negativní.
Image 1. Předoperační CT VND, koronární projekce.
Hvězdička – nádor, šipka – místo kostní eroze rinobáze.
Fig. 1. Preoperative CT VND, coronary projection.
Star – tumour, arrow – site of rhinobase bone erosion.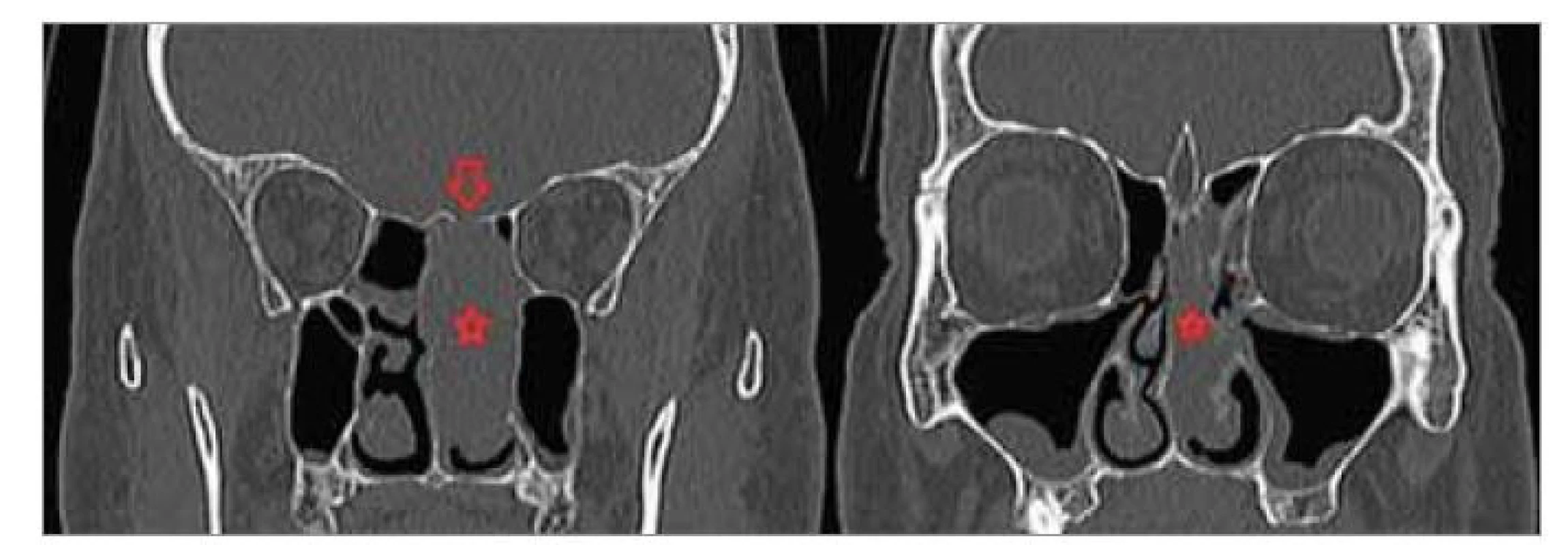
Image 2. Předoperační MR hlavy a VND (koronární projekce, T2 vážený obraz).
Hvězdička – nádor.
Fig. 2. Preoperative MR heads and VND (coronary projection, T2 weighted image).
Star – tumour.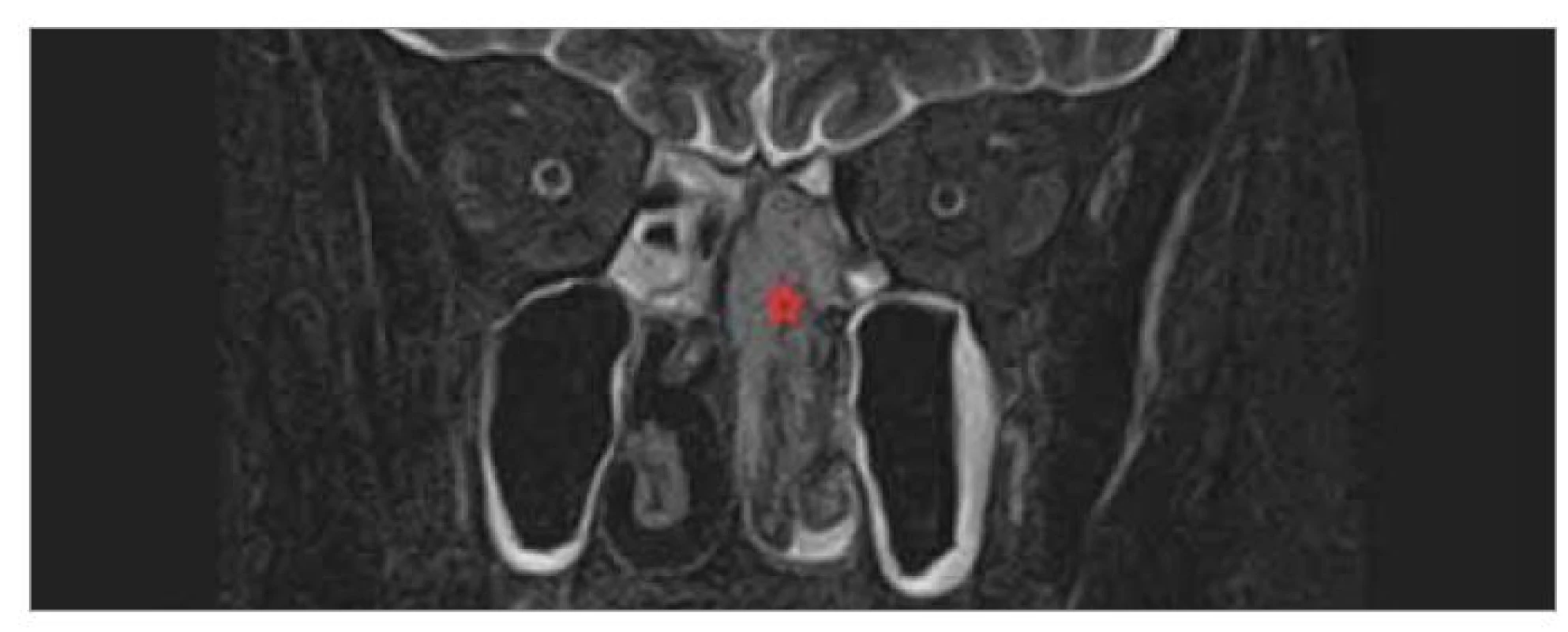
Pacient byl prezentován na multidisciplinárním semináři a po domluvě s onkologem vzhledem k vysokému riziku vzdálené diseminace byla indikována adjuvantní chemoradioterapie (radioterapie pomoci protonů s následnou chemoterapií). Na plánovacím PET/CT popsán nejasný nález v oblasti předních a zadních etmoidů vlevo. Endoskopicky v oblasti původního sfenoetmoidálního recesu, respektive přední stěny klínové, byla přítomná polypoidně změněná křehká sliznice, ze které byla odebrána probatorní excize. Histologicky se prokázala perzistence nádoru. Nález byl poté znovu prezentován na multidisciplinárním semináři s doporučením zahájit onkologickou léčbu. V období duben–červen 2018 probíhala radioterapie protony ve 2 fázích (1. fáze na oblast vedlejších dutin nosních a krčních lymfatických uzlin v počtu 25 frakcí po 2 Gy; 2. fáze na oblast vedlejších dutin nosních a lymfatických uzlin v počtu 10 frakcí po 2 Gy; celková dávka 70 Gy). Poradiačně byly přítomné jen minimální kožní a slizniční reakce. Následně byla zahájena chemoterapie, která probíhala od července do října 2018. Celkově byly podány 4 cykly kombinovaného chemoterapeutika EP (kombinace etoposidu a cisplatiny). Kontrolní MR byla bez známek recidivy původního onemocnění. Kontrolní CT hrudníku a břicha bylo také bez patologie. Pacient je dispenzarizován každé 2–3 měsíce v rinologické poradně kliniky a onkologem. Při zatím poslední kontrole, 26 měsíců od ukončené léčby, je pacient bez známek původního onemocnění (obr. 3).
Image 3. Kontrolní MR hlavy a VND (koronární projekce, T2 vážený obraz) za 24 měsíců po léčbě, bez známek recidivy nádoru.
Fig. 3. Control MR head and VND (coronary projection, T2 weighted image) 24 months after treatment, no signs of tumour recurrence.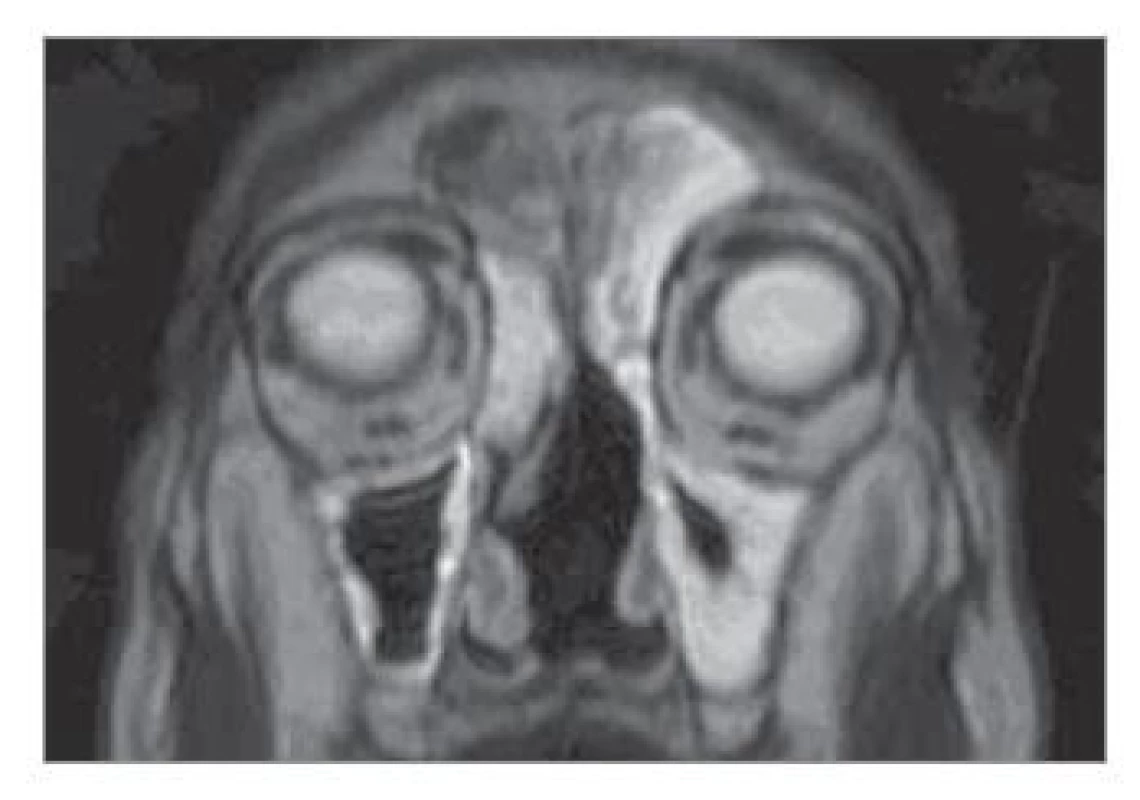
Diskuze
Sinonazální teratokarcinosarkom je vysoce agresivní a vzácný maligní nádor. Předpokládá se, že SNTCS pochází z pluripotentních čichových epiteliálních buněk v nosní dutině. Většina autorů se přiklání k tomu, že pluripotentní progenitorová buňka se schopnostmi různé diferenciace je nejpravděpodobnější příčinou heterogenity tkáně [7, 8].
Morfologicky jsou tyto nádory objemné a načervenalé drobivé hmoty. Mikroskopicky jde o rozmanitý typ tkáně s kombinací epiteliálních, mezenchymálních a neuroektodermálních složek s různým stupněm zralosti [7, 9]. Mezi epitelové komponenty patří benigní a maligní skvamózní, glandulární epitel a fetální skvamózní epitel, který je přítomen u 50–75 % případů [9]. Mezenchymální složky mohou být tvořeny benigními nebo maligními fibromyxoidy, chondroidy, osteoidy nebo myoidy. Jeden z nejčastějších mezenchymálních prvků je rabdomyoblast. Neuroektodermální složka je tvořena formací neurálních rozet s nebo bez fibrilárního pozadí [7, 9]. Tyto nádory postrádají znaky embryonálního karcinomu, choriosarkomu a seminomu [10]. Také je zde popisována absence amplifikace 12p, která je často asociována s nádory zárodečných buněk [11]. Tyto vlastnosti odlišují SNTCS od jiných maligních nádorů zárodečných buněk.
Při analýze somatických mutací byla nalezena mutace v genu PIK3CA a změna v genu DDR2, jehož onkogenní funkce je doposud neznámá [12].
Části nediferencované komponenty vykazují imunohistochemickou pozitivitu cytokeratinu, epitelového membránového antigenu (EMA) a synaptofyzinu v epiteliální složce a pozitivitu CD-99, neuron specifické enolázy (NSE), chromograninu, synaptopyzinu a S-100 proteinu v primitivním neuroepitelu. Mezenchymální složky mají pozitivitu na vimentin a mohou být reaktivní na myogenní markery nebo aktin hladkého svalstva [13]. Tato kombinace je považována za základ pro diagnózu sinonazálního teratokarcinosarkomu. V našem popisovaném případu byla také pozitivita cytokeratinů, EMA, synaptofyzinu, CD-99, chromatograninu, synaptofyzinu vimentinu a aktinu hladkého svalstva.
Je pak logické, že nedostatečný odběr vzorků může vést k nesprávné diagnóze, zejména v důsledku vzácné povahy nádoru [14]. Z 20 případů přezkoumaných Heffnerem a Hyamsem bylo primárně mnoho SNTSC chybně označeno jako adenokarcinom, estezioneuroblastom, rabdomyosarkom a fibrosarkom [2]. Pouze 49,4 % SNTCS je identifikováno prvotní histologií, přičemž nejčastější chybnou diagnózou je estezioneuroblastom [5]. V našem případě první odebraná biopsie zhoubný nádor neprokázala.
Jedná se o vzácný nádor s méně než 100 případů popsaných v literatuře [15, 16]. Nachází se většinou u dospělých, přičemž byly publikovány pouze 3 případy u dětí [17]. Tento nádor má silnou mužskou predilekci (7 : 1) [5, 17, 18]. Není jednoznačná věková predilekce, průměrný věk pacientů byl v největší přehledové publikaci 54,5 roku (rozmezí 0,1–85 let) [5, 19]. Nejčastěji se nachází v nosní dutině (72,1 %), dále v etmoidech (53,4 %) a v oblasti maxilárního sinu (31,4 %) [5]. Kostní eroze a intrakraniální šíření je poměrně běžné vzhledem k agresivní povaze nádoru popisováno u 20,9 % případů [6]. V našem případě se jednalo o postižení levé nosní dutiny s částečnou kostní erozí rinobáze. Zřídka může infiltrovat také oblast nosohltanu, dutiny ústní nebo hypofaryngu [7].
Při klinickém vyšetření jsou u pacientů často přítomné příznaky nosní obstrukce (61,9 %) a epistaxe (53,5 %) [7], někdy také v kombinaci s anosmií (5,8 %), bolestmi hlavy, zejména frontálně (19,8 %), změny vizu (6,9 %) a neurologickými příznaky, jako zmatení, neobvyklé chování a somnolence (5,8 %) [17]. Nejčastější metodou pro radiologickou diagnostiku bylo použití CT (58,4 %) a MR (27,3 %) [5]. V našem případě jsme indikovali předoperačně CT a MR k určení rozsahu postižení. Před zahájením adjuvantní léčby bylo doplněno plánovací PET/CT, kdy bylo vysloveno podezření na perzistenci nádoru, která byla následně histologicky potvrzena. Optimální přístup k léčbě zůstává nejasný z důvodu nedostatku rozsáhlých studií pro vzácnost nemoci. Systematický přehled autorů Misra et al. zahrnující 86 pacientů ukázal, že nejčastější léčebná modalita byla kombinace chirurgické resekce s adjuvantní radioterapií až u 59,3 % popisovaných případů [5]. Kombinace radikální chirurgické léčby s adjuvantní radioterapií prodlužuje specifické přežití [14]. V našem případě byla indikována kombinace radikální chirurgické léčby s adjuvantní chemoradioterapií.
Nejčastěji používaná dávka při radioterapii se pohybuje mezi 54 a 60 Gy, s průměrnou dávkou 55 Gy. Tokunaga et al. a Peng et al. v rámci kazuistických sdělení pacientů s SNTCS prezentovali zkušenosti s radioterapií s modulovanou intenzitou (IMRT) s dobrým efektem bez prokázání recidivy s odstupem 2, resp. 3,5 roku od ukončení léčby [20, 21]. Náš případ podporuje použití protonové léčby vzhledem k obecně vynikajícímu výsledku v této lokalitě sousedící s kritickými strukturami na principu Braggovy křivky. U našeho pacienta nebyly pozorovány žádné závažné vedlejší účinky po dobu 2 let od ukončení léčby.
Role adjuvantní chemoterapie zůstává nejasná, ale podle některých přehledových studií může vést k lepším výsledkům přežití. Misra et al. udávají přežití 88,8 % při sledování 32 měsíců od ukončení léčby pacientů, kteří dostali po chirurgické resekci a adjuvantní radioterapii také adjuvantní chemoterapii (10 pacientů, 11,6 % souboru), oproti průměrnému přežití 56,5 % s odstupem 45 měsíců od ukončení léčby u pacientů, kteří podstoupili pouze chirurgickou resekci s následnou radioterapii [5, 22]. Nejčastějším používaným chemoterapeutikem je platina. U naší kazuistiky byla podána kombinace etoposidu (Vepesid) s cisplatinou, tzv. EP (etoposid-platina). Jde o kombinaci, která se typicky používá u malobuněčných karcinomů plic a karcinomů germinálních buněk. Nicméně vzhledem k malému počtu případů, které využily kombinaci s chemoterapií, bude větší soubor případů vést k lepšímu porozumění účinnosti adjuvantní chemoterapie pro SNTCS.
Také není žádný konsenzus ohledně elektivní iradiace krčních uzlin vzhledem k nejednotnosti uvádění údajů o radiačních polích a techniky. Čtyři studie uvádějí, že nedošlo k elektivní iradiaci krčních uzlin, ve dvou z těchto studií byla popsána recidiva do regionálních lymfatických uzlin [7, 22]. Naopak jen 2 studie popisovaly elektivní ozáření krčních uzlin a u žádné z nich nebyla následně prokázána lokoregionální recidiva uzlin [7, 22]. Náš pacient také podstoupil elektivní ozáření krčních uzlin.
Prognóza v SNTCS však zůstává nejasná, jelikož se jedná o agresivní nádor a recidiva nebo metastázy jsou běžné. Tyto nádory nejčastěji metastazují do regionálních lymfatických uzlin a vzdálených míst, zejména do plic [3]. V recentním systematickém přehledu měla z 71 případů přibližně čtvrtina pacientů recidivy a 10 % metastázy [5]. Budrukkar et al. v souboru 22 pacientů zaznamenali během doby sledování 34 měsíců míru recidivy 56,3 % s průměrnou dobou vzniku recidivy 7 měsíců od ukončení léčby [22]. Ve studii Heffnera a Hyamse z 20 případů 12 zemřelo do 3 let s průměrným přežitím 1,7 roku [2]. Na druhé straně se recidivy objevují obvykle do 3 let. U 8 případů, které přežily déle než 3 roky, nebyla zaznamenána další recidiva nebo metastazování [2].
Závěr
Sinonazální teratokarcinosarkom je vzácný agresivní maligní nádor nosu a vedlejších nosních dutin. Léčba spočívá v kombinaci chirurgické terapie s adjuvantní chemoterapii a radioterapií (protonová terapie). Důležitá je dlouhodobá pravidelná dispenzarizace z důvodu vysokého rizika recidivy onemocnění.
Prohlášení o střetu zájmů
Autorka práce prohlašuje, že v souvislosti s tématem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou firmou. Toto prohlášení se týká i všech spoluautorů.
Grantová podpora
Projekt „Centrum nádorové ekologie – výzkum nádorového mikroprostředí v organizmu podporujícího růst a šíření nádoru“ (reg. č. CZ.02.1.01/0.0/0.0/16_019/0000785) je podpořen z Operačního programu Výzkum, vývoj a vzdělávání.
ORCID autorů
A. Kešner 0000-0001-9346-2412
V. Kratochvíl 0000-0001-8787-4592
D. Kalfeřt 0000-0003-4369-4113
J. Plzák 0000-0003-3710-4455
Přijato k recenzi: 17. 11. 2020
Přijato k tisku: 12. 1. 2021
MUDr. Simona Maléřová, Ph.D.
Klinika otorinolaryngologie a chirurgie hlavy a krku
1. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
Sources
1. Shanmugaratnam K, Kunaratnam N, Chia KB et al. Teratoid carcinosarcoma of the paranasal sinuses. Pathology 1983; 15 (4): 413–419. Doi: 10.3109/00313028309085168.
2. Heffner DK, Hyams VJ. Teratocarcinosarcoma (malignant teratoma?) of the nasal cavity and paranasal sinuses A clinicopathologic study of 20 cases. Cancer 1984; 53 (10): 2140–2154. Doi: 10.1002/1097-0142 (19840515) 53 : 10<2140:: aid-cncr2820531025>3.0.co; 2-y.
3. Chakraborty S, Chowdhury AR, Bandyopadhyay G. Sinonasal teratocarcinosarcoma: Case report of an unusual neoplasm. J Oral Maxillofac Pathol 2016; 20 (1): 147–150. Doi: 10.4103/0973-029X.180979.
4. Wei S, Carroll W, Lazenby A et al. Sinonasal teratocarcinosarcoma: report of a case with review of literature and treatment outcome. Ann Diagn Pathol 2008; 12 (6): 415–425. Doi: 10.1016/j.anndiagpath.2007.05.003.
5. Misra P, Husain Q, Svider PF et al. Management of sinonasal teratocarcinosarcoma: a systematic review. Am J Otolaryngol 2014; 35 (1): 5–11. Doi: 10.1016/j.amjoto.2013.04.010.
6. Shorter C, Nourbakhsh A, Dean M et al. Intracerebral metastasis of a sinonasal teratocarcinosarcoma: a case report. Skull Base 2010; 20 (5): 393–396. Doi: 10.1055/s-0030-1254404.
7. Smith SL, Hessel AC, Luna MA et al. Sinonasal teratocarcinosarcoma of the head and neck: a report of 10 patients treated at a single institution and comparison with reported series. Arch Otolaryngol Head Neck Surg 2008; 134 (6): 592–595. Doi: 10.1001/archotol.134.6.592.
8. Batsakis JG, el-Naggar AK, Luna MA. Teratomas of the head and neck with emphasis on malignancy. Ann Otol Rhinol Laryngol 1995; 104 (6): 496–500. Doi: 10.1177/000348949510400616.
9. Yang S, Sun R, Liang J et al. Sinonasal teratocarcinosarcoma: a clinical and pathological analysis. Int J Surg Pathol 2013; 21 (1): 37–43. Doi: 10.1177/1066896912457202.
10. Vranic S, Caughron SK, Djuricic S et al. Hamartomas, teratomas and teratocarcinosarcomas of the head and neck: Report of 3 new cases with clinico-pathologic correlation, cytogenetic analysis, and review of the literature. BMC Ear Nose Throat Disord 2008; 8 : 8. Doi: 10.1186/1472-6815-8-8.
11. Salem F, Rosenblum MK, Jhanwar SC et al. Teratocarcinosarcoma of the nasal cavity and paranasal sinuses: report of 3 cases with assessment for chromosome 12p status. Hum Pathol 2008; 39 (4): 605–609. Doi: 10.1016/ j.humpath.2007.09.002.
12. Belardinilli F, De Vincentiis L, D‘Ecclesia A et al. PIK3CA somatic mutation in sinonasal teratocarcinosarcoma. Auris Nasus Larynx 2021; 48 (3): 530–534. Doi: 10.1016/j.anl.2020.03. 006.
13. Pai SA, Naresh KN, Masih K et al. Teratocarcinosarcoma of the paranasal sinuses: a clinicopathologic and immunohistochemical study. Hum Pathol 1998; 29 (7): 718–722. Doi: 10.1016/s0046-8177 (98) 90281-7.
14. Terasaka S, Medary MB, Whiting DM et al. Prolonged survival in a patient with sinonasal teratocarcinosarcoma with cranial extension. Case report. J Neurosurg 1998; 88 (4): 753–756. Doi: 10.3171/jns.1998.88.4.0753.
15. Su YY, Friedman M, Huang CC et al. Sinonasal teratocarcinosarcoma. Am J Otolaryngol 2010; 31 (4): 300–303. Doi: 10.1016/j.amjoto.2009. 02.022.
16. Plzák J, Jeřábková P, Skřivan J et al. Nádory nosní dutiny a vedlejších nosních dutin – přehled nových poznatků. Otorinolaryngol Foniatr 2006; 55 (1): 39–49.
17. Agrawal N, Chintagumpala M, Hicks J et al. Sinonasal teratocarcinosarcoma in an adolescent male. J Pediatr Hematol Oncol 2012; 34 (7): e304 – –e307. Doi: 10.1097/MPH.0b013e318266baa8.
18. Fatima SS, Minhas K, Din NU et al. Sinonasal teratocarcinosarcoma: a clinicopathologic and immunohistochemical study of 6 cases. Ann Diagn Pathol 2013; 17 (4): 313–318. Doi: 10.1016/j.anndiagpath.2013.01.003.
19. Tandon S, Gairola M, Ahlawat P et al. Sinonasal teratocarcinosarcoma treated with surgery followed by volumetric modulated radiotherapy: a case report with review of literature. Radiat Oncol J 2018; 36 (4): 341–347. Doi: 10.3857/roj.2018.00304.
20. Peng G, Ke Y, Wang T et al. Intensity-modulated radiotherapy for sinonasal teratocarcinosarcoma. J Huazhong Univ Sci Technolog Med Sci 2011; 31 (6): 857–860. Doi: 10.1007/s11596-011-0691-x.
21. Tokunaga T, Sunaga H, Kimura Y et al. A case of sinonasal teratocarcinosarcoma treated with surgery and post-operative intensity-modulated radiotherapy (IMRT). Auris Nasus Larynx 2012; 39 (6): 641–645. Doi: 10.1016/j.anl.2012.01. 010.
22. Budrukkar A, Agarwal JP, Kane S et al. Management and clinical outcome of sinonasal teratocarcinosarcoma: single institution experience. J Laryngol Otol 2010; 124 (7): 739–743. Doi: 10.1017/S0022215109992866.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2022 Issue 2-
All articles in this issue
- Editorial
- Náhle vzniklá percepční nedoslýchavost u dětí: přehled diagnostiky, terapie a prognóza
- Kontaktní endoskopie – nová diagnostická metoda nádorových a přednádorových změn sliznic hlavy a krku
- Sinonazální teratokarcinosarkom
- Zlomenina kostry hrtanu – kazuistika
- Dá sa včasným pooperačným DWI zistiť reziduálny cholesteatóm?
- Náhodná aplikace vteřinového lepidla do nosní dutiny u čtyřleté holčičky – návrh strategie léčby v ORL oblasti
- Založenie ORL oddelenia v Považskej Bystrici a jeho prví protagonisti
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zlomenina kostry hrtanu – kazuistika
- Náhle vzniklá percepční nedoslýchavost u dětí: přehled diagnostiky, terapie a prognóza
- Kontaktní endoskopie – nová diagnostická metoda nádorových a přednádorových změn sliznic hlavy a krku
- Sinonazální teratokarcinosarkom
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

