-
Medical journals
- Career
Peroperačné monitorovanie funkcie hlavových nervov v otorinolaryngológii, neurootológii a chirurgii bázy lebky na Klinike ORL a chirurgie hlavy a krku LF UPJŠ a UN L. Pasteura (2000 – 2010)
Authors: L. Kaliarik; J. Kovaľ
Authors‘ workplace: Klinika otorinolaryngológie a chirurgie hlavy a krku LF UPJŠ a UN L. Pasteura, Košice, prednosta prof. MUDr. J. Kovaľ, CSc.
Published in: Otorinolaryngol Foniatr, 60, 2011, No. 3, pp. 139-144.
Category: Original Article
Overview
Mnohé chirurgické výkony v oblasti hlavy a krku sú rizikové z hľadiska poškodenia hlavových a periférnych nervov. Príčinou poškodenia sú najčastejšie mechanická trauma a ischémia. Po operácii sa to prejaví bolesťou, funkčnými poruchami a v prípade tvárového nervu až mutilujúcimi kozmetickými zmenami v inervačnej oblasti nervu. Elektrofyziologické merania motorických nervov počas operácie podávajú informácie o lokalizácii a funkčnom stave nervu a pomáhajú minimalizovať rozsah poškodenia. V práci prezentujeme retrospektívnu analýzu súboru pacientov operovaných s použitím peroperačného monitoringu hlavových nervov. 122 pacientov operovaných pre tumor v oblasti pontocerebelárneho uhla (PCU) translabyrintným (TL) prístupom, 22 pacientov operovaných retrosigmoidným (RS) prístupom, 20 pacientov operovaných pre vrodené vývojové chyby (VVCH) vonkajšieho a stredného ucha, 5 pacientov operovaných pre glomus tumor infratemporálnym prístupom A podľa Fischa s premiestnením tvárového nervu (n. VII), 144 pacientov operovaných pre tumor príušnej slinnej žľazy, 12 pacientov operovaných pre malígny tumor štítnej žľazy alebo reoperáciu. Signifikantný bol vzťah Bergesovho pomeru ku veľkosti tumoru PCU do 2 cm (p< 0,001), ako aj závislosť funkcie n. VII v House-Brackmannovej klasifikácii (HB) 10. pooperačný deň pri použitej stimulačnej intenzite 0,05 mA, oproti skupine pacientov s intenzitou nad 0,1 mA ( p< 0,001). Signifikantná bola aj závislosť funkcie n. VII v HB klasifikácii po 1 roku od operácie v skupine pacientov s použitou stimulačnou intenzitou 0,05 mA oproti skupine pacientov s použitou intenzitou nad 0,1 mA (p< 0,001).
Kľúčové slová:
peroperačný monitoring hlavových nervov.ÚVOD
Peroperačný monitoring hlavových nervov sa vďaka svojim diagnostickým možnostiam a v našich podmienkach relatívne nízkej cene stáva postupne čoraz rozšírenejšou metódou pri chirurgii laterálnej bázy lebky, otochirurgii, otoneurochirurgii, chirurgii slinných žliaz a chirurgii štítnej žľazy. Využíva sa na identifikáciu nervu v tumorom zmenených podmienkach, alebo pri reoperáciách v jazvovitom tkanive po predchádzajúcich operáciách. Pre svoju minimálnu invazivitu sa postupne stáva rutinnou súčasťou operácií v oblasti záujmu neurootochirurga ako aj otorinolaryngológa. Výrazný pokrok v technológii sa dosiahol najmä za posledných 10 - 20 rokov vďaka zavádzaniu stále modernejších prístrojov do klinickej praxe. V otorinolaryngológii a neurootochirurgii pomáha peroperačný monitoring zlepšovať funkčné výsledky hlavových nervov po operáciách.
METÓDY
Do retrospektívnej štúdie bolo zaradených 104 pacientov zo 122, ktorí boli v rokoch 2000 až 2010 operovaní pre tumor PCU, 22 pacientov operovaných retrosigmoidným (RS) prístupom pre neurovaskulárny konflikt alebo vestibulárnu neurektómiu, 20 pacientov operovaných pre vrodené vývojové chyby (VVCH) vonkajšieho a stredného ucha, 5 pacientov operovaných pre glomus tumor infratemporálnym prístupom A podľa Fischa s premiestnením tvárového nervu (n. VII), 144 pacientov operovaných pre tumor príušnej slinnej žľazy, 12 pacientov operovaných pre malígny tumor štítnej žľazy alebo reoperáciu.
Stupeň lézie n. VII bol hodnotený podľa House – Brackmannovej klasifikácie (HB). Bola sledovaná a vyhodnotená zmena funkcie n. VII počas hospitalizácie a po 1 roku od operácie.
Monitorovanie hlavových nervov s motorickou komponentou sme na našom pracovisku realizovali dlhodobo dvojkanálovým prístrojom NIM 2 XL. Od roku 2009 sme používali prístroj NIM Response 2.0, umožňujúci štvorkanálové monitorovanie, ktoré využívame hlavne pri chirurgických prístupoch na laterálnu bázu lebky.
Pre štatistické vyhodnotenie súboru pacientov pri monitorovaní n. VII pri operáciách pre tumor PCU sme použili test jednocestnej analýzy rozptylu – jednocestná ANOVA (Graph Pad Prism Version 3.0 s doplnkovým testom (Tukeyho test).
VÝSLEDKY
V súbore 122 pacientov operovaných pre TU PC uhla s použitím neuromonitoringu sme odkontrolovali 104 pacientov a zaznamenali sme anatomické zachovanie n. VII na úrovni 100 %. Skorá dobrá funkcia n.VII - HB I, II, III bola u 59,2 % pacientov. Neskorá dobrá funkcia n. VII po roku HB I, II, III bola u 78,4 % pacientov. Neskorá zlá funkcia n. VII HB IV, V, VI bola u 21,6 % pacientov.
V súbore 22 pacientov operovaných RS prístupom pre neurovaskulárny konflikt alebo vestibulárnu neurektómiu s použitím neuromonitoringu sme zaznamenali anatomické zachovanie n. VII na úrovni 100 %. Skorá dobrá funkcia n.VII HB I, II, III bola u 100 % pacientov. Neskorá dobrá funkcia n. VII HB I, II, III bola u 100 % pacientov. Neskorá zlá funkcia n. VII - HB IV, V, VI nebola zaznamenaná.
V súbore 144 pacientov operovaných pre tumor príušnej slinnej žľazy bola v 8 prípadoch realizovaná totálna radikálna parotidektómia s obetovaním n. VII (5,55 %). Anatomické zachovanie n. VII bolo na úrovni 94,45 %. Skorá dobrá funkcia n.VII HB I, II, III bola dokumentovaná u 87,47 % pacientov. Skorá zlá funkcia n.VII HB IV, V, VI bola dokumentovaná u 12,53 % pacientov. Väčšina pacientov sa na kontrolu neskorej pooperačnej funkcie po roku nedostavila, preto tento údaj v súbore neudávame.
V súbore 20 pacientov operovaných pre VVCH vonkajšieho a stredného ucha s použitím neuromonitoringu dokumentujeme anatomické zachovanie n. VII u 100 % pacientov. Skorá dobrá funkcia n.VII - HB I, II, III bola u 100 % pacientov.
Neskorá dobrá funkcia n. VII - HB I, II, III bola u 100 % pacientov. Neskorá zlá funkcia n. VII - HB IV, V, VI nebola dokumentovaná.
V súbore 5 pacientov operovaných pre glomus tumor infratemporálnym prístupom a podľa Fischa s premiestnením n. VII sme zaznamenali anatomické zachovanie n. VII u 100 % pacientov, skorá dobrá funkcia n. VII - HB I, II, III bola u 20 % pacientov, neskorá dobrá funkcia n.VII - HB I, II, III bola u 60 % pacientov. Neskorá zlá funkcia n. VII HB IV, V, VI bola u 40 % pacientov.
V súbore 12 monitorovaných pacientov po totálnej thyreoidektómii operovaných pre karcinóm štítnej žľazy, alebo reoperáciu, sme dokumentovali anatomické zachovanie NLR u 91,7 % pacientov. 8 pacientov (66,66 %) bolo bez lézie NLR, u 4 pacientov (16,66 %) sme zaznamenali jednostrannú léziu NLR. U 2 pacientov (8,33 %) bola lézia prechodná a odoznela do 14 dní, u 2 pacientov(8,33 %) sa jednalo o trvalú léziu NLR.
DISKUSIA
Lézia n. VII má závažný funkčný a emocionálny vplyv na pacientov. Spôsobuje problém so žuvaním, dysfágiu, xeroftalmiu až devastujúce očné komplikácie, kozmetickú deformitu tváre až eventuálnu sociálnu izoláciu pacienta. Elektrofyziologické merania motorických nervov počas operácie podávajú informácie o lokalizácii a funkčnom stave nervu a pomáhajú minimalizovať rozsah poškodenia pri operácii, negatívne dôsledky pre pacienta ako aj možné forenzné dopady na operatéra (15).
Monitorovanie n. VII v oblasti spánkovej kosti a PC uhle
Monitorovanie n. VII je najstaršou a najlepšie prepracovanou peroperačnou EMG metodikou. Celá história peroperačnej elektromyografie je spojená s tvárovým nervom a vestibulárnymi schwanómami. Ďalšou možnosťou využitia peroperačného monitoringu n. VII je použitie pri otochirurgických výkonoch, transtemporálnych prístupoch, chirurgii tvárového nervu a príušnej slinnej žľazy (4). Vzťahy medzi hlavovými nervami v oblasti zadnej jamy sú konštantné. Najmä veľký tumor môže topograficko-anatomické vzťahy meniť a identifikácia n. VII sa tým stáva obtiažnou až nemožnou, lebo svojím rastom n. VII napína, stenčuje, roztláča až rozvlákňuje. Vtedy je monitoring jediný spôsob, ktorý umožní identifikáciu nervu. Počas preparácie sa stimulátor používa opakovane na sprehľadnenie operačného poľa a identifikáciu nervu v operačnom poli. Po odstránení podstatnej časti tumoru sa objaví celý priebeh tvárového nervu od výstupu z mozgového kmeňa až po fundus vnútorného zvukovodu. No treba vedieť, že n. VII, ktorý sa ešte stále nachádza vo svojom pontocerebelárnom úseku na zvyšku tumoru, môže byť podstatne kvalitatívne zmenený – stenčený, roztlačený, a tým veľmi zraniteľný. Uvoľňovanie nervu je mimoriadne delikátnou činnosťou a monitoring je nápomocný (5).
Peroperačný monitoring n. facialis umožňuje predpovedať pooperačnú funkciu n. facialis, čo umožňuje operatérovi plánovať chirurgickú rehabilitačnú liečbu tvárového nervu (8). Existuje niekoľko metód na predpovedanie pooperačnej funkcie n. facialis založených na elektrofyziologických meraniach.
Berges (1) použil na predpovedanie pooperačnej funkcie nervu pomer definovaný R=R1/R2. Hodnoty R1 a R2 porovnávaje stimulačnú intenzitu a amplitúdu odpovedí na úrovni PC uhla (PC) a vnútorného zvukovodu (MAI) (tab. 1). Výsledný pomer je R=R1/R2=I(PC)x A(MAI) / I(MAI) x A(PC). Na podobnom princípe je založená Tahova metóda, kde sa meria a zaznamenáva proximálna a distálna amplitúda a vyhodnocuje sa ich pomer (19). Ďalšou metódou na predpovedanie pooperačnej funkcie n. VII je meranie minimálnej stimulačnej intenzity potrebnej na vybavenie merateľnej EMG odpovede tvárového nervu po odstránení tumoru z PC uhla (17). Berges vo svojej práci udáva hodnotu pomeru pre funkciu n. VII HB I - II v absolútnom vyjadrení 0,6 a viac pre funkciu tvárového nervu HB V-VI v absolútnom vyjadrení 0,3 a menej. Výsledky Bergesovho pomeru v našom súbore pacientov udávame v tabuľke 4. Pre pooperačnú funkciu tvárového nervu HB I sme zistili priemernú hodnotu 0,5562, pre pooperačnú funkciu tvárového nervu HB V sme zistili priemernú hodnotu 0,3567. Minimálny rozdiel pri výsledkoch pre stupne HB II, III a IV vysvetľujeme relatívne malým počtom pacientov v týchto skupinách v neskorom pooperačnom období a veľkou smerodajnou odchýlkou.
Table 1. Výsledná funkcia n. VII v HB klasifikácii a pomer podľa Bergesovho vzorca. 
Náš súbor pacientov sme štatisticky vyhodnotili testom jednocestná analýza rozptylu - Jednorozmerná ANOVA Graf Pad Prism Version 3.0 s doplnkovým testom (Tukeyho test).
Pri porovnávaní Bergesovho pomeru ku veľkosti tumoru bol štatisticky významný v skupine pacientov s tumorom do 2 cm oproti skupine pacientov s tumorom od 2 do 4 cm na hladine významnosti p< 0,001 aj prísnym Tukeyho testom (tab. 2).
Table 2. Vzťah Bergesovho pomeru ku veľkosti tumoru pri jednotlivých stimulačných intenzitách. 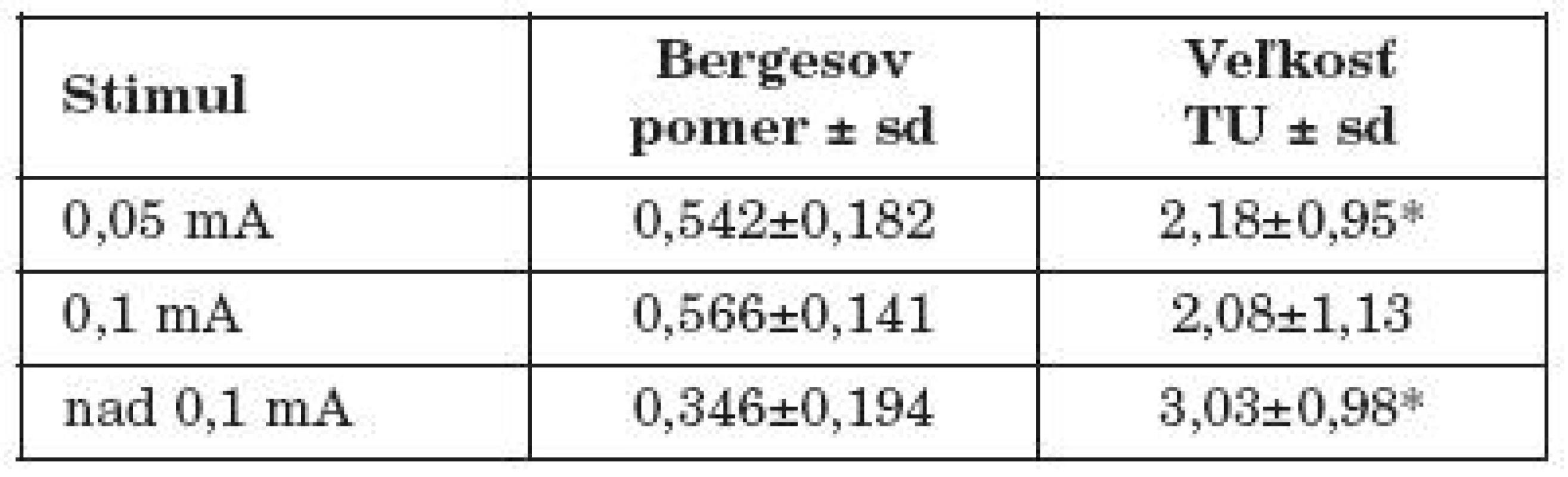
*signifikantný rozdiel na hladine významnosti p<0,001 pri porovnaní Bergesovho pomeru ku veľkosti tumoru v skupine veľkosti TU do 2 cm a od 2-4 cm Ďalšou metódou na predpovedanie pooperačnej funkcie n. VII je meranie minimálnej stimulačnej intenzity potrebnej na vybavenie merateľnej EMG odpovede tvárového nervu po odstránení tumoru z PC uhla. Ak je hodnota pooperačnej stimulačnej intenzity blízka predoperačnej intenzite, dá sa predpokladať fyziologická integrita nervu (10, 12, 14). Amplitúda odpovede získaná po stimulácii je tiež jedným z indikátorov (12). V práci Prasada (12) to bola hladina 0,2 mA a 83 % pacientov s dobrou funkciou n. VII (HB I, II, III), v práci Kirkpatricka (7) to bola hladina 0,2mA a 67 % pacientov s dobrou funkciou n. VII, v práci Silversteina (18) to bola hladina 0,1 mA a 82 % pacientov s dobrou funkciou n. VII a Selesnick v práci (16) stanovil kritickú hladinu na 0,1mA po odstránení tumoru a v súbore udáva 90 % pacientov s dobrou funkciou n.VII v sledovanej skupine po roku od operácie.
Na základe neskorej pooperačnej funkcie n. VII zistenej po roku od operácie môžeme usudzovať, že kritickou hodnotou stimulačnej intenzity, ktorá koreluje s dobrou pooperačnou funkciou tvárového nervu (HB I, II, III), je hodnota 0,10 mA a menej. V našom súbore to bolo v tejto skupine 83,78 % pacientov. U pacientov s dobrou neskorou pooperačnou funkciou HB I, II, III dokumentujeme hodnoty stimulačnej intenzity na úrovni 0,0702 mA – 0,08 mA. Pre zlú funkciu tvárového nervu HB IV, V, VI dokumentujeme hodnoty stimulačnej intenzity 0,2389-0,2916 mA.
Pri porovnaní funkcie tvárového nervu v HB klasifikácii 10. pooperačný deň vo vzťahu k použitej stimulačnej intenzite v skupine pacientov s použitou stimulačnou intenzitou 0,05 mA, oproti skupine pacientov s použitou intenzitou nad 0,1 mA, bola štatistická významnosť na hladine p< 0,001 aj prísnym Tukeyho testom (tab. 3.)
Table 3. Vplyv použitej stimulačnej intenzity na funkciu tvárového nervu vyjadreného v HB klasifikácii na 10. deň a rok po operácii. 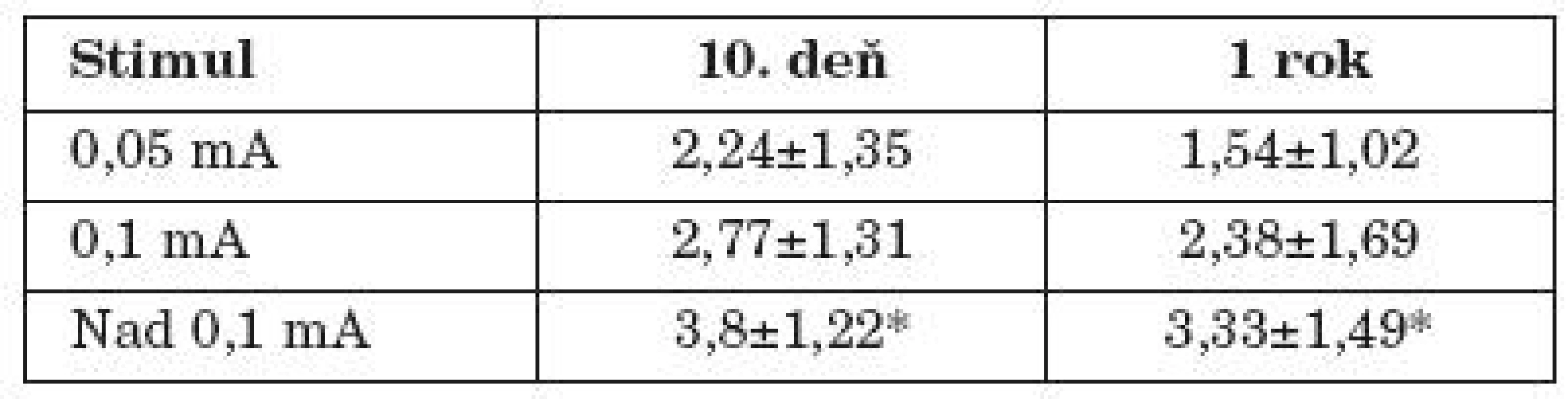
*signifikantný rozdiel oproti stimulačnej intenzite 0,05 mA na hladine výzmanmosti p < 0,001 Obdobnú analýzu sme realizovali pre porovnanie funkcie tvárového nervu v HB klasifikácii po 1 roku od operácie. Pri porovnávaní funkcie tvárového nervu v HB klasifikácii po roku od operácie vo vzťahu k použitej stimulačnej intenzite v skupine pacientov s použitou stimulačnou intenzitou 0,05 mA, oproti skupine pacientov s použitou intenzitou nad 0,1 mA, bola štatistická významnosť na hladine p< 0,001 aj prísnym Tukeyho testom (tab. 3).
Monitorovanie n. VII pri operáciách príušnej slinnej žľazy
V 1907 roku bola prvýkrát publikovaná práca Thomasom Carwardinom, v ktorej opísal zachovanie tvárového nervu pri parotidektómii. Od tejto doby sa zachovanie n. VII stalo štandardom viac ako očakávaním. Začiatkom 20. storočia chirurgovia identifikovali periférne vetvy a následne pokračovali ku hlavnému kmeňu. Janes ako prvý opísal rutinnú identifikáciu hlavného kmeňa na začiatku operácie a postupnú anterográdnu preparáciu po jednotlivých vetvách tvárového nervu pri parotidektómii (4).
Chirurgovia sa snažili o minimalizáciu parézy alebo paralýzy po parotidektómii. Incidencia skorej pooperačnej parézy sa pohybuje v rozmedzí 9,3 % až 64,6 % a trvalej parézy medzi 0 - 0,9 %. Revízna parotidektómia je spájaná s vysokým rizikom incidencie poranenia tvárového nervu 5,5 % - 29 %.
Zavedenie monitoringu tvárového nervu do chirurgie príušnej slinnej žľazy umožnilo rozvoj retrográdnej parotidektómie, ktorá je podľa štúdie Bhattacharyya efektívnejšia, šetrí čas, zmenšuje krvné straty, šetrí a ponecháva viac zdravého tkaniva príušnej slinnej žľazy, vedie k signifikatnému zlepšeniu skorej pooperačnej funkcie n. VII v porovnaní so súborom bez monitoringu (2). Naproti tomu Witt (21) vo svojej práci nepotvrdil signifikantný rozdiel medzi súborom pacientov operovaných s monitoringom a bez monitoringu, jeho práca sa však vzťahovala k súboru pacientov s mobilnými benígnymi léziami príušnej žľazy. Dulguerov vo svojej práci tiež potvrdil signifikantné zlepšenie pooperačnej funkcie n. VII v skupine pacientov operovaných s monitoringom (4). O Brien povrdil 18 % dočasných lézií n. VII (11), Watanabe potvrdil 37 % dočasných lézií (20). Vo svojich súboroch autori prezentovali signifikantne lepšie výsledky v súbore s použitím monitoringu.
V daných prameňoch autori zahŕňali len benígne tumory, v našom súbore boli pacienti operovaní pre benígne ako aj malígne tumory. V skorom pooperačnom období sme dosiahli výsledky porovnateľné so zahraničnými autormi, ktoré dokumentujeme v tabuľke 4.
Table 4. Percentuálne zastúpenie jednotlivých stupňov skorej pooperačnej lézie n. VII podľa HB klasifikácie v súbore pacientov operovaných pre tumor príušnej slinnej žľazy. 
Hodnoty HB IV, V a VI, teda zlá pooperačná funkcia n. VII, patrili pacientom, u ktorých bola realizovaná reoperácia pre recidivujúci pleomorfný adenóm, malígnu transformáciu pleomorfného adenómu a primárne malígne novotvary v príušnej slinnej žľaze. V našom súbore pacientov to bolo 12,53% zastúpenie. Z neskorého sledovania pooperačnej funkcie máme len minimálne množstvo údajov, lebo väčšina pacientov s benígnym novotvarom sa na opakované kontroly nedostavila.
Peroperačné monitorovanie n. laryngeus recurrens
Lézia nervus laryngeus recurrens (NLR) po thyreoidektómii znižuje kvalitu života. Obojstranná lézia NLR vedie ku dyspnoe a život ohrozujúcej obštrukcii glotis.
Odpoveď n. vagus možno snímať z thyroarytenoidných svalov priamo pomocou elektród zavádzaných transkutánne alebo direktnou laryngoskopiou (ihlové, háčikové, povrchové elektródy). Tento typ monitorovania sa používa pri výkonoch na krku s rizikom poškodenia n. laryngeus recurrens. Použitie endotracheálnej intubačnej kanyly so snímacou elektródou je oproti použitiu ihlových elektród bezpečnejšie, snímacia elektróda je stabilnejšia a šetrí čas (9). Ťahanie nervu pri operácii, ischémia v dôsledku tlaku balónika ET kanyly môže viesť k nepohyblivosti hlasiviek, ktorá vyžaduje reintubáciu, tracheotómiu alebo lateralizáciu. Monitoring nemôže vždy predpovedať obojstrannú léziu. Robertson potvrdil štatisticky významný rozdiel v dôsledku zvyšujúceho sa T stagingu pri tumoroch štítnej žľazy (13). Zástancovia monitoringu uvádzajú fakt, že monitoring redukuje riziko lézie NLR a umožňuje predpovedať pooperačnú funkciu NLR. Poukazujú na možnosť umiestnenia elektród transligamentálne. S výhodou ho možno používať pri reoperáciách, aberantnom priebehu nervu alebo veľkej mase tkaniva tumoru (6). Poranenie NLR je zriedkavou komplikáciou pri primochirurgii štítnej žľazy a prištítnych teliesok, prevalencia stúpa pri reoperáciách (22). Peroperačná vedomosť o pooperačnej funkcii NLR je dôležitá informácia pre chirurga. Kontinuálny peroperačný monitoring n. laryngeus recurrens je pri operácii štítnej žľazy a prištítnych teliesok sprevádzaný extrémne nízkym počtom dočasných aj trvalých paralýz n. laryngeus recurrens a najväčšie využitie má pri reoperáciách v jazvovitom tkanive po predchádzajúcich operáciách (3).
V našom súbore 12 pacientov po totálnej thyreoidektómii sme dosiahli anatomické zachovanie NLR v 91,7 % prípadov, 8 pacienti mali normálnu pooperačnú funkciu NLR, 2 pacienti mali prechodnú jednostrannú léziu NLR, ktorá do 14 dní odznela a u 2 pacientov sme dokumentovali trvalú léziu NLR.
ZÁVER
Základným predpokladom chirurgie lebečnej bázy je jej bezpečnosť pre pacienta. Cieľom je komplexné riešenie patologického stavu prístupom výhodným pre pacienta. Extrémne náročné výkony musia spĺňať požiadavky na maximálnu redukciu morbidity a mortality. Spolu s detailnou anatomickou znalosťou danej oblasti, dokonale zvládnutou mikrochirurgickou technikou a precíznou rádiologickou diagnostikou sú peroperačné elektrofyziologické monitorovacie techniky hlavnými metódami, ktoré redukujú riziko pooperačného neurologického deficitu.
Okamžitá spätná väzba pre operatéra umožňuje bezprostrednú reakciu na hroziace poškodenie nervu. Monitorovanie umožňuje bezpečnú anatomickú lokalizáciu nervu nielen v prípadoch anatomickej variability v danej oblasti, neprehľadného operačného poľa alebo pri dislokácii nervu tumorom, ale aj v prípadoch širokého rozvláknenia, aké je typické pri veľkých vestibulárnych schwanómoch. Detailná lokalizácia nervu na povrchu tumoru umožňuje jeho bezpečnú dekompresiu. Zachovaná odpoveď a eventuálne jej ďalšia kvantitatívna analýza môže byť dôležitým prognostickým faktorom pooperačnej funkcie hlavových nervov. Nemožno zabudnúť ani na pozitívny psychologický efekt zachovanej odpovede nervu pre operatéra počas výkonu.
MUDr. Ladislav Kaliarik
Klinika otorinolaryngológie a chirurgie hlavy a krkuLF UPJŠ a UNLP
Tr. SNP 1
040 66 Košice
Slovenská republika
Sources
1. Berges, C., Fraysse, B., Yardeni, E., Rugiu, G.: Intraoperative facial nerve monitoring in posterior fossa surgery: prognostic value. Skull Base Surgery, 3, 1993, s. 214-216.
2. Bhattacharyya, N., Richardson, M. E., Gugino, L. D.: An objective assessment of the advantages of retrograde parotidectomy. Otolaryngol. Head Neck Surg., 131, 2004, 4, s. 392-396.
3. Brennan, J., Moore, E. S., Shuler, K. J.: Prospective analysis of the efficacy of continuous intraoperative nerve monitoring during thyroidectomy, parathyroidectomy and parotidectomy. Otolaryngol. Head Neck Surg,. 124, 2001, 5, s. 537-543.
4. Dulguerov, P., Marchal, F., Lehmann, W.: Postparotidectomy facial nerve paralysis: possible etiologic factors and results with routine facial nerve monitoring. Laryngoskope, 109, 1999, s. 754-761.
5. Grayeli, A. B., Guindi, S., Kalamarides, M., El Garem, H., Smail, M., Rey, A., Sterkers, O.: Four-chanel electromyography of the facial nerve in vestibular schwannoma surgery: sensitivity and prognostic value for short-term facial function outcome. Otol. Neurotik., 26, 2005, 1, s. 114-120.
6. Hermann, M., Hellebart, C., Freissmuth, M.: Neuromonitoring in thyroid surgery: prospective evaluation of intraoperative electrophysiological responses for the prediction of recurrent laryngea nerve injury. Ann. Surg., 240, 2004, 1, s. 9-17.
7. Kirkpatrick, P. J., Walters, M. B., Strong, A. J., Walliker, J. R., Gleeson, M. J.: Prediction of facial nerve function after surgery for cerebellopontine angle tumors. Use of facial nerve stimulator and monitor. Skull Base Surg., 1, 1991, s. 171-176.
8. Kovaľ, J., Šulla, I., Krempaská, S., Kaliarik, L., Almaši, M.: Hľadisko chirurga na zachovanie funkcie nervus facialis pri odstraňovaní vestibulárneho schwanómu translabyrintným prístupom. Otorinolaryng. a Foniat. /Prague/, 55, 2007, 4, s. 199-206.
9. Mikuni, N., Satow, T., Taki, J., Nishida, N., Enatsu R., Hashimoto, N.: Endotracheal tube electrodes to map and monitor activities of the vagus nerve intraoperatively. Technical Note. J. Neurosurg., 101, 2004, 3, s. 536-540.
10. Nissen, A. J., Sikand, A., Curto, F. S., Welsh, J. E., Gardi, J.: Value of intraoperative treshold stimulus in predicting postoperative facial nerve function after acoustic tumor resection. Am. J. Otol., 18, 1997, 2, s. 249-251.
11. O’Brien, C. J., Malka, V. B., Mijailovic, M. : Evaluation of 242 consecutive parotidectomies performed for benign and malignant disease. Austr. N. Z. Surg., 1993, 63, s. 870-877.
12. Prasad, S., Barry, E. H., Kamerer, D. B., Durrant, J., Sekhar, L. N.:Facial nerve function following cerebellopontine angle surgery: prognostic value of intraoperative tresholds. Am. J. Otol., 14, 1993 , 4, s. 330-333.
13. Robertson, M. L., Steward D. L., Gluckman J. L., Welge, J.: Continuous laryngeal nerve integrity monitoring during thyroidectomy: does it reduce risk of injury? Otolaryngol. Head Neck Surg., 131, 2004, 5, s. 596-600.
14. Samii, M., Matthies, C.: Management of 1000 vestibular schwannomas: the facial nerve – preservation and restitution of function. Neurosurgery, 40, 1997, 4, s. 696-706.
15. Schlake, H. P.Goldbrunner, R., Milewski, Ch., Krauss, J., Trautner, H., Behr, R., Sorensen, N., Helms, J., Roosen, K.: Intra-operative electromyographic monitoring of lower cranial motor nerves (LCM IX-XII) in skull base surgery. Clin. Neurol. Neurosurg., 103, 2001, 2, s. 72-82.
16. Selesnik, S. H., Cerew, J. F., Victor, J. D., Heise, C. W, Levine, J.:Predictive value of facial nerve electrofysiologic stimulation Tresholds in cerebellopontine – angle surgery. Laryngoscope, 106, 1996, 5 Pt1, s. 633‑638.
17. Selesnick, S. H.: Optimal stimulus duration for Intraoperative facial nerve monitoring. Laryngoskope, 109, 1999, s. 1376-1385.
18. Silverstein, H., Willcox, T. O., Rosenberg, S. I., Seidman, M. D.: Prediction of facial nerve function following acoustic neuroma resection using intraoperative facial nerve stimulation. Laryngoscope, 104, 1994, s. 539-544.
19. Taha, J. M., Tew, J. M., Keith, R. W.: Proximal – to – distal facial amplitude ratios as predictors of facial nerve function after acoustic neuroma excision. J. Neurosurg., 83, 1995, s. 994-998.
20. Watanabe, Y., Ischikawa, M., Shojaku, H., Mizokoshi, K.: Facial nerve palsy as a complication of parotid gland surgery and its prevention. Acta Otolaryngol., 1993, 504, s. 137-139.
21. Witt, R. L.: Facial nerve monitorng in parotid surgery: the standard of care? Otolaryngology Head and Neck Surgery, 119, 1998, 5, s. 468-470.
22. Yarbrough, D. E., Thompson G. B., Kasperbauer, J. L., Harper C. M., Grant, C. S.: Intraoperative electromyographic monitoring of the recurrent laryngeal nerve in reoperative thyroid and parathyroid surgery. Surgery, 136, 2004, 6, s. 1107-1115.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2011 Issue 3-
All articles in this issue
- Fyziologické hodnoty čichových testů v české populaci
- Test větné srozumitelnosti v hovorovém šumu u osob s normálním sluchem
- Pozitronová emisní tomografie v ORL onkologii
- Peroperačné monitorovanie funkcie hlavových nervov v otorinolaryngológii, neurootológii a chirurgii bázy lebky na Klinike ORL a chirurgie hlavy a krku LF UPJŠ a UN L. Pasteura (2000 – 2010)
- Idiopatická a zdanlivo idiopatická neuralgia nervus trigeminus
- Polyganglionitída pri Bellovej obrne – klinická analýza
- Zkušenosti s lokální kortikoterapií při dysfunkcích Eustachovy tuby
- Zriedkavá vrodená anomália krku: aneuryzma vena jugularis
- Atypická koincidence hereditárního angioedému, systémového lupus erythematodes a karcinomu jazyka
- Vzácná příčina slepoty u pacienta s nosní polypózou, Leberova hereditární neuropatie zrakového nervu
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zkušenosti s lokální kortikoterapií při dysfunkcích Eustachovy tuby
- Idiopatická a zdanlivo idiopatická neuralgia nervus trigeminus
- Zriedkavá vrodená anomália krku: aneuryzma vena jugularis
- Polyganglionitída pri Bellovej obrne – klinická analýza
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

