-
Medical journals
- Career
Metalothionein a jeho obecný význam v kancerogenezi – 1. část
Authors: Z. Horáková; E. Tóthová; H. Binková; Richard Salzman; P. Smilek
Authors‘ workplace: Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u sv. Anny, Brno přednosta prof. MUDr. R. Kostřica, CSc.
Published in: Otorinolaryngol Foniatr, 57, 2008, No. 2, pp. 83-89.
Category: Comprehensive Reports
Overview
Metalothionein (MT) je nízkomolekulární, intracelulární, ubikvitně přítomný protein s charakteristickou strukturou. Je indukován širokým spektrem různých fyziologických i patologických impulzů. V posledních letech je intenzivně studována role MT v kancerogenezi. Následující přehledný článek shrnuje základní informace týkající se jeho struktury, funkce a recentní poznatky o expresi MT v různých typech malignit.
Klíčová slova:
metalothionein, kancerogeneze, tkáňový marker, nádory hlavy a krku.ÚVOD
Metalothionein (MT) patří do supererodiny intracelulárních, kovy vázajících proteinů, ubikvitně přítomných ve všech živých organismech. MT láká pozornost biologů a chemiků vzhledem ke své pozoruhodné chemické struktuře, která podmiňuje jeho specificitu, stabilitu a dynamické chování. U obratlovců se MT nachází ve všech tkáních, v nejvyšší koncentraci se vyskytuje v játrech, ledvinách a střevě. Extracelulárně byly nízké koncentrace nalezeny v plazmě, moči, žluči. Jeho funkční rozmanitost vyplývá z jeho hlavních vlastností, což je redoxní kapacita a schopnost vázat kovy. Koncentrace MT v organismu je elevována za mnoha různých patologických i fyziologických podmínek. Dosavadní literární údaje potvrzují, že ke změně koncentrace MT dochází také v souvislosti s výskytem malignity.
STRUKTURA
MT je přítomen v organismech všech savců a při jejich vzájemném srovnání je patrná velká vývojová stabilita jeho struktury. Molekulová hmotnost se pohybuje od 6500 do 7000 Da. Nejcharakterističtějšími rysy pro molekulární strukturu MT jsou absence aromatických aminokyselin a vysoký obsah cysteinu. Četné thiolové – SH skupiny nezůstávají v molekule MT volné, ale vyvazují divalentní kovy do thiolových klastrů. MT má schopnost navázat 18 různých kovů. Terciární struktura je charakterizována dvěma doménami, alfa a beta. Obě jsou globulární a podmiňují společný elipsoidní tvar molekuly. Relativní afinita různých kovů k vazbě na MT se liší; pro Cu je asi 1000x silnější než pro Zn. Atomy kovů vázané in vivo na MT jsou málokdy tvořeny pouze jedním prvkem, většinou je v různém poměru zastoupeno více různých kovů. Snižováním pH se kovy od apometalothioneinu uvolňují. Vazba kovů je reakcí reverzibilní a rychlou. MT se stává donorem kovových iontů pro ligandy jiných intracelulárních proteinů, čímž se široce zapojuje do různých metabolických procesů v buňce. Protein bez navázaných kovových iontů, tzv. apoMT, je degradován mnohem rychleji než komplex kov-MT. Pohyb atomů kovu přes celulární pool MT probíhá třemi cestami: uvolnění kovu současně s degradací proteinu, vzájemná výměna iontů ve vazbě a transfer komplexu protein-kov do jiného kompartmentu buňky, např lysozymu (6, 7) (obr. 1).
Izoformy
MT zahrnují multigenní rodinu, která se skládá minimálně z 10-12 genů lokalizovaných na chromozomu 16 kódujícím izoformy MTI (s indexy A B E F G H X), MTII, MTIII a IV.
Pouze asi polovina z nich se exprimuje na proteinové úrovni. Každý z těchto genů představuje jedinečný regulační mechanismus a jeho indukovatelnost je závislá na tkáni a vývojovém stadiu. Jejich odlišné vlastnosti vysvětlují i odlišné funkce v organismu. MTII má hlavní roli v metabolismu Zn, při zvýšeném příjmu zinku vede jeho produkce k akumulaci ve formě interacelulárního Zn-thioneinu. MT IA se uplatňuje zejména při expozici těžkým kovům a extrémně vysoké koncentraci zinku (4, 5) MT III a IV jsou indukovány jen marginálně (23).
Tkáňová distribuce
MT nacházíme ve všech tkáních, ale v různých koncentracích. Nejvyšší tkáňová koncentrace MT byla zjištěna v játrech, ledvinách, střevě a pankreatu. Distribuce není závislá na celkovém obsahu MT v buňce, stejně tak nezáleží na typu a množství vázaných kovů. Rozdílná funkce se předpokládá v závislosti na subcelulární distribuci - ochrana proti oxidativnímu stresu při cytoplazmatické distribuci, ochrana proti cytotoxickému poškození a genová regulace při nukleární distribuci. Nukleární distribuce byla pozorována u rychle proliferujících buněk, zejména v nádorových tkáních. MT je pravděpodobně součástí mechanismu kontrolované buněčné smrti, apoptózy. MT může být považován za marker proliferace.
Genová regulace a indukce
Exprese genů MT I a II je ovlivnitelná širokou škálou různých podnětů. Regulace biosyntézy probíhá primárně na úrovni transkripce, kde elementy DNA odpovídají na regulační transkripční proteiny (9). Geny pro MT odpovídají na mnoho signálů, které regulují jak bazální tak indukovatelnou produkci MT, mohou působit ve smyslu aktivace i represe; většina impulzů působí aktivačně.
Indukce kovy
Syntéza MT v játrech je indukovatelná různými kovy, cytokiny a hormony stresu, stejně jako širokou škálou chemikálií. Za primární induktory se považuje Zn a Cu. Zajímavé je, že netoxické hladiny Cu neindukují MT, přestože je na něj in vivo fyziologicky vázán. Vazba Zn na MTF1 (metal transcription factor) umožňuje vazbu tohoto proteinu na MRE (metal response element) promoterové oblasti, která iniciuje transkripci MT genu. MTF1 se standardně vyskytuje v cytoplazmě, při stresu nebo expozici kovům dochází k přesunu do jádra a k vazbě na MRE. MTF1 přímo odpovídá na hladinu Zn, který aktivuje protein přímou alosterickou interakcí. Koncentrace podmiňující indukci a čas nezbytný k dosažení maxima hladiny se liší mezi jednotlivými kovy ( Zn, Cd, Hg, Cu a Bi). Zn a Cd patří mezi suverénně nejsilnější indukční faktory.
Ostatní induktory
Syntéza MT je rovněž indukována hormony, včetně glukokortikoidů, glukagonu, epinefrinu a dalšími faktory působícími cestou cAMP, interferonu a interleukinu 1. Glukokortikoidy indukují MT nezávisle na ostatních regulačních systémech vazbou na GRE (glucocorticoid response element). Indukční potenciál je výrazně nižší než pro kovy (cca 25x). Stejně jako u proteinů akutní fáze dochází k indukci zánětem, infekcí, stresem. Syntéza MT v játrech byla indukována v experimentálních podmínkách, např. chladem, horkem, extrémní zátěží, intoxikací. Stresové podmínky, které indukují syntézu MT, souvisejí s redukcí Zn v plazmě. Celková redistribuce Zn za stresových podmínek je zahájena právě poklesem hodnot v plazmě a přesunem do jater, volný Zn pak stimuluje syntézu MT.
Oxidativním stresem je MTI indukovatelný v závislosti na dávce při expozici oxidativním činidlům. K indukci dochází vazbou na všech šest MRE. MTF1 (metal transcription factor 1) se tak stává dominantním regulačním proteinem v indukci MT. Existuje také specifický mechanismus indukce oxidativním stresem cestou ARE (anti-oxidant response element) (obr. 2).
Image 2. Schéma indukce genu MT. 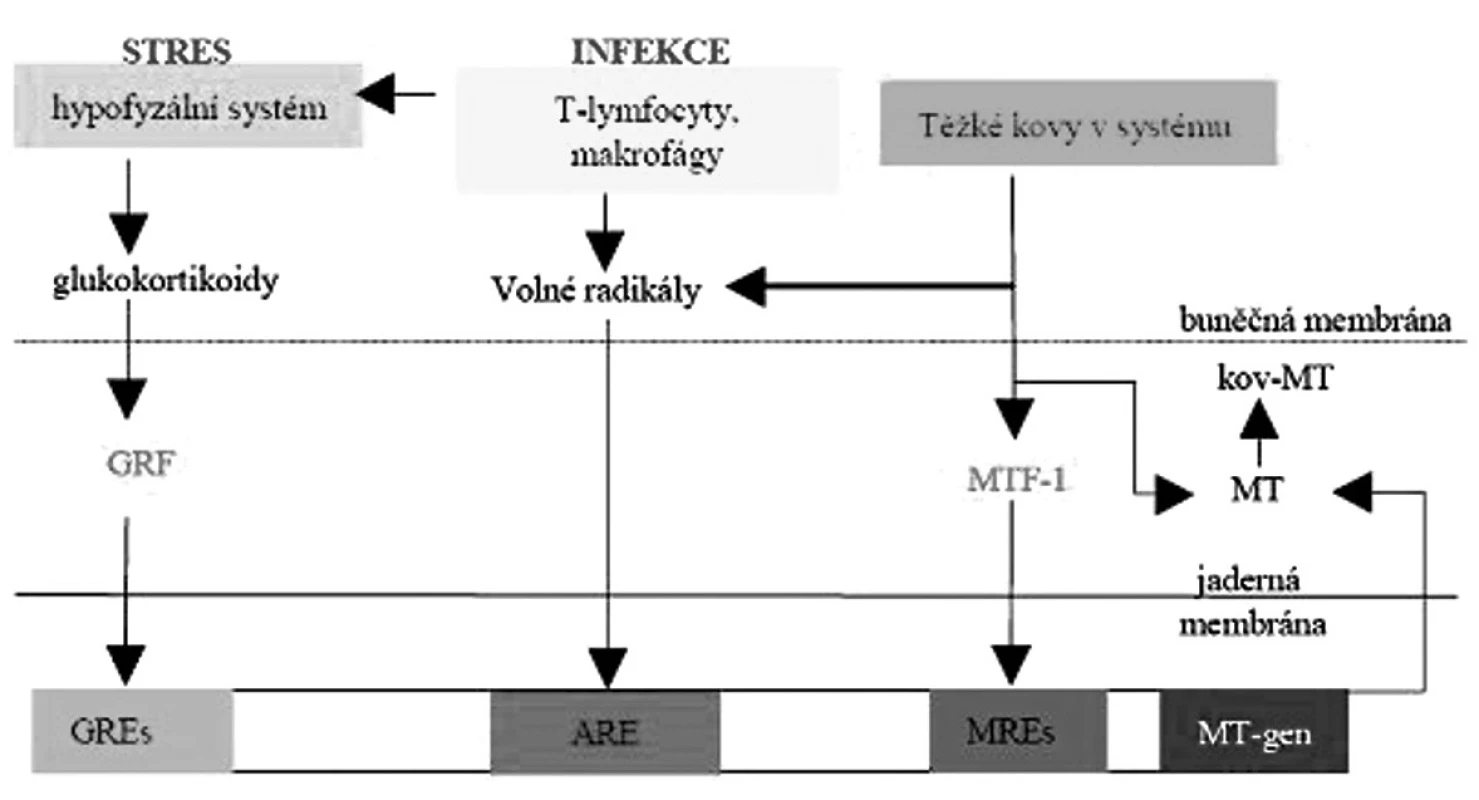
FUNKCE
Definovat jednoznačně funkci metalothioneinu v lidském organismu je poměrně složité. Doposud bylo ověřeno jeho zapojení do mnoha odlišných fyziologických i patologických procesů. Obecně se přijímá, že majoritní funkcí MT je účast na metabolismu kovů, tj. detoxikace a udržování poolu těžkých kovů, a regulace buněčného metabolismu zinku a mědi. Z toho vyplývají i další funkce v buněčném vývoji a adaptaci na stres. Významná je ochrana proti UV a RTG záření a kyslíkovým radikálům, tj. proti oxidativnímu stresu (3).
Metabolismus kovů
MT reguluje pohyb Cu a Zn v buňce přímo, uvolněním iontu pro apoenzym nebo metabolický kompartment nebo nepřímo regulací koncentrace volných iontů. Tuto hypotézu podporuje korelace zvýšené výměnu zinku při zvýšené syntéze MT. Perorální příjem Zn koreluje s hladinami mRNA MT a vazbou Zn-MT. Naopak pokles celulárního MT znamená deficit Zn. Molekula MT je zapojena i do metabolismu dalších kovů.
Jaterní MT stoupá po podání širokého spektra toxických látek. Tímto způsobem játra zajišťují ochranu proti toxickému poškození. Je-li předem indukována zvýšená hladina MT, např. po podání Zn, je hepatotoxicita podané noxy výrazně nižší.
Oxidativní stres
Klastrová struktura molekuly MT umožňuje ligaci Zn a současnou oxidaci a redukci prostřednictvím vazby a uvolňováním Zn. MT se stává redoxním proteinem, kde redoxní potenciál vzniká koordinací s okolím. Redoxní potenciál klastrů je nízký, MT je snadno oxidován i slabými buněčnými oxidanty za současného uvolnění Zn (11). V okamžiku syntézy apothioneinu MT se stanou SH skupiny cysteinových zbytků součástí komplexu s kationty těžkých kovů v cytosolu. Mohou vychytávat superoxidové anionty a hydroxylové radikály s afinitou více než 300krát vyšší než GSH, který je považován za základ antioxidativního obranného mechanismu. Rozhodující je také subcelulární lokalizace MT. Cytoplazmatický MT má supresivní efekt na oxidativní poškození a cytotoxicitu těžkých kovů, na rozdíl od nukleárního MT, který působí naopak protektivně na DNA proti UV záření a H2O2 (1, 27).
MT a zánět
Indukce MT se účastní odpovědi tkáně na zranění, infekci, zánět. V tomto kontextu se MT považuje za protein akutní fáze. Na rozdíl od ostatních proteinů akutní fáze je indukce MT zánětlivými mediátory závislá na přítomnosti Zn. V rámci zánětlivé odpovědi dochází v játrech k extenzivní reorganizaci proteosyntézy a MT jako zdroj Zn se řadí mezi nejčasněji indukované proteiny. Vzrůst hladiny MT se projevuje již za 2-4 hodiny po zánětlivém impulzu. Přesný význam metalothioneinem řízené redistribuce zinku je nejasný. Teoreticky se předpokládá mechanismus snížení hladiny Zn v plazmě, která moduluje funkci leukocytů, včetně produkce cytokinů, podporuje metabolické procesy a podporuje maximální aktivitu enzymů. MT působí také jako antioxidant v terénu zánětu nebo infekce.
MT a metabolismus
MT je zapojen do metabolických procesů svou funkcí liganda Zn v buňce. Jako strukturální nebo katalytický element je součástí více než 300 enzymů. V syntéze apoenzymů ovlivňuje DNA stabilitu. Další funkcí MT je vliv na produkci energie vazbou APT na lyzinové zbytky v MT a na mitochondriální respiraci. ZnMT zvyšuje permeabilitu vnitřní mitochondriální membrány (17).
MT a protinádorová léčba
Předem indukovaný MT chrání tkáně před poškozením způsobeným gama zářením i chemoterapeutiky (např. cisplatina, doxorubicin, bleomycin, cyclophosphamidum). Sekvenací intracelulárního cDDP vazbou na MT se snižuje cytotoxicita. Zkoumá se možnost indukce MT ve zdravé tkáni u onkologických pacientů jako možného způsobu redukce toxických nežádoucích účinků chemoterapie (23, 24). Několik autorů potvrdilo experimentálně na buněčných liniích mechanismus chemorezistence transferem genu pro MT (25-28). Indukce syntézy MT se po radiační expozici liší v různých orgánech. Mechanismy působení rtg, gama i UV jsou pravděpodobně stejné. Ionizující záření působí cca v 10 % poškození DNA přímou absorpcí energie a uvolňováním uhlíkových a následně peroxidových a kyslíkových radikálů, které MT vychytává. Hydroxylové radikály, které působí poškození DNA v 90 %, jsou rovněž inaktivovány ZnMT. Indukce MT může být považována za jeden z mechanismů adaptace expozici radiace. Při vysoké jednorázové dávce (10 Gy) převažuje cytotoxický efekt, který MT neindukuje (2, 15).
MT a kancerogeneze
MT funguje jako intracelulární zásobárna a transportní médium v rámci metabolismu kovů. Během rychlého růstu a zvýšené metabolické aktivity je Zn nutný pro syntézu a metabolismus nukleových kyselin. Tato hypotéza je podpořena skutečností, že klidové buňky obsahují významně menší hladinu MT mRNA než buňky proliferující. Demonstrovat distribuci MT, korelující s proliferační aktivitou buněk, lze na příkladu kůže, kde je lokalizován v bazální a parabazální vrstvě (30). MT se považuje za protein závislý na buněčném cyklu a je pro jisté typy nádorů markerem proliferace exprimovaným v S fázi cyklu. Perinukleární lokalizace MT mRNA je důležitá pro protektivní funkci MT před poškozením DNA a apoptózou indukovanou externím stresem 31. ApoMT je v nenádorových buňkách nacházen pouze přechodně při deficitu Zn. V nádorových buňkách byl detekován trvale bez výraznějšího Zn deficitu. ApoMT může pravděpodobně vyvázáním Zn kontrolovat genovou expresi. Předpokládá se, že odstranění Zn z proteinů vázaných na DNA generuje volné radikály, a tím přispívá ke kancerogenezi (32). Dále může odebráním Zn dojít k inaktivaci p53 a k akceleraci buněčného růstu a životnosti buněk. Vztah MT k p53 byl studován na mnoha nádorech. Další cestou kontroly metabolismu může být interakce s poolem GSH/GSSG redoxního systému.
Změna exprese MT genu a intracelulární lokalizace MT vytváří předpoklad, že se jedná o produkt onkogeneze. MT má některé vlastnosti proteinů, např. alfa fetoprotein, který se fyziologicky exprimuje během prenatálního vývoje a později v jistých typech nádorů. Izoformy MT jsou v tkáních exprimovány specificky a mohou mít různé funkce. Změny v poměru izoforem mohou odrážet změny v proliferaci a diferenciaci jako následek metylace specifických genů. Specifická regulace lidského genu MT byla popsána na buněčných liniích a zdá se, že koreluje s metylací DNA a strukturou chromatinu, ale také s embryonálním základem nádorové tkáně (5).
Exprese u tumorů
Imunohistochemicky byla potvrzena exprese MT v různých typech nádorů, kde byla asociována buď s procesem kancerogeneze nebo s rezistencí na radio-či chemoterapii. Exprese MT v nádorových tkáních koreluje většinou s proliferační kapacitou buněk nebo s indukcí apoptózy. Recentní studie potvrzují, že modulace exprese MT může zajistit změnu rezistence k chemoterapeutikům (35). V následujícím přehledu jsou zmíněny literární odkazy na nejvýznamnější studie hodnotící imunohistochemicky expresi MT v nádorech různých typů a lokalizací (tab. 1).
Table 1. Přehled tkáňové exprese MT v nádorech. 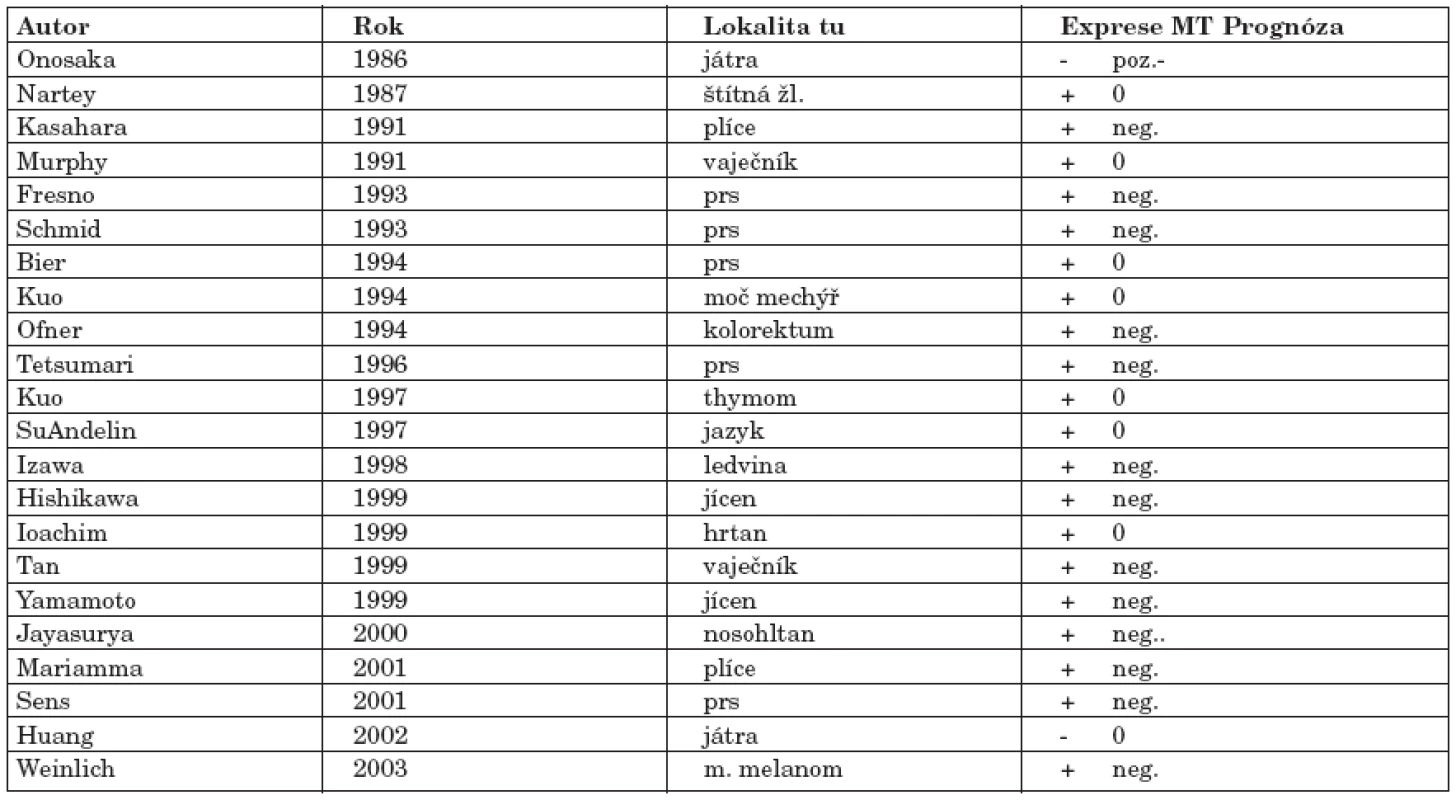
Tumory hlavy a krku
Sundelin studoval expresi MT v preparátech karcinomu jazyka. Ze vzorků zdravé sliznice bylo 5/5 pozitivních v reakci na MT. Na rozdíl od jiných antigenů, které jsou distribuovány rovnoměrně ve všech vrstvách epitelu, MT je lokalizován pouze v bazálních a parabazálních vrstvách. 22/24 karcinomů bylo v reakci na MT pozitivních. MT byl signifikantně zvýšeně exprimován v nádorové tkáni. Při porovnání exprese MT s klinickými a histologickými parametry nádoru nebyla odhalena jednoznačná korelace (24).
Ioachim ve své studii hodnotil expresi MT ve 44 spinocelulárních karcinomech hrtanu, 14 in situ karcinomech, 47 epiteliálních dysplázií, 11 papilomech a 21 keratozách. Nebyla patrná rozdílná exprese mezi karcinomy a karcinomy in situ, ale obě skupiny se lišily signifikantně od ostatních typů studovaných lézí. Výsledky naznačují možnou úlohu MT v kancerogenezi již od časných fází. V benigních lézích byla exprese MT lokalizována v bazálních vrstvách epitelu, kde je výrazná proliferační aktivita. Potvrdila se asociace MT s horší prognózou a agresivnějším chováním tumoru. MT reflektuje pravděpodobně dediferenciaci spojenou s reexpresí dříve suprimovaných vývojových proteinů. MT koreloval s p53 ve všech typech laryngeálních lézí (11).
Jayasurya se snažil objasnit vztah mezi expresí MT a hladinou Zn ve tkáni v souvislosti s buněčnou proliferací v nazofaryngálním karcinomu. Všechny karcinomy reagovaly pozitivně na MT. Při bližší analýze byla objektivizována absence MT v cytoplazmě (lokalizace MT výhradně v jádře u nádorových buněk). V normálním epitelu nosohltanu reagovala pozitivně na MT pouze bazální vrstva. MT inverzně koreloval s apoptotickým indexem nádorové tkáně (13).
Hishikawa analyzoval souvislost mezi expresí MT, prognózou a metastatickým potenciálem spinocelulárního karcinomu jícnu. Exprese MT byla signifikantně asociována s postižením uzlin a se vzdálenými metastázami. Parametry přežití u MT negativních pacientů byly signifikantně lepší než u MT pozitivních pacientů (10).
Yamamoto stanovoval MT a p53 na biopsiích 30 pacientů se spinocelulárním karcinomem jícnu, kteří byli léčeni chirurgicky po předchozí chemoradioterapii. Patologická odpověď tumoru korelovala s prognózou pacientů. Na základě dosažených výsledků může být MT považován za prognostický marker selektující pacienty s dobrou odpovědí na chemoradioterapii. MT-negativita verifikována jako nejlepší indikátor chemoradiosenzitivity (29).
Nartey sledoval reexpresi MT genů v tumorech štítné žlázy na preparátech normální i nádorové tkáně. MT byl zjištěn v 91 % zkoumaných nádorů a ve 20 % preparátů zdravé štítné žlázy. Potvrdil přítomnost MT v jádrech i cytoplazmě ve většině tumorů (19).
Kuo u thymomů sledoval overexpresi MT jako potenciální marker invazivity. Zkoumány byly preparáty neinvazivních, mikro i makro invazivních thymomů. Exprese MT se signifikantně lišila mezi třemi zmiňovanými skupinami na statisticky významné hladině. Nejsilnější, nikoli však výhradní, exprese byla zjištěna u invazivních typů (16).
TUMORY OSTATNÍCH LOKALIZACÍ
Tumory plic
Ve srovnání s okolní tkání byla zvýšena exprese MT u nádorů plic, přestože lze oprávněně přepokládat, že i v normální plicní tkání byla hladina MT ovlivněna abusem cigaret. Mariamma retrospektivně hodnotil expresi MT v tkáni z biopsie z malobuněčného karcinomu plic před léčbou. Sledované parametry byly porovnány s klinickými výsledky přežití pacientů. Byla nalezena silná inverzní korelace se stadiem a přežitím (18).
Kasahara potvrdil korelaci overexprese MT s rezistencí k cisplatině. Tyto poznatky ukázaly roli MT jako nezávislého negativního prediktivního markeru a současně nadějnou možnost k selekci chemorezistentních tumorů (14).
Tumory prsu
Overexprese MT byla zjišťována imunohistochemicky v normální prsní tkáni, v různých benigních, preinvazivních a maligních lézích. V normální tkáni byl MT přítomen v myoepiteliálních buňkách, zatímco většina luminálních buněk byla negativních. Karcinomy in situ a invazivní duktální karcinomy reagovaly pozitivně ve více než 50 % (4). V případě karcinomů pozitivně reagovalo 44 % nádorů, vždy se jednalo o invazivní duktální karcinomy. Exprese MT korelovala s kratším intervalem přežití. Nebyla potvrzena souvislost s metastatickým potenciálem nebo velikostí tumoru na statisticky významné úrovni (8).
Schmid naopak potvrdil souvislost overexprese MT s horší prognózou a vyšším metastatickým potenciálem nádoru. Potvrzena byla také souvislost MT s rezistencí k chemoterapii (22).
Tumory ovaria
Tan ve své studii hodnotil expresi MT u benigních, hraničních i maligních ovariálních nádorů. Signifikantně vyšší byla exprese u karcinomů, nejvyšší ve vícevrstevném epitelu karcinomů. Exprese MT korelovala s histologickým gradingem a byla asociována s horší prognózou pacientů.(25).
Tumory kůže
MT funguje jako endogenní protektivní faktor proti chemickému stresu nebo UV radiaci a karcerogenezi. MT hladina korelovala s progresí epidermální hyperplázie. U bazaliomů overexprese souhlasila s infiltrativním růstem. Overexprese MT dominovala v izolovaným skupinách buněk zejména u fibroblastů a v místech intenzivního zánětu. U spinaliomů intenzita převyšovala bazaliomy.
Weinlich v prospektivní studii hodnotil 520 pacientů s primárním kožním maligním melanomem imunohistochemicky. MT - pozitivní tumory byly asociovány s progresí onemocnění a sníženými parametry přežití. V univariantní i multivariantní analýze spolu s dalšími prognostickými faktory (Breslowova klasifikace) prokázal, že overexprese MT je nezávislý negativní prognostický faktor (28).
Tumory kolorekta
Ofner sledoval imunohistochemicky MT I a II u 109 kolorektálních adenokarcinomů. Rozdíly v expresi MT statisticky významně korelovaly se stagingem (Dukova klasifikace) a postižením LU v době operace. Na rozdíl do mnoha jiných studií byla v tomto případě pozitivita MT asociována s příznivou prognózou pacientů (20).
Tumory ledvin
MT exprimovaný v renálních karcinomech byl většinou asociován s agresivnějším růstem a horší prognózou. Izawa potvrdil signifikantně významný inverzní vztah gradingu a intenzity MT exprese (12).
Tumory jater
V případě zdravé i maligně transformované hepatální tkáně byly v několika recentních studiích zaznamenány inverzní výsledky ve srovnání s nádory ostatních lokalizací. V hepatocelulárním karcinomu silně pozitivně reagovaly nenádorové hepatocyty. Intenzivní exprese MT u nenádorových cirhotických nodulů v hepatocelulárním karcinomu a nízká exprese v cirhotických nenádorových játrech naznačuje vztah k maligní transformaci hepatocytů. Onosaka a další potvrdili signifikantně vyšší MT ve zdravých játrech klesající při nádorové transformaci (21) (tab. 1).
ZÁVĚR
MT je nízkomolekulární ubikvitně přítomný intracelulární protein. Jeho molekula má jedinečnou strukturu s vysokým obsahem SH skupin umožňujících vazbu atomů kovů. V organismu se vyskytuje v několika izoformách. Indukována je jeho exprese mnoha fyziologickými i patologickými impulzy. Mezi základní funkce patří především podíl na udržování homeostázy Zn, detoxikaci těžkých kovů a ochrana před oxidativním stresem.
Recentní výzkumy ukazují na významnou asociaci MT s kancerogenezí. Zvýšená exprese MT byla imunohistochemicky verifikována u mnoha rozličných typů nádorů. V některých případech korelovala s histologickými nebo biologickými charakteristikami tumorů a predikovala jejich biologické chování.
Došlo 13. 11. 2007
MUDr. Zuzana Horáková
KOCHHK LF MU a FN U sv. Anny
Pekařská 53
659 91Brno
e-mail: zuzana.horakova@fnusa.cz
Sources
1. Andrews, G.: Regulation of metallothionein gene expression by oxidative stress and metal ions. Biochemical pharmacology, 59, 2000, s. 95-104.
2. Bakka, A., Endresen, L., Johnsen, A., Edminson, P., Rugstad, H.: Resistance against cis dichlorodiammineplatinum in cultured cells with a high content of metallothionein toxicology and applied pharmacology. Archives of Biochemistry and Biophysics, 23, 1981, s. 215-226.
3. Brady, F. O.: The physiological function of metallothionein. Biochemical Press , 33, 1982, s. 143-145.
4. Bier, B., Douglas Jones, A., Totsch, M. et al.: Immunohistochemical demonstration of metallothionein in normal human breast tissue and benign and malignant breast lesions. Breast Cancer Research and Treatment, 30, 1994, s. 213-221.
5. Cherian, M., Howell, S., Imura, N., Klaassen, C. et al.: Role of metallothionein in carcinogensis. Toxikology and Splied Pharmacology, 126, 1994, s. 1-5.
6. Coyle, P., Philcox, J., Carey, L., Roge, A.: Metallothionein: The multipurpose protein. Cell Mol Life Sci, 59, 2002, s. 627-647.
7. Dunn, M. A., Blalock, T. L., Cousins, R. J.: Metallothionein, minireview. Proceedings of the Society for Experimental Biology and Medicine, 185, 1987, s. 107-119.
8. Fresno, M., Wu, W., Rodriguez, J., Nadji, M.: Localization of metallothionein in breast carcinomas. Virchows Archiv. Pathol. Anat., 423, 1993, s. 215-219.
9. Haq, F., Mahoney, M., Koropatnick, J.: Signaling events for metallothionein induction. Mutation research , 533, 2001, s. 211-226.
10. Hishikawa, Y., Koji, T., Dhar, D. K., Kinugasa, S., Yamaguchi, M., Nagasue, N.: Metallothionein expression correlates with metastatic and proliferative potential in squamous cell carcinoma of the oesophagus. British Journal of Cancor, 81, 1999, s. 712-720.
11. Ioachim, E., Assimakupoulos, D., Peschos, D., Zissi, A., Skevas, A. Agnantis, N.: Immunohistochemical expression of metallothionein in benign premalignant and malignant epithelium of the larynx. Pathol. Res. Pract., 195, 1999, s. 809-814.
12. Izawa, J., Moussa, M., Cherian, G., Doig, G., Chin, J.: Metallothionein expression in renal cancer. Urology, 52, 1998, s. 767-772.
13. Jayasurya, A., Bay, B., Yap, W., Tan, N., Tan, B.: Proliferative potential in nasopharyngeal carcinoma carcinogenesis, 21, 2000, s. 1809-1812.
14. Kasahara, K., Fujiwara, Y., Nishio, K., Ohmori, T. et al.: Metallothionein content correlates with the sensitivity of human small cell lung cancer cell lines to cisplatin. Cancer Research, 51, 1991, s. 3237-3242.
15. Kelley, S., Basu, A., Teicher, B., Hacker, M., Hamer, M., Lazo, J.: Overexpression of metallothionein confers resistance to anticancer drug. Science, 241, 1988, s. 813-1815.
16. Kuo, T.: Immunohistochemical metallothionein expression in thymoma. Histopathology, 30, 1997, s. 243-248.
17. Li, Y.: Zinc sensing mechanism involves linker peptides between the zinc fingers. Mol. Cell Biol., 26, 2006, s. 5580-5587.
18. Mariamma, J., Diponkar, B., Kocha,W. et al.: Metallothionein expression in patients with small cell carcinoma of the lung. Cancor, 92, 2001, s. 836-842.
19. Nartey, N., Cherian, M.. Banerjee, D.: Immunohistochemical localization of metallothionein in human thyroid tumors. Am. J. Pathol., 29, 1987, s. 177-182.
20. Ofner, D., Maier, H., Riedmann, B., Bammer, T.: Immunohistochemical metallothionein expression in colorectal adenocarcinoma. Virchows Archiv, 425, 1994, s. 491-497.
21. Onosaka, S., Min, K., Fukuhara, C., Tanaka, K.: Concentrations of metallothionein and metals in malignant and non malignant tissues in human liver. Toxikology, 38, 1986, s. 261-268.
22. Schmid, K., Ellis, I., Gee, J., Darke, B. et al.: Presence and possible significance of immunocytochemically demonstrable metallothionein overepression in primary invasive ductal carcinoma of the brest. Virchows Arch. Pathol. Anat., 422, 1993, s. 153-159.
23. Stennard, F., Holloway, A., Hamilton, J., West, A.: Characterisation of six additional human metallothionein genes. Biochimica et Biophysica Acta, 12, 1994, 18, s. 357-365.
24. Sundelin, K., Jadner, M., Norberg-Spaak, L., Davidsson, A., Hellguist, H.: Metallothionein and Fas are expressed in squamous cell carcinoma of the tongue. Eur J. Cancer, 33, 1997, s. 1860-1864.
25. Tan, Y., Sinniah, R., Bay, B., Singh, G.: Metallothionein expression and nuclear size in benign, bordeline and malignant serous ovarian tumours. Journal of Patology, 189, 1999, s. 60-65.
26. Theocharis, S., Margeli, A., Klijanienko, J., Kouraklis, G.: Metallothionein expression in human neoplasia histopathology, 45, 2004, s. 103-118.
27. Viarengo, A., Burlando, B., Ceratto, N., Panfoli, I.: Antioxidant role of metallothioneins a comparative overview. Cellular and Molecular Biology, 46, 2000, s. 407-417.
28 Weinlich, G., Bitterlich, W., Mayer, V., Fritsch, P., Zelger, B.: Metallothionein overexpression as a prognostic factor for progression and survival in melanoma. British Journal of Dermatology, 149, 2003, s. 535-541.
29. Yamamoto, M., Tsujinaka, T., Shiozaki, H., Doki, Y. et al.: Metallothionein expression correlates with the pathological response of patients with esophageal cancer undergoing preoperative chemoradiation therapy. Oncology, 56, 1999, s. 332-336.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2008 Issue 2-
All articles in this issue
- Metalothionein a jeho obecný význam v kancerogenezi – 1. část
- Význam elevace hladin metalothioneinu v krvi u pacientů s nádory hlavy a krku – 2. část
- Hirudoterapia v rekonštrukčnej chirurgii hlavy a krku - naše prvé skúsenosti
- Fibrózní dysplázie a cholesteatom
- Diferenciální diagnostika expanzivních procesů dětského věku v ORL oblasti
- Chirurgická liečba tumorov priušnej žľazy v súbore Kliniky ORL a chirurgie hlavy a krku ÚVN v Ružomberku v rokoch 1995 – 2006
- Výsledky léčby pacientů s nediferencovaným karcinomem štítné žlázy
- Beta defensiny 2 a 3 ve sliznici nosních polypů u nemocných s chronickou rinosinusitidou s nosními polypy a s kultivačním nálezem – Staphylococcus aureus na nosní sliznici
- Spontánní tympanoplastiky - padesát roků od jejich poznání
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chirurgická liečba tumorov priušnej žľazy v súbore Kliniky ORL a chirurgie hlavy a krku ÚVN v Ružomberku v rokoch 1995 – 2006
- Fibrózní dysplázie a cholesteatom
- Hirudoterapia v rekonštrukčnej chirurgii hlavy a krku - naše prvé skúsenosti
- Diferenciální diagnostika expanzivních procesů dětského věku v ORL oblasti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


