-
Medical journals
- Career
Význam hyperbarické oxygenoterapie v léčbě nehojících se defektů
Authors: J. Zapletalová
Authors‘ workplace: IV. interní klinika VFN a 1. LF, Praha, přednosta Prof. MUDr. Aleš Žák, DrSc.
Published in: Pracov. Lék., 59, 2007, No. 1-2, s. 46-51.
Category: Review article
Overview
Autorka podává přehled léčebných účinků inhalace 100% kyslíku v přetlakové komoře při léčbě pacientů s chronickým, nehojícím se defektem. Zdůrazňuje schopnosti 100% O₂ dýchaného v tlaku 2,6 ATA při léčbě těchto defektů: nejen hyperoxygenace (100% vazbu na hemoglobin /Hgb/ a schopnost rozpouštění kyslíku v plazmě), ale též schopnost difundovat do okolí kapiláry, podporovat tvorbu granulační tkáně, stimulovat syntézu kolagenu, epitelu a tím tvorbu jizvy. Kyslík (O₂) v absolutním tlaku 2,5–3 ATA působí bakteriostaticky až baktericidně na některé typy bakterií, a tím přispívá k léčbě infekce, která je v každé chronické ráně zákonitě přítomna. Je zdůrazněn význam vyšetření transkutánní oxymetrie (TcpO₂) – jeho hodnota pro posuzování prognózy – a současně úspěšnosti léčby hyperbarickou oxygenoterapií (HBO). Podává přehled nejčastějších příčin chronických, nehojících se defektů a současně stoupající počet pacientů léčených HBO jako adjuvantní metodou pro osteomyelitidu či osteoradionekrózu.
Mnoho nehojících se defektů je hypoxických s tenzí kyslíku od 5–15 mm Hg. V takových případech je normální hojení defektu problematické – až žádné, neboť fagocytující schopnost leukocytů je snížena a jsou ochromeny další parametry, k hojení rány nezbytné. Přídatné použití 100% kyslíku v absolutním tlaku 2,5–3,0 ATA k základní klasické komplexní léčbě (medikamentózní, lokální, včetně chirurgické) pomocí HBO může pomoci (a jeví se jako nezbytné v nastartování hojivé fáze) až k úplnému zhojení defektu. Ukazuje se, že pokud pacienti mají základní TcpO₂ pod 30 mm Hg, nedochází ke zlepšení, respektive zhojení defektu u všech, ale pouze u určitého procenta. Mají-li TcpO₂ nad 50–100 mm Hg, zhojí se rány u všech pacientů léčených v HBO. Hojení rány však ovlivňují další faktory, v práci uvedené. Je zdůrazněna nutnost komplexní léčby – a stále stoupající významnost HBO jako adjuvantní terapie při hojení chronických defektů.Klíčová slova:
chronické kožní defekty, osteoradionekróza, osteomyelitidaÚvod
Hojení rány je komplexní proces, zahrnující mnohonásobné, vzájemně na sebe působící buněčné typy a biochemické mediátory. Tkáňové poškození přitahuje destičky a fibrin do místa rány, makrofágy, fibroblasty, buňky hladkého svalstva a endoteliální buňky následují. Tato organizovaná spolupráce [13], interakce a produkce cytokinů stimuluje buněčný růst [11]. Následuje angiogeneze a produkce kolagenu. Makrofágy fagocytují mrtvou a znečištěnou tkáň a defekt se začíná vyplňovat novými granulacemi, což je významné a nezbytné ke konečnému zhojení rány [1, 10, 13].
Role kyslíku v hojící se ráně
Kyslík je nezbytností pro výživu rány a hraje důležitou roli při obnově nové kůže [2, 10]. Kyslík je nezbytnou potřebou pro hydroxylaci prolinu a lysinu, je nezbytný pro propustnost – uvolnění kolagenu od fibroblastů a jeho inkorporaci do hojícího se lůžka rány. Lokální hypoxie [9] je nevyhnutelným výsledkem tkáňového poranění: nedostatečná perfuze rány – tedy závislost na angiogenezi [3, 13], hypoxie a vysoká hladina laktátu ve tkáni – brání pak úspěšnému hojení.
Patofyziologie nehojící se rány
Chronická – nehojící se – rána je definována jako defekt, u kterého nedochází ke zhojení v určitém „rozumném“ období, který nereaguje na standardní chirurgické a další klasické léčebné postupy. Bez ohledu na etiologii je jejich společným znakem porucha tepenného prokrvení a přítomnost infekce [4, 5, 9]. Většina takových defektů má souvislost s přítomnou hypoxií a ischémií. Hypoxie narušuje syntézu kolagenu a růst kolagenní trámčiny. Když je tenze kyslíku kolem 10 mm Hg, fibroblasty se řádně „nestěhují“ – nejsou již schopny se hojivého procesu zúčastnit. Anoxie – řídí akumulaci metabolitů jako je amoniak (příčina otoku buněk) a tímto narušuje rovněž hojení. Hypoxie – může aktivovat enzymy, které syntetizují kolagen. Tento paradox je částečně vysvětlován pozorováním syntézy kolagenu, dvojnásobnou elevací laktázy (5–15mmol/l), která negativně působí vedle hypoxie. Zvýšená koncentrace laktátu a posun pH k nižším hodnotám, vysoká koncentrace amoniaku a zvýšený počet cytokinů jsou též příčinou algických stavů [6, 7]. Podaří-li se tkáňový pO2 zvýšit na 40 mm Hg, produkce kolagenu stoupne rovněž.
Rány v ischemickém terénu jsou vysoce vnímavé k infekci, což je známá interference s hojením rány. Společnou vlastností nehojící se rány je tkáňová hypoxie, což bylo potvrzeno řadou renomovaných zahraničních studií. Míra problému je klinicky definována úměrou stupně hypoxie [14]. Ischémie je společnou příčinou nehojícího se defektu, ale ischémie a hypoxie není totéž. Ischemická rána je obvykle hypoxická, ale ne všechny hypoxické rány jsou ischemické. Defekt s adekvátní perfuzí může být relativně hypoxický, neboť infekce v ráně počítá s větším nárokem na kyslík [8].
Vlastní pozorování
Na našem oddělení hyperbarické oxygenoterapie léčíme pacienty s různými indikacemi – viz přehled za posledních 7 let (tab. 1), které byly schváleny Lillským evropským kongresem HBO v r. 1994. Léčba HBO probíhá denně, 5 dní v týdnu (s výjimkou víkendu): pacienti jsou umístěni v dvoumístné přetlakové komoře (obr. 1) plněné vzduchem a dýchají 100% kyslík za pomoci plicní automatiky z masky pod tlakem 2,6 ATA po dobu 90 minut izokomprese. Komprese do příslušného léčebného tlaku trvá cca 15 minut, podle schopnosti pacientů vyrovnávat tlak ve středouší. Během dekomprese provádíme preventivní dekompresní zastávky ve 3 a 6 metrech (tj. v 1,6 a 1,3 ATA) 5 minut. Od pacienta vyžadujeme doporučení k léčbě HBO od indikujícího lékaře,vyšetření ORL (ušní bubínky, vyloučení orofaciální infekce), převlečení do komory z čisté bavlny a souhlas s léčbou. Je nutné rovněž vyloučit nečetné kontraindikace: klaustrofobii, neléčenou thyreotoxikózu, febrilní stav nad 38 °C, pneumothorax, globální respirační insuficienci atd. Je nutno též zvážit relativní kontraindikace, mezi nejčastější patří zánět horních cest dýchacích (v těchto případech léčbu přerušujeme do vyléčení infektu), záchvatovité onemocnění v anamnéze (dobře léčená epilepsie, pokud je pacient rok bez záchvatu není kontraindikací k léčbě).
Table 1. Přehled vybraných diagnóz a počet pacientů v letech 2000–2006 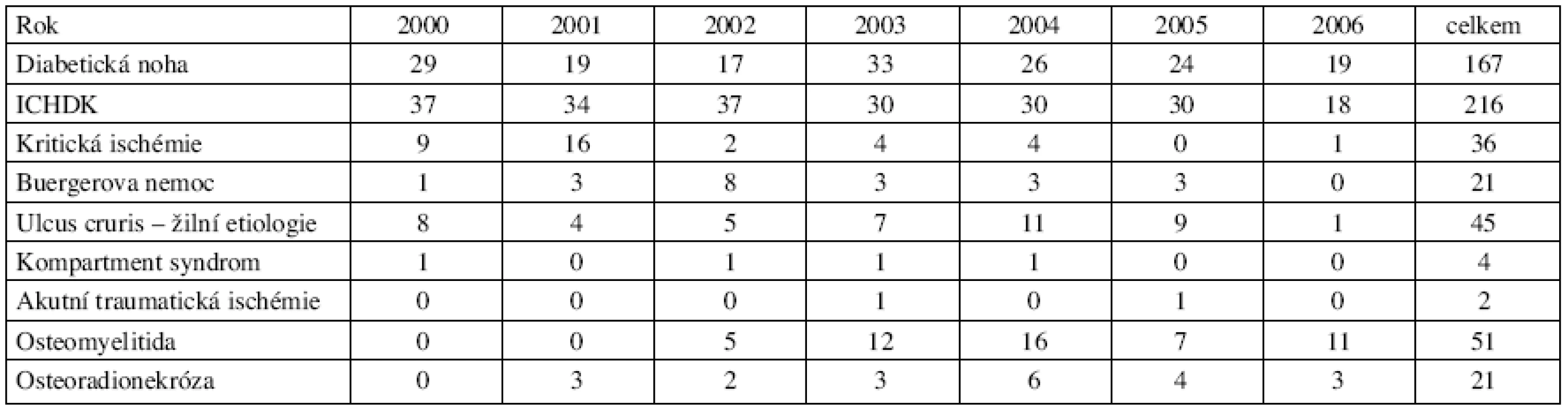
Image 1. Dvoumístná hyperbarická komora 
Vzhledem k charakteru našeho oddělení jsou k léčbě HBO indikování hlavně chronicky nemocní pacienti, především s nehojícími se defekty různé etiologie, zvláště defekty při diabetické noze, defekty při ischemické chorobě dolních končetin, nehojící se defekty po nutných amputacích, torpidní, nehojící se ulcus cruris při pokročilé venózní insuficienci, i defekty smíšené etiologie – arteriální, venózní, neuropatické. I podle renomovaných zahraničních publikací je zřejmé, že etiologie chronické rány se liší, ale nejčastější jsou čtyři hlavní typy nehojících se ran:
1. Diabetes mellitus
(obr. 2, 3) je nejčastější příčinou chronické, nehojící se rány v západních průmyslových zemích. Tato komplikace diabetu souvisí významně s mortalitou a morbiditou [13], nemluvě o četných amputacích. Např. ve Velké Británii je postiženo diabetem 2 % populace (u nás 8 %), 15 % z tohoto počtu má komplikaci v nehojícím se defektu na noze („diabetická noha“). V úspěchu léčby HBO při této diagnóze je zdůrazněna stoupající fibroblastická aktivita, neoangiogeneze, antibakteriální efekt a zvýšená antibiotická aktivita [8, 18, 19]. V případě diabetické nohy má HBO pozitivní efekt i u neischemického chronického defektu a neuropatického defektu [20], a téměř o třetinu snižuje počet vysokých amputací. Faktory ovlivňující hojení ulcerací u nejčastěji se vyskytujícího diabetického defektu jsou: typ a doba trvání diabetu – jeho léčba (hladina glykosylovaného Hb), další diabetické komplikace (diabetická retinopatie, nefropatie, polyneuropatie), přítomnost senzorické neuropatie, kouření, věk, stupeň ulcerózních změn a jejich lokalizace, počínající infekce, frekvence opakovaných infekcí, plazmatická koncentrace vitaminů, nutriční faktory, hematokrit a počet leukocytů, kreatinin, dusík urey v séru, lokální hypoxie – měření TcpO2 a TcpCO2 – čili přímé měření lokální kožní perfuze v okolí rány, pomocí transkutánní oximetrie.
Image 2. Diabetická noha před 1. expozicí HBO 
Image 3. Diabetická noha po absolvování 90 expozic HBO 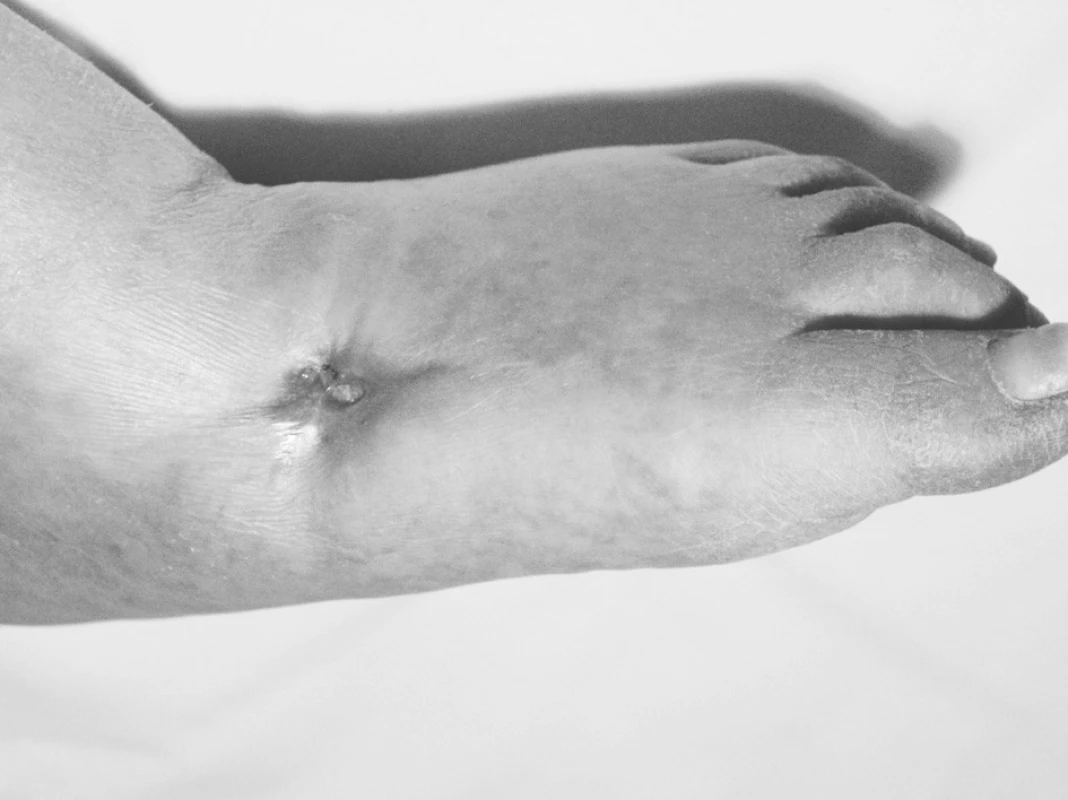
2. Arteriální etiologie
– u ischemické choroby dolních končetin vyššího stupně (ICHDK) při celkové ateroskleróze – má až 25 % defektů tuto etiologii (obr. 4, 5). Velmi významným přitěžujícím faktorem je dlouhodobé kouření – abúzus nikotinu, zřejmý nedostatek pohybu a hyperlipidemie. Adjuvantní léčba HBO je významnou součástí celkové, komplexní léčby. Prioritní je zprůchodnění tepen dolních končetin podle výsledků arteriografie (pokud je to možné): chirurgickou cestou nebo invazivním angiologickým postupem (PTA, stenty, atd.). Velmi často při možnosti zprůchodnění kratších stenóz tepen (do 10 cm), ale i delších úseků na velkých tepnách, dojde ke zlepšení, ale při mizivém nálezu na periferii nohy, kde jsou patrny jen „trosky“ tepen a není možnost odtoku, ke zhojení defektu nedochází. U těchto pokročilých stadií onemocnění – jak u diabetické nohy, tak u defektů při ICHDK, se uplatňuje schopnost HBO – 100% vazba kyslíku na hemoglobin, rozpouštění kyslíku v plazmě (6,7 ml/100 ml), rovněž (v příslušném léčebném tlaku 2,5–3 ATA) difuze O2 do okolí kapiláry a tím do ischemické tkáně. Nutno zdůraznit opakovaný počet 60–90minutových expozic HBO (na našem pracovišti 90minutových) – v 1. sérii nejméně 30krát. Předpokladem úspěchu léčby – jak již bylo výše řečeno – je výše (hladina) transkutánně změřeného kyslíku (TcpO2) v těsné blízkosti defektu (30 mm Hg a výše), dostatečný počet expozic HBO, až pedantsky přísné a pečlivé lokální ošetřování rány, antibiotika, eventuálně vazodilatační terapie, kompenzace diabetu u diabetiků, samozřejmě stop kouření, pokud možno snížení hmotnosti u obézních a zvýšená pohybová aktivita (chůze). Pokud je pacient fyzicky limitován v pohybové aktivitě pro svůj zdravotní stav, je vhodné alespoň cvičení ve stoje (zvláště výstupy na špičky jsou účinné, opakovaně v menších sériích během dne), nebo alespoň vsedě – cvičení v hlezenních kloubech (rotace a zvláště dorzální flexe). Pacient by měl být poučen o důležitosti fyzické aktivity a motivován k vlastní aktivní spolupráci při léčbě.
Image 4. ICHDK před 1. expozicí HBO 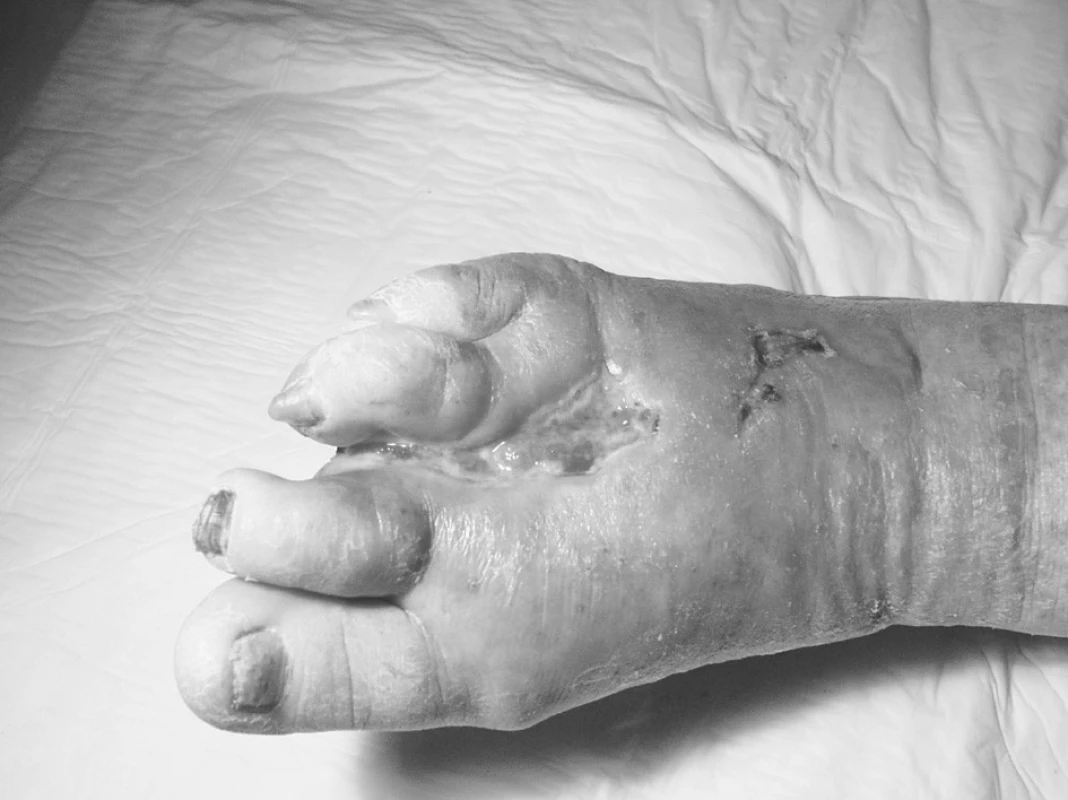
Image 5. ICHDK po 28 expozicích HBO 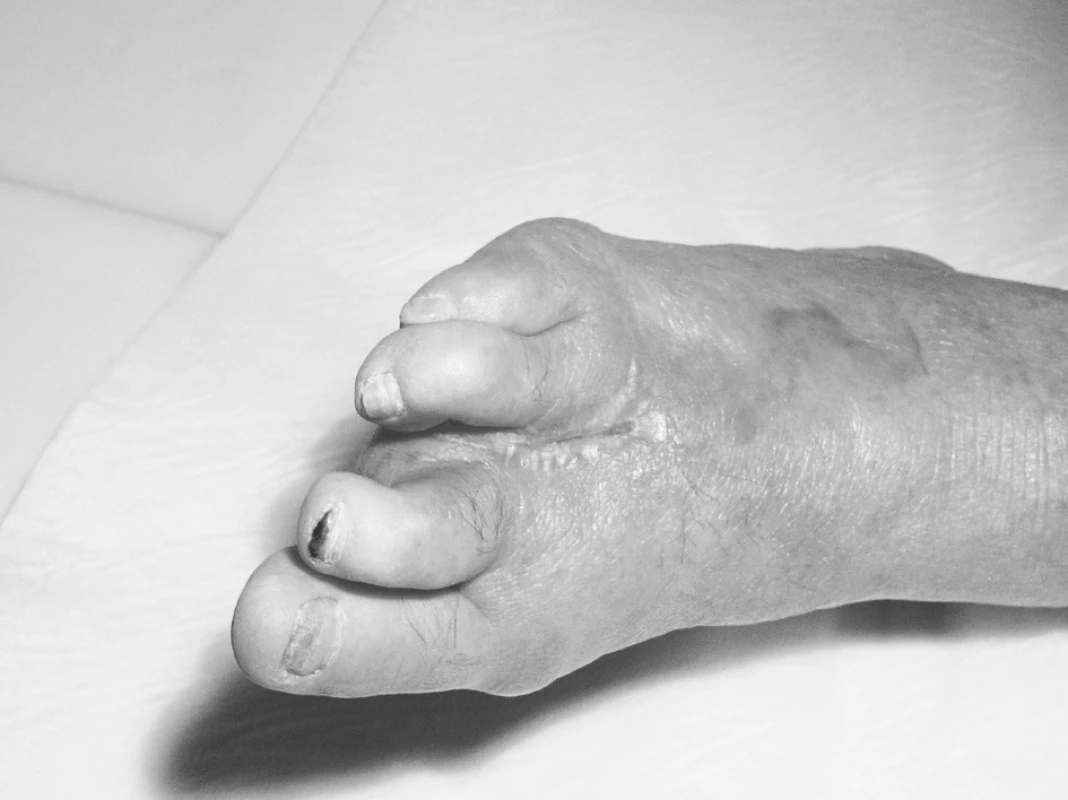
3. Ulcus cruris
(obr. 6, 7) – venózní nebo smíšené etiologie je velmi obtížně hojitelný defekt, vyžadující velkou dávku trpělivosti ze strany lékaře, ošetřujících sester i pacienta. Jedná se opět o chronický defekt – a jedno vyhojení neznamená, že nevznikne recidiva. Podkladem pro to zůstává chronická žilní insuficience i další chronické onemocnění – ICHDK. U většiny pacientů je dalším zatěžujícím faktorem obezita a nedostatek pohybu. Léčba opět musí být komplexní a dlouhodobá a úspěchy se snadněji dostavují při dobré spolupráci pacienta. Z našich zkušeností vyplývá, že pacient po zhojení defektu často přestane dodržovat doporučená opatření (dlouhé stání, sezení s nohama dole, nedostatečná nebo žádná péče o zhojený defekt, nedostatek pohybu). Dochází k recidivám, eventuálně ke vzniku tzv. lahvovité nohy. Efekt HBO při této diagnóze je možný při opakovaných expozicích a sériích HBO. Rozsáhlý (i menší defekt), zvláště defekt hojně secernující, vyžaduje většinou více než 30 expozic (60–90 i více). HBO pozitivně působí na přítomnou infekci, která je zákonitě v každé chronické ráně přítomna [4, 5, 9]. Vazokonstrikce je další základní efekt hyperbarické oxygenoterapie [13, 21]. Sice redukuje krevní průtok, ale hyperoxidační schopnost HBO adekvátně kompenzuje tento zpomalený krevní průtok – a čistý efekt je zlepšení tkáňově oxygenace. Vazokonstrikce je překážkou vzniku edému a má pozitivní efekt na krevní průtok v mikrocirkulaci [21]. Tyto základní schopnosti léčby hyperbarickou oxygenoterapií – vazokonstrikce, vysoké sycení krve kyslíkem jak 100% vazbou na hemoglobin, tak schopností rozpouštět se v plazmě, schopnost difundovat do okolí kapiláry do ischemické tkáně – jsou prioritou této léčebné metody. Byly však léčeny i defekty jiné etiologie.
Image 6. Ulcus cruris před 1. expozicí HBO 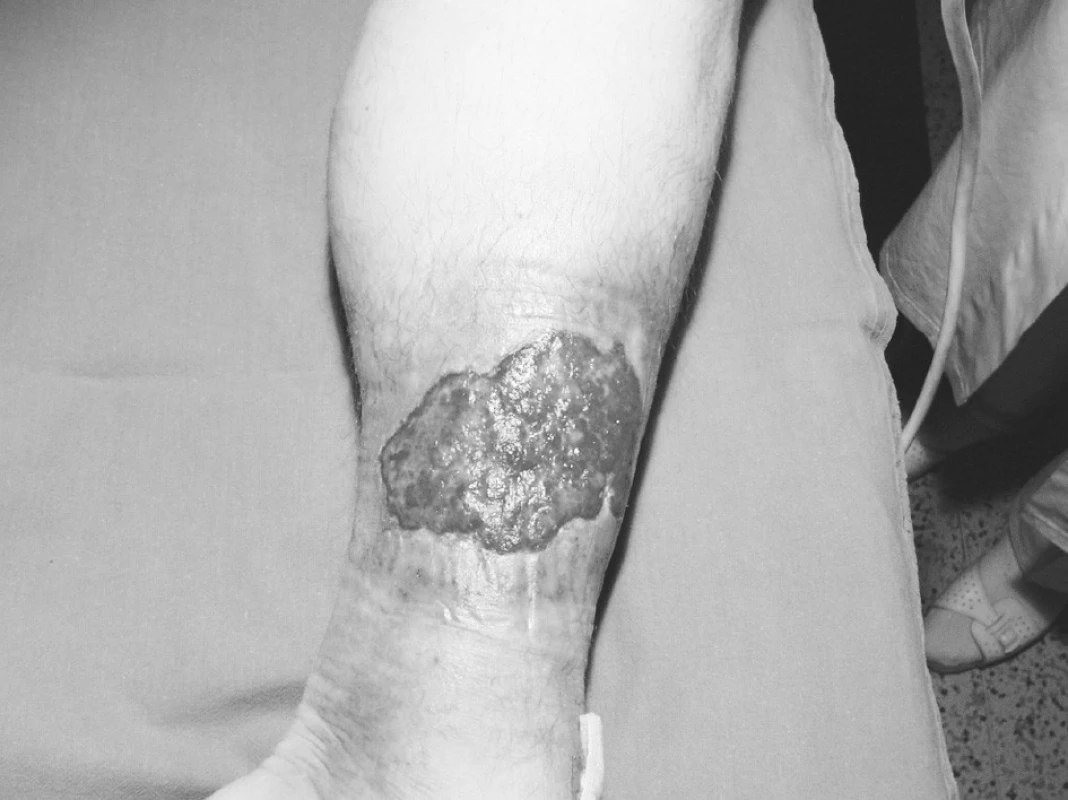
Image 7. Ulcus cruris po 118 expozicích HBO 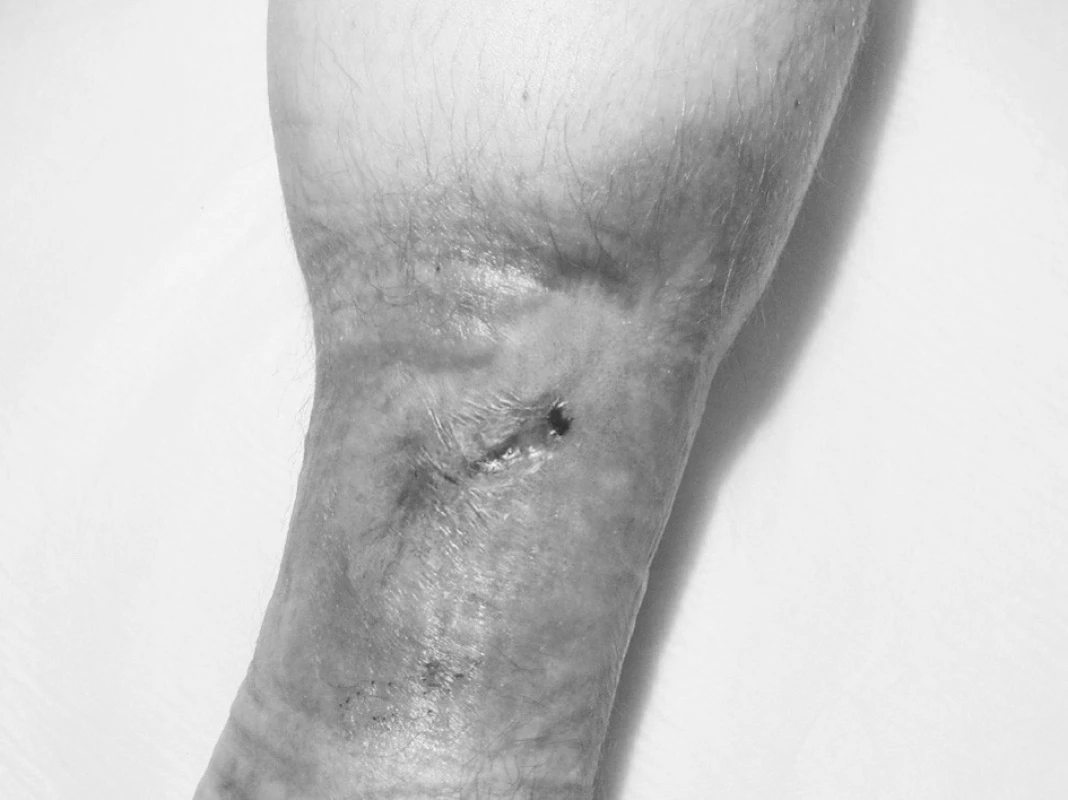
4. Nehojící se pooperační defekty
(obr. 8, 9) u pacientů polymorbidních a metabolicky komplikovaných, tlakové defekty – dekubity převážně u pacientů vyššího věku, imobilních, kde rovněž malnutrici nutno považovat za rizikový faktor [22]. V určitém procentu jsou rovněž léčení pacienti s vaskulitidou různé etiologie, s postižením často i horních končetin. V poslední době přibývá pacientů indikovaných ze stomatologie s osteoradionekrózou mandibuly po ozáření tumoru v orofaciální oblasti [23, 24]. Při nevyhnutelné extrakci zubu v těchto případech je nejlépe podat předoperačně 20–30 expozic HBO lkrát denně po 5–6 týdnů (25–30 expozic HBO). Pooperačně by měl být pacient léčen HBO 1krát denně po dalších 10 dnů. Lze tak zabránit vzniku osteoradionekrózy v cca 92 % případů. V našich zemích však tato praxe není zcela běžná. Další indikací ze stomatologie jsou osteomyelitidy různé etiologie, nejčastěji jako komplikace po extrakci zubu. Jak je však zřejmé z dostupných informací [26], není dosud jednotný názor, při jakém atmosférickém tlaku by byla léčba nejúčinnější, neexistuje jednotný protokol a nejsou publikovány randomizované, dvojitě slepé studie při postradiačním postižení v orofaciální oblasti, zřejmě pro nižší soubor pacientů. Na jednotlivých případech pak zřetelně pozitivní efekt adjuvantní léčby HBO lze prezentovat.
Image 8. Stav po laparotomii pro karcinom rekta před 1. expozicí HBO 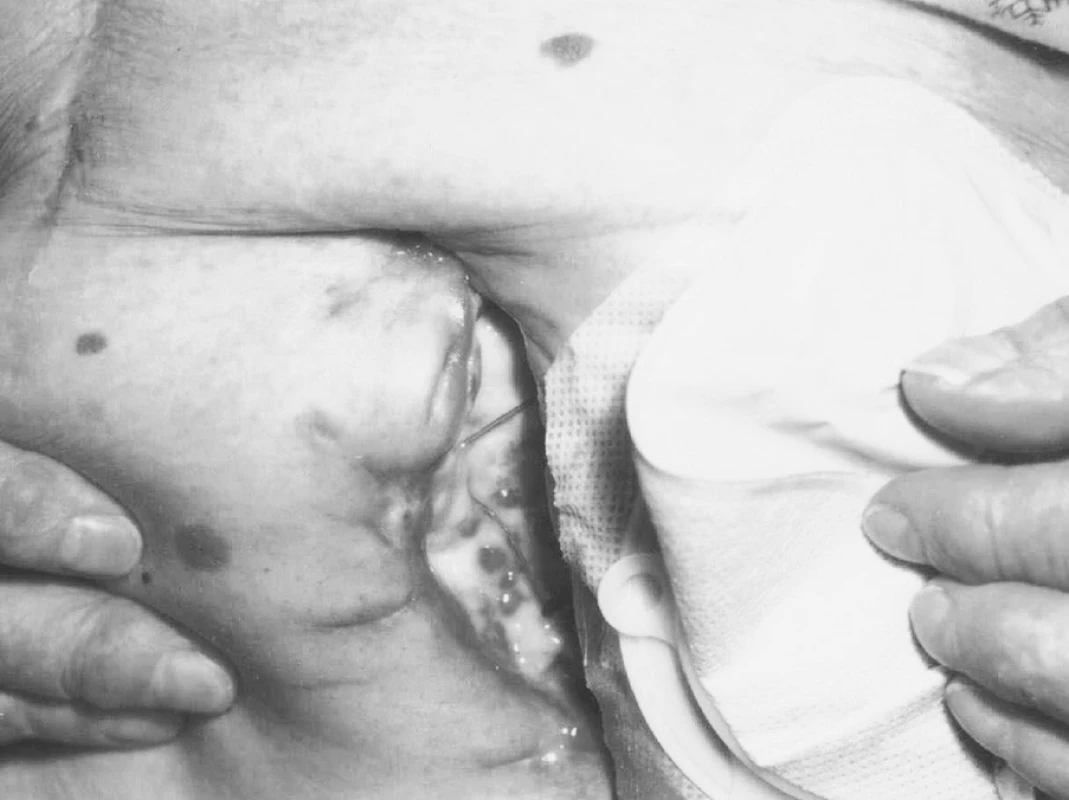
Image 9. Stav po laparotomii pro karcinom rekta po 58 expozicích HBO 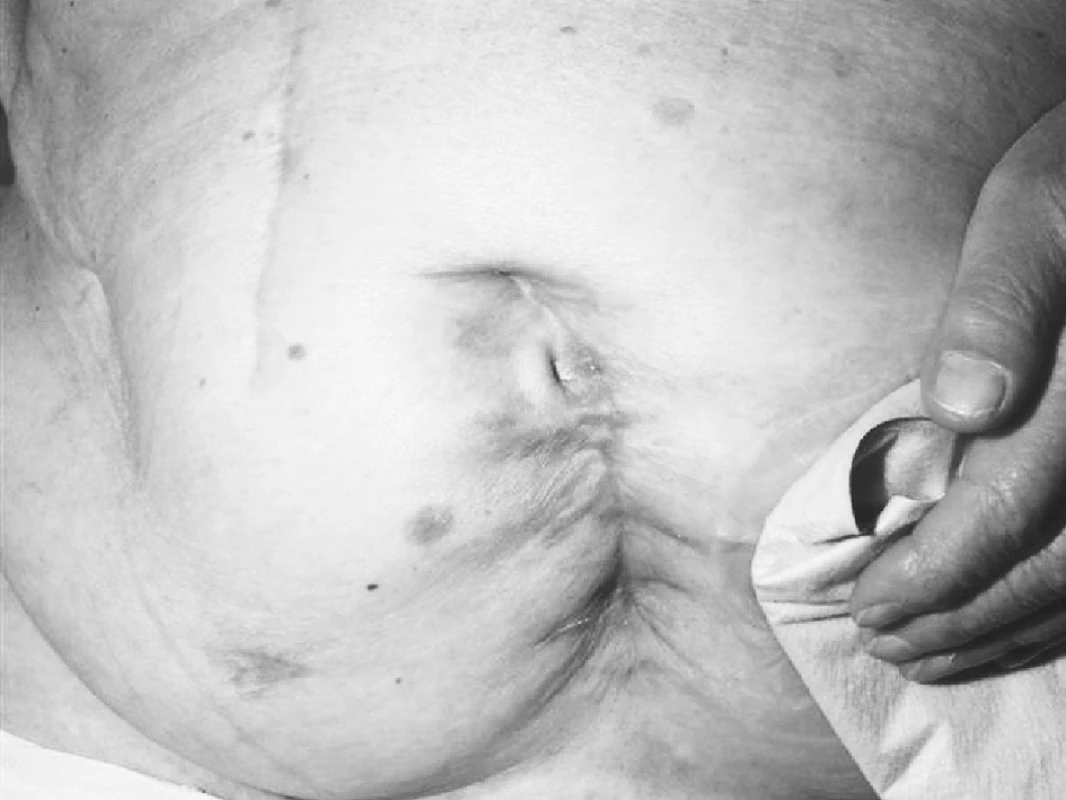
Hyperbarická oxygenoterapie ve všech výše uvedených případech působí jako významná podpůrná léčba, při základní – a to je nutné zdůraznit – komplexní terapii.
U hypoxického defektu je významná souvislost se stupněm hypoxie a výsledky dobře korelují s hladinou transkutánně změřeného O2 v místě defektu. Již Pecorraro v r. 1988 uvádí možné hladiny TcpO2 v závislosti měření na vzduchu, 100 % vdechovaného kyslíku na vzduchu a 100 % vdechovaného kyslíku pod tlakem 1–2,5 ATA (tab. 2).
Table 2. Hodnoty tenze tkáňového kyslíku ve srovnání s HBO 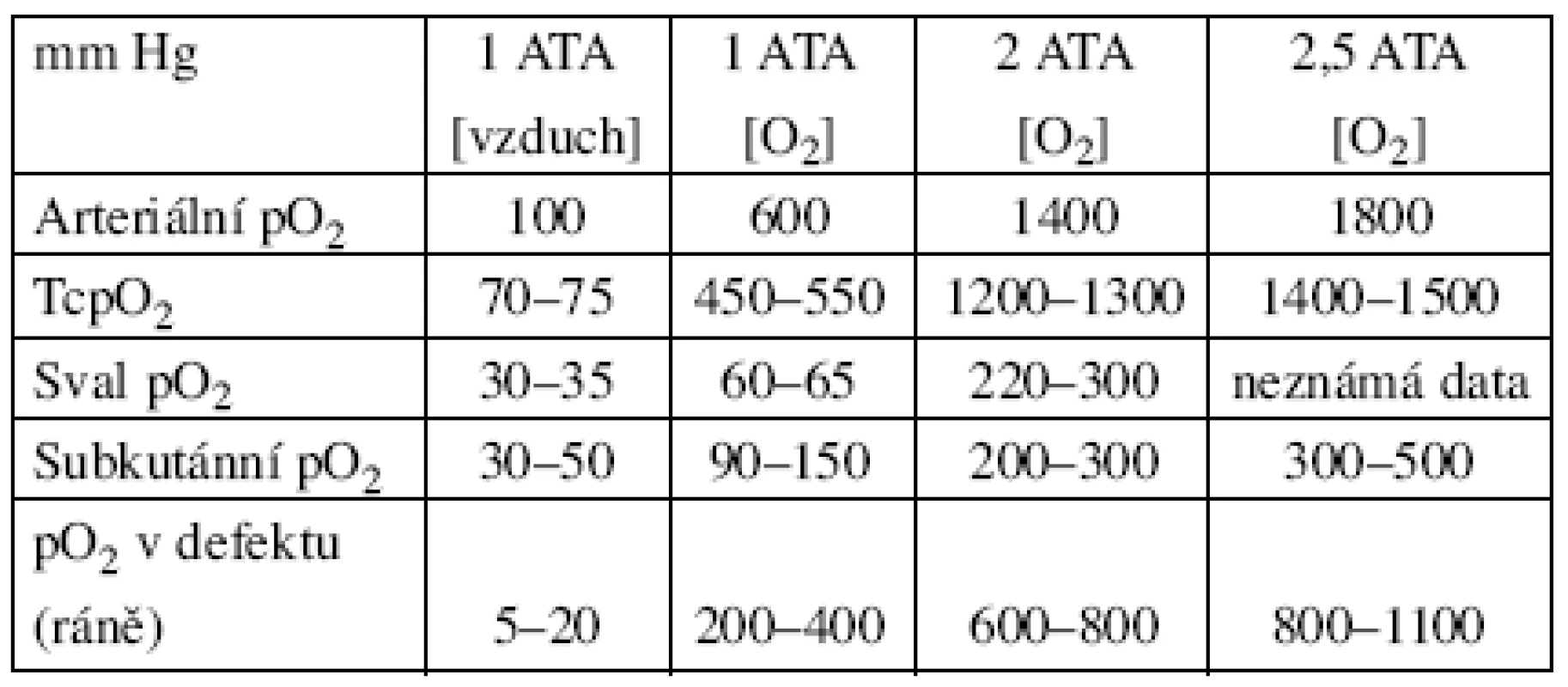
(Sheffield, Heimbach 1985) Podle různých autorů je variabilita měření kompenzována úpravami prostého měření TcpO2. Nejčastěji se v praxi používá vrcholová hodnota TcpO2, tj. maximální hodnota naměřená při sledování během delšího časového intervalu na vzduchu, končetinové/hrudní měření TcpO2 – hodnotí poměr mezi hodnotami naměřenými v místě hypoxie (defektu) a na hrudníku (nejčastěji pod klíčkem jako hladiny základní) – tzv. RPI (regional perfusion index) a měření TcpO2 za hyperbarických podmínek.
Ve světě se klidová hladina TcpO2 v místě defektu běžně používá k určení amputační linie v indikovaných případech. V našich podmínkách, kdy metoda TcpO2 není ještě plně dostupná na všech pracovištích, to samozřejmostí není. Dochází pak nezřídka k situaci, že amputační pahýl se po operaci nehojí a je nutno přistoupit k další – vyšší amputaci. I zde má význam předchozí léčba v barokomoře.
Závěr
Zhojení defektu či alespoň nastartování hojivé fáze záleží na výše uvedených parametrech: na komplexnosti léčby; na hladině TcpO2 v místě či okolí defektu, na možném chirurgickém či jiném způsobu zprůchodnění tepen (PTA atd.); pokud je to možné, na tom, zda pacient skutečně přestal kouřit; na dlouhodobé kompenzaci diabetu u diabetiků; na léčbě chronické infekce v ráně; na lokálním pečlivém ošetřování defektu a zvláště pak – na době léčby, tj. na opakovaných expozicích HBO a na opakovaných sériích HBO (30 expozic v jedné sérii), což je u těchto chronických nehojících se defektů základní a prioritní podmínkou. Léčba kortikoidy, pacienti v chronickém dialyzačním programu, metabolicky a nutričně nevyvážení pacienti mají horší předpoklady k úspěšné léčbě – je třeba více trpělivosti a větší počet HBO expozic. Schopnost 100% O2 dýchaném v přetlaku 2,6 ATA není pouze ve vysoké oxygenaci arteriální krve, protože se kyslík plně – ve 100 % – váže na hemoglobin, ale navíc se fyzikálně rozpouští v plazmě (6,7 ml/100 ml plazmy), což za normálního atmosférického tlaku 0, 98 ATA není schopen. Další jeho schopnost při výše uvedeném léčebném tlaku je, že difunduje z kapiláry do okolní tkáně, stupňuje gradient pro difuzi kyslíku z krve do tkáně (což za normálního atmosférického tlaku rovněž není možné). Zvyšuje fibroblastickou proliferaci, podporuje syntézu kolagenu a růst kolagenní trámčiny, podporuje tvorbu granulací a růst epitelu a tím tvorbu jizvy. Podporuje neoangiogenezi – růst a tvoření nových kapilár – při opakovaných sériích. Působí bakteriostaticky až baktericidně (zvyšuje antibakteriální funkci lymfocytů a makrofágů a tím pozitivně ovlivňuje infekci, která je v každé hypoxické ráně zákonitě přítomna). Vysokou plazmatickou oxygenací stoupá parciální tlak pO2 v krevní plazmě a stupňujícím se gradientem a vazokonstrikcí dochází k částečné redukci tkáňového edému (otoku – např. u diabetické nohy, kompartment syndrom atd.). Všechny tyto schopnosti 100% kyslíku dýchaného v absolutním tlaku 2,5–3 ATA, který má prokazatelný léčebný efekt a současně je bezpečný při dodržování času v barokomoře, se výrazně uplatňují v léčbě tzv. nehojících se defektů. Potvrzuje to nejen zkušenost na našich pracovištích hyperbarické oxygenoterapie, ale i množství randomizovaných dvojitě slepých studií, jak je patrno zvláště ze zahraničních publikací. Tyto studie, zvláště z větších center HBO, které mají různé velikosti a typy barokomor a přímou souvislost s příslušnými klinickými pracovišti, jako jsou např. ve Švédsku, Itálii a USA, potvrzují naše letité zkušenosti již na větších souborech pacientů.
Kontaktní adresa:
MUDr. Jitka Zapletalová
Oddělení hyperbarické oxygenoterapie
IV. interní klinika VFN a 1. LF UK
U Nemocnice 2, 128 08 Praha 2
Sources
1. BRAKARA, M. J., SHEFIELD, P. J. Hyperbaric oxygen therapy for diabetic wounds. Clin. Podiatr. Med. Surg., 1995, 12, s. 105–107.
2. GILBERT, D. L. Oxygen and living process. New York, Heidelberg : Springer Verlag 1981, 401 s.
3. FENG, J. J., HUSSAIN, M. Z., KONSTANT, J. et al. Angiogenesis in wound healing. J. Surg. Pathol., 1998, 3, s. 1–8.
4. KNIGHTON, D. R., HALLIDEY, B. J., HUNT, T. K. Oxygen as an antibiotic: The effect of inspired oxygen infection. Arch. Surg., 1986, 119, s. 199–204.
5. HOPF, H. W., HUNT, T. K., WEST, J. M. et al. Wound tissue oxygen tension predicts the risk of wound infection in surgal patients. Arch. Surg., 1997, 132, s. 997–1004.
6. ALLEN, D. B., MAQUIRE, J. J., MANI, M. et al. Wound hypoxia and acidosis limit neutrophil killing mechanism. Arch. Surg., 1997, 132, s. 991–996.
7. NYLANDER, G. Metabolic effects of hyperbaric oxygen in postischemic muscle. Plast. Reconstr. Surg,, 1987, 79, s. 91–96.
8. RABKIN, J. M., HUNT, T. K. Infection and oxygen. In Davis, J. C., Hunt, T. K. (eds.). Probleme wounds: the role of oxygen. New York : Elsevier 1988, s. 1–16.
9. GAYLE, M., GORDILLO, M. D., CHANDAN, K.. sen. Revisiting the essential role of oxygen in wound healing. Am. J. Surg., 2003, 186, s. 259–263.
10. NIINIKOSKI, J. Effect of oxygen supply on wound healing and formation of experimental granulation tissue. Acta Physiol. Scand., 1970, 78, s. 1–72.
11. DARRINGTON, R., GODDEN, D., PARK, M. et al. The effect of hyperoxia on expression of cytokins RNA in endothelial cells. Biochem. Soc. Trans., 1997, 25, s. 29–25.
12. SHEIKH, A., GIBBON, J., ROKLINA, M. et al. Effect of hyperoxia on vascular endothelial growth factor levels in a wound model. Arch. Surg., 2000, 152, s. 1293–1297.
13. JUHA, H. A., NIINIKOSKI, J. Clinical hyperbaric oxygen therapy,wound perfusion, and transcutaneous oximetry. World J. Surg., 2004, 28, s. 307–311.
14. SHEFFIELD, P. J. Tissue oxygenation measurements. In Davis, J. C., Hunt, T. K. (eds). Problem wounds: The role of oxygen. New York : Elsevier 1988, s. 17–51.
15. KALANI, M., JORNSKOG, G., NADERI, N. et al. Hyperbaric oxygen (HBO) therapy in treatment of diabetic foot ulcers. Long-term follow-up. J. Diabetes Compl., 2002, 16, s. 153–158.
16. FAGLIA, E., FAVALES, F., ALDEGHI, A. et al. Adjunctive systemic hyperbaric oxygen therapy in treatment of severe prevalently ischemic diabetic foot ulcer. Diabet. Care, 1996, 19, s. 1338–1343.
17. ROECKL-WIEDMANN, B. M., KRANKE, P. Systematic review of hyperbaric oxygen in the management of chronic wounds. Br. J. Surg,, 2005, 92, s. 24–32.
18. BAYATI, S., RUSSELL, R. C., ROTH A. C. Stimulation of angiogenesis to improve the viability of prefabricated flaps. Plast. Reconstr. Surg., 1998, 101, s. 1290–1295.
19. STEVENS, D. L., BRYANT, A. E., ADAMS, K. et al. Evaluation of therapy with hyperbaric oxygen for experimental infection with Clostridium Perfrindens. Clin. Infect. Dis., 1993, 17, s. 231–237.
20. KESSLER, L., BILBAULT, P., ORTÉGA, F. et al. Hyperbaric oxygenation accelerates the healing rate of nonischemic chronic diabetic foot ulcers. Diabet. Care, 2003, 26, s. 2378–2387.
21. NYLANDER, G., LEWIS, D., NORDSTROM, H. et al. Reduction of postischemic edema with hyperbaric oxygen. Plast. Reconstr. Surg., 1985, 76, s. 596–601.
22. ALLMAN, R. M. Pressure ulcer prevalence, incidence, risk factor, and impact. Clin. Geriatr. Med., 1997, 13, s. 421–436.
23. BENNETT, M. H., FELDMEIER, J., HAMPSON, N. et al. Hyperbaric oxygen therapy for late radiation tissue injury. Cochrane Database of Syst. Rev., 2005, 3.
24. ANDERSON, D. W. Using hyperbaric oxygen therapy to heal radiation wounds. Nurs. Horsham., 2003, 33, s. 50.
25. WREFORD-BROWN, C. E., HAMPSON, N. B. Hyperbaric oxygen treatment protocols for mandibular osteoradionecrosis. Undersea Hyperb. Med. Soc., 2003, s. 175–179.
Labels
Hygiene and epidemiology Hyperbaric medicine Occupational medicine
Article was published inOccupational Medicine

2007 Issue 1-2-
All articles in this issue
- Hyperbarická oxygenoterapie při léčbě dětí s neuroblastomem nejvyššího rizika – zkušenosti z období let 1997–2000
- Využití hyperbarické oxygenoterapie v traumatologii – výsledky léčby v roce 2005
- Přínos hyperbarické oxygenoterapie v komplexní terapii hypoxických postižení mozku nejrůznější etiologie u dětí a dospělých
- Monitorování srdeční frekvence při výcviku potápěčů
- Vznik oboru hyperbarická medicína a oxygenoterapie v České republice a jeho význam v současné humánní medicíně
- Hyperbarický kyslík a diabetická noha
- K problematice Sudeckova syndromu
- Transkutánní oxymetrie
- Význam hyperbarické oxygenoterapie v léčbě nehojících se defektů
- Zdravotnická problematika potápění
- Zdravotní prohlídky potápěčů
- Perzistentní foramen ovale a potápění
- Occupational Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- K problematice Sudeckova syndromu
- Přínos hyperbarické oxygenoterapie v komplexní terapii hypoxických postižení mozku nejrůznější etiologie u dětí a dospělých
- Zdravotní prohlídky potápěčů
- Transkutánní oxymetrie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

