-
Medical journals
- Career
Optimalizace času akvizice diagnostické celotělové scintigrafie 131I u pacientů s diferencovanými karcinomy štítné žlázy
Authors: Libuše Quinn; Pavel Karhan; Pavel Koranda
Authors‘ workplace: Klinika nukleární medicíny, LF UP Olomouc, ČR
Published in: NuklMed 2022;11:10-14
Category: Original Article
Overview
Úvod: Diagnostická celotělová scintigrafie 131I (dxWBS) u pacientů s diferencovanými karcinomy štítné žlázy (DTC) je důležitým krokem k ověření radiojódavidity tkáně DTC před podáním terapie 131I. Doporučení odborných společností (EANM, SNMMI, DGN) neuvádějí doporučený čas akvizice dxWBS přesně, většinou se shodují na odstupu 48 nebo 72 hodin od podání 131I. Cílem studie na limitovaném souboru pacientů bylo posouzení, v kterém časovém odstupu od aplikace 131I poskytuje dxWBS nejlepší zobrazení ložisek akumulujících 131I.
Metodika: Při poablační kontrole bylo vyšetřeno 16 pacientů pomocí dxWBS za 48 i 72 hodin od aplikace 185 MBq 131I. Doba akvizice planárních scintigramů – 48 hodin od aplikace 10 minut, 72 hodin od aplikace 20 minut. Obrazy byly nahrávány na gamakameře s kolimátorem HEGP. Porovnání časnějšího a pozdního scintigramu bylo provedeno: vizuálně, výpočtem kontrastu ložiska (T-B/B) a výpočtem poměru signálu a šumu ve vztahu k zobrazenému ložisku (SNR). Pro porovnání T-B/B a SNR v obou akvizičních časech byl použit Wilcoxonův párový test.
Výsledky: Ložisková akumulace 131I byla zjištěna v oblasti krku u celkem 10 pacientů – z toho u 4 pacientů byla tato ložisková akumulace jednoznačně zřetelná jen na pozdním scintigramu. Na pozdním skenu se průměrná hodnota T-B/B zvýšila na 0,592 z hodnoty 0,219 na časnějším scintigramu (p = 0,005). Na pozdním skenu se průměrná hodnota SNR zvýšila na 0,841 z hodnoty 0,457 na časnějším scintigramu (p = 0,005).
Závěr: Pro nahrávání dxWBS se jeví odstup 72 hodin od aplikace 131I jako diagnosticky vhodnější i za cenu výrazného prodloužení doby akvizice scintigramů.
Klíčová slova:
terapie – diferencované karcinomy štítné žlázy – 131I – diagnostická celotělová scingrafie
Úvod
Základem sledování pacientů s diferencovanými karcinomy štítné žlázy (DTC) je průběžné monitorování hladiny tyreoglobulinu, která má být u pacientů po prodělané totální tyreoidektomii a navazující eliminaci zbytků štítné žlázy negativní. Negativita hladiny tyreoglobulinu je známkou svědčící proti možné perzistenci zbytků nádorové tkáně. 1,2 Výpovědní schopnost stanovení hladiny tyreoglobulinu i za stimulace TSH je omezena u pacientů s elevací anti-Tg protilátek. Je však nutno mít na zřeteli, že i samotná dlouhodobě perzistující významná elevace anti-Tg protilátek nebo jejich vzestup u pacientů bez tkáně štítné žlázy je také nálezem svědčícím pro perzistenci maligního procesu.
Vzhledem k tomu, že tkáň DTC je hormonálně dependentní a pacienti s vyšším stupněm rizika jsou léčeni tyreoidálními hormony v dávce vedoucí k supresi TSH, může být hladina tyreoglobulinu za suprese i bez přítomnosti anti-Tg protilátek falešně negativní. Proto je zvyklou součástí sledování indikovaných pacientů s vyšším rizikem i vyšetření pacienta za podmínek endogenní (vysazení terapie tyreoidálními hormony) nebo exogenní (injekční podání rekombinantního rhTSH) stimulace TSH.
Za endogenní stimulace TSH se u rizikových pacientů při kontrolní hospitalizaci v adjuvantní fázi (tj. po totální tyreoidektomii a eliminací zbytků štítné žlázy radiojódem) nestanovuje jen hladina tyreoglobulinu, ale současně se provádí také diagnostická celotělová scintigrafie 131I (dxWBS). Toto vyšetření slouží k ověření, zda případná rekurence diferencovaného papilárního nebo folikulárního karcinomu štítné žlázy je tvořena radiojód-avidní tkání a pacient je tedy léčitelný podáním terapeutické dávky radiojódu. 3,4,5 Studie prokázaly výrazný rozdíl v prognóze pacientů – u pacientů s metastázami nebo rekurencí neakumulujícími radiojód, a tedy neléčitelných terapeutickými dávkami radiojódu, je prognóza výrazně nepříznivá. 6 U radiojód-negativních pacientů s elevací tyreoglobulinu je lokalizace radiojód-refrakterní maligní tkáně prováděna pomocí 18F-FDG PET/CT.
Z výše uvedeného vyplývá, že spolehlivost správnosti rozhodování o adekvátní terapii v adjuvantní fázi ve významné míře závisí na senzitivitě (kvalitě) dwWBS 131I. Příčinou limitované senzitivity dxWBS ve srovnání s poterapeutickou scintigrafií (rxWBS) je skutečnost, že parametry scintigrafického obrazu při dxWBS jsou podstatně horší než při jiných scintigrafických vyšetřeních z následujících fyzikálních důvodů:
- Záření gama emitované 131I má vyšší energii než je tomu u 99mTc a je nutno používat speciální kolimátory pro „vysoké“ energie se silnějšími septy, což vede k tomu, že FWHM při těchto vyšetřeních je horší než při scintigrafiích s 99mTc – tato skutečnost zhoršující detekovatelnost lézí není překonatelná.
- Aplikované aktivity 131I jsou omezené z důvodu rizika tzv. stunning efektu 7 (ozáření tkáně při dxWBS by snížilo akumulaci následně aplikované terapeutické dávky 131I), nelze tedy dosáhnout optimálních četností impulzů tvořících scintigrafický obraz i při dlouhé době jeho akvizice.
Z těchto důvodů je pro dxWBS charakteristická vysoká úroveň šumu.
O detekovatelnosti ložiska zjednodušeně rozhoduje to, zda rozdíl mezi četnostmi impulzů detekovaných nad cílovou tkání a tělovým pozadím přesahuje významně úroveň šumu. (Obr. 1)
Image 1. Schematické zobrazení faktorů rozhodujících o detekovatelnosti lézí. Ložisko není detekovatelné pokud: T – B < 2σ (T – četnost impulzů nad cílovou tkání, B – četnost impulzů nad pozadím, 2σ – úroveň šumu – 2 standardní odchylky). 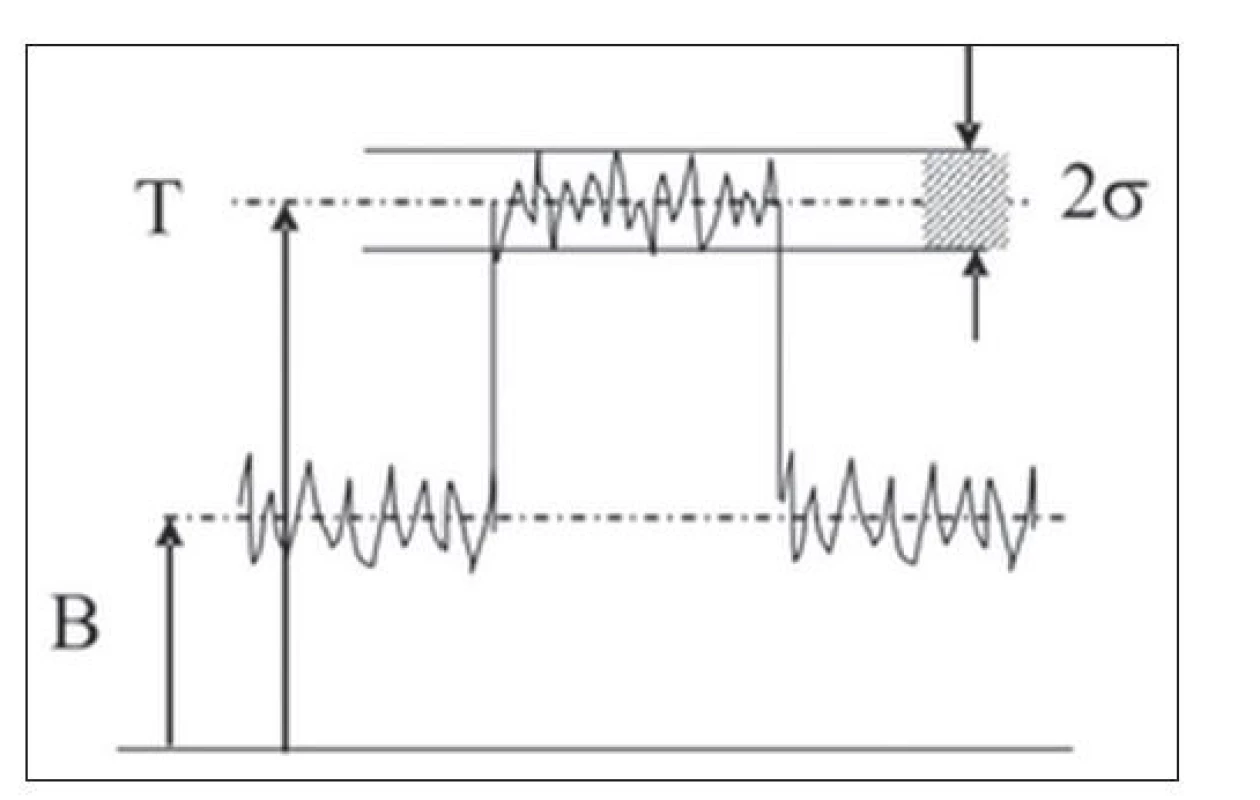
O detekovatelnosti léze tedy spolurozhodují i biologické procesy, které mají vliv na míru akumulace radiofarmaka v cílové tkání a pozadí. S časem se tento poměr mění z fyziologických důvodů. V případě DTC je 131I pomaleji „vyplavován“ z radiojód-avidní tkáně než z tkání tělového pozadí. S časem se tedy výše uvedený rozdíl mezi četnostmi impulzů detekovaných nad cílovou tkání a tělovým pozadím zvyšuje. Bohužel současně klesá i celková radioaktivita v těle, a tím se zvyšuje úroveň šumu, která se stane po čase nepřijatelnou.
Bohužel ani doporučení zahraničních společností neuvádějí přesněji čas akvizice diagnostické scintigrafie 131I u pacientů s diferencovanými karcinomy štítné žlázy jednotně. SNMMI a DGN mají přitom pro provádění celotělové scintigrafie po podání radiojódu u pacientů s DTC speciální doporučení. SNMMI 3 při dxWBS doporučuje odstup 1 až 3 dny od aplikace 131I se slovní preferencí pozdějšího času, DGN 4 uvádí odstup 48 nebo lépe 72 hodin od aplikace 131I. EANM 5 má pouze komplexní guideline pro terapii DTC, kde je uveden odstup 48–72 hodin od aplikace 131I v případě využití stimulace pomocí rhTSH (pro endogenní stimulaci není uvedené časové rozmezí vůbec specifikováno). Nejasnost v doporučeních ponechává prostor pro další zkoumání optimálního časového odstupu.
Cílem studie bylo pokusit se na pilotním souboru pacientů o zpřesnění vhodného optimálního odstupu dxWBS od aplikace radiojódu.
Metoda
Na KNM LF UP jsou pravidelně pacienti s DTC vyšetřování pomocí dxWBC v souladu s doporučenými postupy pro sledování a terapii pacientů s DTC. Na pracovišti bylo zavedeno provedení dxWBS v odstupu 48 i 72 hodin od aplikace 185 MBq Na131I. Doba akvizice scintigramů v uvedených časech je nastavena tak, aby byl zmenšen rozdíl v četnosti impulzů registrovaných při jednotlivých scintigramech. (Obr. 2A a 2B) Akviziční doba jednoho zorného pole jako jedné součásti planárního celotělového scintigramu v režimu „step and shoot“ v době 48 hodin od aplikace byla 10 minut. Scintigram od baze lební po bránici v době 72 hodin od aplikace byl nahráván 20 minut. Obrazy pacientů zahrnutých do pilotní studie byly nahrávány na scintilační SPECT/CT kameře GE Infinia Hawkeye 4 s kolimátorem HEGP.
Image 2. Příklad vyšetření a průběhu terapie 131I u pacienta s uzlinovými metastázami. A – diagnostický celotělový scintigram 48 hodin od aplikace 131I bez zřetelného zobrazení ložiska; B – diagnostický celotělový scintigram 72 hodin od aplikace 131I s ložisky akumulace; C – poterapeutický scintigram 131I se zobrazením metastáz; D – poterapeutický SPECT/CT 131I se zobrazením metastáz (dokumentace z archivu autora). 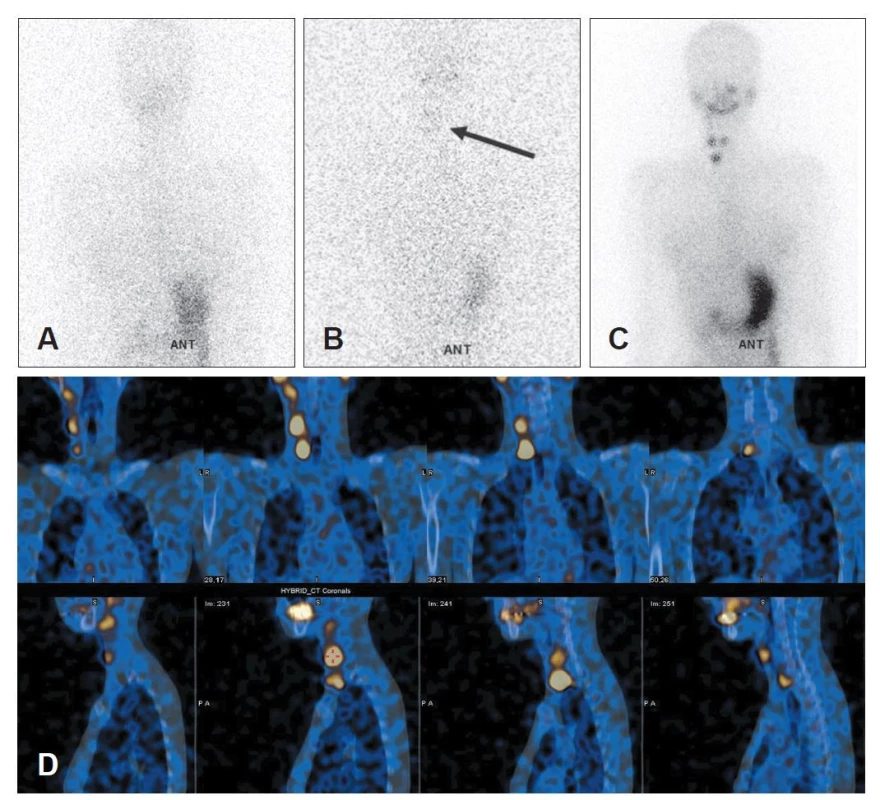
V rámci pilotní studie bylo v rámci ročního sledování analyzováno 16 pacientů. Do následného vyhodnocení studie bylo zavzato pouze 10 pacienti, u kterých byla na základě pozitivity dxWBS podána terapie radiojódem a bylo možno verifikovat správnost dxWBS pomocí poterapeutické scintigrafie (rxWBS). (Obr. 2C a 2D) Vlastní vyhodnocení bylo založeno na vizuálním hodnocení časnějšího a pozdního scintigramu, byla vypočtena hodnota kontrastu ložiska (T-B/B, kde T je průměrná četnost impulsů na pixel v oblasti cílového ložiska a B je průměrná četnost impulsů na pixel v oblasti pozadí) a byl vypočten poměr signálu a šumu daného ložiska (SNR – výpočet: (T-B)/SDB, kde SDB je směrodatná odchylka v oblasti pozadí). Oblasti zájmu cílového ložiska a pozadí byly zakresleny na scintigramu zaznamenaném 72 hodin od aplikace, který prokazoval přítomnost ložiska akumulujícího radiojód a následně byly tyto oblasti v identickém tvaru i velikosti přeneseny do adekvátní lokalizace na scintigramu získaném v čase 48 hodin od aplikace.
Výsledné hodnoty pro dxWBS v časech 48 a 72 hodin od aplikace radiofarmaka byly statisticky porovnány Wilcoxonovým párový testem a zobrazeny s pomocí box-grafů.
Výsledky
Ložisková akumulace 131I opravňující k podání terapeutické dávky 131I s následnou verifikující rxWBS byla zjištěna v oblasti krku u celkem 10 pacientů – z toho u 4 pacientů byla tato ložisková kumulace jednoznačně zřetelná jen na pozdním scintigramu. Soubor hodnot u jednotlivých pacientů je na Tab. 1. Na pozdních skenech se průměrná hodnota kontrastu ložiska T-B/B zvýšila na 0,592 z hodnoty 0,219 na časnějších scintigramech (p = 0,005). Na pozdním skenu se průměrná hodnota poměru signálu a šumu SNR zvýšila na 0,841 z hodnoty 0,457 na časnějším scintigramu (p = 0,005). (Tab. 2)
Table 1. Tabulka naměřených hodnot – hodnoty s indexem 1 časný scintigram, index 2 pozdní scintigram. T (imp) – počet naměřených impulzů v oblasti cílové léze, T ave – průměrný počet impulzů na pixel v oblasti cílové léze, SDT – směrodatná odchylka v oblasti cílové léze, B (imp) – počet naměřených impulzů v oblasti pozadí, B ave – průměrný počet impulzů na pixel v oblasti pozadí, SDB – směrodatná odchylka v oblasti pozadí, T-B/B – kontrast ložiska, SNR – poměr signálu a šumu ložiska. 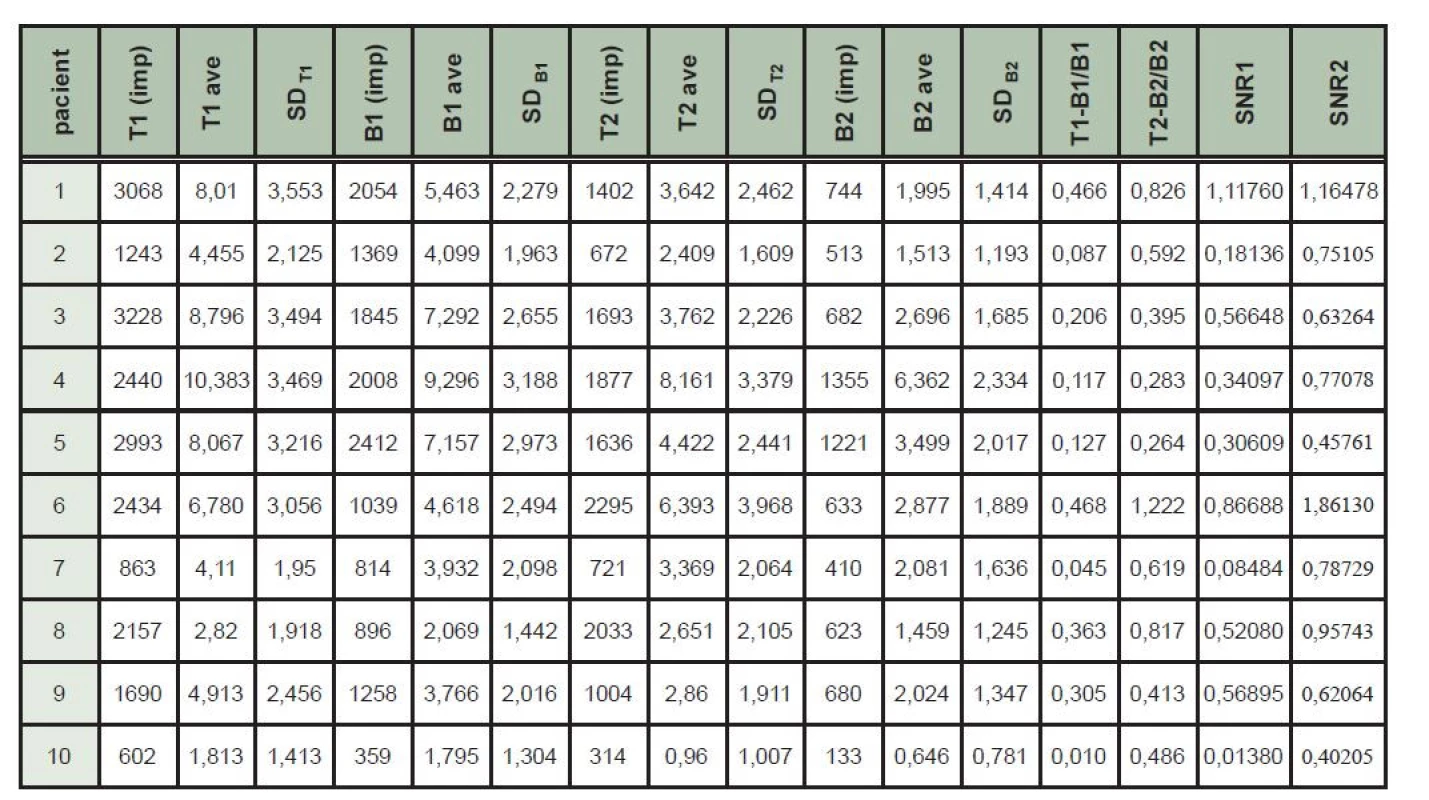
Table 2. Tabulka srovnávající hodnoty kontrastu ložisek vůči pozadí (T-B/B) a poměru signálu a šumu (SNR) v oblastech ložisek, které byly naměřeny na skenech získaných po 48 hodinách (1) a po 72 hodinách (2) od aplikace 131I. Při vyšetření po 72 hodinách byl zjištěn signifikantně vyšší kontrast ložiska vzhledem k pozadí i SNR než při vyšetření po 48 hodinách (Wilcoxonův párový test p = 0,005). 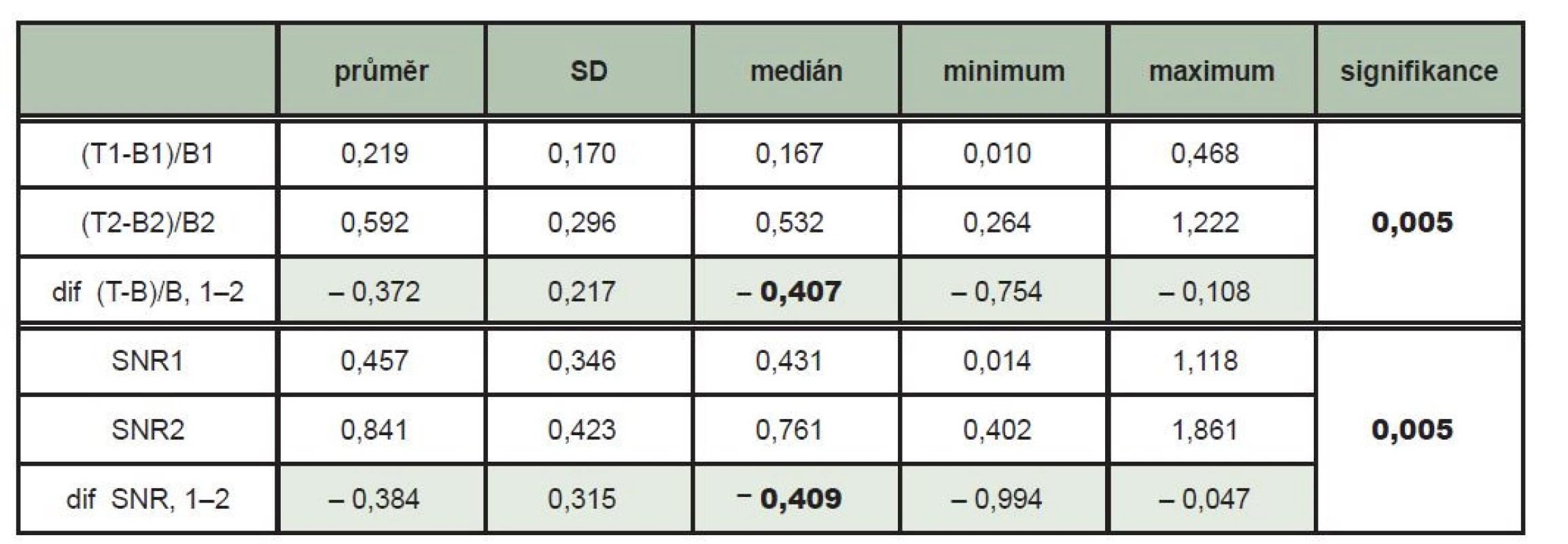
K názornému zobrazení distribuce hodnot kontrastu ložiska vůči pozadí a poměru signálu a šumu v oblasti ložisek v časech 48 a 72 hodin od aplikace radiofarmaka slouží graf na Obr. 3.
Image 3. Kvartilový krabicový graf – distribuce hodnot kontrastu ložiska vůči pozadí (T-B/B) a poměru signálu a šumu (SNR) v oblasti ložisek, které byly naměřeny na skenech získaných po 48 hodinách (1) a po 72 hodinách (2) od aplikace radiofarmaka. 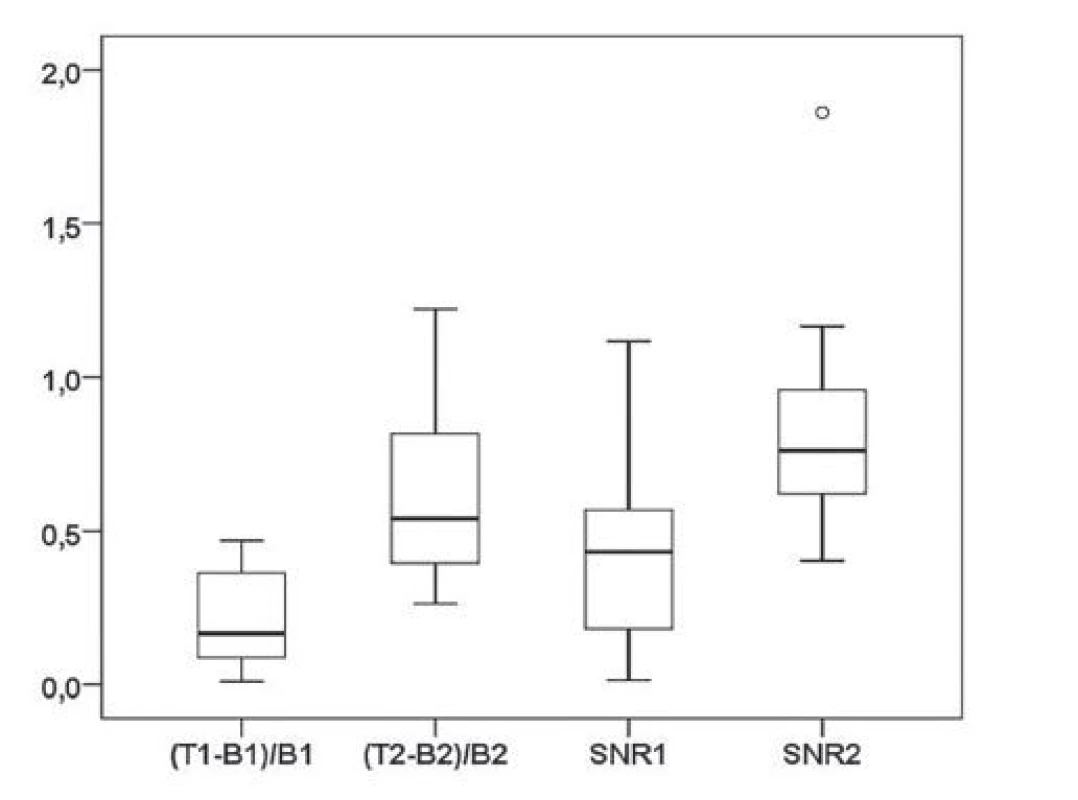
Diskuze
Strategie léčby pacientů s DTC prošla v posledních letech výraznými změnami s přechodem k více konzervativnímu přístupu s intenzivnějším přístupem k terapii až u pacientů spadajících do vysoce rizikové skupiny, případně části pacientů ze skupiny se středním rizikem onemocnění. 1,2 I nadále však dxWBS zůstává součástí péče o pacienty.
V obsáhlých a ucelených doporučeních American Thyroid Association (ATA) z roku 2015 je uvedeno 1, že diagnostická WBS, buď po vysazení hormonů štítné žlázy, nebo podání rhTSH 6–12 měsíců po adjuvantní RAI může být užitečná při sledování pacientů s vysokým stupněm závažnosti nebo středním rizikem přetrvávajícího onemocněním a měla by být provedena pomocí 123I nebo 131I s nízkou aktivitou. S tímto doporučením je třeba souhlasit. dxWBS je nutno i nadále považovat za potřebný krok k ověření přítomnosti radiojód-avidní tkáně před případnou adjuvantní terapií radiojódem zaměřenou již přímo na rezidua DTC. Tento postup je žádoucí i z pohledu legislativního, protože tento výkon svou formou částečně odpovídá požadavku provádět preterapeuticky dozimetrii – vyšetření zabraňuje zbytečnému podání terapie radiojódem u radiojód-refrakterních pacientů, zvláště v případě, pokud je tumorózní tkáň prokázána 18F-FDG PET/CT.
European Thyroid Asscoation (ETA) systematicky pojatá doporučení k terapii diferencovaných karcinomů štítné žlázy nevydala. Nejčerstvěji bylo aktuálně v letošním roce 2022 vydáno jen konsenzuální sdělení ETA k této terapii 2 – v tomto textu však není systematicky pojednána celá terapie DTC včetně klasické adjuvantním fáze u pacientů s rezidui tumoru. Ve vztahu k dxWBS je tam pouze uvedeno, že diagnostický celotělový sken radiojódem poskytuje informace o přítomnosti jód-avidní tkáně štítné žlázy, a to jak normální, tak maligní. Přitom je dále uvedeno, že stále častěji se objevuje tendence vyhýbat se diagnostickému WBS RAI před post-operační léčbou 131I, protože má malý vliv na rozhodnutí o léčbě a protože panují obavy ohledně 131I vyvolaného omráčení zbytků štítné žlázy. 7 Je zcela zřejmé, že toto konsensuální sdělení se věnuje v této části pouze terapii radiojódem přímo po chirurgickém výkonu, kdy cílem podání radiojódu je především odstranění zbytků nemaligní štítné žlázy a vytvoření podmínek pro další sledování pacienta pomocí tyreoglobulinu jako tumormarkeru. Na našem pracovišti v této fázi dxWBS již dlouhodobě nepoužíváme. Vlastní adjuvantní terapii v pozdější fázi onemocnění s potřebným užitím dxWBS k ověření radiojód-avidity reziduální nádorové tkáně se autoři již nevěnovali.
U všech pacientů i pacientek s DTC v našem pilotním souboru došlo ke zlepšení detekce ložisek akumulujících 131I, pokud se scintigrafie provedla až po cca 72 hodinách od podání radiofarmaka místo již po cca 48 hodinách (u části pacientů nejsou ložiska na scintigramech provedených po cca 48 hodinách dokonce ani detekovatelná).
Závěr
Rozdíl v parametrech detekce ložisek akumulujících 131I pomocí dxWBS v odstupu dvou a třech dnů od aplikace diagnostické aktivity radiojódu je tak výrazný, že to naznačuje, že v metodických doporučeních renomovaných odborných společností nukleární medicíny by zřejmě bylo vhodnější místo uváděného širšího časového rozmezí doporučovat zřetelněji dobu akvizice scintigramů 72 hodin od aplikace radiofarmaka i za cenu prodloužení doby nahrávání scintigramů. Lze aproximovat, že v doporučení SNMMI připouštěný čas již 1 den od aplikace radiofarmaka je zřejmě málo vhodný.
Práce byla vytvořena s podporou grantu IGA_LF_2021_040.
Sources
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016; 26 : 1-133
- Pacini F, Fuhrer D, Elisei R, et al. 2022 ETA Consensus Statement: What are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J. 2022;11(1):e210046. doi: 10.1530/ETJ-21-0046. PMID: 34981741
- Silberstein EB, Alavi A, Balon HR, et al.. The SNM practice guideline for therapy of thyroid disease with 131I 3.0*. J Nucl Med. 2012;53 : 1633-1651
- DGN-Handlungsempfehlung (S1-Leitlinie) Iod-131-Ganzkorper - szintigraphie beim differenzierten Schilddruesenkarzinom (Version 5) Stand 1/2019 – AWMF-Registernummer: 031-013. https://www.nuklearmedizin.de/leistungen/leitlinien/docs/031-013_Ganzkoerperszintigraphie_2019.pdf
- Luster M, Clarke SE, Dietlein M, et al. Guidelines for radioiodine therapy of differentiated thyroid cancer. Eur J Nucl Med Mol Imaging 2008;35 : 1941-1959
- C. Durante, N. Haddy, E. Baudin, S., et al.. Long-Term Outcome of 444 Patients with Distant Metastases from Papillary and Follicular Thyroid Carcinoma: Benefits and Limits of Radioiodine Therapy. J Clin Endocrinol Metab. 2006;91 : 2892–2899
- Hilditch TE, Dempsey MF, Bolster AA, et al. Self-stunning in thyroid ablation: evidence from comparative studies of diagnostic 131I and 123I. Eur J Nucl Med Mol Imaging 2002;29 : 783–788.
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2022 Issue 1-
All articles in this issue
- Historie, současnost a budoucnost používání 68Ge/68Ga generátorů – 2. část
- Optimalizace času akvizice diagnostické celotělové scintigrafie 131I u pacientů s diferencovanými karcinomy štítné žlázy
- Kostní scintigrafie detekuje metastázy dříve než CT
- Nové postavení oboru nukleární medicína v Nizozemsku a jeho důsledky
- Lympho 2021, Mariánské Lázně
- Významné životní jubileum v tomto čtvrtletí slaví
- Volby 2022
- 4 roky poté, tentokrát bez COVID
- Nuclear Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kostní scintigrafie detekuje metastázy dříve než CT
- Historie, současnost a budoucnost používání 68Ge/68Ga generátorů – 2. část
- Lympho 2021, Mariánské Lázně
- Optimalizace času akvizice diagnostické celotělové scintigrafie 131I u pacientů s diferencovanými karcinomy štítné žlázy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

