-
Medical journals
- Career
Cílená alfa terapie a její místo v moderní nukleární medicíně
Authors: Petra Suchánková 1; Jaroslav Červenák 2,3; Ján Kozempel 1; Martin Vlk 1
Authors‘ workplace: Fakulta jaderná a fyzikálně inženýrská, Katedra jaderné chemie, České vysoké učení technické v Praze, ČR 1; Ústav jaderné fyziky Akademie věd České republiky, v. v. i., Husinec-Řež, ČR 2; Všeobecná fakultní nemocnice v Praze, ČR 3
Published in: NuklMed 2018;7:7-13
Category: Review Article
Overview
Cíl:
Shrnutí vývoje terapie pomocí radionuklidů a potenciálu alfa radionuklidů v cílené terapii.Úvod:
Zájem o radionuklidy emitující alfa částice v nukleární medicíně vzrůstá. V rámci cílené alfa terapie jsou využívány nejen samotné radionuklidy podléhající jedné nebo několika alfa přeměnám, ale dochází především k vývoji nosičů alfa zářičů se specifickou akumulací v nádorových buňkách, následně využitelných jako radiofarmak.Materiál:
Radium se již od roku 1908, tedy necelých deset let po jeho objevu, používalo v medicíně především k léčbě kožních onemocnění. Od té doby prošla terapie pomocí radionuklidů dlouhou cestu – od 226Ra, přes negatronové zářiče, 211At, až po nuklidy tvořící krátké rozpadové řady označované jako in vivo generátory, např.: 225Ac, 213Bi či 223Ra.
Předností alfa terapie je uvolnění vysoké energie v malém objemu, čímž dochází k nižší radiační zátěži okolních tkání. Díky vysokému LET alfa částic vznikají dvojité zlomy DNA, které jsou pro buňku letální. Z tohoto důvodu by měly být nosiče alfa radionuklidů schopné odolat vysoké uvolněné energii, aby nedošlo k jejich radiolýze. Rovněž je důležitá stabilizace odraženého dceřiného radionuklidu tak, aby nedošlo k jeho úniku do okolní tkáně, a tedy k jejímu poškození. Mezi studovanými nosiči alfa radionuklidů převažují anorganické nanomateriály, např. nanočástice oxidu železa, titanu, zlata či hydroxyapatity.Závěr:
Výzkum cílené alfa terapie otevírá cestu k léčbě některých druhů nádorových onemocnění, především ke zvýšení kvality a prodloužení života pacientů. Proto by mělo být i nadále věnováno úsilí přípravě nových radionuklidů, vhodných jak pro včasnou diagnostiku, tak i pro následnou terapii. Patřičná pozornost by měla být rovněž dedikována nosičům terapeutických radionuklidů, nejlépe splňujících i teranostický koncept, s ohledem na jejich chemickou a radiační stabilitu a dostupnost.Klíčová slova:
alfa radionuklidy, 223Ra, nosiče, nanočástice, cílená terapie, teranostikaÚvod
Radionuklidová terapie onkologických onemocnění využívá emitory částicového záření, zejména beta, alfa, či v menší míře přeměn emisí Augerových elektronů, které působí na mnohobuněčné, buněčné, respektive subbuněčné úrovni. Alfa radionuklidy začaly být využívány pro medicínské účely už krátce po svém objevu.
V prosinci 1898 manželé Marie a Pierre Curieovi ohlásili objev nového prvku vyseparovaného ze smolince – radia. Vědecká veřejnost ale požadovala viditelný důkaz tohoto prvku, a tak si manželé Curieovi práci rozdělili: Pierre se věnoval výzkumu radioaktivity a Marie (Obr. 1) izolaci radia. Po nemalém úsilí se jí podařilo získat 0,1 g čistého RaCl2 a určila hmotnostní číslo takto připraveného radia: 226.
Image 1. Marie Sklodowská-Curie, objevitelka radia.<sup>1</sup> 
Roku 1900 Walkhoff a Giesel zjistili, že radium má i fyziologické účinky, a tak se Pierre Curie ve spolupráci s mnoha významnými lékaři pustil do studia těchto účinků na zvířatech. Velmi rychle si všimli, že radium dokáže hojit rány a dokonce i vyléčit nádory. V červnu 1901 Pierre Curie spolu s Henrim Becquerelem vydali „Pojednání o fyziologických účincích paprsků radia“. Tehdy začala éra radioterapie, původně zvaná „radiumterapie“ nebo „Curieterapie“.
Radium se ihned stalo téměř univerzálním lékem na různá onemocnění, např. nádory kůže. V průběhu první světové války se dokonce pomocí radia „rentgenovali“ postřelení, aby mohli lékaři rychleji a lépe lokalizovat kulku v jejich těle. Za pár let se radia chopily i farmaceutické firmy a začaly vyrábět nespočet produktů se „zázračnými účinky“: mastičky, obklady, kapky či dokonce výživové doplňky pro zvířata.
Postupně ale byly odhaleny i negativní dopady „radiového“ záření na lidský organizmus a v roce 1921 byla vydána pravidla a doporučení pro zacházení s radiem. V roce 1937 bylo radium zakázáno k nelékařským účelům až nakonec, v roce 1976, bylo od radia upuštěno definitivně a vystřídalo ho iridium-192 nebo cesium-137.
Od časů manželů Curieových urazila radioterapie pořádný kus cesty, přičemž po objevu umělé radioaktivity už není odkázána jen na radionuklidy, které se vyskytují v přírodě. Díky různým fyzikálním a chemickým charakteristikám uměle připravených nuklidů se naskytla možnost vybrat radionuklid pro daného pacienta „na míru”. 1,2,3
Cílená alfa terapie (TAT)
Využití radionuklidů emitujících alfa částice ve výzkumu a klinických testech neustále roste. Prvními systémy používanými pro cílenou alfa terapii (angl. targeted alpha therapy – TAT) byly radionuklidy rozpadající se pouze jedním alfa rozpadem, např. 211At. 4,5 Následně byla pozornost věnována tzv. in vivo generátorům. Jedná se o radionuklidy, které se rozpadají kaskádou alfa rozpadů, např. 223Ra, 225Ac nebo 213Bi.
Vysoká uvolněná energie při alfa rozpadu, která je přínosem pro alfa terapii, je však komplikací při konstrukci radiofarmaka. Během rozpadu dochází k radiačnímu poškození nosiče daného radionuklidu. Tento problém je důležité vyřešit především pro molekuly nesoucí radionuklidy, které se rozpadají kaskádou několika rozpadů. Může totiž docházet k úniku dceřiných produktů, které následně mohou zvyšovat radiační zátěž okolních tkání.
Na Obr. 2 je uveden příklad simulace stopy uvolněného horkého atomu v kortikální kostní tkáni za předpokladu, že je mateřský radionuklid uprostřed částice o poloměru 50 nm. Jak je z obrázku patrné, uvolněný horký atom může jednoduše z částice uniknout. Alfa částice, která odnáší převážnou většinu energie, má v tomto materiálu dosah okolo 37 µm, což odpovídá několika buněčným poloměrům. Pokud je atom na povrchu nanočástice, může následně dojít k jeho zpětné sorpci. 6
Image 2. Simulace stopy uvolněného horkého atomu 219Rn o energii 100 keV z bodového zdroje (500 opakování) v materiálu představujícím kortikální kostní tkáň (ρ = 1,92 g/cm<sup>3 </sup>). <sup>6</sup> 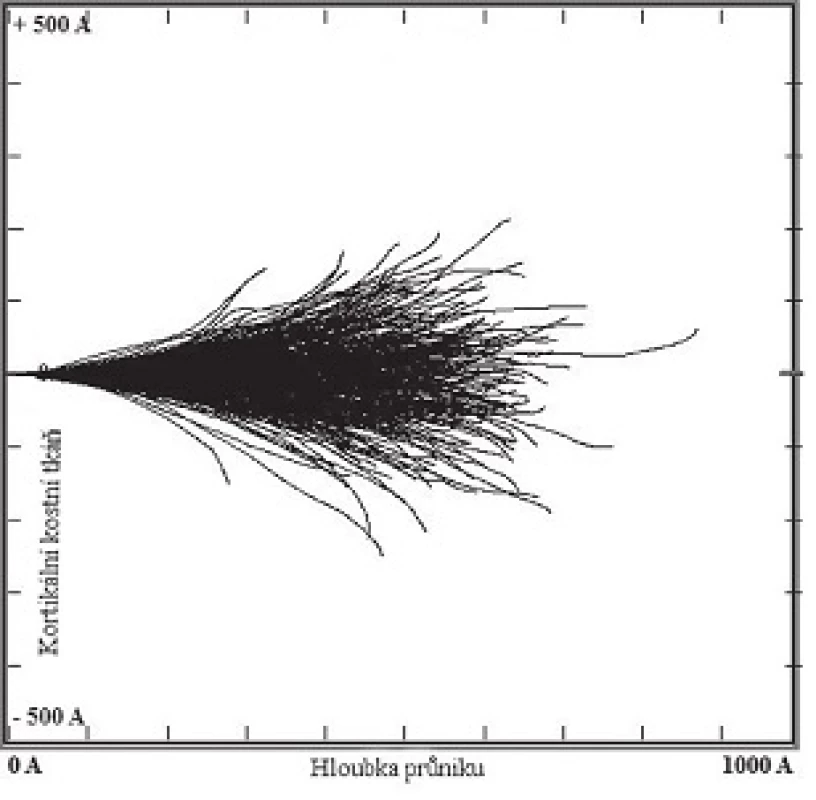
Pokud nadefinujeme buněčný poloměr 20 µm, bude průměrný dosah beta částic emitovaných radionuklidy 215 buněčných poloměrů pro 90Y (Eβmax = 2,3 MeV), 40 buněčných poloměrů pro 131I (Eβ max = 606,3 keV), ale u alfa částic emitovaných radionuklidem 211At bude průměrný dosah pouze 6 buněčných poloměrů. Bylo vypočítáno, že frakce energie, která se uvolní v nádorové tkáni o průměru 200 µm, bude pouze 1,5 % pro 90Y, 17 % pro 131I, avšak 50 % pro 211At. Ve srovnání s 211At je tedy potřeba tisíckrát více rozpadů 90Y pro dosažení stejného efektu. 7
Alfa radionuklidy
Mezi radionuklidy, které si již našly místo jak v preklinických, tak i klinických testech a z nichž některé jsou v terapii již běžně využívány, patří například izotopy aktinia (225Ac), bismutu (212Bi, 213Bi) nebo radia (223Ra, 224Ra), jejichž vlastnosti shrnuje Tab. 1.
Table 1. Přehled radionuklidů (potenciálně) používaných pro TAT a jejich vlastnosti12 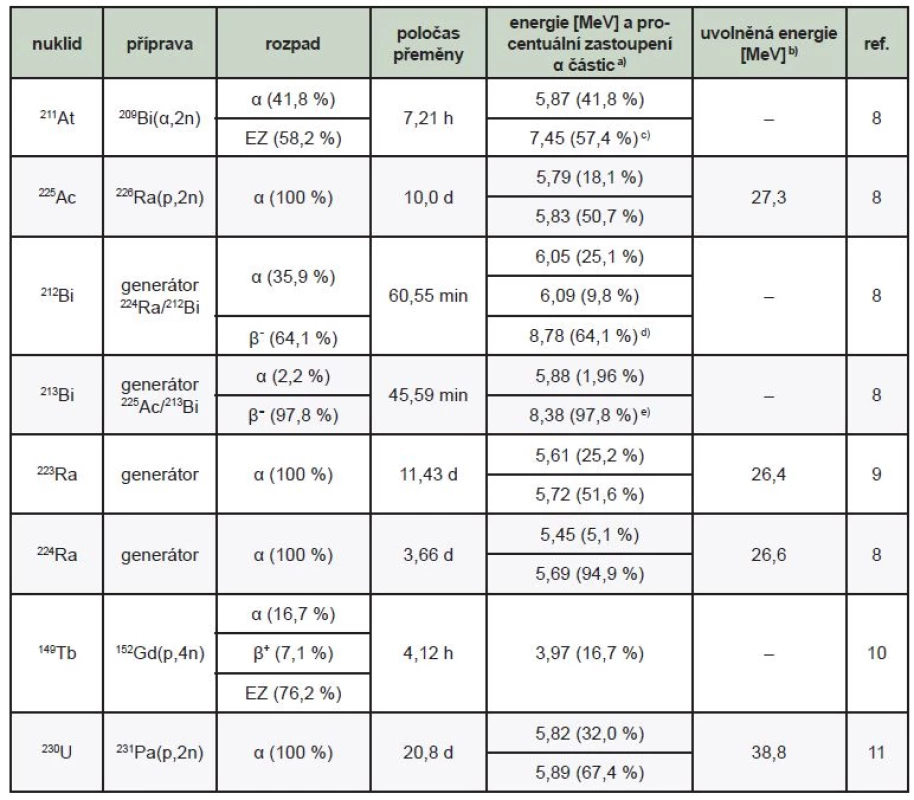
a) α částice s nejvyššími intenzitami b) průměrná energie odnesená α částicemi po rozpadu celé řady (viz. Obr. 3, 4 a 6) c) z rozpadu 211Po a intenzita propočítána na rozpad 211At d) z rozpadu 212Po a intenzita propočítána na rozpad 212Bi e) z rozpadu 213Po a intenzita propočítána na rozpad 213Bi Zvláštní postavení mezi alfa terapeutickými radionuklidy přísluší astatu (211At), který je předmětem mnoha in vitro i in vivo experimentů. Astat-211 je jedním z prvních studovaných radionuklidů pro alfa terapii. Předpokládá se, že by díky své podobnosti s jodem mohl být využitelný k léčbě hypertyreózy. Nejčastěji je 211At navazován na protilátku. Avšak v důsledku jeho nejasné chemie není v klinické praxi rozšířen. Jedním ze studovaných příkladů terapeutického potenciálu 211At byla léčba intraperitoneálně rozšířeného ovariálního karcinomu OVCAR-3 pomocí 211At značené protilátky MOv18. Myším byla intraperitoneální cestou podána aktivita 400 kBq. Byl zjištěn medián přežití 213 dní oproti 138 dnům u kontrolních zvířat, které byly léčeny fyziologickým roztokem. 13 Také byla studována výhoda alfa zářičů oproti beta zářičům a byla demonstrována studií 211At značené protilátky MOv18 (A = 310–400 kBq) a 131I značené protilátky MOv18 (aplikovaná aktivita 5,1–6,2 MBq). V prvním případě byl u 9 z 10 zvířat pozorován zánik makro - i mikronádorů, kdežto ve druhém pouze u 3 z 10. 14
Jedním z velmi perspektivních preklinicky i klinicky ověřených radionuklidů přeměňujících se kaskádou rozpadů (Obr. 3) doprovázenou současnou emisí gama záření je 225Ac (10 d). Doprovodného gama záření lze s výhodou využít pro zobrazení biodistribuce pomocí SPECT. Aktinium-225 je připravováno (p,2n) reakcí na terči 226Ra, přičemž jednou z dalších možností jeho přípravy (oproti Tab. 1) je separace 229Th/225Ra z 223U, která probíhá iontovou výměnou a extrakční chromatografií. 15 V klinických studiích 16,17 jsou nyní protilátky anti-CD33 (myší protilátka akutní myeloidní leukémie) a HuM195 (lidská protilátka akutní myeloidní leukémie) konjugovány s 225Ac. V jiné studii 18 se autoři zaměřují na využití konjugátu 225Ac-PSMA-617 v terapii karcinomu prostaty ve srovnání s 177Lu-PSMA-617, který byl pacientovi kontraindikován a místo beta zářiče byla pacientovi aplikována dávka 9–10 MBq 225Ac-PSMA-617 ve třech cyklech (100 kBq/kg) s další premedikací. Postterapeutický PET/CT pomocí 68Ga-PSMA indikoval úplný úbytek léze a signifikantní depresi PSA (z původně 2 923 ng/mL na ˂ 0,1 ng/mL) devět měsíců po zahájení experimentální terapie.
Image 3. Rozpadová řada <sup>233</sup>U. 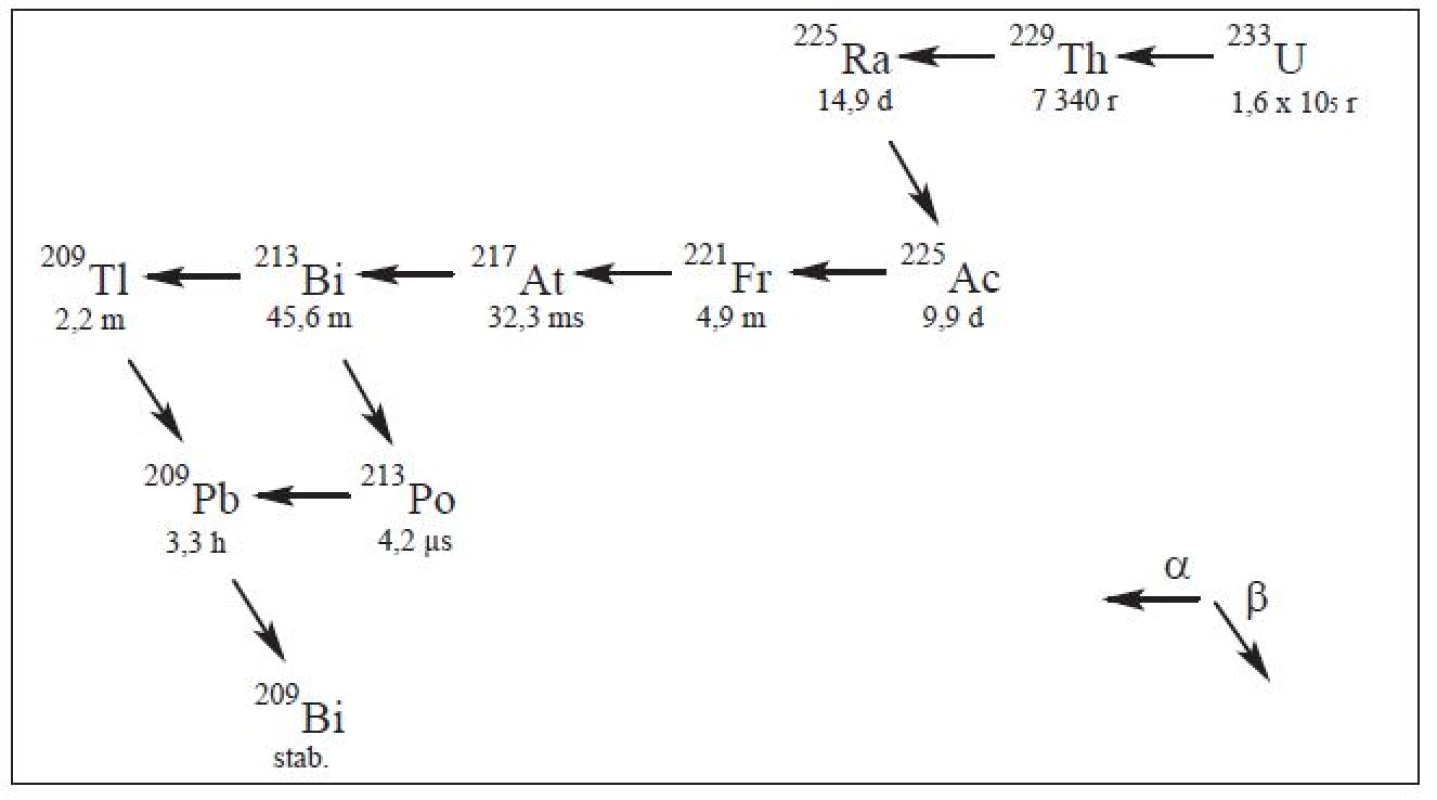
Pozornost jak v preklinických, tak i klinických studiích byla rovněž věnována izotopům bismutu 212Bi a 213Bi. První z nich – izotop 212Bi – je získáván elucí generátoru 224Ra/212Bi (Obr. 4), alternativně však také pomocí mateřského radionuklidu 212Pb, který je beta zářičem s poločasem rozpadu 10 h a tvoří komplex s 2-(4-isothiokyanatobenzyl)-1,4,7,10-tetraaza-1,4,7,10-tetra-(2-karbamoyl methyl)-cyklododekanem (TCMC) (Obr. 5-1). Konjugát 212Pb-TCMC byl následně využíván jako in vivo generátor 212Bi. Klinické testy 212Pb-TCMC-trastuzumab byly prováděny u pacientů s HER-2 exprimujícím karcinomem ovárií, přičemž byla zjišťována toxicita, farmakokinetika a dozimetrie. Klinická studie ukázala minimální distribuci radiofarmaka mimo peritoneální dutinu, což koreluje s preklinickými studiemi. 19
Image 4. Rozpadová řada <sup>232</sup>Th. 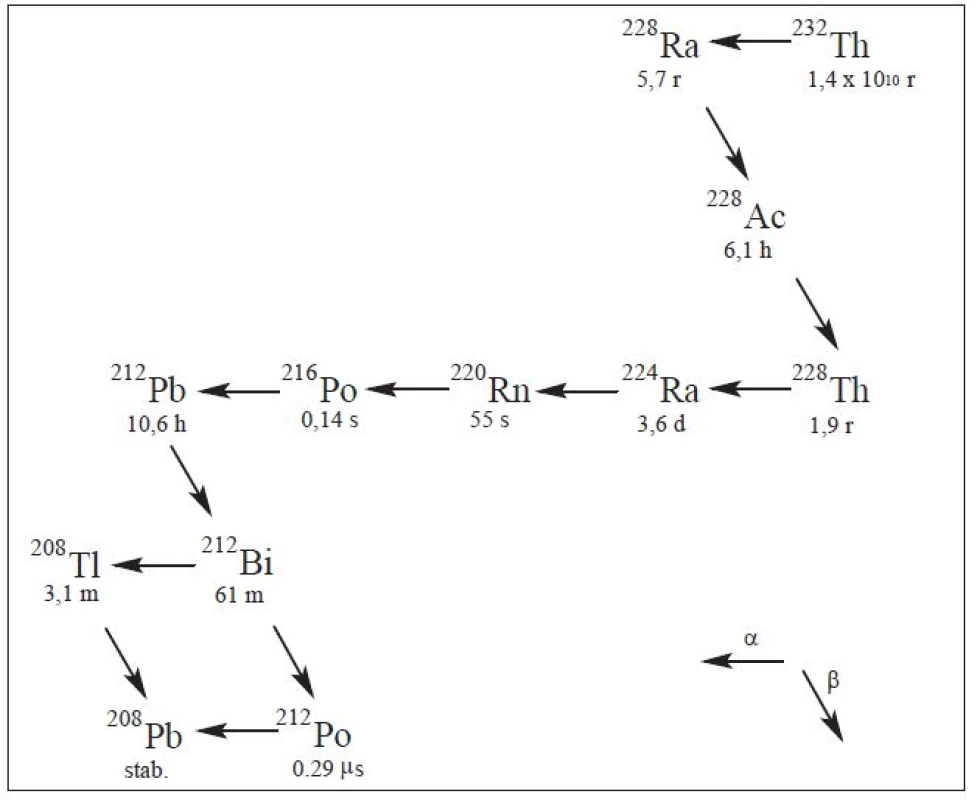
Rovněž druhý izotop – 213Bi – nachází potenciální využití v TAT. Byly studovány různé případy značení protilátek tímto nuklidem, avšak bylo zapotřebí se vypořádat s jeho krátkým poločasem rozpadu. Z tohoto důvodu je tedy klíčové nalezení vhodné protilátky s adekvátně rychlou kinetikou. Ve většině studií byl využíván jako chelátor N-[2-amino-3-(p-isothiokyanatofenyl)propyl]-trans-cyklohexan-1,2-diamin-N,N´,N´,N´´,N´´-pentaoctová kyselina jako (CHX-A´´-DTPA) (Obr. 5-2), konjugát 213Bi-CHX-A´´-DTPA je následně navázán na protilátku. První cílená radioterapie s alfa emitujícími radionuklidy byla studována u pacientů s akutní myeloidní leukémií s využitím konjugátu 213Bi-HuM195. Celková podávaná aktivita byla v rozmezí 0,6–1,6 GBq ve 3–6 aplikacích i.v. po 10,4 – 15,5 – 20,7 MBq/kg během 48 h. Poměr absorbované dávky mezi kostní dřeň, játra a slezinu k celému tělu byl přibližně 1000krát větší než u radioterapeutik beta-emitujících radionuklidů. I když pacienti nedosáhli úplné remise, byla poprvé ukázána realizovatelnost cílené alfa terapie s přijatelnou bezpečností pro pacienta i zdravotnický personál. 20
Z hlediska cílené alfa terapie je v současnosti pravděpodobně nejatraktivnějším izotopem 223Ra, jehož jednou z výhod je kratší poločas dceřiného radonu (219Rn – 3,9 s) oproti 220Rn z přeměnové řady 224Ra, který se rozpadá s poločasem 55,5 s a u kterého je tedy větší pravděpodobnost emanace z kostní tkáně.
Izotop 223Ra sleduje metabolismus vápníku a díky tomu je selektivně cílen do kosti, především v místě zvýšeného metabolizmu kostní tkáně – metastáz, kde tvoří komplexy s hydroxyapatitem. 21 Xofigo© 223RaCl2 je schválen FDA a používán v klinické praxi už několik let. Dodává se v podobě injekčního roztoku o objemové aktivitě 1 000 kBq/ml. Indikace pro použití přípravku Xofigo© je kastračně rezistentní karcinom prostaty se symptomatickými metastázami v kostech bez známých viscerálních metastáz, přičemž intravenózně podávaná aktivita je 50 kBq/kg/inj. v intervalu 4 týdnů v 6 terapeutických dávkách. 22
V nedávno publikované klinické studii týkající se terapie kastračně rezistentního karcinomu prostaty přípravkem Xofigo© bylo retrospektivně prozkoumáno 110 pacientů. Primárně bylo sledováno celkové přežití, přežití bez kostních příhod a selhání kostní dřeně a dále parametry stanovené před prvním podáním 223Ra, tedy sérová hladina hemoglobinu, hladina PSA, alkalické fosfatázy, skóre bolesti, použití chemoterapie či externího ozařování. Na základě těchto informací bylo zjištěno, že pacienti dobře tolerují chemoterapii a sekundární hormonální terapii doprovázenou 223Ra. Na druhé straně riziko selhání kostní dřeně vzrostlo se současným externím ozařováním. Následky externího ozařování během terapie přípravkem Xofigo© však doposud nebyly popsány, a je proto nutná jejich další studie. 23 Kromě klinicky používaného 223Ra je vyvíjeno značné úsilí o nalezení nosičů, které by společně s 223Ra a případně i dalšími radionuklidy byly vhodné pro TAT, jako například hydroxyapatity 21, LaPO4 24, nanozeolity 25 či superparamagnetické nanočástice. 26
Nosiče alfa radionuklidů
Nosiče radionuklidů rozpadajících se jednou nebo několika emisemi alfa i beta částic musí kromě obecných požadavků na chemické sloučeniny používané pro značení či transport splňovat i další specifické nároky.
Kromě účelové volby vhodného radionuklidu je nutné věnovat patřičnou pozornost také nosiči a celému cílícímu systému – vektoru. Výběrem diagnostického (PET, SPECT) či terapeutického radionuklidu s využitím konkrétního vektoru je možné připravit přínosné teranostické léčivo. Cílení systému do nádorové tkáně může probíhat několika způsoby: jednak pasivním cílením např. na základě velikosti částic, jednak cílením aktivním, kdy dochází k vychytání daného radiofarmaka na základě specifické interakce, např. vazby na nosiči vázaného ligandu nebo antigenu na receptor.
K pasivnímu cílení farmak i radiofarmak do nádorové tkáně lze využít EPR efektu (Enhanced Permeation and Retention). Nádorová tkáň roste poměrně rychle, a tedy tvorba nových cév není precizní a stává se tak pro velké molekuly přístupnější a díky nedostatečnému odtoku lymfy jsou v ní i zadržovány. Velikost struktury tedy může určit akumulaci farmak v nádorové tkáni. EPR lze využít i pro cílení látek do tkání, jejichž cévy jsou zúženy a farmakum je aplikováno přímo do cévy vyživující příslušnou tkáň či orgán. 27,28
Na druhé straně, prostřednictvím specifického ligandu nebo antigenu dochází k aktivnímu transportu radiofarmak přímo do nádorové tkáně. Vazbou ligandu či antigenu na daný receptor dojde k jejich selektivnímu vychytání v cílových oblastech. Nádorové buňky ve většině případů mají na svém povrchu velké množství receptorů na rozdíl od zdravé tkáně, kde je jejich počet podstatně menší nebo úplně chybí. Navázáním selektivního ligandu či antigenu na povrch nanočástice nesoucí radionuklid je možné výrazně ovlivnit či přímo docílit transport radionuklidu do nádorové tkáně a tím přispět ke snížení radiační zátěže pacienta. Vazba ligandu s nanočásticí musí být zprostředkována kovalentní vazbou přes tzv. spacer – dvojvazný alifatický nebo aromatický uhlíkatý řetězec, aniž by negativním způsobem ovlivňovala specifickou vazbu ligand-receptor. 29
Dalším důležitým faktorem ovlivňujícím konstrukci nového alfa-radiofarmaka je stabilizace dceřiných produktů v nosiči. Touto stabilizací je možné dosáhnout přesnějšího cílení a uvolnění energie v požadované tkáni. Jedním z možných přístupů je využití nanočástic, např. nanočástic kovů jako je zlato, stříbro či železo (superparamagnetické nanočástice). 26Dále jsou studovány částice hydroxyapatitu, který je přirozenou složkou kostní tkáně, nanozeolity nebo oxid titaničitý.
Nanočástice zlata mají hned několik důvodů pro využití v nanotechnologiích pro terapii i diagnostiku nádorových onemocnění. Jejich syntéza je jednoduchá, ekonomicky nenáročná, lze je syntetizovat v širokém rozmezí velikostí (od 2 do 500 nm) a tvarů. Další výhodou je možnost jejich povrchové modifikace pomocí biomolekul. Byla potvrzena jejich biokompatibilita a nízká akutní toxicita. 30 Pro terapeutické účely byly syntetizovány zlaté nanočástice značené 211At, které byly konjugovány se substancí P (krátký peptid s vysokou afinitou k NK1 receptorům buněk gliomu). Stabilita těchto nanočástic byla studována v roztoku chloridu sodného, cysteinu, glutathionu a v lidském séru. Uvolněná aktivita ve všech roztocích se pohybovala pod 0,1 %. 31
Podobně jako zlato jsou využívány i nanočástice stříbra, které jsou studovány především z důvodu jejich antibakteriálních vlastností, např. k čištění vody. V rámci studie TAT byly připraveny nanočástice stříbra obalené PEO (poly (ethylen oxid)), které odpuzují plazmatické proteiny a spolu se správnou velikostí částic mohou chránit před pohlcením makrofágy. Takto modifikované nanočástice byly značeny 211At. Stabilita [211At]Ag-PEO nanočástic byla studována při 37°C po dobu 3,5 h v přítomnosti kompetitivních chloridových iontů. Z těchto prvotních experimentů vyplynulo, že za takto zadaných podmínek jsou značené nanočástice v suspenzi stabilní. 32
Zeolity jsou biokompatibilní krystalické hlinitokřemičité materiály. Jejich zajímavost tkví v prostorovém uspořádání: jsou tvořeny kanálky a dutinkami, které mají konstantní rozměry. V intersticiálních polohách jsou zachyceny ionty alkalických kovů a kovů alkalických zemin. Toho bylo využito pro syntézu nanozeolitů značených radioizotopy Ra. 25
Hydroxyapatity jsou minerální látky přirozeně se nacházející v kostní tkáni či zubech. Jedná se o materiály, které se díky své biokompatibilitě běžně používají ve formě bločků či prášku k náhradě kosti a již jsou schváleny FDA. Díky své biokompatibilitě, dobré radiační stabilitě a schopnosti stabilizovat dceřiné atomy jsou tyto materiály studovány ve spojitosti s TAT. Bylo prováděno značení 223Ra pro terapii, které díky své analogii s vápníkem při inkorporaci radionuklidu do struktury hydroxyapatitu nahrazuje jeho místo. Uvolněné aktivity byly studovány ve fyziologickém roztoku. Po 24 hodinách bylo uvolněno méně než 5 % celkové aktivity. 21
Magnetické nanočástice jsou využívány především v diagnostice. Jejich využití s terapeutickými radionuklidy je teprve studováno. První vlaštovkou je studie přípravy 223Ra-SPIONs (nanočástice Fe3O4). Jejich dobrá stabilita in vitro je slibný předpoklad pro další in vivo testy. Bylo zjištěno, že proces záchytu 223Ra nanočásticemi Fe3O4 odpovídá sorpci a povrchové komplexaci spíše než mechanismu srážení. Počáteční vychytávání 223Ra na povrchu je následováno pomalejším procesem zabudovávání 223Ra do intersticiálních poloh. 26
Image 5. Rozpadová řada <sup>235</sup>U. 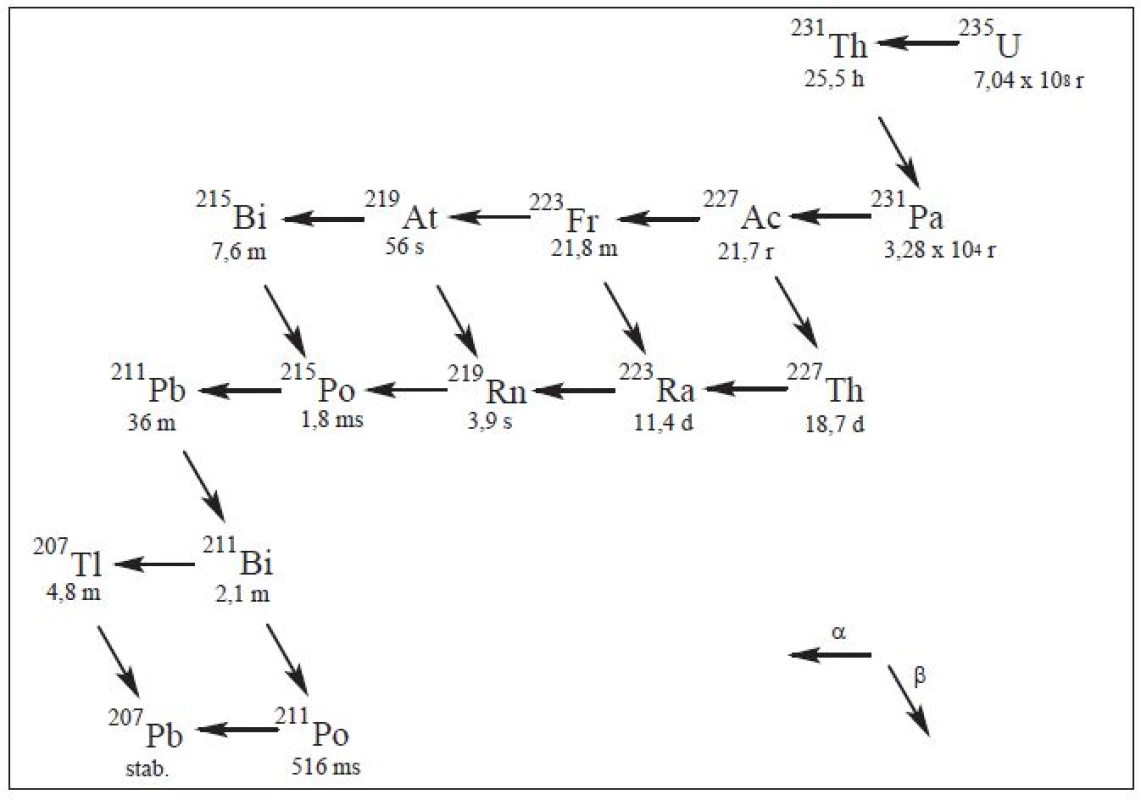
Závěr
Cílená radionuklidová terapie si klade za cíl nastavit léčbu pro pacienta na míru a má potenciál být levnější s nižší morbiditou v porovnání se standartní terapií (např. radiační synovektomie je alternativou k chirurgickému zákroku při revmatoidní artritidě; je levnější a pacient se po ní může dříve vrátit do běžného života). Výzkum na poli cílené alfa terapie tedy jednoznačně otevírá cestu ke zkvalitnění léčby některých druhů onemocnění, zvýšení kvality a prodloužení života pacientů. To jsou jednoznačně důvody, proč by mělo být i nadále věnováno nemalé úsilí přípravě nových a perspektivních radionuklidů a jejich nosičů ve vývoji tohoto typu léčby. Aby to všechno bylo možné, bude potřeba vysoce kvalifikovaný personál s interdisciplinárním zázemím ve fyzice, chemii, biologii, medicíně a dalších odvětvích vědy a techniky. Jinak by hrozilo, že se z TAT stane sice vysoce účinná, ale jen teoretická nebo jen zřídka využívaná možnost léčby.
Ján Kozempel
Sources
1. Běhounek F. Radium a paprsky X (Tajemství hmoty a energie). Praha, Šolc a Šimáček, Nakladatelská společnost s r. o. 1924, 174 p
2. Bayounes O, Souffrin C, Meunier D La radium: découverte, utilisation et danger; [online]. 2013. [cit. 1. 9. 2015]. Dostupné na: http://culturesciences.chimie.ens.fr/content/le-radium-découverte-utilisation-et-danger.
3. Curiová E. Paní Curiová. Praha, vyd. Mladá fronta, nakladatelství Máj, 1964, 320 p
4. Zalutsky MR, Reardonb DA, Pozzia OR et al. Targeted α-Particle Radiotherapy with 211At-labeled Monoclonal Antibodies. Nucl Med Biol. 2007;34 : 779-785
5. Zalutsky MR, Reardon DA, Akabani G, et al. Clinical Experience with α-Particle–Emitting 211At: Treatment of Recurrent Brain Tumor Patients with 211At-Labeled Chimeric Antitenascin Monoclonal Antibody 81C6. J Nucl Med. 2008;49 : 30-38
6. Kozempel J, Vlk M. Nanoconstructs in Tagreted Alpha-Therapy. Recent Patents on Nanomedicine 2014;4 : 71-76
7. Humm JL. Dosimetric Aspect of Radiolabeled Antibodies for Tumor Therapy. J Nucl Med. 1986;27 : 1490-1497
8. Vértes A, Nagy S, Klencsár Z, et al. Handbook of Nuclear Chemistry, Heidelberg, Springer Sciences Business Media B.V. 2011, 389 p
9. Shishkin DN, Krupitskii SV, Kuznetsov SA. Extraction Generator of Ra-223 for Nuclear Medicine, Radiochemistry, 2011;53 : 404-406
10. Steyn GF, Vermeulen C, Szelecsenyi F et al. Cross sections of proton-induced reactions on 152Gd, 155Gd and 159Tb with emphasis on the production of selected Tb radionuclides. Nucl Instrum Methods Phys Res B. 2014;319 : 128-140
11. Morgenstern A, Lebeda O, Stursa J, et al. Production of U-230/Th-226 for Targeted Alpha Therapy via Proton Irradiation of Pa-231, Anal. Chem. 2008;80 : 8763-8770
12. NuDat 2.6 National Nuclear Data Center, Brookhaven National Laboratory; [online]. [cit. 1. 4. 2016]. Dostupné na: www.nndc.bnl.gov/nudat2/.
13. Andersson H, Elqqvist J, Horvath G et al. Astatine-211-labeled Antibodies for Treatment of Disseminated Ovarian Cancer: An Overview of Results in an Ovarian Tumor Model. Clin Cancer Res. 2003;9 : 3914-3921
14. Andersson H, Palm S, Lindegren S et al. Comparison of the therapeutic efficacy of 211At - and 131I-labelled monoclonal antibody MOv18 in nude mice with intraperitoneal growth of human ovarian cancer. Anticancer Res. 2001;21 : 409-412
15. Apostolidis C, Molinet R, McGinley J et al. Cyclotron production of Ac-225 for targeted alpha therapy. Appl Radiat Isot. 2005;62 : 383-387
16. U.S. National Institutes of health. Low Dose Cytarabine and Lintuzumab-Ac-225 in Older AML Patients. Ident. No.: NCT02575963
17. U.S. National Institutes of health. Targeted Atomic Nano-Generators (Actinium-225-Labeled Humanized Anti-CD33 Monoclonal Antibody HuM195) in Patients With Advanced Myeloid Malignancies. Ident. No.: NCT00672165
18. Kratochwil C, Bruchertseifer F, Giesel FL et al. 225Ac-PMSA-617 for PSMA-Targeted α-Radiation Therapy of Metastatic Castration-Resistant Prostate Cancer. J Nucl Med 2016;57 : 1941-1944
19. Meredith R F, Torgue J, Shen S et al. Pharmacokinetics and Imaging of 212Pb-TCMC-Trastuzumab After Intraperitoneal Administration in Ovarian Cancer Patients. Cancer Biotherapy & Radiopharmaceuticals. 2014;29 : 12-17
20. Sgouros G, Ballangrud AM, Jurcic JG et al. Pharmacokinetics and Dosimetry of an α-Particle Emitter Labeled Antibody: 213Bi-HuM195 (Anti-CD33) in Patients with Leukemia. J Nucl Med. 1999;40 : 1935-1946
21. Kozempel J, Vlk M, Málková E et al. Prospective carriers of Ra-223 for targeted alpha particle therapy. J Radioanal Nucl Chem. 2014;34 : 443-447
22. EMA: Xofigo (radium Ra-223 dichloride) [online]. 2017. [cit. 2. 1. 2016]. Dostupné na: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/002653/human_med_001692.jsp&mid=WC0b01ac058001d124.
23. Etchebehere EC, Milton DR, Araujo JC et al. Factors affecting 223Ra therapy: clinical experience after 532 cycles from a single institution. Eur J Nucl Med Mol Imaging. 2016;43 : 8-20
24. Rojas JV, Woodward JD, Chen N et al. Synthesis and characterization of lanthanum phosphate nanoparticles as carriers for 223Ra and 225Ra for targeted alpha therapy. Nucl Med Biol. 2015;42 : 614-620
25. Piotrowska A, Leszczuk E, Bruchertseifer F et al. Functionalized NaA nanozeolites labeled with 224,225Ra for targeted alpha therapy. J Nanopart Res. 2013;15 : 2082-2092
26. Mokhodoeva O, Vlk M, Málková E et al. Study of 223Ra uptake mechanism by Fe3O4 nanoparticles: towards new prospective theranostic SPIONs. J Nanopart Res 2016;18 : 301
27. Matsumura Y, Maeda H. A new Concept for Macromolecular therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Research 1986;46 : 6387-6392
28. Maeda H, Tsukigawa K, Fang J et al. A Retrospective 30 Years After Discovery of the Enhanced Permeability and Retention Effect of Solid Tumors: Next-Generation chemotherapeutics and Photodynamic Therapy – Problems, Solutions and Prospects. Microcirculation. 2016;23 : 173-182
29. Van Butsele K, Jérôme R, Jérôme C. Functional amphiphilic and biodegradable copolymers for intravenous vectorisation. Polymer. 2007;48 : 7431-7443
30. Patra Ch R, Bhattacharya R, Mukhopadhyay D. et al. Fabrication of gold nanoparticles for targeted therapy in pancreatic cancer. Advanced Drug Delivery Reviews 2010;62 : 346-361
31. Janiszewska Ł, Koźmiński P, Pruszyński M. et al. Gold Nanoparticle-Substance P(5-11) Conjugate as a Carrier for 211At in Alpha Particle Therapy. Abstrakt – 9th Symposium on Targeted Alpha Therapy, Varšava, Polsko (2015)
32. Kučka J, Hrubý M, Koňák Č. et al. Astatination of nanoparticles containing silver as possible carriers of 211At. Applied Radiation and Isotopes. 2006;64 : 201-206
Labels
Paediatric radiology Nuclear medicine Clinical oncology Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2018 Issue 1
Most read in this issue- Cílená alfa terapie a její místo v moderní nukleární medicíně
- Cévní malformace tváře zobrazená na scintigrafii skeletu
- Vliv monitorování pracoviště na radiační zátěž personálu na pracovišti PET
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



