-
Medical journals
- Career
Rekonstrukce SPECT obrazu skeletu s použitím dekonvoluce a vlnkové transformace
Authors: Jaroslav Ptáček 1,2; Lenka Henzlová 1; Pavel Koranda 1
Authors‘ workplace: Klinika nukleární medicíny, LF UP a FN Olomouc 1; Oddělení lékařské fyziky a radiační ochrany, LF UP a FN Olomouc 2
Published in: NuklMed 2015;4:42-50
Category: Original Article
Overview
Úvod:
Cílem práce bylo vytvořit nový algoritmus pro rekonstrukci projekčních dat při SPECT vyšetření skeletu a porovnat její výsledky s dostupnou standardní OSEM a resolution recovery rekonstrukcí.Materiál a metody:
Algoritmus používá Lucy-Richardsonovu dekonvoluci a logaritmické zpracování obrazu k úpravě projekčních dat. K potlačení šumu bylo využito modifikace koeficientů vlnkové transformace. V rámci fantomové studie byly hodnoceny změny poměru signálu k šumu (SNR), signálu k pozadí (SBR) a prostorového rozlišení. V klinické studii byly sledovány změny kontrastu, prostorového rozlišení a detekovatelnosti lézí.Výsledky:
Fantomová studie prokázala změnu v SNR (od – 4 do 40 %), nárůst SBR (od 19 do 40 %), malé zlepšení prostorového rozlišení a udržení obdobné hladiny šumu jako u klinicky používané OSEM. V porovnání s resolution recovery (RR) algoritmem bylo dosaženo horšího prostorového rozlišení, nižšího SNR, ale pouze o 3–13 % nižšího SBR. Navržený algoritmus vytváří obrazy pacientů s lepším kontrastem, což vede k lepší detekovatelnosti lézí v porovnání s klinicky používanou OSEM. V porovnání s RR rekonstrukcí více než polovina vytvořených obrazů vykazovala lepší kontrast a téměř polovina lepší detekovatelnost lézí.Závěr:
Navržený algoritmus vykazuje v porovnání se standardní OSEM dobré výsledky. Oproti RR rekonstrukci sice poměrně jednoznačně zaostává, ale i přesto poskytuje obrazy s pouze mírně sníženým SBR.Klíčová slova:
algoritmus, rekonstrukce SPECT, OSEM, RRÚVOD
SPECT vyšetření skeletu je standardní metodou doplňující celotělovou planární scintigrafii. 1 Všichni výrobci SPECT systémů v současné době nabízejí řešení ke zlepšení poměru signálu k šumu (SNR), kontrastu nebo poměru signálu k pozadí (SBR) a korekci efektu částečného objemu (PVE). Účelem těchto algoritmů je obnovit rozlišení obrazu (resolution recovery – RR) a potlačit šum v obraze a jsou založeny na modelu zobrazovacího systému zejména modelu odezvy dvojice kolimátor – detektor. 2,3 Vytvoření systémové matice, která obsahuje všechny důležité informace o zobrazovacím systému, a její použití v iterativní rekonstrukci, však bohužel není jednoduché.
Jednou z možností jak zlepšit prostorové rozlišení (a potlačit tak vliv PVE) je dekonvoluce obrazu s použitím funkce odezvy systému na bodový zdroj (PSF). K použití Lucy-Richardsonovy (LR) iterativní dekonvoluce 4,5 je nutné znát pouze PSF, která rozmazala obraz distribuce radiofarmaka. Dekonvoluční postupy bohužel výrazně zvyšují šum ve zpracovávaném obraze a kvůli tomu je často nutné metodu přerušit ještě před dosažením optimálních výsledků. Další zlepšení kvality obrazu (především kontrastu) je možné například s použitím logaritmického zpracování obrazu (LIP). LIP 6 je používáno pro celou řadu aplikací: vylepšení osvětlení scény, korekce kontrastu a doostření obrazu, detekce hran, segmentace a v neposlední řadě může být použito ke zpracování obrazu s použitím vlnkové transformace. Po úpravě projekcí pomocí dekonvoluce a LIP vznikají tomografické obrazy s lepším prostorovým rozlišením a kontrastem, ale se zvýšenou hladinou šumu. K potlačení šumu po ukončení iterativní rekonstrukce je běžně používán Gaussovský filtr. Obecnou nevýhodou takové filtrace je, že je stejnou měrou používána na všechny pixely bez ohledu na to, jestli obsahují signál nebo šum. Existují však i metody, které pracují s informací obsaženou v jednotlivých pixelech a umožňují selektivně potlačovat šum. Tyto metody jsou založené na vlnkové transformaci, která je použita k rozkladu obrazu a následné modifikaci koeficientů rozkladu s použitím vhodné prahovací metody. V této práci byla použita metoda označovaná jako Neighbourhood shrinking (NeighShrink), která je založena na průzkumu vlastností okolních pixelů. 7
Cílem práce bylo vytvořit nový algoritmus pro rekonstrukci SPECT vyšetření skeletu bez použití systémového modelu, nalezení jeho optimálních parametrů s pomocí fantomové studie a použití algoritmu s optimálním nastavením na pacientská data. Obrazy získané navrženým algoritmem byly porovnány s OSEM a RR algoritmem používaným v klinické praxi.
MATERIÁL A METODY
Dekonvoluce
Vznik scintigrafického obrazu je možné popsat jako konvoluci aktuální distribuce radiofarmaka s PSF zobrazovacího systému:
kde f je aktuální distribuce radiofarmaka, g je PSF, h je obraz distribuce radiofarmaka a * značí konvoluci. Dekonvoluce je opačný proces – aktuální distribuce f může být nalezena s použitím obrazu distribuce h a PSF systému g. K vyřešení rovnice (1) byla použita iterativní LR dekonvoluce. 4,5
Logaritmické zpracování obrazu
LIP zavádí obrazovou aritmetiku, která zabezpečuje, že při sčítání, odčítání nebo násobení obrazů nedojde k překročení rozsahu intenzit, ve kterém jsou obrazy definovány. 8 LIP definuje intenzitu obrazu F(i,j) na základě hodnot absorpce filtru f(i,j), přičemž hodnoty filtru jsou v rozmezí [0,M). Vztah mezi intenzitou obrazu a filtrem použitým k jeho vzniku je potom dán rovnicí: 6,9
Vztah 2 není ničím jiným než inverzí obrazu intenzity F(i,j). Použitím funkcí filtrů f(i,j) (takzvaných “greytone” funkcí), základních matematických operací LIP a normalizované komplementární transformace:
je možné přepsat Leeho vztah 10 určený k vylepšení kvality obrazu na:
kde
a f (i, j) f (i, j) jsou transformované greytone funkce před a po úpravě a a(i, j) je aritmetický průměr pixelů v (n x n) okolí pixelu f (i, j) . Parametry α a β umožňují měnit kontrast a ostrost obrazu. LIP operace jsou prováděny pixel po pixelu, jsou definovány v ( − ∞,M) f > 0, a proto mohou být použity i na koeficienty vlnkové transformace. Pro LIP operace však musí být matice koeficientů vlnkové transformace rozdělena na pozitivní a negativní část. V případě pozitivních koeficientů je nutné jejich převedení na příslušné hodnoty absorpčního filtru. Negativní koeficienty mohou být pokládány za odražený obraz a mohou být zpracovány rovnou. 11 Nevýhodou LIP je, že při zpracování negativních koeficientů není jejich rozsah zdola omezen. To vede k narušení symetrie koeficientů a možnému výskytu artefaktů ve zrekonstruovaném obraze (především na okrajích aktivních zdrojů).
Vlnková transformace a “neighborhood shrinking”
Pro potlačení šumu je běžně používána filtrace s pomocí Gaussovského filtru. Použití filtrace však vede ke zhoršení prostorového rozlišení, protože je aplikována na všechny pixely bez rozdílu. Metoda Neighboorhood shrinking naproti tomu umožňuje selektivně potlačit šum v jednotlivých pixelech. Předpokladem pro správnou funkci výše uvedeného algoritmu je Gaussovská distribuce šumu 12, což je ovšem obecný předpoklad při zpracovávání obrazů v nukleární medicíně zrekonstruovaných OSEM rekonstrukcí. 13
Pro zpracování obrazů v této práci byla použita multi-resolution analýza (MRA) 14,15 založená na rozkladu s použitím vysoko a nízko propustného filtru. V jednotlivých úrovních dekonvoluce jsou používány postupně se prodlužující filtry, což vede k translačně invariantní transformaci známé jako Undecimated Wavelet Transform (UDWT) 16,17 a umožňuje opětovnou rekonstrukci obrazu z modifikovaných koeficientů rozkladu. V každé úrovni dekompozice jsou vytvořeny čtyři matice koeficientů rozkladu (cA, cDver, cDhor, cDdia) a každá z nich má stejnou velikost jako originální obraz. Matice cA (matice aproximací) obsahuje informace o nízkých prostorových frekvencích, matice cDver, cDhor a cDdia obsahují informace o vysokých prostorových frekvencích v podobě vertikálních, horizontálních a diagonálních detailů.
NeighShrink metoda 7,18 je založena na předpokladu, že koeficienty detailů s vysokou hodnotou by ve svém okolí měly mít rovněž vysoké hodnoty koeficientů, pokud se jedná o užitečný signál. Jednotlivé koeficienty rozkladu jsou upravovány na základě vztahu:
kde mdij je hodnota modifikovaného koeficientu detailu dij na upravované úrovni rozkladu (index ij označuje pozici koeficientu v dané matici). Ve snaze vyhnout se příliš intenzivnímu potlačení šumu, které může dát vzniknout nadměrně vyhlazeným obrazům, je v případě vstupních dat s vysokou hladinou šumu (obrazy v nukleární medicíně) rozumné použít modifikované bij navržené v práci Mohideen SK a kol.: 19
kde 0 ≤ K ≤ 1 snižuje úroveň potlačení a umožňuje kontrolovat hladinu šumu ve zrekonstruovaném obraze. je suma čtverců hodnot pixelů v okolí dij. Znaménko + v (7) znamená, že k adaptaci hodnot pixelů jsou přímo použity pouze kladné hodnoty bij, kdežto negativní hodnoty jsou položeny rovny nule. Parametr l, odpovídající prahové hodnotě pro UniThresh metodu, byl vypočten v souladu s prací Shih YY a kol. 20 Modifikovaný obraz byl získán s použitím zpětné vlnkové transformace s použitím banky rekonstrukčních filtrů.
Algoritmus
K úpravě obrazu bylo použito následujících po sobě jdoucích kroků: LR dekonvoluce a LIP projekčních dat, OSEM rekonstrukce a NeighShrink zrekonstruovaných řezů.
PSF požadovaná pro LR dekonvoluci byla získána pomocí měření prostorové rozlišovací schopnosti detektoru s LEHR kolimátorem v 10, 15 a 20 cm a lineární regresí naměřených hodnot. FWHM PSF použitá pro úpravu projekcí byla vypočtena pro vzdálenost odpovídající poloměru Jaszczakova fantomu nebo jako aritmetický průměr výšky a šířky pacienta v daném transverzálním řezu. Získané rozměry byly upraveny s uvážením přítomnosti systému detekujícího povrch pacienta a skutečnou vzdálenost čela detektoru od pacienta nebo fantomu bylo nutné o výšku tohoto systému zvětšit. Pro Jaszczakův fantom byla tedy vypočtena FWHM PSF 9,04 mm.
V reálných podmínkách jsou různé vrstvy zobrazovaného objektu rozmazány různými PSF. V rámci akvizice jsou tyto rozmazané vrstvy sečteny a vzniká tak planární projekce. Použití jediné PSF na projekci by mohlo být zdrojem chyb. K posouzení vlivu použití jediné PSF byla provedena simulace s malým zdrojem rozmazaným danou PSF s tvarem Gaussovské křivky (simulace určité vzdálenosti zdroje od čela kolimátoru) a dekonvolvovaným pomocí různých PSF s FWHM menší a větší než PSF, která byla použitá pro rozmazání. Bylo zjištěno, že vliv použití jediné PSF pro všechny vzdálenosti by neměl zásadně ovlivnit výsledek vyšetření (s výjimkou možného nepatrného podhodnocení aktivity v centrální části). Je to dáno vlivem zeslabení signálu ze vzdálených vrstev objektu a rovněž vizuálním charakterem hodnocení SPECT vyšetření skeletu.
K provedení vlnkové transformace je nutné použít banku filtrů. Při zpracování obrazů v nukleární medicíně byly v pracech 13,17,21 demonstrovány dobré výsledky tzv. Koren-Laineovy banky filtrů: HiD = [-2 2], LoD = [0,125 0,375 0,375 0,125], HiR = [-0,0078125 -0,0546875 -0,171875 0,171875 0,0546875 0,0078125], LoR = [0,125 0,375 0,375 0,125].
LIP vyžaduje volbu vhodné velikosti okolí modifikovaného pixelu a hodnoty parametrů a a b. Větší okolí dává vzniknout ostřejším obrazům, ale za cenu většího nárůstu hladiny šumu, a proto bylo zvoleno nejmenší možné okolí 3x3 pixelů. LIP byla použita na koeficienty detailů v druhé úrovni rozkladu vlnkovou transformací. Díky použití delšího filtru jsou tyto koeficienty zatíženy nižší hladinou šumu než originální projekce a je v nich ještě zachováno přijatelné prostorové rozlišení. Jejich modifikace s použitím LIP vedla ke zřetelným změnám kontrastu a ostrosti obrazu v porovnání s LIP aplikovanou na originální projekce.
NeighShrink (stejně jako LIP) vyžaduje informaci o velikosti okolí modifikovaného pixelu. S rostoucí velikostí okolí klesá schopnost algoritmu potlačovat šum. Na druhou stranu je možné používat poměrně vysoké hodnoty K (v této studii byla použita matice 7 x 7). NeighShrink byla použita na sagitální, koronární a transverzální řezy a konečný výsledek byl získán jako aritmetický průměr obrazů ze všech rovin – pseudo-3D metoda.
Fantomová studie byla zaměřena na zjištění optimálního nastavení počtu iterací LR dekonvoluce, LIP, počtu iterací OSEM a hodnoty K v NeighShrink.
Všechny úpravy byly prováděny v prostředí programu Matlab (verze R2013a, MathWorks, USA). Pro dekonvoluci byla použita procedura deconvlucy. Pro rozklad a rekonstrukci obrazu vlnkovou transformací, LIP a NeighShrink byly sestaveny uživatelské procedury. V rámci OSEM rekonstrukce byly použity procedury radon a iradon. DICOM obrazy byly zpracovány s použitím dicomread, dicominfo a dicomwrite.
Fantomová studie
Pro fantomovou studii byl použit Jaszczak Flangless Esser PET PhantomTM (Data Spectrum Corporation, USA) obsahující plnitelné cylindrické zdroje o průměrech 8, 12, 16 a 25 mm. Velikosti lézí se nacházejí v oblasti, kde se viditelně projevuje PVE. Pozadí fantomu bylo naplněno aktivitou 130 MBq 99mTc. Léze byly naplněny tak, že bylo dosaženo poměru mezi aktivitou v lézi a pozadím 3,7 : 1, 9,5 : 1 a 12,6 : 1. Projekční data (tři studie od každého poměru objemových aktivit) byla získána na SPECT kameře Siemens e.cam Dual Head (Siemens Medical Solutions USA, Inc.) s klinicky používaným akvizičním protokolem (matice 128 x 128, rotace 180° na hlavu, 32 projekcí na hlavu, 15 sekund na projekci, necirkulární dráha detektorů, technika step and shoot, kolimátor LEHR). Akvizice probíhala při nastavení zoom 2 a pro každý poměr objemových aktivit byly navíc pořízeny dvě studie ve vysoké kvalitě (60 sekund na projekci), které byly použity k definování oblastí zájmu (ROI). Korekce na zeslabení Changovou metodou byla provedena v Matlab. Výsledky získané s optimalizovaným nastavením navrženého algoritmu byly porovnány s výsledky klinicky používané OSEM rekonstrukce s nastavením 8 subsetů, 4 iterace, 6 mm Gaussovský filtr.
Rovněž byla pořízena projekční data s pomocí scintilační kamery Infinia Hawkeye 4 (GE Healthcare, USA). Pozadí fantomu bylo naplněno stejnou aktivitou a byly použity tyto poměry objemových aktivit v lézi a pozadí: 3,5 : 1, 8,8 : 1 a 10,9 : 1. Pro akvizici byl použit klinický protokol: matice 128 x 128, rotace 180° na hlavu, 30 projekcí na hlavu, 15 sekund na projekci, necirkulární dráha detektorů, technika step and shoot, kolimátor LEHR. Byl použit zoom 2 a pořízeny dvě doplňkové studie ve vysoké kvalitě. Ke korekci na zeslabení byla místo CT metody použita Changova korekce provedená v Matlab. Výsledky získané pomocí navrženého algoritmu byly porovnány s výsledky RR algoritmu Evolution for Bone s klinicky používaným nastavením.
K měření prostorové rozlišovací schopnosti dosažené pomocí navrženého algoritmu, klinicky používané OSEM a Evolution for Bone byl použit čárový zdroj. Zdroj byl umístěn do vzdálenosti 10 cm od čela kolimátoru a byly použity stejné akviziční parametry jako pro studii s Jaszczakovým fantomem.
Pacientská studie
Porovnání výsledků navrženého algoritmu a klinicky používaných rekonstrukcí na stanicích Siemens e.soft a GE Xeleris 2 bylo provedeno na dvou skupinách, z nichž každá čítala dvacet pacientů. Surová data z obou modalit byla vybrána bez ohledu na výslednou diagnózu. V případě pacientských dat nebyla kvůli vysoké nehomogenitě v oblasti hrudníku a pánve použita korekce na zeslabení.
Navrženým algoritmem modifikované obrazy byly v DICOM formátu importovány zpět do vyhodnocovací stanice. Pro zobrazení stejných transverzálních, sagitálních, koronárních řezů a pseudo AP a PA projekcí vytvořených z koronárních řezů byl použit uživatelsky sestavený porovnávací zobrazovací protokol.
Analýza dat
S použitím automaticky vytvořených oblastí zájmu byly ve zrekonstruovaných řezech fantomem hodnoceny parametry SNR, SBR, úroveň šumu v pozadí a prostorové rozlišení. Změny těchto parametrů byly použity k určení optimálního nastavení jednotlivých kroků navrženého algoritmu.
Surová pacientská data byla zrekonstruována navrženým algoritmem s optimálním nastavením nalezeným ve fantomové studii a výsledky byly předány lékařům z oboru nukleární medicíny k provedení porovnání s výsledky klinicky užívaných rekonstrukcí (OSEM a RR). V rámci porovnávání byly hodnoceny následující parametry: kontrast obrazu (horší/stejný/lepší), detekovatelnost lézí (horší/stejná/lepší), prostorové rozlišení (horší/stejné/lepší), výskyt závažných obrazových artefaktů (ano/ne), úroveň a charakteristika šumu přijatelná (ano/ne), diagnostický přínos (ano/ne). Porovnání bylo provedeno nezávisle dvěma lékaři (25 a 7 let praxe).
Prvním krokem klinického hodnocení bylo posouzení reprodukovatelnosti (shody ve způsobu hodnocení) hodnocení lékařů. K tomu bylo použito Cohenovo kappa 22 (pro hodnocené parametry s možností volby ano/ne) a vážené Cohenovo kappa (pro ostatní parametry). 23
Vzhledem k použití pouze kategorických hodnocení byla z výsledků hodnocení dvou lékařů vytvořena jedna sada „souhrnných“ dat beroucí v úvahu nejkonzervativnější výsledek hodnocení (horší ze dvou hodnocení daného parametru dané studie). Tato souhrnná data byla použita pro porovnání výsledků navrženého algoritmu s klinicky používanou OSEM rekonstrukcí a s RR rekonstrukcí. K popisu výsledků vizuálního klinického hodnocení bylo použito konfidenčních intervalů pro párovaná data. 24
VÝSLEDKY
Fantomová studie
Při hledání optimálního nastavení jednotlivých kroků navrženého algoritmu byla vždy použita identická OSEM rekonstrukce bez systémové matice a postrekonstrukčního filtru. OSEM rekonstrukce dosahovala nejlepších výsledků – nejlepšího prostorového rozlišení zrekonstruovaného obrazu měřeného s pomocí čárového zdroje při 4 iteracích a 2 subsetech. S dalším nárůstem počtu iterací se již prostorové rozlišení neměnilo. U závislosti SNR cylindrických zdrojů na počtu iterací byl pozorován předpokládaný průběh. SNR nejdříve rostlo, po několika iteracích bylo dosaženo maxima a v důsledku rostoucí hladiny šumu poté došlo k jeho poklesu. Maximálních hodnot SNR bylo pro nejmenší objekty ve fantomu dosaženo taktéž při 4 iteracích a 2 subsetech.
K určení optimálního počtu iterací LR dekonvoluce bylo použito opakovaných úprav projekčních dat s následnou rekonstrukcí. Po počátečním nárůstu začal SNR během několika málo iterací klesat, což bylo dáno nárůstem šumu v dekonvolvovaných obrazech. Protože však došlo ke zlepšení prostorového rozlišení systému a tedy i částečné korekci PVE, byl pozorován nárůst SBR. (Obr. 1) Po čtyřech iteracích byla hodnota SNR pro malé objekty velmi blízká hodnotě po samotné OSEM rekonstrukci, avšak zároveň došlo k nárůstu SBR v rozmezí od 8 % pro nejmenší objekty s nejnižším poměrem objemové aktivity vůči pozadí až po 26 % pro největší objekty a největší poměr objemové aktivity. Po úpravách byla hladina šumu vyšší o 19 % v porovnání se samotnou OSEM rekonstrukcí.
Image 1. Změna SNR (plná čára) a SBR (přerušovaná čára) s rostoucím počtem iterací LR dekonvoluce (v porovnání s výsledkem OSEM rekonstrukce). 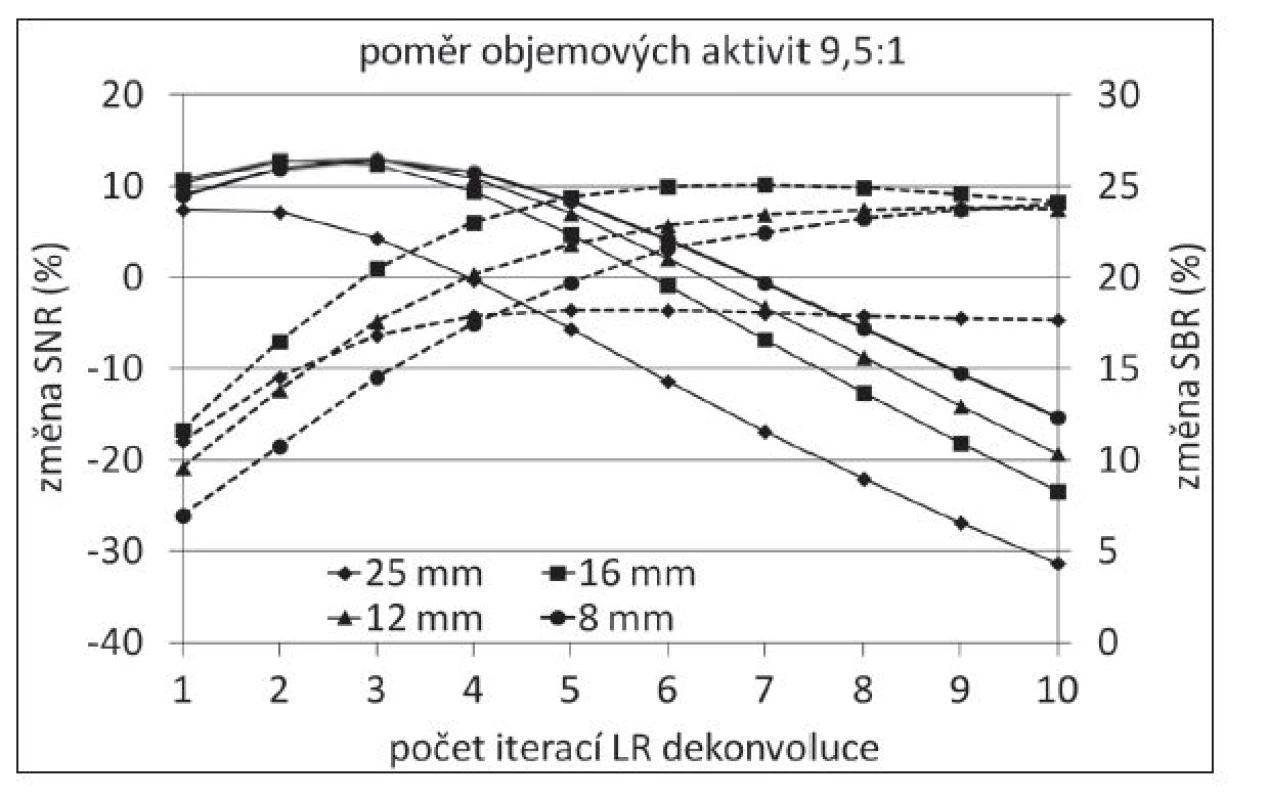
Projekce vytvořené LR dekonvolucí byly dále zpracovány pomocí LIP. Testovány byly všechny kombinace parametrů a a b v rozmezí hodnot 1, 2, a 3. Závislost SNR na použitém nastavení vykazovala pokles SNR s rostoucí hodnotou parametru β pouze malý nárůst SBR a vzrůstající hladinu šumu. Změna parametru α byla provázena významným nárůstem SNR, SBR a hladiny šumu. Kvůli možnému překročení skutečného ve fantomu nastaveného kontrastu mezi lézí a pozadím bylo nutné kontrolovat dosaženou hodnotu SBR. Při nastavení α = 2 a β = 1 nebyly pozorovány žádné artefakty v obraze a hodnota SBR největší léze byla blízko skutečnému poměru objemových aktivit. Pozorovaný nárůst SNR (SBR) v porovnání s výsledkem dekonvoluce se pohyboval v rozmezí 14 % (11 %) pro nejmenší léze s nejmenším poměrem objemových aktivit až po 26 % (36 %) pro největší léze a nejvyšší poměr objemových aktivit. (Obr. 2) Výsledná hladina šumu byla o 32 % vyšší v porovnání s OSEM.
Image 2. Změna SNR (plná čára) a SBR (přerušovaná čára) s měnícím se nastavením hodnot parametrů α a β (v porovnání s výsledkem LR dekonvoluce). 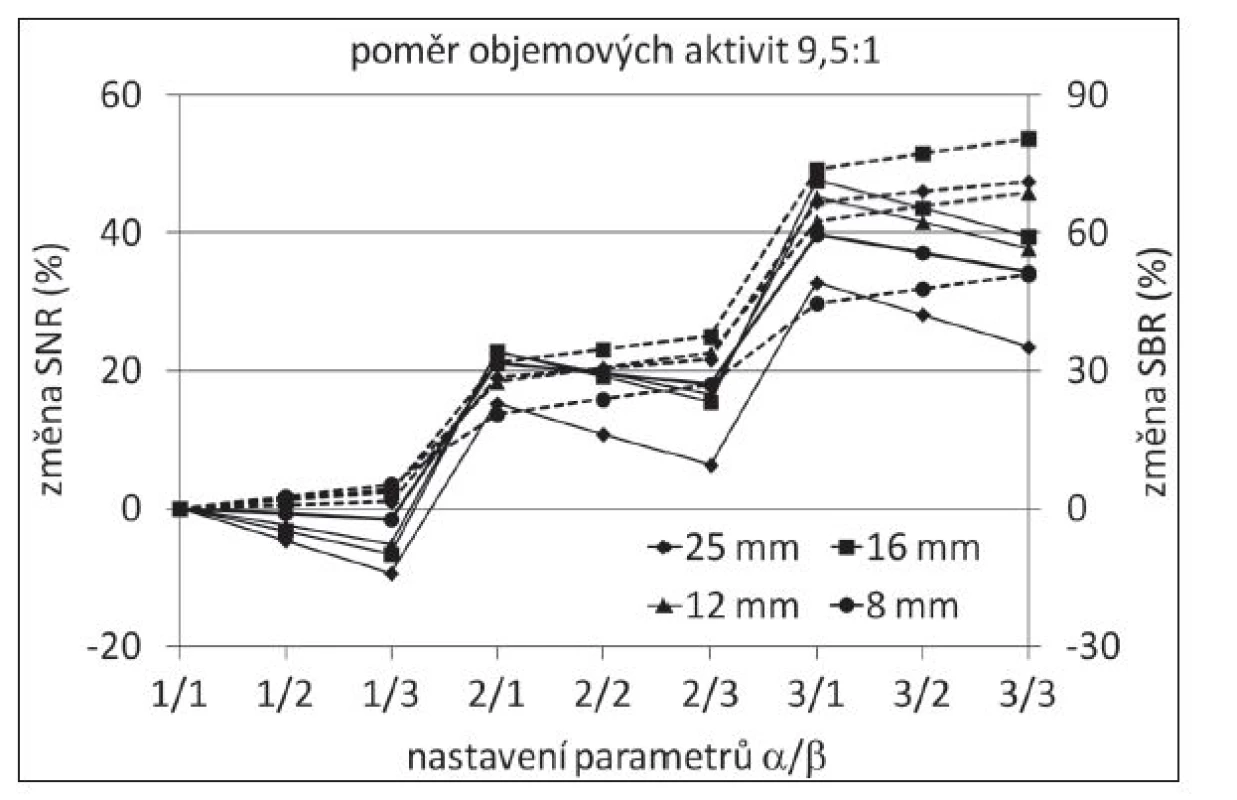
Cílem potlačení šumu bylo dosáhnout jeho obdobné hladiny jako před jakoukoli úpravou obrazu. Nastavení K bylo měněno v rozsahu od 0,1 do 1,0 (K = 1/k, kde k = 1,2,…10). Hodnota K = 0,25, při které byla výsledná hladina šumu v pozadí průměrovaná přes všechna měření všech fantomů naplněných stejnou aktivitou vyšší pouze o 1,6 % v porovnání s OSEM bez jakýchkoli dalších úprav, byla použita jako optimální nastavení NeighShrink. Podle očekávání došlo k poklesu SNR se slabším potlačením šumu a změna SBR byla v rozsahu použitých nastavení K malá. (Obr. 3)
Image 3. Změna SNR (plná čára) a SBR (přerušovaná čára) s měnícím se nastavením hodnot parametru K (v porovnání s výsledkem LIP). 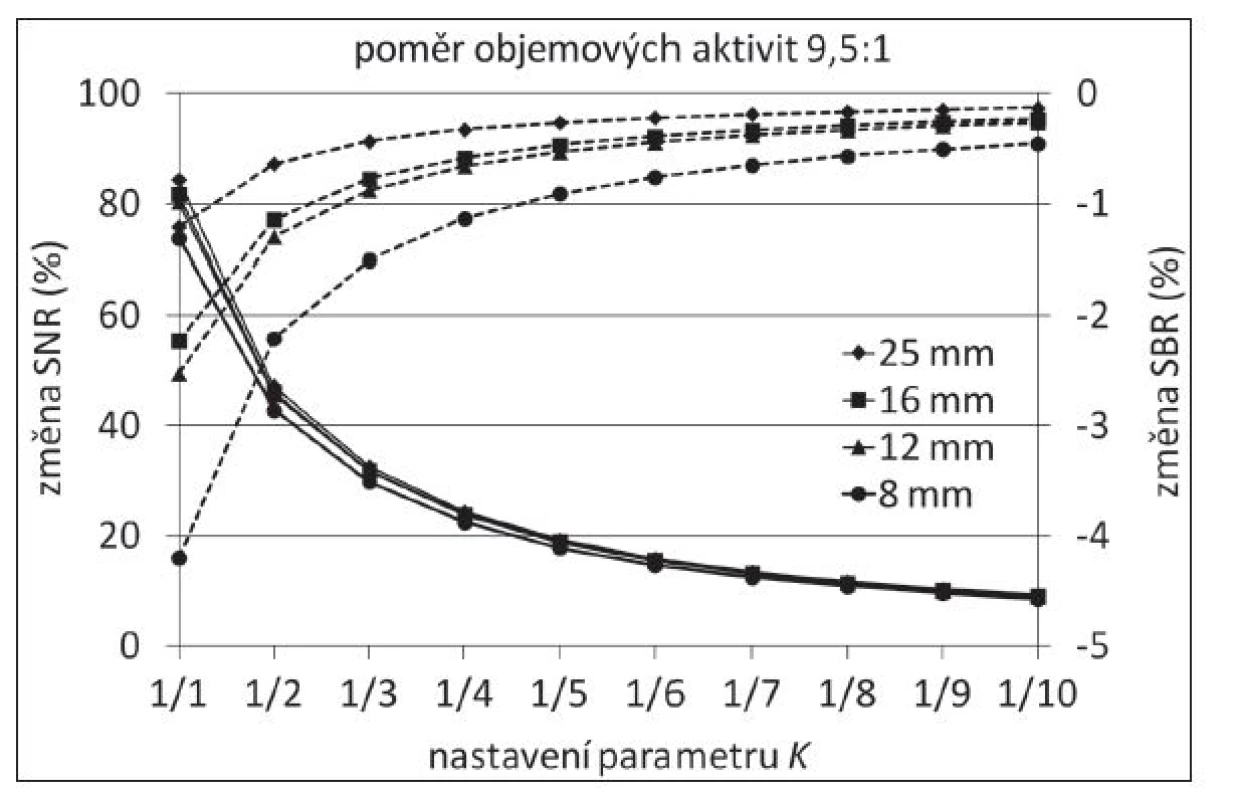
Použitím získaných hodnot nastavení jednotlivých kroků navrženého algoritmu bylo dosaženo nárůstu SNR (SBR) v rozmezí od 41 % (18 %) pro nejmenší léze a nejmenší poměr objemových aktivit až po 77 % (70 %) pro největší léze a největší poměr objemových aktivit.
Rovněž bylo dosaženo změn v prostorovém rozlišení.S navrženým algoritmem bylo na kameře Siemens e.cam DualHead dosaženo FWHM 5,4 mm (měřeno čárovým zdrojem ve vzdálenosti 10 cm od čela kolimátoru), na kameře Infinia Hawkeye 4 bylo změřeno rozlišení 5,1 mm. Rekonstrukcí s pomocí výrobcem dodaných rekonstrukčních algoritmů bylo dosaženo prostorového rozlišení 7,4 mm (OSEM, Siemens) a 4,7 mm (Evolution for Bone, GE Healthcare).
NeighShrink sice významným způsobem potlačila šum, ale jeho struktura byla pozměněna a pro lékaře byla nezvyklá. Proto bylo nakonec přistoupeno k použití filtrace výsledných obrazů. Optimální FWHM Gaussova filtru bylo získáno ze série měření hladiny šumu při použití filtrů různých FWHM. Při použití filtru s FWHM o velikosti 1,5 násobku velikosti pixelu (tedy 3,6 mm) bylo dosaženo obdobné hladiny šumu jako na obraze získaném s klinicky používanou OSEM. Zlepšení prostorového rozlišení zůstalo sice zachováno, ale rozdíl oproti klinicky používané OSEM již nebyl tak významný – 6,6 mm v porovnání se 7,4 mm (OSEM). Výsledky porovnání SNR a SBR získané s pomocí navrženého algoritmu a klinické OSEM jsou uvedeny v tabulce 1. Navržený algoritmus vykazoval lepší výsledky u menších objektů a menších objemových aktivit. Hlavním příspěvkem navrženého algoritmu ke zlepšení obrazu se ukázal nárůst SBR v rozmezí 19 až 40 % pozorovaný u všech objektů a všech objemových aktivit.
Table 1. Procentuální změny SNR a SBR po úpravách fantomových dat pomocí navrženého algoritmu vůči výsledkům klinicky používané OSEM rekonstrukce. 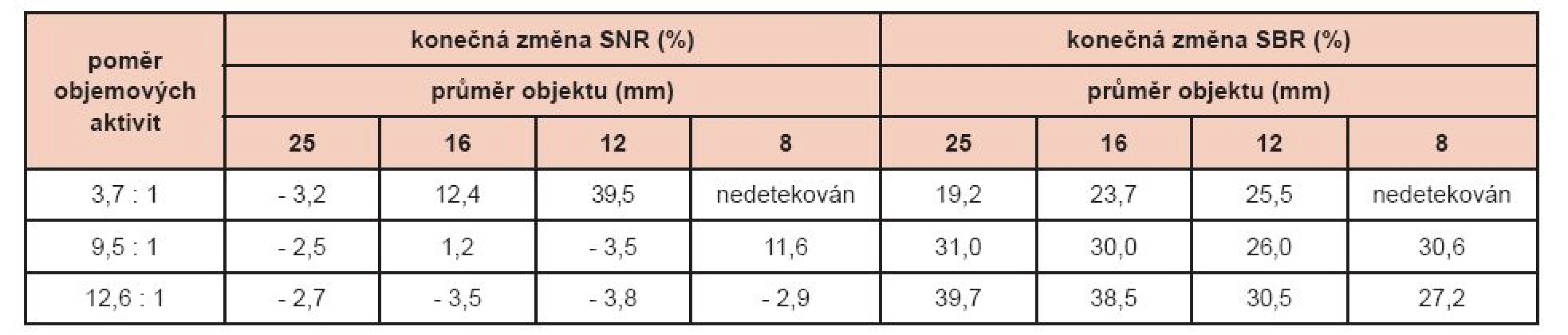
Pro porovnání kvality úprav s použitím navrženého algoritmu byla použita i projekční data získaná z kamery Infinia Hawkeye 4 a zrekonstruovaná pomocí RR algoritmu Evolution for Bone. Porovnání vyznělo ve prospěch pokročilejšího výrobcem dodávaného algoritmu. Výsledky jsou shrnuty v tabulce 2. Hodnoty SNR dosažené s navrženým algoritmem byly výrazně nižší než s Evolution for Bone, ale zjištěný rozdíl v SBR byl malý. Výsledná hladina šumu (20 %) byla vyšší než s RR algoritmem (17 %).
Table 2. Procentuální změny SNR a SBR po úpravách fantomových dat pomocí navrženého algoritmu vůči výsledkům rekonstrukce Evolution for Bone. 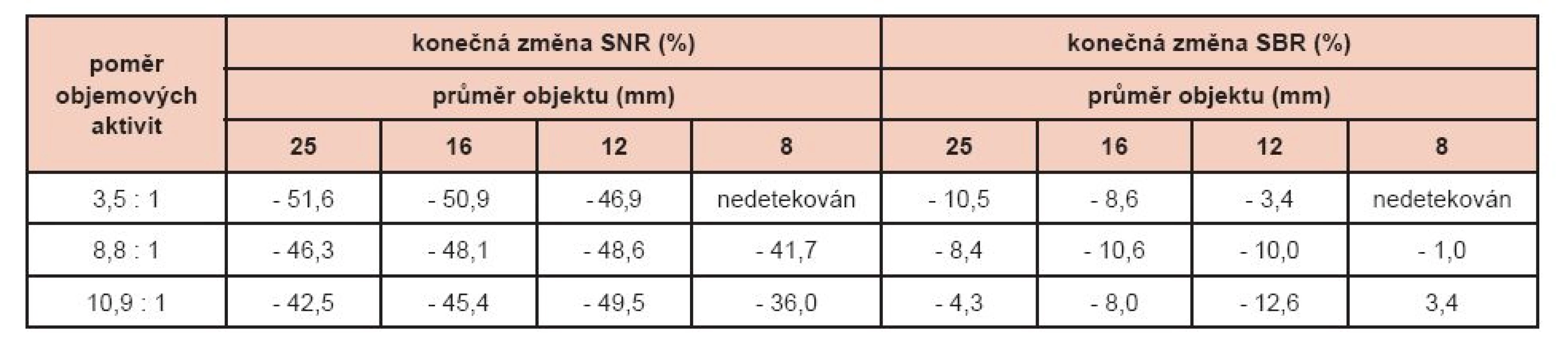
Pacientská studie
Žádný z hodnotitelů nezaznamenal výskyt výrazných artefaktů v obraze po rekonstrukci s pomocí navrženého algoritmu a v porovnání s klinicky používanou OSEM rekonstrukcí a resolution recovery rekonstrukcí. Obdobně tomu bylo při hodnocení šumu, kde 34 a 36 hodnocení ze 40 u lékaře č. 1 resp. č. 2 ukazovalo na přijatelnou hladinu a charakteristiku šumu. Výsledky subjektivního klinického hodnocení ostatních parametrů jsou uvedeny v tabulce 3. Reprodukovatelnost (shoda) výsledků hodnocení mezi hodnotiteli vyjádřená pomocí kappa byla Kw = 0,71 pro hodnocení kontrastu obrazu, Kw = 0,79 pro detekovatelnost lézí, K = 0,73 pro diagnostický přínos a Kw = 0,80 pro prostorovou rozlišovací schopnost.
Table 3. Výsledky vizuálního hodnocení kontrastu obrazu, rozlišení, detekovatelnosti lézí a diagnostického přínosu. 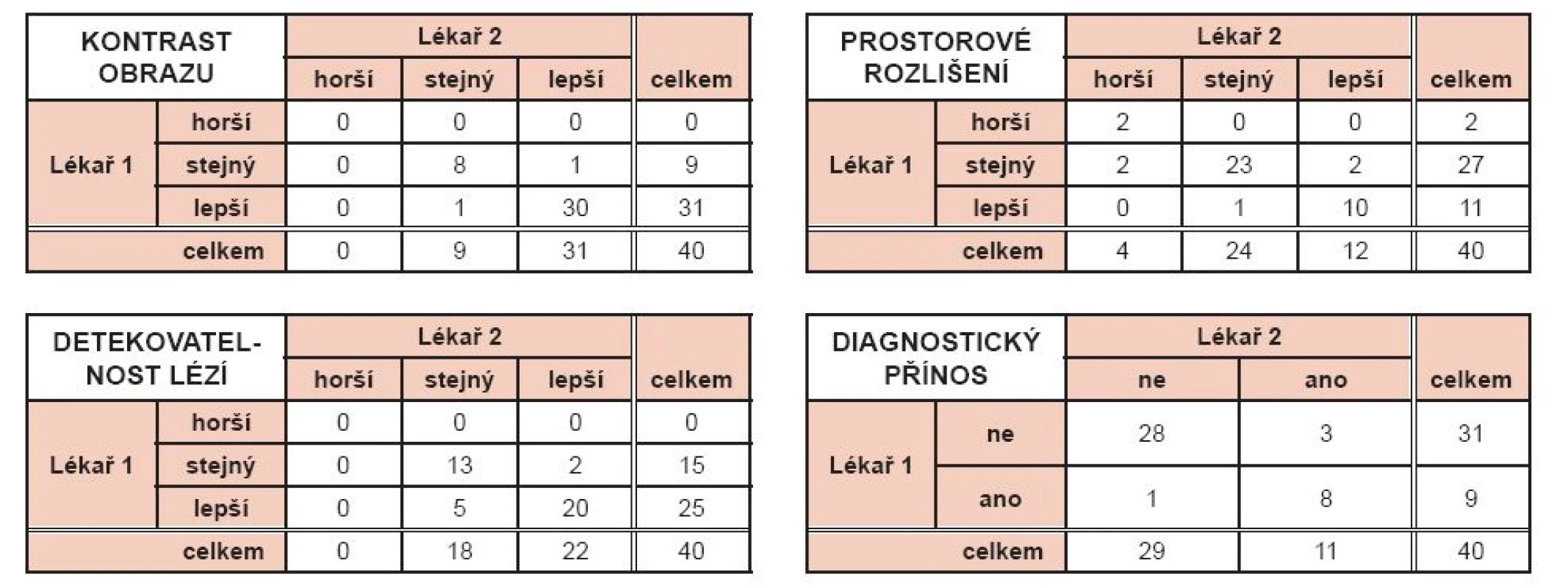
Obrazy získané s pomocí navrženého algoritmu byly obecně lépe hodnotitelné v porovnání s obrazy získanými pomocí klinicky používané OSEM rekonstrukce na stanici Siemens. Lepší kontrast (Obr. 4) byl pozorován v 19 z 20 případů (95 %; CI95 % = 85 % – 100 %) a lepší detekovatelnost lézí byla pozorována v 13 případech (65 %; CI95 % = 43 % – 88 %). Zároveň nebylo pozorováno zhoršení kontrastu ani detekovatelnosti. Ke zlepšení resp. zhoršení prostorové rozlišovací schopnosti došlo v 10 (50 %) resp. 2 případech (10 %). Konfidenční interval pro tuto vlastnost obrazu byl (95 %; CI95 % = – 6 % – 46 %). Artefakty nebyly pozorovány a úroveň šumu a jeho struktura byly akceptovatelné v 95 % studií. Diagnostický přínos navrženého algoritmu byl spatřován v 8 z 20 případů (40 %; CI95 % = 16 % – 63 %).
Image 4. Příklad změn ve kvalitě SPECT obrazu skeletu po provedení úprav navrženým algoritmem (horní řádek) v porovnání s klinicky používanou OSEM. 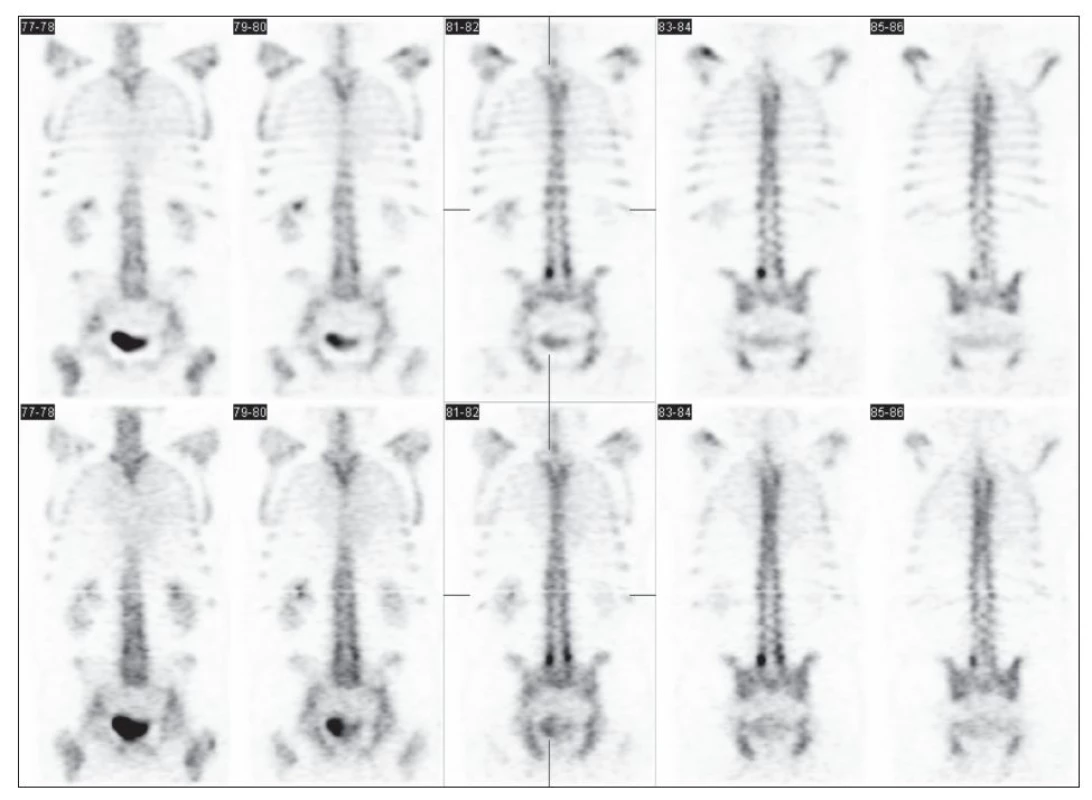
Porovnání pacientských studií zrekonstruovaných pomocí navrženého algoritmu s rekonstrukcí pomocí RR algoritmu Evolution for Bone ukázalo na zlepšení kontrastu a detekovatelnosti lézí v 11 z 20 případů (55 %; CI95 % = 31 % – 79 %) a zhoršení prostorové rozlišovací schopnosti ve 2 případech (10 %; CI95 % = – 4 % – 24 %). Závažné artefakty nebyly pozorovány, ale hladina a struktura šumu byly v některých případech označeny jako nevyhovující (25 %; CI95 % = 4 % – 46 %). Významný diagnostický přínos navrženého algoritmu v porovnání s Evolution for Bone nebyl pozorován.
DISKUZE
Každý z kroků použitého algoritmu byl optimalizován s cílem co možná nejlépe využít jeho charakteristických vlastností. Použití iterativních dekonvolučních technik je v literatuře zmiňováno v souvislosti s potlačením efektu částečného objemu. 3 Práce Teo BK a kol. 25 je zaměřena na post-rekonstrukční použití iterativní (Van-Clittert) dekonvoluční metody, Rizzo a kol. 26 použili dekonvoluci během OSEM rekonstrukce. Vlnková transformace a následná modifikace koeficientů rozkladu s použitím BayesShrink metody byla úspěšně použita k potlačení šumu v práci Boussion a kol. 27 Ve studiích 25,27 byly úpravy provedeny až po iterativní rekonstrukci s pomocí algoritmu dodaného výrobcem zobrazovacího systému. Tyto rekonstrukční algoritmy používají rozličné systémové modely a šum ve výsledném obraze je snížen použitím filtrace např. Gaussovským filtrem. Naproti tomu navržený algoritmus pracuje přímo s projekčními daty. Tomografické obrazy byly zrekonstruovány použitím OSEM rekonstrukční metody bez jakéhokoli modelu zobrazovacího systému. Výsledky fantomových měření prokázaly, že použití dekonvolučních metod vede především ke zlepšení kontrastu obrazu a umožňuje dosáhnout lepšího prostorového rozlišení. SNR měl nejprve rostoucí trend, ale po několika iteracích už nárůst SNR nemohl kompenzovat nárůst šumu v obraze a SNR postupně klesal. Kvůli tomu byl výsledný počet použitých iterací nízký.
V dostupné odborné literatuře se nepodařilo dohledat žádnou práci, která by se zabývala použitím LIP na obrazy v nukleární medicíně. V navrženém algoritmu byla LIP použita na úpravu koeficientů vlnkové transformace. Fantomová měření ukázala, že při změnách parametru a docházelo ke změnám SNR, SBR a k nárůstu hladiny šumu. Změny parametru b vedly k mírnému nárůstu SBR a poklesu SNR v důsledku rychlého nárůstu hladiny šumu. I přes omezení LIP dané možným výskytem obrazových artefaktů se metoda ukázala jako použitelná pro úpravu projekčních dat.
Pokusy s použitím vlnkové transformace pro potlačení šumu v nukleárně medicínských obrazech jsou poměrně časté. V nejjednodušších případech postačuje modifikace obrazu získaného přímo ze zobrazovacího přístroje pomocí některé z četných prahovacích metod. 13,14,15 Náročnější metody vyžadují k potlačení šumu nebo korekci PVE použití doplňkové anatomické informace z CT nebo MRI. 28,29,30 Navržený algoritmus používá prahovací metodu založenou na analýze informací z okolních pixelů – NeighShrink. Při použití NeighShrink na fantomová data nebylo nutné aplikovat post-rekonstrukční filtraci a přesto bylo dosaženo poklesu úrovně šumu po všech krocích algoritmu na podobnou úroveň, jaké bylo dosaženo s použitím klinické OSEM rekonstrukce. Použití Gaussovského filtru s malou FWHM na modifikovaná pacientská data sice ovlivnilo výsledné prostorové rozlišení zrekonstruovaných řezů, ale v míře menší než kdyby NeighShrink nebyla použita vůbec.
Hlavní výhodou navrženého algoritmu je jeho otevřenost a možnost měnit nastavení jeho jednotlivých kroků v případě použití na jiné nukleárně medicínské studie. Algoritmus je také snadno použitelný na jakémkoli typu SPECT zobrazovacího systému, protože OSEM rekonstrukce neobsahuje žádný model dat. V důsledku použití nejjednodušších možných metod nejsou získané výsledky zcela ideální. Přesto bylo prokázáno, že algoritmus dosahuje lepších výsledků než běžně dostupné algoritmy dodávané výrobci zobrazovacích systémů. Srovnání výsledků navrženého algoritmu s RR rekonstrukcí vyznělo ve prospěch pokročilejší metody, což je dáno použitím propracovaného systémového modelu. Použití dekonvoluce a LIP mělo za následek změny ve struktuře šumu v obraze. Původní víceméně rovnoměrně rozprostřený šum se zdál být více lokálně koncentrovaný do malých „zrn“. Tento typ šumu není na nukleárně medicínských obrazech běžně pozorován. Je však známo, že použití PSF nebo time-of-flight (TOF) rekonstrukce u moderních PET systémů vede právě k tomuto typu šumu v obraze.
Při použití navrženého algoritmu na projekční data pacientů získaná na kameře Siemens e.cam byl pozorován především nárůst kontrastu a s ním spojený nárůst SBR. V některých případech bylo zjištěno i zlepšení detekovatelnosti lézí, patrně v důsledku nárůstu SNR, SBR a také zlepšení prostorového rozlišení. Srovnání výsledků s RR rekonstrukcí plně nekorespondovalo s výsledky měření na fantomu. Oba lékaři označili kontrast obrazů získaných navrženým algoritmem za lepší v 58 % případů a detekovatelnost lézí za lepší ve 45 % případů. Rozdíl oproti fantomové studii vznikl patrně v důsledku rozdílů mezi strukturami obklopujícími aktivní léze v pacientovi a ve fantomu. Zatímco ve fantomu bylo použito homogenní pozadí, akumulace radiofarmaka v měkkých tkáních v blízkosti lézí u pacientů není homogenní. Stejně tak je rozdílná akumulace v kostní tkáni v porovnání s fantomovou studií. Tyto rozdíly ovlivňují jak LIP tak NeighShrink, protože oba tyto kroky algoritmu využívají informaci z okolních pixelů. Protože jsou obrazy získané s pomocí RR algoritmu již dostatečně kvalitní, měl nárůst kontrastu a detekovatelnosti lézí pouze malý vliv na výsledný klinický popis (nárůst nebo pokles počtu lézí nebo zvýšení diagnostické jistoty).
ZÁVĚR
Bylo ukázáno, že navržený algoritmus může být nasazen k úpravám SPECT studií skeletu a že jeho použití vede ke zlepšení parametrů zrekonstruovaného obrazu. Každá z použitých metod má však svoje omezení a volba jejich nastavení musí být provedena obezřetně. Díky nárůstu kontrastu obrazu, zlepšené detekovatelnosti lézí a vizuálně pozorované zlepšení prostorového rozlišení byla interpretace SPECT vyšetření skeletu jednodušší. Měnící se struktura šumu v získaných obrazech však v některých studiích navozovala subjektivní pocit chybějící nebo naopak přebývající informace. Navržený algoritmus může být použit například k vytvoření nezávislé rekonstrukce při optimalizaci klinicky používaných rekonstrukcí nebo jako kontrolní rekonstrukce v případě diagnostické nejistoty. Po odpovídající optimalizaci LR dekonvoluce, LIP a NeighShrink může být algoritmus použit také pro planární studie.
jaroslav.ptacek@fnol.cz
Sources
1. Bombardieri E. Aktolun C, Baum RP et al. Bone Scintigraphy Procedures Guidelines for Tumour Imaging [online] EANM 2003. [cit. 2013-03-16]. Dostupné na: http://www.eanm.org/publications/guidelines/gl_onco_bone.pdf0
2. Knoll P, Kotalova D, Köchle G et al. Comparison of advanced iterative reconstruction methods for SPECT/CT, Z Med. Phys. 2012; 22 : 58-69
3. Zaidi H ed., Quantitative Analysis in Nuclear Medicine Imaging, Springer, 2006
4. Richardson WH., Bayesian-Based Iterative Method of Image Restoration, J Opt Soc Am 1972;62 : 55–59. doi:10.1364/JOSA.62.000055
5. Lucy LB. An iterative technique for the rectification of observed distributions. Astronomical Journal 1974;79 : 745–754. doi:10.1086/111605
6. Pinoli JC. The logarithmic image processing model: connections with human brightness perception and contrast estimators. J Math Imaging Vis. 1997;7 : 341-358
7. Chen GY, Bui TD, Krzyzak A. Image denoising with neighbour dependency and customized wavelet and threshold. Pattern Recognition 2005;38 : 115-124
8. Fernandes M, Gavet Y, Pinoli JC. Improving focus measurement using logarithmic image processing. Journal of Microscopy 2010;242 : 228-2419
9. Deng G, Pinoli JC. Differentiation-based edge detection using the logarithmic image processing model. J Math Imaging Vis. 1998;8 : 161-180
10. Deng G, Cahill W, Tobin GR. The study of logarithmic image processing model and its application to image enhancement. IEEE Trans Image Process. 1995;4 : 506-512
11. Navarro L, Courbebaisse G. Symmetric Logarithmic Image Processing Model Application to Laplacian Edge Detection. [online]. 2012. [cit. 2013-04-24]. Dostupné na: http://hal.archives-ouvertes.fr/docs/00/71/19/04/PDF/Article.pdf
12. Chang SG, Bin Y, Vetterli M. Adaptive wavelet thresholding for image denoising and compression. IEEE Trans Image Proc 2000;9 : 1532-1546
13. Green GC. Wavelet-based denoising of Cardiac PET data (MASc Thesis). [online]. 2005. [cit. 2013-04-24]. Dostupné na: http://www.sce.carleton.ca/~geogreen/GeoffGreenMAScThesis.pdf
14. Fugal DL. Conceptual Wavelets In Digital Signal Processing – An In-Depth, Practical Approach for the Non-Mathematician, Space & Signal Technologies LLC, [online]. 2009. [cit. 2013-04-24]. Dostupné na: www.conceptualwavelets.com
15. Turkheimer FE, Brett M, Visvikis D et al. Multiresolution analysis of emission tomography images in the wavelet domain. J Cerebr Blood F Met 1999;19 : 1189-1208
16. Nowak RD, Baraniuk RG. Wavelet-domain filtering for photon imaging systems. IEEE Trans Image Proc 1999;8 : 666-678
17. Koren I, Laine A. A discrete dyadic wavelet transform for multidimensional feature analysis. In: M. Akay, editor. Time frequency and wavelets in biomedical signal processing. New Yor, IEEE Press, 1998, pp. 425-448
18. Cai TT, Silverman BW. Incorporating information on neighbouring coefficients into wavelet estimation. Sankhya Ser B 2001;63 : 127-148
19. Mohideen SK, Perumal SA, Sathik MM. Image de-noising using discrete wavelet transform. Int J Comput Sci Netw Sec 2008;8 : 213-216
20. Shih YY, Chen JC, Liu RS. Development of wavelet de-noising technique for PET images. Comput Med Imag Grap 2005;29 : 297-304
21. Lin JW, Laine AF. Improving PET-based physiological quantification through methods of wavelet denoising. IEEE Trans Biomed Eng 2001;48 : 202-212
22. Cohen J. A coefficient of agreement for nominal scales. Educational Psychological Meas 1960;20 : 37-46
23. Cohen J. Weighted kappa: nominal scale agreement with provision for scaled disagreement or partial credit. Psych Bull 1968;70 : 213-220
24. Gardner MJ, Altman DG. Statistics with confidence, BMJ; London, 1989
25. Teo BK, Seo Y, Bachatach SL et al. Partial-Volume Correction in PET: Validation of an Iterative Postreconstruction Method with Phantom and Patient Data, J Nucl Med 2007;802-810
26. Rizzo G, Castiglioni I, Russo G et al. Using Deconvolution to Improve PET spatial Resolution in OSEM Iterative Reconstruction. Methods Inf Med 2007;46 : 231-235
27. Boussion N, Cheze Le Rest C, Hatt M et al. Incorporation of wavelet-based denoising in iterative deconvolution for partial volume correction in whole-body PET imaging. Eur J Nucl Med Mol Imaging 2009;36 : 1064-1075
28. Turkheimer FE, Boussion N, Anderson AN et al. PET Image Denoising Using a Synergistic Multiresolution Analysis of Structural (MRI/CT) and Funtional Datasets, J Nucl Med 2008; 9 : 657-666
29. Boussion N, Hatt M, Lamare F et al. A multiresolution image based approach for correction of partial volume effects in emission tomography. Phys Med Biol 2006;51 : 1857-1876
30. Le Pogam A, Hatt M, Descourt P et al. Evaluation of a 3D local multiresolution algorithm for the correction of partial volume effects in positron emission tomography, Med Phys 2011;38 : 4920-4923
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2015 Issue 3
Most read in this issue- Dobutaminový test a SPECT myokardu
- Rekonstrukce SPECT obrazu skeletu s použitím dekonvoluce a vlnkové transformace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career








