-
Medical journals
- Career
Hodnocení efektivity tyreoeliminace radiojódem u diferencovaného karcinomu štítné žlázy
: Vladimír Dedek 1; Martin Formánek 2,3; Petr Matoušek 2,3
: Klinika nukleární medicíny, Fakultní nemocnice Ostrava 1; Otorinolaryngologická klinika, Fakultní nemocnice Ostrava 2; Katedra kraniofaciálních oborů, Lékařská fakulta, Ostravská univerzita, Ostrava 3
: NuklMed 2014;3:31-36
: Original Article
Úvod:
Součástí terapeutického postupu u diferencovaného karcinomu šítné žlázy (DTC) je po chirurgické léčbě tyreoeliminace zbytků štítné žlázy radiojódem (RJ).Cíl:
Hodnocení úspěšnosti tyreoeliminace radiojódem (TERJ) u nemocných operovaných na ORL klinice ve Fakultní nemocnici Ostrava (FNO) v letech 2007–2012.Materiál:
131 nemocných s DTC po téměř totální tyreoidektomii (nTTE), z toho 109 pacientů s papilárním (83 %) a 22 s folikulárním karcinomem (17 %). Zastoupení podle velikosti primárního tumoru: T1 72 pacientů, T2 21 pacientů, T3 5 pacientů, u 33 pacientů.nebyla velikost tumoru zjištěna (Tx).Metodika:
Hospitalizace na KNM za 5–6 týdnů po nTTE v hypotyreóze, provedení scintigrafie oblasti krku s vizuálním hodnocením zbytků tyreoidální tkáně, podání tyreoablační dávky 3,7 GBq 131I, rehospitalizace za 6 měsíců v myxedému, celotělová scintigrafie po diagnostické dávce 110–185 MBq 131I. Kritériem úspěšné TERJ je negativní nález v oblasti krku při scintigrafii. Sledovali jsme také efektivitu TERJ v závislosti na vstupní hladině tyreoglobulinu (Tg).Výsledky:
Při kontrolní celotělové scintigrafii nebyla patrná na krku žádná tyreoidální tkáň u 105 ze 131 nemocných (80 %). Ve 26 případech (20 %) TERJ nebyla úspěšná a byla nutná další terapie RJ. Pravděpodobnost úspěšné TERJ pro hladinu Tg <1 µg/l byla 8 : 1, pro Tg mezi 1–10 µg/l 4,25 : 1 a pro Tg >10 µg/l 0,75 : 1.Závěr:
Úspěšnost TERJ v 80 % případů je srovnatelná s literárními údaji a svědčí pro uspokojivou radikalitu operací prováděných na ORL klinice FNO. Vstupní hladina tyreoglobulinu je důležitý faktor predikce úspěšnosti radioablace zbytků štítné žlázy a při jeho vyšších hladinách (obvykle nad 10 µg/l) preferujeme při kontrolní hospitalizaci přímé podání léčebné dávky 131I.Klíčová slova:
diferencovaný karcinom štítné žlázy, tyreoeliminace radiojódem, celotělová scintigrafie, hladina tyreoglobulinuÚvod
Neoplazie štítné žlázy představují velmi heterogenní skupinu nádorů. Nejfrekventovanějším typem nádorů tyreoidálního původu jsou epitelové tumory vycházející z folikulárních buněk. Z malignit mají obecně nejpříznivější biologické chování dobře diferencované nádory, které jsou zastoupeny papilárním a folikulárním karcinomem.
Úvodním krokem léčby takových tumorů je samozřejmě léčba chirurgická, která je optimálně indikována v rozsahu totální tyreoidektomie (TTE). V praxi se však nejčastěji operatérovi nepodaří kompletně odstranit veškerou tyreoidální tkáň a strumektomie je ve skutečnosti provedena v rozsahu subtotálním (STE) nebo téměř totálním (nTTE). K dokončení kompletního odstranění zbytků štítné žlázy pak klinický lékař (endokrinolog) odesílá nemocného k tyreoeliminaci radiojódem (TERJ), která se provádí za hospitalizace na lůžkové části oddělení nukleární medicíny. Při opakované hospitalizaci za několik měsíců je pak možno scintigraficky prokázat vymizení funkční tyreoidální tkáně z oblasti lůžka štítné žlázy. Je zřejmé, že pravděpodobnost úspěšně dokončené tyreoablace radiojódem (RJ) je dána hlavně radikalitou provedené operace.
Cíl
Cílem naší práce je zhodnotit efektivitu TERJ provedené na lůžkové jednotce Kliniky nukleární medicíny (KNM) u nemocných operovaných na ORL klinice ve FN Ostrava (FNO).
Materiál a metodika
Do souboru bylo zařazeno celkem 131 nemocných operovaných v letech 2007–2012 s histologickým nálezem papilárního nebo folikulárního karcinomu štítné žlázy, kteří byli poté odesláni k TERJ na KNM. Ve 116 případech byla klinikem přímo indikována TTE, v 15 případech se TTE dokončovala ve druhé době, kdy až po histologickém vyšetření z první operace vyšla najevo malignita štítné žlázy. Ve 109 případech z celkového počtu 131 pacientů (83 %) se jednalo o papilární typ karcinomu, u 22 nemocných (17 %) byl nalezen folikulární karcinom. U 72 nemocných byla velikost primárního tumoru podle TNM klasifikace T1, u 21 pacientů T2, u 5 nemocných T3 a u 33 z nich nebyla velikost tumoru při retrospektivním zkoumání zjištěna (Tx). V 50 případech byla histologicky prokázána angioinvaze a/nebo invaze do pouzdra tumoru a/nebo do pouzdra štítné žlázy. U 33 nemocných se jednalo o multicentrický nádor, u 22 pacientů byly postiženy regionální lymfatické uzliny a ve 4 případech byly scintigraficky prokázány vzdálené metastázy (2× do kostí, 1× do plic a 1× do jater). (Tab. 1)
1. Rozsah onemocnění pacientů v souboru. Vysvětlivky: TNM klasifikace (aktuální 7. vydání, rok 2009), (m) - multicentrický tumor, N1 - pozitivní histologický nález v regionálních lymfatických uzlinách, M1 - scintigraficky prokázané vzdálené metastázy, invaze - histologický popis invaze nádoru do pouzdra tumoru a/nebo do pouzdra štítné žlázy a/nebo do cév. 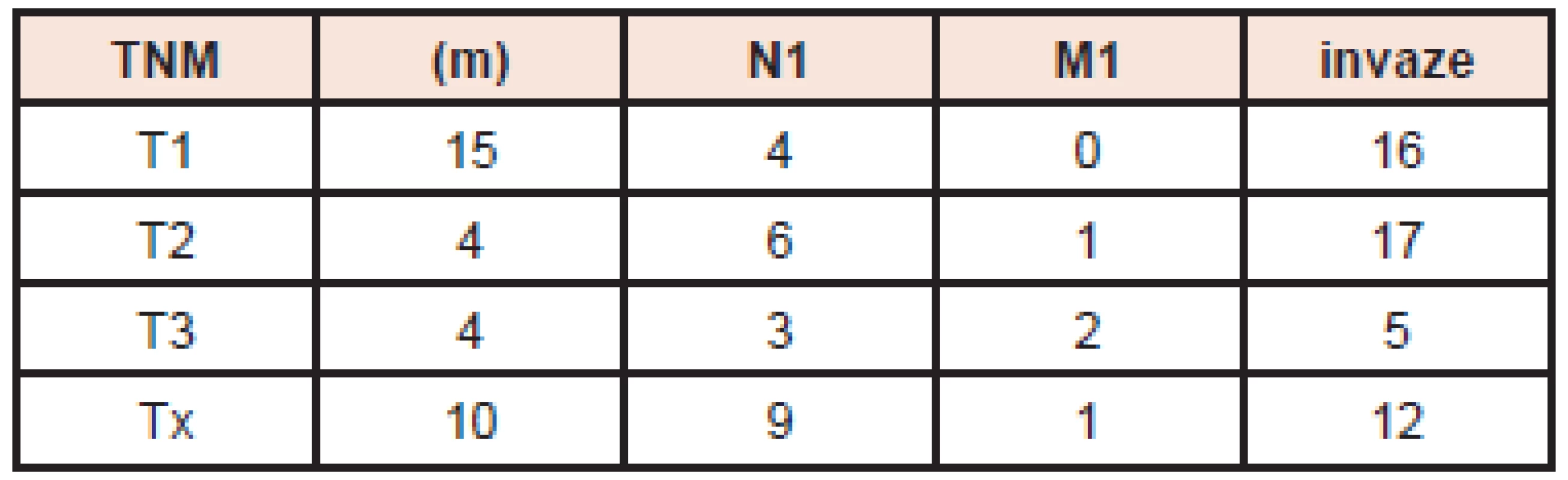
Kromě operace štítné žlázy na ORL klinice FNO a následné tyreoablaci RJ byla podmínkou pro zařazení do souboru také rehospitalizace na KNM k provedení kontrolní celotělové scintigrafie a posouzení efektivity TERJ. Klinickým kooperujícím lékařem byl ve všech případech endokrinolog, který na základě histologického nálezu objednal pacienta k hospitalizaci na KNM s odstupem 5–7 týdnů od operace. Zásadní podmínkou bylo nenasazování hormonální substituce po operaci a vyvarování se aplikace jódu ve všech formách, zejména jódových kontrastních látek při rtg vyšetření.
Po přijetí k první hospitalizaci na KNM jsme odebírali testy in vitro k ověření stupně hypotyreózy s požadovanou optimální hladinou TSH nad 30 mU/l. Dále jsme stanovovali koncentraci tyreoglobulinu (Tg) a protilátek proti tyreoglobulinu (anti-Tg) v krvi. U všech nemocných jsme nejprve provedli scintigrafii oblasti krku po podání 20 MBq 131I k vizuálnímu hodnocení reziduální tkáně po nTTE. U některých nemocných jsme měřili akumulaci RJ v oblasti krku v procentech za 6 a 24 hodin. Při podezření na postižení krčních lymfatických uzlin či nepřijatelně velkého rezidua laloků štítné žlázy jsme doplňovali ultrazvukové (USG) vyšetření krku. Tyreoeliminační dávku RJ jsme aplikovali per os ve formě kapsle o standardní radioaktivitě 3,7 GBq (100 mCi) 131I, výjimečně u rizikovějších pacientů 5,0–7,4 GBq 131I. Pátý až sedmý den po podání RJ jsme nasazovali hormonální substituci, po přibližně 2 měsících při ambulantní kontrole ověřili její dostatečnost vyšetřením hladin FT4 a TSH a naplánovali termín kontrolní hospitalizace v myxedému s odstupem 6 měsíců od první hospitalizace. Jeden měsíc před rehospitalizací jsme hormony štítné žlázy nemocným vysadili.
V průběhu druhé hospitalizace jsme aplikovali per os diagnostickou dávku radiojódu 110–185 MBq (3–5 mCi) 131I ve formě roztoku, u rizikových nemocných (invaze tumoru do okolí štítné žlázy, postižení LU, vícečetná rezidua, vyšší vstupní hladina Tg) jsme podali přímo dávku terapeutickou (kapsle 7,4 GBq (200 mCi) 131I). Za 48 hodin po diagnostické aplikaci RJ, resp. za 5 dní po léčebné dávce jsme provedli celotělovou (WB) scintigrafii, případně SPECT/CT (CT v „low dose“ režimu) oblasti krku a hrudníku. Kritériem úspěšné TERJ byl negativní nález v oblasti krku při scintigrafii doprovázený poklesem hladiny Tg.
Výsledky
Z celkového počtu 131 nemocných po operaci pro DTC, kteří podstoupili TERJ, jsme u 4 pacientů již při první hospitalizaci scintigraficky v oblasti krku neprokázali žádnou reziduální tyreoidální tkáň. V těchto případech tak můžeme hovořit o stavu po TTE. Hladina Tg se pohybovala mezi 0,1–0,4 µg/l, jen u jednoho pacienta byla zvýšená hladina protilátek anti-Tg. (Obr. 1)
1. Příklad TTE - bez rezidua v lůžku štítné žlázy po operaci. Vysvětlivky: nativní - scintigram oblasti krku, značení - scintigram stejné oblasti se značkou v místě jugula a nad ním se značením jizvy po TTE. 
U těchto nemocných jsme proto provedli za 5 dní po podání tyreoablační dávky RJ také WB scintigrafii, která byla u tří z nich negativní. V jednom případě (právě u nemocné se zvýšenou hladinou anti-Tg) jsme překvapivě prokázali několik malých ložisek v obou plicích. (Obr. 2)
2. Stejný pacient jako na obr. 1, plicní metastázy. Vysvětlivky: celotělová scintigrafie a SPECT/CT hrudníku po podání tyreoablační dávky RJ, hladina Tg 0,3 μg/l, anti-Tg 221 U/ml. 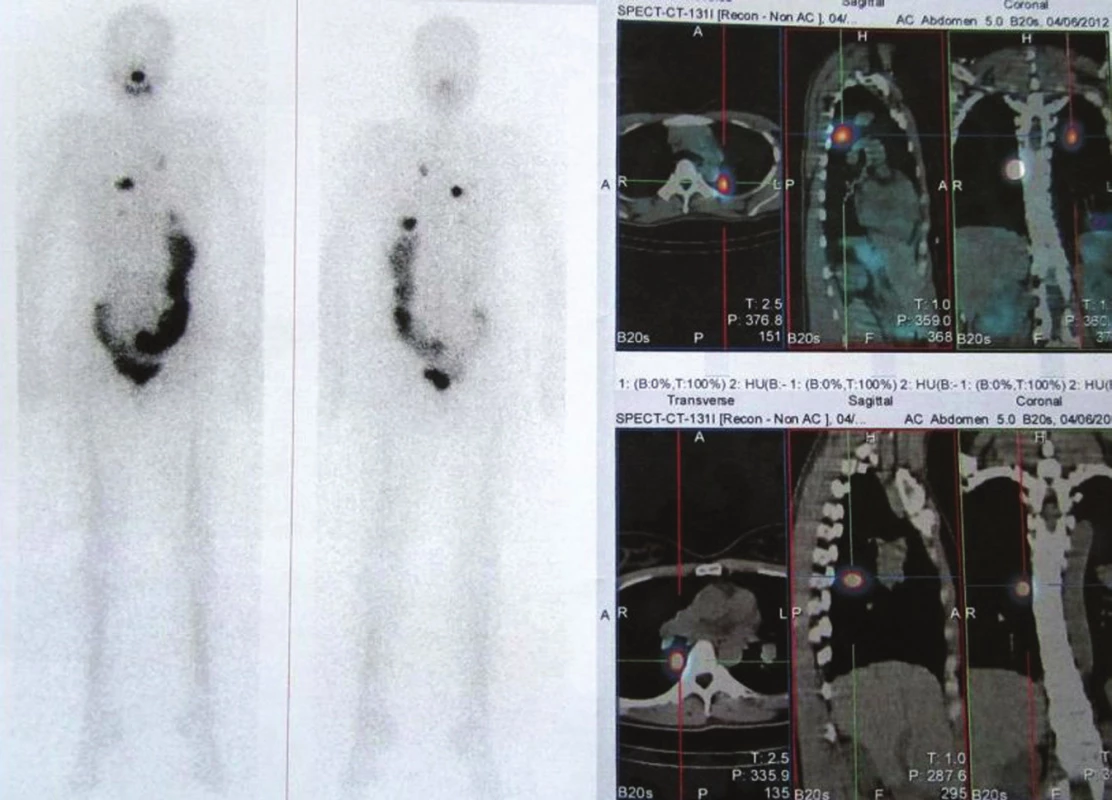
Z tohoto důvodu jsme s odstupem 6 měsíců podali léčebnou dávku radiojódu (7,4 MBq 131I) a na postterapeutickém scintigramu jsme v plicích prokázali úplnou regresi akumulujících metastáz. (Obr. 3)
3. Stejný pacient jako na obr. 1 a 2, vymizení plicních metastáz. Vysvětlivky: stav po terapii RJ pro plicní metastázy, postterapeutický scintigram - negativní nález při celotělové scintigrafii, hladina Tg 0,1 μg/l, anti-Tg 33 U/ml (pokles hodnot). 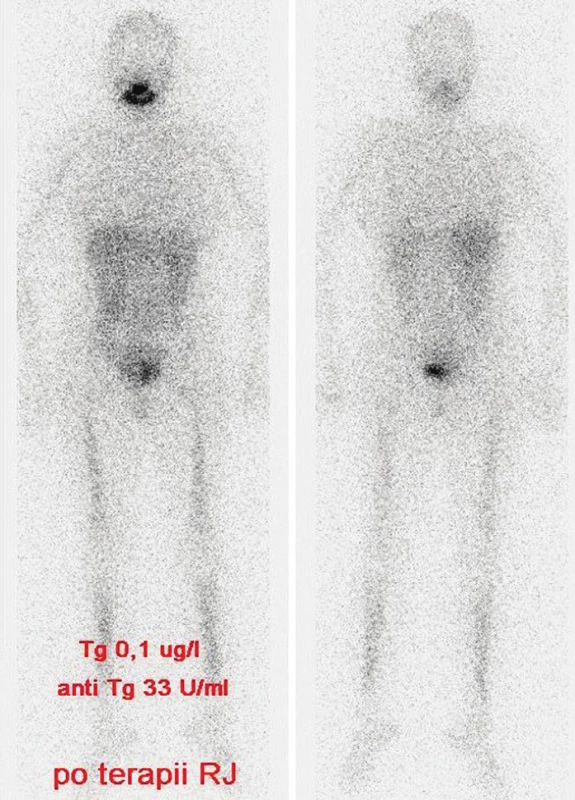
V dalších 101 případech byly v oblasti krku prokázány okrsky depozice radiojódu různého počtu a velikosti, které při kontrolní WB scintigrafii za půl roku již nebyly patrné. Příklady reziduální tyreoidální tkáně v lůžku štítné žlázy, resp. v oblasti lobus pyramidalis. (Obr. 4 a 6)
4. Příklad úspěšné TERJ. Vysvětlivky: nativní - stav po nTTE, drobné okrsky tyreoidální tkáně v oblasti lůžka štítné žlázy; značení - scintigram stejné oblasti se značkou v místě jugula a nad ním s vyznačením jizvy po nTTE, hladina Tg 3,1 μg/l, při scintigrafii za 6 měsíců již bez reziduální tkáně. 
5. Příklad úspěšné TERJ. Vysvětlivky: nativní - stav po nTTE, drobné okrsky tyreoidální tkáně v oblasti lobus pyramidalis; značení - scintigram stejné oblasti se značkou v místě jugula a nad ním se značením jizvy po nTTE, hladina Tg 1,1 μg/l, (při scintigrafii za 6 měsíců již bez reziduální tkáně). 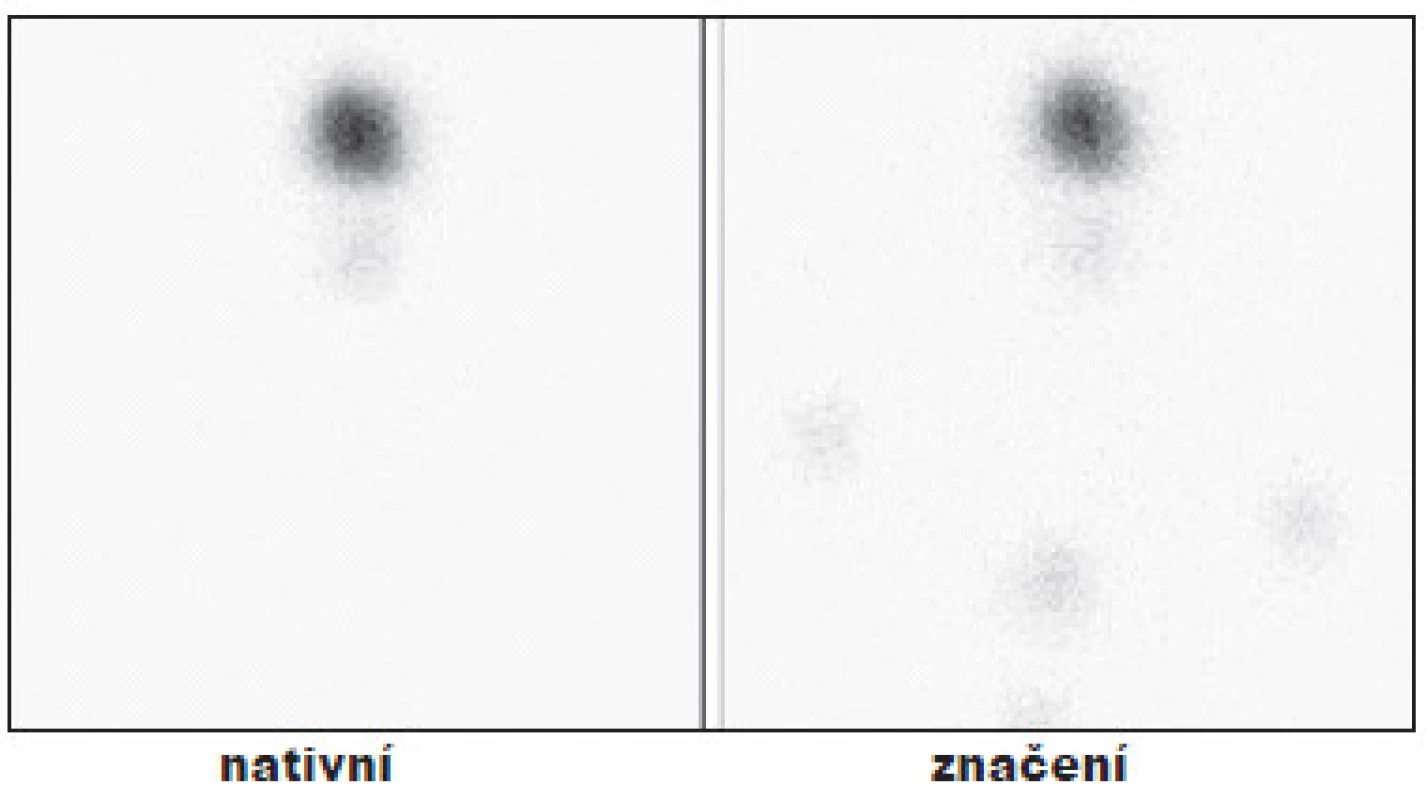
Příklad negativního nálezu při kontrolní WB scintigrafii provedené při rehospitalizaci v myxedému za půl roku u nemocné s nálezem reziduí po nTTE na scintigramu krku (Obr. 4) je uveden na obr. 5. Hladina Tg klesla po eliminaci zbytků štítné žlázy z 3,1 na 0,1 µg/l.
6. Stejný pacient jako na obr. 4 - příklad úspěšné TERJ. Vysvětlivky: negativní celotělová scintigrafie po diagnostické aplikaci radiojódu, hladina Tg 0,1 μg/l. 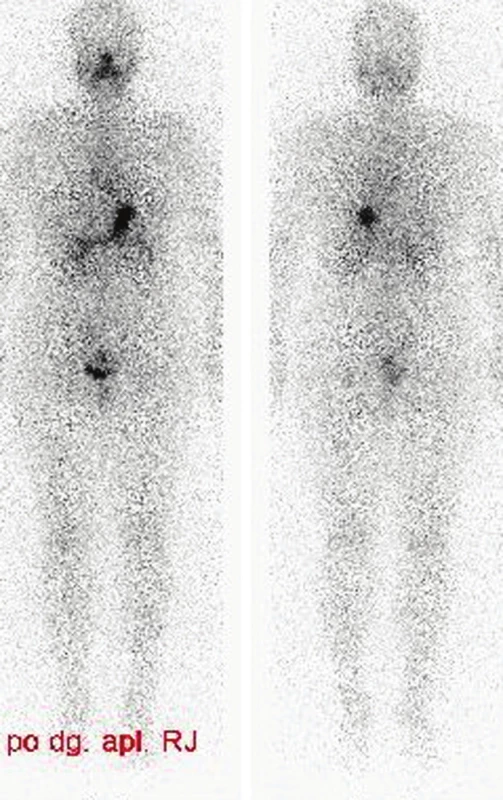
Celkový počet nemocných s průkazem eliminace funkční tyreoidální tkáně po TERJ byl 105 z celkového počtu 131 pacientů (80 %). Hladina Tg se u 104 z nich pohybovala mezi 0,1–15,9 µg/l, pouze v jednom případě byla hodnota výrazně zvýšená (70,1 µg/l) v důsledku kostních metastáz.
U dalších 26 ze 131 nemocných (20 %) se při kontrolní WB scintigrafii zobrazila reziduální funkční tyreoidální tkáň v oblasti lůžka štítné žlázy případně také známky postižení regionálních LU v laterálních částech krku a vzdálené metastázy. Hladina Tg se pohybovala v této skupině v rozmezí 0,4–491 µg/l. Tyto nálezy při WB scintigrafii v budoucnu vyžadovaly další podání léčebných dávek radiojódu s odstupem 6–12 měsíců. Příklady scintigramů jsou uvedeny na obr. 7–10.
7. Příklad neúspěšné TERJ. Vysvětlivky: nativní - stav po nTTE, protáhlý okrsek depozice radiojódu v oblasti lobus pyramidalis; značení - scintigram stejné oblasti se značkou v místě jugula a se značením jizvy po nTTE, hladina Tg 6,6 μg/l, (za 6 měsíců celotělová scintigrafie - perzistující rezidua). 
8. Příklad neúspěšné TERJ. Vysvětlivky: nativní - stav po nTTE, vícečetná rezidua v místě obou laloků a v oblasti lobus pyramidalis; značení - scintigram stejné oblasti se značkou v místě jugula a se značením jizvy po nTTE, hladina Tg 92,1 μg/l, (za 6 měsíců celotělová scintigrafie - perzistující rezidua) 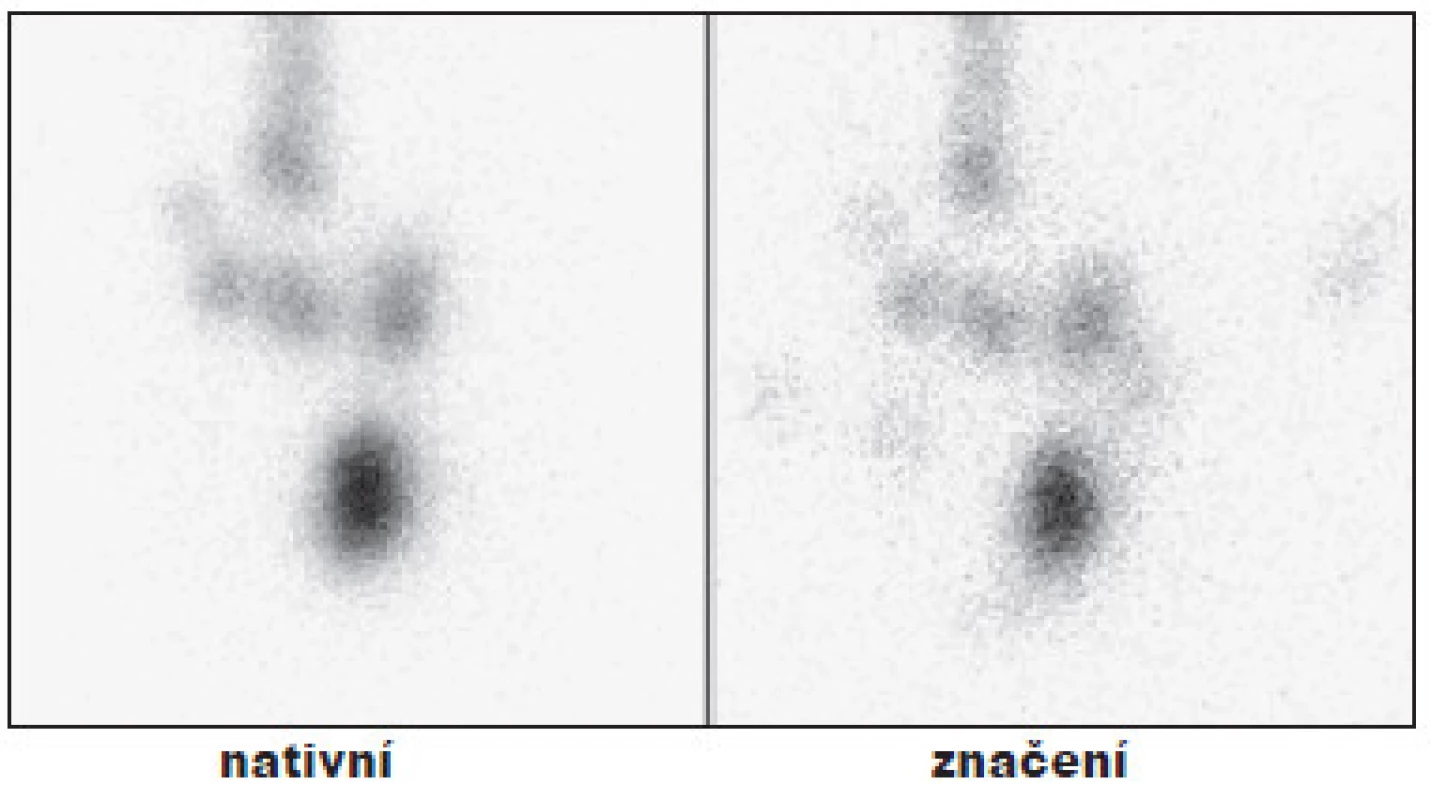
9. Příklad neúspěšné TERJ. Vysvětlivky: nativní - stav po nTTE, jedno větší reziduum těsně pod jizvou po nTTE, značení - scintigram stejné oblasti se značkou v místě jugula a se značením jizvy po nTTE, hladina Tg 23,0 μg/l, anti- -Tg negativní, akumulace RJ za 24 hodin 16 %. 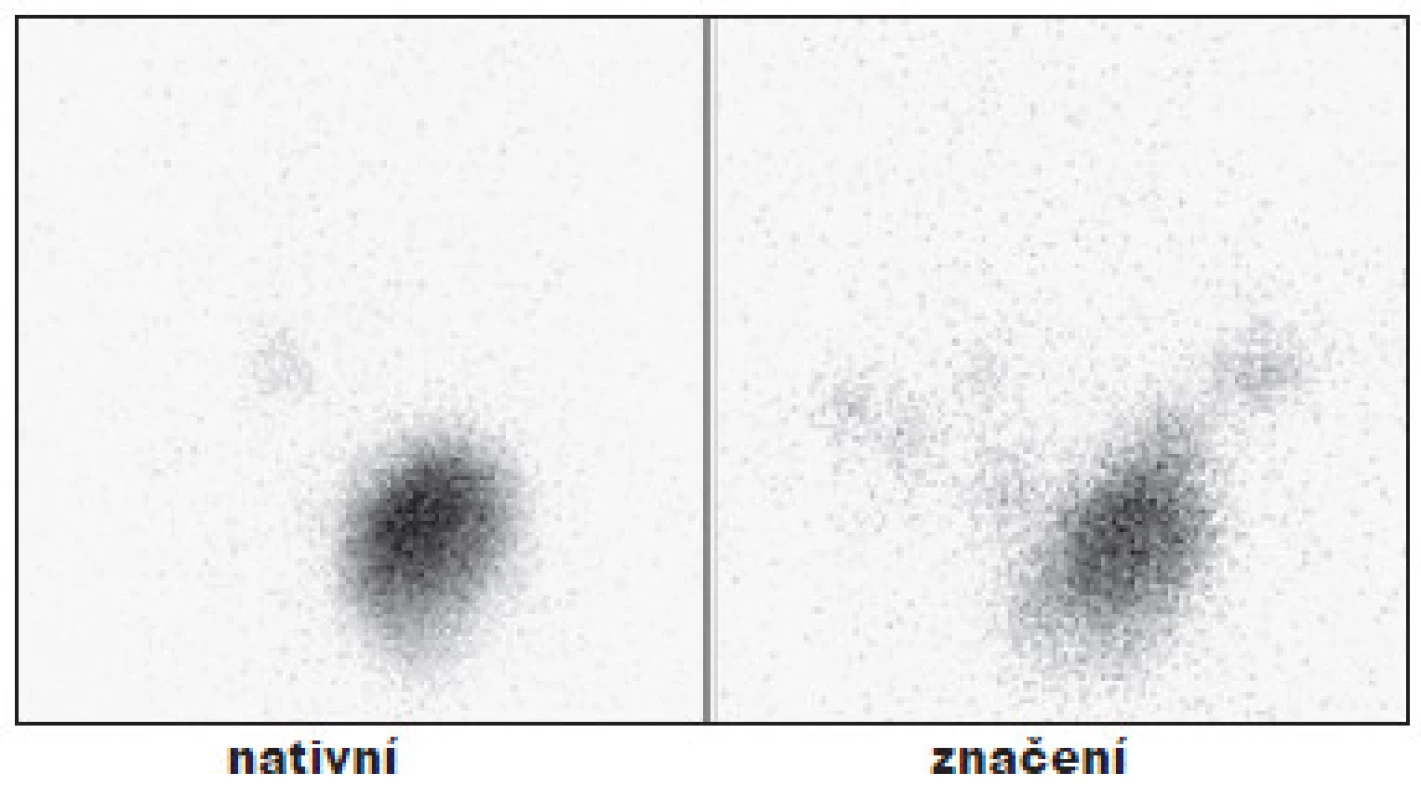
10. Stejný pacient jako na obr. č. 9, příklad neúspěšné TERJ. Vysvětlivky - postterapeutická celotělová scintigrafie a SPECT/CT krku - reziduum štítné žlázy vlevo, pokles Tg na 0,1 μg/l, zvýšená hladina protilátek anti-Tg, v plánu další terapie RJ. 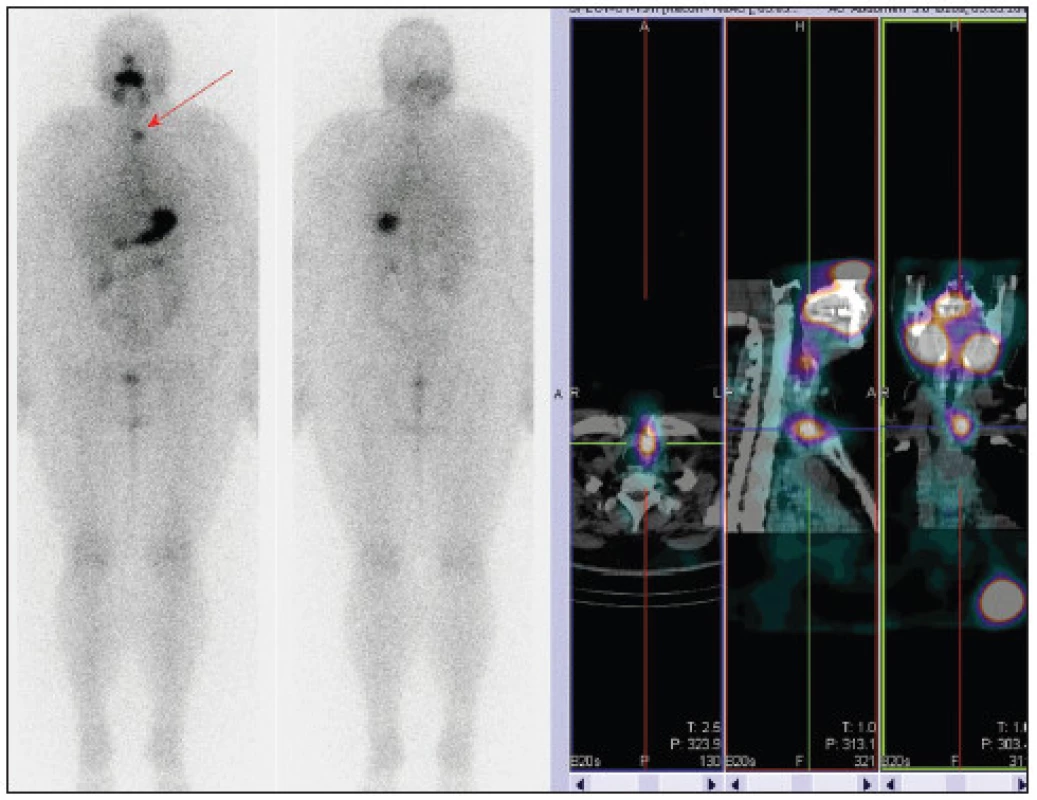
V tabulce 2 uvádíme absolutní počty a procentuální zastoupení úspěšných a neúspěšných TERJ v závislosti na vstupních hladinách Tg po operacích. Z tabulky je podle předpokladů zřejmá vyšší pravděpodobnost úspěšné TERJ při nižších hladinách Tg. (Tab. 2)
2. Závislost úspěšnosti TERJ na vstupních hladinách tyreoglobulinu. Vysvětlivky: Tg - hladina tyreoglobulinu v μg/l, TERJ (Ú) - úspěšná tyreoeliminace radiojódem, TERJ (NÚ) - neúspěšná tyreoeliminace radiojódem, Ú:NÚ - podíl úspěšných k neúspěšným TERJ v závislosti na hladině Tg. 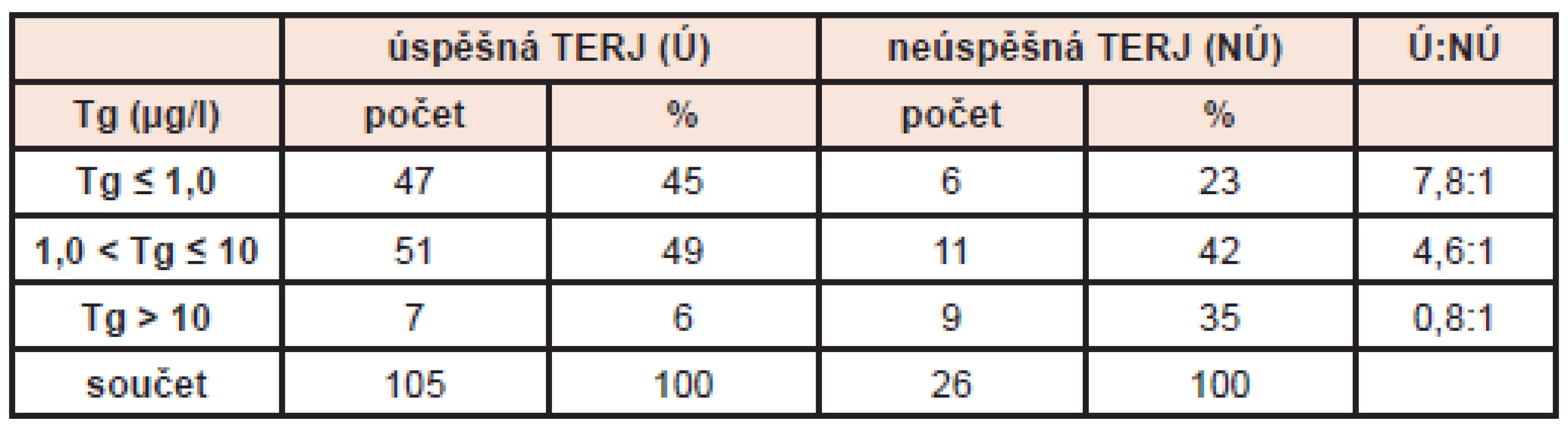
Diskuze
Diferencovaný karcinom štítné žlázy (DTC) vycházející z folikulárních buněk zahrnuje až 90 % malignit tyreoidey. 1 Podle studie ze Spojených států amerických je doložen za poslední 3 desetiletí minulého století nárůst počtu případů u papilárního karcinomu bez signifikantního zvýšení incidence u folikulárního typu. 2 Stejná práce dokládá vzestup počtu případů mikrokarcinomů do 1 cm (T1a) o téměř 50 % a do 2 cm (T1b) až o 87 %. Podle jiné studie bylo z celkového počtu 207 histologicky prokázaných papilárních DTC 72 % menších než 2 cm. 3 Podle statistiky českého ÚZIS došlo v letech 2003–2010 ke vzestupu incidence novotvarů tyreoidey u mužů z 2,1 na 4,2 případů/100000 a u žen z 9,8 na 14,4/100000 osob. 4
Terapie DTC ve své komplexní podobě vyžaduje interdisciplinární přístup. V úvodu endokrinolog na základě USG nálezu a cytologické punkce indikuje nejčastěji totální tyreoidektomii. Z aktuální analýzy 1936 nemocných operovaných pro zhoubný nádor štítné žlázy v letech 1991–2010 vyplývá jasná převaha radikálních výkonů (TTE, TTE ve dvou dobách a TTE včetně blokové disekce regionálních LU) nad méně radikálními (lobektomie, hemityreoidektomie či subtotální nebo téměř totální tyreoidektomie) v poměru přibližně 10 : 1. 5 V praxi se však nejčastěji stává, že i při plánované TTE se chirurgovi nepodaří odstranit veškerou tkáň štítné žlázy. Radikalitu strumektomie je možno verifikovat analýzou hladiny tyreoglobulinu, dynamikou vzestupu TSH či změřením míry akumulace RJ v oblasti krku. Pomocí USG či scintigrafie krku se i přes deklarované TTE nacházejí rezidua v lůžku štítné žlázy až v 95 % případů. 6 Také samotná nízká hladina Tg nemusí znamenat nepřítomnost tyreoidálních zbytků po operaci. Ze souboru 158 pacientů za 3 týdny po operaci u 21 % z nich nedetekovatelná hladina Tg neodpovídala akumulaci RJ, jež se pohybovala mezi 3–46 %. 7 Ve stejné práci autoři považovali za úspěšně provedenou TTE kombinaci nízké hladiny Tg a akumulaci RJ v oblasti krku do 2 %, což dokumentovali v 7 % případů. Podle scintigrafického kritéria, podle něhož nejsou na pooperačních scintigramech po podání diagnostické a tyreoablační dávky radiojódu patrná v lůžku štítné žlázy žádná rezidua, bylo skutečně radikálně provedených TTE jen 5 %, přičemž reziduální tkáň byla detekována nejčastěji v oblasti horních pólů laloků nebo v místě lobus pyramidalis. 8 Výše uvedené údaje řádově v jednotkách procent jsou ve shodě s našimi zkušenostmi, kdy jsme mohli scintigraficky konstatovat stav po TTE jen u čtyř ze 131 operovaných osob, což činí 3 % případů.
V léčebném postupu u nemocných s DTC se využívá terapeutické podání radiojódu za hospitalizace na lůžkových jednotkách oddělení nukleární medicíny. Optimálně za 4–6 týdnů po operaci se v myxedému podá per os tyreoablační dávka 131I za účelem eliminace zbytků štítné žlázy. Úvodní aplikace RJ umožní získání postterapeutického scintigramu, na němž se mohou také neočekávaně zobrazit ložiska nádoru v regionálních LU a/nebo ve vzdálených metastázách. 9 Tím se upřesní aktuální (pooperační) staging onemocnění a lze tak s výhodou provést stratifikaci nemocných ve vztahu k riziku rekurence nádoru. Konsenzus odborníků Americké Tyreologické Asociace (ATA) považuje aplikaci tyreoablační dávky 131I také za formu adjuvantní terapie pro potenciálně tumoricidní efekt na případné mikrometastázy, které nejsou jinou vyšetřovací metodou prokazatelné. 10 Nelze opomenout také obecně známou alteraci jódového metabolizmu nádorových buněk DTC, které vykazují celkově nižší akumulaci a kratší biologický poločas RJ, mající za následek nižší absorbovanou dávku záření ve srovnání s normální tyreoidální tkání. 11 Také z tohoto důvodu považujeme za zásadní eliminovat nejprve reziduální tkáň štítné žlázy pro budoucí snazší detekci a kurabilitu případných metastatických lézí. Je také zřejmé, že ablace veškeré tyreoidální tkáně způsobí pokles hladiny Tg k „nedetekovatelným“ hodnotám, což umožní přesnější monitorování Tg v budoucnu pro zjišťování případných recidiv nemoci. Podporu pro paušální provádění TERJ lze nalézt ve studiích, které v souborech nemocných po absolvování TERJ prokázaly snížení rekurencí a mortality DTC 12,13 a to i u nemocných s papilárním mikrokarcinomem. 14
Hlavním cílem naší práce bylo zhodnotit úspěšnost provedené TERJ u souboru 131 pacientů po nTTE. U 80 % z nich jsme na kontrolním WB scintigramu po 6 měsících prokázali eliminaci zbytků štítné žlázy. Podle údajů v literatuře se úspěšnost TERJ pohybuje v rozmezí 27–94 %. 15–21 Jednotlivé procentuální úspěšnosti TERJ nelze navzájem korektně srovnávat, neboť TERJ byla prováděna za různých podmínek. Rozdíly spočívaly ve velikosti podané dávky RJ, která byla od 30 až do 155 mCi a soubory nemocných často čítaly jen několik desítek pacientů. Rozdílná byla také příprava před TERJ. Někteří byli léčeni po 4–6týdenním vysazení hormonální substituce, u některých byl podán rekombinantní lidský TSH (rhTSH), u některých byl rhTSH podán ještě navíc po měsíčním vysazení substituce.
Našim podmínkám se nejvíce blížily práce s obdobným množstvím podané radioaktivity, v nichž bylo také dosaženo podobných výsledků. V první studii autorů Bal a kolektiv 16 bylo dosaženo ve skupině 122 nemocných po použitých ablačních aktivitách RJ mezi 50–150 mCi úspěšnosti tyreoablace v rozmezí 73,7–77,8 %. Signifikantně se lišila pouze efektivita TERJ po 30 mCi 131I ve skupině 27 nemocných, u nichž byla vykázána úspěšnost 63 %. V další studii 17 obsahující údaje o 191 pacientech byla celková úspěšnost 74,3 % u podaných aktivit v rozmezí 100–200 mCi 131I. Předpokládaná vyšší efektivita TERJ při použití vyšších radioablačních dávek RJ (84% úspěšnost po 100 mCi ve srovnání se 76% úspěšností po 30 mCi 131I) je doložena analýzou souboru 115 pacientů. 18
Závěr
Tyreoeliminace radiojódem po provedené TTE (resp. nTTE) je nedílnou součástí komplexního léčebného postupu u nemocných s diferencovaným karcinomem štítné žlázy. Radioablace zbytků tyreoidální tkáně kromě potenciálně terapeutického efektu na možná mikroskopická nádorová ložiska umožní také přesnější sledování nemocného a efektivnější kurabilitu případných recidiv. Vlastní efektivita TERJ závisí zejména na radikalitě provedeného operačního výkonu, což dokládá její vyšší úspěšnost při nižších hodnotách hladiny tyreoglobulinu změřených za 4–6 týdnů po operaci. Podle naší analýzy výsledků TERJ u našeho souboru nemocných je její 80% úspěšnost srovnatelná s literárními údaji.
Sources
1. Sherman SI, Thyroid carcinoma. Lancet 2003;361 : 501–511
2. Davies L, Welch HG Increasing incidence of thyroid cancer in the United States, 1973-2002. JAMA 2006;295 : 2164–2167
3. Hasbek Z, Turgut B, Erselcan T et al. The evaluation of microcarcinoma in differentiated thyroid cancers according to old and new TNM classification. Molecul. Imag. and Radionuclide Therapy 2011;20 : 94–99
4. Publikace ÚZIS, Novotvary Česká republika, [online] [cit. 2014-05-15]. Dostupné na: http://www.uzis.cz/katalog/zdravotnicka-statistika/novotvary
5. Astl J. Chirurgická léčba nemocí štítné žlázy, 2. rozšířené vydání Praha, Maxdorf 2013, 254 p
6. Vlček P. Nádory štítné žlázy. Postgraduální medicína 2003;5 : 208-212
7. Moser E, Fristch S, Braun S. Thyroglobulin and I-131 uptake of remaining tissue in patients with differentiated carcinoma after thyroidectomy. Nucl Med Commun 1988;9 : 262–266
8. Fratkin MJ, Newsom HH, Sharp AR et al. Cervical distribution of iodine 131 following total thyroidectomy for thyroid cancer. Arch Surg. 1983;118 : 864–867
9. Vlček P. Radionuklidy v diagnostice a terapii tyreopatií. Postgraduální medicína 2003;5 : 212–215
10. Cooper DS, Doherty GM, Haugen BR et al. Revised American Thyroid Association Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer The American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2009;19 : 1167–1214
11. Klain M, Ricard M, Leboulleux S et al. Radioiodine therapy for papillary and follicular thyroid carcinoma. Eur J Nucl Med 2002;29(S 2):479–485
12. Mazzaferri EL, Jhiang SM. Differentiated thyroid cancer: longterm impact of initial therapy. Transactions of the American Clinical and Climatological Association 1994;106 : 151–168
13. DeGroot LJ, Kaplan EL, McCormick M et al. Natural history, treatment, and course of papillary thyroid carcinoma. J Clin Endocrinol Metab 1990;71 : 414–424
14. Chow SM, Law SC, Chan JK et al. Papillary microcarcinoma of the thyroid-Prognostic significance of lymph node metastasis and multifocality. Cancer 2003;98 : 31–40
15. Comtois R, Theriault C, Del Vecchio P. Assessment of the efficacy of iodine-131 for thyroid ablation. J Nucl Med 1993;34 : 1927–1930
16. Bal C, Padhy AK, Jana S et al. Prospective randomized clinical trial to evaluate the optimal dose of 131 I for remnant ablation in patients with differentiated thyroid carcinoma. Cancer 1996;77 : 2574–2580
17. Sengöz T, Sürücü E, Demir Y, Derebek E. The Effects of the Factors Related to the Patient and the Disease on the Performance of Ablation Therapy in Patients with Differentiated Thyroid Cancer who have Received I-131 Ablation Therapy. Mol Imaging Radionucl Ther 2012;21 : 103–109
18. Cherk MH, Kalff V, Yap KS et. al. Incidence of radiation thyroiditis and thyroid remnant ablation success rates following 1110 MBq (30 mCi) and 3700 MBq (100 mCi) post-surgical 131I ablation therapy for differentiated thyroid carcinoma. Clin Endocrinol 2008;69 : 957–962
19. Barbaro D, Boni G, Meucci G et al. Radioiodine treatment with 30 mCi after recombinant human thyrotropin stimulation in thyroid cancer: effectiveness for postsurgical remnants ablation and possible role of iodine content in L-thyroxine in the outcome of ablation. The Journal of Clinical Endocrinology & Metabolism 2003;88 : 4110–4115
20. Pacini F, Molinaro E, Castagna MG et al. Ablation of thyroid residues with 30 mCi (131)I: a comparison in thyroid cancer patients prepared with recombinant human TSH or thyroid hormone withdrawal. J Clin Endocrinol Metab 2002;87 : 4063–4068
21. Zidan J, Hefer E, Iosilevski G et al. Efficacy of I-131 ablation therapy using different doses as determined by postoperative thyroid scan uptake in patients with differentiated thyroid cancer. Int J Radiat Oncol Biol Phys 2004;59 : 1330–1336
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2014 Issue 2
Most read in this issue- Evaluation of the effectiveness of radioiodine ablation for differentiated thyroid carcinoma
- Positron emission tomography with lipid metabolism markers for primary liver cancers imaging
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

