-
Medical journals
- Career
Specifikace nejistých lézí na planární celotělové kostní scintigrafii s použitím SPECT/CT u onkologických pacientů
: Ladislav Zadražil () 1,2,3; Petr Libus () 1
: Oddělení nukleární medicíny, Nemocnice Havlíčkův Brod, p. o. 1; Radiodiagnostické oddělení, Nemocnice Havlíčkův Brod, p. o. 2; Radiologická klinika, LF MU Brno 3
: NuklMed 2013;2:25-30
: Original Article
Cíl:
Stanovit, jak často je SPECT/CT potřebné ke specifikaci abnormálního nálezu na planárním WB kostním skenu, zda je užitečné porovnat scintigrafický nález s předcházejícím vyšetřením, v kolika případech SPECT/CT určí definitivní diagnózu a kolik ložisek abnormální aktivity nacházíme na kostním skenu u benigních a maligních afekcí.Pacienti a metoda:
Retrospektivně jsme prostudovali 471 WB skenů u 450 pacientů s karcinomem prsu, plic a prostaty, kteří v roce 2008 podstoupili kostní scintigrafii. SPECT/CT nebo CT jsme použili v 11,9 % vyšetření u 12,4 % pacientů. Opakovaná scintigrafie (319 pacientů po kostní scintigrafii a 36 pacientů po SPECT/CT) sloužila jako referenční vyšetření.Výsledky:
Srovnání s předchozí scintigrafií bylo užitečné u pacientů s karcinomem prsu před indikací SPECT/CT. S použitím SPECT/CT jsme mohli specifikovat nejisté scintigrafické léze u 90,9 % vyšetření. Pro detekci kostních metastáz dosáhlo CT ve SPECT/CT vyšetření senzitivitu 72,8 %, specificitu 96 %, pozitivní a negativní prediktivní hodnotu 88,9 %. V pravděpodobnosti rozvoje kostních metastáz do 2 let od vyšetření mezi pacienty s jedním suspektním ložiskem ve skeletu a pacienty bez suspektního ložiska jsme nezaznamenali signifikantní rozdíl (p = 0,4272), ovšem riziko vzrůstalo, jestliže jsme nalezli suspektních ložisek více (p ≤ 0,0001).Závěr:
SPECT/CT zvyšuje specificitu kostní scintigrafie. Po porovnání scintigrafického nálezu s předchozím vyšetřením se zdá rozumné uvažovat o použití SPECT/CT v 10-20 % vyšetření. CT cílené podle WB skenu přidává relativně malou radiační zátěž k zátěži z kostní scintigrafie, v naší studii zvýšilo kolektivní efektivní dávku o 13 %.Klíčová slova:
kostní scintigrafie, kostní metastázy, SPECT/CTÚvod
Kostními metastázami bývá postiženo 30-90 % pacientů s pokročilým karcinomem prsu, plic a prostaty 1, 2 a skelet je rovněž nejobvyklejším místem prvního relapsu karcinomu prsu a prostaty 1, 3, 4. Tito pacienti s kostními metastázami však přežívají déle než pacienti s pouze mimokostním metastatickým postižením 1, 3. Kostní scintigrafie za použití 99mTc-metylendifosfonátu (MDP) je citlivá metoda pro odkrytí kostních metastáz 5. Nižší citlivost však má pro léze v páteři a pro léze omezující se na kostní dřeň 6, 7 a vlivem nižší specificity nemůže také vždy spolehlivě určit příčinu abnormálního scintigrafického nálezu 1,5. Kostní scintigram může totiž zobrazovat ložiska zvýšené metabolické aktivity i u pacientů bez recidivy choroby 8, 9. Proto je obtížné správně odhalit kostní metastázy, které mají atypický scintigrafický obraz, jako jsou například solitární léze zvýšeně akumulující MDP, studené léze nebo léze s nízkou osteoblastickou aktivitou. SPECT/CT je tedy vhodná metoda pro specifikaci nejednoznačných nálezů na planární celotělové (WB) kostní scintigrafii, s jejíž pomocí můžeme ozřejmit povahu 87-96 % těchto lézí 5,10. Na obr. 1 a 2 je uveden příklad benigního a metastatického postižení skeletu, které nemůžeme s jistotou odlišit na planární scintigrafii ani za použití SPECT.
1. Osteolytická metastáza karcinomu plic do 5. bederního obratle. 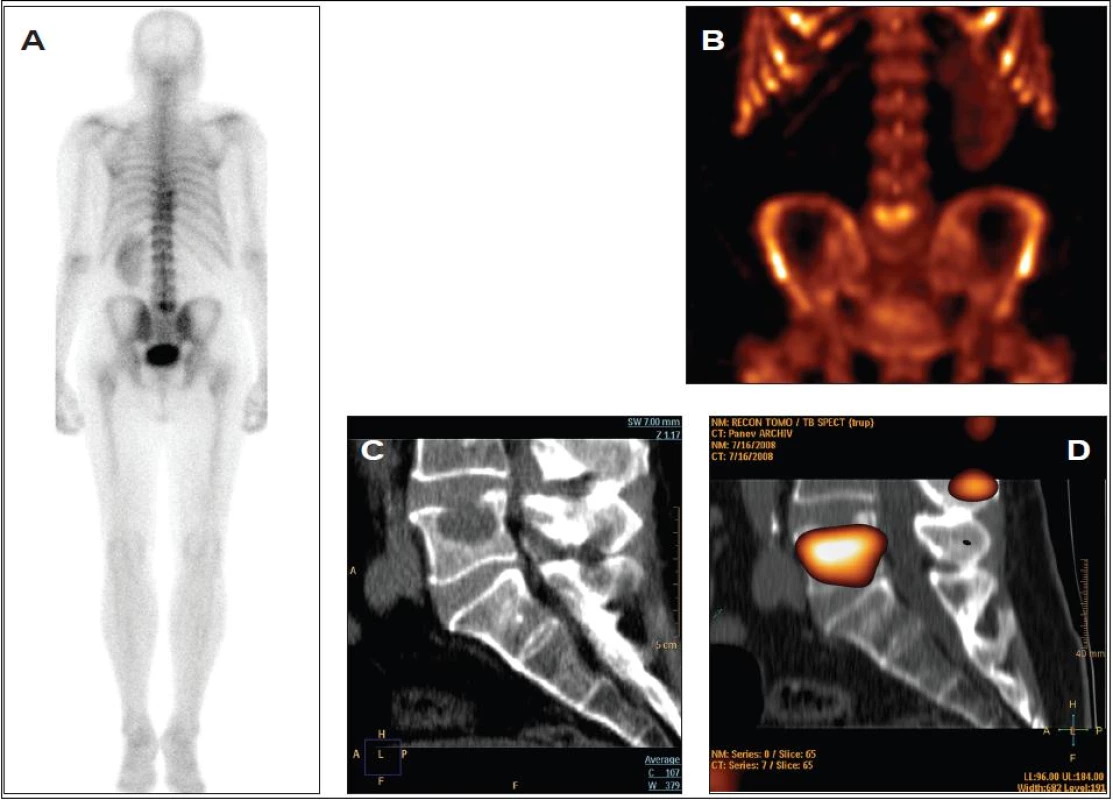
A WB, zadní projekce,
B SPECT MIP (maximum intensity projection), přední pohled,
C CT MPR (multiplanární rekonstrukce), sagitální řez,
D SPECT/CT MPR, sagitální řez2. Benigní osteochondróza meziobratlové ploténky mezi 4. a 5. bederním obratlem. 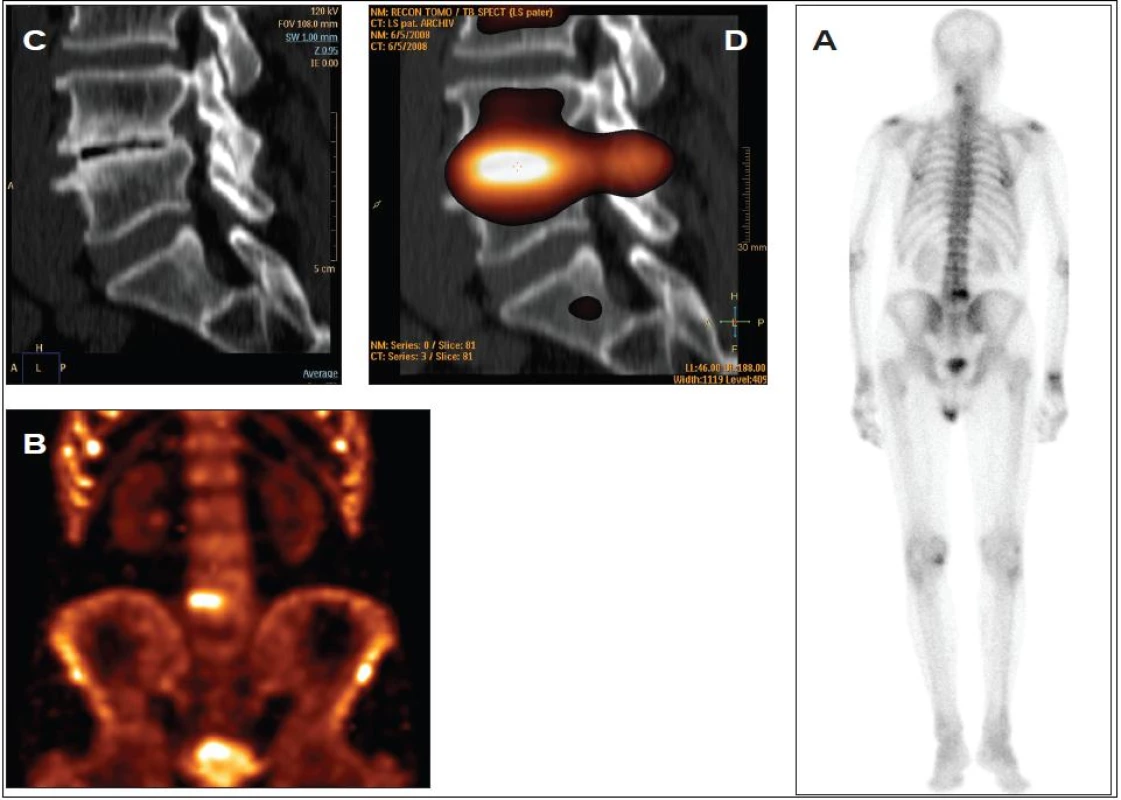
A WB, zadní projekce,
B SPECT MIP (maximum intensity projection), přední pohled,
C CT MPR (multiplanární rekonstrukce), sagitální řez,
D SPECT/CT MPR, sagitální řezPacienti a metoda
Z archivu oddělení jsme retrospektivně vybrali 450 pacientů léčených pro karcinom prsu, plic nebo prostaty, kteří v roce 2008 podstoupili WB kostní scintigrafii, aby se vyloučilo metastatické postižení skeletu. Skupina obsahuje 366 žen průměrného věku 63,3 let a 1 muže stáří 38 let stižených karcinomem prsu, 37 mužů průměrného věku 65,8 let a 11 žen průměrného věku 59,5 let s karcinomem plic a konečně 35 mužů průměrného věku 68,9 let léčených pro karcinom prostaty. Průměrný věk všech pacientů byl 63,8 let. 151 pacientů bylo vyšetřeno poprvé, tj. při hodnocení nebyl k dispozici výsledek kostní scintigrafie v období předchozích 7 let. 143 z nich (skupina „A“) podstoupilo jedno scintigrafické vyšetření a zbývajících 8 (skupina „B“) ještě opakovanou kostní scintigrafii v roce 2008. 299 pacientů přišlo k opakovanému vyšetření a WB scintigram bylo tedy možné porovnat s předešlým nálezem, který nebyl starší 2 let. 286 z nich (skupina „C“) podstoupilo jedno a 13 pacientů (skupina „D“) dvě opakovaná vyšetření během roku 2008. Pacienti, u nichž bylo metastatické postižení skeletu diagnostikováno již v minulosti, nebyli vybráni.
U 450 pacientů jsme provedli celkem 471 planárních WB kostních scintigrafií, 52 SPECT/CT a 4 CT vyšetření. SPECT/CT nebo CT jsme použili tedy v 11,9 % (56/471) všech vyšetření u 12,4 % (56/450) pacientů. 21 pacientů podstoupilo dvě scintigrafická vyšetření v roce 2008, avšak žádný opakované SPECT/CT nebo CT vyšetření. Průměrně jsme podali na jedno scintigrafické vyšetření 857 MBq MDP. Kolektivní dávka MDP byla 403,64 GBq, což odpovídá kolektivní efektivní dávce 2,018-2,422 Sv, tj. průměrné celotělové efektivní dávce pro jednoho pacienta 4,5-5,4 mSv. WB sken jsme snímali gamakamerou Picker Prism 2000 VP rychlostí 110 mm/min nebo 120 mm/min nebo Precedence 6 fy. Philips rychlostí 130 mm/min. SPECT jsme snímali na Precedence 6 v 64 projekcích, matice 128 x 128, 30 s/projekci a pro rekonstrukci jsme použili algoritmus Astonish. Kolektivní DLP (dose length product) z CT byl 19442,3 mGycm (56 vyšetření, 66 helikálních akvizicí, 6 % na hlavu a krk, 94 % na trup) a odpovídá kolektivní efektivní dávce pro hermafroditní fantom 0,273-0,317 Sv, tj. průměrné celotělové efektivní dávce pro jednoho vyšetřeného pacienta 4,9-5,7 mSv 11. CT jsme skenovali s kolimací 6 x 1,5 mm za použití angulární modulace radiační intenzity (D-DOM) a axiální skeny jsme rekonstruovali v šíři 2 mm s inkrementem 1 mm. V menšině vyšetření jsme rekonstruovali axiální skeny šíře 5 mm s inkrementem 2,5 mm z CT dat snímaných s kolimací 6 x 3 mm nebo jsme volili LDCT (low-dose CT, 6 z 66 helikálních akvizicí).
Za scintigrafický nález, u kterého jsme se rozhodovali použít SPECT/CT specifikaci, jsme považovali výskyt jednoho nebo několika ložisek abnormální osteoblastické aktivity na WB skenu, která neměla typický scintigrafický obraz kostních metastáz, tj. mnohočetných, náhodně rozložených ložisek zvýšené osteoblastické aktivity 6. Jedná se o heterogenní skupinu scintigrafických nálezů. Lékař se na základě své zkušenosti a předchozích vyšetření rozhodoval, zda indikovat SPECT/CT nebo doporučit scintigrafickou kontrolu s časovým odstupem případně specifikaci další zobrazovací metodou. SPECT/CT vyšetření bylo hodnoceno dvěma lékaři s rozdílnými zkušenostmi v nukleární medicíně a v radiologii. Opakovanou kostní scintigrafii v období od 3 měsíců do 2 let jsme použili jako referenční vyšetření, pokud byla provedena (36 pacientů pro zhodnocení senzitivity, specificity, pozitivní a negativní prediktivní hodnoty CT ve SPECT/CT ke kostním metastázám a 319 pacientů pro posouzení rozvoje metastatického onemocnění skeletu v závislosti na počtu nejistých ložisek na WB skenu). Pro statistické srovnání jednotlivých skupin jsme použili Fisherův exaktní test.
Výsledky
Jelikož jsme SPECT/CT indikovali výhradně podle výsledku planární scintigrafie, můžeme porovnat četnost potřeby SPECT/CT ve skupině „A“ a „B“, tj. u pacientů vyšetřených poprvé, a ve skupině „C“ a „D“, u nichž bylo možné porovnat výsledek WB skenu s předchozím nálezem ne starším 2 let. Výsledky zobrazuje tabulka 1.
1. Četnost použití SPECT/CT u pacientů s (skupina A, B) a bez (skupina C, D) předcházející kostní scintigrafie a rozdíl mezi nimi ve Fisherově exaktním testu. 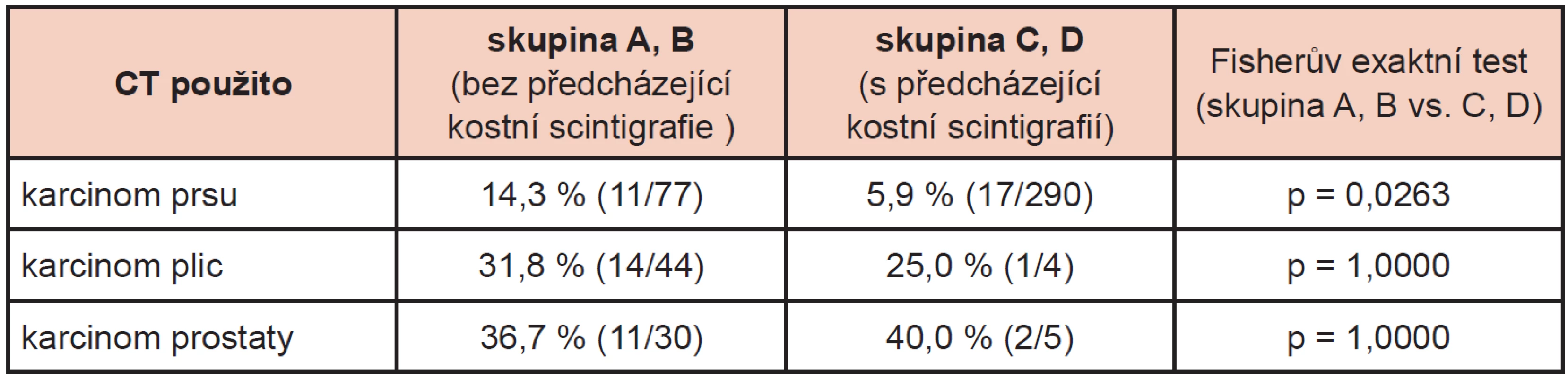
Nejistý scintigrafický nález na WB skenu jsme specifikovali SPECT/CT případně pouze CT vyšetřením u 55 pacientů:
- a) V 34 případech jsme odkryli benigní a v 16 případech maligní příčinu abnormálního scintigrafického nálezu. 32 pacientů (z těchto 50) podstoupilo opakované scintigrafické vyšetření, které potvrdilo stejnou diagnózu.
- b) 4 pacienti (1 pacientka s karcinomem prsu ze skupiny „C“, 2 pacienti s karcinomem plic ze skupiny „A“ a „B“ a 1 pacient s karcinomem prostaty ze skupiny „A“) neměli žádné nebo měli jen minimální změny na CT nevysvětlující důvod abnormální osteoblastické aktivity. 3 z nich podstoupili opakovanou kostní scintigrafii, která potvrdila maligní charakter těchto lézí.
- c) V 1 případě jsme odhalili metabolicky aktivní sklerózu v os sacrum vlevo, kterou jsme hodnotili jako nález nejisté povahy (pacientka s karcinomem prsu ze skupiny „D“). Na opakované kostní scintigrafii byla osteoblastická aktivita normální.
V podskupině 36 pacientů, u nichž mohla být použita opakovaná kostní scintigrafie jako referenční, dosáhlo CT v SPECT/CT vyšetření senzitivity 72,8 %, specificity 96 %, pozitivní prediktivní hodnoty 88,9 % a negativní prediktivní hodnoty 88,9 % pro odhalení kostních metastáz. Pacientku s nejednoznačnou interpretací SPECT/CT nálezu zmíněnou výše (c) jsme považovali za pozitivní pro toto hodnocení.
U 44 pacientů jsme nalezli abnormalitu na scintigrafickém nálezu, prostudovali jsme dostupnou předcházející scintigrafickou a radiologickou snímkovou dokumentaci (pokud pacient podstoupil předcházející vyšetření) a rozhodli se doporučit scintigrafickou kontrolu s časovým odstupem nebo případně specifikaci další zobrazovací metodou. V této skupině jsme diferenciálně diagnosticky popisovali scintigrafický obraz metabolicky aktivní osteochondrózy meziobratlové ploténky, reparace po kompresi obratlového těla, reparace v žebrech, abnormality v sumaci s úhlem lopatky či v manubriu sterna nebo vznesli podezření na m. Paget či exostózu. Scintigrafický nález svědčící pro kostní metastázy jsme zachytili na 15 WB kostních scintigrafiích. V 1 případě jsme povahu lézí potvrdili SPECT/CT. U zbývajících 336 pacientů jsme nacházeli na WB scintigramu normální nález, případně benigní, věku úměrné degenerativní změny. Pokud byl pacient vyšetřen opakovaně v roce 2008, použili jsme pro hodnocení vyšetření se SPECT/CT a pokud SPECT/CT nebylo provedeno, použili jsme WB scintigram s horším nálezem.
Celkem 319 pacientů v našem souboru podstoupilo opakovanou kostní scintigrafii v období od 3 měsíců do 2 let, která u 301 pacientů (skupina „I“) rozvoj metastatického postižení skeletu neprokázala a u 18 pacientů (skupina „II“) jej odhalila. Pacienty jsme roztřídili podle počtu nejistých ložisek patrných na WB skenu: žádné, 1, 2-3, 4 a více; skupinu bez nejistého fokusu jsme použili jako referenční. Jestliže byl pacient vyšetřen opakovaně v roce 2008, použili jsme pro hodnocení vyšetření s větším počtem nejistých fokusů. Výsledky zobrazuje tabulka 2 a graf 1.
2. Četnost rozvoje kostních metastáz do 2 let. Rozdíl mezi pacienty s jedním a bez nejistého ložiska na WB skenu byl nevýznamný, ale pokud se vyskytlo více nejistých ložisek ve skeletu, byla pravděpodobnost maligního postižení skeletu významně vyšší. 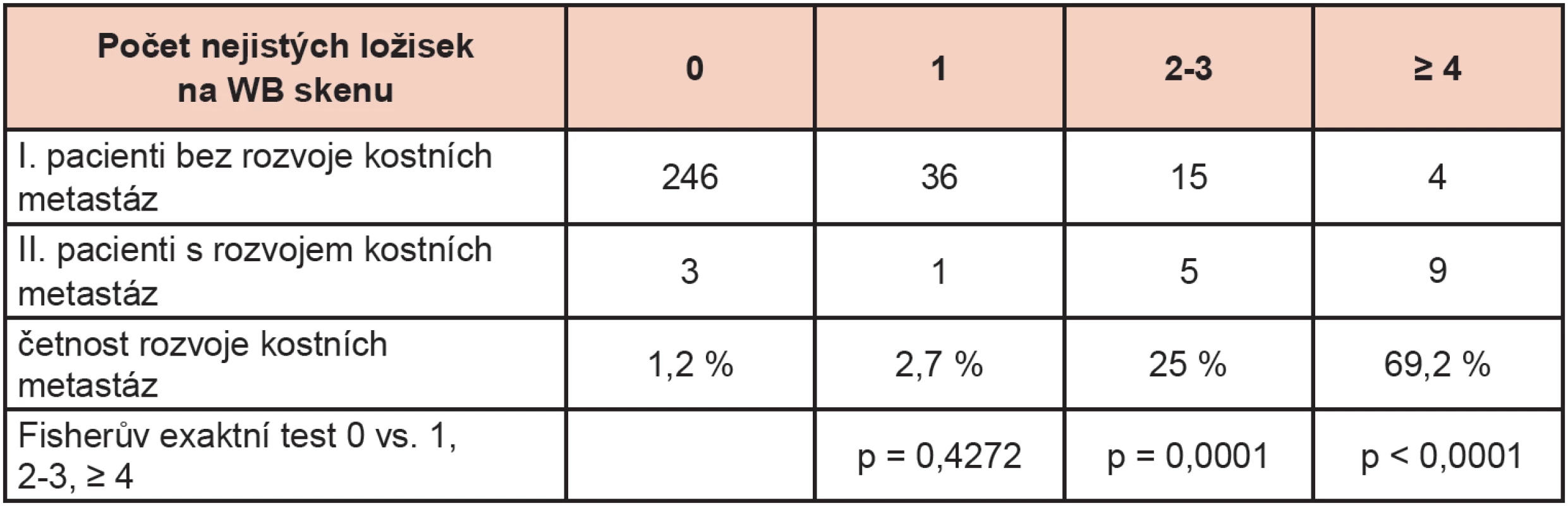
1. Četnost rozvoje kostních metastáz do 2 let. Rozdíl mezi pacienty s jedním a bez nejistého ložiska na WB skenu byl nevýznamný, ale pokud se vyskytlo více nejistých ložisek ve skeletu, byla pravděpodobnost maligního postižení skeletu významně vyšší. 
Diskuze
V našem souboru pacientů bylo užitečné porovnat u pacientů léčených pro karcinom prsu před indikací SPECT/CT scintigrafický nález s předchozím vyšetřením. Méně často jsme u nich indikovali SPECT/CT specifikaci abnormálního nálezu zjištěného na planární kostní scintigrafii (pouze v 5,9 % vs. 14,3 %, p = 0,0263). U pacientů stižených karcinomem plic a prostaty jsme SPECT/CT použili v 25-40 % a nezaznamenali jsme signifikantní rozdíl ve výskytu nejistého scintigrafického nálezu, jestliže lékař hodnotící planární scintigrafii měl k dispozici předcházející vyšetření. Domníváme se, že SPECT/CT bylo u těchto pacientů častěji indikováno pravděpodobně kvůli všeobecně nízké osteoblastické aktivitě plicních metastáz a kvůli pokročilejším degenerativním změnám skeletu u pacientů s karcinomem prostaty, neboť obojí může diagnózu kostních metastáz ztěžovat.
S použitím SPECT/CT jsme mohli odlišit maligní léze od benigních v 90,9 % (50/55) vyšetření. Römer et al. s pomocí SPECT/CT objasnil 92 % kostních lézí nejasného charakteru na SPECT. Ve zbývajících 8 % nenacházel na CT dostatek viditelných morfologických alterací a tyto léze, které se nacházely v žebrech a v lopatce, zůstávaly tedy i nadále nejisté 12. Horger et al. správně klasifikoval 85 % nejasných ložisek, avšak s použitím samotného SPECT pouze 36 % a dosáhl specificitu detekce malignity 81 % pro SPECT/CT a 19 % pro SPECT 13. CT v kombinaci se SPECT v naší studii dosáhlo specificity pro detekci kostních metastáz 96 %. Even-Sapir et al. vyšetřil 44 pacientů s vysokým rizikem metastáz karcinomu prostaty a popsal specificitu 57 % 99mTc-MDP planární kostní scintigrafie, 82 % multi-FOV SPECT a 100 % 18F-NaF PET/CT 14. Suspektní scintigrafická ložiska postrádající anatomickou korelaci na CT zmíněná výše (b) se v našem souboru nacházela v páteři a v žebrech. Opakované scintigrafické vyšetření provedené u 3 z těchto 4 pacientů potvrdilo maligní povahu těchto lézí, a tedy opakovaná kostní scintigrafie byla pro tyto nemocné přínosná.
Pravděpodobnost maligního původu nejistých ložisek ve skeletu zobrazených na planární kostní scintigrafii stoupala s jejich počtem. V našem souboru jsme nezaznamenali signifikantní rozdíl v rozvoji kostních metastáz do 2 let od vyšetření mezi pacienty s jedním suspektním ložiskem ve skeletu a pacienty bez suspektního ložiska (p = 0,4272). Riziko maligního postižení skeletu však výrazně vzrůstalo, jestliže jsme na planárním scintigramu nalezli více než jedno nejisté ložisko (p ≤ 0,0001). Svou roli zde sehrává samozřejmě zkušenost lékaře hodnotícího vyšetření. U 1,2 % pacientů (3/249, 2 pacienti s karcinomem plic a 1 pacientka s karcinomem prsu) bez suspektního ložiska na planární kostní scintigrafii došlo k rozvoji kostních metastáz do 2 let od vyšetření. V 2,7 % (1/37, 1 pacientka s karcinomem prsu) byl solitární fokus kostní metastáza, kdežto u 25 % pacientů s 2 nebo 3 a u 69,2 % pacientů se 4 a více suspektními ložisky ve skeletu opakovaná kostní scintigrafie potvrdila metastatické postižení skeletu. Tomoda et al. revidoval 1167 kostních skenů pacientů s anamnézou karcinomu plic, prsu nebo prostaty. Na 185 skenech se zobrazila solitární léze se zvýšenou aktivitou, která byla kostní metastázou pouze v 23 % (v 25 % u karcinomu plic, v 22 % u karcinomu prsu a v 14 % u karcinomu prostaty) 15. V jiné studii revidující 301 kostních skenů onkologických pacientů s dosud neprokázaným metastatickým postižením skeletu se maligní původ potvrdil v 11 % pro 1 a v 24 % pro 2 nové abnormality. Na opakované scintigrafii vykazovala ve stejné studii většina metastáz (19 z 21) vzestup aktivity, kdežto většina benigních abnormalit zůstávala buď nezměněna (47 %) nebo vymizela (41 %). Benigní léze v žebrech, na končetinách a v pánvi vymizely obvykle během 12-24 měsíců, avšak benigní léze v lebce a páteři zůstávaly patrny i po 35-58 měsících 16.
Závěr
S pomocí SPECT/CT jsme byli schopni objasnit charakter 90,9 % nejistých nálezů na WB kostní scintigrafii se specificitou 96 %. Suspektní ložiska na scintigrafii postrádající anatomický korelát na CT jsme nalézali v páteři a žebrech a opakovaná kostní scintigrafie byla pro tyto nemocné opodstatněná. Pravděpodobnost maligního postižení skeletu vzrůstala s počtem nejistých ložisek zobrazených na WB skenu. V pravděpodobnosti rozvoje kostních metastáz do 2 let od vyšetření mezi pacienty s jedním suspektním ložiskem ve skeletu a pacienty bez suspektního ložiska jsme nezaznamenali významný rozdíl, ovšem riziko stoupalo, jestliže jsme nalezli suspektních ložisek více. Srovnání s předchozím scintigrafickým nálezem bylo užitečné před indikováním SPECT/CT u pacientů stižených karcinomem prsu. CT není u každého pacienta nezbytné a uvažovat o SPECT/CT se zdá rozumné u 10-20 % scintigrafií. Jelikož jsme CT cílili podle WB scintigramu na pouze nejasné léze a délku CT skenu jsme volili co nejkratší, vnesli jsme do souboru pacientů malou kolektivní efektivní dávku z CT, přibližně 13 % radiační dávky z kostní scintigrafie. Pro jednotlivce, který podstoupil vyšetření SPECT/CT, vzrostla efektivní radiační dávka v průměru o 4,9-5,7 mSv.
CT přidává ke SPECT vyšší specificitu, má dobré anatomické rozlišení, poskytne podrobné zobrazení kortikální i trabekulární kosti a především odhalí dobře kostní destrukci. CT může také odkrýt doprovodné komplikace, jako jsou fraktury nebo komprese durálního vaku 17. Velkým přínosem SPECT/CT je správná specifikace nejednoznačných scintigrafických lézí v páteři, ve skeletu hrudního koše, v lebce a pánvi, a odlišení malých juxtaartikulárních osteolytických lézí během jednoho vyšetření 6,13,18. Pokud vyšetřujeme léze v oblasti hrudníku, je rovněž výhodné, že SPECT/CT je méně ovlivňováno pohybovými artefakty než MRI 18.
Ladislav Zadražil1,2,3, Petr Libus 1
1 Oddělení nukleární medicíny, Nemocnice Havlíčkův Brod, p.o.
2 Radiodiagnostické oddělení, Nemocnice Havlíčkův Brod, p.o.
3 Radiologická klinika, LF MU Brno
ladislav.zadrazil@onhb.cz
Sources
1. Body JJ. Metastatic bone disease. In: Seibel MJ, Robins SP, Bilezikian JP Eds. Dynamics of Bone and Cartilage Metabolism: Principles and Clinical Applications - 2nd edition. San Diego, N.Y., Boston, London, Sydney, Tokyo, Toronto, Academic Press, 2006, 920 p
2. Galasko CSB. Skeletal metastases. Clin Orthop Rel Res 1986;210 : 18-30
3. Coleman RE, Rubens RD. The clinical course of bone metastases from breast cancer. Br J Cancer 1987;55 : 61-66
4. Kamby C, Vejborg I, Daugaard S et al. Clinical and radiologic characteristics of bone metastases in breast cancer. Cancer 1987;60 : 2524-2531
5. Barwick T, Fernando R, Gnanasegaran G et al. The use of 99mTc-MDP SPECT/CT in the evaluation of indeterminate bone lesions on whole body planar imaging in cancer patients. Eur J Nucl Med Mol Imaging 2008;35(Suppl 2):S154
6. Elgazzar AH. Neoplastic bone disease. In: Elgazzar AH. Orthopedic Nuclear Medicine - 1st edition. Berlin, Heidelberg, N.Y., Springer, 2004, 240 p
7. Ron IG, Striecker A, Lerman H et al. Bone scan and bone biopsy in the detection of skeletal metastases. Oncol Rep 1999;6 : 185-188
8. Yildiz M, Oral B, Bozkurt M et al. Relationship between bone scintigraphy and tumor markers in patients with breast cancer. Ann Nucl Med 2004;18 : 501-505
9. Nicolini A, Ferrari P, Sagripanti A et al. The role of tumour markers in predicting skeletal metastases in breast cancer patients with equivocal bone scintigraphy. Br J Cancer 1999;79 : 1443-1447
10. Kohlfürst S, Lobnig M, Matschnig S et al. Impact of SPECT-CT performed in case of inconclusive findings on planar whole body bone scintigraphy in patients with a history of breast or prostate cancer. Nuklearmedizin 2009;48:A147-A148
11. Hoeschen C, Regulla D, Zankl M et al. Radiation exposure and protection in multislice CT. In: Reiser MF, Becker CR, Nikolaou K et al. Eds. Multislice CT - 3rd edition. Berlin, Heidelberg, Springer, 2009, 628 p
12. Römer W, Nömayr A, Uder M et al. SPECT-guided CT for evaluating foci of increased bone metabolism classified as indeterminate on SPECT in cancer patients. J Nucl Med 2006;47 : 1102-1106
13. Horger M, Eschmann SM, Pfannenberg C et al. Evaluation of combined transmission and emission tomography for classification of skeletal lesions. AJR 2004;183 : 655-661
14. Even-Sapir E, Metser U, Mishani E et al. The detection of bone metastases in patients with high-risk prostate cancer: 99mTc-MDP planar bone scintigraphy, single - and multi-field-of-view SPECT, 18F-fluoride PET, and 18F-fluoride PET/CT. J Nucl Med 2006;47 : 287-297
15. Tomoda Y, Ishino Y, Nakata H. Assessment of solitary hot spots of bone scintigraphy in patients with extraskeletal malignancies. Jpn J Nucl Med 2001;38 : 721-726
16. Jacobson AF, Cronin EB, Stomper PC et al. Bone scans with one or two new abnormalities in cancer patients with no known metastases: frequency and serial scintigraphic behavior of benign and malignant lesions. Radiology 1990;175 : 229-232
17. Even-Sapir E. Imaging of malignant bone involvement by morphologic, scintigraphic, and hybrid modalities. J Nucl Med 2005;46 : 1356-1367
18. Buck AK, Nekolla S, Ziegler S et al. SPECT/CT. J Nucl Med 2008;49 : 1305-1319
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2013 Issue 2
Most read in this issue- Ewing sarcoma - scintigraphic image
- Brief overwiev of individually prepared radiopharmaceuticals in laboratory on KNME FN Motol Prague
- Specification of Equivocal Lesions in Planar Whole Body Bone Scintigraphy with SPECT/CT in Oncological Patients
- What can you see on the image?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

