-
Medical journals
- Career
Ewingův sarkom - scintigrafický obraz
: Jana Páterová; Jaromír Bernátek; Blanka Kadlčíková
: Oddělení nukleární medicíny, Krajská nemocnice T. Bati, a. s., Zlín
: NuklMed 2013;2:31-35
: Casuistry
Cíl:
Prezentovat scintigrafický nález u 15leté dívky s Ewingovým sarkomem.Metoda:
Patnáctiletá pacientka s nevýznamnou osobní i rodinnou anamnézou byla přijata na dětské oddělení spádové nemocnice pro zhoršující se únavu, nechutenství, váhový úbytek (10 kg), bolesti kloubů a kostí, vysoké laboratorní zánětlivé parametry (CRP 160 mg/l, FW 120/128) a anémii. Byla provedena třífázová scintigrafie skeletu k vyloučení zánětlivého postižení sakroiliakálního skloubení (SIS) vpravo. Pacientce byla dle hmotnosti (59,5 kg) podána aktivita 750 MBq 99mTc-metylendifosfonátu (MDP). Za 10 minut po intravenózní aplikaci radiofarmaka byla provedena 2. fáze třífázové kostní scintigrafie zaměřená na oblast sakroiliakálního skloubení. S odstupem tří hodin byla vyšetřena 3. fáze (kostní). Vyšetření bylo provedeno na dvouhlavé gamakameře AXIS firmy PICKER se semikvantitativním vyhodnocením na počítači. Gamakamera byla osazena kolimátory pro nízké energie s vysokým rozlišením a paralelními otvory.Výsledky:
Třífázová scintigrafie skeletu metodou celotělové scintigrafie zjistila ve 3. fázi výrazně skvrnitě zvýšené vychytávání v axiálním skeletu, v kalvě okcipitálně ve střední čáře, v obou kyčelních kloubech a v levé fibule. Diferenciálně diagnosticky nález naznačoval možnost hematologické malignity, proto byla pacientka přeložena na onkohematologické oddělení dětské kliniky FN Olomouc. Zde bylo doplněno vyšetření skeletu pomocí magnetické rezonance (MR), plnohodnotné vyšetření kostní dřeně a trepanobiopsie. Nález podporoval diagnózu Ewingův sarkom, respektive Ewingův sarkom - primitivní neuroektodermový nádor (ES/PNET) s nejasným primárním ložiskem. Pacientka byla předána k další péči na pracoviště Kliniky dětské onkologie do Brna. Zde byl nález uzavřen jako Ewingův sarkom/PNET s primárním ložiskem na levé fibule a s nálezem mnohočetných metastáz ve skeletu a kostní dřeni, T2N0M1, klinické stádium Enneking III.Závěr:
Kazuistika poukazuje na význam vysoce senzitivních nukleárně medicínských vyšetření při složité diagnostice onemocnění nejen dětského věku a na jejich přínos z hlediska urychlení dalšího vyšetřovacího postupu a léčby.Klíčová slova:
třífázová scintigrafie skeletu, 99mTc-metylendifosfonát, hematologická malignita, Ewingův sarkom/PNETÚvod
Cílem sdělení je poukázat na přínos třífázové kostní scintigrafie jako neinvazivní a vysoce senzitivní metody v diagnostice patologického postižení skeletu. Chceme prezentovat případ 15leté pacientky, která podstoupila vyšetření třífázové kostní scintigrafie pomocí 99mTc-metylendifosfonátu za účelem vyloučení suspektních zánětlivých změn pravého sakroiliakálního skloubení. Ve 2. fázi třífázové kostní scintigrafie zaměřené na sakroiliakální skloubení jsme neviděli zvýšené vychytávání radiofarmaka ve smyslu hyperémie. 3. kostní fáze celotělové scintigrafie zobrazila výrazně nehomogenní akumulaci radiofarmaka ve skeletu se skvrnitě zvýšeným vychytáváním ve skeletu axiálním (s výjimkou hrudního obratle Th 10, ve kterém byla akumulace snížená), v kalvě okcipitálně, v obou kyčelních kloubech, v levém femuru (v intertrochanterické oblasti a krčku femuru) a ložiskovou depozici ve střední části levé fibuly. Jako příčina nálezu byl následně identifikovaný Ewingův sarkom/PNET s primárním ložiskem na levé fibule. Současně byly zjištěny mnohočetné metastázy ve skeletu a kostní dřeni, T2N0M1, klinicky Enneking III.
Materiál a metoda
15letá pacientka s nevýznamnou osobní i rodinnou anamnézou, po přeléčené tonzilitidě V-Penicilinem a po terapii Xorimaxem pro postinfekční koxitidu, byla odeslaná k hospitalizaci na dětské oddělení spádové nemocnice pro měsíc se zhoršující únavu, nechutenství, váhový úbytek (10 kg), bolesti v pravé kyčli, v pravém sakroiliakálním skloubení, bolesti zad a febrilie. Laboratorně byly potvrzeny zvýšené hladiny C-reaktivního proteinu (160 mg/l), sedimentace erytrocytů (120/128 mm za 1. resp. 2. hodinu) a laktátdehydrogenázy (25 μkat/l). Hodnoty sérového železa (0,84 μmol/l), sodíku (129 mmol/l), a draslíku (3,68 mmol/l) byly snížené. Byla vyloučena infekční etiologie potíží. Na prostém RTG snímku pánve byl popsán nález suspektních zánětlivých změn pravého sakroiliakálního skloubení, proto byla pacientka empiricky zaléčená Ceftriaxonem podávaným intravenózně a odeslaná na oddělení nukleární medicíny k vyšetření třífázovou scintigrafií skeletu. Pacientce byla podána aktivita 750 MBq 99mT-metylendifosfonátu. Za 10 minut po intravenózní aplikaci radiofarmaka byla provedena 2. fáze třífázové kostní scintigrafie zaměřená na oblast sakroiliakálního skloubení. S odstupem tří hodin byla vyšetřena 3. fáze (kostní) metodou celotělové scintigrafie. Vyšetření bylo provedeno na dvouhlavé gamakameře AXIS firmy PICKER. Následně byla studie semikvantitativně vyhodnocena na počítači. Gamakamera byla osazena kolimátory pro nízké energie s vysokým rozlišením a paralelními otvory.
Výsledky
Třífázová scintigrafie skeletu: Po intravenózní aplikaci 750 MBq 99mTc-metylendifosfonátu ve 2. fázi (tzv. blood pool) zaměřené na sakroiliakální skloubení nevidíme zvýšené vychytávání radiofarmaka ve smyslu hyperémie. Třetí kostní fáze celotělové scintigrafie zobrazuje výrazně nehomogenní akumulaci radiofarmaka ve skeletu se skvrnitě zvýšeným vychytáváním v axiálním skeletu (s výjimkou hrudního obratle Th 10, kde je akumulace snížená), v kalvě okcipitálně, v obou kyčelních kloubech, ve femuru vlevo (v intertrochanterické oblasti a krčku femuru) a ložiskovou depozici ve střední části levé fibuly (Obr. 1). Bylo proto vysloveno podezření na difuzní nitrodřeňový proces.
1. Třífázová scintigrafie skeletu metodou celotělové scintigrafie v přední a zadní projekci. Třetí (kostní fáze). Nález skvrnitě zvýšeného vychytávání v axiálním skeletu, v kalvě okcipitálně, v obou kyčelních kloubech a v levé fibule - vzhledem k věku pacientky výrazně atypický obraz. 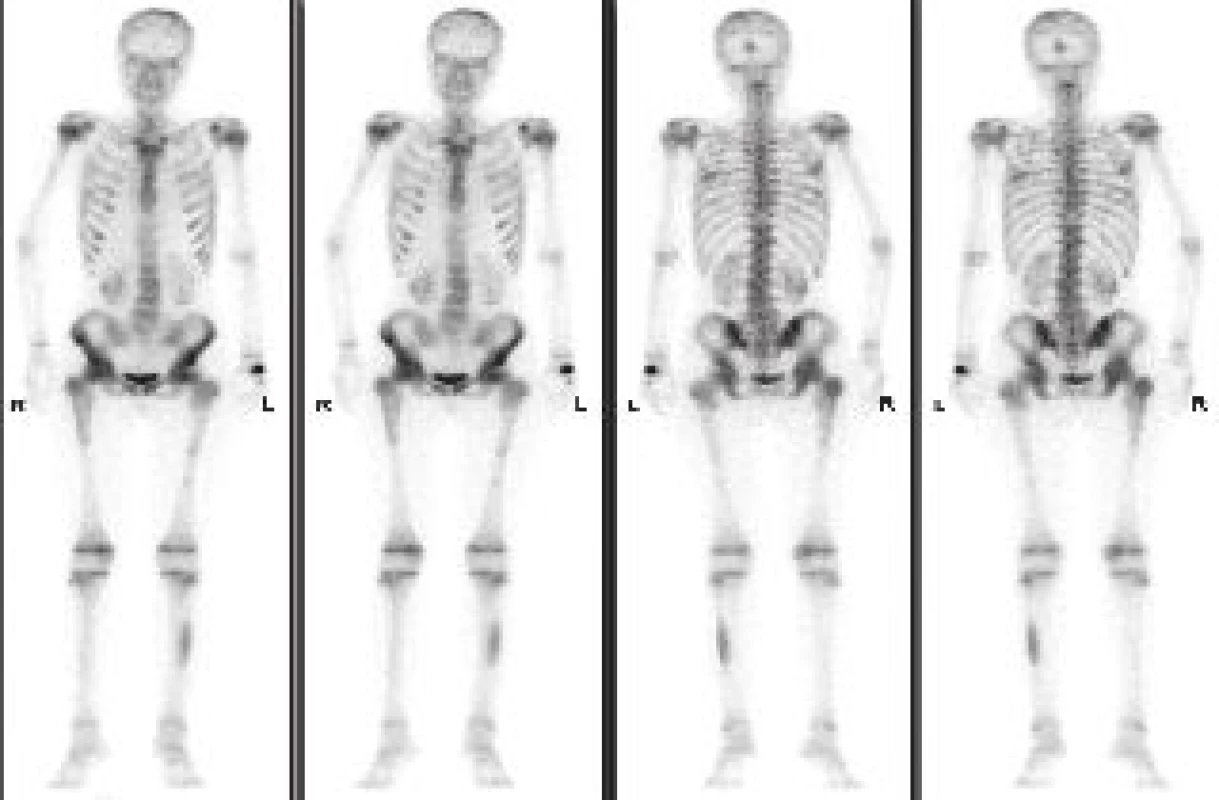
Následný postup: Pacientka byla následně přeložena na hematoonkologickou kliniku Fakultní nemocnice v Olomouci. Zde bylo provedeno vyšetření magnetickou rezonancí skeletu, které potvrdilo mnohočetné ložiskové změny v zobrazovaném skeletu, odpovídající změnám při maligní proliferaci. Vyšetření kostní dřeně a následné trepanobioptické vyšetření prokázalo nález podporující diagnózu Ewingova sarkomu/PNET s nejasným primárním ložiskem. K další diagnostice a léčbě byla pacientka přeložena na Kliniku dětské onkologie Fakultní nemocnice v Brně. Zde bylo před zahájením terapie dle Ewinga 08 provedeno vyšetření pozitronovou emisní tomografií (PET/CT) (Obr. 2) po aplikaci 2-[18F]fluoro-2-deoxy-D-glukózy (18F-FDG). Ve výsledku vyšetření byla popsána mnohočetná hypermetabolická ložiska ve skeletu s nejvyšší aktivitou v levé fibule. Extraoseálně ložiska hypermetabolismu glukózy nebyla nalezena.
2. Snímky PET/CT zapůjčeny z Masarykova onkologického ústavu Brno. Pozitronová emisní tomografie trupu <sup>18</sup>F-FDG ze dne 20. 1. 2012 (nález před zahájením terapie dle Ewinga 08). Po aplikaci <sup>18</sup>F-FDG i. v., po 60-ti minutách, snímání emisních a transmisních skenů s korekcí absorpce a iterativní rekonstrukcí dat. Snímání od proximální části stehen výše (horní část obrázku). Snímání dolních končetin (dolní část obrázku). Low dose CT ke korekci atenuace. Nález hodnocen jako mnohočetná hypermetabolická ložiska ve skeletu s nejvyšší aktivitou v levé fibule. Extraoseálně ložiska hypermetabolismu glukózy t. č. nenalezena. 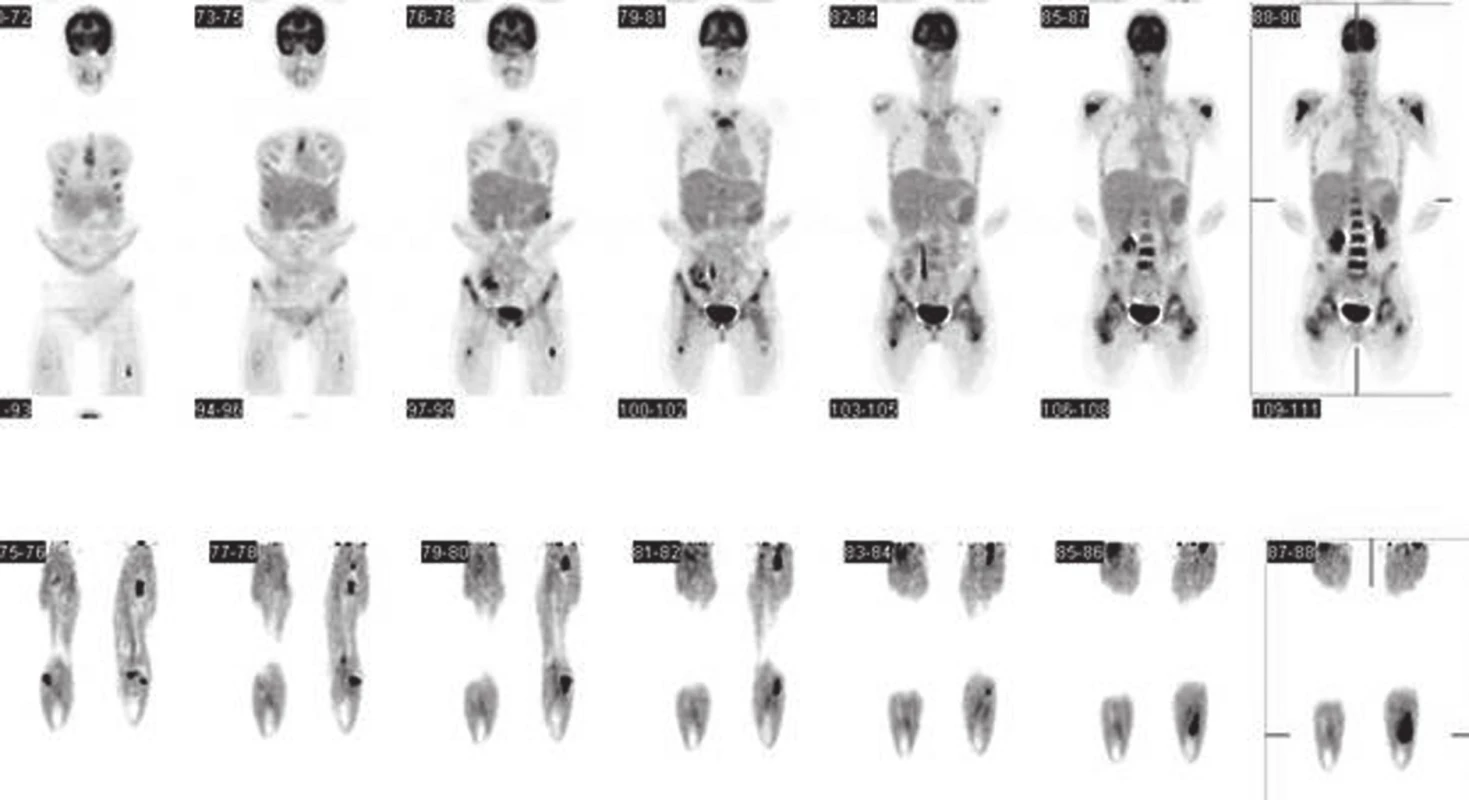
Staging byl uzavřen jako Ewingův sarkom/PNET s primárním ložiskem v levé fibule s mnohočetnými metastázami do skeletu a kostní dřeně T2N0M1, klinické stádium Enneking III. Byla nasazena terapie dle protokolu Ewing 08. Tato terapie byla následně komplikována encefalopatiií a febrilní neutropenií. Po 2. bloku chemoterapie bylo provedeno kontrolní vyšetření PET/CT (Obr. 3). Byla zjištěna výrazně nehomogenní drobně ložisková distribuce metabolismu 18F-FDG ve slezině a nově i v játrech. Nebylo možno jednoznačně rozhodnout, zda příčinou těchto ložisek je metastáza, mykotický infekt nebo zda se jedná o poléčebnou hepatopatii. Dále byla nalezena lehce nehomogenně vyšší akumulace fluorodeoxyglukózy v kostní dřeni obou kostí stehenních (více vlevo) s náznakem i lehce vyšší akumulace 18F-FDG v proximální části levé fibuly.
3. nímky PET/CT zapůjčeny z Masarykova onkologického ústavu Brno, vyšetření ze dne 1. 6. 2012 (nález po 2. bloku chemoterapie), po aplikaci <sup>18</sup>F-FDG i. v., po 60-ti minutách, snímání emisních a transmisních skenů s korekcí absorpce a iterativní rekonstrukcí dat. Snímání od proximální části stehen výše (horní část obrázku). Snímání dolních končetin (dolní část obrázku). Low dose CT ke korekci atenuace. Zjištěna výrazně nehomogenní až drobně ložisková distribuce metabolismu <sup>18</sup>F-FDG nejen ve slezině (kde SUV max. až 3,77), ale nově i v játrech (SUV max. až 3,42) (viz šipky). Dále byla nalezena lehce nehomogenně vyšší akumulace <sup>18</sup>F-FDG v kostní dřeni obou femurů, více vlevo, SUV max. do 1,48. Náznakem i velmi lehce vyšší akumulace <sup>18</sup>F-FDG v proximální části levé fibuly, SUV max. kolem 0,8. Jednoznačná ložiska patologického hypermetabolismu <sup>18</sup>F-FDG (meta) patrná (mimo uvedené nehomogenity v játrech a slezině) nejsou. 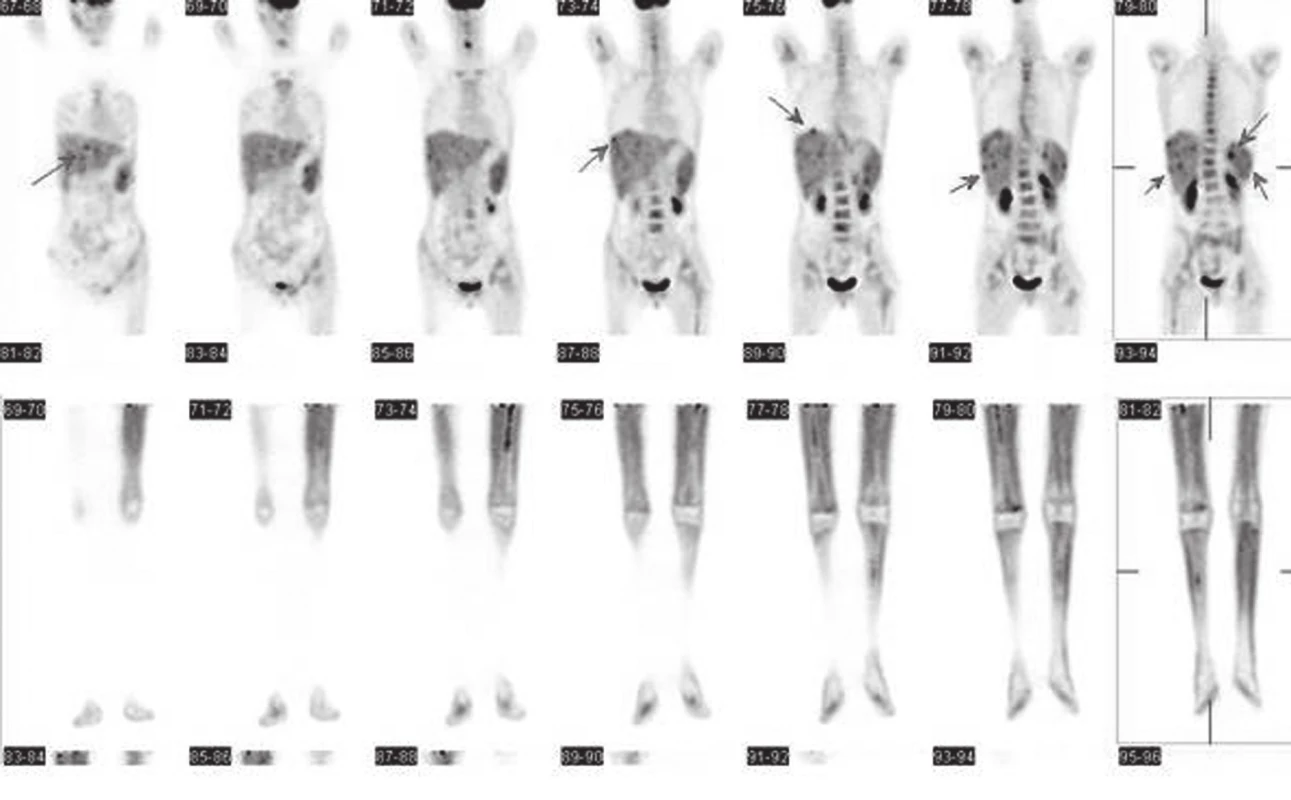
Po skončení šesti bloků chemoterapie byla dle stavu pacientky plánována vysokodávkovaná chemoterapie s převodem vlastních periferních kmenových buněk a následně ozáření ložisek radioterapií. Chirurgická terapie následující po neoadjuvantní chemoterapii u pacientky není možná z důvodu metastatického rozsevu.
Diskuze
Ewingův sarkom je vysoce maligní biologicky agresivní špatně diferencovaný kostní nádor neurogenní histogeneze, druhý nejčastější po osteosarkomu, postihující kost i měkké tkáně. Nejčastěji se vyskytuje u dětí mezi 4.-15 rokem věku. Incidence je 1 pacient na 1 milion obyvatel ročně. Společně s primitivními neuroektodermálními tumory (PNET) tvoří Ewingův sarkom skupinu ES/PNET. Tyto dvě klinicko-patologické jednotky mají podobné histologické a imunohistochemické charakteristiky. Ewingův sarkom velmi často vychází z dlouhých kostí končetin (zejména stehenní kosti, fibuly a humeru) a kostí pánve. Diagnóza je definitivně stanovena histologickým, imunohistochemickým a cytogenetickým vyšetřením. Zobrazovací metody relevantní v diagnostice Ewingova sarkomu zahrnují prostý RTG snímek, CT vyšetření, magnetickou rezonanci (MR), kostní scintigrafii a pozitronovou emisní tomografii (PET/CT). Moderní terapie zahrnuje vícesložkovou chemoterapii kombinovanou s chirurgickým výkonem, případně radioterapii.
Třífázová kostní scintigrafie je metoda zvyšující specificitu kostní scintigrafie. Představuje kombinaci dynamické a statické scintigrafie. Je to metoda nevyžadující žádnou přípravu a lze ji provádět prakticky u všech pacientů od kojeneckého věku až po pozdní stáří. Relativními kontraindikacemi jsou pouze těhotenství a laktace. Třífázová kostní scintigrafie je tvořena 1. fází angiografickou (tzv. blood flow), která následuje bezprostředně po aplikaci radiofarmaka. 2. fáze (tzv. blood pool) je podmíněna přestupem radiofarmaka z krevních cest do extracelulárního prostoru měkkých tkání. Snímkuje se do 10 minut po aplikaci radiofarmaka. 3. fáze (kostní) se snímkuje v rozmezí 2-5 hodin od aplikace radiofarmaka. Zvýšené regionální prokrvení v prvních dvou fázích odráží aktivitu procesu zvláště při diagnostice zánětlivého procesu (osteomyelitida, artritida), ale i při zánětlivém postižení měkkých tkání. Má svůj význam i v diagnostice primárních kostních nádorů a metastatického procesu. Platí, že chybění lokální hyperémie ve 2. fázi s vysokou pravděpodobností vylučuje infekční zánětlivý proces. K poznání příčiny hyperémie přispívá třetí kostní fáze, kdy např. u osteomyelitidy přetrvává vysoká akumulace. Na vybrané oblasti s ohledem na zvýšení senzitivity, specificity a upřesnění případné lokalizace léze je možné doplnit jednofotonovou emisní tomografii (SPECT).
Pro zobrazení skeletu metodou třífázové kostní scintigrafie se jako radiofarmakum používá 99mTc-metylendifosfonát. Množství podané aktivity 99mTc-metylendifosfonátu je závislé na tělesné hmotnosti pacienta. Jedná se o nejčastěji používané osteotropní radiofarmakum na bázi fosfátových komplexů značených 99mTc (bifosfonát) s nejkratším řetězcem, a proto i s nejrychlejším únikem z měkkých tkání. Po intravenózní aplikaci se fosfátové komplexy v kostech z velké části navazují na povrch hydroxyapatitového krystalu, v menší míře na kalcium fosfát a organickou matrix. Intenzita akumulace značeného fosfátu v kostní tkáni závisí na prokrvení a na osteoblastické aktivitě. Tato determinuje tvorbu a růst hydroxyapatitových krystalů a ovlivňuje hromadění radiofarmaka v minerální části kosti. Při hodnocení radiační zátěže pacienta je u dospělých orgánem s nejvyšší absorbovanou dávkou povrch kostí (0,063 mGy/MBq). Efektivní dávka je 0,0057 mSv/MBq 1.
Diagnostika kostních nádorů může být značně složitá. Klinicky se tyto tumory projevují zpočátku mírnými bolestmi kostí a kloubů, postupně až s omezením pohybů a nočními bolestmi. Příznaky jako horečka, slabost, pokles hmotnosti či anémie jsou přítomny pouze u 10-20 % pacientů. Dle čtyřletého sledování uvádí Skotáková J. et al. 2 ve své práci, že v dětském věku tvoří maligní kostní nádory 5 % všech malignit. Nejčastějšími jsou osteosarkom a nádory Ewingova typu. Rutinně se dělí na sarkom typický a primitivní neuroektodermální nádor (PNET), v posledních letech se objevuje označení Ewing´s sarcoma family of tumors (ESFT). U těchto pacientů je nejvíce ohroženou anatomickou oblastí diafýza dlouhých kostí a kyčelní kost.
Vzhledem k tomu, že u naší pacientky nedocházelo ke zlepšení klinického stavu, byla provedena třífázová scintigrafie skeletu. Cílem bylo vyloučit možné zánětlivé postižení pravého sakroiliakálního skloubení. Výsledek tohoto vyšetření prokázal difuzně nehomogenní akumulaci radiofarmaka ve skeletu se skvrnitě zvýšeným vychytáváním v axiálním skeletu, v kalvě, v obou kyčelních kloubech, ve femuru vlevo (v intertrochanterické oblasti a krčku femuru) a ložiskovou depozici ve střední části levé fibuly. V oblasti pravého sakroiliakálního skloubení nebyla zjištěna zvýšená akumulace radiofarmaka.
Scintigrafií skeletu lze rychle posoudit celý skelet. Hlavní limitací scintigrafického vyšetření je však jeho nízká specificita. Na základě scintigrafie skeletu proto není možné posoudit etiologii procesu, neboť jakékoliv postižení kostí nádorem, zánětem či traumatem může vést k abnormální akumulaci radiofarmaka ve skeletu a tedy k obdobnému obrazu. Scintigrafický nález je tedy nutno hodnotit vždy s ohledem na klinický stav pacienta, anamnézu a laboratorní výsledky. Vysoká senzitivita je naopak výhodou v detekci časných fází onemocnění. Vižďa et al. 3 uvádí, že u maligních kostních nádorů je zvýšená akumulace radiofarmaka ve všech třech fázích třífázové kostní scintigrafie. Zvýšená perfuze nemusí být lokalizovaná pouze do oblasti nádoru, ale postihuje obvykle celou končetinu. U Ewingova sarkomu bývá v kostní fázi akumulace obvykle homogenní, ale nález může být obdobný jako u osteomyelitidy, eozinofilního granulomu a velkobuněčného kostního tumoru 4. Při lokalizaci v pánvi a kosti křížové však byl na pozdním scintigrafickém snímku popsán i normální nález.
V prezentovaném klinickém případě je popisováno postižení fibuly. Adámková et al. 5 ve své práci z roku 2012 poukazuje na skutečnost, že z celkem 18 léčených a sledovaných pacientů s diagnózou Ewingova sarkomu mělo 13 pacientů (72 %) onemocnění lokalizované a 5 pacientů (28 %) onemocnění metastatické. Z hlediska primární lokalizace šlo v osmi případech o končetinový nález (femur, tibie, fibula). Cousins et al. 6 prezentuje zajímavý případ metastatického Ewingova sarkomu u mladého muže s postižením kalvy, žeber, femuru a fibuly. Provedení celotělové scintigrafie skeletu pomocí 99mTc-metylendifosfonátu u tohoto pacienta, stejně jako v případě naší pacientky, vedlo k dramatické změně v dalším diagnostickém postupu.
Kostní scintigrafie 99mTc-metylendifosfonátem se v literatuře v souvislosti s kostními nádory uvádí jako vhodná také k vyloučení skip metastáz (A.M.Davies 7). Dupal et al. 8 uvádí scintigrafii skeletu v diagnostice kostních tumorů jako jedno z téměř „screeningových“ vyšetření, které dokáže s předstihem zobrazit metabolickou aktivitu procesu, jeho biologické chování i výskyt metastáz. Ze zobrazovacích metod se v současné době k potvrzení diagnózy používá vyšetření pomocí magnetické rezonance. Vyšetření PET/CT s použitím 2-[18F]fluoro-2-deoxy-D-glukozy (18F-FDG) nemá v diagnostice primárních kostních nádorů dostatečnou specificitu. Slouží především k hodnocení odpovědi na neoadjuvantní léčbu a k detekci recidivy nádoru.
Závěr
Vyšetření skeletu pomocí třífázové kostní scintigrafie dokumentuje přínos daného vyšetření jako neinvazivní a vysoce senzitivní metody v diagnostice patologie kostí či kostní dřeně. Její použití v našem případě znamenalo obrat v diagnostickém postupu a urychlilo proces stanovení klinické diagnózy.
Jana Páterová, Jaromír Bernátek, Blanka Kadlčíková
Oddělení nukleární medicíny, Krajská nemocnice T. Bati, a.s., Zlín
jankapaterova@volny.cz
Sources
1.Hušák V, Petrová K, Masopust J et al. Aplikované aktivity radiofarmak, radiační zátěž a radiační riziko vyšetřovacích postupů v nukleární medicíně. Cas Lek Cesk 1999;138 : 323-328
2.Skotáková J, Mach V, Bajčiová V et al. Maligní tumory dlouhých kostí u dětí, diferenciální diagnostika, přínos zobrazovacích metod. Acta Chir Orthop Traumatol Cech. 2006;73 : 183-189
3.Vižďa J, Křížová H, Urbanová E. Atlas kostní scintigrafie. Praha. Lacomed 2006 : 71
4.Mottl H. Ewingův sarkom a osteosarkom. Sanquis 2007;51 : 18
5.Adámková Krákorová D, Tuček Š, Tomášek J et al. Léčba Ewingova sarkomu/periferního neuroektodermálního tumoru dospělých. Onkologie 2012;6 : 91-94
6.Cousins JP, Blend MJ. MDP Bone Scan: a Key Step in Assessment and Staging of a Rare Presentation of Ewing sarcoma in a Young Adult Man. The Internet Journal of Nuclear Medicine 2012;3 : 1-5
7.Davies A, Makwana N, Grimer R et al. Skip metastases in Ewing‘s sarcoma: a report of three cases. Skeletal Radiol 1997;26 : 379-384
8.Dupal P, Křížová H. Scintigrafie skeletu v diagnostice kostních nádorů. Zdravotnické noviny ZDN Příloha Lékařské listy LL 2000;31 : 2
Labels
Nuclear medicine Radiodiagnostics Radiotherapy
Article was published inNuclear Medicine

2013 Issue 2
Most read in this issue- Ewing sarcoma - scintigraphic image
- Brief overwiev of individually prepared radiopharmaceuticals in laboratory on KNME FN Motol Prague
- Specification of Equivocal Lesions in Planar Whole Body Bone Scintigraphy with SPECT/CT in Oncological Patients
- What can you see on the image?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

