-
Medical journals
- Career
Fibromyalgický syndrom
: Jeremiáš Pavel
: Oddělení klinické farmakologie, FN Plzeň
: Reviz. posud. Lék., 15, 2012, č. 3-4, s. 97-113
: Review articles
Článek pojednává o diagnostice, četnosti, prognóze a dopadu na kvalitu života, dále o patofyziologii a léčbě fibromyalgického syndromu. Kromě kliniky uvádí i dopady na pojistné a nepojistné systémy – podle některých studií 25 % nemocných pobíralo nějakou sociální dávku, pacienti mají dvakrát vyšší pracovní neschopnost.
Jsou uvedeny i testy užívané pro hodnocení jednotlivých příznaků a možnosti léčby včetně doporučení EULAR.Klíčová slova:
fibromyalgický syndrom – bolest – deprese – funkční disabilita – bolestivé body – maladaptivní bolest – dolorimetrie – katastrofizace1. ÚVOD
Fibromyalgický syndrom (FMS) je charakterizován chronickou difuzní bolestí. Jedná se o běžné onemocnění, postihující 2–4 % populace. Prevalence tohoto onemocnění dramaticky stoupla od roku 1990. Nejedná se o novou klinickou jednotku, neboť již v minulosti bylo onemocnění známo pod různými názvy, jako např. fibrositis nebo syndrom myofasciální bolesti. V roce 1990 byl prvně použit termín fibromylagie v souvislosti s publikací nových klasifikačních kritérií, která zveřejnila americká revmatologická společnost.
Chybění objektivního diagnostického testu a překrývání s jinými onemocněními vedly často k signifikantnímu opoždění ve stanovení diagnózy. Obecně panuje mylná představa, že toto onemocnění špatně odpovídá na jakoukoliv léčbu. Ve světle výsledků nových studií se ukazuje, že včasná a správná diagnostika spolu s adekvátní terapií mohou pozitivně ovlivnit symptomy a kvalitu života nemocných spolu s úsporou nákladů zdravotního systému. Aby se zabránilo zbytečné úzkosti a frustraci nemocných s fibromyalgií, je nesmírně důležité toto onemocnění rozpoznat již v časných fázích.
1. 1. Klíčové body při diagnostice fibromyalgického syndromu
- Fibromyalgický syndrom je charakterizován chronickou difuzní bolestivostí a zvýšenou citlivostí.
- Únava, absence osvěžujícího spánku, deprese, úzkost a poruchy kognitivních funkcí jsou tzv. red flags, značí příznaky, které nutí pomýšlet na alternativní diagnózu. Patří sem otoky kloubů, svalová slabost, abnormality chůze, kožní výsevy, snížené šlachové reflexy a lymfadenopatie.
1. 2. Terminologie
Fibromyalgický syndrom není novou klinickou jednotkou, přestože tento termín byl nově zaveden až v souvislosti s publikováním nových diagnostických kritérií ACR (American College of Rheumatology) v r. 1990. Již od r. 1800 byla pro toto onemocnění používána promiskuitně řada názvů, jmenovitě např. fibrositida, myofascitida či myofasciální bolest. Ačkoliv termín fibromyalgický syndrom není ideální, neboť nenaznačuje příčinu onemocnění, popisuje nejběžnější symptom, kterým je chronická difuzní plošná bolest svalů.
2. SYMPTOMY A KLINICKÉ ZNÁMKY ONEMOCNĚNÍ
2. 1. Bolest
Univerzálním symptomem FMS je chronická difuzní bolest. Tímto pojmem se rozumí bolest na obou stranách těla, nad pasem i pod ním, trvající déle než 3 měsíce. Bolest je převážně axiální a plošná, ale může postihovat jakoukoliv oblast a v určitém čase pak je vnímána jako povšechná. Charakteristické je, že pacient si stěžuje na bolest celého těla, která trvá po celý čas. U některých pacientů se zjistí v anamnéze chronická lokální bolest (např. chronická bolest zad v lumbální oblasti), která se vyvíjí v difuzní bolest.
Bolest je nejčastěji uváděna jako bodavá, s občasnými ostrými spasmy, jiní pacienti uvádějí napětí svalů až s pocitem svázání do uzlu. Jednoduchá analgetika jako je paracetamol a NSA bývají zřídka efektivní. Přestože je bolest přítomna po celý den a je konstantní, bez signifikantního vlivu diurnálního rytmu, její intenzita a lokalizace může být variabilní. Fyzická aktivita bolest často zhoršuje, nicméně řada pacientů uvádí i spontánní obtíže bez předcházejícího vyvolávajícího faktoru.
Dalším z charakteristických rysů onemocnění je zvýšená citlivost, která může být vyvolána u některých postižených i lehkým tlakem či dotykem, v extrémním případě i ten nejjemnější kontakt může vést k obranné reakci projevující se ucuknutím.
Dále jsou u FMS běžné i další bolestivé projevy, jako jsou chronické bolesti hlavy tenzního i migrenózního charakteru, bolesti na hrudi nekoronárního původu, dysmenorhea či syndrom dráždivého tračníku. Pacienti si často stěžují na závažnost bolesti, která je omezuje při běžných aktivitách i v zaměstnání.
2. 2. Únava
Únava je zvláště častá u pacientů, kteří trpí současně depresemi, ale může se vyskytovat i u nemocných bez poruch nálady. Mnoho pacientů udává únavu jako druhý nejvážnější symptom vyjadřující míru dopadu nemocí. Často se zhoršuje ráno a v časných večerních hodinách. Mnozí pacienti udávají únavu v souvislosti i s jen mírnou fyzickou a psychickou činností. I když tíže únavy kolísá, obecně je u pacientů s FMS méně omezující než u pacientů s chronickým únavovým syndromem. Přesto u některých jedinců únava redukuje schopnost vykonávat běžné aktivity a snižuje kvalitu života.
2. 3. Neosvěžující spánek
Neosvěžující spánek postihuje asi 65 % nemocných s FMS, avšak často není spontánně uváděn a je třeba se nemocných cíleně dotazovat. U některých pacientů má tento symptom význam i v patogenezi onemocnění. Nemocní udávají typicky absenci osvěžení či odpočinku i po celonočním spánku. To vede k postupnému pocitu vyčerpání, únavě a fyzickému omezení.
Poruchy spánku mají také často přímou souvislost s tíží únavy a bolesti. V některých případech jsou popisovány i problémy s usínáním a časté noční buzení. Potíže s častým buzením pak mívají často pacienti, u nichž se vyskytuje komorbidně onemocnění definované jako syndrom spánkové apnoe. Na to je třeba myslet zvláště v souvislosti s výskytem nápadného chrápání a poruchami dechu.
Syndrom neklidných nohou se vyskytuje u 20 až 30 % nemocných a je rovněž asociován se špatnou kvalitou spánku.
2. 4. Deprese a úzkost
30–50 % nemocných s FMS trpí na výrazné deprese a úzkostné stavy. Jejich výskyt je u některých pacientů sekundární, kdy vznikají jako reakce na protrahované obtíže, u jiných předchází rozvoji chronické difuzní bolesti. To poukazuje na kauzální souvislost chronické bolesti s poruchami emocí a nálady. Někdy je užitečné se pacientů přímo zeptat, zda cítí souvislost chronické bolesti s depresemi. Prospěšné jsou i dotazy ohledně přítomnosti pocitů smutku, méněcennosti či prázdnoty. Je třeba zjišťovat, zdali se dotyčný již méně těší z věcí, které mu dříve činily radost, je užitečné ptát se na míru chuti do života. Zvláště důležité je včas citlivě odhalit depresivní stavy s možností suicidálních sklonů. V takovém případě je pak nutná neodkladná intervence psychiatra.
Deprese je často provázena únavou, což může dále zhoršit již přítomné symptomy, jakými jsou svalové bolesti a ztuhlost. Platí to zvláště v situaci, kdy ještě není diagnóza onemocnění stanovena a u postižených prudce vzrůstá pocit frustrace. U těžkých případů jsou přítomny panické ataky, symptomy asociované s úzkostí zahrnují závratě, nadměrné pocení, zažívací obtíže, palpitace a parestezie.
2. 5. Poruchy kognitivních funkcí
Poruchy kognitivních funkcí se u FMS vyskytují rovněž často. Patří mezi ně problémy s pamětí, neschopnost koncentrace, potíže s uchováním nových informací či obtíže při plnění matematických úloh. Ve Spojených státech amerických je používán termín „fibrofog“, kdy pacienti udávají, že se ocitají jakoby v mlze. Tyto obtíže jsou typicky epizodické, trvající několik dnů, ale mohou být v některých případech i prolongované. Poruchy kognitivních funkcí často vedou k problémům při plnění běžných úkolů v domácnosti i zaměstnání. To má značný vliv na kvalitu života zvláště v případech, kdy charakter práce vyžaduje větší mentální nasazení. V konečném důsledku se tak poruchy kognitivních funkcí spolupodílí na frustraci a psychosociálním stresu.
2. 6. Funkční disabilita
Mnoho postižených má problémy sladit svoje soukromí se zaměstnáním. Fyzické i duševní obtíže vedou k funkční disabilitě se snížením kvality života. Správně komplexně zhodnotit rozdílnou míru důležitosti symptomů a jejich důsledků u konkrétního pacienta je zvláště důležité pro vedení léčebné strategie.
2. 7. Ostatní symptomy
U pacientů s FMS se vyskytuje i řada jiných symptomů, jmenovitě ranní ztuhlost, pocity otoků v různých částech těla, znecitlivění či brnění končetin. Objektivní nálezy však často chybí. Chronické bolesti hlavy, bolesti na hrudi, pocity dechové tísně a palpitace jsou běžné. Často jsou sice projevem úzkosti, ale pečlivé vyšetření kardiovaskulárního aparátu by mělo být přesto provedeno k vyloučení závažného srdečního onemocnění. Gastrointestinální symptomy, jako jsou nauzea, zvracení, nadýmání, bolesti břicha, průjmy či zácpa, jsou u FMS rovněž časté, a to zvláště v souvislosti s přítomným syndromem dráždivého tračníku.
Urogenitální projevy pak zahrnují nucení na močení, častější frekvenci močení, inkontinenci, pánevní bolesti a menstruační problémy.
Nevysvětlitelná změna tělesné hmotnosti a objektivně zjištěné febrilie jsou varovnými symptomy, které nás nutí pomýšlet na jinou diagnózu, než je FMS.
2. 7. Klinické aspekty: fyzikální vyšetření
Cílem fyzikálního vyšetření je především potvrdit diagnózu a vyloučit přítomnost jiného systémového onemocnění. Z toho důvodu je pečlivé vyšetření velmi důležité. U nemocných s FMS je obvykle fyzikální nález nenápadný. Sledují se abnormality pacientovy chůze, vyšetřuje se přítomnost kloubních deformit a rozsah kloubních pohybů. Objektivní zjištění svalové slabosti, synovitidy, srdečního šelestu, oslabení či vymizení šlachových reflexů nebo nález jiných neurologických abnormalit nutí vždy pomýšlet na jiné onemocnění, jako je např. hypotyreóza. V takovém případě jsou nutná detailnější vyšetření. U FMS jako vedlejší nález často zjišťujeme osteoartrózu a tendinitidy.
2. 8. Bolestivé body, bolestivost, hyperalgezie a alodynie
Přítomnost mnohočetných hyperalgických spouštěcích bodů (tender points) je typickým nálezem u FMS. Pokud aplikujeme dostatečný tlakový stimul na kteroukoliv část těla, vyvoláme bolest. Jedná se o normální reakci na nociceptivní podněty. Pacienti s FMS však mají výrazně snížený práh bolestivosti. Bolestivé jsou pro ně i stimuly, které u zdravých jedinců bolest nevyvolají. Toto vnímání bolesti označujeme jako alodynie. Pokud je bolestivý stimul aplikován pacientovi s FMS, pociťuje jej výrazněji než zdravý jedinec. Takové vnímání nazýváme hyperalgezií. Vyvolat bolestivou odpověď v určitých spouštěcích bodech je důležité pro stanovení diagnózy FMS.
2. 9. ACR klasifikační kritéria pro FMS
Dlouho neexistovala žádná kritéria pro toto onemocnění. Publikování kritérií ACR v r. 1990 mělo značný význam pro sjednocení terminologie a bylo klíčové pro další výzkum onemocnění. Tato kritéria se opírají o 2 základní požadavky:
- Přítomnost chronické difuzní bolesti, definované jako bolest ve všech 4 kvadrantech těla včetně axiálního skeletu, trvající nejméně 3 měsíce a mající více či méně kontinuální charakter.
- Přítomnost nejméně 11 z 18 anatomicky definovaných bolestivých tlakových bodů (tender points). Ty zahrnují 9 bodů, vždy párově:
- záhlaví při úponu m. suboccipitalis,
- v rovině intertransverzálních prostorů C5–C7 při pohledu zepředu,
- ve středu horního okraje m. trapezius,
- v oblasti m. supraspinatus nad hřebenem lopatky blíže k mediálnímu okraji,
- na úponu druhého žebra na sternum,
- na laterálním okraji epikondylu humeru,
- v zevním horním kvadrantu hýždí,
- v oblasti velkého trochanteru,
- na mediální straně kolenních kloubů.
Tlak na tyto body vyvolá sice nepříjemné pocity i u jinak zdravých jedinců, nicméně u pacientů s FMS stejný tlakový podnět vyvolá zřetelnou bolestivost s častým záškubem a ucuknutím. K vyvolání tlakového stimulu by měl být použit palec a tlak by měl být natolik silný, aby vyvolal zbělení nehtu examinátora. To odpovídá tlaku cca 4 kg.
V roce 2010 vyšla nová ACR doporučení pro diagnostiku a hodnocení tíže symptomů. Výhoda těchto kritérií je v tom, že ke stanovení diagnózy není nutné provádět vyšetření bolestivých tlakových bodů. U nemocného se hodnotí pomocí dotazníku různé symptomy a další aspekty onemocnění. Pacient splňuje diagnostická kritéria pro fibromyalgii, pokud jsou splněny tyto podmínky:
- Wide spread pain index (WPI) > 7 a symptom severity (SS) scale score > 5 nebo WPI 3-6 a SS > 9
- Symptomy musí být přítomny ve stejné intenzitě nejméně 3 měsíce.
- Není přítomna jiná porucha, která by mohla případně způsobovat bolesti.
Wide spread pain index (WPI) – zaznamenává počet oblastí, ve kterých pociťuje pacient bolest v posledním týdnu. Skóre 0 až 19:
Symptom severity scale (SS scale score) – hodnotí tíži symptomů:
- Únava
- Nonrestoratorní spánek
- Kognitivní symptomy
Pro každý ze tří výše uvedených symptomů v uplynulém týdnu je použito následující hodnocení:
0 = žádné problémy
1 = nepatrné nebo mírné problémy, obvykle lehké nebo intermitentní
2 = znatelný, vážnější problém, často přítomné a/nebo střední úrovně
3 = těžké problémy: všudypřítomné, souvislé, negativně ovlivňující život
Zhodnocením somatických symptomů celkově hodnotíme, zda má pacient:
0 = žádné symptomy
1 = málo symptomů
2 = větší počet symptomů
3 = mnoho symptomů
SS skóre je souhrnem tíže 3 symptomů (únava, nonrestoratorní spánek, kognitivní symptomy) a počtu somatických symptomů. Konečné skóre je 0–12. Za somatické syptomy jsou považovány:
- bolesti svalů,
- syndrom dráždivého tračníku,
- únava, vyčerpání,
- problémy s myšlením nebo pamětí,
- svalová slabost,
- bolesti hlavy,
- bolest/křeče v břiše,
- pocit brnění, znecitlivění,
- nespavost,
- deprese,
- zácpa,
- bolest v horní části břicha,
- nevolnost,
- nervozita,
- bolest na prsou,
- rozmazané vidění,
- teplota,
- průjem,
- sucho v ústech,
- svědění,
- sípání,
- Raynaudův fenomén,
- kopřivka/šrámy: pruhy,
- zvonění v uších,
- zvracení,
- pálení žáhy,
- vředy v ústech,
- ztráta/změna chuti,
- záchvaty,
- suché oči,
- pocit dechové tísně,
- raš, fotosenzitivita,
- sluchové problémy,
- snadná tvorba pohmožděnin,
- padání vlasů,
- zvýšená frekvence močení,
- bolesti při mikci,
- spasmy močového měchýře.
Diferenciální diagnostika onemocnění vyvolávajících difuzní bolestivost a slabost:
- Primární generalizovaná osteoartróza.
- Revmatická polymyalgie.
- Autoimunitní onemocnění pojiva jako je SLE a idiopatické zánětlivé myopatie.
- Myopatie rozličné etiologie.
- Hypotyreóza.
- Malignity.
- Někdy se může FMS konkomitantně vyskytovat s osteoartrózou, revmatoidní artritidou, hypotyreózou či autoimunitním onemocněním. V takovém případě by měla být diagnóza FMS zvažována, pokud tíže bolesti neodpovídá aktivitě onemocnění.
Na alternativní diagnózu nutí pomýšlet tyto symptomy a fyzikální nálezy (tzv. red flags):
Symptomy:
- Signifikantní změny hmotnosti.
- Teploty.
- Apnoické pauzy během spánku (hlasité a nadměrné chrápání).
Nálezy:
- Otok kloubu.
- Svalová slabost.
- Abnormality chůze.
- Kožní projevy.
- Oslabené šlachové reflexy.
- Lymfadenopatie.
- Fokální neurologické nálezy.
2. 10. Vyšetřovací postupy
V rámci vyloučení jiných onemocnění je třeba provést laboratorní vyšetření, které by mělo zahrnovat krevní obraz, FW, biochemický screening, jaterní testy, hormony štítné žlázy a svalové enzymy. Revmatoidní faktor a antinukleární faktor by měly být stanoveny v případě, že je podezření na systémové autoimunitní onemocnění, často však mohou být falešně pozitivní.
Radiologické vyšetření obvykle není nutné, svalová slabost nebo abnormální neurologický nález mohou vyžadovat další vyšetření, jako je např. EMG.
Praktické návody pro diagnostiku
Dobře odebraná anamnéza je u FMS zvláště důležitá. Je třeba aktivně klást nemocnému následující cílené otázky a dotazy:
- Na místo, začátek a tíži bolesti.
- Zda se cítí dlouhodobě unavený.
- Zda dobře spí a zda se cítí po spánku osvěžený.
- Zda pociťuje deprese*, úzkost, nebo zda se cítí být stresován doma či v práci.
- Zda cítí dopad nemoci na všední život, práci a vztahy.
- Na „red flags“ symptomy, především na změny hmotnosti a přítomnost teplot.
- Provedení důkladného fyzikálního vyšetření včetně stanovení bolestivých bodů podle kritérií ACR.
- „Red flags“ nálezy zahrnují: otok kloubu, svalovou slabost, abnormalitu chůze, vyrážku, oslabení šlachových reflexů a přítomnost lymfadenopatie.
*V případě přítomnosti deprese je třeba se zeptat, zda postižený trpí myšlenkami na sebevraždu. Pokud ano, je třeba zajistit neodkladné psychiatrické vyšetření.
Asociovaná onemocnění
Pokud fibromylagie superponovala na již preexistující onemocnění, jako je osteoartroza či revmatoidní artritida, byla v minulosti označována jako sekundární. Pokud se fibromylagie vyskytovala samostatně, byla označována jako primární. Nová ACR klasifikační kriteria však již toto rozdělení neakceptují.
Společný výskyt („overlap“) FMS se somatizací
FMS sdílí často klinické příznaky s jednotkami, jako je syndrom dráždivého tračníku, chronický únavový syndrom a dysmenorea. To vede k představě, že FMS je částí spektra poruch charakterizovaných somatizací. Často vidíme běžný překryv symptomů a funkčních poruch mezi FMS, úzkostí a depresemi. Pacienti s FMS běžně dosahují vyšší skóre při hodnocení dotazníků valorizujících anxiózní stavy a deprese, nicméně je známým faktem, že mnoho pacientů s FMS depresemi netrpí a odpověď na antidepresiva u nich nezávisí na změnách nálady.
2. 11. Závěr
Poslední výzkumy u FMS dokazují, že diagnóza tohoto onemocnění je často opožděna o 5 let. V řadě případů je prováděna řada zbytečných vyšetření a testů. Promptní rozpoznání a stanovení diagnózy je důležité jak pro pacienta, tak i pro zdravotní systém. ACR diagnostická kritéria, která máme k dispozici, jsou jednoduše aplikovatelná i v rutinní praxi.
3. Epidemiologie a dopady na zdravotní systém
3. 1. Klíčové body
- FMS je běžné onemocnění postihující 2 % populace.
- Častější výskyt u žen v poměru 7 : 1.
- Fyzické funkce a kvalita života jsou často redukovány.
- Většina pacientů má chronické onemocnění.
- Spontánní remise nejsou běžné.
- Zdravotní náklady jsou nejvyšší v prvních 10 letech předcházejících diagnóze.
- Sociální výdaje jsou vysoké.
- Konstruktivní diagnostika může snížit zdravotní náklady.
3. 2. Historie FMS
První přesný popis onemocnění se objevil v polovině 19. století. V roce 1850 Froriop podal zprávu o pacientovi s „revmatismem“, který se vyznačoval silně bolestivými místy ve svalech, kdy tato bolest byla vyvolána tlakem. V roce 1904 představil Gowers termín „fibrositis“, ačkoliv tehdy popsal pouze regionální bolestivé syndromy zahrnující citlivost na dotek v asociaci s únavou a poruchami spánku, ale bez přítomnosti známek lokálního nebo systémového zánětu. V roce 1930 Lewis a Kellgren aplikovali hypertonický roztok soli hluboko do svalové tkáně, a vyvolali tak výše zmíněné svalové bolesti, které byly uniformní a jejichž distribuce byla odlišná od bolesti v dermatomech. V druhé polovině 20. století pak byla fibrositida některými odborníky považována za běžnou příčinu svalové bolesti, pro jiné byla manifestací tenze a „psychogenního revmatismu“.
Smythe a Moldofski představili současný koncept onemocnění v roce 1970 na základě studií, ve kterých popisovali určité anatomické lokalizace, které byly více bolestivé u pacientů s FMS než u kontrolních skupin. Tyto bolestivé body byly často identické s takovými regionálními bolestivými jednotkami, jako je tenisový loket, kostochondritida či syndromy z přetížení krční páteře. Zvláště důležité bylo to, že jako první tito autoři prokázali u nemocných s FMS poruchy spánku. Pokud byly tyto poruchy spánku navozeny u zdravých dobrovolníků, vyvolávaly u nich stejné symptomy, jaké měli nemocní s fibromyalgií. Během 80. let pak byla řadou studií prokázána diagnostická užitečnost spouštěcích bodů a byl rovněž navržen koncept primární a sekundární fibromylagie na základě pozorování současného výskytu FMS s některými revmatickými onemocněními, jako je revmatoidní artritida či systémový lupus. Během let se diskutovalo o optimálním počtu bolestivých bodů, stejně tak jako o relevantnosti koncepce primární a sekundární fibromyalgie. V roce 1990 ACR publikovala nová diagnostická kritéria, která prokázala vysokou senzitivitu (88,4 %) i specificitu (81,1 %). Tato kritéria byla vytvořena na základě examinace vybraných skupin pacientů vyšetřovaných trénovanými odborníky ve slepém uspořádání. Protože se mezi vyšetřovanými probandy s primární a sekundární fibromylagií nezjistily signifikantní rozdíly, byl tento koncept pro klasifikační účely opuštěn. Ačkoliv původním cílem ACR bylo usnadnit výzkum onemocnění díky snaze o homogenizaci pacientů a formovaná kritéria původně nebyla zamýšlena jako diagnostická, jsou nyní široce využívána v rutinní klinické praxi.
3. 3. Epidemiologie
S použitím ACR kritérií kolísá prevalence FMS v obecné populaci mezi 0,5–4 %. Prevalence FMS v podmínkách ambulantních klinik je však daleko vyšší a pohybuje se mezi 10–16 %. Onemocnění postihuje děti stejně často jako dospělé. Ženy jsou postiženy 3–7krát častěji než muži. FMS může být diagnostikován v kterémkoliv věku. Ačkoliv symptomy jsou nejvíce vyjádřeny ve věkové skupině 20–55 let, nemoc se může projevit již v dětství. Ve studii ACR v roce 1990 bylo nejvíce nemocných ve věku 49 let a z toho 89 % představovaly ženy. Prevalence onemocnění stoupá s věkem a dosahuje až 7 % u žen ve věku 60–80 let. FMS postihuje všechna etnika, srovnávací studie mezi populacemi v Evropě a Spojených státech amerických neprokázaly signifikantní rozdíly ve výskytu onemocnění.
3. 4. Celková prevalence v obecné populaci
FMS se vyskytuje ve všech zemích, nezávisle na stupni industrializace či lokálních kulturních vlivech. Vztaženo na ACR kritéria prevalence kolísá v populačních studiích mezi 1–2 %. V Evropě byla provedená studie (FEEL study – Fibromylagia & Epidemiology European large-scale survey), která ukázala nejvyšší prevalenci tohoto onemocnění v Portugalsku a ve Francii.
Populace vs. klinická praxe
Zatímco nejvyšší hodnota prevalence v obecné populaci je 2%, v ordinacích praktických lékařů je to 2,1 %, ve všeobecných zdravotních zařízeních 5,7 % a na revmatologických klinikách činí až 14–20 %.
3. 5. Rizikové faktory
Mnohé studie prokázaly, že psychologické poruchy, jako je somatizace, poruchy duševního zdraví, přítomnost psychologického distresu, panická porucha či depresivní syndromy jsou rizikovými faktory pro rozvoj FMS. Předchozí trauma a sociálně kulturní faktory, jako je nedostatečné vzdělání, nízký příjem, rozvodovost, imigrace, kouření a nízké společenské postavení, se mohou na rozvoji onemocnění pravděpodobně rovněž účastnit, definitivní důkazy kauzality však v tomto případě zatím chybí.
Řada studií prokázala, že genetické faktory hrají rovněž důležitou roli v rozvoji FMS. Bylo zjištěno, že až 28 % potomků matek s FMS trpí na chronické difuzní bolesti. Jedna kontrolovaná studie rovněž nalezla silnou familiární vazbu FMS. Riziko postižení touto chorobou u příbuzných probandů s FMS bylo 8krát zvýšené, pokud je srovnáme např. s jedinci s revmatoidní artritidou. Studie porovnávající prevalenci chronické difuzní bolesti u monozygotních a dizygotních dvojčat ukázaly, že míra vlivu genetické shody je cca 50%.
3. 6. Souhrn epidemiologie
Chronická difuzní bolest je v populaci běžná. V rozvinutých zemích se její prevalence pohybuje mezi 7–13 %, jak ukázaly populační studie z Velké Británie, Švédska a Severní Ameriky. Chronická regionální bolest, jakou je např. chronická bolest v dolní části zad, postihuje dokonce až 25 % obyvatel. Jak lokální, tak i chronická bolest postihují více ženy v poměru 5 : 1.
Chronická difuzní bolest i FMS jsou velmi běžné. Prevalence chronické difuzní bolesti je v obecné populaci vyšší než prevalence FMS. V populaci existuje mnoho pacientů, kteří splňují kritéria ACR pro FMS, aniž by u nich byla tato diagnóza stanovena. Z těchto důvodů se diagnóza FMS často nekryje se skutečným výskytem tohoto onemocnění v populaci. Pacienti s FMS jsou ve skutečnosti v populaci běžnější, FMS může reprezentovat část nemocných s chronickou difuzní bolestí. Signifikantně zvýšený poměr žen vůči mužům může být způsoben použitím ACR kritérií s daným počtem vyhrazených bodů. Při jejich vyšším výskytu u žen může docházet ke zkreslení v diagnostice onemocnění v neprospěch mužů. FMS je t. č. na 2–3. místě mezi nejčastějšími nemocemi v ordinaci revmatologa, kdy pacienti s FMS tvoří asi 10–20 % klientely.
3. 7. Nevýhody ACR klasifikačních kritérií
U FMS již bylo popsáno množství genů, které zahrnují např. polymorfismy genů pro serotoninonergní, katecholaminonergní či dopaminergní systém. Celkově existují přesvědčivé důkazy podporující důležitost genetických faktorů v souhře s faktory zevního prostředí při rozvoji FMS. V době, kdy byla formulována ACR kritéria, se předpokládala existence lokální patologie na úrovni bolestivých bodů. Recentní výzkumy ale ukázaly, že bolestivost je u FMS generalizovaná a může být vyvolána v mnoha částech těla. Patofyziologie této zvýšené citlivosti bude vysvětlena dále.
Vyhrazené body zvýšené citlivosti nejenže zkreslují patofyziologický podklad onemocnění, ale mají rovněž důležitý dopad na epidemiologická data. Mimoto počet bolestivých bodů koreluje více s psychologickým distresem než s prahem bolesti a palpační citlivostí měřenou pomocí dolorimetru. Počet bolestivých bodů je rovněž ovlivněn pohlavím, neboť i u zdravých dobrovolníků mají ženy tendenci vykazovat větší počet pozitivních bodů než muži. Výzkumy ukázaly, že ženy mají oproti mužům 11krát větší pravděpodobnost splnit počet nejméně 11 z 18 bodů podle kritérií ACR. To rezultuje v možnost poddiagnostikování FMS u mužů díky této bias.
Recentní studie porovnávající pacienty s dg. FMS založenou na hodnocení bolestivých bodů podle ACR kritérií v klinických a observačních studiích naznačují, že míra shody je pouze částečná. Ukazuje se, že cut-off hodnota 11 bodů není pro dg. FMS dostatečně senzitivní. Použití 6 bodů jako cut-off se ukázalo být senzitivnější bez zhoršení specificity. Tyto problémy, týkající se ACR kritérií, proto vedly v některých epidemiologických studiích k použití difuzní chronické bolesti jako definice onemocnění.
3. 8. Prognóza
Obecně není FMS progresivním nebo fatálním onemocněním. Většina studií ukazuje, že léčba může významně zlepšit symptomy, funkci i kvalitu života postižených již v krátké době. Obecně mají děti a mladší jedinci s FMS tendenci k lepším výsledkům léčby. Přestože již panuje určitý optimismus stran možností léčby FMS, prospektivní dlouhodobé kohortové studie provedené v Severní Americe a Evropě nenalezly signifikantní změny v prognóze onemocnění za 6–8leté období. Tíže bolesti, únavy, disability a kvality života zůstaly beze změn, navíc se prokázalo jen malé zlepšení v celkovém zdravotním stavu pacientů, v čerpání zdravotního systému a v míře nákladů spojených s touto nemocí. To dokumentuje zvláště skutečnost, že přibližně 25 % nemocných pobíralo sociální dávky.
Zdravotní stav pacienta s FMS je zatím i nadále špatný, často horší než u nemocného s ostatními chronickými muskuloskeletálními onemocněními, jako je např. revmatoidní artritida. Prediktorem špatného vývoje nemoci je především vyústění obtíží nemocného v životní krizi nebo těžkou disabilitu. Je zajímavým faktem, že pacienti, kteří se léčí ve specializovaných centrech, mají horší symptomy onemocnění a prognózu než ti, kteří lékaře nevyhledávají.
Granges at al. uvádějí 24% četnost remise po 2 letech trvání. Jiné studie udávají 25–35% zlepšení v tíži bolesti, nicméně kompletní vymizení symptomů je vzácné. Je proto důležité vysvětlit nemocnému povahu a prognózu nemoci. Je mu třeba zdůraznit, že zatím neexistuje žádný jednoduchý léčebný postup či univerzální lék. Pacient by měl být motivován k zaujetí pozitivního postoje k životu, což je podmínkou k rozvoji strategie umožňující vypořádat se s touto nemocí. Právě pozitivní myšlení a snaha vyrovnat se s chorobou se ukázaly být klíčovými body pro dosažení dobrých výsledků léčby. Zvládání stresu a povzbuzování pacientů v boji s chorobou má prvotní úlohu, pokud má být dosaženo dlouhotrvajícího zlepšení. Příkladem by mohl být prokázaný benefit pravidelného cvičení, jak ukázala jedna ze studií. S vědomím složitosti onemocnění a absence univerzálního léku je často nezbytný multidisciplinární přístup.
3. 9. Kvalita života
Tíže FMS je variabilní, nicméně kvalita života je obvykle snížená. Na vině je jak narušení fyzických funkcí, tak i emocionální poruchy. Přibližně 50 % pacientů má obtíže při denních aktivitách, 30–40 % nemocných změní svoje zaměstnání nebo přestane pracovat úplně. Chybějící podpora rodiny, přátel a zdravotníků pak může dále prohlubovat problém. Někteří pacienti s FMS mají srovnatelný stupeň sociálního, emočního i ekonomického dopadu na svůj život jako nemocní s revmatoidní artritidou.
3. 10. Kvalita života a vliv na fyzické funkce
Pro pacienty s FMS je často obtížné vykonávat běžné denní aktivity. Téměř polovina pacientů udává určitý stupeň disability. Mnoho nemocných si stěžuje na ranní ztuhlost, kdy potřebují více času, než se tzv. „nastartují“. Kvalita života měřená pomocí otazníku Sf-36 je u nemocných s FMS a RA srovnatelná s běžnou populací. Rozdíl je však ve stupni fyzické a sociální funkce, tělesné bolesti, všeobecném zdravotním stavu a úrovni mentálního zdraví, které jsou u pacientů s FMS a RA nižší než u zdravých jedinců. Pokud se týká mentálního zdraví, mají pacienti s FMS dokonce signifikantně více sníženou úroveň než revmatičtí nemocní. Psychologické faktory (mentální zdraví) hrají významnou roli v celkovém dopadu FMS na život pacienta.
Duševní zdraví/psychologický stres
Jedna ze studií porovnávala kvalitu života a celkový zdravotní stav u 98 pacientů s FMS oproti 48 zdravým dobrovolníkům. Měření probíhalo pomocí dotazníku Notingham Health Profile (NHP). Pacienti s FMS měli signifikantně vyšší skóre, což značilo, že jejich celkový zdravotní stav byl špatný. NHP skóre koreluje s aktivitou nemoci měřenou počtem bolestivých bodů i s dotazníky Fibromyalgia Impact Questionnaire (FIQ) a Health Assessment Questionnaire (HAQ). Pacienti s depresemi mají rovněž vyšší NHP skóre. To ukazuje na důležitý vztah mezi bolestí, depresí a kvalitou života nemocných s FMS. Navíc NHP skóre koreluje i s trváním nemoci, a ukazuje se tak, že zvláště chronicita má vážný dopad na zdraví a kvalitu života obecně.
Poruchy spánku a kvalita života
Studie provedená na více než 100 pacientech s FMS dokumentovala, že kvalita spánku byla signifikantním predikátorem bolesti, únavy a sociální funkce. Intervence zaměřené na zlepšení kvality spánku proto mohou mít pozitivní dopad i na kvalitu života nemocných s FMS.
Riziko negativního chování
Tíže bolesti, špatný mentální stav a poruchy spánku mohou buď samostatně, nebo v kombinaci vést k nadužívání medikace, alkoholu nebo drog. Studie provedená v roce 2001 zjistila vyšší incidenci násilných úmrtí včetně sebevražd a nehod u pacientů s chronickou difuzní bolestí. Jedině promptní diagnóza a pozitivní léčba mohou zabránit bludnému kruhu, kdy se nemoc vymkne kontrole.
3. 11. Náklady na zdravotní péči
Ve Spojených státech amerických byly v roce 1996 roční náklady spojené s FMS vyčísleny na 2 274 USD na 1 pacienta. Hlavními položkami jsou náklady na hospitalizaci a běžný denní servis. Data z národního centra pro prevenci chronických onemocnění ukázala, že FMS byl v r. 1997 spojen se 7440 hospitalizacemi.
Pokud srovnáme FMS s ostatními chronickými nemocemi, jako je diabetes či hypertenze, zjistíme, že náklady jsou sice obdobné, avšak nemocným s FMS se dostává ze strany zdravotního systému daleko menší pozornosti. Zlepšení povědomí lékařské veřejnosti o tomto onemocnění může nejen zlepšit léčbu, ale může také výrazně zefektivnit celkové náklady zdravotního a sociálního systému.
Databáze 5 milionů pacientů zahrnutých do britské General Practice Research Database (GPRD) ukázala vysokou frekvenci ambulantních návštěv, množství preskripce a náklady spojené s diagnostickými testy u nemocných s FMS oproti kontrolní skupině. Tyto náklady byly vysoké především v době do stanovení diagnózy, poté se již situace značně zlepšila. Tyto výsledky tak demonstrují nutnost konstruktivního přístupu, pokud chceme docílit snížení obrovských nákladů spojených s tímto onemocněním.
3. 12. Sociální výdaje
Náklady individuálního jedince i celého sociálního systému jsou u FMS obrovské. Přibližně 1/3 nemocných je nucena omezit pracovní dobu nebo zkrátit pracovní týden. Někteří dělají obojí ve snaze udržet si práci. Pro jiné se změna zaměstnání stává nutností i za cenu ztráty prestiže a sníženého příjmu. Observační studie z USA udávají, že sice 42 % nemocných s FMS chodí do zaměstnání, ale již 28 % pracuje doma. U pacientů s FMS je pak 2krát vyšší míra pracovní neschopnosti než u ostatních pracujících, 20–30 % nemocných pobírá nemocenské dávky a 16 % sociální dávky. Celkový roční dopad FMS na ekonomiku Spojených států je odhadován na více než 9 bilionů USD, což činí asi 1–2 % hrubého domácího produktu. Finanční náklady jsou sice obrovské, nicméně osobní dopad na pacienty, jejich rodiny a přátele je těžko vyčíslitelný.
4. PATOFYZIOLOGIE
4. 1. Klíčové body
- Zpracování bolesti je komplexní proces zahrnující nocicepci, transmisi, modulaci a percepci.
- Objektivní vyšetření s užitím funkčního snímání nervového systému prokázala, že bolest má u pacientů s FMS reálný základ.
- Fyziologická bolest je důležitá v ochraně před škodlivými vlivy, zatímco maladaptivní (patologická) bolest je způsobena funkčními abnormalitami nervového systému. FMS je charakterizován právě maladaptivní bolestí.
- Studie spánku u pacientů s FMS ukázaly sníženou kvalitu spánku se zvýšenou frekvencí buzení. U zdravých dobrovolníků pak vyvolala selektivní deprivace non-REM spánku stejné symptomy a hyperalgické body, jaké mají nemocní s FMS.
- Pacienti s FMS často uvádějí zážitky předchozí stresové nebo traumatické události. Redukovaná odpověď osy hypotalamus-hypofýza-nadledviny na stresové podněty může být jednou z příčin zhoršení FMS.
Anglosaský termín „fibromyalgia“, česky fibromyalgie, byl odvozen z latinského jazyka, konkrétně ze slov fibro (fibrous tissue), my (muscles), al (pain) a gia (podmínečný způsob, 2. pád). Fibromyalgie však byla mnohem častěji známa pod chybným označením fibrositis, dokud Chaitrow neprokázal, že onemocnění není spojeno se žádným zánětlivým procesem. Naše současné poznání patofyziologie FMS je založeno na tom, že nemoc je nejspíše poruchou na úrovni zpracování centrální bolesti nebo že se jedná o syndrom centrální senzitivity.
4. 2. Porozumění bolesti
Bolest je důležitým fyziologickým mechanismem, který nás má chránit před škodlivými vlivy. Upozorňuje nás na aktuální nebo blížící se nebezpečí poškození. Není tedy překvapivé, že je bolest spojena se stresovou odpovědí a reflexními pohyby tak, abychom byli ochráněni před dalším poškozením. Absence bolestivé percepce, jakou nalézáme např. u Charcotovy osteoartropatie, rezultuje v rozsáhlé poškození s destrukcí tkání. V tak extrémním případě, jakým je přítomnost vzácného onemocnění, tzv. vrozeného syndromu ztráty odpovědi na bolest, vede absence vysoce afinitních receptorů pro nervový růstový faktor ke ztrátě bolestivého čití a potažmo pak k výskytu mnohočetných Charcotových kloubů, fraktur a deformit. Nepochybně tak má bolest důležitou fyziologickou roli jak v ochraně proti poškození, tak i ve vytvoření prostoru pro navození reparačních procesů. Přestože základem bolesti je senzorické čití, má bolest i silnou kognitivní a emocionální komponentu. Tu lze interpretovat jako utrpení rezultující do psychologického a fyziologického stresu. Fyziologickým stresem je míněna činnost motorických reflexů, změny autonomního systému a vzestup neuroendokrinologické odpovědi. Všechny výše jmenované procesy jsou pak zahrnuty do vlastního zážitku bolesti.
Současné teorie fyziologického zpracování bolesti
Zpracování bolesti můžeme dělit na 4 hlavní části: nocicepci, transmisi, modulaci a percepci.
Nocicepce. Jde o vnímání tkáňového poškození, kdy je škodlivý (nociceptivní) stimul detekován periferními nociceptory a konvertován na elektrický impuls ve volných aferentních nervových zakončeních. Jedná se o přísně fyzikální a fyziologický proces, který může být inhibičně ovlivněn nesteroidními protizánětlivými léky, opiáty a lokálními anestetiky.
Transmise. Jedná se o proces, kdy jsou nervové impulsy šířeny periferním a centrálním nervovým systémem. Ostrá bolest je přenášena pomocí A-delta (rychlých) vláken, tupá bolest pomocí C (pomalých) vláken a taktilní čití je vedeno A-beta vlákny. Všechny typy vedení mají nízký stimulační práh. Transmise může být inhibována pomocí lokálních anestetik a alfa-2 agonistů.
Modulace. Proces probíhá v CNS, především v zadních rozích míšních. Excitační neuropeptidy, jako je substance P, glutamát a aspartát, zesilují bolestivý signál v ascendentních neuronech, zatímco endogenní inhibitory descendentních neuronů, jakými jsou opioidy, serotonin a noradrenalin, působí zeslabení nociceptivní odpovědi. Lokální anestetika, alfa-2 agonisté, opioidy, NSA, tricyklická antidepresiva, inhibitory zpětného vychytávání serotoninu a antagonisté receptorů pro N-methyl-D-aspartát (NMDA) mohou ovlivňovat rovnováhu mezi excitací a inhibicí bolesti.
Percepce. Znamená odpověď mozkové kůry na nociceptivní signál, jde o proces, který je silně závislý na interpretaci iniciálního podnětu. Percepce jeví velkou míru interindividuální odlišnosti – u některých jedinců vyvolá malý stimul velký stupeň bolesti, zatímco u jiných i silný stimul nemusí být zaregistrován. Percepce může být negativně ovlivněna celkovými anestetiky, opioidy a léky ze skupiny alfa-2 agonistů.
4. 3. Maladaptivní bolest
Maladaptivní bolest může být buď akutní, nebo chronická. Jednou z klíčových podmínek maladaptivní bolesti je stoupající senzitivita nebo nadměrná odpověď. To značí, že percepce bolesti není pevně naprogramovaná, ale že jde o proces plastický a dynamický. To je způsobeno změnami odpovědi nervového systému (neuroplasticitou) na periferní i centrální úrovni.
Hyperalgezie je definována jako vzrůstající odpověď na normální bolestivý stimul. Může být vyvolána např. uplatněním zánětlivých mediátorů na úrovni periferních tkání, v takovém případě používáme termín primární hyperalgezie nebo též periferní senzitizace. Pojem centrální senzitizace pak vyjadřuje zvýšenou excitabilitu spinálních neuronů. Ta může být způsobena několika mechanismy, na kterých se podílí řada molekul, jakými jsou substance P, CGRP, VIP, cholecystokinin, angiotenzin, alanin, glutamát a aspartát. Skrze změny v membránové excitaci na úrovní buňky pak tyto mediátory vedou ke zvýšené produkci oxidu dusnatého. Ten poté difunduje z buňky a stimuluje formování cyklického guanosinmonofosfátu (cGMP) v sousedících neuronech. NO se tak účastní v procesu rozvoje hyperexcitability rezultujícího v projevy hyperalgezie a alodynie.
Maladaptivní bolest u FMS
Charakteristickým projevem FMS je hyperalgezie (vzrůstající odpověď na nízkoprahové škodlivé podněty) a alodynie (bolestivá odpověď na normální, neškodlivý podnět). Hyperalgezie a alodynie jsou považovány za výsledek centrální senzitizace. Existuje několik druhů důkazů, které ukazují, že vnímání bolesti u pacientů s FMS je částečně výsledkem zpracování bolesti na centrální úrovni.
4. 4. Důkazy zaměřené na somatosenzorickou stimulaci
Sekundární hyperalgezie, tj. bolest vyvolaná v nepoškozené tkáni v okolí primárního místa bolesti, byla nacházena častěji u pacientů s FMS než u zdravých kontrol. Pokud byl na kůži aplikován elektrický podnět, pacienti s FMS měli nižší práh bolesti a ta byla vnímána jak distálněji, tak i proximálněji od místa podnětu a přetrvávala až do 20 minut poté, co byla stimulace ukončena. Nemocní s FMS mají redukovánu centrální inhibiční odpověď. Tato „down-regulation“ odpověď pro práh bolesti může být demonstrována u normálních nemocných, pokud je vystavíme opakované kožní stimulaci. Pokud byly srovnávány ženy s FMS a zdravé ženy stejného věku po aplikaci totožných tepelných stimulů, zdravé ženy bez FMS jevily posun ve smyslu zvýšení prahu bolesti, což nebylo u žen s FMS pozorováno. Podobný důkaz přinesl pokus s aplikací hypertonického solného roztoku do oblasti předního tibiálního svalu; u nemocných s FMS bylo zjištěno prolongované trvání a větší vnímaná oblast bolesti než u zdravých osob stejného věku.
4. 5. Důkazy zaměřené na složení mozkomíšního moku
Substance P
Substance P snižuje práh excitace na úrovni synapsí a „senzitizuje“ spinální neurony druhého řádu. Dvě studie prokázaly trojnásobné zvýšení substance P v mozkomíšním moku u pacientů s FMS ve srovnání se zdravými kontrolami.
Serotonin
Tento neurotransmiter zahrnutý v procesech spánku, percepce bolesti a poruch nálady je uvolňován některými inhibičními neurony a jeho snížené hladiny byly pozorovány u pacientů s FMS.
Nervový růstový faktor
Je naprosto nezbytný pro diferenciaci, podporu růstu a přežívání senzorických neuronů. Rovněž zvyšuje produkci substance P aferentními neurony, čímž stoupá citlivost na bolestivý podnět. Některé studie zaznamenaly až čtyřikrát vyšší hladinu nervového růstového faktoru u pacientů s FMS ve srovnání se zdravými kontrolami.
4. 6. Důkazy zaměřené na funkční zobrazovací metody
Existuje několik technik, kterými mohou být demonstrovány některé funkční změny na úrovni CNS. Je zajímavé, že stav chronické bolesti je asociován se snížením průtoku krve v oblasti hypothalamu, zatímco akutní bolest tento průtok zesiluje. Příčina této odlišnosti by mohla být v desinhibici mediálního thalamu ústící v aktivaci limbické sítě. Mountz et al. demonstrovali snížený průtok v oblasti nc. caudatus a thalamu u nemocných s FMS ve srovnání s kontrolní skupinou pomocí zobrazení jednofotonovou emisní počítačovou tomografií. Změny ve zpracování bolesti mohou být rovněž demonstrovány ve studiích využívajících fMRI, kdy bolestivý tlakový stimul vedl k vzestupu průtoku krve mozkem v oblastech asociovaných s aktivací na nociceptivní stimul a tato aktivace je signifikantně přemrštěná u pacientů s FMS.
Lze tedy souhrnem říci, že existují konzistentní důkazy ukazující na důležitost abnormálního zpracování bolesti v patofyziologii fibromyalgického syndromu.
4. 7. Spánek
Jedním z důležitých posunů v porozumění FMS je jeho asociace s poruchami spánku. Většina nemocných s FMS uvádí spánek s absencí odpočinku („non-restorative sleep“). Spánkové studie u nemocných s FMS ukázaly, že redukce kvality spánku souvisí s non-REM fází, respektive s jejím přerušením. U zdravých dobrovolníků vedla selektivní deprivace non-REM spánku ke vzniku stejných symptomů a manifestních hyperalgických spouštěcích bodů, jaké známe u pacientů s FMS. Růstový hormon produkovaný během delta spánku se spolupodílí na procesu tkáňového hojení. Růstový faktor rovněž stimuluje v játrech produkci insulin-like growth faktoru-1 (růstový faktor podobný inzulinu). Některé studie objevily u pacientů s FMS nízké hladiny obou těchto růstových faktorů. To by mohlo potencionálně poukazovat na příčinnou souvislost mezi přerušením 4. fáze spánku (delta) a hladinou těchto hormonů u nemocných s FMS.
4. 8. Osa hypotalamus-hypofýza-nadledviny (HHN)
Dysfunkce v této ose lze zahrnout mezi další příčiny asociované s patofyziologií FMS. Tato osa má klíčovou úlohu v procesu odpovědi na stres. Při normální funkci systému stimuluje CRH (corticotropin--releasing hormone) produkci adrenokortikotropního hormonu (ACTH) v oblasti přední hypofýzy, ten pak indukuje kůru nadledvin k produkci glukokortikoidů, důležitých hormonů v mechanismu odpovědi na stres. Jejich sekrece podléhá cirkadiánnímu rytmu, kdy největší vzestup hladiny je patrný po probuzení, maximální hladiny dosahuje po 30–45 minutách a poté pozvolna klesá v průběhu celého dne s vrcholem v pozdním odpoledni. Během večera hladina kortizonu opět klesá a dna dosahuje asi uprostřed noci. Stresem indukované uvolňování CRH z hypothalamu je zpětnovazebně ovlivňováno hladinou kortizonu a je rovněž závislé na rytmu spánek/bdění. Zvýšená hladina kortizolu pomáhá organismu vyrovnat se se stresem zásahem do celé řady funkcí organismu a metabolických pochodů. V určitých případech však mohou být vysoké hladiny kortizolu škodlivé, jak ukazují případy atrofie hipokampu u člověka a primátů vystavených těžkému a protrahovanému stresu.
U pacientů s FMS byla zjištěna snížená odpověď osy hypothalamus-hypofýza-nadledviny. Mezi nejdůležitější abnormality patří:
- Velmi nízké hladiny kortizolu ve vzorcích moči za 24 hodin.
- Ztráta cirkadiánního rytmu vylučování kortizolu s absencí večerního vzestupu jeho hladiny.
- Inzulinem indukovaná hypoglykémie asociovaná s nadprodukcí hypofyzálního ACTH.
- Nízké hladiny růstového hormonu (growth hormon – GR).
- Nedostatečná produkce glukokortikoidů nadledvinami po stimulaci ACTH.
Pacienti s FMS často udávají předcházející stresové a traumatické situace. Snížená odpověď HHN osy tak může přispívat k rozvoji FMS nebo k jeho zhoršení. Tato osa je rovněž propojena s autonomním nervovým systémem, který zahrnuje modulaci spánku, nálady, bolesti a kardiovaskulární aktivity včetně svalové mikrocirkulace. To by mohlo vysvětlovat mnoho klinických příznaků asociovaných s FMS.
Nemocní s FMS často udávají maximum obtíží, jako je ranní ztuhlost a bolest v ranních hodinách. Toto zhoršení je častěji udáváno s předchozí přítomností neosvěžujícího spánku. Přestože mechanismy a příčina těchto obtíží zatím nejsou přesně definovány ve vztahu k ose HHN, předpokládá se důležitá role dysfunkce této osy v patofyziologii příznaků FMS. Neurotransmiter serotonin hraje roli v regulaci cirkadiánního rytmu a ve stresem indukované stimulaci osy HHN. Platí i obráceně, že dysfunkce HHN osy může akcentovat metabolismus serotoninu vyúsťující v jeho nízké hladiny, které vidíme u nemocných s FMS.
Alternativně může mít dysfunkce HHN osy roli v patofyziologii řady poruch včetně anxiety, deprese, posttraumatické stresové poruchy, chronické únavy, poruch spánku a syndromu dráždivého tračníku.
5. HODNOCENÍ ONEMOCNĚNÍ
5. 1. Klíčové body
- Je k dispozici široká paleta nástrojů, které se již osvědčily během výzkumu onemocnění, některé metody však trpí řadou nedostatků, jako je např. validizace kognitivních funkcí.
- Vizuální analogová škála (VAS) bolesti může být použita ke stanovení intenzity bolesti v běžné praxi i přesto, že existují sofistikovanější metodiky.
- Ztuhlost a tlaková bolest mohou být změřeny pomocí jednoduchých nástrojů, jako jsou např. dolorimetry.
- Hospital Anxiety and Depression Scale (HADS) je jednoduchý a užitečný dotazník mapující poruchy nálady. Může odhalit pacienty s těžkými depresivními stavy vyžadujícími okamžitou intervenci psychiatra.
- Použitím kombinace těchto metod mohou být definovány podskupiny nemocných s FMS, vyžadující odlišné strategie léčby.
U mnoha muskuloskeletálních onemocnění byla řada vyšetřovacích postupů využívaných v klinické praxi zavedena iniciálně během klinického výzkumu. V klinické praxi jsou však často některé postupy hůře použitelné, či dokonce nevhodné. Je to způsobeno např. tím, že klinický výzkum je zaměřený na objasnění patofyziologie onemocnění a snahu objektivizovat efekt léčebné intervence, zatímco v klinické praxi nás často zajímá tíže onemocnění, přítomné komorbidity a definování jednotlivých podskupin nemocných s ohledem na odlišné léčebné strategie.
5. 1. Nástroje hodnocení
Existuje velké množství nástrojů, které byly použity u FMS v klinických studiích. Je to částečně způsobeno tím, že často neexistuje konsenzus v tom, co se má přesně stanovit. Většina nástrojů navíc byla vyvinuta pro jiné klinické jednotky, jako jsou ostatní onemocnění provázená chronickou bolestí, či pro hodnocení poruch spánku, depresí a úzkosti obecně. Jedinou výjimkou je tzv. Fibromyalgia Impact Questionnaire (FIQ), který byl vyvinut speciálně pro zhodnocení symptomů, funkce a kvality života u FMS.
Vzhledem k pestrosti klinických projevů a různé míře jejich výskytu u jednotlivých podskupin pacientů s FMS je často obtížné přesně definovat, které komponenty mají být stanoveny. Je proto trvalou snahou odborníků začleněných např. v FMS working group najít konsenzus v klíčových bodech nutných pro definování metodiky vyšetřovacích postupů.
5. 2. Bolest
Bolest je dominantním symptomem u FMS. Existuje mnoho nástrojů, jak ji měřit. Nejběžnější a nejjednodušší metodou je použití Vizuální analogové škály (Visual Analogue Scale – VAS). V klinických studiích jsou však vyžadovány metodiky exaktněji a detailněji vyjadřující změnu v intenzitě bolesti v závislosti na čase. McGill Pain Questionnaire a Brief Pain Inventory jsou validované dotazníky široce používané u chronických bolestivých stavů včetně FMS. Mezi dalšími metodami lze jmenovat tzv. „Pain Drawing“, kdy pacient zakresluje rozsah bolestivého postižení do figuríny na obrázku.
5. 3. Citlivost na dotyk
V praxi se používají ke stanovení této modality dvě metody: počet citlivých bodů a dolorimetrie. Ačkoliv je počet citlivých bodů zahrnut do klasifikačních kritérií ACR, jeho role při vyšetření u FMS zůstává zatím ne zcela jasná. Někteří autoři se domnívají, že počet citlivých bodů je pouze hrubým měřítkem alodynie vzhledem k tomu, že je zde zřejmé ovlivnění psychologickým distresem a že vykazuje vyšší hodnoty u ženského pohlaví. Jiní autoři naopak prokázali korelaci počtu bolestivých bodů s intenzitou bolesti měřenou pomocí VAS, nenašli však žádnou souvislost s anxietou, depresí či mírou somatizace. V mnoha studiích je počet bolestivých bodů zahrnut do arzenálu vyšetřovacích nástrojů pro hodnocení aktivity FMS, detailnější stanovení stupně palpační bolestivosti je pak obsaženo v tzv. „Manual Tender Point Survey“. Počet bolestivých bodů je v klinických studiích považován za přiměřené a senzitivní hodnocení.
Tlaková algometrie pomocí dolorimetru je semiobjektivní kvantitativní metodou ke stanovení prahu tlakové bolesti. Je využívána v klinických studiích i v rutinní klinické praxi. Ve srovnání se zdravými kontrolami vykazují nemocní s FMS nižší práh tlakové bolestivosti, která navíc není ohraničená na definované tlakové body, ale je vyjádřena generalizovanou alodynií na tlakový podnět. Ačkoliv exaktní metodologie není standardizovaná, některé práce ukázaly, že vyšetření 3 párů bolestivých bodů dává reprezentativní hodnotu pro stanovení průměrného prahu tlakové bolestivosti. Existuje již řada metod, jejichž bližší charakteristika přesahuje rozsah této práce, většinou však tyto metody nejsou běžně používané ať už v klinické či rutinní praxi.
5. 4. Únava
Únava je běžným příznakem FMS, ale i jiných onemocnění včetně onemocnění muskuloskeletálního aparátu. Řada nástrojů validizovaných k hodnocení únavy u jiných onemocnění je proto používána i u FMS. Tyto nástroje lze rozdělit do 2 základních skupin – unidimenzionální a multidimenzionální. Unidimenzionální nástroje hodnotí intenzitu bez snahy o další upřesnění, např. ve vztahu k příčinné souvislosti. Mezi tyto nejběžněji využívané nástroje patří VAS, Functional Assessment of Chronic Illness Therapy – Fatigue Scale a Fatigue Severity Scale. Mezi multidimenzionální nástroje pak patří Multidimenzional Assessment of Fatigue a Multidimenzional Fatigue Inventory. Oproti unidimenzionálním hodnocením se zabývají bližší specifikací únavy ve vztahu k fyzickému a mentálnímu dopadu a hodnotí i vliv únavy na motivaci a funkce pacienta.
Spánek
Neosvěžující spánek je běžným příznakem a má zřejmě důležitou roli v patofyziologii FMS. Objektivní a detailní zhodnocení kvantity spánku pomocí polysomnografie se příliš nehodí pro klinické studie ani pro rutinní praxi.
Běžně se využívá modifikovaná VAŠ. V klinických studiích se využívají i detailnější stanovení, jako je např. The Medical Outcome Sleep Scale, Pittsburgh Sleep Duality Index a Jenkins Sleep Questionnaire. Jako excelentní screeningový dotazník k odhalení pacientů s FMS se nedávno ukázal 17položkový dotazník Sleep Assessment Questionnaire.
5. 6. Multidimensionální funkce a se zdravotním stavem asociovaná kvalita života
Přestože není kurativní léčba u FMS tak, jako u řady jiných chronických onemocnění známa, může řada léčebných přístupů redukovat tíži onemocnění, mírnit symptomy, a snižovat tak celkový dopad na život pacienta. Toto zlepšení celkového stavu se odráží jak ve fyzických funkcích a emocionální rovině, tak i v participaci nemocného v zaměstnání a v prostředí rodiny. Je proto snaha zhodnotit celkový zdravotní stav a se zdravím asociovanou kvalitu života. V praxi jsou využívány jak generické dotazníky, tak i hodnocení specifická pro dané onemocnění. Mezi specifická hodnocení patří Fibromyalgia Impact Questionnaire (FIQ), z generických dotazníků lze uvést Medical Outcomes Short Form – 36 Health Survey.
Fyzické funkce
FMS je spojovaný se značnou mírou fyzické disability vedoucí k nutnosti značných medicínských a sociálních nákladů, přesto neexistují dosud valorizované nástroje k hodnocení fyzických funkcí. I když je hodnocení fyzických funkcí obsaženo v multidimenzionálních hodnoceních, jako je FIQ a SF-36, není jasné, do jaké míry je v těchto dotaznících hodnocení fyzických funkcí validní u nemocných s FMS.
Poruchy nálady: deprese a anxieta
Tyto duševní změny jsou u FMS zcela běžné a hrají důležitou roli v patofyziologii tohoto onemocnění. K jejich hodnocení se využívá řada dotazníků, jako je MINI International Neuropsychiatric Interview, Hospital Anxiety and Depression Scale, The Beck Depression Inventory II, Hamilton Depression Rating Scale či State-Trait Anxiety Inventory.
Kognitivní funkce
Mnoho nemocných s FMS udává poruchy kognitivních funkcí. Mívají problémy s pamětí, hůře zpracovávají informace a ztrácejí koncentraci. To často ústí v obavy o ztrátu zaměstnání, a prohlubuje se tak celkové depresivní ladění těchto pacientů. Zatím však neexistují vhodné validizované nástroje, které by pro složitost této problematiky byly schopny hodnotit míru dopadu onemocnění na kognitivní funkce. Vychází se proto nejvíce z údajů udávaných samotným nemocným.
5. 10. Globální hodnocení onemocnění pacientem
Toto hodnocení je často využíváno v klinických studiích u řady onemocnění. U FMS se často využívá měření pomocí 11bodové škály (tzv. Patient Global Impression of Change).
Katastrofizace a strategie vyrovnání se s nemocí
Jako katastrofizace se označuje takové chování, kdy je bolest charakterizována jako strašlivá, šílená či nesnesitelná. Katastrofizace hraje zřejmě významnou roli v přechodu z akutní do chronické bolesti, ukazuje se být nezávislým faktorem tíže onemocnění. K hodnocení různých strategií pacientů používaných k vyrovnání se s chronickou bolestí, tzv. „coping strategies“, byl vyvinut speciální dotazník Coping Strategies Questionnaire (CSQ).
Objektivní nástroje
Současný výzkum se mimo jiné cíleně zabývá zdokonalováním současných metod a vývojem nových nástrojů, které by bylo možné využít pro diagnostiku a hodnocení FMS. Jako slibné metody se již ukázaly např. funkční magnetická rezonance nebo polysomnografie. V současné době však jejich širšímu použití brání technická i finanční dostupnost.
Vyšetřovací postupy v běžné klinické praxi
FMS není homogenním onemocněním. Nedávné výsledky výzkumu ukazují na možnost existence tří podskupin, které se mezi sebou liší profilem vyjádřených symptomů. Pro první skupinu je charakteristický mírný stupeň deprese, úzkosti a katastrofizace, slabá kontrola bolesti v kontrastu s nejvyšším prahem pro bolest a nízkou palpační citlivostí. Druhá skupina zahrnuje nemocné s vysokým stupněm úzkosti, deprese a katastrofizace, nízkým prahem bolesti a značnou palpační citlivostí, zatímco ve třetí skupině nacházíme nemocné s nízkou mírou anxiety, deprese a katastrofizace, dobrou kontrolou bolesti, ale s velmi nízkým prahem bolesti a největší palpační citlivostí. Předpokládá se rozdílná odpověď na různé léčebné strategie u těchto podskupin nemocných. Klíčovými nástroji v diferenciaci jednotlivých podskupin jsou měření tíže bolesti, palpační citlivosti, screeningové hodnocení deprese (např. pomocí HADS) a stanovení strategie vyrovnání se s nemocí hodnoceného např. dotazníkem CSQ.
6. LÉČBA
6. 1. Klíčové body
- Hlavním léčebným záměrem je podpořit pacienta k získání kontroly nad svým životem díky pozitivnímu přístupu a snaze o lepší zvládnutí vyrovnání se s nemocí. Již existují doporučení pro léčbu FMS vycházející z medicíny založené na důkazech, jakým je např. doporučení EULAR.
- K dosažení dobrých výsledků je obvykle nutné kombinovat edukaci, nefarmakologické a farmakologické postupy.
- Objevují se nové nadějné léčebné přístupy, které sice nejsou kurativní, ale mají důležitou adjuvantní roli pro pacienty, kterým pomáhají lépe se vyrovnat s nemocí.
Častým omylem lékařské veřejnosti je názor, že neexistuje efektivní léčba FMS. Je sice pravdou, že dosud neexistuje univerzální všelék či kurativní léčba, ale existují důkazy z randomizovaných kontrolovaných studií ukazujících profit některých nefarmakologických a farmakologických postupů. Je nesporné, že náklady spojené s tímto onemocněním jsou obrovské. Epidemiologické studie provedené v posledních letech ve Velké Británii ukazují stoupající počet diagnostikovaných pacientů. Ke snížení celkových nákladů vede pouze konstruktivní diagnostika a racionální léčba tohoto onemocnění.
6. 2. Doporučení EULAR pro léčbu FMS
Na základě medicíny založené na důkazech formulovala EULAR v roce 2006 doporučení pro léčbu FMS, která byla následně elektronicky publikována v r. 2007 (tab. 1). Snahou těchto doporučení je zhodnotit současné možnosti léčby a zapojit do problematiky léčby FMS širokou medicínskou veřejnost včetně praktických lékařů. Tato doporučení revidovalo více než 180 klinických studií zahrnujících přes 60 odlišných léčebných přístupů. Data pak byla extrahována podle definovaných kritérií, byly tak vyloučeny nedostatečně uspořádané studie. Expertní skupina, která pak formulovala doporučení, zahrnovala i zástupce pacientů.
1. EULAR doporučení pro léčbu fibromylagie 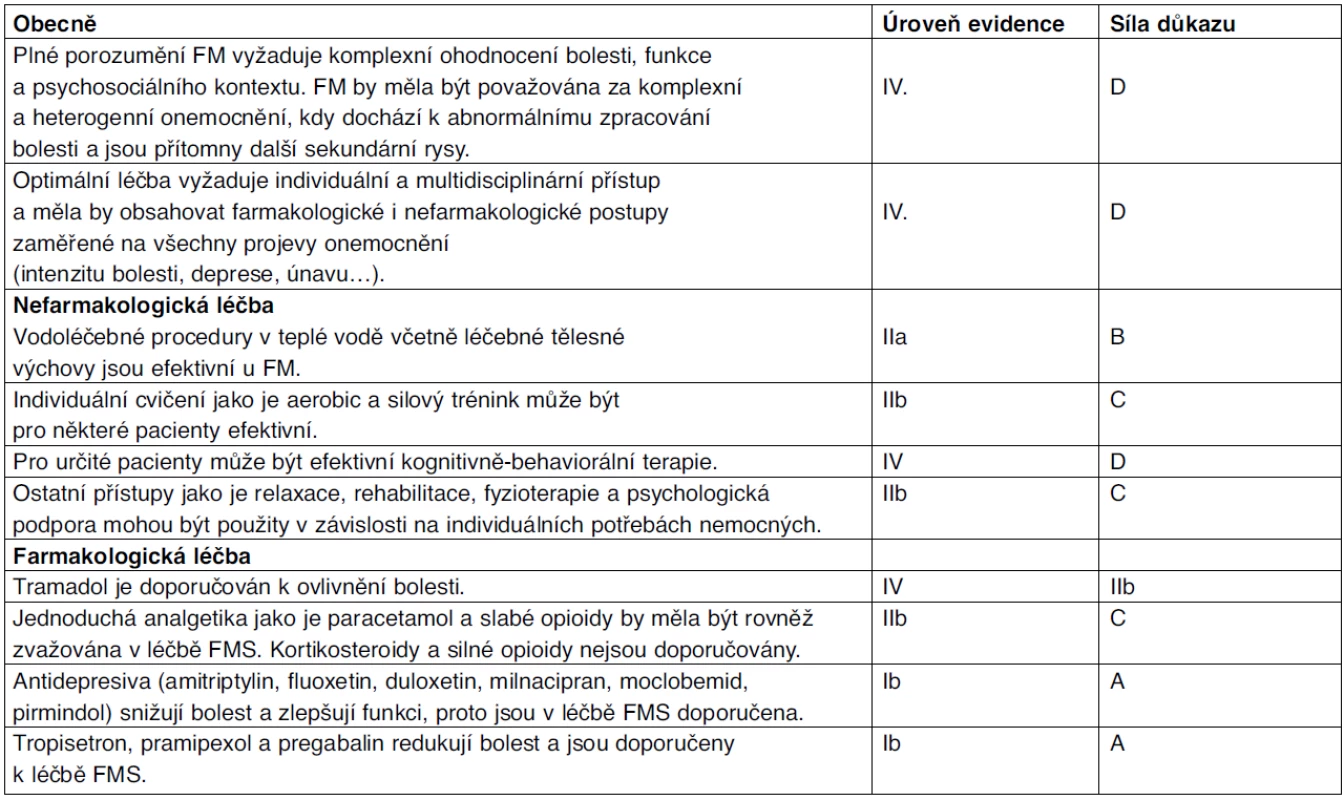
Léčba nemocných s FMS by měla být individuální, neboť jde o značně heterogenní onemocnění a zdá se, že jednotlivé podskupiny nemocných mohou odlišně odpovídat na různé léčebné strategie. Léčba by proto měla být šitá na míru s ohledem na hlavní symptomy u daného pacienta. U nemocných s preexistující nebo klinicky suspektní depresí by mělo být pomýšleno na možnost sebevražedných tendencí a v urgentních případech je tedy nezbytné zajistit psychiatrické vyšetření. I v případě, že sebevražedné myšlenky nejsou v popředí a nevyžadují akutní řešení, mohou nemocní z psychiatrického vyšetření profitovat, zvláště v případech, kdy si je sám nemocný vědom, že trpí depresemi či jinými poruchami psychického ladění.
Zvláště důležité je edukovat nemocného již na začátku onemocnění. Vědomí, že sice bohužel pravděpodobně nikdy nedojde k úplnému zmizení symptomů, ale že se rovněž nejedná o progresivní onemocnění, pomáhá nemocným lépe zvládat bolest a rovněž řada pacientů pak již nevznáší nereálná očekávání směrem ke zvolené léčebné strategii a cílům léčby.
6. 3. Nefarmakologická léčba
V randomizovaných kontrolovaných studiích již byla použita řada nefarmakologických postupů, které zahrnují mimo jiné např. cvičení, kognitivně-behaviorální terapii, homeopatii, fyzioterapii, akupunkturu, magnetoterapii, dietní režimy či laser.
Stupňované cvičení
U FMS se ukázalo zvláště užitečné aerobní cvičení šité na míru individuální fyzické úrovni daného pacienta. Na počátku sice může docházet ke zhoršení intenzity bolesti, avšak po určité době dochází ke zlepšení únavy, fyzických funkcí, kvality života i poruch spánku. Existuje mnoho odkazů podporujících význam graduovaného cvičení u FMS. Touto problematikou se zabývala řada systematických přehledů, které prokázaly prospěch tohoto postupu. Je třeba připomenout, že cvičení nevede ke zmenšení intenzity bolesti, naopak ji může na začátku zhoršovat. Výzkumy ukázaly, že nemocní s FMS jsou schopni cvičení ve stejné míře jako zdraví lidé, je však třeba individualizovat cvičení míře fyzických schopností nemocného tak, aby byla zajištěna jeho dlouhodobá adherence.
Pro některé pacienty se ukázalo zvláště prospěšné cvičení v teplém bazénu či hydroterapie. Vztlaková síla snižuje svalové napětí a teplá voda tak pomáhá relaxaci. Problémem zůstává dostupnost a cena speciálních bazénů určených k hydroterapii.
Kognitivně behaviorální terapie
Tato terapie je často doporučována nemocným v kombinaci s edukací. U některých jedinců může zlepšit bolest a funkci buď samostatně, nebo v kombinaci s cvičením. Zvláště prospěšná bývá krátce po stanovení diagnózy, kdy pomáhá nemocným lépe porozumět vlastnímu onemocnění a učí je, jak se aktivně zapojit do léčby. Pacienty učí samoregulaci díky rozvoji efektivních „copy strategií“, které jim umožňují získat kontrolu nad svým životem.
Koupele v horké vodě a cvičení (balneoterapie)
Balneoterapie ulehčuje od bolesti, zlepšuje funkci a psychické ladění. Přestože efekt bývá často krátkodobý, je vyvážen nízkým rizikem vedlejších účinků. Mnoho pacientů má prospěch z domácích večerních koupelí v horké vodě, které jim redukují bolest a rovněž jim pomáhají usnout.
Ostatní léčebné přístupy
Byla studována řada dietetických opatření, ale pouze s omezenou evidencí účinnosti. V literatuře jsou zmíněny doplňkové metody, jako např. homeopatika či akupunktura, pro slabou evidence efektivity jsou však tyto postupy sporné a nedovolují je zahrnout do všeobecně přijatých léčebných strategií.
6. 4. Farmakologická léčba
Donedávna neexistovala pro FMS specifická medikamentózní léčba. Přestože již dříve byla známa řada randomizovaných kontrolovaných studií ukazujících efekt různých farmak, teprve v roce 2007 schválila FDA ve Spojených státech amerických pregabalin jako první lék pro léčbu FMS. Následně pak obdržely povolení další preparáty: duloxetine a milnacipran. Farmakologická intervence se zdá být užitečná v kombinaci s nefarmakologickými postupy. Ačkoli ne všechna nesteroidní antirevmatika jsou u FMS účinná, jsou běžně předepisována ve snaze zmírnit bolest. Na základě klinických studií, které neprokázaly efektivnost této léčby, však nelze léčbu NSA v případě FMS doporučit. Dobře známou skutečností je intolerance řady farmak u nemocných s FMS, kde je četnost nežádoucích účinků analgetik, NSA a tricyklických antidepresiv vyšší, než u srovnatelných skupin nemocných s revmatoidní artritidou či bolestmi zad. Přesná příčina tohoto jevu není známa. Hypotézy zmiňují záměnu se symptomy samotné nemoci, nadměrnou interpretaci senzorických vjemů či centrální sensitizaci.
Analgetika
Tramadol, který patří mezi slabé opioidy, zlepšuje prokazatelně bolest a funkci u nemocných s FMS. Jde o centrálně působící analgetikum, které inhibuje zpětné vychytávání noradrenalinu a serotoninu, zatímco současně působí jako agonista μ-opiodních receptorů. Nejčastějšími uváděnými nežádoucími účinky jsou nauzea, somnolence, obstipace a závratě. Ostatní systémová analgetika užitá v krátkodobých studiích zahrnují lidocain, ketamin a morfin. O jejich efektivitě u chronických stavů, jako je FMS, však panují pochybnosti. Stejně tak nemají prokázaný účinek ani topická analgetika jako capsaicin.
Antidepresiva
Jedná se o skupinu léků běžně používaných k léčbě FMS. V klinických studiích byla již efektivně použita řada skupin, jako jsou tricyklická antidepresiva, selektivní inhibitory zpětného vychytávání serotoninu (SSRI), duální inhibitory, inhibitory MAO či antagonisté serotoninu.
Tricyklická antidepresiva
Jedná se o léky běžně užívané v léčbě FMS. Tyto léky inhibují re-uptake serotoninu a noradrenalinu, zasahují rovněž do glutaminergní transmise díky působení na acetylcholinové, histaminové a N-methyl-d aspartátové (NMDA) kanály. V randomizovaných kontrolovaných studiích se prokázal efekt amitriptylinu a cyclobenzaprinu na redukci bolesti, zlepšení spánku a snížení únavy. Tento efekt je nezávislý na ovlivnění psychického ladění i díky tomu, že jsou u FMS užívány mnohem nižší dávky než při léčbě depresivních stavů. Navíc je známo, že existuje pouze mírná korelace mezi zlepšením nálady a zmírněním bolesti u nemocných s FMS. Problémem těchto léků je špatná tolerance a vysazení léků pro vedlejší nežádoucí účinky je časté. Běžné nežádoucí účinky zahrnují somnolenci, anticholinergní projevy, jako je suchost v ústech, gastrointestinální projevy a neuropsychiatrické poruchy. Tolerance může být zvýšena použitím nízkých dávek v úvodu léčby (např. 10 mg amitriptylinu) s postupnou eskalací dávky. Léky by navíc měli nemocní užívat několik hodin před usnutím.
Selektivní inhibitory zpětného vychytávání serotoninu (SSRI)
Obecně mají tyto léky méně nežádoucích účinků a jsou lépe tolerovány oproti tricyklickým antidepresivům. Jsou proto často užívány v léčbě FMS. Fluoxetin, citalopram a paroxetin byly sice použity v randomizovaných placebem kontrolovaných studiích, ale výsledky jsou konfliktní. Fluoxetin zlepšoval ve dvou studiích symptomy FMS, jako je bolest, funkce, únava a deprese. Celkově lze konstatovat konsekventní zkušenosti s výsledky užití SSRI v léčbě FMS ve srovnání s ostatními chronickými bolestivými stavy. Novější vysoce selektivní SSRI, jako je citalopram, se zdají být méně účinné než starší preparáty, které si zachovávají určitou noradrenergní aktivitu při užívání vyšších dávek.
Inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI)
Léčba preparáty inhibujícími zpětné vychytávání serotoninu a noradrenalinu (některá SSRI a tricyklická antidepresiva) se ukázala být efektivnější než léčba vysoce selektivními SSRI. To vedlo některé autory k hypotéze, že by duální inhibitory mohly být v léčbě FMS prospěšné. Vzhledem k absenci anticholinergního efektu lze předpokládat lepší toleranci než u tricyklických antidepresiv. Klinické studie prokázaly efekt venlafaxinu jakožto modulátoru u neuropatické bolesti, migrény a tenzních bolestí hlavy. Otevřená studie s venlaxaxinem u nemocných s FMS ukázala zlepšení v parametrech bolesti, funkce, prahu bolesti, únavy a kvality života. Novější velké randomizované studie s duálními inhibitory milnacipranem a duloxetinem prokázaly u FMS dobrý efekt těchto léků. Do placebem kontrolované studie s milnacipranem bylo randomizováno 125 pacientů splňujících kritéria ACR pro FMS. Tito nemocní pak dostávali milnacipran v dávce 200 mg denně nebo placebo. Během 4 týdnů byla postupně zvyšována dávka až k cílové hodnotě. Primárním cílem studie byla změna v globálním skóre bolesti ve 12. týdnu. Na konci studie byla intenzita bolesti snížena o 40 % ve srovnání s 25% snížením po placebu. 50% redukce intenzity bolesti byla zjištěna u 37 % pacientů léčených milnacipranem oproti 14 % zlepšení po placebu. Více než 70 % nemocných udávalo celkové zlepšení symptomů po milnacipranu oproti 38 % v placebové větvi. Příznivě byla ovlivněna úzkost, deprese, únava, fyzická funkce i kvalita života. Zlepšení intenzity bolesti nebylo závislé na změnách nálady navozených léčbou. Nejčastěji uváděným nežádoucím účinkem v této studii byla nauzea, méně časté byly bolesti břicha, bolesti hlavy, závratě a palpitace.
Dalším preparátem ze skupiny SNRI je duloxetin, který je licencován k léčbě deprese a neuropatické bolesti. U FMS byl použit v randomizované placebem kontrolované studii s 207 pacienty. Dávka duloxetinu byla 60 mg denně a studie trvala 12 týdnů. Na konci hodnocení dosahovali pacienti léčení duloxetinem oproti placebu statisticky signifikantně výraznější zlepšení v redukci bolesti hodnocené pomocí Brief Pain Inventory. Oproti placebu došlo navíc i ke zlepšení v dalších parametrech, jako je počet bolestivých bodů, ztuhlost, fyzická funkce, deprese a se zdravím asociovaná kvalita života. Tak jako ve výše zmíněné studii s milnacipranem nebyla zjištěna závislost mezi tíží deprese na začátku ve vztahu k ovlivnění symptomů a úrovně bolesti. Vedlejší efekty léčby duloxetinem zahrnují nauseu, bolesti hlavy, poruchy spánku, zácpu a somnolenci.
Antiepileptika
Antiepileptické léky jako je gabapentin a pregabalin modulují percepci bolesti díky vzestupu hladiny inhibitorů neurotransmise a blokují rovněž kalciové a/nebo sodíkové buněčné kanály. Jejich efekt byl prokázán u chronických onemocnění, jako je postherpetická neuralgie a bolestivá diabetická neuropatie.
Pregabalin, analog gamma-amino máselné kyseliny (GABA) a μ-2-delta agonista, byl prvním lékem schváleným pro léčbu FMS v USA. V placebem kontrolované studii s 529 pacienty dostávali probandi buď pregabalin v dávkách 150, 300 a 450 mg/den, nebo placebo. Dávka pregabalinu byla zvyšována na cílové hodnoty během 2 týdnů. Pacienti léčení dávkou 450 mg/denně vykazovali statisticky signifikantně větší redukci intenzity bolesti než nemocní na placebu. Rovněž bylo patrné zlepšení v kvalitě spánku, únavě a globálním hodnocení změn. Nejčastějšími vedlejšími nežádoucími účinky byly závratě, somnolence, hmotnostní úbytek a suchost v ústech. V USA je pregabalin schválen pro léčbu FMS v dávce 300 nebo 450 mg/den.
Léky ovlivňující spánek
Vzhledem k tomu, že špatná kvalita spánku je častým symptomem onemocnění, bývají nemocným s FMS hojně předepisována sedativa a hypnotika. Tyto léky účinkují na benzodiazepinové receptory a pozitivně tak ovlivňují spánek a míru únavy u pacientů s FMS. Vzhledem k tomu, že nezlepšují bolest, měly by být tyto léky používány spíše do kombinací.
Nedávno byl v jedné kontrolované studii prokázán efekt oxybátu sodného u nemocných s FMS. Oxybát sodný je prekurzorem GABA, ovlivňuje spánek charakterizovaný pomalými vlnami a zvyšuje hladinu růstového hormonu. Je schválen v léčbě narkolepsie, ale jeho efekt u FMS se zdá být rovněž slibný, jak ukázala fáze II randomizované kontrolované studie.
Pramipexol je dopaminový antagonista indikovaný pro léčbu Parkinsonovy choroby. Účinkuje na mezolimbický systém, který je zapojen do kontroly spánku. Výsledky z RCT ukázaly, že jeho užití zlepšuje bolest, únavu, funkci a celkový stav. Léčba byla dobře tolerována. K potvrzení efektu této léčby u FMS však bude nutné provést další studie.
Ostatní
Tizanidin je centrálně působící alfa-2 adrenergní agonista, který dokáže redukovat hladinu substance P. V otevřené studii u FMS zlepšoval spánek a redukoval bolest. Tropisetron a ondasetron jsou antagonisté serotoninových receptorů [3]. Jejich užití v krátkých studiích (5–10 dnů) mělo pozitivní vliv na celkovou bolest i počet bolestivých bodů. Příznivý efekt bude nutné potvrdit v dalších studiích. Pozitivní důkazy existují i u dalších léků jako je paroxetin či gabapentin.
Adresa pro korespondenci:
MUDr. Pavel Jeremiáš
Oddělení klinické farmakologie
FN Plzeň
E. Beneše 13
305 99 Plzeň
e-mail: Jeremias@fnplzen.cz
Sources
1. Bennet, R. The Fibromylagia Impact Questionnaire (FIQ): areview of its development, current version, operating characteristics and uses. Clinical and Experimental Rheumatology, 2003, 23(5 suppl 39): S154-62.
2. Bennet, R. M. Coufounding features of fibromylagia syndrome: a current perspective of differential diagnosis. Journal of Rheumatology, 1989, Supplement, 19, p. 58–61.
3. Bennet, R. M. Disordered growht hormone secretion in fibromyalgia: a review of recent findings and hypothesized etiologie. Zeitschrift fur Rheumatologie, 1998, 57, p. 72–76.
4. Bjelland, I., Dahl, A. A., Haug, T. T., Neckelmann, D. The validity of the Hospital Anxiety and Depression Scale. An updated literature review. Journal of Psychosomatic Research, 2002, 52, 2, p. 69–77.
5. Busch, A., Barber, K. A., Overend, T. J., Peloto, P. M., Bombardier, C., Schachter, C. L. Exercise for treating fibromyalgia syndrome. Cochrane Database of Systematic Reviews, 2007, 17, 4, CD003786.
6. Carville, S. F., Arndt-Nielsen, L., Bliddal, H. et al. EULAR evidence based recommentdations for the management of fibromyalgia syndrome. Annals of Rheumatic Disease, 2008, 67, p. 536–541.
7. Clauw, D. J. The pathogenesis of chronic pain and fatigue syndrome, with special reference to fibromylagia. Medical Hypothese, 1995, 44, p. 369–378.
8. Clauw, D. J. Fibromylagia: update on mechanisms and management. Journal of Clinical Rheumatology, 2007, 13, 2, p. 102–109.
9. Clauw, D. J., Crofford, L. J. Chronic widespread pain and fibromyalgia: what we know, and what we need to know. Best Practice and Research Clinical Rheumatology, 2003, 17, 4, p. 685–701.
10. Crofford, L. J. The hypothalamic pituitary adrenal stress axis in fibromyalgia and chronic fatigue syndrome. Zeitschrift fur Rheumatologie, 1998, 57, p. 67–71.
11. Crofford, L. J., Appleton, B. E. The treatment of fibromyalgia: a review of clinical trials. Current Rheumatology Reports, 2000, 2, p. 101–103.
12. Desmeules, J. A., Cedraschi, C., Rapiti, E. et al. Neurophysiologic evidence for a central sensitization in patients with fibromyalgia. Arthritis & Rheumatism, 2003, p. 1420–1429.
13. Gallagher, A. M., Thomas, J. M., Hamilon, W. T., White, P. D. Incidence of fatigue symptoms and diagnose presenting in UK primary care from1990 to 2001. Journal of the Royal Society of Medicine, 2004, 97, p. 571–575.
14. Gendreau, M., Hufford, M. R., Stone, A. A. Evoked pain measures in fibromyalgia. Best Practice & Research Clinical Rheumatology, 2003, 17, p. 593–609.
15. Giesecke, R. H., Petzke, F., Wolf, J. M., Clauw, D. J. The relationship between depression, clinical pain, and experimental pain in a chronic pain cohost. Arthritis & Rheumatism, 2005, 52, p. 1577–1584.
16. Giesecke, T., Williams, D. A., Hartus, R. E. et al. Subgrouping of fibromyalgia patiens on the basis of pressure - -pain tresholds and psychological factors. Arthritis & Rheumatism, 2003, 48, p. 2916–2922.
17. Goldenberg, D. L. Fibromyalgia syndrome. An emerging but controversial condition. Journal of American Medical Association, 1987, 257, p. 2782–2787.
18. Goldenberg, D. L., Burckhartdt, C., Crofford, L. Management of fibromyalgia syndrome. Journal of the American Medical Association, 2004, 292, p. 2388–2395.
19. Gracely, R. H., Geiiser, M. E., Giesecke, R. L. et al. Abnormal sensitization and temporal summation of second pain (wind-up) in patients with fibromyalgia syndrome. Pain, 2004, 91, p. 165–175.
20. Gracely, R. H., Grant, M. A., Giesecke, T. Evoked pain measures in fibromyalgia. Best Practice & Research Clinical Rheumatology, 2003, 17, p. 593-609.
21. Gracely, R. H., Petzke, F., Wolf, J. M., Clauw, D. J. Functional magnetic resonance imaging evidence of augmented pain processing in fibromyalgia. Arthritis & Rheumatism, 2002, 46, p. 333–343.
22. Gran, T. J. The epidemiology of chronic generalized musculoskeletal pain. Best Practice & Research Clinical Rheumatology, 2003, 1, p. 547–561.
23. Hughes, G., Martinez, C., Myon, E. et al. The impact of a diagnosis of fibromyalgia on health care ressource use by primary care patiens in the UK: an observational study based on clinical praktice. Arthritis & Rheumatism, 2006, 54, p. 177–183.
24. Choy, E. Fibromyalgia syndrome. 1th Ed. Oxford: Oxford University Press, 2009, 96 p.
25. Katz, R. S., Wolfe, F., Michaud, K. Fibromyalgia diagnosis a comparison of clinical, survey, and Američan College of Rheumatology kriteria. Arthritis &Rheumatism, 2006, 54, p. 169–176.
26. Mease, P. Fibromyalgia syndrome: review of clinical presentation, pathogenesis, outcome measures, and treatment. Journal of Rheumatology, 2005, Supplement, 75, p. 6–21.
27. Mease, P., Arnold, L. M., Bennet, R. et al. Fibromyalgia syndrome. Journal of Rheumatology, 2007, 34, p. 1415–1425.
28. Rao, S. G., Flauš, D. J. The management of fibromyalgia. Drugs Today (BARC), 2004, 40, p. 539–554.
29. Sinclair, D., Starz, T., Turk, D. The manual tender point survey. National Fibromyalgia Association, Dostupné na: www.fmaware.org/site/News2?page=NewsArticleamp;id=6263 (october3rd, 2005).
30. Turk, D. C., Vierck, C. J., Scarbrough, E., Crofford, L. J., Rudin, N. J. Fibromylagia: combining pharmacological and nonpharmacological approaches to treating the person, not just the pain. Jornal of Pain, 2008, 9, p. 99–104.
31. Wolfe, F., Smythe, H. A., Yunus, M. B. et al. The American College of Rheumatology 1990 criteria for the classification of fibromyalgia. Arthritis and Rheumatism, 1990, 33, p. 160–172.
Labels
Medical assessment Occupational medicine
Article was published inMedical Revision

2012 Issue 3-4-
All articles in this issue
- Pervasive developmental defects in children and adolescents, degree of dependence and disability from the Medical Advisory Service standpoint
- Economic aspects of mental health care in advanced countries
- Fibromyalgic syndrome
- Some knowledge from the control and revision activity of Center care centralizing the therapy of patients with the multiple sclerosis diagnosis
- Do independent advisory physicians participate in citizen segregation?
- Medical Revision
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Fibromyalgic syndrome
- Pervasive developmental defects in children and adolescents, degree of dependence and disability from the Medical Advisory Service standpoint
- Economic aspects of mental health care in advanced countries
- Do independent advisory physicians participate in citizen segregation?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

