-
Medical journals
- Career
Bolest na hrudi z pohledu pneumologa
Authors: Jiří Votruba
Authors‘ workplace: 1. klinika tuberkulózy a respiračních nemocí VFN a 1. LF UK v Praze
Published in: Čas. Lék. čes. 2022; 161: 224-231
Category: Review Article
Overview
Bolest na hrudi je jedním z nejčastějších příznaků, se kterými se setkávají lékaři pracující na akutních, interních i plicních ambulancích. Nejčastějšími situacemi, které mohou způsobovat bolesti na hrudi s důrazem na jejich diagnostiku a časnou léčbu, jsou hrudní infekce, pneumotorax, pneumomediastinum a nádory postihující pohrudniční dutinu.
Klíčová slova:
bolest na hrudi – nádory pleury – pneumotorax – pneumomediastinum – pleuritida
ÚVOD
Ve Spojených státech amerických bylo v roce 2006 10 % všech návštěv na emergency zapříčiněno chorobami respiračního systému a bolest na hrudi při tom byla nejčastějším symptomem (1). V prvních fázích vyšetřovacího procesu vždy vylučujeme život ohrožující příčiny bolesti – akutní koronární syndrom, aortální disekce, plicní embolizace, pneumotorax, pneumomediastinum, perikarditidu či perforace jícnu. Hodnotíme vždy základní parametry funkce dýchacích cest, samotného dýchání a cirkulace. V případě, že rychlá klinická diagnostika, laboratorní a EKG vyšetření, respektive zobrazovací metody včetně sonografie provedené přímo na místě nepřinesou jednoznačnou diagnózu, lze indikovat bronchoskopické vyšetření, které napomáhá diagnóze, ale v některých případech má i terapeutickou roli. Ve výbavě plicní endoskopie je z hlediska diagnostiky bolesti na hrudi významné také vyšetření klinickou pleuroskopií, kterou indikujeme v posledních letech stále častěji a budeme se jí věnovat dále.
ODBĚR ANAMNÉZY
V posledních letech došlo k výraznému zlepšení možností zobrazeni hrudníku, ale i tak zůstává důkladný sběr anamnestických dat a precizní tělesné vyšetření nejdůležitější součástí diagnostiky pacienta s bolestmi na hrudi. Bolest na hrudi, která je způsobena respiračním onemocněním, nejčastěji pochází z parietální pleury, hrudní stěny a struktur mediastina. Plicní parenchym a viscerální pleura nemají inervaci pro bolestivé podněty. Bolest, která vzniká iritací parietální pleury, se typicky zhoršuje hlubokým dýcháním, kašlem nebo kýcháním, případně pohybem těla, při kterém dochází i k pohybům hrudní stěny.
Intenzita bolesti nám v diagnostice příliš nepomůže, neboť vnímání pleurální bolesti je velmi individuální, od asymptomatických průběhů až po agonizující bolest. Řádný záznam a pokus o objektivizaci stupně bolesti je však přesto důležitý zejména při longitudinálním sledování stavu pacienta. Popis bolesti se u pacientů také velmi významně liší, od ostré přes tupou až po pálivou či bodavou.
Přínosnější bývá popis vývoje bolesti v čase, kdy náhlý začátek bolesti většinou doprovází spontánní pneumotorax nebo frakturu žebra, kdežto bolest, která má původ v maligním postižení pleury, vzniká často pomalu a postupně. Časově někde mezi náhlým a postupným vznikem řadíme genezi interkostální neuritidy, která je ale poměrně vzácná (2). Přímá infiltrace hrudní stěny malignitou způsobuje často chronickou tupou bolest, která je lokalizována v odpovídající anatomické oblasti. Vzácněji se může podobně projevovat i trauma hrudní stěny, žeber a obratlů.
Je tedy nezbytné se ptát na vznik bolesti, její lokalizaci, trvání, vyzařování, kvalitu, vyvolávající momenty a úlevové faktory. Pouze na základě detailní anamnézy a fyzikálního vyšetření můžeme pokračovat v diagnostice a rozhodování o dalším postupu.
Kvantifikace bolesti je obtížná i vzhledem k tomu, že někteří jedinci mohou mít snížený práh pro bolestivé podněty (hyperalgezie). Nejčastěji používaná vizuální analogová škála (VAS) nás dokáže informovat pouze o intenzitě bolesti, ale další podstatné charakteristiky bolestivého vnímání zůstanou nedokumentovány. Proto se snažíme častěji využívat dotazník McGill Pain Questionnaire, jehož vyhodnocení dokáže poskytnout mnohem lepší orientaci v kvalitativních i kvantitativních aspektech bolesti.
ZÁKLADNÍ PLEUROPULMONÁLNÍ PATOLOGIE, KTERÉ MOHOU PŮSOBIT BOLEST NA HRUDI
Tradičně se předpokládá, že plicní parenchym a viscerální pleura jsou necitlivé na běžná bolestivá podráždění. Imunohistochemické studie na zvířecím modelu vagové denervace a talkové pleurodézy však prokázaly přítomnost nervových zakončení na viscerální pleuře, která mohou být schopna přenášet bolestivé vzruchy. Také podráždění sliznice trachey a obou hlavních bronchů může způsobit bolestivý vjem. Plíce i bronchiální strom jsou inervovány mechanoreceptory i chemoreceptory, zvanými receptory J, které odpovídají na několik signálů způsobujících bolest – například působením bradykininů, prostaglandinů, serotoninu a kapsaicinu. Inhalace některých dráždidel, např. amoniaku, může spustit kašlací reflex a způsobit pocity tíhy na hrudi a bolesti.
Plicními příčinami bolesti na hrudi mohou být patologie pleury, plicních cév či plicního parenchymu. Není tedy překvapující, že bolest na hrudi může být způsobena parenchymovou infekcí, nádorem nebo chronickými nemocemi jako například tuberkulózou či sarkoidózou. Nejčastější příčiny bolestí na hrudi z pohledu pneumologa uvádí tab 1.
Table 1. Nejdůležitější etiologické momenty vedoucí k bolesti na hrudi způsobené plicní patologií 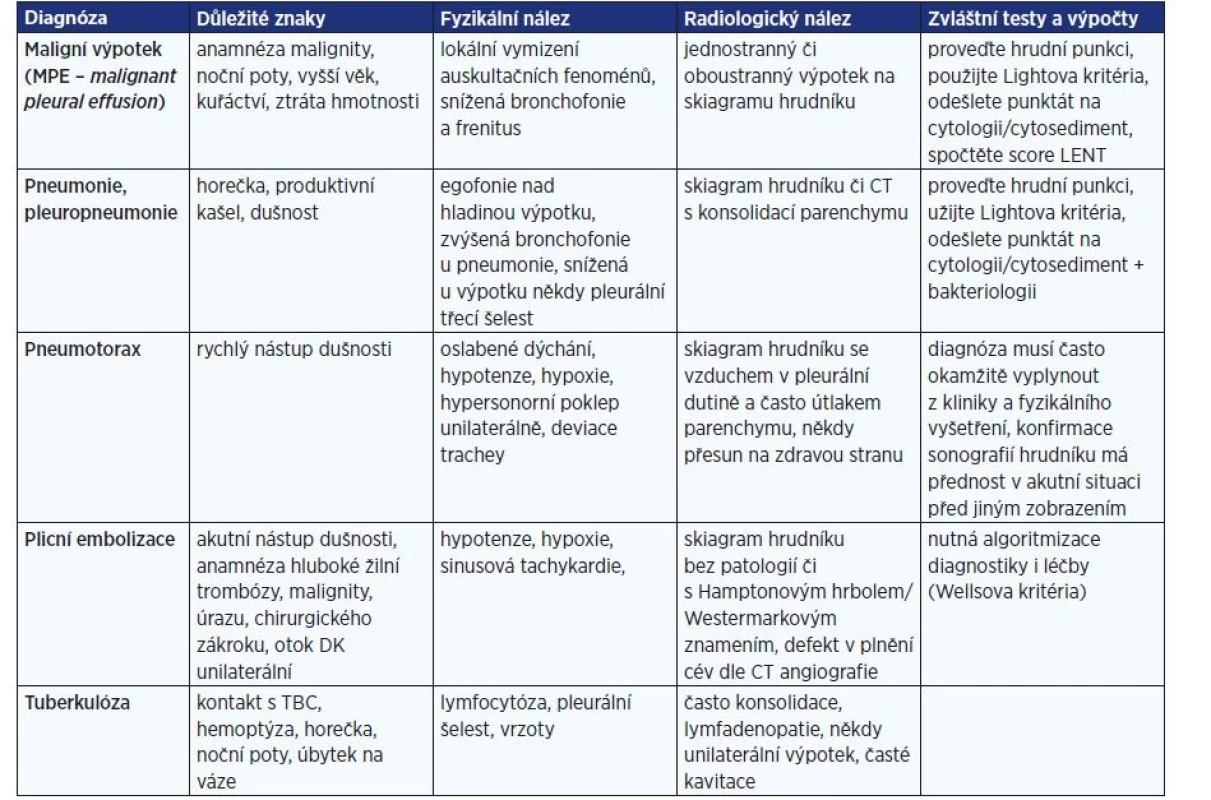
BOLESTI PLEURÁLNÍHO PŮVODU NA PODKLADĚ ZÁNĚTU
Zánětlivé procesy periferní části plic, které postihují také přilehlou viscerální pleuru, způsobují často zánětlivé změny přilehlé parietální pleury. Parietální pleura, jež vystýlá hrudní koš a pokrývá vnější části obou bráničních kopulí, je inervována interkostálními nervy. Jejich podráždění se pak promítá do odpovídajících oblasti hrudní stěny. Parietální pleura, která pokrývá centrální oblasti bránic, je inervována vlákny bráničního nervu (n. phrenicus). Pokud je podrážděna tato část pohrudnice, bolest se promítá do ipsilaterálního ramene či stejné strany krku. Je to pravděpodobně proto, že viscerální aferentní inervace přinášená n. phrenicus konverguje se somatickou inervaci přinášenou supraklavikulárním nervstvem c3–c5 (tzv. viscerosomatická konvergence)
PNEUMONIE A PLEUROPNEUMONIE VČETNĚ KOMPLIKACÍ
Navzdory pokrokům v diagnostice a léčbě zůstávají plicní infekce důležitou příčinou morbidity i mortality dospělých pacientů. Odhaduje se, že každý rok je v USA na pneumonií léčeno mezi 4 a 6 miliony osob, v Česku je hlášeno 80–150 tisíc pneumonií za rok (3).
Spektrum patogenů, které mohou způsobit respirační infekce, je široké a stále se rozšiřuje jak identifikací nových patogenů, tak zhoršováním imunitní odpovídavosti populace (v důsledku farmakoterapie, jiných chorob i špatné životosprávy). Úmrtnost na zápal plic je stále vysoká, v Evropě i dalších rozvinutých zemích se pohybuje kolem 20 na 100 000 obyvatel (4,5). Bývá nejčastější infekční příčinou úmrtí a v Česku její roční incidence přesahuje 100 tisíc případů s 3000 zemřelých.
V diagnostice hraje důležitou roli radiodiagnostika. Skiagram hrudníku je stále tím nejčastěji používaným vyšetřením u zápalu plic vzhledem ke své dobré dosažitelnosti a skvělému poměru nákladů a přínosů. Výpočetní tomografii (CT) hrudníku bychom měli indikovat u pacientů, kde pneumonie či pleuropneumonie neodeznívá tak, jak očekáváme, nebo když máme podezření na nějakou komplikaci. Snímek hrudníku nás orientuje v charakteristikách a vývoji nálezu a také případných komplikacích. Klasické dělení pneumonií na typické a atypické a na lobární a bronchiální bylo zavrženo a nahrazeno klinickou klasifikaci. Pneumonie tedy rozdělujeme do 3 hlavních skupin:
- Komunitně získané pneumonie.
- Nozokomiální pneumonie (hospital-acquired pneumonia, s možnou podtřídou ventilator-acquired pneumonia).
- Pneumonie spojené se zdravotní péčí (healthcare-associated pneumonia), které byly definovány poměrně recentně a není úplně jisté, zda se jako nový typ pneumonie udrží.
Etiologie
U komunitní pneumonie postihující imunokompetentního pacienta je seznam etiologických mikrobiálních patogenů poměrně krátký a docela stabilní. Navzdory tomu, že se stále objevují nové patogeny (například metapneumovirus v roce 2001 či nověji koronavirus SARS-CoV-2, který způsobil pandemii od roku 2019), je většina případů způsobena Streptococcus pneumoniae následovaným Mycoplasma pneumoniae, Hemophilus influenzae, Chlamydia pneumoniae a respiračními viry.
Obvyklým obrazem komunitně získané pneumonie je lobární pneumonie – konsolidace ohraničená na jeden lalok, nebo dokonce segment. Toto pravidlo však není spolehlivé, radiologické prezentace komunitně získaných pneumonií mohou být dosti variabilní a často závisejí na původci.
Aspirační pneumonie obvykle postihují dolní laloky s obrazem multicentrických opacit. Rozlišení mezi bakteriální a virovou pneumonií podle rtg obrazu je však prakticky nemožné (6).
Navzdory tomu má smysl hodnotit charakteristiky rtg obrazu, neboť některé radiologické známky nás mohou navést ke specifickým původcům zápalu plic. Lobární konsolidace, která postihuje jeden či více laloků, je vzorcem, který vidíme u nejčastější komunitně získané pneumokokové pneumonie, a to zvláště u pacientů vyžadujících hospitalizaci. Normální nález na skiagramu hrudníku prakticky vylučuje diagnózu pneumonie u jiných než imunokompromitovaných pacientů s pneumonií způsobenou Pneumocystis carinii a vzácně u dehydratovaných starších či neutropenických pacientů.
Rtg charakteristika nálezů nám někdy může pomoci i v pátrání po mykoplazmové či virové pneumonii, i když k definitivnímu potvrzení diagnózy je vždy vyžadována kultivace nebo serologická charakteristika. U virových pneumonií, které jsou lokalizovány predominantně v alveolárním prostoru, vídáme často difuzní bilaterální zastření a retikulace spojené se ztluštěním interlobulárních sept. Mohou být také spojeny s Kerleovými liniemi B. Pleurální výpotek je u nich vzácnější. U pneumonie způsobené Pneumocystis carinii vídáme na skiagramu hrudníku nejčastěji symetrické jemné retikulární heterogenní opacity.
Diferenciální diagnostika je u zánětlivého postižení plicního parenchymu samozřejmě velmi široká. Může zahrnovat akutní bronchitidu, postiradiační pneumonitidu i srdeční selhání, a to jmenujeme jenom zlomek možných chorobných stavů. Fyzikální vyšetření je vždy základní součástí diagnostiky pneumonií, i když jeho senzitivita a specifita činí pouze 56 a 67 %.
V diagnostice dále využíváme cytologii a kultivaci sputa, přestože podle některých literárních zdrojů až 40 % pacientů není schopno poskytnout zpracovatelný vzorek (takovým vzorkem sputa míníme nález s > 25 polymorfonukleárními leukocyty a < 10 dlaždicovými epitelovými buňkami na 1 zobrazovací pole). V řadě případů také pacienti mají od svých praktických lékařů nebo i z domácích zásob zahájenou antibiotickou léčbu. To jsou důvody, proč ve studii s 33 tisíci hospitalizovaných pacientů s komunitně získanou pneumonií bylo zaznamenáno pouze 7,6 % případů, ve kterých byl identifikován patogen (7).
Pokud je pacient v kritickém stavu na jednotce intenzivní péče a je intubován, je s výhodou použít chráněný aspirát, kartáček nebo bronchoalveolární laváž. Takové materiály už mají mnohem vyšší výtěžnost. Podle okolností a diagnostické situace používáme také jiná barvení, například na tuberkulózu a mykózy. Hemokultury mají obvykle velmi nízkou výtěžnost, která se pohybuje mezi 7 a 16 % u hospitalizovaných pacientů; vyšší výtěžnost bývá u pacientů s pneumonií vyvolanou S. aureus. Vzhledem k tomu se obvykle hemokultury nedoporučují pro paušální diagnostiku hospitalizovaných pacientů s komunitní pneumonií, i když samozřejmě mají nezastupitelný význam u skupiny vysoce rizikových pacientů, například s asplenií, chronickou hepatopatií, komplementovým defektem a/nebo leukopenií. Nezastupitelnou hodnotu naopak mají močové antigenní testy k průkazu pneumokoků a Legionella pneumophila, jež mají senzitivitu a specificitu 80 a 90 %, resp. 90 a 99 % a jejich výhoda spočívá mimo jiné v detekci antigenů i po zahájení antibiotické léčby.
Testy amplifikace nukleových kyselin patogenů se v poslední době stávají rutinní součásti diagnostických metod. Jsou rychlé, velmi citlivé a specifické, ale mají zásadní problém, že metoda PCR nedokáže rozlišit kolonizující organismus od skutečného patogenu. Výsledky genetického vyšetření je tedy vždy nutno hodnotit kriticky. Sérologické testy mají v diagnostice akutní pneumonie velmi limitovanou hodnotu vzhledem k problému s přesností i časem, který je nutný k získání konvalescentního IgM.
Z podstatných biomarkerů využíváme standardně CRP a prokalcitonin, které jsou efektivní nejen k zhodnocení závažnosti zánětu, ale mohou také pomoci k rozhodnutí o zastavení antimikrobiální terapie. Metaanalýza hodnotící 14 randomizovaných kontrolovaných studii se 4467 účastníky zjistila, že stanovení prokalcitoninu redukovalo množství podaných antibiotik bez zvýšení mortality (8).
Pro hodnocení tíže onemocnění pacienta máme k dispozici několik predikčních nástrojů, z nich nejpoužívanější jsou Pneumonia Severity Index (PSI) a CURB-65 (9). skóre PSI používá 20 proměnných k roztřídění pacientů do 5 kategorií, zatímco CURB-65 sleduje pouze 5 ukazatelů tak, aby zařadilo pacienty do jedné ze 3 kategorií. Oba systémy nám mohou pomoci se stratifikací tíže pacientova postižení a určení prioritizace příjmu na akutní lůžko, ale vždy je třeba chápat, že se jedná o okamžité posouzení stavu, validní jen v řádu minut či několika málo hodin od jeho provedení.
Léčba
U komunitní pneumonie a pleuropneumonie jsou léky volby betalaktamy, makrolidy, fluorochinolony a tetracykliny. Organismy rezistentní na léky ze tří a více antimikrobiálních skupin s různými mechanismy účinků považujeme za multidrug-rezistentní.
Léčba by měla být určována lokální úrovní rezistence bakterií, převažující bakteriální populací v dané oblasti i ročním obdobím. Měla by být zahájena každopádně co možná nejdříve a u pacientů, kteří byli hospitalizováni, by měla být iniciální dávka podána již v příjmové ambulanci ještě před zahájením přijímacích procedur.
Parapneumonický výpotek se vyskytuje u 20–40 % hospitalizovaných nemocných s pneumonií. U každého nově diagnostikovaného parapneumonického výpotku se separací na sonografii přesahující 2 cm doporučujeme provést hrudní punkci. Sonografie je vzhledem k zobrazení výpotku ideálním nástrojem umožňujícím poměrně přesný odhad objemu výpotku a také punkci pod vizuální kontrolou.
Výpotky u pleuropneumonií klasifikujeme do následujících 3 skupin:
- Nekomplikovaný parapneumonický výpotek, který je exsudativní, kultivace z něj jsou negativní a koncentrace glukózy i LDH je podobná sérové hladině.
- Komplikovaný parapneumonický výpotek způsobený vstupem bakterií do pleurální dutiny a postižením pleury. U tohoto typu výpotku se zvyšuje koncentrace LDH na > 3násobek horní hranice normálních hladin v séru, hladina glukózy ve výpotku je < 2,2 mmol/l a pleurální tekutina má pH < 7,2. Bakteriologické kultivace i mikroskopie jsou negativní, což je vysvětlováno rychlým odbouráváním bakterií z pleurálního prostoru nebo nízkým počtem bakterii. Výpotku říkáme komplikovaný, neboť vyžaduje drenáž.
- Hrudní empyém, tedy hnis v pleurální dutině nebo známky bakteriální infekce pleurální tekutiny na základě cytologie či kultivace (10).
Rizikovými faktory vzniku empyému jsou vysoký věk a komorbidity jako diabetes mellitus alkoholismus, refluxní choroba a opakované hospitalizace pro zápaly plic.
Asi 70 % grampozitivních aerobních kultivací z emblémové tekutiny je zapříčiněno Str. pneumoniae nebo S. aureus. Z gramnegativních jsou nejčastější klebsiely, pseudomonády a hemofilus. Pokud nacházíme anaerobní organismy, jsou to nejčastěji Bacteroides a Peptostreptococcus sp. Pokud je empyém komplikací chirurgického výkonu, nacházíme v něm zpravidla S. aureus.
Z hlediska terapeutického přístupu klasifikujeme parapneumonické výpotky do 4 skupin vzhledem k rizikům zhoršeného terapeutického výstupu:
- Kategorie 1 (velmi nízké riziko): malý výpotek s volnou tekutinou bez srůstu se separaci na sonografii < 2 cm. Zde zpravidla není nutná punkce.
- Kategorie 2 (nízké riziko): malý a střední výpotek v rozsahu 2 cm až vyplněná polovina objemu hrudní dutiny, separace s volným pohybem tekutiny, bez srůstů s negativní kultivaci i cytologií a pH > 7,2.
- Kategorie 3 (střední riziko): přítomné alespoň 1 z následujících kritérií – tekutiny je více než polovina hemitoraxu, tekutina je lokulizovaná, pleura je ztluštělá na kontrastním CT skenu, je pozitivní cytologie nebo je pH < 7,2.
- Kategorie 4 (vysoké riziko): pleurální tekutina ve formě hnisu.
U pacientů spadajících do kategorií 3 a 4 je prakticky vždy indikovaná drenáž a mohou být nutná i další terapeutická opatření – např. fibrinolytická léčba (ideálně využíváme protokolu ze studie MIST2, obr. 1), klinická pleuroskopie, videoasistovaná torakoskopie nebo otevřený chirurgicky výkon.
Image 1. Stav pleurální dutiny vpravo po podání alteplázy v protokolu MIST 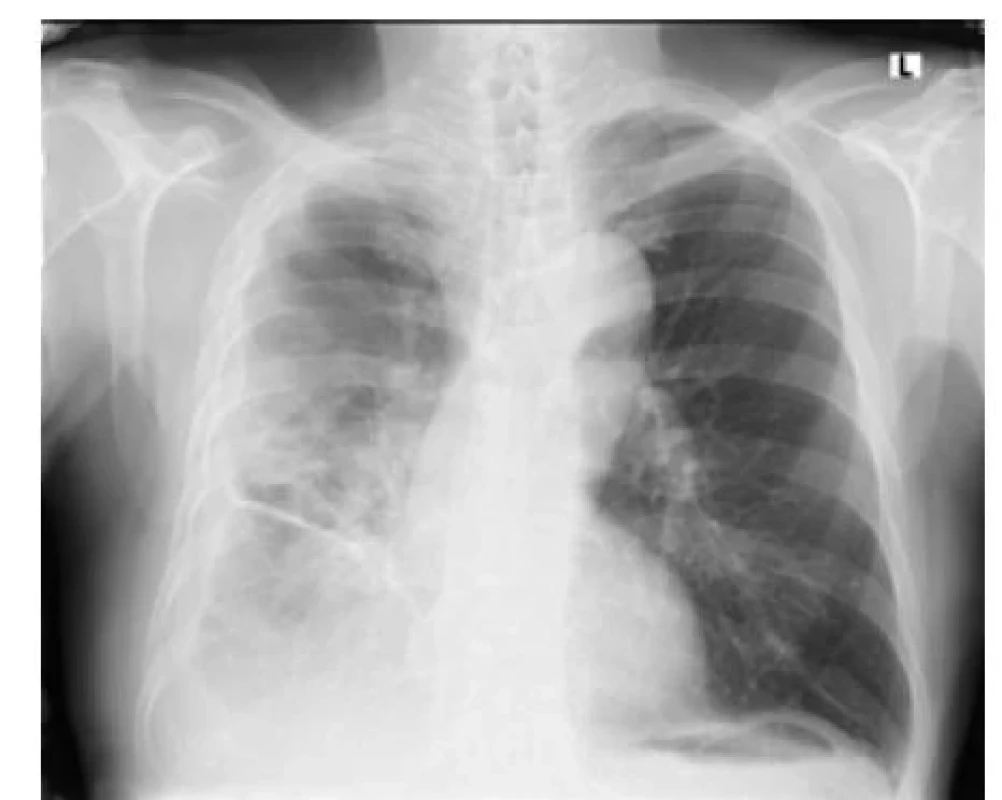
Vzhledem k důležitosti hrudní drenáže v plicní i interní medicíně považujeme za nutné doplnit zde alespoň krátkou informaci. Drenáž obvykle používáme v případě, že se v pleurální dutině akumuluje vzduch, výpotek či krev (vzácně lymfa nebo moč) (obr. 2 a 3). U spontánního pneumotoraxu u neventilovaného pacienta i u nekomplikovaného pleurálního výpotku doporučujeme použití tenkých hrudních drénů (< 14F). Jiná je ovšem situace hemotoraxu a u maligních pleurální výpotků. Hrudní drén by měl být vždy zaváděn po sonografické nebo CT kontrole.
Image 2. Rozsáhlý parapneumonický výpotek 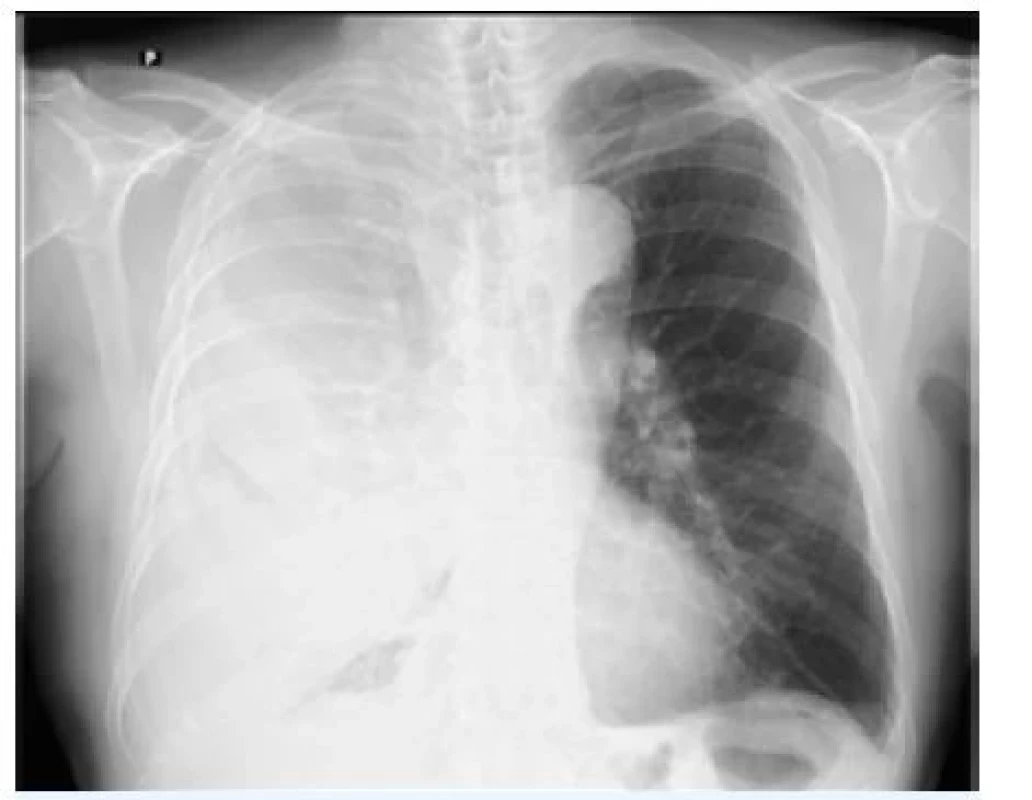
Image 3. Komplikovaný parapneumonický výpotek u stejného pacienta po zadrénování 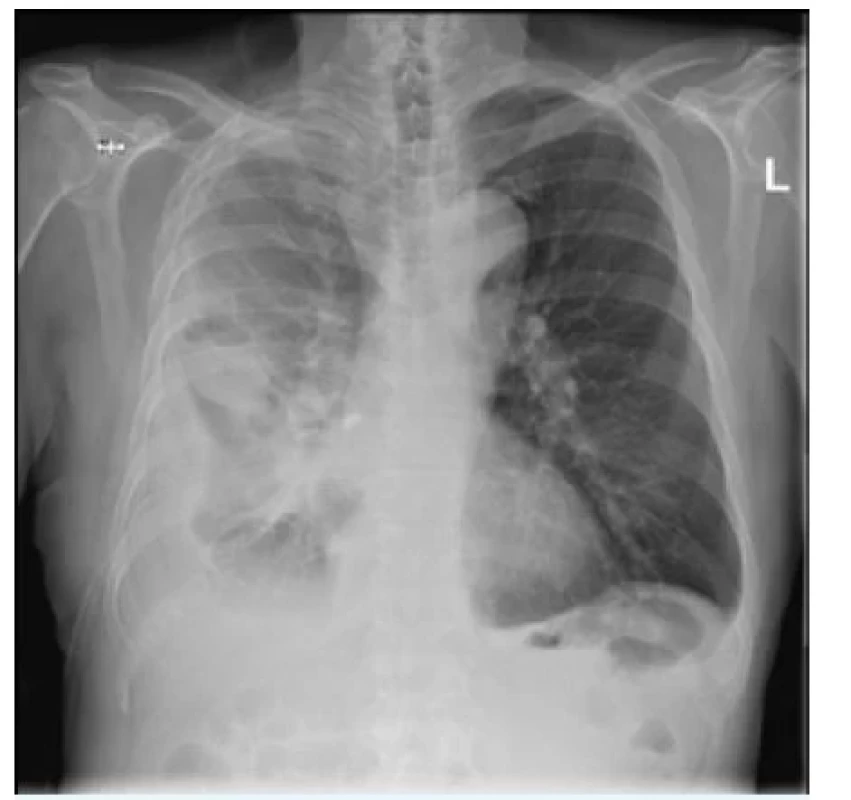
Jedinou absolutní kontraindikací výkonu je neposkytnutí informovaného souhlasu a nespolupráce pacienta. Relativní kontraindikací je nekorigovaná koagulopatie (na naší klinice je to například INR > 1,8 nebo destičky < 50×109/l). Drenáži se také vyhýbáme v případě zcela obliterované pleurální dutiny na sonografii a tam, kde je zanícená kůže nad místem vstupu.
Tenké drény, tedy drény do velikosti 14F, zavádíme většinou pomoci seldingerovské techniky, která je bezpečnější a pro pacienta méně bolestivá než technika tupé disekce, kterou používáme jenom při nutnosti použití větších drénů, tedy při selhání drénů tenkých a při velkém úniku vzduchu drénem (air leak). Při použití tenkého drénu je nutné drenážní systém 2× denně proplachovat 20–50 ml sterilního fyziologického roztoku.
ZÁNĚTLIVÁ ONEMOCNĚNÍ DÝCHACÍHO STROMU A CHOPN
Dalšími skupinami nemocí, které často mohou způsobit špatně lokalizovatelnou a specifikovatelnou bolest, jsou zánětlivá onemocnění dýchacího stromu a chronická obstrukční plicní nemoc (CHOPN). Tracheitida i bronchitida mohou někdy způsobit pálivou bolest při dýchání a kašli, která většinou odezní s nástupem zvýšené tracheobronchiální sekrece. Mnohem častější a klinicky závažnější jsou chronické bolesti na hrudi, které jsou často jedním z příznaků CHOPN.
Jedná se o progresivní degenerativní chorobu respiračního systému, která je jednou z důležitých příčin morbidity a mortality v celém světě a je obvykle spojená s přítomností řady komorbidit. Odhaduje se, že v současnosti zemře ve světě na toto onemocnění na 64 milionů osob za rok. V roce 2030 bude CHOPN 3. nejčastější příčinou úmrtí na světě. Více než polovina pacientů má alespoň jednu komorbiditu a existuje silná korelace mezi přítomností bolesti a komorbidit. Pacienti, kteří si stěžují na bolest, mají většinou vyšší stupeň plicní hyperinflace, tedy větší celkovou plicní kapacitu, vyšší skóre dušnosti, častěji depresi a sníženou fyzickou aktivitu. Léčba bolesti je tedy často zaměřená na zvládání komorbidit a léčbu deprese.
Pozoruhodné zlepšení chronických bolestí jsme zaznamenali u některých pacientů s těžkou chronickou plicní hyperinflaci na podkladě rozedmy, u kterých bylo provedeno ošetření pomocí endoskopické volumredukce. Zmenšením objemu plíce následkem blokády periferních průdušek nebo aplikací kovových svitků (coilů), které mechanicky smrští parenchym plic, dochází ke zmenšení tlaku na bránici, zlepšení mechaniky hrudního koše, a tudíž úlevě od chronických bolestí. Z toho pohledu je v léčbě bolestivých stavu u CHOPN velmi důležitá také dlouhodobá dechová rehabilitace (11).
PNEUMOTORAX
Jednou z poměrně častých příčin bolesti na hrudi může být pneumotorax. Primární spontánní pneumotorax (PSP, obr. 4) je jednou z nejčastějších plicních patologií adolescentů a mladých dospělých, s roční incidencí kolem 20 na 100 000. Jsou k němu náchylnější kuřáci a osoby s rodinnou anamnézou pneumotoraxu. I když je vznik tenzního pneumotoraxu u PSP spíše vzácný, v některých případech může docházet k ohrožení života a je třeba okamžité intervence.
Image 4. Kompletní primární spontánní pneumotorax bez přesunu mediastinálních struktur 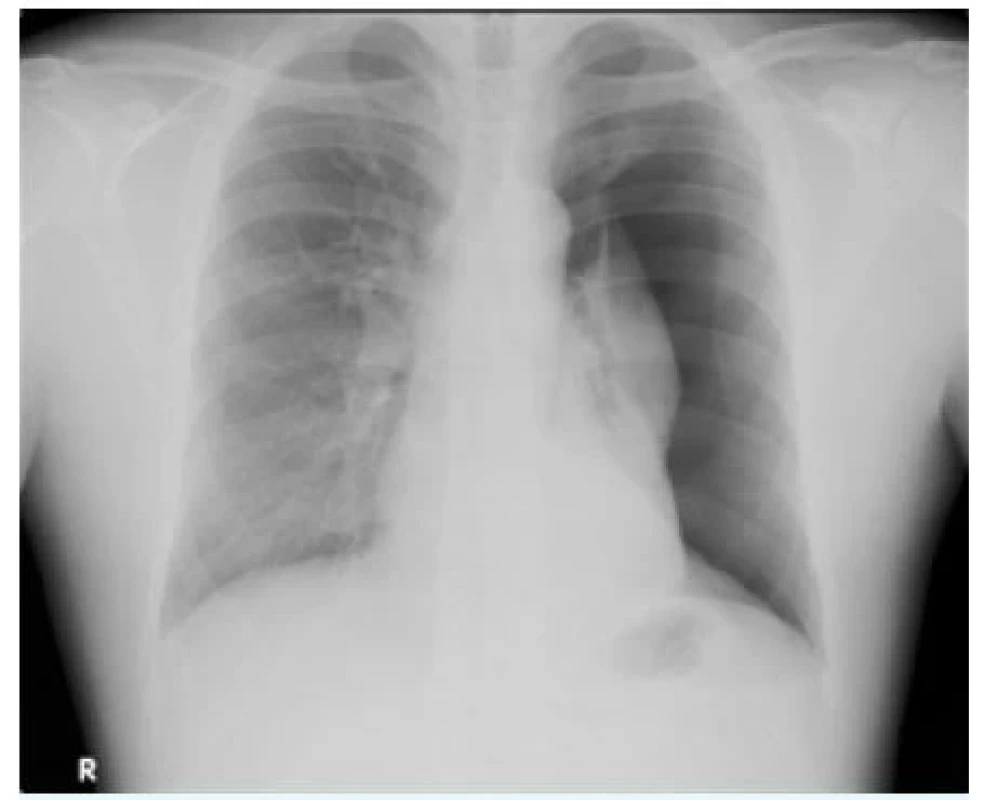
Sekundární spontánní pneumotorax vzniká na podkladě preexistující plicní choroby. Nejčastěji ho vídáme u pacientů s chronickou obstrukční plicní chorobou, asi v 70 % případů. Další choroby, které mohou zvyšovat incidenci pneumotoraxu, jsou tuberkulóza, nekrotizující pneumonie, pneumocystová pneumonie, karcinomy a sarkomy plic, sarkoidóza či endometrióza a prakticky všechny další nemoci, které postihují kvalitu a mechaniku plic. Jen okrajově zmiňujeme traumatický pneumotorax, neboť se jedná o typicky chirurgický problém a k internistovi pacient s touto problematikou zavítá poměrně vzácně, i když i na interních a plicních klinikách někdy vídáme nemocné s bolestmi na hrudi způsobenými pneumotoraxem vzniklým primárně frakturou žebra.
Při pátrání po etiologii pneumotoraxu musíme vzít úvahu, že plíce jsou obaleny viscerální pleurou a parietální pleurou, mezi nimiž je malé množství serózní tekutiny. Plíce jsou plně rozvinuty v hrudní dutině, protože tlak uvnitř průdušek je vyšší než tlak uvnitř pleurálního prostoru (Dondersův negativní nitrohrudní tlak). Pneumotorax může vzniknout, jen když je tento negativní tlak zrušen vzduchem, který pronikne postiženou hrudní stěnou, samotnou plící nebo vzácněji v případě, že mikroorganismus v pleurální prostoru produkuje plyn.
Léčba pneumotoraxu závisí na mnoha faktorech a může spočívat jenom v kontrole nebo v okamžité dekompresi hrudním drénem či jehlou. Propuštění pacienta domů a jeho následná kontrola je možná v případě malého pneumotoraxu (menšího než polovina objemu hemitoraxu), pacient není dušný ani nemá vyvolávající plicní chorobu. Sekundární pneumotoraxy jsou většinou pouze sledovány v případech, kdy jsou velmi malé (< 1 cm tloušťky) a mají omezenou symptomatiku. Kyslík podávaný ve vyšším průtoku může zrychlit resorpci pneumotoraxu až 4×. Pokud má pacient primární spontánní pneumotorax > 50 % nebo primární spontánní pneumotorax spojený s dušností, současná doporučení připouštějí jako možnost zvládání tohoto stavu aspirací, kterou považují za podobně efektivní jako založení hrudního drénu. Bylo prokázáno, že primární aspirace u pneumotoraxu redukuje počet hospitalizací bez navýšení rizika komplikaci. Provedení je většinou snadné – po lokální anestezii zavedenou jehlou připojenou k trojcestnému ventilu vypustíme až 2,5 l vzduchu.
Hrudní drenáž
Zavedení hrudního drénu a varianty v provedení drenáže jsou popsány výše. Podstatné je, že drén neponecháváme v hrudníku déle než jeden den poté, kdy přestaneme pozorovat air leak za předpokladu rozepjaté plíce (obr. 5).
Image 5. Stav po drenáži pneumotoraxu s úplným rozvinutím plíce 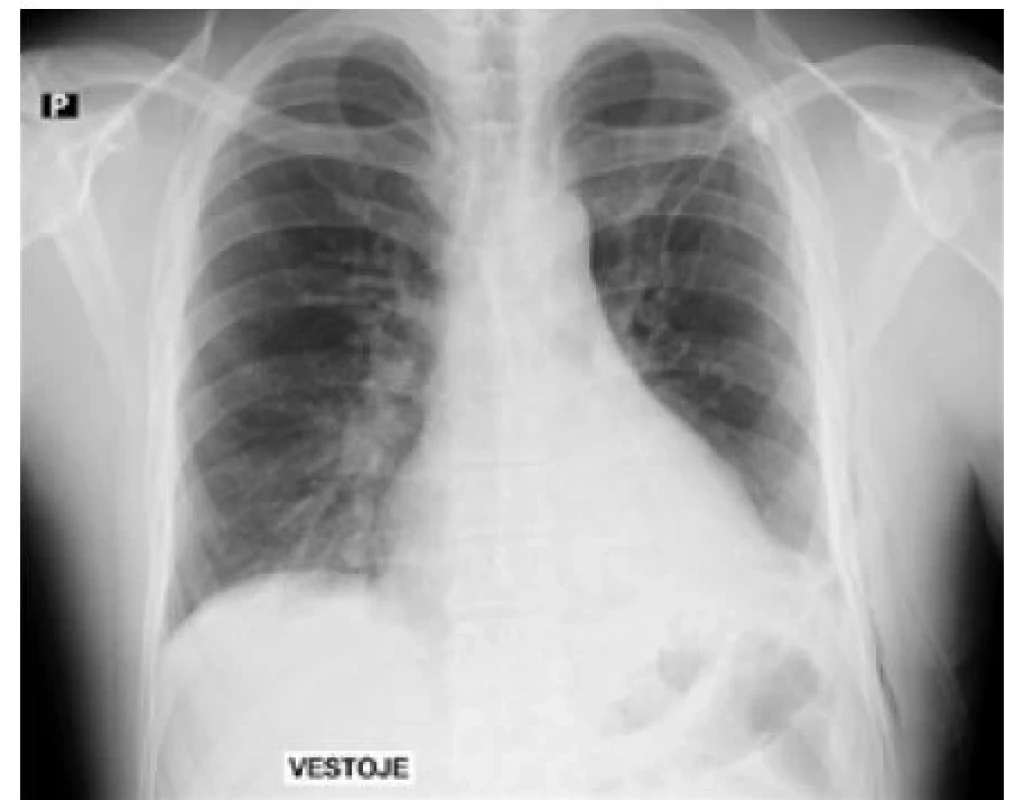
V případě, že air leak přetrvává déle než 4 dny, je vhodné zvážit další možnosti zvládání tohoto stavu. Moderním přístupem je zavedení jednosměrných chlopní bronchoskopickou cestou do průdušky zásobující postiženou oblast plic, čímž se často daří air leak zastavit a následně je možné drenáž ukončit a po několika týdnech i odstranit chlopeň. Tradiční je metoda chirurgická, při které ať již formou torakotomie nebo videoasistované torakoskopie může chirurg staplerem odstranit puchýřky („blebsy“) a zároveň provést pleurektomii s pleurální abrazí. V průběhu procesu hojení pak plíce přiroste k hrudní stěně a efektivně obliteruje pleurální prostor. Recidivy jsou zhruba v 1 % případů, často se ale setkáváme s bolestmi po torakotomii (12).
PNEUMOMEDIASTINUM
Pneumomediastinum je definováno přítomností vzduchu v mezihrudí. Může být zapříčiněno traumatem nebo jinou situací, kdy vzduch uniká z plic, střev či průdušek do hrudní dutiny. Při spontánním pneumomediastinu se vzduch v mediastinu vyskytuje u jinak zdravé osoby bez očividné příčiny (operace, perforace dutých orgánů, přítomnost infekce či trauma). Pokud je vzduch v mezihrudí přítomen ze známých důvodů, jedná se o sekundární pneumomediastinum.
Řada respiračních onemocnění může vést k pneumomediastinu, zvláště exacerbace spojené s výrazným kašlem u respiračních infekcí, astmatu, intersticiálních plicních chorob a chronické obstrukční plicní nemoci. Další možností je excesivní zvracení, trauma průdušnice (obr. 6) a hrudníku včetně iatrogenního postižení. V poslední době je také se vznikem akumulace vzduchu v mezihrudí spojováno užívání drog (kokainu, marihuany, metamfetaminu) a dále extrémní námaha jako výstup potápěčů z hloubkových ponorů, porod a extrémní sportovní aktivity.
Image 6. Sekundární pneumomediastinum jako následek perforace trachey 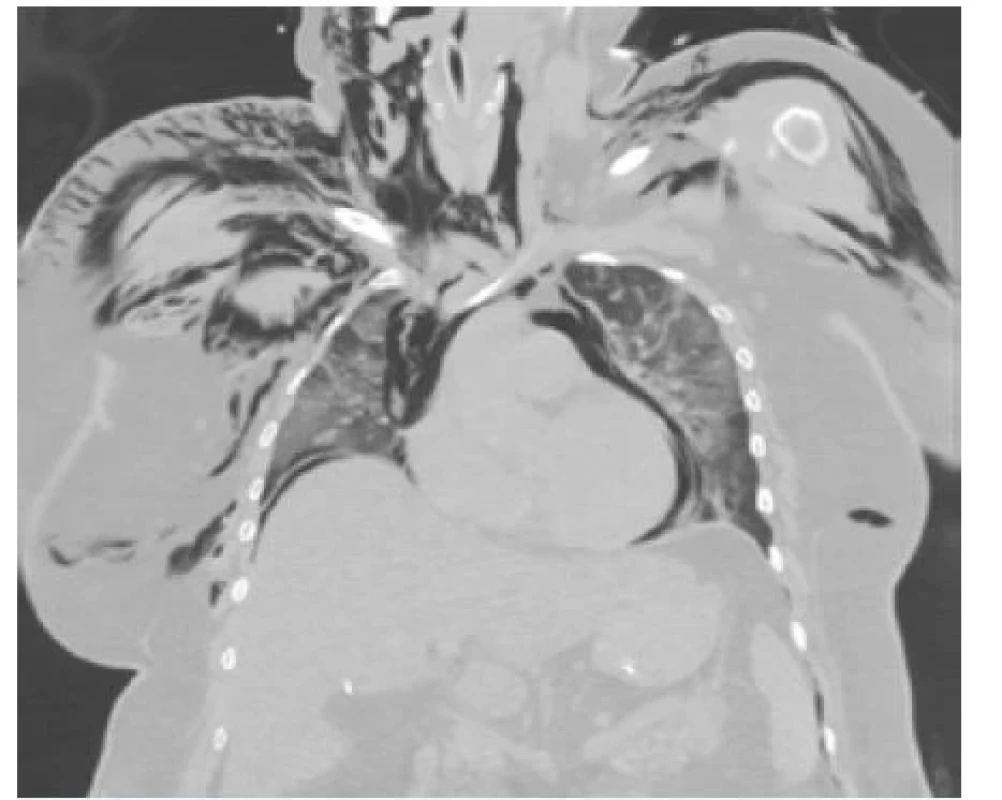
Incidence onemocnění je poměrně nízká, podle některých studií se pohybuje kolem 1 na 25 000 ve věku mezi 5 a 34 lety, přičemž většina pacientů jsou muži (až v 76 % případů). Mnoho autorů ovšem předpokládá, že tento problém je poddiagnostikovaný. Častější onemocnění u mladých osob může být vysvětleno tím, že u těchto jedinců jsou mediastinální tkáně pružnější a pevnější, kdežto u starších věkových skupin jsou fibrotizované, a tím se do nich vzduch dostává obtížněji. Nejčastějším symptomem je bolest na hrudi, obvykle retrosternální s možným vyzařováním do krku a zad. Vznik obtíží je obvykle náhlý a často nasedá na exacerbaci podkladového onemocnění – astmatu nebo CHOPN. Nezřídka se vyskytují dušnost (75 %), kašel (80) a bolesti v krku (36). V některých případech jsou přítomné zvracení a obtíže s polykáním. Subkutánní emfyzém je přítomný až v 70 % případů pneumomediastina. Specifickou známkou, po které je třeba pátrat, je Hammanovo znamení – přítomnost mediastinálního kliku slyšitelného nad apexem a parasternálně vlevo, který je synchronní s úderem srdce. Při maligním pneumomediastinu se v mezihrudí hromadí významné množství vzduchu působící stlačení a obstrukcí velkých cév či průdušnice; může způsobit tamponádu nebo těžkou dušnost.
Diagnóza je zpravidla založena na zadopředním skiagramu hrudníku. Ten je diagnostický až v 90 % případů. CT nález nejenom potvrzuje, ale může také identifikovat kauzální faktory a patologie. U spontánního pneumomediastina většinou nemusíme provádět bronchoskopii, ezofagoskopii ani ezofagografii, pokud nemáme podezření na konkrétní podkladovou patologii.
Komplikacemi pneumomediastina mohou být podkožní emfyzém a pneumotorax. Pokud je podkožní emfyzém rozsáhlý, může vyžadovat provedení kožních incizí k dekompresi.
Léčba
Stav většinou odezní bez léčby, ale byly popsány případy s delší než 2měsíční perzistencí vzduchu v mezihrudí. V případě opakovaného výskytu spontánního pneumomediastina je nutné provádět plicní i jícnovou endoskopii, takové případy jsou nicméně vzácné.
BOLESTI NÁDOROVÉHO PŮVODU
Parietální pleuru a hrudní stěnu může postihnout řada nádorových procesů – primárních i sekundárních. Nejčastější je bronchogenní karcinom, který však zpravidla způsobuje bolest až v relativně pozdním stadiu svého růstu, neboť plicní tkáň, ze které pochází, není senzitivně inervována. Toto onemocnění tak bolí až při prorůstání do hrudní stěny nebo při postižení pleury. Obecně ůže k postižení pohrudnice a hrudní stěny dojít jak při šíření nádoru per continuitatem, tak při šíření lymfogenním či hematogenním (obr. 7).
Image 7. Hematogenní metastatický plicní proces s postižením pohrudnice 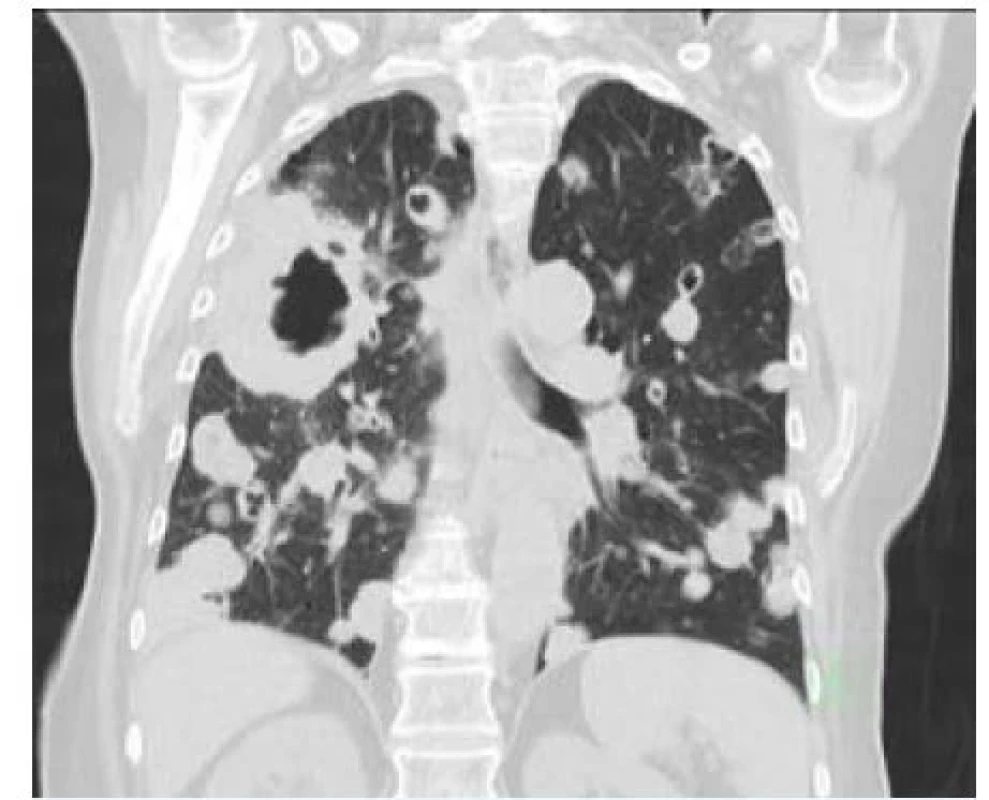
Pancoastův tumor
Nádor horní hrudní apertury může vést k takzvanému Pancoastovu syndromu. U něj obtíže začínají typicky postižením brachiálního plexu a způsobují bolesti horní části hrudní stěny, ramene a paže u téměř všech pacientů. Může také postihovat parietální pleuru či žebra a způsobovat tak velmi výraznou bolest. Ve chvíli, kdy nádor zasáhne sympatické dráhy a cervikální ganglia, může mít pacient problém s ipsilaterálním zarudnutím tváře a výrazným pocením. V pozdějším průběhu šíření nádoru může vzniknout i Hornerův syndrom, tedy ipsilaterální ptóza víčka, mióza, enoftalmus a anhidróza. Pak může docházet i ke kontralaterálnímu pocení a zarudnutí, které se vyvíjí následkem přehnaného dráždění sympatického systému a bývá označováno jako harlekýnův syndrom. (13)
Pancoastův tumor je prakticky vždy nemalobuněčným plicním karcinomem. V minulosti to byl nejčastěji dlaždicobuněčný nádor, dnes už vídáme častěji adenokarcinom. Pancoastův syndrom je vlastně skupina příznaků spojených s šířením nádoru k brachiálnímu plexu a hrudní stěně, žebrům nebo obratlům. Způsobuje bolesti ramene a hrudní stěny, parestezie končetin s maximem v mediální části ruky včetně 4. a 5. prstu v důsledku radikulopatie C8–Th1. Vzhledem k tomu, že jsou tyto nádory lokalizovány apikálně, způsobují v časných fázích nikoliv dušnost, nýbrž obličejové flashe a pocení.
Vyšetřovací metody
Prvním vyšetřením je skiagram hrudníku, který může zobrazit apikální masu. Zobrazovacím standardem je CT a PET CT hrudníku, v některých případech i magnetická rezonance, která dokáže dobře odlišit postižení měkkých tkáních brachiálního plexu a obratlů. Je zvláště důležitá u operabilních tumorů. Histologickou diagnózu pak získáváme pomocí transbronchiální či transparietální biopsie.
Léčba
Standardem léčby je v současnosti chemoradiace následována chirurgickou resekci. Časná diagnostika je velmi důležitá, neboť prognóza jednoznačně závisí na stagingu v době diagnózy (14).
Mezoteliom
Maligní pleurální mezoteliom (MPM) je agresivní nádor vycházející z mezotelových pleurálních buněk (obr. 8). Je to vzácnější nádor, který je velmi obtížné léčit a je často spojen s expozicí azbestu. Incidence tohoto onemocnění v Evropě činí asi 2 na 100 000 ročně. V roce 1960 byla odhalena spojitost mezi azbestem a mezoteliomem, ale opatření vedoucí k redukci expozice začala být účinná až po 30 letech. Vzhledem k průměrné latenci mezi expozicí a počátkem choroby (44,6 roku) prevalence v Evropě ještě stále stoupá a dosahuje svého maxima právě v současnosti.
Image 8. Maligní mezoteliom pleury – zobrazení PET/CT 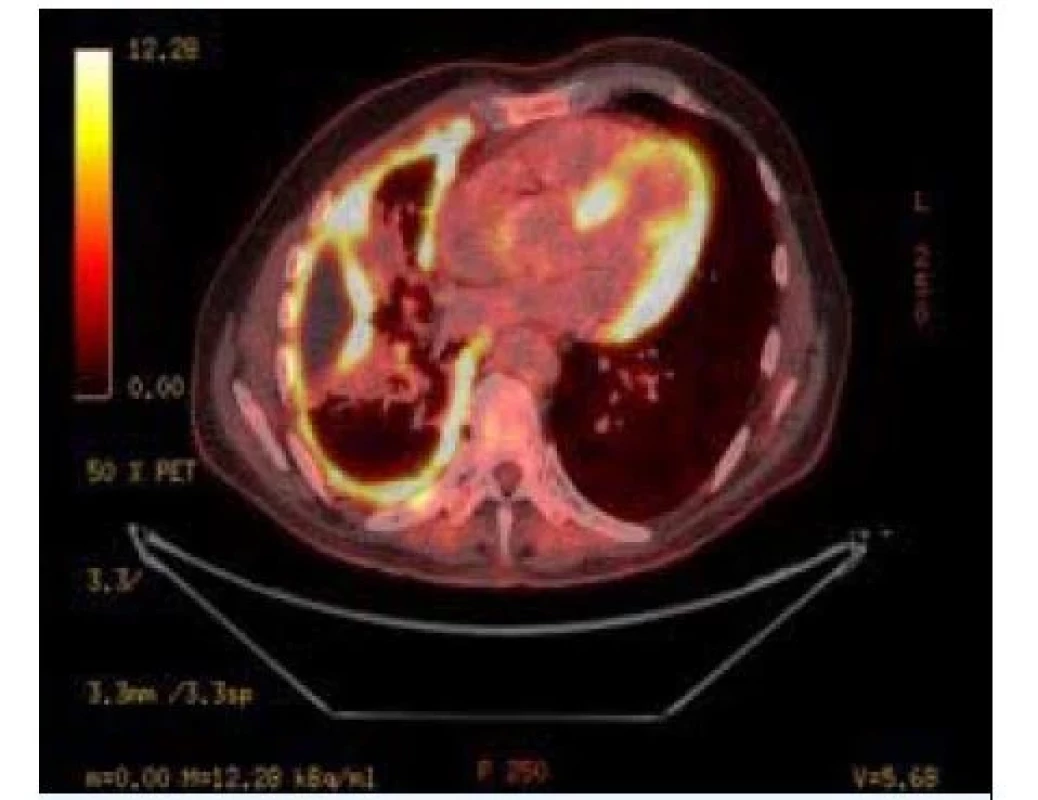
Diagnóza a staging
Klinická diagnóza mezoteliomu je poměrně obtížná. Nádor se projevuje nejčastěji dušností při narůstajícím pleurálním výpotku a bolestmi různé intenzity charakteru pálení a tlaku na hrudníku. Ze zobrazovacích metod používáme skiagram hrudníku, CT, PET/CT a sonografii k zaměření a biopsii. Onemocnění má většinou tendenci progredovat od bazí k apexům.
Mezoteliom je dosti heterogenní tumor, u kterého jsou popsány 3 základní typy podle klasifikace WHO: epiteloidní, sarkomatoidní a smíšený typ (15).
Léčba
Preferenční metodou je stále chirurgická kompletní resekce. V současnosti se používají dva hlavní postupy, kterými lze dosáhnout makroskopické kompletní resekce. Pleurektomie/dekortikace nebo extrapleurální pneumonektomie. Ta představuje extrémní výkon spočívající v odstranění plíce, viscerální i parietální pleury, přiléhajícího perikardu a bránice. Role tohoto výkonu je nyní dosti nejasná vzhledem výsledkům studie MARS 1 (Mesotelioma and Radical Surgery), která prokázala, že neposkytuje žádnou výhodu z hlediska přežití ve srovnání s trimodální léčbou, a naopak není vyloučeno, že pacientům škodí (16).
V léčbě se vždy snažíme používat multimodální postupy, nejlépe v prospektivních studiích ve specializovaných centrech. V chemoterapii se nejvíce uplatňuje cisplatina s antifolátem (pemetrexed). Nové metody jako přidání bevacizumabu či imunoterapie do kombinace nebo snaha o cílené snížení objemu nádorové tkáně pomocí fotodynamické léčby jsou výrazem zatím nepříliš úspěšných snah o snížení vysoké úmrtnosti na toto onemocnění.
ZÁVĚR
Bolesti na hrudi jsou enormně častou manifestací pestré množiny plicních chorob. Diferenciální diagnostika je zde široká a zahrnuje i život ohrožující stavy. Článek si nedělá ambice na vyčerpávající a detailní popis všech možných příčinných procesů, snaží se však přiblížit klinicky nejdůležitější situace a jejich management v praxi.
Adresa pro korespondenci:
doc. MUDr. Jiří Votruba, Ph.D.
1. klinika tuberkulózy a respiračních nemocí 1. LF UK a VFN
U nemocnice 2, 128 08 Praha 2
Tel.: 224 969 355
e-mail: jiri.votruba@vfn.cz
Sources
- Pitts SR, Niska RW, Xu K et al. National Hospital Ambulatory Medical Care Survey: 2006 emergency departments summary. Natl Health Stat Report 2008; 2 : 1–39.
- Murray JF, Gebhart G. Chest pain. In: Murray JF, Nadel J (eds.). Textbook of Respiratory Diseases. WB Saunders, Philadelphia, 2005 : 848–865.
- Mandell LA. Epidemiology and etiology of community acquired pneumonia. Infect Dis Clin North Am 2004; 18 : 761–776.
- Hoyert FL, Herron M, Murphy SL, Kung HC. Deaths: final data for 2003. Natl Vital Stat Rep 2006; 54 : 1–120.
- Kolek V, Kolář M, Kašák V a kol. Diagnostika a léčba komunitní pneumonie dospělých. Vnitřní lékařství 2011; 57 : 858–866.
- Courtoy I, Lande AE, Turmer RB. Accuracy of radiographic differentiation of bacterial from nonbacterial pneumonia. Clin Pediatr 1989; 28 : 261–264.
- Bartlett JG. Diagnostic tests for agents of community-acquired pneumonia. Clin Infect Dis 2011; 52: S296.
- Schuetz P, Chiappa V, Briel M, Greenwald JL. Procalcitonin algorithms for antibiotic therapy decisions: a systematic review of randomized controlled trials and recommendations for clinical algorithms. Arch Intern Med 2011; 171 : 1322–1331.
- Lim WS, van der Eerden, Laing R et al. Defining community acquired pneumonia severity on presentation to hospital an international derivation and validation study Thorax 2003; 58 : 377–382.
- Light RW. Parapneumonic effusions and empyema. Proc Am Thorac Soc 2006; 3 : 75–80.
- HajGhanbari B, Holsti L, Road JD, Reid WD. Pain in people with chronic obstructive pulmonary disease (COPD). Respir Med 2012; 106 : 998–1005.
- Zarogoulidis P, Kioumis I, Pitsiou G et al. Pneumothorax: from definition to diagnosis and treatment. J Thorac Dis 2014; 6 (Suppl. 4): S372–S376.
- Khadilkar SV, Khade SS. Brachial plexopathy. Ann Indian Acad Neurol. 2013; 16 : 12–18.
- Waseda R, Klikovits T, Hoda MA et al. Trimodality therapy for Pancoast tumors: T4 is not the contraindication for radical surgery. J Surg Oncol 2017; 116 : 227–235.
- Travis W, Brambilla E, Müller-Hemerlink HK. WHO classification of tumours pathology and genetics of the lungs, pleura, thymus and heart. IARC Press, 2004.
- Treasure T, Lang-Lazdunski L, Waller D et al.; MARS trialists. Extra-pleural pneumonectomy versus no extra-pleural pneumonectomy for patients with malignant pleural mesothelioma: clinical outcomes of the Mesothelioma and Radical Surgery (MARS) randomised feasibility study. Lancet Oncol 2011; 12 : 763–772.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- ÚVODEM
- EDITORIAL
- Chest pain from pneumologist point of view
- Chronic cough
- Current interventional treatment options for severe emphysema
- The importance of lung biopsy in a patient with idiopathic pulmonary fibrosis: a case report
- The challenges of telemedicine in the Czech Republic from an expert perspective
- Počátky Sexuologického ústavu ve vzpomínkách jeho prvního přednosty prof. MUDr. Josefa Hynie, DrSc.
- Lékař a spisovatel František Langer a jeho povídka „Děti a dýka“
- Joseph Edward Murray (1919–2012)
- Z pétépáka trestaného komunisty profesorem neurochirurgie a primátorem Plzně
- Za profesorem Vladimírem Benckem
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (LEDEN – ÚNOR 2023)
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chest pain from pneumologist point of view
- Chronic cough
- Current interventional treatment options for severe emphysema
- The challenges of telemedicine in the Czech Republic from an expert perspective
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

