-
Medical journals
- Career
Testování COVID-19 – co bychom měli mít na paměti
Authors: Zuzana Krátká 1,3; Štěpánka Luxová 1; Karin Malíčková 2; Tomáš Fürst 3,4; Halina Šimková 3,5
Authors‘ workplace: Imunologická laboratoř GENNET, s. r. o. 1; Klinické centrum ISCARE, a. s. 2; Katedra matematické analýzy a aplikací matematiky PřF UP Olomouc 4; Znalecký a expertizní ústav, z. ú., Praha 5; BIN – Centrum pro bayesovskou inferenci 34
Published in: Čas. Lék. čes. 2020; 159: 72-77
Category: Original Article
Overview
Diagnostické postupy používané k průkazu onemocnění COVID-19 zahrnují klinickou anamnézu, PCR test přítomnosti SARS-CoV-2 a průkaz protilátek proti viru. Kombinací těchto metod je možné zjistit séroprevalenci zdravotnických pracovníků na SARS-CoV-2.
Cílem práce bylo stanovení výskytu protilátek proti SARS-CoV-2 u zdravotnických pracovníků po 6–8 týdnech od prvního nálezu COVID-19 v České republice.
Bylo vyšetřeno 269 osob (187 žen, 82 mužů) s věkovým průměrem 45,9 roku (21–71 let). Pomocí dotazníků bylo zjišťováno, zda osoby byly v zahraničí a zda se u nich vyskytovaly klinické příznaky typické pro respirační onemocnění. U všech byla zjišťována přítomnost IgG protilátek v séru. V případě pozitivního IgG bylo doplněno vyšetření IgA a PCR vyšetření přítomnosti SARS-CoV-2 ve stěru. Ke stanovení protilátek byly použity testy ELISA SARS-CoV-2-IgG a SARS-CoV-2-IgA firmy Euroimmun.
Klinické příznaky udávalo 17 % osob, v zahraničí bylo 35,8 % osob. IgG-pozitivních bylo 5 z 269 testovaných osob (1,85 %). Pozitivní IgA a hraničně pozitivní IgG měla 1 osoba (0,37 %). Pozitivní výsledek PCR měla 1 osoba. Protilátky proti SARS-CoV-2 tak byly zjištěny u 2,22 % vyšetřovaných osob.
V článku jsou diskutovány limity testování, které jsou ovlivněny jak zvoleným typem vyšetření, tak nízkým výskytem onemocnění ve společnosti.
Klíčová slova:
COVID-19 – SARS-CoV-2 – protilátky – pozitivní prediktivní hodnota – IgA – IgG – rychlotest – ELISA – senzitivita – specificita
ÚVOD
Epidemie SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) významně zasáhla do našeho života i do provozu většiny zdravotnických zařízení. Viditelný průběh epidemie v České republice, tedy nárůst počtu pozitivně testovaných osob a nemocných s klinickými projevy, je pozvolný a k promořování populace dochází zřejmě velmi pomalu.
Jedním z pravděpodobně nezbytných předpokladů udržení příznivého vývoje epidemie je extenzívní testování nejen osob s příznaky onemocnění, ale i rizikových skupin osob v komunitních či zdravotnických zařízeních (1). Zcela logicky platí, že čím vyšší je počet testovaných lidí, tím lepší máme přehled o promořenosti.
Na stránkách https://ourworldindata.org lze nalézt pravidelně aktualizované údaje o testování COVID-19 (coronavirus disease 2019) z celého světa (2). Nejlépe si dlouhodobě v počtu testovaných stojí Island, kde bylo k 10. 5. 2020 otestováno 155,95 osoby na 1000 obyvatel. Pro porovnání – v Itálii to k tomuto datu bylo 41,58; v České republice 28,25 a ve Velké Británii 13,93. Údaje se vždy vztahují k posledním 10 dnům testování (2).
Kolik je v České republice imunních osob, zatím nevíme. Konečné výsledky ze studie SARS-CoV-2-CZ-Preval, jež probíhala v České republice v dubnu 2020, zatím zveřejněné nebyly. K dispozici jsou průběžná data, a to výsledky vyšetření provedených pomocí rychlotestu Wantai (3). Protilátky byly detekované u 107 osob z 26 549 testovaných, tedy u 0,4 % testovaného vzorku populace. Výsledky testů ELISA zatím k dispozici nejsou. Z dostupných dat z rutinního testování osob, které je prováděno v České republice, víme, že na 1 pozitivní PCR test připadá 37,5 negativních, tedy že pozitivních je 2,67 % provedených PCR testů (2).
Zdravotnická zařízení se mohou velmi rychle stát nebezpečnými ohnisky nákazy. Kontrolní testování všech osob, jež do zdravotnických zařízení přicházejí nebo v nich pracující, je vhodné zejména tehdy, pokud v těchto místech již došlo k výskytu infekce (4). Laboratorní testování je zároveň vhodné doplnit dotazníkovým šetřením, které umožní zjistit:
- a) výskyt klinických příznaků COVID-19 v nedávném období (horečky, kašle, dušnosti, významně vyšší únavy, rýmy, průjmu, ztráty čichu a chuti či jiných atypických zdravotních obtíží);
- b) pobyt v zahraničí mezi lednem a březnem 2020, než byly uzavřeny hranice.
V rámci testování v ideálním případě můžeme odlišit:
- osoby, které se s virem nepotkaly a jsou zdravé;
- osoby nakažené, u kterých probíhá více či méně klinicky manifestované onemocnění COVID-19;
- osoby, které jsou nakažené a jsou asymptomatickými přenašeči infekce;
- osoby, které infekci prodělaly a jsou zdravé a imunní.
Pro správné vyhodnocení použitých testů je klíčová znalost jejich možností a limitů. Provedením výtěru a následnou reverzní PCR detekcí SARS-CoV-2 zjistíme osoby PCR pozitivní, u kterých s vysokou pravděpodobností probíhá infekce koronavirem. Mezi zbylými (PCR-negativními) osobami však z principu nerozlišíme ty, které se s infekcí ještě nesetkaly, již zdravé osoby a osoby s falešně negativním testem. Uvádí se, že reverzní PCR je pozitivní u 59–78,2 % pacientů s COVID-19 (5), ale i tento údaj závisí na mnoha okolnostech.
Při stanovení specifických protilátek metodou ELISA (enzyme-linked immunosorbent assay) nebo pomocí imunochromatografických testů (tzv. rychlotestů) je interpretace výsledku silně závislá na tom, kdy (z pohledu průběhu onemocnění) byl odběr krve proveden. Imunitní systém reaguje na virovou infekci tvorbou specifických protilátek. Jejich vývoj (tzv. sérokonverze) trvá 8–21 dní (počítáno od prvních symptomů onemocnění), a není proto možné spolehlivě detekovat protilátky u všech osob v počátečním stadiu onemocnění (6, 7). U většiny lidí jsou protilátky detekovatelné po 14 dnech (6, 7). U mnoha budou alespoň IgM protilátky detekovatelné i dříve (3.–7. den).
V literatuře nacházíme velké rozdíly v tom, kdy se jednotlivé izotypy protilátek začínají tvořit, což může být do značné míry ovlivněno použitými diagnostickými soupravami (7). Zatímco pozitivní nálezy protilátek (v ideálním případě) znamenají kontakt imunitního systému s virem, negativní nálezy neznamenají opak, tedy že se osoba s virovou infekcí dosud nesetkala. Je možné, že infekci má, ale ještě u ní neproběhla sérokonverze, případně že na infekci reagovala jinou imunitní reakcí a nevytvořila protilátky (7).
Při stanovování protilátek anti-SARS-CoV-2 můžeme použít levnější rychlotesty s menší přesností nebo spolehlivější, ale dražší testy ELISA. Při nízké prevalenci infekce v populaci je však nutné si uvědomit, že mnoho pozitivních výsledků bude projevem falešné pozitivity, i když byly použity špičkové testy (7, 8). Na obr. 1 je znázorněna situace pro 10 000 náhodně vybraných osob z populace s 2% promořeností při použití testu IgG protilátek s 95% senzitivitou a 95% specificitou. Senzitivita říká, s jakou pravděpodobností je test pozitivní u osoby, která již onemocnění prodělala. Specificita říká, s jakou pravděpodobností je test negativní u osoby, která onemocnění neprodělala. Správně pozitivních bude v uvedeném případě 190 osob (= 0,02 × 10 000 × 0,95); falešně pozitivních bude 490 osob (= 0,98 × 10 000 x 0,05). Pozitivní prediktivní hodnota testu, tj. pravděpodobnost, že osoba s pozitivním testem skutečně prodělala onemocnění, bude činit přibližně 28 %.
S rostoucí promořeností populace bude růst i důkazní váha pozitivního výsledku testu. Pokud by promořenost populace dosáhla 10 %, bude poměr správně a falešně pozitivních 950 : 450 a pozitivní prediktivní hodnota testu bude činit téměř 68 %. Kritický moment nastává, jestliže pacienty z populace neznámé promořenosti testujeme testem ne zcela známých parametrů. V takovém případě totiž nejsme schopni pozitivní prediktivní hodnotu testu vyčíslit, což nám následně znemožňuje správně se rozhodovat a dělat účinná opatření.
Image 1. Stanovení pozitivní prediktivní hodnoty testování populace s 2% promořeností (ilustrace: Halina Šimková)
Pozn.: PPV – pozitivní prediktivní hodnota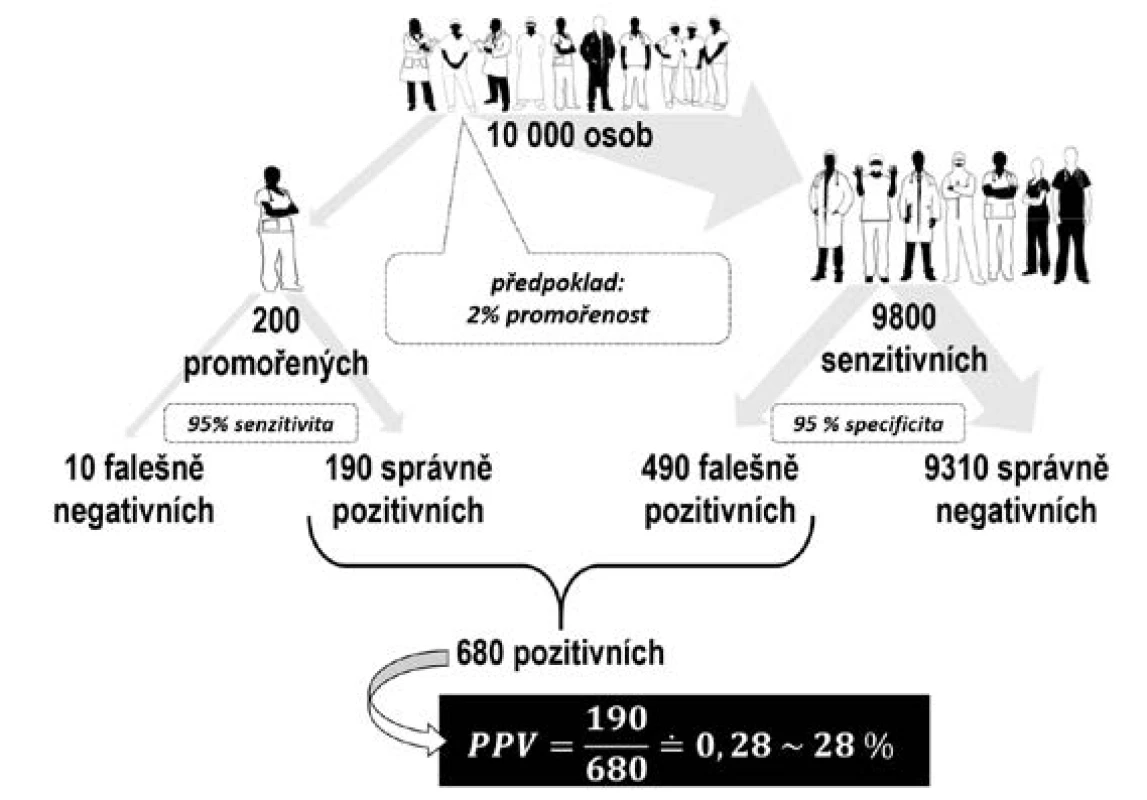
CÍL STUDIE
V rámci screeningu zdravotnických týmů zjistit počet osob, jež v průběhu první vlny epidemie prodělaly COVID-19 a jsou pravděpodobně imunní vůči SARS-CoV-2. K monitoringu využít stanovení IgG protilátek proti SARS-CoV-2 metodou ELISA.
VYŠETŘOVANÝ SOUBOR
V rámci studie bylo vyšetřeno 269 osob (187 žen, 82 mužů). Věkový průměr souboru činil 45,9 roku (21–71 let). V souboru byli lékaři, zdravotní sestry, pracovníci laboratoří, recepční, sanitáři, ale i pracovníci v administrativě či manažeři. K odběru krve se dostavili lidé, kteří se cítili zdrávi, v předchozích 14 dnech nebyli nemocní a nebyli v nařízené karanténě. Výjimkou byla 1 osoba (v tab. 1 uvedená jako osoba 1) s prodělaným onemocněním COVID-19 na konci karantény a 5 rodinných příslušníků, kteří byli dotestováni u pozitivních osob.
182 osob vyplnilo dotazník, který obsahoval otázky sledující výskyt klinických příznaků typických pro COVID-19 v období od ledna do dubna 2020 a otázky týkající se cest do zahraničí.
METODIKA
U všech vzorků sér byla stanovena hladina IgG protilátek proti SARS-CoV-2. V případě zjištění pozitivní nebo hraniční hodnoty IgG byly vyšetřeny rovněž IgA protilátky. Osobám s pozitivními protilátkami byl proveden stěr z důvodu PCR vyšetření viru SARS-CoV-2.
Na základě těchto vyšetření jsme mezi osobami s pozitivními IgG protilátkami mohli rozlišit:
- osoby PCR-pozitivní, IgA/IgG-pozitivní, bez klinických příznaků (nejspíš asymptomatické nosiče);
- osoby PCR-negativní, IgA/IgG-pozitivní, s anamnézou klinických příznaků nebo bez klinických příznaků (nejspíš uzdravené imunní jedince);
- osoby PCR-negativní, IgA-negativní a IgG-pozitivní, bez anamnézy klinických příznaků – suspektně osoby, které infekci neprodělaly a měly jen falešně pozitivní IgG protilátky.
Testování protilátek proti SARS-Cov-2 v séru bylo provedeno pomocí metody ELISA (enzyme-linked immunosorbent assay) firmy Euroimmun Medizinische Labordiagnostika AG (Německo) – SARS-CoV-2 IgG (EI 2606-9601 G) a SARS-CoV-2-IgA (EI 2606-9601 A). Soupravy měly CE-IVD certifikaci (in vitro diagnostic medical device). Použitým vazebným antigenem byla S1 doména viru (rekombinantní strukturní protein), která je považována za vysoce specifický protein SARS-CoV-2 (9).
Hodnocení protilátek se provádělo semikvantitativně – tedy jako poměr (OD ratio) optické denzity zkoumaného vzorku k optické denzitě kalibrátoru (neboli séra s definovanou hraniční koncentrací protilátek). OD ratio > 1,1 bylo považováno za pozitivní, 0,8–1,1 za hraniční, < 0,8 za negativní. Výrobcem udávaná senzitivita testu je ovlivněna dobou, která uběhla od počátku infekce. S delší dobou od prvních příznaků se vytvoří více protilátek a senzitivita vyšetření stoupá. Po 10–20 dnech dosahuje 100 % pro IgA, 87,5 % pro IgG, po 20 dnech od infekce je to 100 % pro IgA i IgG. Specificita testu činí 99 % pro IgG a 90,4 % pro IgA.
Vyšetření přítomnosti viru pomocí PCR byla provedena v mikrobiologických laboratořích Vidia Diagnostika v Praze, v Thomayerově nemocnici v Praze a ve Fakultní nemocnici Hradec Králové.
Přítomnost protilátek byla u 3 pozitivních vzorků ověřována také rychlotestem ACCU-TELL Covid-19 IgG/IgM Rapid Test od výrobce AccuBiotech Co Ltd. Výrobcem udávaná senzitivita rychlotestu byla pro IgG 100 % a pro IgM 91,8 %. Specificita testu byla pro IgG 99,5 % a pro IgM 99,2 %. Použitý vazebný antigen nebyl v příbalovém letáku uveden. Vyšetření bylo provedeno u 3 vzorků kvůli verifikaci rychlotestu v laboratoři Vidia Diagnostika.
V 1 případě (u osoby 1) byl použit test RightSign IgG/IgM od výrobce Hangzhou Biotest Biotech Co., Ltd. Tento test nemá dostupné informace o použitém antigenu, na webových stránkách není dostupná senzitivita a specificita testu.
VÝSLEDKY
Výsledky dotazníkového šetření
Dotazníky vyplnilo 182 osob. Subjektivně zdravých (tedy bez klinických příznaků) bylo 151 osob (83 %), 31 mělo některý z klinických příznaků typických pro respirační onemocnění: kašel (56,2 %), teplota > 37,5 °C (48,4 %), dušnost (29,0 %), průjem (25,8 %), horší čich či chuť (6,5 %), únava (58,1 %). Alespoň 3 příznaky uvedlo 10 osob (32,3 % ze symptomatických). Většinou šlo o kombinaci teploty s kašlem a únavou.
Stejná skupina osob vyplnila i údaje o cestách do zahraničí v lednu až březnu 2020. 49 osob (27 %) bylo na dovolené v Evropě – nejčastěji v Rakousku (23), Itálii (5), na Slovensku (5) a v Německu (3). 13 osob bylo v jiných evropských zemích. 16 osob (8,8 %) navštívilo různé exotické země (např. Brazílii, Tanzanii, Thajsko, Spojené arabské emiráty), jež nebyly v dané době považovány za rizikové oblasti s ohledem na COVID-19. V Číně nebyl nikdo.
Výsledky vyšetření protilátek
Pro screeningové testování asymptomatických jedinců je vhodnější použít vyšetření IgG protilátek než IgA z důvodu vyšší specificity testu. V testovaném souboru bylo 263 vzorků (97,7 %) s negativním IgG, jeden vzorek (0,4 %) s hraničním IgG a 5 vzorků (1,9 %) s pozitivním IgG (tab. 1).
U vzorků s pozitivním a hraničním IgG bylo doplněno vyšetření specifických IgA protilátek – ve 3 případech bylo pozitivní, v 1 případě bylo hraniční, ve 2 negativní (tab. 1).
Vyšetření IgG protilátek ve zkoumaných vzorcích bylo provedeno v 5 bězích a pomocí 2 různých šarží soupravy SARS-CoV-2 IgG. Distribuce naměřených dat OD ratio je uvedena v obr. 2. V negativních hodnotách testu je možné rozlišit 2 skupiny dat: Zcela negativní vzorky měly hodnoty OD ratio pod 0,4. Malá část vzorků (12 z 268) měla mírně vyšší hodnoty OD ratio, mezi 0,4 a 0,8. U 9 vzorků s tímto mírně vyšším OD ratio jsme doplnili vyšetření IgA protilátek (tab. 2). V 7 případech bylo IgA negativní, v 1 bylo hraniční a v 1 pozitivní.
Image 2. Distribuce hodnot OD ratio z testu ELISA – SARS-CoV-2 IgG Euroimmun. Zahrnuty jsou výsledky z 268 vyšetření 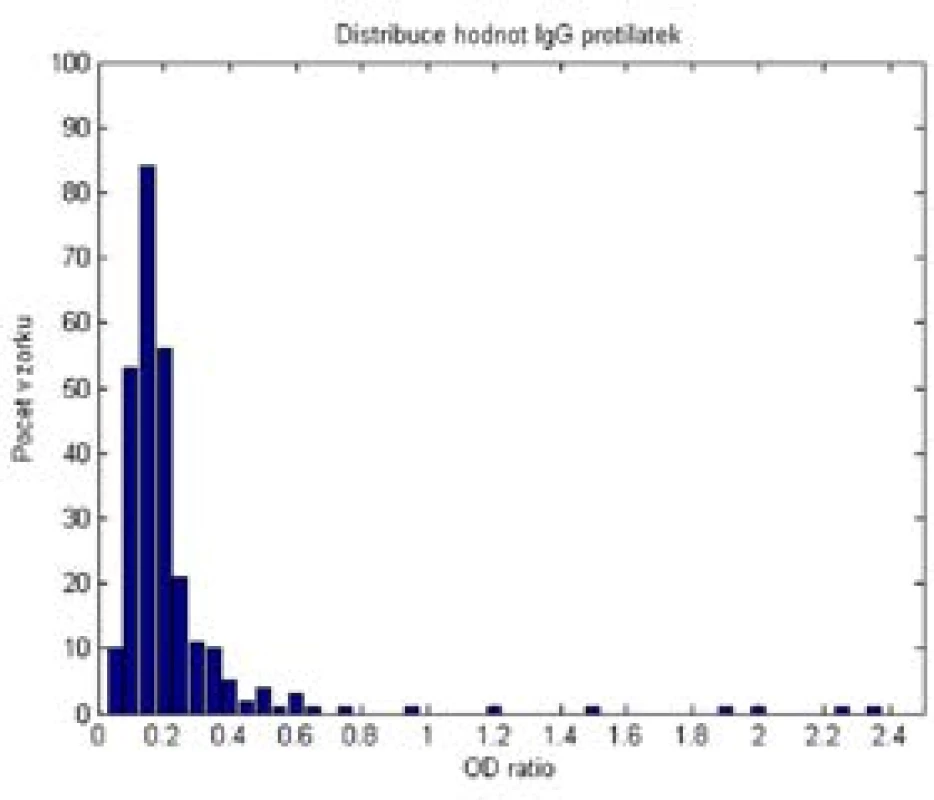
Výsledky PCR vyšetření u osob s pozitivními protilátkami
U osob s pozitivními protilátkami bylo doplněno také PCR vyšetření. V případě osoby 1 (pacient s COVID-19) bylo první kontrolní PCR pozitivní (po 14 dnech od začátku onemocnění) a při opakovaném vyšetření (po 27 dnech) již bylo PCR negativní. U ostatních osob s pozitivními protilátkami (u 5 osob s pozitivním IgG a 1 osoby s pozitivním IgA) bylo PCR negativní (tab. 1).
Vyšetření protilátek rychlotesty
Pacient s COVID-19 (osoba 1) byl testován na přítomnost protilátek celkem 4×, z toho 2× metodou ELISA, která pokaždé vyšla IgG-pozitivní a IgA-pozitivní (z odběrů séra 21 a 27 dní po prvních příznacích). První vzorek séra byl použit také pro verifikaci testu „Rapid Test“ od výrobce AccuBiotech Co Ltd. V něm bylo zjištěno hraniční IgG a silně pozitivní IgM. Po 37 dnech od začátku onemocnění bylo u ošetřujícího lékaře provedeno vyšetření kapilární krve pacienta rychlotestem „RightSign“ od firmy Biotest. Tento test vyšel IgG-pozitivní, IgM-negativní.
Další 2 vzorky od osob 2 a 5 s pozitivním IgG a pozitivním či hraničním IgA byly při vyšetření rychlotestem „Rapid Test“ IgG-negativní a IgM-negativní (tab. 1).
Table 1. Přehled osob s pozitivním nebo hraničním výskytem IgG protilátek 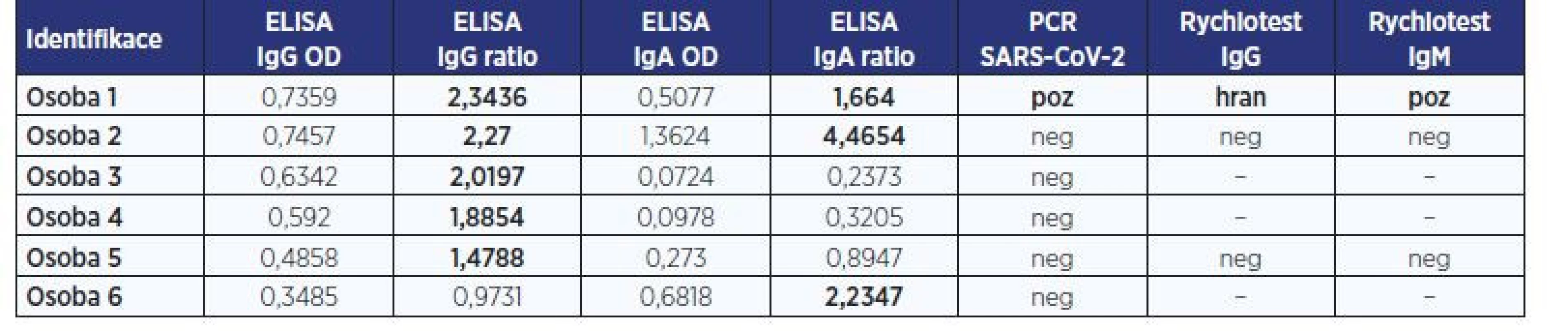
Pozn.: OD – optická denzita; PCR – polymerázová řetězová reakce.
ELISA od firmy Euroimmun, rychlotest od firmy AccuBiotech. Hodnocení testu se provádí semikvantitativně jako poměr (ratio) = OD vzorku / OD kalibrátoru: negativní < 0,8; hraniční 0,8–1,1; pozitivní > 1,1.Table 2. Přehled osob s negativním výskytem IgG protilátek a s vyšetřením IgA 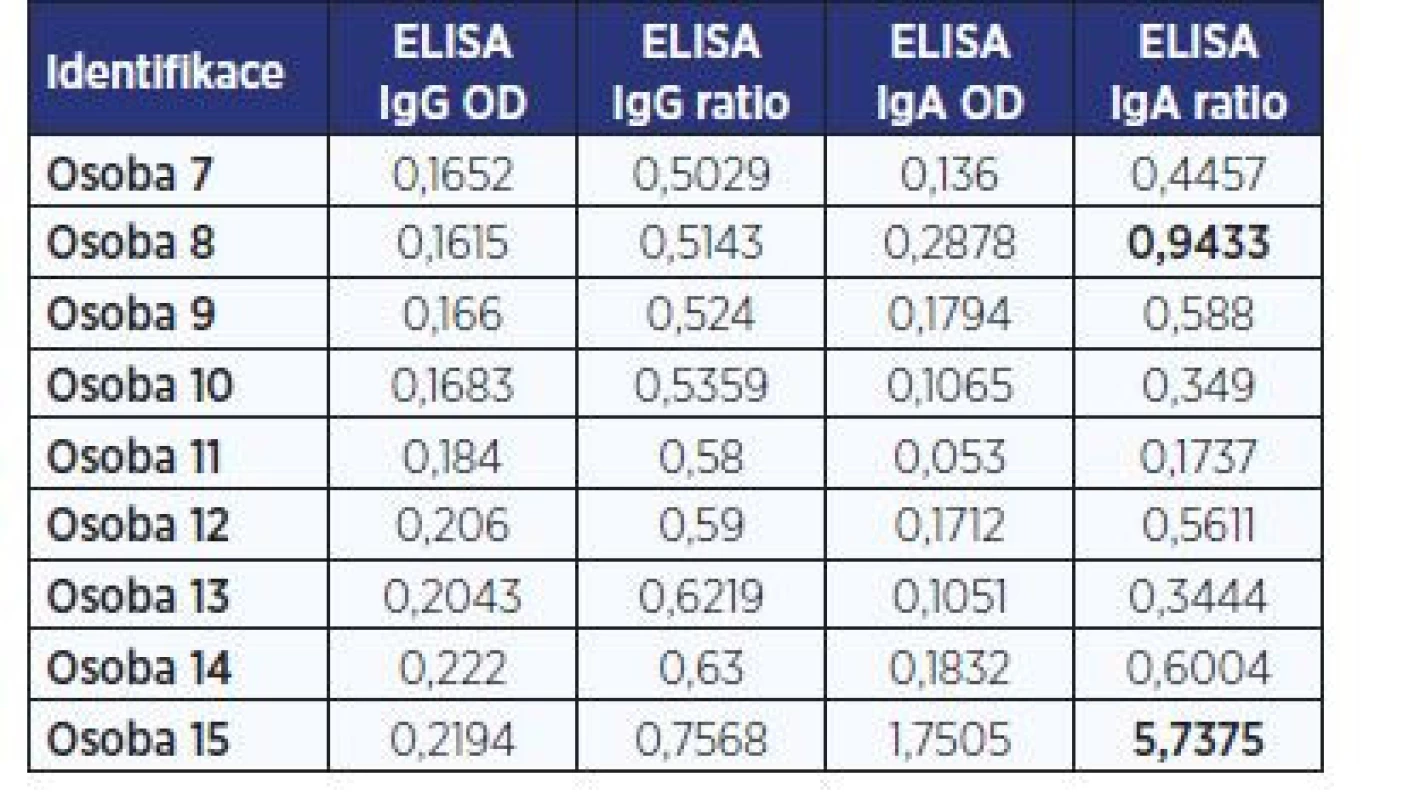
Pozn.: OD – optická denzita; PCR – polymerázová řetězová reakce.
ELISA od firmy Euroimmun. Hodnocení testu se provádí semikvantitativně jako poměr ratio) = OD vzorku / OD kalibrátoru: negativní < 0,8; hraniční 0,8–1,1; pozitivní > 1,1.DISKUSE
Cílem této studie bylo zjistit séroprevalenci zaměstnanců klinik infekcí SARS-CoV-2 po prvních 2 měsících pandemie SARS-CoV-2. Pouze pomocí protilátek není možné detekovat „nemocné osoby“ a „asymptomatické přenašeče“. Obě skupiny lze zjistit jen a pouze za použití PCR detekce viru, ovšem PCR vyšetření není v současné době dostupné, jelikož kapacita laboratoří stačí pouze na testování pacientů s podezřením na COVID-19 a na opakované testování pacientů v rekonvalescenci.
Vyšetření přítomnosti protilátek proti SARS-CoV-2 v séru je dostupnější a k dispozici je široká nabídka vyšetřovacích souprav. Vzhledem ke krátké době, kterou měly firmy na jejich vývoj, není kvalita mnoha nabízených souprav dostatečně otestovaná (7, 10, 11). Na webu www.finddx.org/covid-19 je uveden přehled testů ELISA od 17 výrobců, kterými je možné stanovit hladiny celkových imunoglobulinů i izotypů IgM, IgA nebo IgG (10). 9 výrobců má ELISA testy certifikované CE-IVD. V nabídce tzv. rychlotestů je uvedeno 281 položek, 114 z nich s certifikací CE-IVD. Detekují protilátky IgM, IgG nebo celkové imunoglobuliny.
Zatímco u certifikovaných testů ELISA je informace o vazebném antigenu dohledatelná, u rychlotestů tato informace zpravidla chybí a není jasné, jaké protilátky (tj. proti jakému antigenu) jsou stanovovány. Nejčastěji využívanými antigeny jsou S (spike), M (membrane), N (nucleocapsid) a E (envelope) (7). Specificita i senzitivita testů je ovlivněna právě použitými antigeny. Zorientovat se v této záplavě diagnostik je ovšem obtížné. Dalším problémem je, že chybějí definované hodnoty cut-off.
V současné době již probíhají intenzivní studie, které by měly pomoci ověřit kvalitu diagnostických souprav. Na webových stránkách The Antibody Society je uveden přehled souprav, které jsou v současné době intenzivně testované v USA (11). Další testování souprav je koordinováno ze strany Foundation for Innovative New Diagnostics (FIND: www.finddx.org/covid-19/sarscov2-eval-immuno), která spolupracuje s WHO (12).
V obou verifikačních studiích jsou zahrnuté i ELISA testy firmy Euroimmun, které jsme použili v naší studii (11, 12). Ve studii FIND je zahrnut i Wantai SARS-CoV-2 Ab Rapid Test použitý ke screeningovému vyšetření české populace. Než budou výsledky nezávislých verifikačních testů k dispozici, je jedinou možností jak si ověřit kvalitu souprav provedení vlastních verifikačních experimentů – tedy vyšetření vzorků sér od pacientů různými testy a porovnání zjištěných dat s klinikou a s PCR testy. Chybí nám česká platforma pro sdílení výsledků verifikačních testů diagnostických souprav.
Mezi 268 vyšetřenými osobami byly protilátky (IgG/IgA) proti SARS-CoV-2 zjištěny u 6 osob (2,2 %). Příznaky onemocnění COVID-19 jsou společné i pro mnohá další respirační onemocnění. Shodne-li se klinický obraz a pozitivita protilátek a současně je testovaná osoba již PCR-negativní, pak má dotyčný velkou pravděpodobnost, že patří do kategorie „uzdravený pacient“. V našem souboru byl 1 již dříve potvrzený pacient. Tento muž nebyl v zahraničí, ale import viru z ciziny u něj nelze vyloučit, neboť byl několik dní v kontaktu se skupinou cizinců. Průběh onemocnění u něj odpovídal lehké viróze. Druhá pozitivní osoba byla recepční, která byla na exotické dovolené. Její projevy onemocnění připomínaly spíše cestovatelský průjem. Je třeba zdůraznit, že zatím nevíme s jistotou, zda prodělané onemocnění a přítomnost specifických protilátek u těchto 2 osob znamenají, že budou dostatečně chránění proti reinfekci (7, 11).
U potvrzeného pacienta s COVID-19 byly vyzkoušeny dva různé rychlotesty k průkazu protilátek. Ve všech stanoveních byl detekován IgG, ale IgM byl v jednom rychlotestu pozitivní, zatímco ve druhém negativní. Vzorky dalších 2 osob, které byly IgG-pozitivní v testu ELISA, byly v rychlotestu negativní. Na základě několika vyšetření není možné dělat závěry o kvalitě souprav, nicméně je to reálný příklad ilustrující, proč je nutné verifikovat diagnostické soupravy a vybírat ty kvalitní, které korelují s klinickými nálezy. Na podobná úskalí upozorňují i zahraniční publikace (7).
Pokud má osoba protilátky, ale neměla klinické projevy onemocnění a je PCR-negativní, pak nelze rozlišit, zda jde o falešnou pozitivitu vyšetření protilátek, nebo bezpříznakově prodělaný COVID-19 (7). V našem souboru byly 4 takové osoby. 2 z nich měly pozitivní protilátky IgG i IgA, lze tedy předpokládat, že tyto osoby budou spíše po prodělané infekci. 2 osoby měly pozitivní IgG a negativní IgA, a nelze tedy jednoznačně potvrdit, jestli prodělaly nebo neprodělaly COVID-19. Řešením může být vyšetření protilátek soupravou s jiným specifickým antigenem, případně provedení opakovaných odběrů a sledování kinetiky tvorby protilátek (testem ELISA). Negativní výsledek IgA protilátek může být zjištěn také u pacientů s IgA deficitem, proto je vhodné vyšetřit i celkové IgA.
Na tomto místě je však důležité zmínit, že se může stát, že si osoba při vyplnění dotazníku neuvědomí, že nějaké příznaky měla (situaci podcení). Proto by se organizátor šetření měl při takovémto výsledku s dotyčným spojit a tvrzení si ověřit.
Zajímavé je také, že 3 osoby s pozitivním IgG vycestovaly do zahraničí a navštívily exotické země v Asii, Jižní Americe či v Africe. Nelze vyloučit, že si infekci dovezly ze zahraničí, ale nevíme, zda z navštívených zemí, či zda se nakazili cestou od spolucestujících.
V souboru bylo 6 osob, které vykazovaly příznaky respiračního onemocnění, ale neměly IgG protilátky. Pravděpodobně prodělaly jiné onemocnění, nicméně nelze vyloučit ani COVID-19 (7). Pokud bychom doplnili IgA a v případě jeho pozitivity i PCR, pak bychom věděli více. COVID-19 nelze vyloučit, ani když protilátky chybějí, protože se ukazuje, že někteří pacienti s COVID-19 (PCR-pozitivní, s příznaky onemocnění) nemají protilátky detekovatelné (7, 13). Proč chybějí nebo jsou velmi nízké, zatím neumíme vysvětlit. Možná u nich převažuje jiná imunitní reakce – např. aktivace NK buněk (natural killers) a/nebo dochází k aktivaci cytotoxických T lymfocytů. Obě tyto cesty jsou zcela standardní antivirovou imunitní odpovědí. Výzvou, která před námi v současnosti stojí, je nalézt takové diagnostické testy, které by prokázaly onemocnění COVID rovněž u osob, u nichž protilátky z nějakého důvodu nelze detekovat nebo se netvoří (7).
V našem souboru jsme zaznamenali 147 osob bez klinických příznaků s negativním IgG. Předpokládali jsme, že jde o zdravé osoby. Kdybychom mezi nimi chtěli odlišit zdravé osoby, které se s infekcí nesetkaly, byly by to ty, které by neměly ani IgA protilátky a byly by PCR-negativní. Nicméně bez PCR nejsme schopní zachytit asymptomatické nosiče (7).
Z naší praktické ukázky testování zdravotnického personálu je zřejmé, jak je testování COVID-19 dosud obtížné. Za současné situace, kdy je nízká promořenost populace, má omezený smysl plošně testovat skupiny (zdravotníků, pacientů, jiných pracovních kolektivů), neboť hrozí nepřiměřeně vysoké riziko falešně pozitivních výsledků. Koho tedy má smysl vyšetřovat? Smysl má testování lidí po prodělaném respiračním onemocnění. Smysl má testování rizikových skupin – tedy osob, které byly v kontaktu s nakaženými jedinci (zdravotníci, vysokoškolské koleje, domovy důchodců). Plošné testování celých zdravotnických kolektivů je přínosné buď jednorázově po proběhlé „epidemii na pracovišti“, aby se zjistilo, jak na tom kdo je, nebo případně při další vlně epidemie, až bude promořenost společnosti vyšší.
Hlavním obdobím výskytu méně nebezpečných koronavirů (OC43, 229E, HKU1, NL63) je každoročně prosinec až únor (14). Zatím nevíme, zda se SARS-CoV-2 bude chovat obdobně jako tyto koronaviry a infekce se v zimním období vrátí, nebo zda se podaří SARS-CoV-2 zcela vymýtit, podobně jako došlo k eradikaci SARS a MERS (7, 13). Proto je nezbytné se raději na případnou další vlnu epidemie metodicky připravit.
ZÁVĚR
Správně prováděné testování rizikových skupin na SARS-CoV-2 je jedním z účinných nástrojů ochrany společnosti před šířením onemocnění COVID-19. Diagnostiku tohoto onemocnění zlepšíme pouze tehdy, pokud budeme kvalitně naměřená data společně s klinickými údaji správně vyhodnocovat. Klíčovým úkolem laboratoří je vybrat ze široké nabídky kvalitní diagnostické soupravy a nastavit spolehlivý systém testování. V dohledné době snad budou k dispozici výsledky nezávislých verifikačních studií, jež nám výběr zjednoduší. Je třeba se zaměřit také na jiné typy testů, než je stanovení protilátek, např. na testy buněčné imunity, které zatím pro SARS-CoV-2 chybí.
Může-li něco v této nepřehledné době pomoci, pak je to mezilaboratorní spolupráce, maximální otevřenost a sdílení informací. Pouze na základě spolupráce pracovníků klinických laboratoří, lékařů, výrobců diagnostických souprav a statistiků může dojít k upřesnění našich poznatků, což povede ke zlepšení diagnostiky tohoto onemocnění nejen u pacientů a také při screeningových vyšetřeních rizikových skupin obyvatel.
Poděkování
Studie byla financována společností FUTURE-LIFE a Nadačním fondem IBD-COMFORT.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam zkratek
- CE-IVD in vitro diagnostic medical device
- COVID-19 coronavirus disease 2019
- ELISA enzyme-linked immunosorbent assay
- IgA imunoglobulin A
- IgG imunoglobulin G
- PCR polymerázová řetězová reakce
- PPV pozitivní prediktivní hodnota
- SARS-CoV-2 severe acute respiratory syndrome coronavirus 2
Adresa pro korespondenci:
RNDr. Zuzana Krátká, Ph.D.
Imunologická laboratoř GENNET, s. r. o
Na Poříčí 26, 110 00 Praha 1
Tel.: 242 456 845
e-mail: zuzana.kratka@gennet.cz
Sources
- Pueyo T. Coronavirus: learning how to dance. Part 1: A dancing masterclass, or what we can learn from countries around the world. Medium, 2020 Apr 20. Dostupné na: https://medium.com/@tomaspueyo/coronavirus-learning-how-to-dance-b8420170203e
- Hasell J, Ortiz-Ospina E, Mathieu E et al. Coronavirus (COVID-19) testing. Statistics and Research. Our World in Data, 2020. Dostupné na: https://ourworldindata.org/covid-testing
- ÚZIS ČR. Studie SARS-CoV-2-CZ-Preval. Ústav zdravotnických informací a statistiky ČR, 6. 5. 2020. Dostupné na: https://covid-imunita.uzis.cz/res/file/prezentace/20200506-dusek.pdf
- WHO. Laboratory testing strategy recommendations for COVID-19. Interim guidance. World Health Organization, 2020 Mar 21. Dostupné na: https://apps.who.int/iris/bitstream/handle/10665/331509/WHO-COVID-19-lab_testing-2020.1-eng.pdf
- Xu G, Yang Y, Du Y et al. Clinical pathway for early diagnosis of COVID-19: Updates from experience to evidence-based practice. Clin Rev Allergy Immunol 2020 Apr 24; 1–12, doi: 10.1007/s12016-020-08792-8.
- Bloch EM, Shoham S, Casadevall A et al. Deployment of convalescent plasma for the prevention and treatment of COVID-19. J Clin Invest 2020 Apr 7; 138745, doi: 10.1172/JCI138745.
- Theel ES, Slev P, Wheeler S et al. The role of antibody testing for SARS-CoV-2: Is there one? J Clin Microbiol 2020 Apr 29; JCM.00797-20, doi: 10.1128/JCM.00797-20.
- Fürst T, Strójil J, Šimková H. Velká drogová kocovina. FinMag, 25. 6. 2019. Dostupné na: https://finmag.penize.cz/kaleidoskop/407932-velka-drogova-kocovina
- Okba NMA, Müller MA, Li W et al. Severe acute respiratory syndrome coronavirus 2-specific antibody responses in coronavirus disease 2019 patients. Emerg Infect Dis 2020 Apr 8; 26(7), doi: 10.3201/eid2607.200841.
- FIND. SARS-CoV-2 diagnostic pipeline. Foundation for Innovative New Diagnostics, 2020. Dostupné na: www.finddx.org/covid-19/pipeline/?section=immunoassays#diag_tab
- Goodman SL. Coronavirus in the crosshairs, Part 7: Diagnostic tests. The Antibody Society, 2020 Apr 28. Dostupné na: www.antibodysociety.org/uncategorized/coronavirus-in-the-crosshairs-part-7-diagnostic-tests
- FIND. FIND evaluation update: SARS-CoV-2 immunoassays. Foundation for Innovative New Diagnostics, 2020. Dostupné na: www.finddx.org/covid-19/sarscov2-eval-immuno
- Li X, Geng M, Peng Y el al. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal 2020 Mar 5, doi: 10.1016/j.jpha.2020.03.001.
- Monto AS, DeJonge PM, Callear AP et al. Coronavirus occurrence and transmission over 8 years in the hive cohort of households in Michigan. J Infect Dis 2020 Apr 4; jiaa161, doi: 10.1093/infdis/jiaa161
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Nový koronavirus (SARS-CoV-2) a onemocnění COVID-19
- Aktuální problematika COVID-19 z pohledu imunologa
- Testování COVID-19 – co bychom měli mít na paměti
- O lékařském tajemství (nejen) za časů koronaviru
- Genetické mechanismy stárnutí
- Molekulárně genetický pohled na podstatu buněčné senescence v kontextu stárnutí organismu
- Eutanázie v zajetí věcných omylů a falešných argumentačních strategií
- Za prof. Milanem Šamánkem
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Testování COVID-19 – co bychom měli mít na paměti
- Nový koronavirus (SARS-CoV-2) a onemocnění COVID-19
- Genetické mechanismy stárnutí
- Molekulárně genetický pohled na podstatu buněčné senescence v kontextu stárnutí organismu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

