-
Medical journals
- Career
Spánková apnoe a kardiovaskulární onemocnění
: Ondřej Ludka
: Mezinárodní centrum klinického výzkumu, FNUSA, Brno ; I. interní kardioangiologická klinika LF MU a FN u sv. Anny, Brno
: Čas. Lék. čes. 2019; 158: 178-184
: Review Article
Spánek je pro kardiovaskulární systém stavem fyziologického oddechu a poruchy dýchání ve spánku tento stav narušují. Opakující se epizody spánkové apnoe pak narušují fyziologické interakce mezi spánkem a kardiovaskulárním systémem. Spánková apnoe může ovlivnit nejen kvalitu život pacientů s kardiovaskulárními onemocněními, ale i jejich morbiditu a mortalitu. Spánková apnoe se tak stává významným ovlivnitelným rizikovým faktorem v kardiologii.
Klíčová slova:
spánková apnoe – poruchy dýchání ve spánku
ETIOPATOGENEZE SPÁNKOVÉ APNOE
Mezi nejčastější poruchy dýchání ve spánku (SDB) patří spánková apnoe (SA), kterou můžeme dále dělit na obstrukční (OSA) a centrální (CSA) (obr. 1 a 2). Zatímco CSA se vyskytuje především u pacientů se srdečním selháním (SS), OSA je častější u pacientů s hypertenzí, ischemickou chorobou srdeční (ICHS), arytmiemi a cévní mozkovou příhodou (CMP).
1. Obstrukční spánková apnoe (OSA) a obstrukční hypopnoe 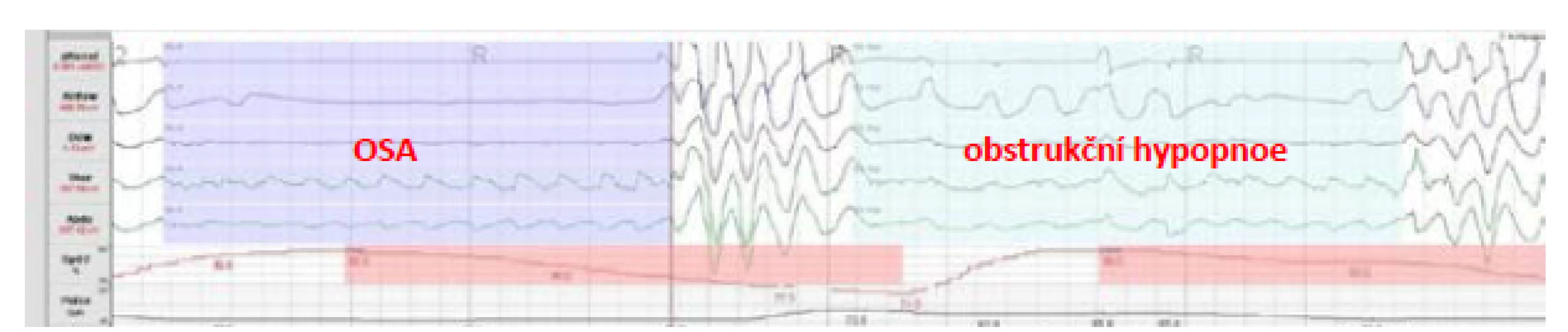
2. Centrální spánková apnoe (CSA) 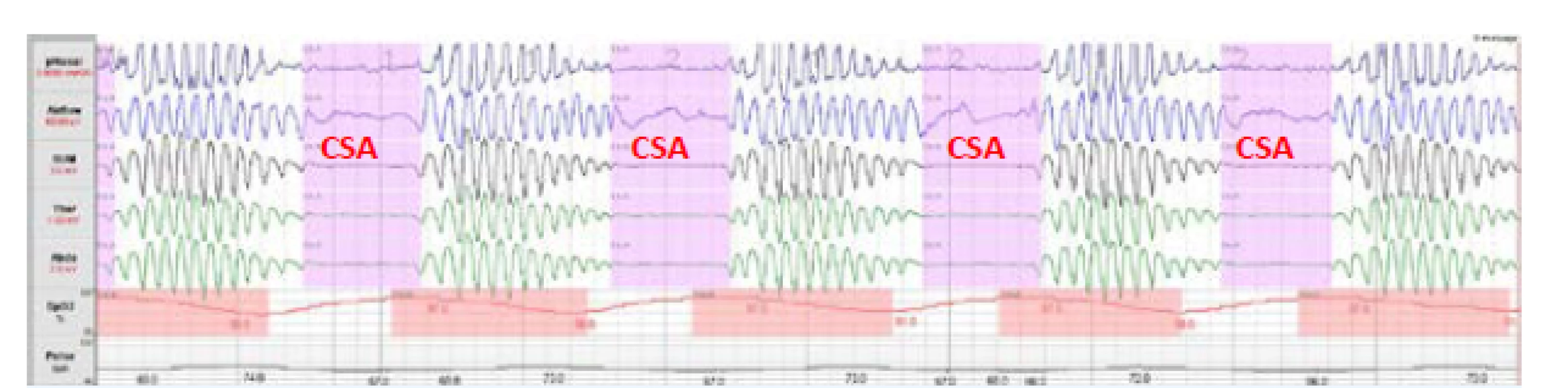
3. Cheyneovo-Stokesovo dýchání (CSR) 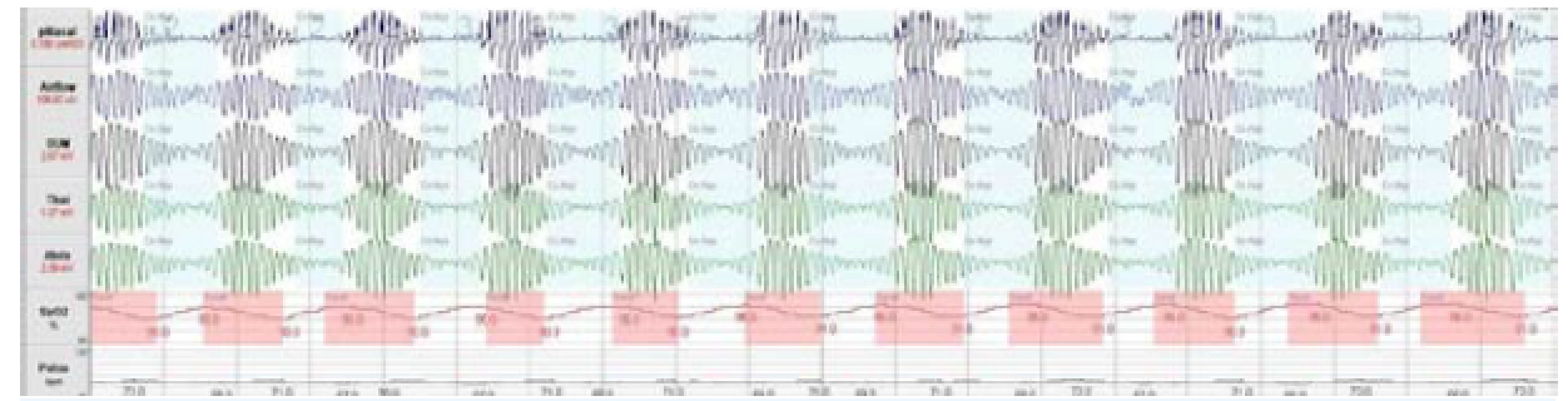
OSA je vyvolaná zúžením horních cest dýchacích ve spánku. I když v její patogenezi sehrává hlavní úlohu funkce svalů horních cest dýchacích (HCD), respektive snížená aktivita inspiračních svalů, na zmenšení průchodnosti HCD se mohou podílet i faktory jako anatomické anomálie jazyka, patra či faryngu, otok HCD nebo obezita. Mezi další rizikové faktory patří věk, mužské pohlaví a abúzus léků (zejména hypnotik), drog a alkoholu. OSA je tedy dána primárně kolapsem HCD při zachovaném dechovém úsilí, kdy se dýchací svaly snaží překonat odpor dýchacích cest zúžených (přičemž vzniká hypopnoe) nebo úplně uzavřených (přičemž vzniká apnoe).
V klinické praxi je nutné rozlišovat mezi OSA jako laboratorní diagnózou a syndromem obstrukční spánkové apnoe (OSAS), který je charakterizován AHI > 5/hod a zároveň současnou přítomností nadměrné denní spavosti, která není vysvětlitelná jinými příčinami a/nebo 2 či více z níže uvedených klinických příznaků.
K CSA dochází v důsledku přechodného zastavení respirační aktivity dechového centra v mozku, což vede k úplné zástavě dechových pohybů. Klíčovou úlohu při vzniku CSA sehrává nedostatečná stimulace dechového centra pomocí CO2, k čemuž může dojít v důsledku dvou zcela protichůdných mechanismů. A sice při poruše funkce dechového centra, přičemž dochází k alveolární hypoventilaci a hyperkapnii v průběhu spánku i bdění, nebo při hypokapnii v důsledku alveolární hyperventilace, tedy ke stavu, kdy je PaCO2 pod úrovní apnoického prahu. Přítomnost hypokapnického typu CSA je charakteristická pro pacienty se srdečním selháním. Typickým obrazem dýchání ve spánku u většiny pacientů s hypokapnickou CSA, a tedy i u pacientů se srdečním selháním je periodické Cheyneovo-Stokesovo dýchání (CSR) charakterizované pravidelnými crescendo-decrescendovými oscilacemi dechového objemu (obr. 3). Základním faktorem, který vyvolává hyperventilaci, je dysfunkce levé komory srdeční a stáza v malém oběhu (1). CSR-CSA je tedy na rozdíl od OSA spíše důsledkem než příčinou dysfunkce levé komory.
KLINICKÝ OBRAZ
Mezi nejčastější noční příznaky SA patří partnerem pozorovaná apnoe, chrápání, pocit dušení, epizodická dušnost, lapavé dechy, opakované probouzení ze spánku, neklidné nohy, nykturie, pocení a gastroezofageální reflux. Mezi nejčastější denní příznaky patří výrazná denní spavost, únavnost, ranní cefalea, poruchy koncentrace, pokles libida, impotence, změny osobnosti a deprese.
DIAGNOSTIKA
V rámci diagnostického postupu je důležitá nejen anamnéza, ale též objektivní vyšetření včetně stanovení obvodu krku, body mass indexu a podrobného vyšetření HCD. V rámci diagnostiky využíváme některé standardizované dotazníky jako např. Epworthskou škálu spavosti (ESS). Oxymetrie v průběhu noci může být použita jako screeningová metoda, neboť SA vede v průběhu spánku k desaturacím, neslouží však v žádném případě jako diagnostická metoda.
Zlatým standardem v diagnostice poruch dýchání ve spánku stále zůstává polysomnografie (PSG) prováděná ve spánkové laboratoři. PSG je však ekonomicky náročná a mnohdy i nedostupná, proto se v praxi v diagnostice využívá i jednodušší metoda, kterou je limitovaná polygrafie. Výhodou tohoto vyšetření je jeho dostupnost a možnost provádět jej i v domácích podmínkách.
TERAPIE
Léčba OSA je zaměřená především na stabilizaci dýchacích cest a tím na zabránění jejich kolapsu. Využívají se režimová opatření, mezi něž patří redukce hmotnosti, změna polohy těla ve spánku (vyvarování se spánku na zádech) a vyvarování se alkoholu, myorelaxancií a sedativ před spánkem. Pacienty, většinou s lehkým stupněm OSA, můžeme léčit pomocí různých ústních zařízení a protéz (obr. 4) nebo využít léčbu chirurgickou. Mezi chirurgické metody léčby OSA patří především ORL zákroky a bariatrické operace.
Naprostá většina nemocných se středně těžkou a těžkou OSA však vyžaduje léčbu pomocí noční neinvazivní ventilace s použitím kontinuálního (CPAP) či dvojúrovňového (BPAP) přetlaku v dýchacích cestách nebo jiného neinvazivního ventilačního režimu v závislosti na komorbiditách, typu a tíži poruch dýchání ve spánku. Část pacientů ovšem tuto přetlakovou ventilaci netoleruje a u nich pak můžeme vyzkoušet stimulaci n. hypoglossus (UAS – upper airway stimulation).
V léčbě CSA-CSR se využívají různé typy noční neinvazivní ventilace. Základem terapie CSA u pacientů se SS je především intenzivní režimová a farmakologická léčba základního onemocnění. Ke zlepšení CSA vede i aerobní trénink, srdeční resyn
chronizační terapie, implantace mechanických srdečních podpor nebo transplantace srdce. Ventilační léčba CSA může být u nemocných se SS spojena se zhoršením prognózy. U pacientů s ejekční frakcí levé komory (EF LK) > 45 % můžeme využít i adaptivní servoventilaci (ASV).
OSA A KARDIOVASKULÁRNÍ ONEMOCNĚNÍ
Klinické studie přinesly přesvědčivé důkazy o souvislostech mezi SA a rizikem kardiovaskulární morbidity a mortality. SA je modifikovatelným rizikovým faktorem, přičemž léčba může vést např. k redukci časných známek endotelové dysfunkce a aterosklerózy, ke snížení krevního tlaku, nefatálních kardiovaskulárních příhod a mortality související s KVO (2). Přitom až 85 % pacientů s klinicky významnou a léčitelnou OSA nikdy nebylo diagnostikováno ani léčeno.
Prevalence OSA u pacientů s KVO
OSA se v běžné vyskytuje populaci relativně často a je přítomná u 22 % mužů a 17 % žen (3). U pacientů s KVO je prevalence 2–3× vyšší než v běžné populaci, přičemž 30 % pacientů má přítomnou klinicky významnou (středně těžkou a těžkou) formu OSA. Pacienti s OSA mají ale na druhou stranu častěji hypertenzi, ICHS, cévní mozkové příhody či jiná KVO (4). Zatím ovšem není jasné, zda se jedná o přímý vliv OSA na výskyt těchto onemocnění, nebo jde jen o vliv podobných rizikových faktorů na rozvoj těchto onemocnění (mužského pohlaví, věku, nadváhy, centrální depozice tuku, alkoholu, kouření, nedostatku tělesné aktivity).
Patofyziologické souvislosti mezi OSA a KVO
U pacientů s OSA vedou opakované hypoxemie, reoxygenace, retence CO2, probouzecí reakce (arousal) a změny nitrohrudního tlaku v průběhu spánku k aktivaci sympatiku, endotelové dysfunkci, uvolnění vazoaktivních substancí, aktivaci systémového zánětu, hyperkoagulaci, oxidativnímu stresu a metabolickým změnám, jakými jsou inzulinová a leptinová rezistence a obezita. Tyto nepříznivé vlivy pak mohou vést ke vzniku hypertenze, ischemické choroby srdeční, cévní mozkové příhody, arytmiím nebo k srdečnímu selhání. OSA hraje svou roli rovněž u některých vzácnějších KVO, jako jsou hypertrofická kardiomyopatie nebo prekapilární plicní hypertenze.
OSA a systémová hypertenze
OSA je nezávislým rizikovým faktorem rozvoje hypertenze. Hypertenze se vyskytuje u 50–70 % nemocných s OSA, na druhou stranu přibližně 30–40 % nemocných s hypertenzí trpí OSA (5). U pacientů s farmakologicky rezistentní hypertenzí dosahuje prevalence OSA dokonce 80–94 % (6). OSA v současné době patří mezi identifikovatelné příčiny hypertenze a taktéž nejčastější příčiny sekundární hypertenze. Pacienti s hypertenzí, ale i bez ní, u kterých v průběhu noci nedochází k poklesu krevního tlaku, mají vyšší riziko výskytu OSA (7). Na základě těchto důkazů by měli být na přítomnost OSA vyšetřeni zvláště pacienti s rezistentní hypertenzí, s hypertenzí v průběhu spánku a hypertonici, u kterých nedochází k poklesu tlaku v nočních hodinách (non-dipper).
U pacientů s OSA vede k hypertenzi především zvýšená aktivita SNS, dysfunkce endotelu a zvýšení hladin endotelinu a aktivace RAAS. Při neléčené OSA dochází ke vzniku strukturálních cévních změn s proliferací hladké svaloviny a vaziva a tím k fixaci hypertenze. Strukturální změny taktéž postihují myokard.
Terapie pomocí CPAP snižuje zvýšený krevní tlak a sympatickou aktivitu asociovanou s OSA v průběhu noci. Na základě výsledků mnoha studií lze říci, že terapie OSA pomocí CPAP má na výšku krevního tlaku mírný, ale dle některých studií signifikantní vliv. Efekt terapie je větší u pacientů s těžkým stupněm OSA, bez nočního poklesu tlaku, s obtížně kontrolovanou hypertenzí a u nemocných, kteří mají vyšší adherenci k terapii (8). Léčbu pomocí CPAP bychom měli zahájit u všech hypertoniků se středně těžkou a těžkou OSA, neboť i když nedojde k signifikantnímu poklesu TK, vede tento postup nejen ke zlepšení kvality života a zároveň může snížit či oddálit riziko vzniku závažných kardiovaskulárních komplikací.
Léčba OSA musí být vždy provázena adekvátní farmakoterapií a režimovými opatřeními. Za nejúčinnější antihypertenziva jsou u pacientů s OSA považovány betablokátory, zejména lipofilní s dlouhodobým účinkem.
OSA a ischemická choroba srdeční (ICHS)
Prevalence OSA u nemocných s ICHS přesahuje 60 %, u pacientů po akutním infarktu myokardu je to v naší populaci na dosud největším publikovaném souboru na světě 66 % (polovina má klinicky významnou formu OSA) (9), přičemž celosvětový průměr činí dle nedávno publikované metaanalýzy 69 % (10). OSA však u těchto pacientů, tak jako je tomu v běžné populaci, zůstává často nediagnostikována. Na druhou stranu mají pacienti s OSA vyšší incidenci ICHS než pacienti bez OSA. Dle Sleep Heart Health Study je OSA nezávislým rizikovým faktorem rozvoje ICHS s relativním rizikem 1,27.
Mezi klíčové mechanismy, kterými OSA stimuluje aterogenezi patří hypoxií indukovaná aktivace zánětlivé odpovědi a metabolické účinky aktivace SNS spouštějící kaskádu metabolických dějů, které vedou ke zvýšení hladin krevních lipidů a rozvoji aterosklerózy. Značný význam v procesu aterogeneze má i toxický vliv cirkulujících katecholaminů na endotel koronárních tepen. U akutních koronárních syndromů (AKS) se navíc přidávají hemodynamické změny, zejména nárůst afterloadu na konci OSA (nárůst spotřeby kyslíku myokardem) a změny koronárního průtoku v průběhu OSA (pokles v průběhu apnoe a následný vzestup po obnovení dýchání). K těmto mechanismům se u AKS přidává i zvýšená aktivita a agregabilita trombocytů.
Část pacientů s ICHS má v důsledku OSA změněný diurnální rytmus epizod anginy pectoris s maximem v nočních hodinách a lze u nich probouzecími reakcemi vyvolat deprese segmentů ST na EKG (11). Přítomnost OSA má též vliv na výskyt závažných nežádoucích kardiovaskulárních příhod (MACE – major adverse cardiac events), jakými jsou např. úmrtí z kardiální příčiny, reinfarkt či rePCI (12).
Naše studie SAPAMI rovněž ukázala, že pacienti se středně těžkou a těžkou OSA mají relativně vyšší výskyt NSTEMI oproti STEMI. Tato skutečnost je vysvětlitelná možným efektem ischemického preconditioningu, který může být způsoben opakovanými epizodami hypoxemie v průběhu OSA (13).
Užití CPAP vede nejen k poklesu hladin CRP, IL-6 a endotelinu 1, ale taktéž ke snížení frekvence depresí segmentů ST v průběhu spánku a ke snížení epizod noční anginy pectoris (14). Tato léčba vede rovněž k poklesu morbidity a mortality – může pomoci redukovat úmrtí z kardiovaskulárních příčin, akutních koronárních syndromů, hospitalizací pro srdeční selhání a taktéž nutnost revaskularizace (15). Přidání CPAP ke standardní terapii nevedlo ve studii SAVE (The Sleep Apnea cardioVascular Endpoints study), která hodnotila vliv léčby středně těžké a těžké OSA pomocí CPAP na morbiditu a mortalitu u pacientů s koronárním nebo cerebrovaskulárním onemocněním, k redukci KV událostí. Tato studie ukázala neutrální efekt léčby OSA na KV morbiditu a mortalitu, zlepšila se ale nálada či kvalita života pacientů. Studie však měla celou řadu limitací – např. využití pouze screeningové metody ke stanovení diagnózy OSA a indikace k léčbě, krátká průměrná doba užití CPAP a vyloučení pacientů s těžkou denní spavostí nebo s těžkými desaturacemi v průběhu spánku (16). Dle poslední publikované metaanalýzy, která zahrnula 7 observačních a 2 randomizované klinické studie, vedla léčba pomocí CPAP k signifikantnímu poklesu MACE, celkové mortality, úmrtí z KV příčiny a reIM jen v observačních studiích (17). Otázka vlivu léčby OSA na morbiditu a mortalitu pacientů s ICHS tak stále zůstává otevřená.
OSA a arytmie
Vztah mezi OSA a arytmiemi byl popsán již v roce 1983, kdy byl ve sledovaném souboru 400 pacientů s OSA zaznamenán výskyt nesetrvalých komorových tachykardií (NSKT), poruch sinusového uzlu (SSSy), atrioventrikulárních blokád (AVB) II. stupně a komorových extrasystol (KES) (18). OSA tedy může prostřednictvím řady patofyziologických mechanismů přispívat ke vzniku prakticky jakékoli arytmie (tachy - či bradyarytmie), včetně život ohrožujících poruch srdečního rytmu, a tím i ke zvýšení rizika náhlé srdeční smrti.
U predisponovaných jedinců může hypoxie v průběhu OSA vyvolat interakce mezi chemo - a baroreceptory s následnou aktivací vagu, což může vést ke kterémukoli typu bradykardie. Prevalence sinusové zástavy (SA) a AVB II. a III. stupně je dle některých studií vyšší u pacientů s OSA než u těch bez OSA. Analýza dat ze Sleep Heart Health Study nicméně nepotvrdila významný rozdíl v prevalenci SA, AVB I. stupně, II. stupně 1. typu a II. stupně 2. typu mezi pacienty s těžkým stupněm SDB a těmi bez SDB (19). The European Multicentre Polysomnographic Study pak prokázala poměrně vysokou prevalenci OSA u pacientů po implantaci kardiostimulátoru (20). Závěry výše uvedených studií jsou tedy do jisté míry nejednotné.
Na možnost přítomnosti OSA je v současné době zapotřebí myslet zejména u pacientů s nočním výskytem symptomatických bradyarytmií. Dle některých studií je terapie OSA pomocí CPAP spojena se signifikantním poklesem výskytu bradyarytmií, či dokonce s významným poklesem všech arytmií (21). Na druhou stranu randomizovaná kontrolovaná studie, která se zabývala vlivem 4týdenní terapie pomocí CPAP, již tento příznivý efekt neprokázala (22). V současné době jsou tedy zapotřebí další klinické studie k průkazu eventuálního příznivého vlivu terapie pomocí CPAP u pacientů s OSA na výskyt arytmií, zejména bradyarytmií.
Nejčastější supraventrikulární arytmií s nepříznivou prognózou, která je dána především vyšším výskytem cévních mozkových příhod, je fibrilace síní. Prevalence OSA se u pacientů s fibrilací síní pohybuje v rozmezí 32–49 % (23). Studie, jež zahrnula přes 3500 nemocných z Olmsted County v Minnesotě, kteří podstoupili polysomnografické vyšetření a neměli anamnézu fibrilace síní, prokázala, že tíže noční hypoxemie je nezávislým prediktorem vzniku fibrilace síní, ale pouze u osob mladších 65 let (24). Několik studií taktéž ukázalo vyšší prevalenci fibrilace síní u nemocných s chronickým srdečním selháním se spánkovou apnoí, zejména CSA. OSA je taktéž nezávislým prediktorem recidivy fibrilace síní po úspěšné radiofrekvenční ablaci (25). Příznivý efekt terapie pomocí CPAP na rekurenci fibrilace síní v průběhu 1 roku po úspěšné kardioverzi byl popsán v prospektivní studii, která ukázala přibližně dvojnásobné riziko rekurence fibrilace síní u neléčených pacientů (26). Remodelace síní, hemodynamické a autonomní změny, intermitentní hypoxemie a zánět asociovaný s OSA mohou zvyšovat riziko vzniku fibrilace síní a uplatňovat se tak v patofyziologii vzniku fibrilace síní u pacientů s OSA. Toto zvýšené riziko je ovšem závislé i na věku, obezitě, diabetu mellitu, hypertenzi, srdečním selhání a nemoci koronárních tepen.
Mnoho prací poukazuje na vyšší prevalenci komorových arytmií u pacientů s OSA oproti těm bez OSA (27). Například komorová ektopie byla pozorována u 74 % pacientů s OSA a komplexní komorová ektopie (polymorfní, repetitivní) u 55 % pacientů s OSA (28). V této práci byla pozorována souvislost mezi výskytem KES a saturací krve kyslíkem. Analýza Sleep Heart Health Study prokázala vyšší výskyt nesetrvalých komorových tachykardií (NSKT) a komplexních komorových ektopií u pacientů s těžkým stupněm SDB oproti těm bez SDB. Tato studie taktéž dokázala zvýšený výskyt NSKT po apnoické/hypopnoické epizodě (29). U pacientů se sníženou funkcí levé komory srdeční, se závažnou OSA a s již dřívějšími projevy komorových ektopií při Holterově monitorování se KES vyskytují častěji v návaznosti na apnoické pauzy než v jiných obdobích respiračního cyklu (30). Na druhou stranu u pacientů s CSA se tyto předčasné KES vyskytují až v průběhu hyperpnoické fáze. Souvislost mezi SDB a komorovými arytmiemi byla potvrzena u pacientů s chronickým srdečním selháním (CHSS) 6 měsíců po implantaci srdeční resynchronizační terapie společně s implantabilním kardioverterem-defibrilátorem (CRT-D). OSA i CSA byla v této práci nezávislým rizikovým faktorem pro výskyt komorových arytmií (31). Neléčená OSA je spojena se signifikantním zvýšením rizika náhlé srdeční smrti (NSS), zejména však u pacientů s desaturací < 78 %. U neléčených nemocných s OSA docházelo k NSS zejména v nočních hodinách (32).
SDB a cévní mozkové příhody (CMP)
Prevalence SDB u pacientů po cévní mozkové příhodě kolísá mezi 41 a 91 % dle zvoleného cut-off AHI a dle doby od vzniku cévní mozkové příhody (33). U pacientů po CMP, podobně jako u těch po IM, převažuje OSA nad CSA. Akcelerace aterosklerózy, hypertenze, zvýšená prevalence fibrilací síní či prokoagulační efekt jsou faktory, kterými může OSA zvýšit riziko vzniku CMP. Určitou roli v patogenezi vzniku CMP mohou hrát i akutní hemodynamické změny v důsledku poklesu srdečního výdeje, intrakraniálního steal fenoménu nebo zvýšení nitrolebního tlaku v průběhu apnoe. Ke vzniku CMP může taktéž dojít v důsledku paradoxní embolie přes patentní foramen ovale v průběhu OSA, kdy se vlivem již dříve popisovaných změn v nitrohrudním tlaku může změnit původně levopravý tok na pravolevý. SDB ovšem mohou vznikat i jako následek CMP, zejména těch, které postihují mozkový kmen a hlavové nervy, v důsledku poruch řízení dýchání a poruch řízení svalového tonu HCD.
Jako nejpravděpodobnější se v současné době jeví teorie preexistující SDB jako významného rizikového faktoru pro vznik CMP společně s možností vzniku či zhoršení SDB v rámci nově vzniklé CMP. Preexistující těžká OSA je tak významným prediktorem rizika vzniku CMP a u pacientů, kteří přežili akutní CMP, může neléčená OSA zhoršovat nejen prognózu, ale i hybnost a kognitivní funkce. I přes výsledky studie SAVE se vzhledem k výše uvedeným poznatkům stále doporučuje u pacientů po CMP provádět aktivní screening na přítomnost SDB, a pokud jsou přítomné středně těžké a těžké formy, je třeba včas zahájit jejich léčbu.
SDB a chronické srdeční selhání (CHSS)
Prevalence SDB u pacientů s CHSS kolísá dle různých prací mezi 51 a 88 %. CSA, která vede ke zvýšené neurohumorální aktivaci, vyšší náchylnosti k nočním komorovým arytmiím a je nezávislým rizikovým faktorem mortality, trpí 9–40 % nemocných s CHSS. Tento vysoký rozptyl je primárně dán skutečností, že frekvence výskytu CSA významně souvisí s tíží srdečního selhání. Prevalence OSA dosahuje u nemocných s CHSS 22–62 %. OSA se často vyskytuje u pacientů s CHSS v kombinaci s CSA. OSA bývá přítomná zejména v první polovině noci (vliv přesunu tekutiny po ulehnutí z dolní do horní poloviny těla), zatímco CSA se vyskytuje hlavně ve druhé polovině noci (vliv zvýšení tlaku v zaklínění). Pacienti s neléčenou OSA jsou tak typicky přijímáni pod obrazem plicního edému zejména v nočních hodinách. Pacienti s CHSS a neléčenou OSA mají vyšší riziko progrese srdečního selhání do jeho terminálních forem, vyšší riziko vzniku arytmických komplikací, horší neurohumorální profil a prognózu. OSA tak má u pacientů s CHSS stejné zákonitosti i důsledky jako u jiných nemocných s KVO, proto se nadále budeme věnovat zejména CSA-CSR.
SDB se vyskytují u srdečního selhání jak se sníženou systolickou funkcí levé komory (HFrEF), tak se zachovanou systolickou funkcí (HFpEF). U pacientů s HFpEF je prevalence podobně vysoká jako v případě s HFrEF. Mechanismy, kterými se OSA podílí na vzniku diastolické dysfunkce a její progresi do HFpEF nejsou zatím zcela jasné. Na vzniku a rozvoji diastolické dysfunkce se může podílet toxické působení dlouhodobě zvýšených hladin katecholaminů na myokard, hypoxický stres myokardu, akutní změny v morfologii srdečních dutin v průběhu OSA či strukturální změny srdce. U pacientů s CHSS se taktéž jako u jiných KVO setkáváme s poddiagnostikovaností SDB. U těchto pacientů se na tom může podílet i relativní nedostatek typických symptomů pro toto onemocnění, respektive jejich překryv se symptomy srdečního selhání.
V patofyziologii CSA se krom změněné senzitivity chemoreceptorů související s poklesem srdečního výdeje uplatňuje zejména zvýšený tlak v zaklínění, tedy městnání v malém oběhu, kdy je CSA-CSR spouštěna s největší pravděpodobností na základě aktivace nízkotlakých baroreceptorů v okolí plicních kapilár. Prevalence CSA-CSR narůstá s tíží srdečního selhání a její výskyt je asociován s horší prognózou i u lehkých forem onemocnění (34–36). CSA-CSR je tak významným faktorem, který nejen ovlivňuje patofyziologii srdečního selhání, ale také akceleruje progresi srdečního selhání a významně tak ovlivňuje prognózu pacientů. I ve specializovaných centrech pro diagnostiku a léčbu srdečního selhání je však diagnostice CSA-CSR věnována poměrně malá pozornost, a to i přes skutečnost, že hodnocení přítomnosti CSA-CSR může být jedním z důležitých faktorů ve stratifikaci rizika a určení prognózy pacientů, zejména ve vztahu k dostatečně včasné indikaci specifických forem léčby srdečního selhání, jakými jsou srdeční resynchronizační terapie (CRT), mechanické srdeční podpory (VAD) či srdeční transplantace (OTS).
V oblasti terapie CSA-CSR platí, že nejúčinnějším postupem je správná léčba srdečního selhání využívající všechny poznatky současné farmakoterapie či nefarmakologické léčby srdečního selhání. Významné zlepšení CSA-CSR přinášejí jak CRT, tak i mechanické VAD, a to primárně na základě zlepšení systémové i plicní hemodynamiky. K úplnému vymizení CSA-CSR dochází po OTS. Tam, kde tato terapie nestačí, jsou v léčbě SDB zkoušeny různé typy přetlakové ventilace. U pacientů s CHSS a OSA, kteří byli léčeni pomocí CPAP, došlo oproti kontrolám ke zvýšení EF LK a ke zlepšení ve funkční třídě NYHA (37). Nadějnou studií u pacientů s CHSS byla CANPAP, jež však musela být předčasně ukončena pro časný vzestup mortality u pacientů léčených pomocí CPAP. Limitací této studie byly reziduální hodnoty AHI při léčbě (19/hod, tedy velmi neuspokojivé). Post hoc analýza ukázala, že CPAP může snížit mortalitu u nemocných s CHSS a EF LK < 40 %, pokud bude hodnota AHI při léčbě < 15/hod (38). Léčba OSA pomocí CPAP může také vést ke zlepšení diastolické dysfunkce a představuje tak novou nadějnou terapii pro léčbu HFpEF u pacientů s konkomitantně přítomnou OSA.
Některé menší studie ukázaly, že v léčbě nemocných s CHSS a SDB má větší efektivitu při léčbě CSA-CSR ASV než CPAP, že pacientům s CHSS lépe vyhovuje a že ji nemocní s CHSS preferují před léčbou pomocí CPAP či BPAP (39). Menší randomizované klinické studie u pacientů s CHSS a CSA-CSR ukazují snížení AHI, NT-proBNP a NYHA a naopak zlepšení 6MWD a EF LK u pacientů léčených pomocí ASV. Léčba pomocí ASV u nemocných s CHSS a CSA-CSR byla taktéž spojena se snížením mortality (40). U pacientů s CHSS se navíc často vyskytuje CSA společně s OSA a ASV je schopna úspěšně odstranit jak centrální, tak obstrukční formy spánkové apnoe.
Tyto poznatky vedly k tomu, že byla zahájena velká multicentrická randomizovaná paralelní event-driven designovaná studie SERVE-HF (Treatment of Sleep-Disordered Breathing with Predominant Central Sleep Apnea by Adaptive Servo Ventilation in Patients with Heart Failure and Reduced Ejection Fraction) srovnávající kontrolní skupinu (na optimální léčbě) s aktivně léčenou skupinou (na optimální léčbě + ASV). Cílem studie bylo zjistit vliv léčby poruch dýchání ve spánku s predominancí centrální spánkové apnoe pomocí ASV u pacientů se srdečním selháním s EF LK ≤ 45 % na přežití a kardiovaskulární výsledky. Primární cíl dopadl neutrálně. Bohužel však byl ve skupině léčené pomocí ASV zaznamenán nárůst úmrtí ze všech příčin (poměr rizik [HR] 1,28; p = 0,01) a také došlo k signifikantnímu nárůstu úmrtí z KV příčin (HR 1,34; p = 0,006). Z analýzy podskupin vyplývá, že z terapie pomocí ASV profitovali ti pacienti, kteří měli nižší výskyt CSR (< 20 %), a ti s vyšší EF LK (≥ 30 %) (41).
Nemocní s HFrEF s predominancí CSA by tedy neměli ASV používat, přesněji řečeno, terapie pomocí ASV je u nich nyní kontraindikovaná. U všech pacientů, kterým je plánována terapie pomocí ASV, je třeba posoudit riziko přítomnosti srdečního selhání a v případě příznaků a projevů srdečního selhání je nutno provést objektivní zhodnocení EF LK. Je však třeba upozornit, že studie nezahrnovala osoby s CSA bez srdečního selhání nebo s HFpEF, pacienty s převládající OSA a žádné další způsoby léčby (např. CPAP či APAP). U těchto osob tedy ASV kontraindikovaná není. Patofyziologie nárůstu KV mortality zatím není objasněna. Jedním z možných vysvětlení je, že ve studii byly použity příliš vysoké ventilační tlaky, které vedly k poklesu preloadu nebo k nedostatečné compliance. Nové informace o léčbě pacientů s HFrEF by mohla kolem roku 2020 přinést multicentrická randomizovaná studie ADVENT-HF, která využívá modifikovaný režim adaptivní servoventilace.
V terapii CSA-CSR se podobně jako v terapii OSA zkouší neurostimulace, konkrétně stimulace bráničního nervu, která vede k obnovení dýchacích pohybů. Aktuálně jsou k dispozici pilotní data, jež prokazují bezpečnost a účinnost této terapie (setrvalý pokles AHI, zlepšení saturace, kvality spánku a života). V současnosti lze ovšem říci, že základem terapie SDB stále zůstává optimální farmakologická a nefarmakologická léčba srdečního selhání, a to jak v úvodu onemocnění, tak i u pacientů s pokročilým srdečním selháním.
OSA a prekapilární plicní hypertenze
Prekapilární plicní hypertenze (PH) se vyskytuje přibližně u 20 % pacientů s de novo diagnostikovanou OSA, většinou se však jedná pouze o mírné formy PH. Neléčená OSA může vést k progresi prekapilární PH do jejích těžších forem. Patofyziologické mechanismy spojující OSA a PH opět nejsou zcela objasněny. Hypoxemie v průběhu OSA vede k hypoxií indukované vazokonstrikci a k vzestupu tlaku v plicnici. Dlouhodobě neléčená OSA pak podobně jako u jiných KVO může vést k chronickým strukturálním změnám (zde v plicním řečišti) a k fixaci PH. Léčba OSA pomocí CPAP vede k poklesu tlaku v plicním řečišti a ke zlepšení PH. Z těchto důvodů a dle současných doporučení ESC by měla být OSA zvažována jako možná příčina PH u všech pacientů s nově diagnostikovanou prekapilární PH (42).
OSA a hypertrofická kardiomyopatie (HKMP)
Klinicky významné formy OSA se u pacientů s hypertrofickou kardiomyopatií vyskytují asi ve 30 %. OSA je u těchto pacientů nezávislým rizikovým faktorem pro výskyt fibrilace síní, zvětšenou velikost levé síně a pro sníženou toleranci zátěže (43). V průběhu apnoe také může docházet k dalšímu vzestupu gradientu v LVOT. Neléčená OSA tak může ovlivňovat nejen prognózu těchto nemocných, ale i kvalitu jejich života. Vliv OSA na prognózu pacientů s HKMP bude nutné ještě dále ověřit, stejně jako vliv její léčby na morbiditu a mortalitu.
ZÁVĚR
Poruchy dýchání ve spánku jsou jedním z mnoha nezávislých rizikových faktorů rozvoje kardiovaskulárních onemocnění a u osob s kardiovaskulárními onemocněními mají 2–3× vyšší prevalenci oproti běžné populaci, přesto však zůstává vysoké procento těchto poruch nediagnostikovaných. Současný rozvoj farmakologické a nefarmakologické léčby kardiovaskulárních onemocnění doplněný o možnost konzervativní léčby SDB snižuje kardiovaskulární morbiditu a mortalitu a též zlepšuje kvalitu života nemocných. Z těchto důvodů je nutné na tyto poruchy myslet v naší běžné denní kardiologické praxi.
Poděkování:
Podpořeno European Regional Development Fund, Project FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123).
Čestné prohlášení:
Prohlašuji, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsem ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam zkratek
- 6MWD test šestiminutovou chůzí
- AHI index apnoe/hypopnoe
- AKS akutní koronární syndrom
- APAP autotitrační přetlak v dýchacích cestách
- ASV adaptivní servoventilace
- AVB atrioventrikulární blokáda
- BPAP dvojúrovňový přetlak v dýchacích cestách
- CMP cévní mozková příhoda
- CO2 oxid uhličitý
- CPAP kontinuální přetlak v dýchacích cestách
- CRP C-reaktivní protein
- CRT-D srdeční resynchronizační léčba + implantabilní kardioverter-defibrilátor
- CSA centrální spánková apnoe
- CSR Cheyneovo-Stokesovo dýchání
- EF LK ejekční frakce levé komory srdeční
- EKG elektrokardiografie
- ESC Evropská kardiologická společnost
- ESS Epworthská škála spavosti
- HCD horní cesty dýchací
- HFpEF srdeční selhání se zachovanou systolickou funkcí levé komory srdeční
- HFrEF srdeční selhání se sníženou systolickou funkcí levé komory srdeční
- HKMP hypertrofická kardiomyopatie
- HR poměr rizik
- CHSS chronické srdeční selhání
- ICD implantabilní kardioverter-defibrilátor
- ICHS ischemická choroba srdeční
- IL-6 interleukin 6
- IM infarkt myokardu
- KES komorová extrasystola
- KPR kardiopulmonální resuscitace
- KVO kardiovaskulární onemocnění
- LVOT výtokový trakt levé komory
- MACE závažné nežádoucí kardiovaskulární příhody
- NSKT nesetrvalá komorová tachykardie
- NSS náhlá srdeční smrt
- NSTEMI infarkt myokardu bez elevace ST segmentů
- NT-proBNP N-terminální fragment natriuretického propeptidu typu B
- NYHA funkční klasifikace New York Heart Association
- OSA obstrukční spánková apnoe
- OTS ortotopická transplantace srdce
- PaCO2 parciální arteriální tlak oxidu uhličitého
- PSG polysomnografie
- RAAS renin-angiotenzin-aldosteronový systém
- SA spánková apnoe
- SDB poruchy dýchání ve spánku
- SNS sympatický nervový systém
- STEMI infarkt myokardu s elevacemi segmentů ST
- SS srdeční selhání
- VAD mechanická srdeční podpora
Adresa pro korespondenci:
doc. MUDr. Ondřej Ludka, Ph.D.
1. interní kardioangiologická klinika LF MU a FN u sv. Anny
Pekařská 53, 656 91 Brno
Tel.: 777 036 914
e-mail: oludka@yahoo.com
Sources
-
Tkáčová R, Hall MJ, Liu PP et al. Left ventricular volume in patients with heart failure and Cheyne-Stokes respiration during sleep. Am J Respir Crit Care Med 1997; 156 : 1549–1555.
-
Marin JM, Carrizo SJ, Vicente E et al. Long-term cardiovascular outcomes in men with or without treatment with continuous positive airway pressure: an observational study. Lancet 2005; 365 : 1046–1053.
-
Franklin KA, Lindberg E. Obstructive sleep apnea is a common disorder in the population-a review on the epidemiology of sleep apnea. J Thorac Dis 2015; 7(8): 1311–1322.
-
Somers VK, White DP, Amin R et al. Sleep apnea and cardiovascular disease: an American Heart Association/American College of Cardiology Foundation Scientific Statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing. J Am Coll Cardiol 2008; 52 : 686–717.
-
Hermida RC, Zamarron C, Ayala DE et al. Effect of continuous positive airway pressure on ambulatory blood pressure in patients with obstructive sleep apnoea. Blood Press Monit 2004; 9 : 193–202.
-
Logan AG, Perlikowski SM, Mente A et al. High prevalence of unrecognized sleep apnea in drug-resistant hypertension. J Hypertens 2001; 19 : 2271–2277.
-
Suzuki M, Guilleminault C, Otsuka K et al. Blood pressure "dipping" and "non-dipping" in obstructive sleep apnea syndrome patients. Sleep 1996; 19 : 382–387.
-
Malik J, Drake CL, Hudgel DW. Variables affecting the change in systemic blood pressure in response to nasal CPAP in obstructive sleep apnea patients. Sleep Breath 2008; 12 : 47–52.
-
Ludka O, Štěpánová R, Vyskočilová M et al. Sleep apnea prevalence in acute myocardial infarction – the Sleep Apnea in Post-acute Myocardial Infarction Patients (SAPAMI) Study. Int J Cardiol 2014; 176(1): 13–9.
-
Huang Z, Zheng Z, Luo Y et al. Prevalence of sleep-disordered breathing in acute coronary syndrome: a systemic review and meta-analysis. Sleep Breath 2017; 21(1): 217–226.
-
Quyyumi AA, Efthimiou J, Quyyumi A et al. Nocturnal angina: precipitating facators in patients with coronary artery disease and those with variant angina. Br Heart J 1986; 56 : 346–352.
-
Yumino D, Tsurumi Y, Takagi A et al. Impact of obstructive sleep apnea on clinical and angiographic outcomes following percutaneous coronary intervention in patients with acute coronary syndrome. Am J Cardiol 2007; 99 : 26–30.
-
Ludka O, Štěpánová R, Sert-Kuniyoshi F et al. Differential likelihood of NSTEMI vs STEMI in patients with sleep apnea. Int J Cardiol 2017; 248 : 64–68.
-
Philip P, Guilleminault C. ST segment abnormality, angina during sleep and obstructive sleep apnea. Sleep 1993;16 : 558–559.
-
Milleron O, Pillière R, Foucher A et al. Benefits of obstructive sleep apnoea treatment in coronary artery disease: a long-term follow-up study. EurHeart J 2004; 25 : 728–734.
-
McEvoy RD, Antic NA, Heeley E et al. CPAP for prevention of cardiovascular events in obstructive sleep apnea. N Engl J Med 2016; 375(10): 919–931.
-
Wang X, Zhang Y, Dong ZM et al. Effect of continuous positive airway pressure on long-term cardiovascular outcomes in patients with coronary artery disease and obstructive sleep apnea: a systematic review and meta-analysis. Respir Res 2018; 19 : 61.
-
Guilleminault C, Connolly SJ, Winkle RA. Cardiac arrhythmia and conduction disturbances during sleep in 400 patients with sleep apnea syndrome. Am J Cardiol 1983; 52 : 490–494.
-
Mehra R, Benjamin EJ, Shahar E et al. Association of nocturnal arrhythmias with sleep-disordered breathing: The Sleep Heart Health Study. Am J Respir Crit Care Med 2006; 173 : 910–916.
-
Garrigue S, Pepin JL, Defaye P et al. High prevalence of sleep apnea syndrome in patients with long-term pacing: the European Multicenter Polysomnographic Study. Circulation 2007; 115 : 1703–1709.
-
Koehler U, Fus E, Grimm W et al. Heart block in patients with obstructive sleep apnoea: pathogenetic factors and effects of treatment. Eur Respir J 1998; 11 : 434–439.
-
Craig S, Pepperell JC, Koulet M et al. Continuous positive airway pressure treatment for obstructive sleep apnoea reduces resting heart rate but does not affect dysrhytmias: a randomised controlled trial. J Sleep Res 2009; 18 : 329–336.
-
Gami AS, Pressman G, Caples SM et al. Association of atrial fibrillation and obstructive sleep apnea. Circulation 2004; 110 : 364–367.
-
Javaheri S. Sleep disorders in systolic heart failure: a prospective study of 100 male patients. The final report. Int J Cardiol 2006; 106 : 21–28.
-
Matiello M, Nadal M, Tamborero D et al. Low efficacy of atrial fibrillation ablation in severe obstructive sleep apnoea patients. Europace 2010; 12(8): 1084–1089.
-
Kanagala R, Murali NS, Friedman PA et al. Obstructive sleep apnea and the recurrence of atrial fibrillation. Circulation 2003; 107 : 2589–2594.
-
Koshino Y, Satoh M, Katayose Y et al. Association of sleep-disordered breathing and ventricular arrhythmias in patients without heart failure. Am J Cardiol 2008; 101 : 882–886.
-
Shepard JW jr., Garrison MW, Grither DA et al. Relationship of ventricular ectopy to oxyhemoglobin desaturation in patients with obstructive sleep apnea. Chest 1985; 88 : 335–340.
-
Monahan K, Storfer-Isser A, Mehra R et al. Triggering of nocturnal arrhythmias by sleep-disordered breathing events. J Am Coll Cardiol 2009; 54 : 1797–1804.
-
Ryan CM, Juvet S, Leung R et al. Timing of nocturnal ventricular ectopy in heart failure patients with sleep apnea. Chest 2008; 133 : 934–940.
-
Bitter T, Westerheide N, Prinz Ch et al. Cheyne-Stokes respiration and obstructive sleep apnoea are independent risk factors for malignant ventricular arrhythmias requiring appropriate cardioverter-defibrillator therapies in patients with congestive heart failure. Eur Heart J 2011; 32 : 61–74.
-
Gami AS, Howard DE, Olson EJ, Somers VK. Day-night pattern of sudden death in obstructive sleep apnea. N Engl J Med 2005; 352(12): 1206–1214.
-
Ahn SH, Kim JH, Kim DU et al. Interaction between sleep-disordered breathing and acute ischemic stroke. J Clin Neurol 2013; 9 : 9–13.
-
Levy LM, Pepin J-L, Tamisier R et al. Prevalence and impact of central sleep apnea in heart failure. Sleep Med Clin 2007; 2 : 615–621.
-
Bitter T, Faber L, Hering D et al. Sleep-disordered breathing in heart failure with normal left ventricular ejection fraction. Eur J Heart Fail 2009; 11 : 602–608.
-
Yumino D, Wang H, Floras JS et al. Relationship between sleep apnoea and mortality in patients with ischaemic heart failure. Heart 2009; 95(10): 819–24.
-
Kaneko Y, Floras JS, Usui K et al. Cardiovascular effects of continuous positive airway pressure in patients with heart failure and obstructive sleep apnea. N Engl J Med 2003; 348 : 1233–1241.
-
Arzt M, Floras JS, Logan AG et al. Suppression of central sleep apnea by continuous positive airway pressure and transplant-free survival in heart failure: a post hoc analysis of the Canadian Continuous Positive Airway Pressure for Patients with Central Sleep Apnea and Heart Failure Trial. Circulation 2007; 115 : 3173–3180.
-
Kasai T, Usui Y, Yoshioka T et al. Effect of flow-triggered adaptive servo-ventilation compared with continuous positive airway pressure in patients with chronic heart failure with coexisting obstructive sleep apnea and Cheyne-Stokes respiration. Circ Heart Fail 2010; 3 : 140–148.
-
Nakamura S, Asai K, Kubota Y et al. Impact of sleep-disordered breathing and efficacy of positive airway pressure on mortality in patients with chronic heart failure and sleep-disordered breathing: a meta-analysis. Clin Res Cardiol 2015; 104(3): 208–16.
-
Cowie MR, Woehrle H, Wegscheider K et al. Adaptive servo-ventilation for central sleep apnea in systolic heart failure. N Engl J Med 2015; 373 : 1095–105.
-
Galie N, Humbert M, Vachieryc JL et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J 2016; 37 : 67–119.
-
Konečný T, Geske J, Ludka O et al. Decreased exercise capacity and sleep-disordered breathing in patients with hypertrophic cardiomyopathy. Chest 2015; 147(6): 1574–1581.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2019 Issue 5-
All articles in this issue
- Ke 150. výročí úmrtí Jana Evangelisty Purkyně
- Docent František Novotný – poslední asistent J. E. Purkyně a „vir infelix“
- Zemřel profesor Josef Marek, nejskromnější Rytíř českého lékařského stavu
- Advance in sleep medicine and non-invasive ventilation in respiratory medicine
- Sleep apnea and cardiovascular disease
- Metabolické poruchy a spánek
- Significance of sleep and sleep disorders in psychiatry
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Significance of sleep and sleep disorders in psychiatry
- Sleep apnea and cardiovascular disease
- Metabolické poruchy a spánek
- Advance in sleep medicine and non-invasive ventilation in respiratory medicine
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


