-
Medical journals
- Career
Hybridní zobrazení PET/MR u karcinomu prostaty
: Jiří Ferda; Eva Ferdová; Radek Tupý; Jan Baxa
: Klinika zobrazovacích metod LF UK a FN Plzeň
: Čas. Lék. čes. 2018; 157: 169-174
: Review Article
Zobrazení vlastní tkáně nádoru prostaty je při použití postupů zobrazení obvyklých u jiných nádorů velmi nesnadné, selhávají metody zobrazení pomocí kontrastního CT vyšetření, PET/CT s aplikací 18F-fluorodeoxyglukózy. Magnetickou rezonanci je možné využít v detekci karcinomu prostaty u mužů s elevací prostatického specifického antigenu (PSA) a/nebo zvýšeným indexem zdraví prostaty (PHI).
Nejnověji je možné využit spojení magnetické rezonance a pozitronové emisní tomografie v PET/MR s aplikací 18F-fluorocholinu (18F-FCH) a 18F-natriumfluoridu (18F-NaF) nebo 68Ga-PSMA-11 (ligand prostatického specifického membránového antigenu), a to ve vyhledávání, stagingu a restagingu karcinomu prostaty. PET/MR v současnosti představuje optimální metodu při stagingu, restagingu a kontrole účinku terapie karcinomu prostaty.
Klíčová slova:
karcinom prostaty, PET/MR, 18F-fluorocholin, 18F-natriumfluorid, 68Ga-PSMA-11
ÚVOD
Karcinom prostaty (CaP) představuje medicínský a socioekonomický problém mužské populace, jde o jednu z nejčastějších příčin morbidity a mortality ve vyšším středním a starším věku. Základními diagnostickými problémy u karcinomu prostaty jsou odhalení nádoru, rozlišení mezi nádory vyšší agresivity a nádory s perspektivou pomalé nebo žádné progrese. Vedle vlastní detekce se jedná o problémy plánování léčby a kontroly jejího efektu.
Zobrazení vlastní tkáně nádoru prostaty je při použití postupů zobrazení obvyklých u jiných nádorů velmi nesnadné, selhávají metody zobrazení pomocí kontrastního CT vyšetření, běžných postupů zobrazení magnetickou rezonancí i PET/CT s aplikací 18F-fluorodeoxyglukózy. U metastatického onemocnění u karcinomu prostaty je široce známa tvorba osteoplastických metastáz viditelných na prostých snímcích, CT i zobrazitelných pomocí scintigrafie s 99mTc-difosfonáty.
Často je nutné využívat metody, které se odlišují od konvenčních přístupů k zobrazování většiny nádorů. Je možné využit magnetické rezonance a dále hybridního zobrazení PET/CT nebo PET/MR s aplikací 18F-fluorocholinu (18F-FCH) a 18F-natriumfluoridu (18F-NaF) nebo 68Ga-PSMA (ligand prostatického specifického membránového antigenu), a to ve vyhledávání, stagingu a restagingu karcinomu prostaty.
MAGNETICKÁ REZONANCE
V současnosti byly do klinické praxe zavedeny systémy magnetické rezonance s vyšší magnetickou indukcí, výhodné je při zobrazování pánve včetně prostaty využívat systémy 3T. Se zvýšením kvality rozlišení pomocí povrchové cívky bylo opuštěno použití endorektální cívky a byla prokázána shodná reprodukovatelnost obrazů i spektroskopického nálezu získaných povrchovými a endorektálními cívkami.
Vývojem skenovacích technik byly postupně vytvořeny protokoly morfologické, protokoly molekulárního zobrazení se spektroskopií a difuzním zobrazením. Nejnověji byly zavedeny do klinické praxe dynamické skenovací protokoly, podle nichž je možné sérii dynamických postkontrastních zobrazení využít jako zdrojová data pro farmakodynamickou analýzu. V hodnocení se používají mapy distribučních parametrů kontrastní látky.
Optimální zobrazovací protokol (na našem pracovišti používaný na 3T PET/MR Biograph mMR, Siemens) se skládá ze zobrazení T2-váženými obrazy rychlého spinového echa (TSE T2) ve třech ortogonálních rovinách, jež byly následovány T1-váženými obrazy gradientního echa (např. VIBE – volume interpolated breath-hold examination). Další sekvencí je zobrazení difuzně váženými obrazy echoplanární sekvencí s kalkulací aparentního difuzního koeficientu (ADC) se třemi hodnotami b (50, 400, 800–1200 × 10-6 mm2/s) s doplněním výpočtu map kvantifikujících hodnotu b. Standardním postupem je dynamické zobrazení po podání bolusu gadoliniové kontrastní látky v dávce 0,5 mmol/kg hmotnosti nemocného. Během aplikace je spuštěna akvizice dat 30–60 sérií T1-vážených obrazů gradientního echa (např. VIBE), která ukončuje akvizici dat.
Při hodnocení je měřen objem prostaty s kalkulací objemu v mililitrech aproximovanou z výpočtu pomocí 0,6násobku součinu maximálního rozměru v centimetrech ve třech v ortogonálních rovinách. Dále je hodnocena struktura žlázy na TSE T2-vážených obrazech, přítomnost vysokého signálu na T1-vážených obrazech. Při posuzování difuzního zobrazení jsou hledány nehomogenity se známkami restrikce difuzivity.
Při farmakodynamickém hodnocení sycení tkání je správné používat analytický software s možností tvorby barevných map farmakodynamických parametrů (na našem pracovišti Tissue4D, Siemens Healthineers, Erlangen, Německo) dovolující vytvořit na základě analýzy dynamické T1-vážené série mapy objemu krve ve tkáni (vypočítaný integrálem z dynamické křivky, tj. area under the curve), dále mapu transferové konstanty (Ktrans), objemu extracelulárního prostoru (Ve) a konečně mapu eliminační konstanty (Ke). Kromě hodnocení map byla v podezřelých oblastech hodnocena křivka sycení kontrastní látkou, za patologický nález byla považována křivka s hypervaskularizací a rychlým vymýváním.
Vyhodnocení, zda jsou v prostatě přítomny známky karcinomu, spočívá na konkordantním nálezu nejméně 3 z následujících 4 nálezů:
- hypointenzní ložisko na T2;
- ložisko restrikce difuze (nízký signál na parametrické mapě ADC a současně vysoký signál na obrazu difuzního vážení s vysokým faktorem b);
- pozitivní nález akumulace radiofarmaka;
- patologický nález při farmakodynamické analýze, tj. patologická křivka sycení + ložisko hypervaskularizace společně se zvýšením Ktrans, zejména jde-li o ložisko asymetrické hyperperfuze.
V současnosti se při detekci nádorového onemocnění prostaty – a zejména při kontrolách aktivního sledování – prosazují zjednodušené protokoly, které vypouštějí spektroskopii, či dokonce dynamické postkontrastní zobrazení. Pro zjednodušení klasifikace ložisek v prostatě se používá skórování podle schématu PIRADS: skóre 1 znamená benigní nález, skóre 2 pravděpodobně benigní nález, skóre 3 nález intermediální, skóre 4 pravděpodobně maligní nález a skóre 5 s vysokou pravděpodobností maligní nález. Každé z ložisek by mělo být zařazeno podle skóre samostatně a mělo by být lokalizováno – prostata je rozdělena do sektorů periferní a přechodové zóny, a to na ventrální a dorzální segment a segmenty bazální střední a apikální třetiny. V současnosti je doporučováno používat klasifikaci PIRADS verze 2 (PIRADSv2), která se opírá především o T2-vážené obrazy a difuzní zobrazení s odlišným postupem pro přechodovou zónu a zónu periferní. Dynamické zobrazení po aplikaci gadoliniové kontrastní látky má jen podpůrný význam.
Z hlediska nálezu magnetické rezonance, jak již bylo uvedeno výše, bývá typickým karcinomem prostaty označován tumor vznikající v periferní zóně žlázy, hypointenzní v T2, vykazující restrikci difuze při spektroskopickém nálezu, obsahující vysoký kmit cholinu s kreatinem v dynamickém postkontrastním obrazu rapidně se sytící kontrastní látkou, ale současně s jejím rychlým vymýváním. Nalezení typického obrazu bývá jednoznačné, avšak existuje velká skupina obrazů, jež se od ideálního značně liší. T2-hypointenzní léze v tkáni prostaty v přechodové zóně jsou velmi časté u adenomyomatózní přestavby a dále u kalcifikací ve žláze. Adenomyomatózní hyperplazie často způsobí vytlačení tkáně periferní zóny do podoby úzké slupky.
PET/MR s podáním 18F-fluorocholinu
Terapie karcinomu prostaty je prováděna ve více liniích, přičemž na začátku stojí terapie radikální prostatektomií nebo radikálním ozářením a vedle těchto přístupů i možnost aktivního sledování u karcinomů prostaty, u nichž lze předpokládat neagresivní průběh onemocnění. Radikální prostatektomie se obvykle indikuje při lokálně operabilním nálezu a také při absenci vzdálených metastáz a absenci metastáz mimo pánevní uzliny, proto jsou zobrazovací postupy zaměřeny na přesné morfologické zobrazení lokálního šíření nádoru a posouzení přítomnosti pánevních uzlinových metastáz a také metastáz vzdálených.
Při stanovení prognózy onemocnění i při stanovení postupu léčby má stěžejní roli bioptické vyšetření a následná klasifikace tumoru podle Gleasonova skóre, podobný význam má i pro volbu strategie zobrazení u CaP, který již byl biopticky ověřen. Jelikož však část tumorů i zcela klinicky jasných uniká bioptickým vyšetřením i několikrát po sobě, lze využít pokročilé zobrazovací metody (MR, PET/CT i PET/MR) k lepšímu zacílení biopsie a ke zvýšení její úspěšnosti. Zvýšení efektivity je možné použitím fúzních zobrazení při endorektálním ultrazvukem naváděné biopsii prostaty.
Co se týče nemocných, u nichž bylo stanoveno vysoké Gleasonovo skóre (≥ 8), se předpokládá výrazně vyšší incidence vzdálených, především kostních metastáz, ale také častější postižení mízních uzlin (3–5). Při detekci postižených mízních uzlin byla recentně prováděna mimo jiné extenzivní pánevní lymfadenektomie, u níž se však zjistilo, že nemá výraznější opodstatnění. Pokud bylo prováděno porovnání PET/CT po podání 18F-fluorocholinu s následně prováděnou lymfadenektomií, bylo zjištěno, že senzitivita činí pouze 33 % ve srovnání s vysokou specificitou 92 % (5–8). Ukazuje se, že zvýšenou akumulaci je možné považovat za vysoce suspektní známku přítomnosti metastáz, i když nikoli všechny metastázy jsou fluorocholin akumulující. Nižší specificitu lze přisuzovat časté metastatické infiltraci uzlin mnohem menších než 10 mm, neboť asi jen 10 % nemocných mělo metastázy v uzlinách tento rozměr přesahujících.
U nemocných, u nichž dochází po radikální léčbě k opětovnému zvýšení koncentrací PSA, je vzrůstající hodnota známkou přítomnosti viabilní nádorové tkáně prostatického karcinomu. V několika studiích autoři dokumentují jako kritickou hodnotu pro odhalení patologického ložiska akumulace FCH hodnotu kolem 4 ng/ml (3, 4). Naše vlastní zkušenosti ukázaly, že nejvýznamnějším zlomem v odhalení rekurence je hodnota 2 ng/ml, nad kterou je zobrazena nádorová tkáň projevující se akumulací FCH ve třech čtvrtinách případů, a dále hladina 5 ng/ml, nad níž již je akumulující nádorová odhalena ve všech případech.
Výraznějším posunem v detekci uzlinových metastáz může být použití ligandů prostatického specifického membránového antigenu (PSMA) značených galiem. Distribuce cholinu krví do tkání je poměrně rychlá a v některých z nich dochází k urychlené extrakci FCH z krevního oběhu. Jde především o uzliny, které jsou aktivovány, ale také o aktivovanou kostní dřeň. Při detekci kostních metastáz je nutné si všímat lokálního nálezu na kosti, a je-li akumulace FCH fokálně spojena s fokální osteosklerózou či fokální osteolýzou, je třeba nález hodnotit jako metastázu. Naopak difuzní akumulace v obratlových tělech, provázená zpravidla prořídnutím skeletu charakteru osteoporózy, bývá přítomna u konverze kostní dřeně při její aktivaci například po chemoterapii, ale i po vystupňování absence hormonální stimulace kostní tkáně při kompletní antiandrogenní blokádě (8).
Pro provedení PET/MR s cholinovými deriváty jsou preparáty značené 11C pro svůj velice krátký poločas rozpadu (pouhých 20 minut) v běžné klinické praxi nepoužitelné mimo centra, která jsou vybavena cyklotronem (11). V Evropské unii dominuje mezi cholinovými deriváty používanými pro PET fluoromethylcholin značený 18F. Jedná se o látku, která je schopna inkorporace do prekurzoru fosfatidylcholinu. Zvýšený obrat cholinu je typický pro tkáně závislé na lipidovém metabolismu a s vysokou proliferační aktivitou (1, 2, 11). Až na vzácné výjimky (jako jsou malobuněčné nebo anaplastické karcinomy prostaty) je PET/MR s fluorodeoxyglukózou u karcinomu prostaty bez významu, neboť typický acinický karcinom prostaty bez závislosti na stupni Gleasonova skóre 18F-fluorodeoxyglukózu neakumuluje. V některých studiích bylo prováděno dynamické časné zobrazení doplněné pozdním skenem PET, ale Kwee et al. ve své studii ukázali, že tato kombinace v současné době nepřináší lepší výsledky a že ani časné zobrazení nedosahuje lepších výsledků než zobrazení pozdní (13).
PET/MR s podáním 68Ga-PSMA ligandu
Ligand PSMA označený galiem 68 ve formě Glu-NH-CO-NH-Lys-[Ga-68-(HBED-CC)] (68Ga-PSMA-11) je novým radiofarmakem, které se cíleně váže na PSMA s vysokou afinitou, a to na její extracelulární doménu. Díky přítomnosti pozitronového zářiče 68Ga je možné toto radiofarmakum využít v diagnostickém zobrazení pomocí hybridních zobrazovacích metod PET/MR nebo PET/CT (14–16). Zobrazení pomocí radiofarmaka s cílenou vazbou umožňuje přesněji stanovit vlastní rozsah onemocnění, zejména u nemocných, kteří již podstoupili nebo podstupují komplexní terapii.
Dle dostupných literárních údajů zobrazení pomocí PSMA ligandu i při velmi nízkých hodnotách PSA dovoluje identifikovat jak uzlinové, tak kostní metastázy u léčeného karcinomu prostaty, a to s vyšším počtem detekovaných lézí obecně; ale také identifikaci lokálního i metastatického postižení při koncentracích PSA < 2 nmol/l. U stagingového vyšetření trpí jiné metody zobrazení především nízkou specificitou pro odhalení uzlinových metastáz. Kombinace PET zobrazení s ligandem PSMA v kombinaci s komplexním zobrazením magnetickou rezonancí včetně farmakokinetické analýzy nálezu v prostatě a difuzním zobrazením v rozsahu trupu je vedena k možnosti detekovat přítomnost tkáně s PSMA i v nezvětšených uzlinách.
Kromě identifikace vlastní nádorové tkáně u nově diagnostikovaných případů karcinomu prostaty je také prokázána pozitivní korelace mezi úrovní akumulace ligandu PSMA a hladinou PSA a hodnocením Gleasonova skóre z bioptického vzorku. Cílem zobrazení je tedy zvýšení specificity detekce metastáz, ale také možnost hodnotit biologickou povahu nádorové tkáně, kdy výsledky zobrazení mohou být použity i v cílení biopsie.
Jelikož ligandy PSMA umožňují vazbu i jiných trojmocných kovů, je možné molekulu označit také beta minus emiterem, a tak v budoucnosti využít také galiem označeného ligandu k odhadnutí biodistribuce a dozimetrii před případným léčebným podáním ligandu označeného například luteciem-177. Zavedení diagnostiky pomocí galiem značeného ligandu je tedy prvním stupněm postupného vývoje kombinovaného (teranostického) přístupu k diagnostice a zároveň cílené terapii u jinak k léčbě rezistentních karcinomů prostaty.
PET/MR s podáním 18F-NaF
Indikace NaF-PET/MR zahrnují vzácněji zobrazení kostního metabolismu, především osteoblastové aktivity u systémových onemocnění metabolického a přestavbového charakteru, dále posuzování viability kostní tkáně včetně osteoblastové aktivity v kostních štěpech a v oblastech osteonekrózy. Nejdůležitější je však zobrazení kostních nádorů, především metastáz, kdy převážná část indikací je v literatuře udávána u karcinomu prostaty, prsu a plic. Indikacemi má být metastatický kostní proces, u něhož kostní scintigrafie nebo pozitronová emisní tomografie s jinými radiofarmaky neposkytne dostatečnou diagnostickou informaci o přítomnosti kostní diseminace, případně neposkytne informace o stupni progrese postižení, nebo naopak neposkytne dostatečné informace o jak pozitivní, tak nedostatečné odpovědi na cílenou terapii kostních metastáz (3–8).
Při vzniku osteoplastických metastáz karcinomu prostaty vede přímá stimulace osteoblastové aktivity nádorovými buňkami karcinomu prostaty prostřednictvím osteoprotegerinu ke vzniku osteosklerózy (1, 9). Jsou-li nádorové buňky viabilní, stimulují osteoblasty k výstavbě kostního minerálu a poté je v ložisku metastázy vysoká akumulace 18F. Příznivý účinek terapie kostních metastáz může být hodnocen na základě osteoblastové aktivity v postižení. Pokud dojde při léčbě ke snížení nebo vymizení viability nádorových buněk, dochází k poklesu, nebo dokonce k absenci akumulace 18F. Metastázy karcinomu prostaty s převážně osteolytickou formou vykazují při větším rozsahu zónu masy nádorové tkáně bez akumulace 18F, přestavbovou zónu s vysokou akumulací 18F, a dokonce vysokou akumulaci 18F i v oblasti, kde se zdá struktura kosti nenarušená; zvýšení aktivity v přechodové zóně je důsledkem stimulace osteoblastové aktivity osteoklasty.
Při porovnání 18F-NaF-PET/MR a kostní scintigrafie s aplikací 99mTc-methylendifosfonátu (99mTc-MDP) se jedná v obou případech o zobrazení pomocí markerů osteoblastové aktivity. Výhodou 18F-NaF-PET/MR je také mnohem lepší prostorové rozlišení PET subsystému. Rozlišení kostní scintigrafie i v případě, že je planární záznam doplněn SPECT zobrazením, výrazně zaostává za 18F-NaF-PET. Při porovnání obou metod je potom patrné mnohem větší množství ložisek se zvýšenou metabolickou aktivitou a detailních detekovatelných úrovní akumulace radiofarmaka na PET/MR než při kostní scintigrafii včetně SPECT.
ZOBRAZOVACÍ METODY V ALGORITMECH DIAGNOSTIKY KARCINOMU PROSTATY
U nemocných s patologicky zvýšenými hodnotami PSA je nejvýznamnější odhalení vysoce agresivních forem karcinomu, a to zejména v případech významné elevace PSA a po opakovaném negativním výsledku transrektální punkční biopsie. Selhání bioptického odběru nastává dle jednotlivých studií až u 25 % karcinomů. Primární zobrazovací metodou je pak magnetická rezonance, která často poskytne exaktní zobrazení nádorové tkáně s typickými nálezy hyposignálního ložiska v T2 s restrikcí difuze, elevací cholinu ve spektru a patologickým sycením tkáně s urychleným přestupem kontrastní látky do extracelulárního prostoru. Jako doplňkovou metodu je možné využití 18F-FCH-PET/CT, která lépe pomůže odlišit patologickou tkáň od tkáně s normálním obratem cholinu. V případech laboratorně velice suspektního nálezu (zejména s elevací PHI a výrazným poklesem poměru free/total PSA je účelné přímo využít PET/MR s fluorocholinem (případně, je-li k dispozici, s 68Ga-PSMA).
PET/MR s fluorocholinem využívá de facto stejného principu jako MR spektrometrie (MRS), tedy toho, že zvýšený podíl cholinu ve tkáni ukazuje na zvýšenou úroveň výstavby biogenních membrán. Rozdílem je však, že MRS ukazuje jen statickou úroveň koncentrace metabolitu, PET/MR s FCH jeho skutečný metabolický obrat. Další výhodou je lepší prostorové zobrazení pomocí PET než MRS a také menší náchylnost k artefaktům. Lokální extrakapsulární šíření, perineurální propagace i invaze do semenných váčků je s vysokou úspěšností zobrazena pomocí T2-vážených obrazů, pokud je tumor v T2 vážení hypointenzní, u ostatních nádorů bez typického hypointenzního signálu je přesné ohraničení tumoru problematické.
Farmakodynamická analýza sice přispívá lepšímu odlišení normální tkáně od tkáně nádorové, ale horší rozlišení prostorové je její hlavní nevýhodou. Metabolické zobrazení pomocí 18F-FCH-PET/MR má sice výborné prostorové rozlišení MR subsystému, ale rozlišení PET se pohybuje kolem 3–5 mm z důvodu jednak prostorového rozlišení vlastní metody, jednak doletu pozitronu ve tkáni. Pro přesnější zobrazení metabolických změn, změn farmakokinetiky i difuzivity je výhodná multiparametrická analýza s fúzí jednotlivých zobrazení včetně PET obrazů s T2-váženými obrazy s vysokým rozlišením.
U nádorů s vysokým potenciálem agresivního chování (Gleasonovo skóre ≥ 7) a vysokými hodnotami PSA je vhodné aktivně pátrat po uzlinových metastázách a metastázách ve skeletu. Při zobrazení pomocí klasického vyšetřovacího protokolu magnetickou rezonancí je vyšetřena pouze oblast pánve a třísel, kdy v naprosté většině případů není možné odlišit uzlinové metastázy v nezvětšených uzlinách. K lepším výsledkům uzlinového stagingu přispívá zobrazení pomocí 18F-FCH-PET/MR, při němž ovšem dochází v části uzlin aktivovaných ke zvýšené akumulaci radiofarmaka v oblasti plášťové zóny, proto se specificita uzlinového stagingu (ovšem při zachování vysoké senzitivity) dle studií s využitím 18F-FCH pohybuje kolem 65 %. Posunu bude v blízké budoucnosti dosaženo pravděpodobně pomocí 68Ga-PSMA, u něhož odpadají problémy s falešnou pozitivitou nespecifické akumulace FCH mimo nádorovou tkáň.
Zobrazení kostních metastáz u karcinomu prostaty bývalo u iniciálního stagingu většinou prováděno pomocí kostní scintigrafie, je-li však použito 18F-FCH-PET/MR ke stagingu lokálnímu a uzlinovému, je možné stejné vyšetření využít i pro hodnocení kostní diseminace. Klasický obraz osteosklerotického postižení je již projevem dlouhodobější aktivity nádorové tkáně ve skeletu. V iniciálním stadiu je možné pozorovat i kostní metastázy, které nemají sklerotickou složku vyjádřenu, nebo naopak je možné diferencovat i osteolytickou komponentu. K detekci kostních metastáz je možné využít i 18F-NaF-PET/MR, podobně jako u 18F-FCH-PET/MR lze zobrazit i léze, jež nejsou osteosklerotické, ale vykazují již vyšší obrat kostního minerálu. Jde o projevy osteoblastové stimulace nádorovou infiltrací i v kostní tkáni, v níž chybí makroskopické projevy osteosklerózy.
K posouzení lokálního účinku androgenní blokády slouží především zobrazení pomocí MR spektroskopie, ale lze využít i hodnocení změn vaskularizace, tedy změny farmakokinetických parametrů, případně změn celularity pomocí difuze molekul vody. U léčené žlázy postupně dochází k vyhasínání produkce citrátu, ale také při dobrém účinku terapie ke snížení podílu cholinu ve spektru při MRS.
Důležitým úkolem zobrazovacích metod je odhalení reziduální aktivity onemocnění při takzvaném biochemickém relapsu onemocnění. Vyšetření je tedy indikované v době, kdy dochází k opětovnému vzestupu sérových hladin PSA. K odhalení relapsu onemocnění může sloužit provedení MR pánve, je možné odhalit lokální recidivu onemocnění, eventuálně zvětšení lokálních uzlin. Vzhledem k tomu, že není vzácným jevem relaps onemocnění v okultně postižených uzlinách či metastázách ve skeletu, jeví se jako výhodné provedení 18F-FCH-PET/CT nebo PET/MR.
Efektivita zobrazení aktivity v metastázách ve skeletu je relativně vysoká, protože u androgenní blokády se na snížení osteoblastové aktivity podílí nedostatek stimulace testosteronem, tedy je-li aktivita nádorového procesu přítomna v terénu tkáně kosti s utlumenou osteoblastovou aktivitou, nemusí být pozitivní nález na 18F-NaF-PET/MR. Pokud je metastatické postižení skeletu u hormonálně refrakterních tumorů léčeno cílenou terapií s přímým účinkem na osteoblastovou i osteoklastovou aktivitou (např. pomocí kyseliny zoledronové), je možné efekt této terapie – tedy účinek na linii intercelulární aktivity osteoblast-osteoklast – sledovat pomocí 18F-NaF-PET/CT. Míra akumulace 18F ukazuje přímo na osteoblastovou aktivitu, proto je možné hodnotit dynamiku vývoje postižení skeletu.
Jednoznačným dalším posunem v diagnostice karcinomu prostaty, a to ve všech jeho indikacích, je hybridní zobrazení PET/MR s podáním 18F-FCH nebo 68Ga-PSMA. Metoda nabízí vysoký potenciál v lokálním zobrazení vlastní prostaty spolu s celotělovým zobrazením skeletu s obratem radiofarmaka v uzlinách a skeletu společně s jejich zobrazením pomocí T2-vážených inversion recovery zobrazení (T2 STIR), ale i s možností difuzního zobrazení (DWI). Podobnou perspektivu může mít rovněž zobrazení pomocí 18F-NaF. Naše zkušenosti s PET/MR na vysoký potenciál metody jednoznačně ukazují, preferujeme ji zejména u nemocných s rizikovým karcinomem prostaty nebo s diskrepancí mezi vysokými laboratorními hodnotami PSA včetně PHI a s negativními nálezy biopsií.
Zatímco ještě v nedávné době byla diagnostika karcinomu prostaty zobrazovacími metodami velmi nesnadná a vedla k jejich výjimečnému indikování, v současnosti se jedná o velmi významnou část klientely center zabývajících se komplexní onkologickou péčí. K efektivní indikaci a správnému náhledu na zobrazování karcinomu prostaty vede především dostupnost všech základních metod s možností použití alternativ při jednotlivých důvodech zobrazení. Ke správnému postupu v indikacích pak přispívá intenzivní komunikace mezi indikujícími pracovišti a provádějícím pracovištěm.
1. Multiparametrické zobrazení PET/MR prostaty s podáním 18F-FCH. 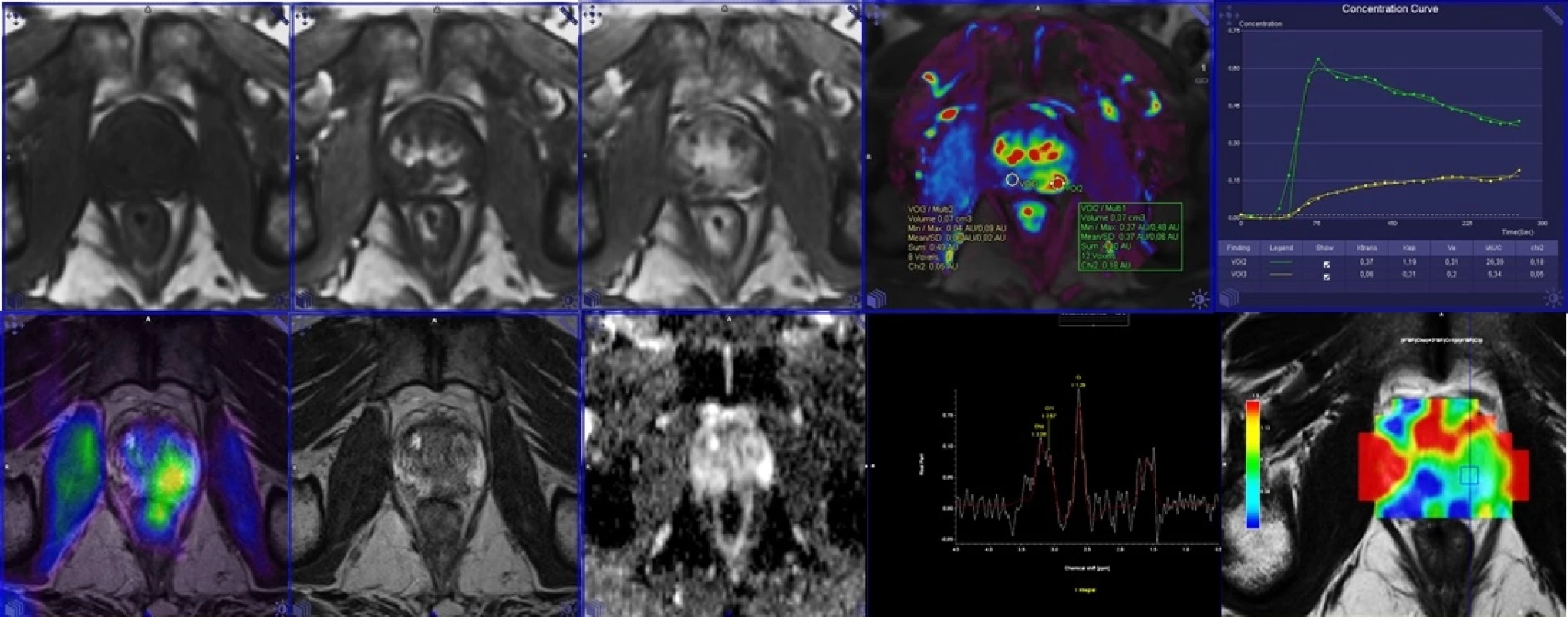
V horní řadě obrazy dynamické studie po aplikaci gadoliniové kontrastní látky včetně farmakodynamické studie, v dolní řadě PET/MR fúze, dále zobrazení morfologické, difuzní a spektroskopie. 2. Porovnání PET/MR u kostní diseminace s podáním 18F-FCH v horní řadě a 18F-NaF v dolní řadě. 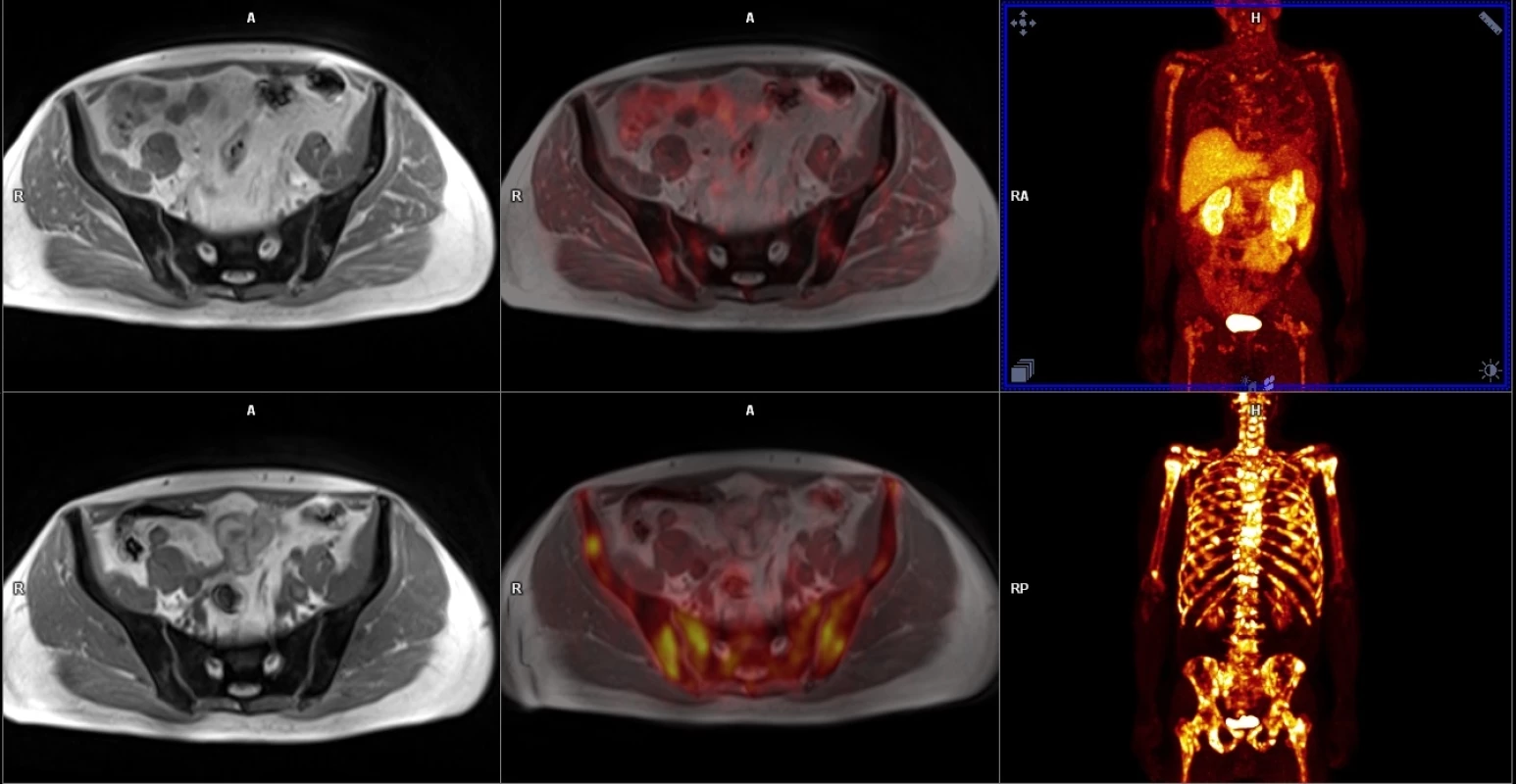
Je vidět značný rozdíl v akumulaci radiofarmak – 18F-FCH ukazuje skutečnou růstovou aktivitu nádorové tkáně metastáz prostatického karcinomu, zatímco 18F-NaF obrat kostního minerálu u změn kostní výstavby indukované přítomností metastáz. 3. Staging high-grade karcinomu prostaty (Gleasonovo skóre 9) pomocí 68Ga-PSMA-11. 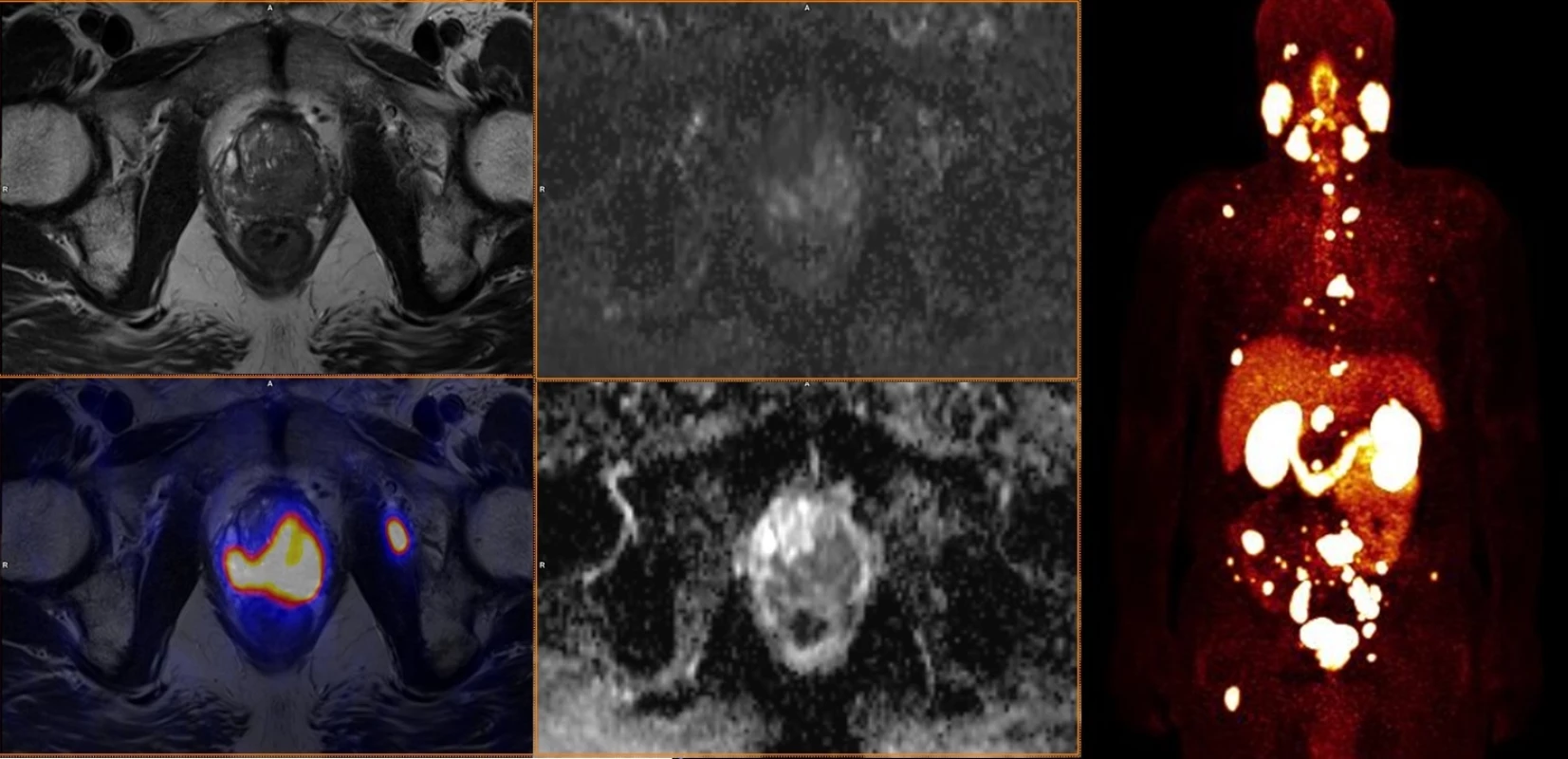
Nález ukazuje lokálně pokročilý, vysoce buněčný nádor s vysokou expresí PSMA s mnohočetnými metastázami ve skeletu a v uzlinách. Poděkování
Podpořeno projektem institucionálního výzkumu MZ ČR 00669806 Fakultní nemocnice Plzeň a projektem výzkumu Univerzity Karlovy PROGRES q39.
Seznam zkratek
ADC - aparentní difuzní koeficient
CaP - karcinom prostaty
CT - výpočetní tomografie
F - fluor
FCH - fluorocholin
Ga - galium
Ke - eliminační konstanta
Ktrans - transferová konstanta
MDP - methylendifosfonát
MR - magnetická rezonance
MRS - MR spektrometrie
NaF - fluorid sodný
PET - pozitronová emisní tomografie
PHI - index zdraví prostaty
PIRADS - Prostate Imaging Reporting and Data System
PSA - prostatický specifický antigen
PSMA - prostatický specifický membránový antigen
SPECT - jednofotonová emisní výpočetní tomografie
STIR - short tau (inversion time) inversion recovery
Tc - technecium
TSE - rychlé spinové echo
Ve - objem extracelulárního prostoru
VIBE - volume interpolated breath-hold examination
Adresa pro korespondenci:
prof. MUDr. Jiří Ferda, Ph.D.
Klinika zobrazovacích metod LF UK a FN Plzeň
alej Svobody 80, 306 40 Plzeň
Tel.: 377 103 440
e-mail: ferda@fnplzen.cz
Sources
1. Eineluoto JT, Järvinen P, Kenttämies A et al. Repeat multiparametric MRI in prostate cancer patients on active surveillance. PLoS One 2017; 12(12): e0189272.
2. Brembilla G, Dell'Oglio P, Stabile A et al. Preoperative multiparametric MRI of the prostate for the prediction of lymph node metastases in prostate cancer patients treated with extended pelvic lymph node dissection. Eur Radiol 2018; 28(5): 1969–1976.
3. Kozlowski P, Chang SD, Jones EC, Goldenberg SL. Assessment of the need for DCE MRI in the detection of dominant lesions in the whole gland: Correlation between histology and MRI of prostate cancer. NMR Biomed 2018; 31(3).
4. Gaunay G, Patel V, Shah P et al. Role of multi-parametric MRI, of the prostate for screening and staging: Experience with over 1500 cases. Asian J Urol 2017; 4(1): 68–74.
5. Druskin SC, Tosoian JJ, Young A et al. Incorporating prostate health index density, mri, and prior negative biopsy status to improve the detection of clinically significant prostate cancer. BJU Int 2018; 121(4): 619–626.
6. Mischinger J, Kaufmann S, Russo GI et al. Targeted versus systematic robot-assisted transperineal MRI-TRUS fusion prostate biopsy. BJU Int 2018; 121(5): 791–798.
7. Schmid DT, John H, Zweifel R et al. Fluorocholine PET/CT in patients with prostate cancer: initial experience. Radiology 2005; 235(2): 623–628.
8. Cimitan M, Bortolus R, Morassut S et al. [18F]fluorocholine PET/CT imaging for the detection of recurrent prostate cancer at PSA relapse: experience in 100 consecutive patients. Eur J Nucl Med Mol Imaging 2006; 33(12): 1387–1398.
9. Kwee SA, Coel MN, Lim J. Detection of recurrent prostate cancer with 18F-fluorocholine PET/CT in relation to PSA level at the time of imaging. Ann Nucl Med 2012; 26(6): 501–507.
10. Graute V, Jansen N, Ubleis C et al. Relationship between PSA kinetics and [18F]fluorocholine PET/CT detection rates of recurrence in patients with prostate cancer after total prostatectomy. Eur J Nucl Med Mol Imaging 2012; 39(2): 271–282.
11. Kjölhede H, Ahlgren G, Almquist H et al. Combined 18F-fluorocholine and 18F-fluoride positron emission tomography/computed tomography imaging for staging of high-risk prostate cancer. BJU Int 2012; 110(10): 1501–1506.
12. Umbehr MH, Müntener M, Hany T et al. The role of 11C-choline and 18F-fluorocholine positron emission tomography (PET) and PET/CT in prostate cancer: a systematic review and meta-analysis. Eur Urol 2013; 64(1): 106–117
13. Dundee PE, Hutton AC, Eden CG. [18F]fluorocholine positron-emission/computed tomography for lymph node staging of patients with prostate cancer: preliminary results of a prospective study. BJU Int 2011; 107(1): 158–159
14. Afshar-Oromieh A, Zechmann CM, Malcher A et al. Comparison of PET imaging with a 68Ga-labeled PSMA ligand and 18F-choline-based PET/CT for the diagnosis of recurrent prostate cancer. Eur J Nucl Med Mol Imaging 2014; 41(1): 11–20.
15. Beer AJ, Eiber M, Souvatzoglou M et al. Radionuclide and hybrid imaging of recurrent prostate cancer. Lancet Oncol 2011; 12(2): 181–191.
16. Castellucci P, Picchio M. 11C-choline PET/CT and PSA kinetics. Eur J Nucl Med Mol Imaging 2013; 40(Suppl. 1): 36–40
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Hybrid imaging PET/MR in prostatic carcinoma
- Contrast-enhanced ultrasonography
- Coronary CT angiography – current options and future perspectives in the diagnosis of coronary artery disease
- Endovascular recanalization and fast diagnosis improve results of ischemic stroke therapy
- Interventional radiology therapies for liver cancer
- Vertebroplasty and epiduroscopy as seen by interventional radiologist
- Imported skin parasitosis
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hybrid imaging PET/MR in prostatic carcinoma
- Coronary CT angiography – current options and future perspectives in the diagnosis of coronary artery disease
- Contrast-enhanced ultrasonography
- Interventional radiology therapies for liver cancer
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

