-
Medical journals
- Career
Je závažná obezita nepříznivým prognostickým faktorem u chřipkového zánětu plic?
Poučení z komplikujícího průběhu onemocnění H1N1
Authors: Renata Zoubková 1,2; Jan Máca 1,2; Petr Handlos 3; Lenka Rudinská 3; Ivana Nytra 1,2; Václav Chýlek 1,2; Jana Vavrošová 2
Authors‘ workplace: Katedra intenzivní medicíny a forenzních oborů Lékařská fakulta Ostravské univerzity v Ostravě 1; Klinika anesteziologie, resuscitace a intenzivní medicíny FN Ostrava 2; Ústav soudního lékařství FN Ostrava a Lékařská fakulta Ostravské univerzity v Ostravě 3
Published in: Čas. Lék. čes. 2014; 153: 277-283
Category: Case Report
Overview
Chřipkové viry způsobují každoroční epidemii, která se vyskytuje v různých obdobích jak na severní, tak i na jižní polokouli. V případech sezonní chřipky se jedná většinou o lehké formy onemocnění, které jen málokdy vedou k úmrtí nemocného. Ohroženy jsou zejména rizikové skupiny obyvatel (vysoký nebo nízký věk, přidružená onemocnění) zpravidla v řádech desetitisíců obětí na celém světě. Občas se však objeví rozsáhlá epidemie způsobená novou nebezpečnou variantou viru, která se vyznačuje obvykle velkou kontagiozitou a patogenitou (virulencí). Následkem pak často bývá komplikovaný průběh s vysokou mortalitou. V roce 2009 se objevilo pandemické onemocnění virem označeným pH1N1 2009 Influenza A. I přesto, že původní očekávání byla daleko horší, průběh chřipky způsobené tímto virem byl relativně často komplikován akutním respiračním selháním ve formě syndromu akutní respirační tísně (ARDS) probíhajícím v rámci syndromu multiorgánového selhání (MODS). Tento typ viru častěji napadá mladší věkové skupiny a vyznačuje se výraznější kontagiozitou ve srovnání se sezonní chřipkou. K dokreslení průběhu komplikované formy virózy pH1N1 2009 Influenza A popisujeme průběh tří kazuistik komplikovaných plicní manifestací probíhající pod obrazem primární formy ARDS.
Klíčová slova:
influenza A pH1N1 2009 – pandemie pH1N1 2009 – obezita – histologie plicÚVOD
V průběhu 20. století bylo zaznamenáno několik větších epidemií chřipky. Nejrozsáhlejší a nejzávažnější byla pandemie tzv. španělské chřipky, která propukla na konci 1. světové války a usmrtila desítky milionů lidí. Je považována za jednu z největších epidemií v historii, někteří vědci jí přisuzují absolutní rekord v počtu zemřelých (1). V období let 1957–1958 proběhla další pandemie tzv. asijské chřipky, jejímž původcem byla zcela nová forma viru H2N2. Na následky asijské chřipky zemřelo 1–1,5 milionů obyvatel. Následující pandemie proběhla o 11 let později, v roce 1968, ve formě „hongkongské“ chřipky způsobené virem H3N2. V roce 1976 ve vojenském táboře Fort Dix došlo k onemocnění tzv. swine flue typem A H1N1, bylo zaznamenáno jedno úmrtí. Tento typ viru se vyskytoval u prasat ve státě New Jersey již od roku 1930. V roce 1986 byl v Nizozemí izolován virus prasečí chřipky A H1swN1, patrně z ptačího zdroje, u nemocného s těžkou pneumonií. O 2 roky později zemřela v USA ve státě Wiscosin na prasečí chřipku těhotná žena, která byla v opakovaném kontaktu s domácími vepři (2).
Pandemie pH1N1 2009 Influenza A
První dokumentované případy onemocnění virem pH1N1 2009 Influenza A se objevily v Jižní Kalifornii v dubnu 2009. Primární ohnisko nákazy bylo později nalezeno v Mexiku, odkud se od března 2009 pozvolna rozšířilo po celém světě. Pandemického rozsahu onemocnění dosáhlo na podzim a v zimě 2009–2010, což znamenalo významný zdravotní problém. Onemocnění si vyžádalo do dnešní doby několik set obětí na celém světě. Jde především o nemocné s významnými komorbiditami, se sníženou obranyschopností, těhotné ženy a mladší jedince.
Do ledna 2010 bylo v České republice evidováno 2381 laboratorně potvrzených případů infekce virem H1N1, z nichž 95 zemřelo. Navzdory původnímu očekávání byl ve srovnání se sezonní chřipkovou variantou zaznamenán největší výskyt infekce u lidí pod 45 let, zatímco u jedinců starších 65 let byla infekce málo častá (3). Vysvětlením může být skutečnost, že jedinci narození před rokem 1950 mohou mít zvýšený titr zkřížených protilátek proti viru H1N1 kvůli větší a dlouhodobější expozici podobným virům v minulosti a kvůli vakcinaci některých z nich proti prasečí chřipce v roce 1976. Nejnižší titr těchto protilátek mají jen 4 % populace narozené po roce 1980, zatímco 34 % nemocných narozených před rokem 1950 má protilátky proti H1N1, a to dokonce v titru 80 a více (převrácená hodnota nejvyššího ředění séra). Výsledky studie, která srovnává demografická data pacientů postižených chřipkovou pandemií nyní a na konci padesátých let 20. století, tento aspekt potvrzují. Z celkového počtu pacientů bylo zaznamenáno 87 % úmrtí a 71 % případů těžké pneumonie u pacientů ve věkové kategorii 5–59 let, přičemž před 50 lety byly údaje srovnatelné – 17 % úmrtí a 32 % případů těžké pneumonie (6). Z dostupných statistických údajů z Mexika vyplývá, že jedinci, kteří byli exponováni obdobné chřipkové epidemii před a v průběhu roku 1957 jako děti, mají pravděpodobně z této doby protilátky (zachovanou specifickou imunologickou reaktivitu) (5, 6). Rizikové komorbidity jsou uvedeny v tabulce 1 (26). Významně rizikovou skupinou jsou imunokompromitované osoby a gravidní ženy ve 2. a 3. trimestru nebo do 2 týdnů po porodu. U osob s těžkou obezitou (BMI nad 35) byl zaznamenáno 5–15násobné riziko výskytu komplikovaného průběhu. Rovněž vyšší výskyt byl zaznamenán u původních populací Severní Ameriky a australských Aboriginů. Tento fakt se vysvětluje způsobem života, mírou kouření, alkoholismu, ale i přístupem ke zdravotní péči a genetickými faktory.
Table 1. Rizikové faktory pro komplikovaný průběh chřipky H1N1 2009 Influenza A (26) 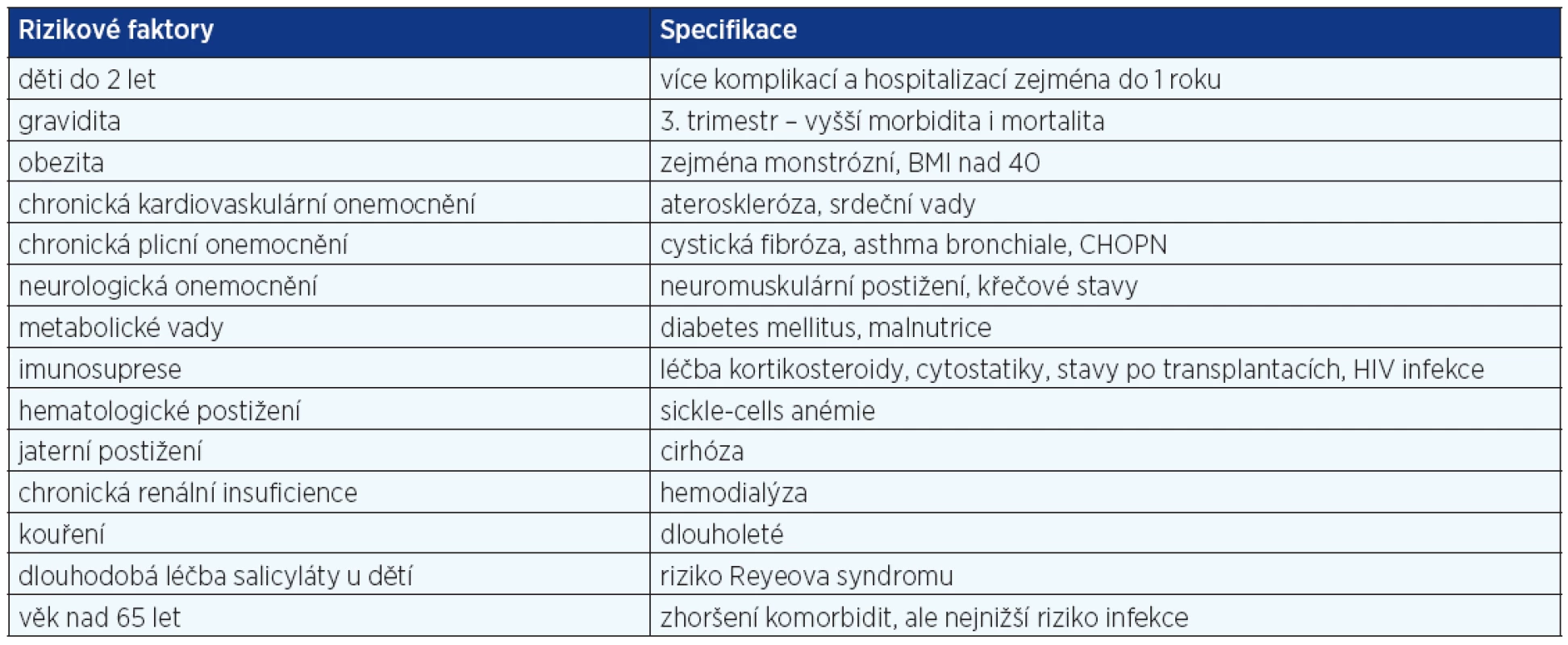
Charakteristika viru Influenza A
Viry z čeledi Orthomyxoviridae se podle vnitřního, druhově specifického nukleoproteinového antigenu rozdělují do typů A, B a C. Povrchové glykoproteinové antigeny – hemaglutinin (HA) a neuraminidáza (NA), jsou součástí zevní vrstvy virové partikule a mají rozhodující význam pro patogenitu. Byly prokázány běžné antigenní změny hemaglutininu podmíněné mutacemi RNA. Chřipkové viry typu influenza A se vyskytují u lidí i u zvířat, typy B a C pouze u lidí. Důležitou biologickou vlastností chřipkových virů A je schopnost vytvářet antigenní variace – antigenní posun (drift) a antigenní zvrat (shift). Antigenní posun je způsobován bodovými mutacemi částí genomu kódujících HA a NA a projevuje se malými antigenními a strukturálními změnami obou glykoproteinů. Antigenní zvrat vzniká vzájemnou výměnou segmentů nově se tvořících genomů virů po předchozí infekci vnímavé buňky (embrya, hostitele) dvěma nebo i více antigenně odlišnými viry. Tak dochází v přírodě ke vzniku antigenně zcela „nových“ chřipkových virů. Onemocnění virem influenza A pH1N1 2009 je označováno jako prasečí chřipka.
Klinický průběh a epidemiologie onemocnění virem pH1N1 2009
Inkubační doba tohoto onemocnění je 1–3 dny, na rozdíl od sezonní chřipky může trvat až 7 dní. Riziko přenosu infekce je v období 24 hodin před vývojem klinické symptomatologie a 24 hodin po jeho rozvoji. Základním symptomem je horečka, její přetrvávání je známkou trvající replikace virů. Ke klinické symptomatologii patří zimnice s třesavkou, suchý, dráždivý kašel, bolesti hlavy, krku a svalů. Může se objevit průjem a zvracení. U dětí je na rozdíl od sezonní chřipky velmi častým klinickým příznakem rinorea (až v 80 %). Při nejzávažnějším průběhu onemocnění se může rozvinout bilaterální pneumonie provázená respirační insuficiencí a v některých případech až rozvojem těžké formy ARDS.
U obecné populace se odhaduje potřeba hospitalizace zhruba u 5–7 % infikovaných jedinců, jejichž průměrná doba pobytu v nemocnici se pohybuje kolem 2,5 (1–7) dne. Asi 10 % hospitalizovaných (tedy 0,6 % ze všech infikovaných) vyžaduje pobyt na JIP z důvodu závažného postižení plic (těžké pneumonie s rozvojem ARDS). Celková mortalita u obecné populace se pohybuje kolem 0,2–0,5 % (27). U pacientů s komplikovaným průběhem onemocnění influenza A pH1N1 2009 s rozvojem ARDS se mortalita pohybuje mezi 15–40 % případů (28).
Léčba
Specifická léčba by měla být zahájena do 12–48 hodin od vzniku symptomů, tedy často empiricky. V případě negativního nálezu se léčba zpravidla ukončí. Influenza A pH1N1 2009 je citlivá na inhibitory neuroaminidázy, mezi něž patří: oseltamivir (p.o.), zanamivir (inhal), peramivir (i.v.). Oseltamivir je určen k p.o. podávání a jde o nejčastěji užívaným preparátem. Jeho rizikem v intenzivní péči je snížená dostupnost léku při dysfunkci zažívacího traktu (redukovaná intestinální resorpce) a možnost vzniku rezistence. Zanamivir je podáván inhalačně, ve vyšších koncentracích se ukládá v dýchacím traktu při menší systémové absorpci. Je mu dávána přednost u těhotných, pokud nejsou klinické kontraindikace. Peramivir je jediný inhibitor neuraminidázy s i.v. formou, jeho dostupnost je ale prozatím omezená. K terapii chřipky patří neodmyslitelně i podpůrná léčba v podobě antipyretik a dostatečné hydratace. V případě komplikovaného průběhu např. bakteriální superinfekcí je potřeba zahájit cílenou antibiotickou terapii. Při vývoji respiračního selhání je zahájena komplexní terapie ARDS, jejíž základní součástí je netraumatizující umělá plicní ventilace a konzervativní tekutinová strategie.
KAZUISTIKY
Následující část je věnována popisu průběhu komplikované formy chřipky pH1N1 2009 Influenza A u tří pacientů.
Kazuistika 1
Pacientka, 52 let, byla přijata na Kliniku anesteziologie, resuscitace a intenzivní medicíny (KARIM FNO) s anamnézou osmidenního febrilního stavu, s bolestí na hrudi s kašlem a hemoptýzou, po předchozí hospitalizaci v malé nemocnici. V osobní anamnéze byla uvedena Bechtěrevova choroba, pacientka nekouřila, alkohol nepila, BMI 27. Během hospitalizace v Bílovci byla metodou RT-PCR (real time – polymerase chain reaction) potvrzena chřipka pH1N1 2009 Influenza A a zahájena virostatická terapie. Po krátké stabilizaci stavu za hospitalizace na interním oddělení dochází k prudkému zhoršení stavu. Pacientka byla přijata v kritickém stavu na ARK FNO z důvodu progrese respirační insuficience, zaintubovaná a na umělé plicní ventilaci (UPV). Klinicky stav progredoval do těžké formy ARDS. Dle CT nálezu byla odhadnuta redukce vzdušnosti plicní tkáně na 30 %. V úvodním laboratorním vyšetření CRP 228 mg/l, PCT 0,44 µg/l, IL-6 81,8 ng/l, leukocyty 5,9 × 109/l, pO2 13,4 kPa, pCO2 6,35 kPa. K již zavedené virostatické a antibiotické terapii byly podány kortikoidy. I přes maximalizaci terapie došlo k dalšímu zhoršení stavu s rozvojem ARDS, kdy byla zahájena komplexní podpůrná terapie. Po celou dobu byla pacientka ventilována striktně v pásmu netraumatizující ventilace (respektována pravidla protektivní ventilace), s nutností frekventních úprav ventilačních parametrů.
Druhý den hospitalizace byla zahájena terapie oxidem dusnatým (NO) a byl aplikován surfaktant bronchoskopicky (dle protokolu vytvořeného na KARIM FN Ostrava k užití v krizové situaci dle dostupných publikovaných informací) (27). Pacientka byla ukládána do pronační polohy. Postupně došlo ke zlepšování stavu. Vzhledem k riziku dlouhodobého odvykání od UPV byla provedena punkční dilatační tracheostomie (TCHST). Postupně došlo k úpravě parametrů ventilace i CT nálezu. V dalším průběhu došlo k superinfekci Pseudomonas aeruginosa, která měla dobrou odpověď na změnu ATB terapie. Stav se zlepšoval a 29. den byla pacientka dekanylována. Následná terapie se zaměřila především na maximální rehabilitaci, dechová cvičení a realimentaci. Brzy byl obnoven plný příjem per os. Pacientka byla přeložena ve stabilizovaném stavu, spontánně ventilující, bez známek elevace zánětlivých parametrů na Neurologickou jednotku intenzivní péče (JIP) FNO z důvodu chabé kvadruparézy na podkladě polyneuropatie kriticky nemocných. Po třítýdenní hospitalizaci, kdy se svalová síla pacientky převážně na horních končetinách výrazně zvýšila, byla přeložena k intenzivní rehabilitaci na Rehabilitační kliniku FNO a po té byla po čtyřtýdenní hospitalizaci propuštěna ve velmi uspokojivém stavu do domácího ošetřování.
Kazuistika 2
Pacient ve věku 31 let byl přivezen RZP na Kliniku infekčního lékařství FNO pro dušnost, vykašlávání krvavého sputa, SpO2 76–82 %, 2 dny trvající febrilie 39–42 °C. Při přijetí byl pacient při vědomí, s dráždivým kašlem, se sníženou hydratací a prokrvením periferie, hypotenzní. Dýchání bylo poslechově volné sklípkové s bazálními chropy a difuzním náznakem krepitace. Pacient v předchorobí netrpěl závažným onemocněním, ale byl extrémně obézní (BMI 37,9). Z materiálu z nosohltanu byla následně metodou RT-PCR potvrzena chřipka pH1N1 2009 Influenza A. Při kultivaci výtěru z krku byly navíc zachyceny kvasinky, bakteriologické vyšetření bylo negativní. Neprodleně byla zahájena virostatická terapie oseltamivirem, s ohledem na rozvoj superinfekce byl podán fluconazol. Na RTG plic z 2. dne hospitalizace bylo patrné splývavé infiltrativní zastření obou plicních křídel a následující den pak obraz nehomogenního infiltrativního zastření ve středních a dolních plicních polích oboustranně. Z laboratorních vyšetření CRP 208 mg/l, PCT 2,99 µg/l, IL-6 204 ng/l, leukocyty 14,5 × 109/l. V odpoledních hodinách byl pacient pro respirační selhání tracheálně intubován, analgosedován a pro hypotenzi byla nasazena vazoaktivní terapie. I přes snahu o protektivní ventilační terapii bylo nutné užít hraniční parametry ventilační a oxygenační podpory: FiO2 0,8–1,0, špičkový inspirační tlak (PIP) 35 cm H2O, PEEP 10 cm H2O. Postupně klesá statická plicní poddajnost spolu s oxygenačními funkcemi plic: PaO2 9,5 kPa, PaCO2 7,33 kPa. Třetí den byla pro zhoršující se klinický stav zahájena extrakorporální oxygenace s následnou mírnou úpravou plicní poddajnosti, PaO2 12,1 kPa, PaCO2 7,24 kPa. Čtvrtý den však došlo k dalšímu zhoršení nálezu na plících, SpO2 70% při FiO2 1,0, plicní poddajnost 24 ml/cm H2O. Průběh byl dále komplikován výraznou rhabdomyolýzou s hodnotou myoglobinu 2536 ng/l, renální insuficiencí s hodnotou urey 30 mmol/l a kreatininu 625 µmol/l, proto byla zahájena eliminace formou kontinuální venovenózní hemofiltrace (CVVH). Během dalších 3 dnů vznikla další komplikace ve smyslu značné hemolýzy, která byla provázena makroskopickou hematurií s poklesem hodnoty hemoglobinu ze 160 na 67 g/l, hodnota bilirubinu dosáhla 165 µmol/l. Sekundární autoimunitní etiologie nebyla prokázána. Hematologické konzilium konstatuje hemolytickou mikroangiopatickou anémii, pravděpodobně v souvislosti s mimotělním oběhem a rozvojem těžkého ARDS. Přes rozsáhlou intenzivní péči nadále progreduje respirační insuficience. Osmý den hospitalizace došlo v nočních hodinách ke vzniku supraventrikulární tachykardie, která nereagovala na provádění vagových manévrů, byla neprodleně provedena kardioverze. Stav se dále zhoršuje, pro setrvalou komorovou tachykardii byl pacient 3krát kardiovertován. Přetrvává vazoparalýza s hypotenzí refrakterní na katecholaminy a stav končí tutéž noc úmrtím pacienta.
Patologický nález: Při pitvě byl konstatován lehký ikterus kůže a sklér. Vnitřní prohlídkou bylo zjištěno výrazné překrvení a prosáknutí sliznice průdušnice, v lumen se nacházelo malé množství zkrvavělého hlenu. Plíce byly rozepjaté, těžké (1190 g a 1100 g), pod poplicnicí se nacházely četné tečkovité krevní výrony. Na řezu byla plicní tkáň červenofialové barvy, tuhé konzistence, téměř nevzdušná. Z řezu vytékalo velké množství krví zbarvené tekutiny. Slezina byla výrazně zvětšená (600 g), na řezu tmavě červené barvy, křehké konzistence, pulpa se stírala. Při histologickém vyšetření byla v průdušnici prokázána fokální deskvamace povrchového epitelu, v submukóze byly zjištěny drobné hemoragie a ojedinělá ložiska zánětlivé kulatobuněčné celulizace. Plíce byly výrazně překrvené, plicní sklípky obsahovaly edémovou tekutinu, fokálně s hyperplazii alveolární výstelky s tvorbou hyalinních blanek, fibrinu, deskvamované epitelie pneumocytů, makrofágy a drobné intraalveolární hemoragie. Interalveolární septa byla rozšířená, edematózní, bez zánětlivé celulizace. Bronchioly vykazovaly známky nekrotizující bronchiolitidy. V drobných cévách byla zjištěna leukostáza a ojedinělé fibrinové tromby. Slezina se známkami aktivace zárodečných centrech, v sinusech zjištěny četné granulocyty. Závěrem lze konstatovat, že 31letý muž, dle klinického sdělení s potvrzenou tzv. prasečí chřipkou H1N1, se septickou aktivací sleziny, zmírá na oboustranný zánět plic.
Kazuistika 3
Pacient, 43 let, byl přijat na Kliniku infekčního lékařství FN Ostrava po předchozí hospitalizaci na plicním oddělení regionální nemocnice, kam přišel pro 5 dnů přetrvávající febrilie až 40 °C, zimnici, suchý dráždivý kašel, bolesti břicha a průjem. Pro podezření na levostrannou pneumonii byla zahájena antibiotická terapie. V úvodním laboratorním vyšetření CRP 98 mg/l, IL-6 301 ng/l. Pátráním po etiologii byla na základě pozitivní RT-PCR prokázána viróza H1N1 a pacient byl přeložen na infekční kliniku FN Ostrava. V anamnéze byla léčená hypertenze, jiná onemocnění pacient neměl, nekouřil. Při přijetí byl pacient dyspnoický, subfebrilní, bez oxygenoterapie měl saturaci O2 90%, opocený, významně obézní (BMI 34,0). Poslechově dýchání oboustranně mírně zostřené, byly slyšitelné ojediněle chrůpky, pacient spontánně ventiloval. Byla zahájena virostatická terapie oseltamivirem.
Následující den v dopoledních hodinách se pacient subjektivně cítil dobře, byl subfebrilní, na oxygenoterapii. Ve večerních hodinách došlo k návratu vysokých teplot, byly odebrány hemokultury. Třetí den hospitalizace došlo k progresi respirační insuficience, dýchání bylo oslabené, pacient tachypnoický, klesla saturace kyslíku (SpO2 84–70%, pO2 9,5 kPa, pCO2 6,8 kPa při oxygenoterapii 12 l/min kyslíkovou maskou). Pacient byl intubován a byla zahájena protektivní umělá plicní ventilace.
Čtvrtý den byl pacient stále febrilní, UPV s 0,7 FiO2, PIP 30 cm H2O, PEEP 14 cm H2O, pO2 9,5 kPa, s nutností analgosedace. Na snímku nitrohrudních orgánů byla centrálně zmnožena plicní kresba, oboustranně bazálně a perihilózně zánětlivá infiltrace, s postupným rozvojem ARDS. Pro hypotenzi byl nasazen noradrenalin.
Další den přetrvávaly febrilie 39,5 °C nereagující na podání antipyretik. Při mikrobiologickém vyšetření sputa byly zachyceny kvasinky, proto bylo indikováno podání flukonazolu. Dále byl patrný nález herpetických eflorescencí na přední straně hrudníku, proto byl podán Herpesin. Došlo k nárůstu zánětlivých parametrů – leukocytóza 11,109/l, CRP 250 mg/l, IL-6 301 ng/ml, PCT 0,63 µg/ml. Klinicky byla patrná snížená oxygenační funkce plic (SpO2 80–84%), pokles plicní poddajnosti, porucha acidobázické rovnováhy. Na RTG srdce a plic bylo patrné difuzní zastření. Vzhledem k progresi stavu bylo doporučeno zahájení extrakorporální oxygenace.
Šestý den hospitalizace byl na podkladě akutního renálního selhání (AKI ve stadiu I dle RIFLE) indikována kontinuální eliminace metodou CVVH s vysokým obratem tekutin, antikoagulační terapií a chlazením krevního oběhu s ohledem na přetrvávající febrilie. Pro hypotenzi bylo třeba navýšit podávání noradrenalinu, terapie byla doplněna o dobutamin. Sedmý den hospitalizace přes komplexní intenzivní terapii progreduje hypotenze s extrémní tachykardií při přetrvávající hyperpyrexii. V nočních hodinách dochází k zástavě srdeční akce, zahájena KPR, která končí neúspěšně.
Patologický nález: Pitvou 43letého muže bylo zjištěno výrazné překrvení sliznice hrtanu a průdušnice. Na sliznicích ulpívala malé množství nažloutlého a zkrvavělého hlenu. Plíce byly těžké (1390 g a 1270 g), po otevření dutiny hrudní nekolabovaly. Pod poplicnicí se nacházely disperzní tečkovité krevní výrony. Na řezu byla plicní tkáň sytě červenofialové barvy, tuhé konzistence, sníženě vzdušná. Po zatlačení z řezu vytékalo velké množství tmavě červené krve. Disperzně byla v plicním parenchymu zastižena ložiska červenobéžové barvy tužší konzistence. Průdušky byly nerozšířené, vystlané načervenalou prosáklou sliznicí s obsahem nažloutlého a zkrvavělého hlenu.
Při histologickém vyšetření byly zjištěny povrchové eroze epitelu průdušnice s dlaždicovou metaplazií a ztluštěním bazální membrány, submukózně byla zjištěna ložiska kulatobuněčné celulizace a masivní překrvení drobných cév. Plíce byly výrazně překrvené. Plicní sklípky obsahovaly erytrocyty, makrofágy a místy příměs edémové tekutiny. Fokálně byla zjištěna hyperplazie alveolární výstelky s tvorbou hyalinních blanek. Interalveolární septa byla rozšířená, edematózní, bez zánětlivé celulizace. Bronchioly vykazovaly známky nekrotizující bronchiolitidy. Drobné cévy byly vyplněné ojedinělými fibrinovými tromby. Závěrem lze konstatovat, že 43letý muž s klinicky potvrzenou tzv. prasečí chřipkou H1N1 zmírá na oboustranný zánět plic.
DISKUZE
Na podkladě nálezů zjištěných při pitvě lze konstatovat, že makroskopický ani mikroskopický obraz u chřipky není vždy specifický. Velmi často je překryt změnami sekundárně infekčními a mnohdy modifikován dlouhodobou podpůrnou (umělá plicní ventilace) a farmakologickou léčbou.
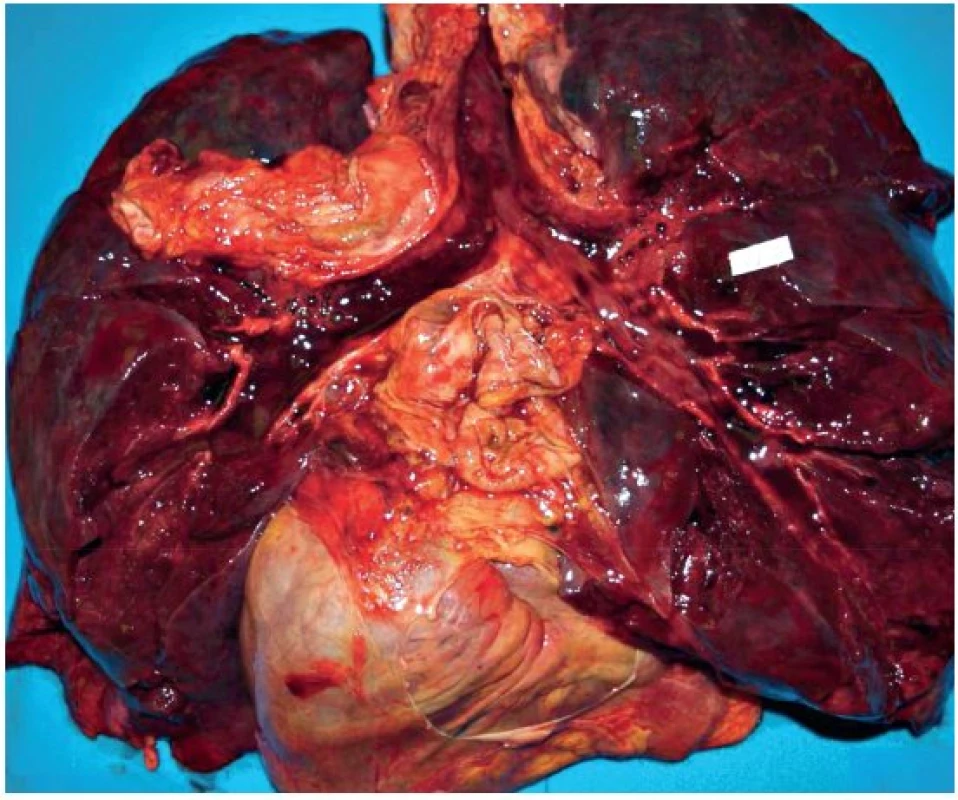
V obou prezentovaných případech, které skončily úmrtím, byl sekční nález na orgánech následující: sliznice průdušnice byla prosáklá, překrvená (obr. 1). Plíce byly těžké, tuhé konzistence, téměř nevzdušné s hemoragickým otokem (obr. 2).
Image 1. Sekční nález průdušnice 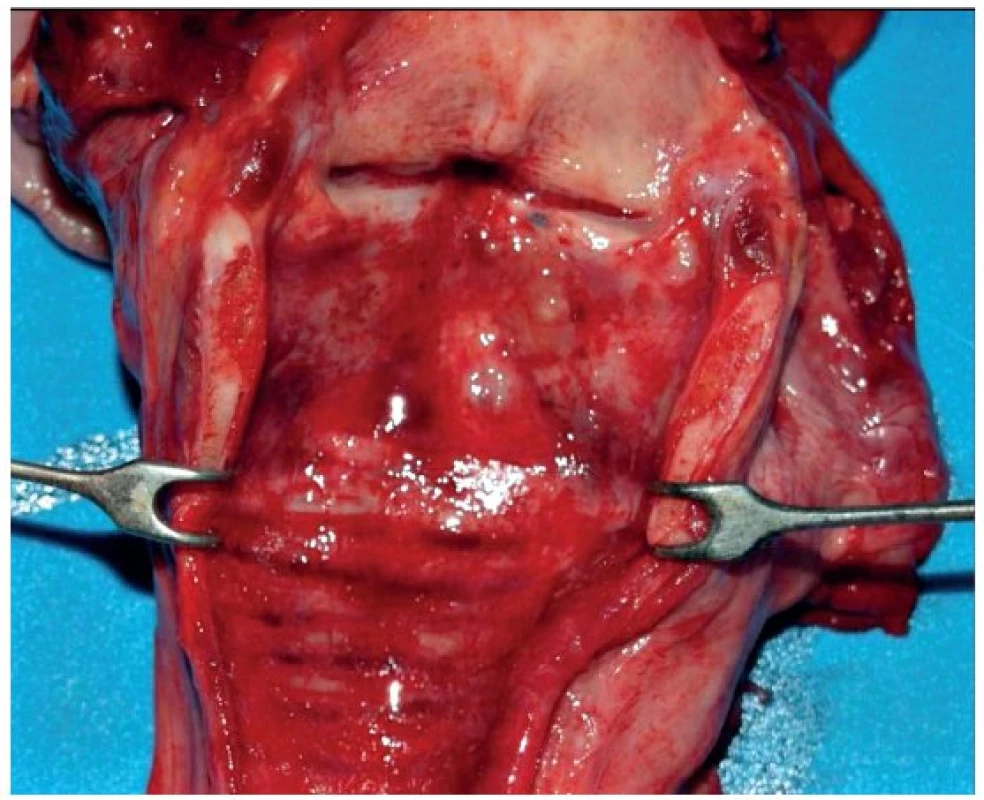
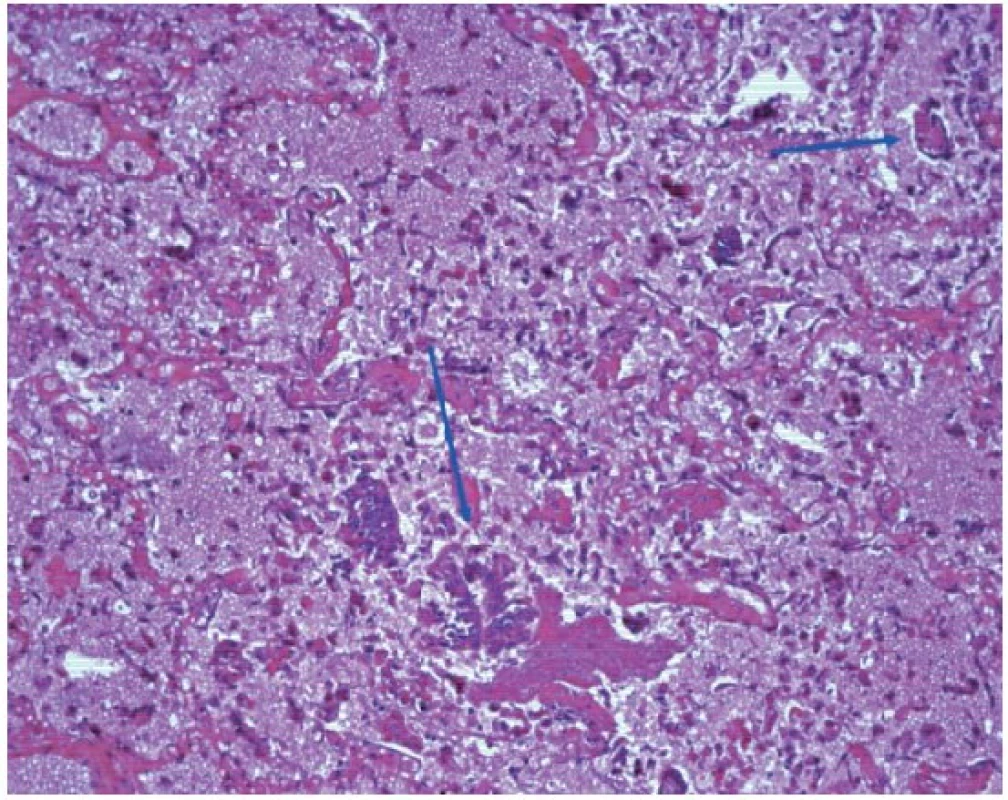
V mikroskopickém obrazu vykazovala průdušnice známky hemoragické až nekrotizující tracheitidy (obr. 3). Plicní parenchym byl překrvený, plicní sklípky obsahovaly edémovou tekutinu, fokálně s hyperplazií alveolární výstelky s tvorbou hyalinních blanek, fibrin, deskvamované epitelie pneumocytů, makrofágy a drobné intraalveolární hemoragie (obr. 4). Intraalveolární septa byla rozšířená, edematózní, bez zánětlivé celulizace. Bronchioly vykazovaly známky nekrotizující bronchiolitidy. V drobných cévách byly zjištěny ojedinělé fibrinové tromby (obr. 5). Námi popisovaný histologický obraz plic odpovídá difuznímu alveolárnímu poškození.
Image 3. Mikroskopický obraz hemoragické tracheitidy 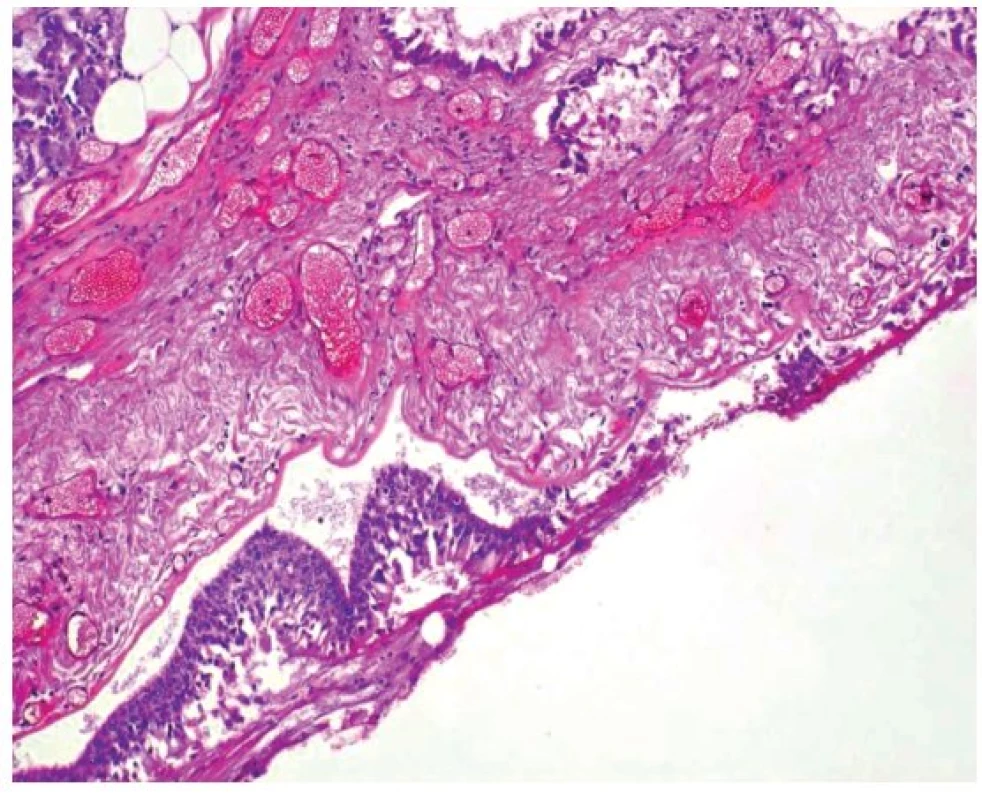
Image 4. Mikroskopický obraz plícního parenchymu 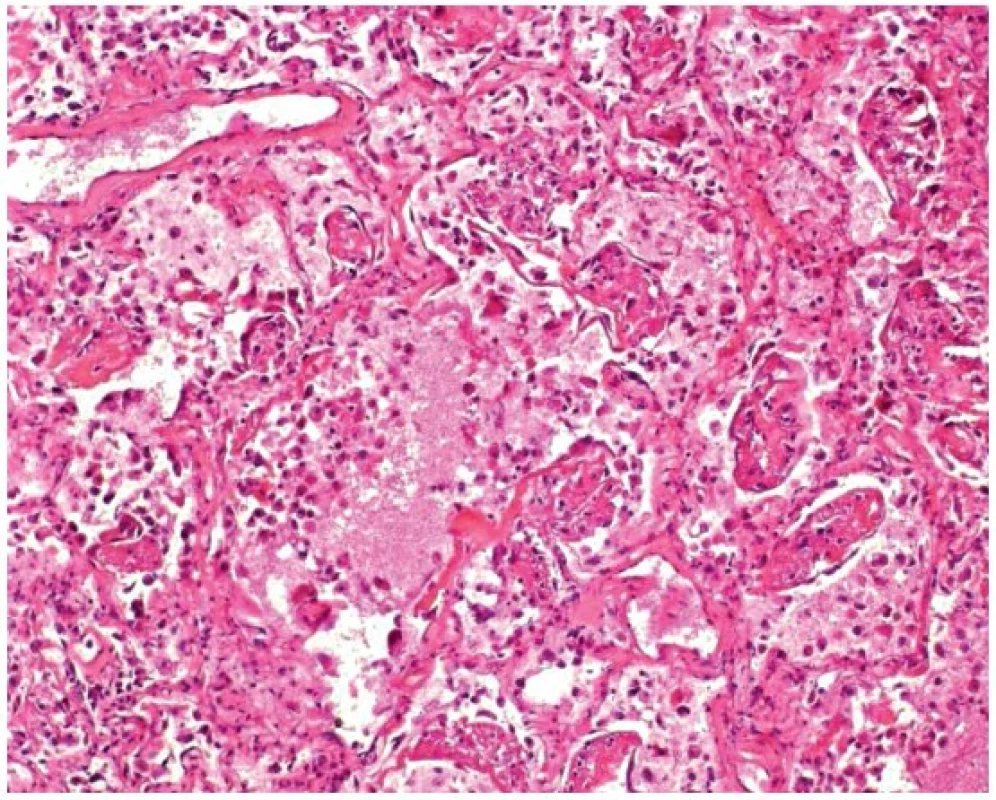
Nález na ostatních orgánech nebyl pro chřipku specifický, vyskytuje se u řady dalších onemocnění a je zcela pravděpodobné, že byl modifikován dlouhodobou intenzivní léčbou.
Závěrem lze konstatovat, že kultivačně a pomocí PCR nebyly v sekčním materiálu u žádného ze zemřelých zastiženy viry chřipky A H1N1. Pomocí přímé elektronové mikroskopie byly v jednom případě prokázané ojedinělé fragmenty čeledi Orthomyxoviridae, kam patří i viry chřipky A H1N1. Dle našich zkušeností, bez potvrzení virů chřipky in vivo pomocí sérologie nebo PCR je elektronová mikroskopie jedinou metodikou, která může být úspěšná při prokazování viru chřipky v sekčním materiálu, a to zpravidla v počátečních fázích onemocnění.
Komplikovaný průběh infekce pandemickým virem je v odborné literatuře popisován především u mladších pa-cientů; věkový interval se pohybuje od 27 do 46 let (6, 9, 11–13, 15). S touto skutečností souvisí i nízká četnost přidružených chronických onemocnění hlavně plicních a kardiálních, které jsou známé jako predisponující faktory komplikovaného průběhu pandemické chřipky (19).
V práci Morgana et al. je srovnávána souvislost obezity s úmrtím v důsledku pandemické chřipky 2009. Bylo zařazeno 361 pacientů, mortalita v souvislosti s morbidní obezitou byla potvrzena u skupiny pacientů ve věku 20 let a více (29). V další publikaci z června 2009 prezentoval kolektiv pracovníků z University of Michigan výsledky studie, kde obezita (BMI nad 40) byla zaznamenána dokonce u devíti z deseti nemocných (17). V dalších zahraničních publikovaných pracích u kriticky nemocných byl popsán výskyt obezity v intervalu 28–62 %. Většina autorů hodnotí obezitu jako významný rizikový faktor primární chřipkové pneumonie s nepříznivým průběhem a vysokou letalitou (6, 7, 12, 14–15). Také metaanalýza Fezeu et al. dokládá, že je morbidní obezita nepříznivým prognostickým faktorem pro pacienty v intenzivní péči s komplikovaným průběhem onemocnění virózy influenza A pH1N1 2009 (30).
Primární ARDS na podkladě chřipkové pneumonie je nejzávažnější komplikací při infekci virem Influenza A pH1N1 2009. Postiženi bývají především jedinci mladšího a středního věku bez vážnější interní komorbidity, častěji obézní jedinci. V případě první kazuistiky se komplikující průběh virózy influenza A pH1N1 2009 podařil zvládnout. Pacientka měla v době onemocnění 52 let a nebyla obézní. Další dvě kazuistiky popisují letální průběh onemocnění, který se rychle vyvinul do těžké formy ARDS s radiologickými známkami téměř difuzního plicního poškození se všemi klinickými důsledky. V obou případech se jednalo o pacienty mladšího věku, kteří byli obézní (BMI 37,9, resp. 34,0).
ZÁVĚR
Chřipkové epidemie, zejména pandemie závažnějšími formami, potenciálně představují celosvětový zdravotní problém. Neustále totiž hrozí riziko vzniku nových agresivních forem virů, které mohou vzniknout kombinací genetické informace mezi zoonotickými i humánními kmeny. Z hlediska rizika pro lidskou populaci je rozhodující jednak kontagiozita a míra virulence viru, ale také jeho schopnost interhumánního přenosu. Kupříkladu nová forma aviárního viru (subtyp H7N9) je významně patogenním kmenem (způsobuje frekventně závažné formy respiračního selhání), ale interhumánní přenos naštěstí prozatím prokázán nebyl a incidence onemocnění v posledních týdnech jeví trend v poklesu.
Také každoroční vlny pandemie virem pH1N1 2009 jsou podstatně mírnější, než se původně očekávalo, a frekvence úmrtí tedy naštěstí také není tak vysoká. Přesto je nutné nadále dbát zvýšené ostražitosti z hlediska diagnostiky a myslet na možnost virové etiologie u každého pacienta přicházejícího k lékaři s příznaky podobných chřipce – tzv. influenza like illness (ILI). Zároveň u pacientů zemřelých na těžké respirační selhání na podkladě oboustranné pneumonie nejasné etiologie je vhodné provést podrobné makroskopické i mikroskopické a kultivační vyšetření sekčního materiálu s cílem dokončení diagnostiky a stanovení definitivní etiologie infekčního onemocnění. V případě diagnostiky chřipkových pneumonií ale nebývá patologická sekční diagnostika jednoznačná.
Seznam použitých zkratek
ATB antibiotika
AKI akutní renální selhání
ARDS syndrom akutního respiračního selhání
BMI body mass index
CVVH kontinuální venovenózní hemofiltrace
HE hemaglutinin
MODS multiorgánová dysfunkce
NA neuraminidáza
PIP maximální inspirační tlak (peak inspiratory pressure)
RT-PCR real time-polymerase chain reaction
UPV umělá plicní ventilace
TCHST tracheostomie
ADRESA PRO KORESPONDENCI:
PhDr. Renáta Zoubková
Katedra intenzivní medicíny a forenzních oborů LF OU
Syllabova 19, 703 00 Ostrava-Zábřeh
e-mail: renata.zoubkova@osu.cz
Sources
1. WHO: Pandemic (H1N1) 2009 – update 101 (http://www.who.int/csr/don/2010_05_21/en/index.html)
2. Beran J. Chřipka, 2. rozš. vyd. Praha: Maxdorf 2002.
3. Kathy Hancock, Vic Veguilla, Xiuhua Lu, Weimin Zhong, et al. Cross-Reactive Antibody Responses to the 2009 Pandemic H1N1 Influenza Virus. N Engl J Med 2009; 361 : 1945–1952.
4. Chowell G, Bertozzi SM, Colchero M, et al. Severe respirátory dinase concurrent with circulation of H1N1 influenza. N Engl J Med 2009; 361 : 674–679.
5. Perez-Padilla R, Rosa-Zamboni D, Ponce de Leon S, et al. Pneumonia and respiratory silure from swine-origin influenza A (H1N1) in Mexiko.N Engl J Med 2009; 361 : 680–689.
6. Dominguez-Cherit G, Lapinsky SE, Macias AE, Pinto R, Espinosa-Perez L, de la Torre A, et al. Critically Ill Patients With 2009 Influenza A(H1N1) in Mexico. JAMA 2009; 302 : 1880–1887.
7. Gomez-Gomez A, Magana-Aquino M, Garcia-Sepulveda CA, Ochoa-Perez UR, Falcon-Escobedo R, Comas-Garcia A, et al. Severe pneumonia associated with pandemic (H1N1) 2009 outbreak, San LuisPotosí, Mexico. Emerg Infect Dis 2010; 16 : 27–34.
8. Jain S, Kamimoto L, Bramley AM, Schmitz AM, Benoit SR, Louie J, et al. Hospitalized Patients with 2009 H1N1 Influenza in the United States, April–June 2009. N Engl J Med 2009; 361 : 1935–1944.
9. Kopel E, Amitai Z, Grotto I, Kaliner E, Volovik I. Patients with Pandemic (H1N1) 2009 in intensive care units, Israel. Emerg Infect Dis 2010; 16 : 720–721.
10. Kumar A, Zarychanski R, Pinto R, Cook DJ, Marshall J, Lacroix J, Stelfox T, et al. Critically ill patients with 2009 infl uenza A (H1N1) infection in Canada. JAMA 2009; 302 : 1872–1879.
11. Louie JK, Acosta M, Winter K, Jean C, Gavali S, Schechter R, et al. Factors associated with death or hospitalization due to pandemic 2009 influenza A (H1N1) infection in California. JAMA 2009; 302 : 1896–1902.
12. Rello J, Rodriguez A, Ibanez P, Socias L, Cebrian J, Marques A,et al. Intensive care adult patients with severe respiratory failure caused by Influenza A (H1N1)v in Spain. Crit Care 2009; 13: R148.
13. Yeung JHY, Bailey M, Perkins GD, Smith FG. Presentation and management of critically ill patients with influenza A (H1N1): a UK perspective. Crit Care 2009; 13 : 426.
14. Zarychanski R, Stuart TL, Kumar A, Doucette S, Elliott L, Kettner J, et al. Correlates of severe disease in patients with 2009 pandemic influenza (H1N1) virus infection. Canad Med Assoc J 2010; 182 : 257–264.
15. Webb SA, Pettila V, Seppelt I, Bellomo R, Bailey M, Cooper DJ,et al. Critical care services and 2009 H1N1 infl uenza in Australia and New Zealand. N Engl J Med 2009; 361 : 1925–1934.
16. SZÚ: Aktualizované informace – potvrzené případy onemocnění virem „Pandemic (H1N1) 2009“ ke dni 3. 3. 2010 (http://www.szu.cz/tema/prevence/aktualizovane-informace-o-potvrzenych-pripadech-onemocneni-2)
17. CDC. Intensive-care patients with severe novel influenza A (H1N1) virus infection – Michigan, June 2009. MMWR Morb Mortal Wkly Rep 2009; 58 : 749–752.
18. Mauad T, Hajjar LA, Callegari GD, da Silva LF, Schout D, Galas FR,et al. Lung pathology in fatal novel human influenza A (H1N1) infection. Am J Respir Crit Care Med 2010; 181 : 72–79.
19. CDC. Prevention and control of influenza: recommendations of the advisory committee on immunization practices (ACIP), 2008. MMWR Morb Mortal Wkly Rep 2008; 57(No. RR-7).
20. Petersen E. Optimal management of severe H1N1. European Congress on Clinical Microbiology and Infectious Diseases, Vienna, 10.–13. 4. 2010.
21. WHO Guidelines for pharmacological management of pandemic influenza A (H1N1) 2009 and other influenza viruses. (http://www.who.int/csr/resources/publications/swineflu/h1n1_guidelines_pharmaceutical_mngt.pdf)
22. Rello J, Pop-Vicas A. Clinical review: Primary influenza viral pneumonia. Critical Care 2009; 13 : 235.
23. Fabiánová K. Prasečí chřipka (online). Státní zdravotní ústav, 25. 4. 2009, rev. 27. 4. 2009 (cit. 2009-04-28).
24. Situation updates – Influenza A (H1N1). WHO (online)/cit. 6. září 2006, http://www.who.int/csr/disease/swineflu/updates/en/index.html
25. Kula R, Maca J, Sklienka P, Tichy J, Szturz P, Jahoda J, Czerný D, Chýlek V, Sukenik P. Exogenous surfactant as a component of complex non-ECMO therapy of ARDS caused by influenza A virus (2009 H1N1). Bratisl. Lek. Listy. 2011; 112(4): 218–222.
26. Blechová Z. Chřipka pandemic H1N1 2009. Lékařské listy 2010; 13.
27. Marcelli D, Marelli C, Richards N. Influenza A (H1N1)v pandemic in the dialysis population: first wave results from an international survey. Nephrol Dial Transplant 2009; 12 : 3566–3572.
28. Jaber S, Conseil M, Coisel Y, Jung B, Chanques G. ARDS and influenza A (H1N1): patients‘ characteristics and management in intensive care unit. (A literature review). Ann Fr Anesth Reanim 2010; 29(2): 117–125. doi:10.1016/j.annfar.2009.12.026. Epub 2010 Feb 8. Review. French.
29. Morgan OW, Bramley A, Fowlkes A, Freedman DS, Tailor TH, et al. Morbid Obesity as a Risk Factor for Hospitalization and Death Due to 2009 Pandemic Influenza A (H1N1). Disease Plos ONE 5 (3): e9694, doi:10.1371/journal.pone.0009694
30. Fezeu L, et al. Obesity is associated with higher risk of intensive care unit admission and dech in influenza A (H1N1) patients: a systemic review and meta-analysis. Obes Rev 2011; 12(8): 653–659.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

Most read in this issue- Adenokarcinom pankreatu – časné symptomy a screening
- Prevalence nadváhy, obezity a podváhy u sedmiletých dětí v České republice od roku 1951*
-
Je závažná obezita nepříznivým prognostickým faktorem u chřipkového zánětu plic?
Poučení z komplikujícího průběhu onemocnění H1N1
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career