-
Medical journals
- Career
Rezistence na tyreoidální hormony*
Authors: Jan Jiskra; Zdeňka Límanová
Authors‘ workplace: III. interní klinika 1. LF UK a VFN, Praha
Published in: Čas. Lék. čes. 2014; 153: 137-141
Category: Review Article
*Článek je věnován k 90. narozeninám prof. MUDr. Vratislava Schreibera, DrSc.
Overview
Rezistence na tyreoidální hormony (RTH) je vzácné onemocnění s prevalencí1 :
40 000–50 000. V 85 % případů je způsobeno mutací genu pro receptor pro tyreoidální hormony TRβ, u zbylých 15 % nelze mutaci prokázat (nonTR-RTH). Pro onemocnění je typická elevace tyreoidálních hormonů v krvi při nesuprimovaném TSH, častá struma a variabilita dalších klinických příznaků. Ty jsou často mírné a řada případů je dokonce zcela asymptomatických. Kardiální příznaky (nejčastěji dysrytmie) mohou být mylně považovány za příznaky hypertyreózy. Někdy se u jednoho nemocného příznaky hypo - a hypertyreózy kombinují podle toho, které tkáně jsou na tyreoidální hormony více či méně citlivé. Diferenciálně diagnosticky je třeba vyloučit jiné častější příčiny podobného obrazu, jako jsou některé léky, non-compliance, laboratorní interferenci a také raritní TSH-secernující tumor hypofýzy. Léčba RTH je symptomatická, a pokud možno, je třeba se vyvarovat tyreoidektomie. Normalizaci tyreoidálních parametrů, ústup klinických příznaků a regresi strumy lze nově dosáhnout i analogy tyreoidálních hormonů (např. 3,5,3´-trijodothyroacetát).Klíčová slova:
rezistence na tyreoidální hormony – volný tyroxin, tyreoidální stimulační hormon – analoga tyreoidálních hormonů – TSH-secernující tumor hypofýzyÚVOD
Rezistence na tyreoidální hormony (RTH) se definuje jako elevace tyreoidálních hormonů při nesuprimovaném TSH a přítomné strumě, způsobená necitlivostí různých tkání na tyreoidální hormony. Onemocnění popsal poprvé Refetoff v roce 1967 (1). Jde o onemocnění vzácné, prevalence se odhaduje na 1 : 40 000–50 000 (2, 3). Dosud bylo ve světě popsáno asi 1000 případů (4).
ETIOLOGIE A PATOGENEZE
Vlastním účinným tyreoidálním hormonem, který ovlivňuje periferní tkáně a zprostředkovává i zpětnou vazbu je trijodtyronin (T3), který vzniká dejodací tyroxinu. Periferní účinky T3 jsou genomové a negenomové. Genomové účinky jsou zprostředkovány vazbou T3 na jaderné tyreoidální receptory TRα (hnědý tuk, srdce, svaly, skelet, gastrointestinální systém, mozek), TRβ1 (ledviny, játra) a TRβ2 (hypothalamus, hypofýza, vnitřní ucho, retina), které ovlivňují transkripci genů pro různé proteiny, a zasahují tím do nejrůznějších metabolických dějů buněk všech orgánů a tkání organismu (5). Gen pro TRα je na 17. chromozomu (THRα), pro TRβ na 3. chromozomu (THRβ). Syndrom rezistence na tyreoidální hormony (RTH) je v 85 % případů způsoben mutací β-receptoru pro tyreoidální hormony (TRβ) na 3. chromozomu. Dosud bylo popsáno více než 150 mutací u necelých 500 rodin. Většinou jde o heterozygoty s autozomálně dominantní dědičností, vzácně jde o homozygoty (6, 7) a u jedné rodiny byla popsána autozomálně recesivní dědičnost (8). Ostatní případy byly dědičné autozomálně dominantně. Vlastním mechanismem defektního receptoru jsou porucha afinity k T3 a porucha interakce s kofaktory (koaktivátory a korepresory), v jejichž důsledku nemohou tkáně přiměřeně odpovídat na T3. Stupeň postižení receptoru nekoreluje s fenotypem RTH. Zbylých 15 % představují případy, kde klinický obraz a laboratorní testy (elevace tyreoidálních hormonů při nesuprimovaném TSH) splňují kritéria pro RTH není však prokázána mutace TRβ a nejedná se o některou z jiných příčin (viz diferenciální diagnóza). Jde o tzv. nonTR-RTH (4, 9).
Nedávno byly popsány i ojedinělé případy mutace receptoru TRα, v těchto případech je však odlišný klinický a laboratorní obraz [růstová retardace, dysplazie skeletu, zácpa, nízký normální tyroxin (T4), vysoký normální T3, nízký poměr T4/T3, nízký reverzní T3 (rT3) a normální TSH v krvi] (10).
KLINICKÝ OBRAZ
Typická je variabilita klinických příznaků, které jsou často mírné, a řada případů je zcela asymptomatických. Na základě klinického obrazu se někdy rozlišuje generalizovaná rezistence (klinicky eutyreoidní či hypotyreoidní nemocný), pituitární rezistence (klinicky hypertyreoidní nemocný), eventuálně i periferní rezistence (klinicky hypotyreoidní nemocný), avšak z patofyziologického hlediska jde o jednu a tutéž chorobu, kdy v jednotlivých případech je rezistence v různých tkáních různě vyjádřena. Někdy se u jednoho nemocného kombinují příznaky hypo - a hypertyreózy podle toho, které tkáně jsou na tyreoidální hormony více či méně citlivé. Nejčastější příznaky RTH jsou v tabulce 1. Laboratorně je typický vyšší volný (FT4) i celkový (TT4) tyroxin, často i vyšší volný (FT3) i celkový (TT3) trijodtyronin a normální nebo mírně vyšší (nesuprimovaný) TSH (tyreoidální stimulační hormon) v krvi. Fibrilace síní u osob středního věku bez objasněné příčiny kombinovaná s vyšším sérovým FT4 vede často k diagnóze hypertyreózy a pacienti pak bývají chybně léčení tyreostatiky, což vede k progresi strumy. Vysoké koncentrace TSH při normálním nebo mírně vyšším FT4 (TT4) naopak nejsou typické a jsou podezřelé z non-compliance. Patogenetické schéma RTH s hlavními klinickými projevy je na obrázku 1. Sonograficky a někdy i palpačně bývá velmi často přítomná difuzní nebo uzlová struma (66–95 %) (9).
Table 1. Klinické příznaky syndromu rezistence na tyreoidální hormony (β-rezistence) (upraveno podle 9, 15) 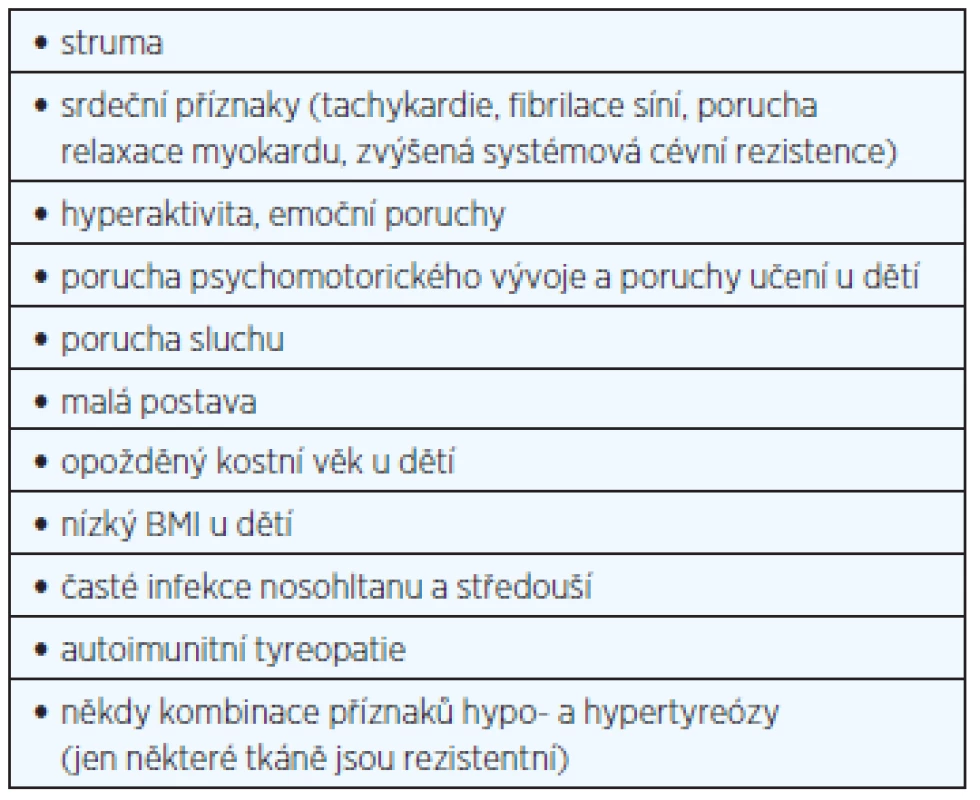
Image 1. Patogenetické schéma syndromu rezistence na tyreoidální hormony TSH – tyreoidální stimulační hormon, FT3 – volný trijodtyroninu, FT4 – volný tyroxin, T4 – tyroxin, T3 – trijodtyronin 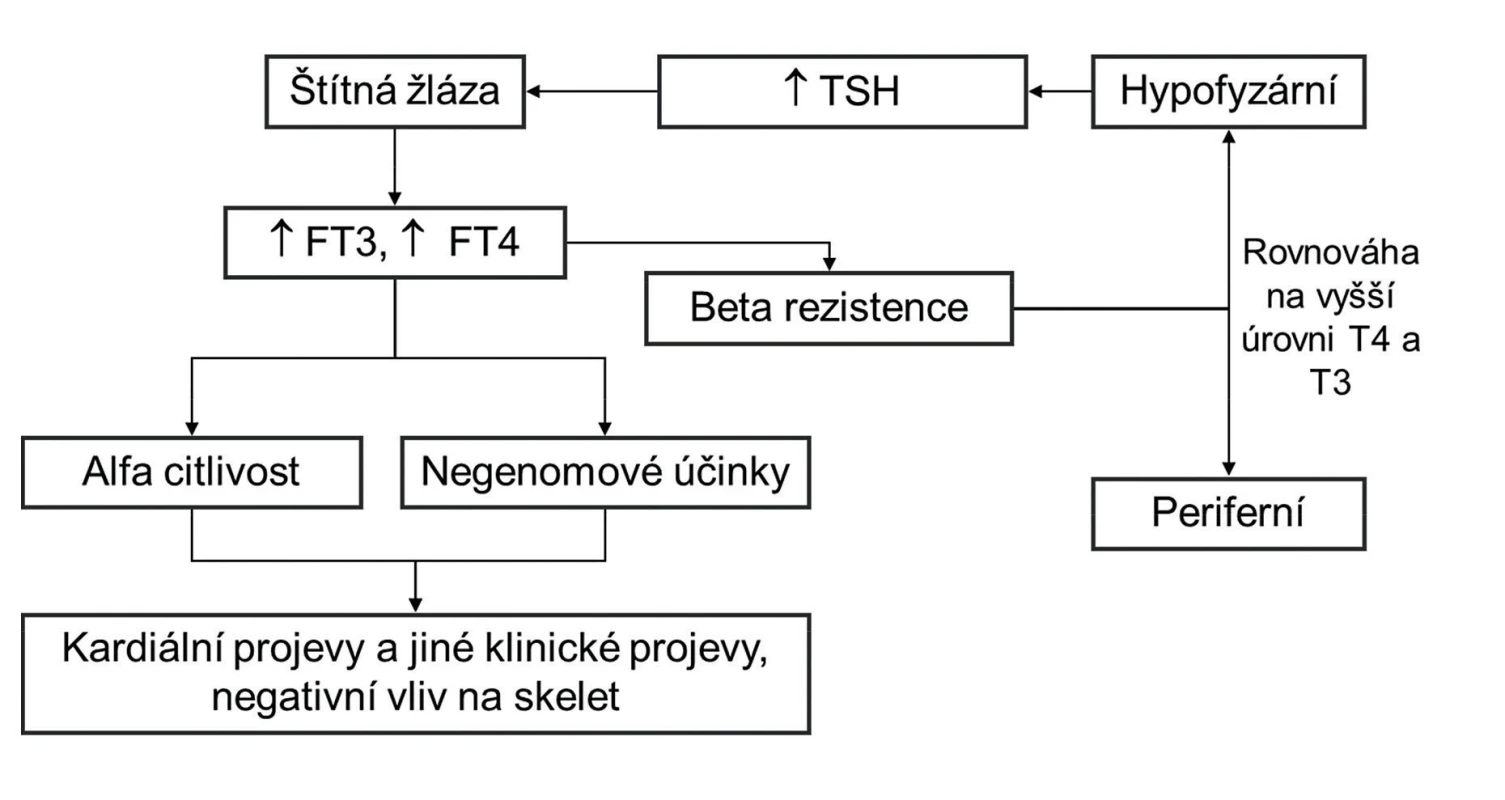
TERAPIE
Léčba je symptomatická. Pokud jsou projevy hypotyreózy (klinické příznaky, dyslipidémie apod.), podává se levotyroxin, při příznacích hypertyreózy jsou účinné betablokátory a u psychických poruch psychofarmaka (11). Tyreostatika jsou kontraindikována. Je vhodná prevence či léčba osteopenie/osteoporózy. U pacientů s RTH je třeba se pokud možno vyvarovat tyreo-idektomie či léčby radiojodem, protože rezistence je příčinou obtížné substituční léčby, která si pak vyžádá velké dávky levotyroxinu (až 1000 µg denně) (9). Někdy se na syndrom RTH přijde právě pro obtíže se substitucí po operaci, která byla indikovaná pro domnělou hypertyreózu (nesprávně diagnostikovanou na podkladě elevace tyreoidálních hormonů při nesuprimovaném TSH). Pokud je však RTH v koincidenci s podezřením na zhoubný nádor, nebo je přítomna klinicky objemná struma s lokálními příznaky, nelze se operaci vyhnout. V poslední době se zkouší v léčbě analoga tyreoidálních hormonů, např. TRIAC (3,5,3´-trijodothyroacetát), D-T4 a jiné, které normalizují hladiny TSH a vedou k redukci strumy (12, 13).
DIFERENCIÁLNÍ DIAGNÓZA
Příčinou elevace tyreoidálních hormonů při nesuprimovaném TSH může být celá řada, jejich přehled je v tabulce 2. Příčinou elevace celkových hormonů je často vzestup vazebných proteinů (thyroxine binding globulin – TBG, albumin, prealbumin), těhotenství, terapie estrogeny a tamoxifenem a jaterní choroby, vzácně je jejich vzestup vrozený. V těchto případech je prvním krokem stanovení FT4 (FT3).
Table 2. Příčiny elevace tyreoidálních hormonů při nesuprimovaném TSH 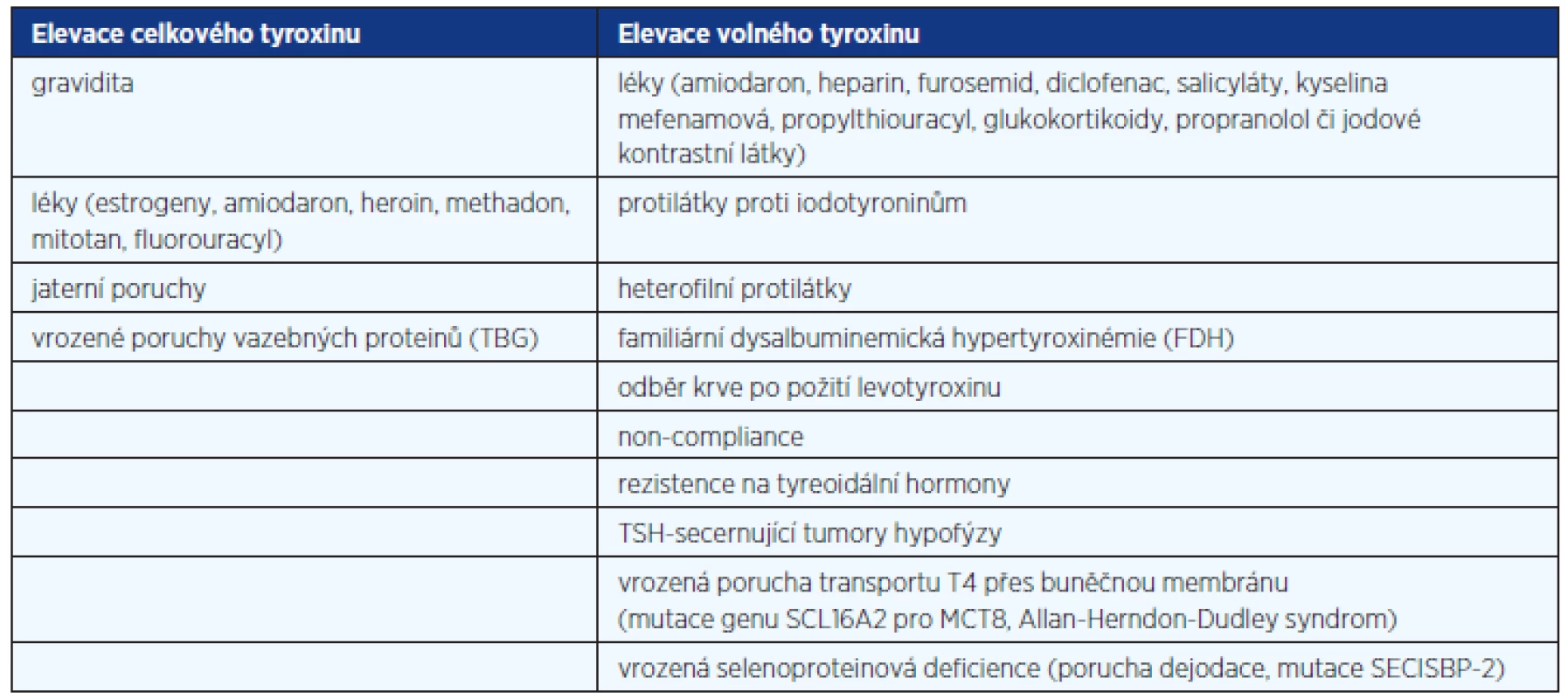
TBG – tyroxin vázající globulin, FDH – familiární dysalbuminemická hypertyroxinémie, T4 – tyroxin, SCL16A2 – gen pro transportér pro tyreoidální hormony MCT8, MCT8 – specific thyroid hormone cell-membrane transporter 8, SECISBP-2 – selenocystein incorporation sequence-binding protein Je-li při nesuprimovaném TSH zvýšený i FT4 (FT3), je diferenciální diagnostika složitější. Je třeba poznamenat, že sérové koncentrace FT4 lze stanovit různými způsoby:1. výpočtem jako FT4 index (TT4 x T3 uptake), nebo jako poměr TT4 a TBG, 2. imunoanalýzou (to je dnes nejběžnější), 3. tekutou chromatografií/tandemovou spektrofotometrií (LC/MS/MS) po předchozí ekvilibrační dialýze. Běžně používané imunoanalýzy předpokládají, že je i během vlastního stanovení zachována rovnováha (ekvilibrium) mezi volnou a vázanou frakcí T4. Tudíž faktory, které naruší tuto rovnováhu, mohou ovlivnit výsledek. Patří sem např. frakcionovaný a nefrakcionovaný heparin (heparin aktivuje lipoproteinovou lipázu, zvyšují se volné mastné kyseliny v séru, které vytěsňují T4 z vazby na proteiny), protilátky proti iodotyroninům, heterofilní protilátky, které blokují analytické protilátky, familiární dysalbuminemická hypertyroxinémie (FDH) a jiné. „Two step“ metody („back titration“) s promytím vzorku před přidáním traceru mohou snížit tuto interferenci, neumí jí však zcela odstranit. Spolehlivě tento problém vyřeší stanovení FT4 tekutou chromatografií/tandemovou spektrofotometrií (LC/MS/MS) po předchozí ekvilibrační dialýze. Tato metoda však není běžně dostupná a je velmi nákladná. Proto se v poslední době znovu někdy vracíme k dříve používaným výpočtům, jako je FT4 index (TT4 x T3 uptake), nebo poměr TT4 a TBG (u nás běžnější). Mutaci genu pro albumin při podezření na FDH lze případně prokázat genetickým vyšetřením.
Obraz zvýšených tyreoidálních hormonů při nesuprimovaném TSH může být způsoben i interferencí stanovení TSH (falešně vysoká hodnota) vlivem interferujících protilátek. To lze laboratorně prokázat vyšetřením s jinou diagnostickou protilátkou (jiná metoda), nelineárním měřením TSH po ředění vzorku (vazbu interferujících protilátek s TSH či reagencii lze ředěním narušit), eventuálně imunosubtrakcí polyethylenglykolem nebo proteiny.
Dalšími častými příčinami elevace tyreoidálních hormonů při nesuprimovaném TSH jsou odběr krve po požití levotyroxinu (maximální koncentrace v séru jsou asi 2,5 hodiny po požití a elevace přetrvává nejméně 9 hodin), non-compliance (pacient dlouhodobě léky neužívá nebo je užívá nesprávným způsobem a poté několik dní před odběrem a v den odběru užívá vyšší dávku ve snaze kompenzovat předchozí vynechání – v těchto případech bývá TSH často více zvýšené, než je typické pro RTH), léky (tab. 2) a jiná závažná celková onemocnění. Dokonce i při fyziologické substituci může být někdy při dosažení normálního TSH mírně zvýšený FT4 a normální FT3, což je přisuzováno změnám zpětné vazby zprostředkované aktivitou dejodázy 2. typu. Amiodaron někdy způsobuje zvýšený TT4 i FT4 vzestupem vazebných proteinů a inhibicí jaterní dejodázy 1. typu. Podobně mohou působit i další léky: propylthiouracyl, glukokortikoidy, propranolol či jodové kontrastní látky (tab. 2).
Dále je třeba odlišit TSH-secer-nující tumor hypofýzy (prevalen-ce 1 : 1000 000) (3), který je ještě vzácnější než RTH. K odlišení pomůže MR hypofýzy, nicméně i pacienti s RTH mohou mít nález afunkčního incidentalomu. U TSH-secernujících tumorů hypofýzy bývá zvýšená alfa-podjednotka (α-SU) v séru, může být ale zvýšená i u afunkčních hypofyzárních tumorů nebo u akromegalie. Pro TSH-secernující tumor svědčí poměr α-SU/TSH větší než 1, ten se ale může někdy vyskytnout i u zdravých osob, zejména postmenopauzálních žen. SHGB v séru bývá zvýšený u TSH-secernujících tumorů a normální u RTH, je však třeba použít normy s ohledem na věk a pohlaví. SHBG může být falešně nízký u hypofyzárních tumorů se smíšenou nadprodukcí růstového hormonu a TSH, naopak terapie estrogeny SHBG zvyšuje. Asi 80–90 % pacientů s TSH - secernujícími tumory má sníženou odpověď TSH v TRH testu (< 150 %bazálních hodnot), naopak u RTH je odpověď normální nebo zvýšená. Lze použít i TRH test po předchozí supresi T3 (3 dny 50 µg, 3 dny 100 µg a 3 dny 200 µg T3 p.o.) (3). U 75 % případů RTH je dominantní dědičnost, tudíž podobné laboratorní nálezy u příbuzných svědčí pro tuto diagnózu. Genetické vyšetření může potvrdit diagnózu RTH, nicméně u 15 % případů RTH nelze mutaci prokázat, což onemocnění nevylučuje (14).
Ještě vzácnější příčinou podobného laboratorního obrazu jsou vrozené poruchy transportu a metabolismu tyreoidálních hormonů, kam patří mutace genu SCL16A2 pro transportér tyreoidálních hormonů přes buněčnou membránu MCT8 (X-vázané onemocnění, které se projevuje psychomotorickou retardací a spastickou kvadruplegií) a vrozené poruchy dejodace, způsobené mutací SECISBP-2 (selenocystein incorporation sequence-binding proteinu) (3, 9).
Diagnostický postup a diferenciální diagnostika při nálezu zvýšených tyreoidálních hormonů při nesuprimovaném TSH je na obrázku 2 a v tabulce 3. V našich podmínkách bývá po vyloučení běžných příčin prvním krokem TRH test, při kterém je u RTH nápadný vzestup sérového TSH.
Image 2. Diagnostický postup při nálezu elevace tyreoidálních hormonů při nesuprimovaném TSH (upraveno podle 3) TSH – tyreoidální stimulační hormon, FT4 – volný tyroxin, FT3 – volný trijodtyronin, TT4 – celkový tyroxin, T3 – trijodtyronin, TBG – tyroxin vázající globulin, α-SU – alfa podjednotka TSH a gonadotropinů, SHGB – pohlavní hormony vázající globulin, MR – magnetická rezonance, TRH – tyreoliberin, THRB – gen pro beta tyreoidální receptor 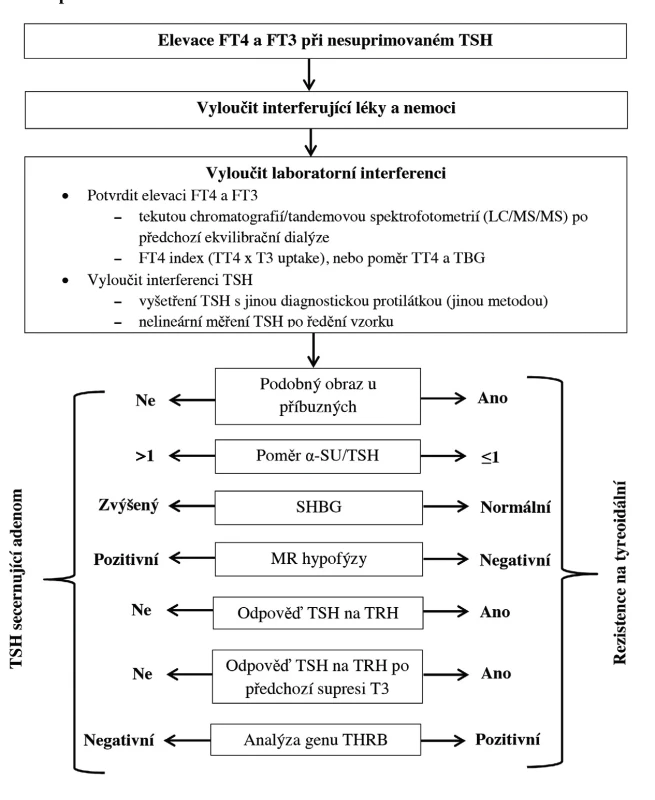
Table 3. Diferenciální diagnostika vzácných genetických příčin vrozené elevace tyreoidálních hormonů při nesuprimovaném TSH (upraveno podle 3) 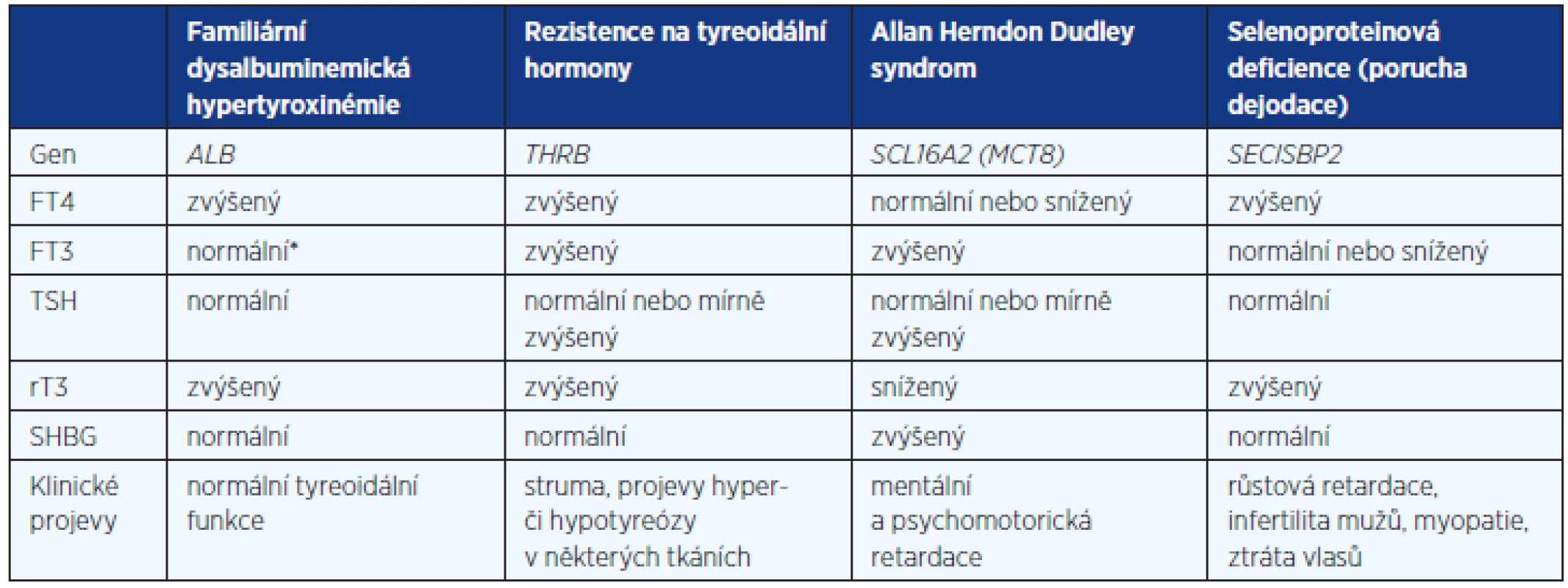
FT4 – volný tyroxin, FT3 – volný trijodtyronin, TSH – tyreoidální stimulační hormon, rT3 – reverzní trijodtyronin, SHGB – pohlavní hormony vázající globulin, ALB – gen pro albumin, THRβ – gen pro β-receptor pro tyreoidální hormony, SCL16A2 – gen pro transportér pro tyreoidální hormony MCT8, SECISBP-2 – gen pro selenoproteiny ZÁVĚR
Rezistence na tyreoidální hormony je vzácné onemocnění, na které je třeba myslet, je-li je přítomný laboratorní obraz zvýšených tyreoidálních hormonů v krvi při nesuprimovaném TSH. Před tím je však třeba vyloučit jiné častější příčiny podobného obrazu, jako jsou některé léky, non-compliance, laboratorní interferenci a také raritní TSH-secernující tumor hypofýzy. Diagnózu lze potvrdit genetickým vyšetřením TRβ genu u pacienta a jeho příbuzných, avšak až u 15 % není mutace zachycena. Léčba je symptomatická, a pokud možno, je třeba se vyvarovat tyreoidektomie. Normalizaci tyreoidálních parametrů, ústup klinických příznaků a regresi strumy lze nově dosáhnout i analogy tyreoidálních hormonů (např. 3,5,3´-trijodothyroacetát).
Zkratky
α-SU alfa podjednotka TSH a gonadotropinů
ALB gen pro albumin
BMI body mass index
FDH familiární dysalbuminemická hypertyroxinémie
FT3 volný trijodtyronin
FT4 volný tyroxin
MCT8 specific thyroid hormone cell-membranetransporter 8
MR magnetická rezonance
rT3 reverzní T3
RTH rezistence na tyreoidální hormony
SCL16A2 gen pro transportér pro tyreoidální hormony MCT8
SECISBP-2 gen pro selenoproteiny) selenocysteinincorporation sequence-binding protein)
SHGB pohlavní hormony vázající globulin
T3 trijodtyronin
T4 tyroxin
TBG tyroxin vázající globulin (tyroxine bindingglobulin)
THRα gen pro tyreoidální receptor α
THRβ gen pro tyreoidální receptor β
TRα α-receptor pro tyreoidální hormony
TRβ β-receptor pro tyreoidální hormony
TRH tyreoliberin
TSH tyreoidální stimulační hormon
TT3 celkový trijodtyronin
TT4 celkový tyroxin
ADRESA PRO KORESPONDENCI:
doc. MUDr. Jan Jiskra, Ph.D.
III. interní klinika 1. LF UK a VFN
U Nemocnice 1, 128 08 Praha 2
e-mail: jan.jiskra@vfn.cz
Sources
1. Refetoff S, DeWind LT, DeGroot LJ. Familial syndrome combining deaf-mutism, stuppled epiphyses, goiter and abnormally high PBI: possible target organ refractoriness to thyroid hormone. J. Clin. Endocrinol. Metab 1967; 27(2): 279–294.
2. Lafranchi SH, Snyder DB, Sesser DE, Skeels MR, Singh N, Brent GA, Nelson JC. Follow-up of newborns with elevated screening T4 concentrations. J Pediatr 2003; 143 : 296–301.
3. Gurnell M, Halsall DJ, Chatterjee VK. What should be done when thyroid function tests do not make sense? Clin Endocrinol (Oxf) 2011; 74(6): 673–678.
4. Hershman JM, Cheng SY, Gianoukakis AG. Update in thyroidology 2010. J Clin Endocrinol Metab 2011; 96(1): 9–14.
5. Běhanová M, Nedvídková J. Periferní účinky tyreoidálních hormonů. In: Stárka L, et al. Aktuální endokrinologie. Praha: Grada Publishing 1999; 283–295.
6. Takeda K, Sakurai A, DeGroot LJ, Refetoff S. Recessive inheritance of thyroid hormone resistance caused by complete deletion of the protein-coding region of the thyroid hormone receptor-beta gene. J Clin Endocrinol Metab 1992; 74(1): 49–55.
7. Ferrara AM, Onigata K, Ercan O, Woodhead H, Weiss RE, Refetoff S.Homozygous thyroid hormone receptor β-gene mutations in resistance to thyroid hormone: three new cases and review of the literature. J Clin Endocrinol Metab 2012; 97(4): 1328–1336.
8. Slezak R, Lukienczuk T, Noczynska A, Karpinski P, Lebioda A, Misiak B,Sasiadek MM. A novel p.E311K mutation of thyroid receptor beta gene in resistence to thyroid hormone syndrome, inherited in autosomal recessive trait. Horm Metab Res 2012; 44(9): 704–707.
9. Weiss WR, Refetoff S. Resistance to Thyroid Hormone (RTH) in the Absence of Abnormal Thyroid Hormone Receptor (TR) (nonTR-RTH). Hot Thyroidol 2009a; 9 : 1–11.
10. Moran C, Schoenmakers N, Agostini M, Schoenmakers E, Offiah A, Kydd A, Kahaly G, Mohr-Kahaly S, Rajanayagam O, Lyons G, Wareham N,Halsall D, Dattani M, Hughes S, Gurnell M, Park SM, Chatterjee K. An adult female with resistance to thyroid hormone mediated by defective thyroid hormone receptor α. J Clin Endocrinol Metab 2013; 98(11): 4254–4261.
11. Kannan S, Safer JD. Finding the right balance between resistance and sensitivity: a review of the cardiac manifestations of the syndrome of resistence to thyroid hormone and the implications for treatment. Endocr Pract 2012; 18(2): 252–265.
12. Radetti G, Persani L, Molinaro G, Mannavola D, Cortelazzi D, Chatterjee VK, Beck-Peccoz P. Clinical and hormonal outcome after two years of triiodothyroacetic acid treatment in a child with thyroid hormone resistance. Thyroid 1997; 7(5): 775–778.
13. Anzai R, Adachi M, Sho N, Muroya K, Asakura Y, Onigata K. Long-term 3,5,3‘-triiodothyroacetic acid therapy in a child with hyperthyroidism caused by thyroid hormone resistance: pharmacological study and therapeutic recommendations. Thyroid 2012; 22(10): 1069–1075.
14. Weiss RE, Refetoff S. Treatment of resistance to thyroid hormone-primum non nocere. J Clin Endocrinol Metab 1999b; 84(2): 401–404.
15. Kahaly GJ, Metthews CH, Mohr-Kahaly S et al. Cardiac involvment in thyroid hormone resistance. J Clin Endocrinol Metab 2002; 87(1): 204–212.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Přístrojový přístup k personalizaci medicíny (vyšetření u pacienta, Point of Care Testing)*
- Perspektivy farmakoterapie obezity*
- Současné možnosti a perspektivy léčby akromegalie*
- Rezistence na tyreoidální hormony*
- Současné možnosti non-orální estrogen-progestinové antikoncepce
- Dobrá smrt: eutanazie očima studentů medicíny
- Vareniklin: bezpečná léčba závislosti na tabáku u kardiovaskulárních pacientů
- Příspěvek k dějinám farmakologie (období raného římského císařství)
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rezistence na tyreoidální hormony*
- Dobrá smrt: eutanazie očima studentů medicíny
- Současné možnosti non-orální estrogen-progestinové antikoncepce
- Současné možnosti a perspektivy léčby akromegalie*
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

