-
Medical journals
- Career
Autofagie a její úloha v obranné a poškozující zánětové reakci*
: Jan Krejsek; Lucia Hrnčířová; Drahomíra Holmannová; Irena Berglová; Mouhammed Abuattieh; Ctirad Andrýs
: Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Ústav klinické imunologie a alergologie FN
: Čas. Lék. čes. 2012; 151: 128-134
: Review Articles
Autofagie je součástí biologické strategie buňky překonat nepříznivé životní podmínky. Je významnou složkou obrany cytoplazmatického kompartmentu buňky před intracelulárními patogeny. Abnormity v autofagii jsou jednou z příčin nedostatečné kontroly mikrobiomu střeva nemocných s Crohnovou chorobou a podílejí se na její imunopatogenezi. Deregulace autofagie přispívá k přežívání autoreaktivních T-lymfocytů, a uplatňuje se tak v imunopatogenezi roztroušené sklerózy.
Klíčová slova:
autofagie, imunita, zánět, roztroušená skleróza, Crohnova choroba.*Rukopis je dedikován jako součást připomenutí 150. výročí vzniku Časopisu lékařů českých.
Úvod
Organismy si evolučně vytvořily velmi účinné a rozmanité strategie jak přežít. Vrcholu svého „umu“ dosáhla v tomto ohledu evoluce v Homo sapiens. V tomto přehledovém sdělení se pokusíme stručně vysvětlit jeden z adaptačních mechanismů, který využívá ke svému přežití základní funkční jednotka organismů – buňka. Konkrétně se budeme zabývat procesem autofagie, který původně zajišťoval buňce přežití za nepříznivých podmínek. Od této základní úlohy autofagie se postupně oddělily další významné funkce. Autofagie se podílí na udržení integrity buňky na úrovni makromolekul a organel. Sehrává významnou roli v obraně proti nitrobuněčně lokalizovaným patogenním mikroorganismům a uplatňuje se v regulačních i efektorových funkcích imunitního systému. Autofagie, která byla ještě v nedávné době tématem výzkumu pro specialisty v buněčné biologii, se v současnosti dostává do popředí zájmu mnoha odborníků v klinické medicíně. Jsou totiž již nyní k dispozici údaje, že autofagie se fyziologicky i patofyziologicky podílí na udržení buněčné i celkové homeostázy. Uplatňuje se v patogenezi zánětlivých a degenerativních procesů, které jsou příčinou vzniku a rozvoje závažných onemocnění a určují i stárnutí člověka (1–3).
Autofagie – homeostatický buněčný mechanismus
V průběhu životního cyklu buňky, který začíná vznikem nové buňky a končí některou z forem buněčné smrti (apoptóza, nekróza, pyroptóza, pyronekróza, autofagie aj.) jsou v procesu proteosyntézy tvořeny nové proteiny (4, 5). Proteosyntéza je složitě strukturovaný děj, který je na mnoha úrovních regulován. Přesto vznikají i za fyziologických okolností proteiny, které jsou strukturně a funkčně alterované. Pravděpodobnost tvorby alterovaných molekul se zvyšuje vlivem buněčného stresu či stárnutí buňky. Buňka může část defektních konformačně změněných bílkovin opravit prostřednictvím stresových proteinů Hsp, patřících do rodiny chaperonů. Většina alterovaných makromolekul nebo agregátů bílkovin však musí být degradována. Buňka jejich degradací sleduje dva cíle: odstraňuje potenciálně škodlivé makromolekuly a jejich recyklací získává energii a výchozí složky pro nové biosyntézy. Pro degradaci bílkovin využívá tzv. proteazomovou cestu, kdy je protein denaturován, označen ubikvitinem a směrován do specializované organely, proteazomu, k degradaci. Zvláštní postavení v této cestě zaujímají tzv. imunoproteazomy, které vytváření peptidové fragmenty následně transportované do endoplazmatického retikula prostřednictvím transportních systémů TAP. V endoplazmatickém retikulu tyto antigenní fragmenty vytvářejí komplexy s molekulami HLA I. třídy a jsou po vystavení na buněčné membráně rozpoznávány cytotoxickými CD8+ T-lymfocyty.
Degradace alterovaných makromolekul je realizována i teprve v nedávné minulosti popsanou cestou autofagie. Autofagií mohou být odstraněny velké buněčné struktury, např. mitochondrie, jejichž degradace prostřednictvím proteazomu není pochopitelně možná. Autofagie spočívá v ohraničení a sekvestraci alterovaných makromolekul, agregátů či narušených organel v určitém okrsku cytoplazmy dvojí cytoplazmatickou membránou. Vzniká tak autofagozom, který je následně směrován k fúzi s lyzozomem. Ve vzniklém autofagolyzozomu je ohraničený materiál proteolyticky rozložen. Takto popsána je tzv. makroautofagie. Kromě ní se na směrování materiálu do endozomálního/lyzozomálního kompartmentu podílejí ještě mikroautofagie a autofagie zprostředkovaná chaperony. Jak již bylo řečeno, autofagie pro buňku zajistí odstranění potenciálně škodlivých makromolekul. Degradace oxidativně či enzymaticky modifikovaných makromolekul, ale i zdravých komponent cytoplazmy však umožní i přežití buňky za situace buněčné metabolické krize, nutriční, oxidativní, informační či jiné deprivace buňky. Zde částečná konzumpce vlastních buněčných struktur dá buňce možnost překonat období metabolické či jiné deprivace. Klíčovou regulační molekulou, která slouží jako senzor nitrobuněčné úrovně energie a živin, tj. ATP a volných aminokyselin, je kináza mTOR. Nutrienty a růstové faktory udržují kinázu mTOR aktivní a procesy autofagie jsou jejím prostřednictvím blokovány (1).
Autofagie zahrnuje tři kroky: iniciační, ve kterém vzniká z biomembrán útvar ve tvaru půlměsíce, zvaný fagofor; dále elongační a uzavírací krok, ve kterém je v kompletní autofagozom uzavřen a obklopuje materiál určený k degradaci (cargo). Posledním je maturační krok charakterizovaný přeměnou autofagozomu do degradační organely – autofagolyzozomu, který vzniká jeho fúzí s pozdními endozomálními a lyzozomálními organelami. Lze konstatovat, že naše představy o molekulárním základu tohoto procesu jsou zatím neúplné. Detailní popis je za rámcem tohoto sdělení, a proto odkazujeme na původní literaturu. Rámcově lze konstatovat, že kináza mTOR spolu s dalšími komponentami zajistí tvorbu fagoforu vycházejícího z endoplazmatického retikula. Tohoto procesu se zúčastní cytoplazmatická membrána, endoplazmatické retikulum, mitochondrie, proteinové a lipidové komponenty, např. fosfatidyletanolamin a fosfatidylserin, které jsou odvozeny právě z mitochondrií. S ohledem na další výklad uvedeme, že iniciační fáze autofagie regulují molekuly beclin a mATG14. V kroku elongace konjugují molekuly ATG5-ATG12 s ATG6L, které se regulačně podílejí na vytvoření organely, tvořené dvojitou biomembránou, která obklopí obsah pro následnou lýzu. V třetím, maturačním kroku, fúzuje autofagozom s lyzozomy opět účinkem složitých molekulových komplexů, obsahujících beclin. Po fúzi je vnitřní membrána autofagozomu lyzována a proteolyticky je degradován i obsah autofagolyzozomu (2) (obr. 1).
1. Autofagie – nitrobuněčný mechanismus 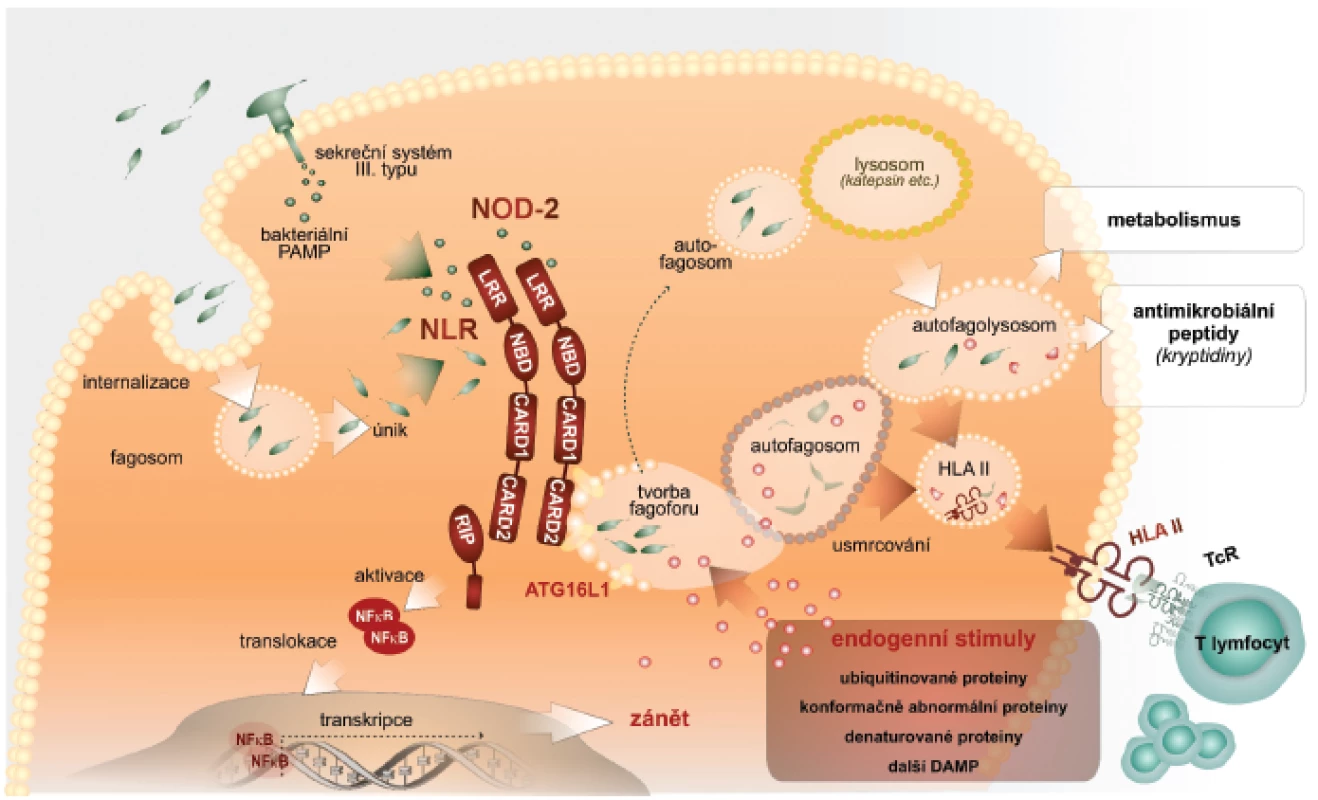
Autofagie a imunitní odpověď
Od základní funkce autofagie, tj. udržovat homeostázu buňky a umožnit její přežití v nepříznivých podmínkách, je evolučně odvozena úloha autofagie v regulačních a efektorových funkcích imunity. Vhled do této mimořádně komplexní oblasti imunologie umožnil fundamentální paradigmaticky nový pohled na vrozenou imunitu. V uplynulých 15 až 20 letech byla znovu objevena a šířeji pochopena zásadní role vrozené imunity na udržení homeostázy, jak byla formulována již v roce 1883 Iljou Mečnikovem. Ve zcela zkratkovitém přehledu zdůrazníme několik klíčových aspektů.
Bylo prokázáno, že buňky vrozené imunity, zvláště dendritické a makrofágové elementy, ale v určité míře všechny ostatní buňky těla včetně epitelových a endotelových buněčných struktur exprimují receptory, které označujeme jako receptory PRR (pattern recognition receptors). Receptory PRR jsou schopny odlišit nebezpečné vzory, tj. takové struktury, které přímo nebo zprostředkovaně narušují homeostázu člověka. Protikladem k signálům nebezpečí, na které musí tělo reagovat zánětovou odpovědí, jsou bezpečné signály, které homeostázu nenaruší a tělo na ně nebude reagovat. Každá obranná reakce těla je spojena s metabolickými náklady a jistou mírou poškození vlastních struktur. Proto je koncepce „nebezpečné“ vs. „bezpečné“ tak významná. Receptory PRR jsou lokalizovány na buněčných membránách nebo se nacházejí v nitrobuněčných kompartmentech – např. v endozomu. Některé jsou však rozptýleny i volně v cytoplazmě. V tělních tekutinách, např. plazmě, se nacházejí solubilní receptory PRR. Receptory PRR jsou v současnosti představovány již několika desítkami plně definovaných struktur (6, 7).
Jak již bylo řečeno, receptory PRR identifikují signály nebezpečí, které můžeme rozdělit na nebezpečné vzory nacházející se ve vnějším prostředí – exogenní a na signály nebezpečí, které vznikají v organismu – endogenní signály nebezpečí. Exogenní nebezpečné vzory jsou těžko popsatelnou směsicí nebezpečných podnětů různého původu a různého charakteru. Pro naše úvahy se soustředíme pouze na nebezpečné vzory charakterizující patogenní mikroorganismy. Velmi zjednodušeně lze říci, že patogenní mikroorganismy jsou charakterizovány přítomností PAMP (pathogen associated molecular patterns) a indukují obrannou zánětovou reakci. Naopak nepatogenní mikroorganismy včetně přirozené mikroflóry člověka vzory PAMP neobsahují a zánětovou reakci neindukují. Tímto způsobem je vyřešen paradox klasického paradigmatu fungování imunitní soustavy postavený na rozpoznávání „cizího“ a toleranci „vlastního“. Je zřejmé, že v modelu mikrobiálního světa by realizace této koncepce vedla k reakci i na nepatogenní mikroorganismy, případně na složky vlastní mikroflóry, protože i tyto se jeví specifické imunitě jako cizí. Koncepce receptorů PRR jako charakteristických rozpoznávacích struktur vrozené imunity, ale také epitelových a jiných buněčných struktur těla schopných odlišit vzory PAMP a reagovat na ně rozvojem zánětové reakce řeší (8, 9).
Teprve s časovým odstupem byla propracována koncepce endogenních signálů nebezpečí. Jakékoliv inzulty, které poškodí integritu buněk a tkání, jsou příčinou vzniku alterovaných struktur nebo jsou odpovědné za buněčnou smrt charakteru nekrózy, lze označit jako endogenní nebezpečné vzory DAMP (danger associated molecular pattern). Opět lze stěží provést výčet vzorů DAMP, které v průběhu života člověka vznikají. Velmi zjednodušeně lze za vzory DAMP považovat chemicky nebo oxidativně modifikované molekuly (oxLDL), konformačně změněné proteiny (tau protein), agregáty bílkovin, ale také přítomnost krystalů urátů. Výraznými vzory DAMP jsou struktury translokované do jiných než fyziologických kompartmentů buňky. Takovým příkladem mohou být nukleoproteiny (HMGB-1), které se z jaderné lokalizace při nekróze dostávají mimo tento kompartment. Extracelulárně zvýšené koncentrace primárně intracelulárně lokalizovaných molekul, např. ATP či eflux draslíku, jsou opět identifikovány receptory PRR jako přítomnost endogenních signálů nebezpečí (10–12).
K identifikaci exo - i endogenních signálů nebezpečí má buňka k dispozici omezené množství několika desítek v současné době definovaných receptorů PRR. Tyto receptory jsou spojeny s nitrobuněčnými signálními drahami, které obvykle vedou k aktivaci transkripčního faktoru NFκB a aktivaci kináz MAPK. Cestou NFκB je stimulován přepis genů s obecně prozánětovými aktivitami. Tyto kroky jsou realizovány v časných fázích rozvoje zánětové odpovědi, na kterých se podílejí složky vrozené imunity a jiných buněčných systémů těla. Zapojení specifické imunitní odpovědi, především T lymfocytárního systému, představuje následnou etapu rozvoje zánětové odpovědi. Je dobře doloženo, že T lymfocytární specifická imunitní odpověď je podmíněna funkcí buněk vrozené imunity, především dendritických buněk a makrofágů, které slouží jako buňky prezentující antigen. Z naznačeného je tedy zřejmé, že specifická T lymfocytární imunita je rozvíjena pouze za situace, kdy buňky vrozené imunity identifikovaly nebezpečné vzory, zpracovaly je a antigenní fragmenty prezentovaly T-lymfocytům v kontextu kostimulačních molekul a v kontextu optimálního cytokinového mikroprostředí (13).
Výše uvedený stručný nárys současného paradigmatu fungování imunitní soustavy byl nutný pro následující popis, jak je do funkce imunitní soustavy integrován fenomén autofagie. Autofagie ve vztahu k imunitní reakci totiž musí výrazně kooperovat s některými komponentami imunitního systému (14). Rozhodující je úvodní fáze, která je na počátku autofagické mašinérie. Autofagie se spolupodílí na udržení bezmikrobního prostředí buňky, především jejího cytoplazmatického kompartmentu. Schopnost patogenních bakterií vstupovat do tohoto kompartmentu představuje významný mechanismus úniku této skupiny patogenů imunitnímu dozoru. Cytoplazma buňky slouží pro patogenní bakterie jako ideální zdroj živin. Navíc jsou bakterie v tomto kompartmentu skryty složkám imunitního dozoru. Intracelulárně parazitické bakterie si evolučně vytvořily velmi sofistikovaný způsob jak vstupovat do hostitelských buněk, zvláště do buněk vrozené imunity. Využívají k tomu i receptory vyjádřené na povrchu buněk. Jiné skupiny bakterií mají schopnost pomocí sekrečních systémů, např. sekrečního systému III. typu, vnášet do cytoplazmy hostitelské buňky své nebezpečné vzory. Proto je nezbytné, aby v cytoplazmě buněk byly přítomny receptory PRR, které patogenní bakterie či jejich produkty identifikují a eliminují (15).
V cytoplazmě jsou lokalizovány receptory, které označujeme jako receptory NLR (16). Jejich strukturní charakteristika je známá. Dalšími strukturně odlišnými senzory PRR jsou v cytoplazmě receptory označované jako RIG. Identifikace velmi rozmanitých bakteriálních PAMP – např. muramyldipeptidu Gram+ bakterií, kyseliny diaminopimelové M. tuberculosis a mnoha jiných prostřednictvím receptorů NLR vede k sestavení tzv. inflamazomu. Opět velmi zjednodušeně uvádíme, že inflamazom je definován jako multimolekulový komplex, který funkčně vede k aktivaci latentní prokaspázy-1 za vzniku aktivní kaspázy-1. Ta štěpí biologicky neaktivní prekurzory interleukinu-1ß (IL), IL-18 a zřejmě také IL-33 za vzniku v případě IL-1ß a IL-18 zřetelně pluripotentních prozánětových cytokinů, které stimulují rozvoj zánětové odpovědi na v cytoplazmě přítomné mikroorganismy. Imunobiologické efekty IL 33 jsou komplikovanější a nebudou v tomto přehledu diskutovány (17, 18).
Pro vytvoření prozánětových podmínek jako odpovědi na intracelulárně lokalizované patogenní bakterie vedle sebe působí jednak signální dráha NFκB, která vede k zvýšené tvorbě latentních forem proIL-1ß, proIL-18, proIL-33 a dalších cytokinů (19). Současně je výše popsaným způsobem stimulováno sestavení inflamazomu, který konvertuje latentní formy interleukinů na zmíněné mimořádně potentní prozánětové působky (20). Součinnost signální dráhy NFκB a sestavení inflamazomu jako nutné podmínky tvorby pluripotentních prozánětových cytokinů představuje významný regulační prvek zánětové reakce. Zvýšená tvorba prozánětových cytokinů je charakteristická právě pro časné fáze obranné reakce proti mikroorganismům. Paradoxně však neřeší vlastní sanaci nitrobuněčných kompartmentů od invadujících patogenních mikroorganismů (21). Jejich eliminace je možná cytotoxickou aktivitou, při které je však infikovaná buňka likvidována. Vhodnější způsob, který není spojen se ztrátou infikované buňky, je nitrobuněčná očista. Na ní se podílí právě autofagie. Velmi zjednodušeně je autofagie využita k tomu, aby identifikované patogenní bakterie byly výše popsanými způsoby obklopeny autofagozomálním membránovým aparátem, a tak sekvestrovány od zbytku cytoplazmy. V dalším kroku je potom autofagozom směrován k endozomálnímu či lyzozomálnímu aparátu buňky, se kterým fúzuje. Vytvoření autofagozomu obklopujícího patogenní bakterie v úvodních krocích vyžaduje součinnost s receptory NLR, které mikroba identifikují. Po vytvoření autofagolyzozomu jsou bakterie v agresivním prostředí usmrcovány a proteolyticky rozkládány. Vznikají z nich využitelné živiny (22).
Výše uvedené představy o iniciaci autofagie prostřednictvím receptorů NLR jsou v současné době postupně doplňovány o hlubší poznání podílu dalších molekulově odlišných cytoplazmatických receptorů signálů nebezpečí. Některé z receptorů TLR jsou lokalizovány intracelulárně, a mohou tak sloužit jako inicializační receptory procesu autofagie. Takováto vazba byla prokázána mezi heterodimery TLR2/TLR1, dále TLR3 a TLR7/8. Dalšími z nich jsou receptory označované jako SLR (sequestosome-like-receptors). SLR jsou definovány jako autofagické receptorové/adaptorové molekuly, které rozpoznávají substráty určené pro autofagii ubikvitinací. Byla prokázána úloha receptorů SLR v autofagii nitrobuněčně lokalizovaných bakterií rodů Salmonella, Shigella, Listeria a Streptococcus (23).
Je obecně přijímáno, že v procesu autofagie jsou některé cytoplazmatické proteiny, které jsou přivedeny do procesu autofagie prostřednictvím SLR zpracovány tak, že jejich rozložením v autofagolyzozomu dochází k jejich úplnému rozkladu na jednotlivé aminokyseliny, které jsou použitelné pro anabolické potřeby buňky. Z pohledu imunity je však unikátní možnost, že částečným proteolytickým rozštěpením těchto cytoplazmatických substrátů vznikají peptidové molekuly, které mají vlastnosti antimikrobiálních peptidů. Mohou se bezprostředně podílet na autofagozomovém usmrcení sekvestrovaných patogenů (mykobakterií). Mají však i signální úlohy pro rozvoj imunitní reakce, protože antimikrobiální peptidy, např. defenziny jsou považovány za významné endogenní nebezpečné vzory stimulující vznik a rozvoj zánětové odpovědi. Pro tyto vlastnosti se označují jako tzv. alarminy (24). Alarminy stimulují diferenciaci dendritických buněk a zpracování antigenů v těchto buňkách s následným rozvojem specifické T lymfocytární odpovědi. Defenziny a jiné antibakteriální peptidy tedy v sobě nesou duální funkce, tj. regulační i efektorové. Podstatnou pro další kroky imunitní odpovědi je však tvorba peptidových fragmentů, které jsou navázány na HLA molekuly II. třídy a prezentovány pomocným CD4+ T-lymfocytům. Tak je aktivována specifická T-buněčná imunita, která mnohými způsoby, např. tvorbou interferonu-γ zesiluje mikrobicidní aktivity makrofágů a jiných buněk těla.
Autofagie je efektorovým antimikrobiálním mechanismem, který vychází z funkce molekul IRG (imunity-related GTPases). U člověka byla prokázána významná úloha IRGM v indukci autofagické obranné reakce nutné pro eliminaci M. tuberculosis v makrofázích. IRGM jsou rovněž aktivní v epitelových buňkách zvláště střevní sliznice, kde se uplatňují v eliminaci mikrobiálních podnětů.
Procesy vedoucí k autofagii jsou iniciovány nejenom identifikací exogenních nebezpečných mikrobiálních vzorů PAMP v cytoplazmě buněk, ale autofagie může být iniciována i identifikací endogenních nebezpečných vzorů DAMP (25). Těmi jsou například krystaly urátů, nukleoproteiny uvolněné z narušeného jaderného aparátu buňky (HMGB-1), extracelulárně lokalizované ATP, ale také eflux kalia. Jejich přítomnost vede k prozánětovým aktivitám mimo jiné spojených s funkcí inflamazomu. Na příkladu nukleoproteinu HMGB-1 můžeme ukázat, že jeho translokace do cytoplazmy vede k jeho oxidaci na cysteinu. Další dva cysteinové zbytky (C23, C45) potom vytvářejí můstky s autofagozomální adaptorovou molekulou Beclin1, a stimulují tak proces autofagie. Tímto způsobem HMGB-1 reguluje přežití buněk v nepříznivých podmínkách. Pokud HMGB-1 je z buněk uvolněno v procesu nekrózy, je identifikováno buněčnými povrchovými receptory PRR, zvláště buněk vrozené imunity. Typickým receptorem pro HMGB-1 jsou receptory RAGE, které jsou pojmenovány podle své primární schopnosti identifikovat produkty pokročilé glykace (advanced glycation end products – AGE). Kromě AGE a HMGB-1 však receptory RAGE patřící do rodiny imunoglobulinů, identifikují řadu dalších molekul charakteru alarminů či DAMP. Na konci je vždy prozánětová aktivita (26, 24).
Autofagie – významný činitel imunopatologických procesů
Fenomén autofagie ovlivňuje mnoho aspektů fyziologické zánětové odpovědi. Mimo jiné i tím, že významným způsobem zasahuje do fungování imunitního systému, který je jedním z ústředních prvků zánětové odpovědi. Nejvíce informací, jak vyplývá z předchozího textu, je k dispozici v oblasti antiinfekční obranné reakce (23). V posledních letech jsou však již k dispozici experimentální údaje na zvířecích modelech a výsledky prvních klinických studií, které naznačují podstatnou účast autofagie v patogenezi imunopatologických a autoimunitních onemocnění. Pro naše sdělení jsme vybrali jako model dvě imunopatologické nemoci, a to Crohnovu chorobu a roztroušenou sklerózu mozkomíšní. Tato dvě závažná a frekventní onemocnění se zásadně odlišují ve své patogenezi. Podle nejnovějších konceptů je podstatnou součástí vzniku a rozvoje Crohnovy choroby nedostatečnost slizničního imunitního systému kontrolovat střevní mikroflóru. Důsledkem je pronikání prozánětově působících složek či celých mikroorganismů do epitelových struktur s následným rozvojem zánětové odpovědi. Je to proces, který zahrnuje jak buňky imunitního systému, tak epitelové struktury střevní sliznice. Paradoxně můžeme velmi zjednodušeně říci, že v případě Crohnovy choroby se zřejmě jedná primárně o „nedostatečnost“ imunitního systému (27, 28).
Roztroušená skleróza mozkomíšní je podle stávajícího paradigmatu považována za prototypovou autoimunitní imunopatologickou nemoc, v jejichž patogenezi jsou zatím za nejdůležitější považovány autoreaktivní T-lymfocyty. Ty rozpoznávají již velmi dobře charakterizované molekulové terče, které jsou součástí myelinové pochvy neuronů (MBP). Díky skutečnosti, že pro mozkomíšní sklerózu existuje zvířecí experimentální model experimentální autoimunitní encefalitidy (EAE), je imunopatogeneze této nemoci velmi detailně poznána na buněčné i molekulární úrovni. Autoreaktivní T-lymfocyty subpopulace pomocných CD4+ T-lymfocytů patří do subsetu TH1 T-lymfocytů. Ve spolupráci s dalšími komponentami imunitního systému je u nemocných s mozkomíšní sklerózou rozvíjena imunopatologická reakce IV. typu. Právě subset autorektivních T-lymfocytů, jeho vznik a udržování jsou významně regulovány prostřednictvím autofagie. Rychle přibývají důkazy, že dosavadní důraz na patofyziologické působení specifické buněčné imunity brání pochopit imunopatogenezi roztroušené sklerózy v celé šíři. Je postupně doceňována úloha protilátek. Především však začínáme vidět zřetelně fundamentální úlohu mechanismů vrozené imunity.
Autofagie a imunopatogeneze Crohnovy choroby
Crohnova choroba je závažné imunopatologické onemocnění, které postihuje trávicí trubici. Studiu imunopatogeneze tohoto poměrně častého onemocnění je věnována značná pozornost. Přesto i v takto dobře a dlouhodobě studované lidské nemoci lze získat nové překvapivé pohledy (29, 30). Ty přinesla aplikace nových metod, které umožňují analýzu lidského genomu po jednotlivých nukleotidech. Takovýto přístup je označován GWS (genome-wide studies) (31). Překvapivě bylo v případě Crohnovy choroby v několika nezávislých studií zahrnujících etnicky odlišné rozsáhlé soubory nemocných zjištěno, že nejvýznamněji predisponují k rozvoji Crohnovy choroby, zvláště jejích klinicky nejzávažnějších forem, polymorfismy v molekulách PRR, které jsou lokalizovány intracelulárně. Jde o receptory NLR NOD1,2 a senzorové molekuly inflamazomu NLRP3 (32, 33). Molekula NOD2 se skládá ze dvou N-terminálních segmentů, odpovědných za vazbu kaspázy-1 (úseky CARD), které jsou spojeny s centrálně umístěnou částí vázající nukleotidy (NOD). Na C terminální části se nachází doména bohatá na leucin (LRR), která je odpovědná za identifikaci nebezpečných vzorů. Pro rozvoj Crohnovy choroby predisponují jedinci se záměnami na třech pozicích nukleotidů v oblasti domény LRR. Receptory NOD2 jsou konstitutivně exprimovány v myeloidních buňkách, zvláště makrofázích, neutrofilech a dendritických buňkách. Zásadní pro střevní homeostázu je jejich exprese ve střevní sliznici, kde jsou lokalizovány v Panethových buňkách. Vlivem prozánětových pluripotentních cytokinů TNF-α a interferonu-γ je jejich přítomnost indukována i v intestinálních epitelových buňkách. Fyziologicky jsou receptory NOD2 schopny identifikovat komponenty bakteriální stěny gram-pozitivních mikroorganismů, konkrétně muramyldipeptid. Polymorfismy SNP v doméně LRR nemocných s Crohnovou chorobou jsou odpovědny za ztrátu schopnosti receptoru identifikovat bakteriální signály nebezpečí (loss of function) (obr. 2).
2. Receptory NLR, jejich polymorfismus a funkce 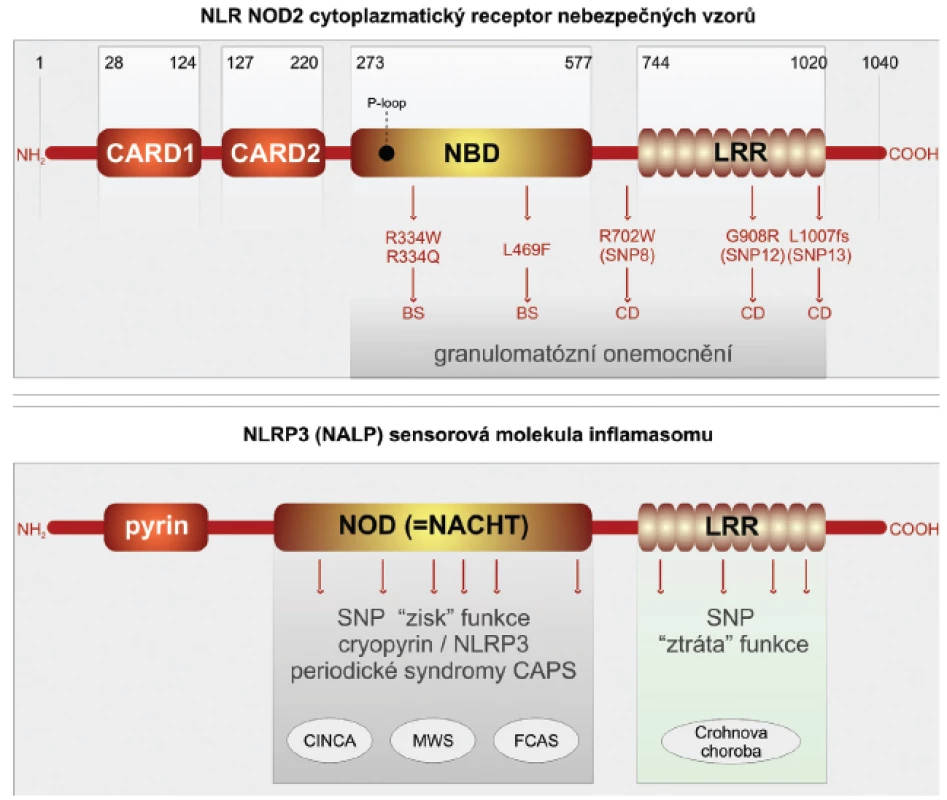
Autofagie je výsledkem složité kaskády interakcí adaptorových a efektorových bílkovin. Za klíčovou je považována molekula ATG16L1, která vytváří komplex s dalšími dvěma molekulami ATG5-ATG12. Tento adaptorový komplex je odpovědný za membránovou kolokalizaci autofagické kaskády a tvorbu autofagoforu s následným vytvořením autofagozomu. Struktura molekuly ATG16L1 je kompletně známa. V jejím středu se nachází doména odpovědná za multimerizaci spolu s několika opakujícími se sekvencemi kyseliny aspartové a tryptofanu (WD). Prostřednictvím GWAS studií bylo ukázáno, že SNP polymorfismus, který vede substituci treoninu za alanin na pozici 300 (T300A) v karboxiterminální části molekuly ATG16L1, je spojen se zvýšenou vnímavostí k rozvoji Crohnovy choroby. Takto alterovaná molekula neumožní, aby došlo ke kolokalizaci receptoru NOD2 spolu s komplexem ATG5-ATG12 na cytoplazmatické membráně. Tato kolokalizace je nutnou podmínkou pro průběh autofagie. Poslední nově objevenou molekulou predisponující pro rozvoj Crohnovy choroby je molekula IRGM. Ta je členem rodiny interferon-γ inducible immunity-related guanosine phosphatases (IRGs). Molekuly IRGM se velmi zjednodušeně podílejí na odstraňování patogenní mikroorganismů z cytoplazmy buněk. IRGM je exprimována v buňkách různých tkání, např. epitelových buněk tlustého střeva, tenkého střeva, granulocytech a monocytech. Mnohočetné SNP v genu pro IRGM jsou asociovány významně s rozvojem Crohnovy choroby (2).
Imunopatogeneze Crohnovy choroby je spojena s SNP polymorfismy vedoucími k defektům ve funkcích receptorů NLR. K nim se připojují jako vysoce rizikové CNP polymorfismy v molekulách významně se podle současných znalostí podílejících na procesu autofagie. K tomu je třeba přičíst ještě skutečnost, že v Panethových buňkách nemocných s Crohnovou chorobou jsou opět z důvodu SNP tvořeny v menší míře antibakteriálně působící alfa defenziny, které slouží současně jako endogenní signály nebezpečí charakteru alarminů. Lze tedy shrnout, že primární příčinou vzniku rozvoje Crohnovy choroby je vlastně v jistém slova smyslu imunitní nedostatečnost kontrolovat mikrobiální osídlení na povrchu sliznice a rozvinout účinnou zánětovou odpověď za situace, kdy patogenní mikroorganismy penetrují do epitelových buněk střevní sliznice. Výsledkem je nedostatečná kontrola střevní mikroflóry, která indukuje abnormální zánětovou reakci ve střevní stěně. Poruchy ve vrozené větvi imunity jsou následně příčinou abnormální reaktivity specifické T lymfocytární imunity, která je směrována k abnormální aktivitě subsetu TH17 a TH1 T-lymfocytů spojené mimo jiné se zvýšenou produkcí IL-17 a IL-23 (29, 34).
Autofagie a roztroušená skleróza mozkomíšní
V imunopatogenezi roztroušené sklerózy se autofagie uplatňuje přinejmenším dvojím způsobem. Prvním je účast autofagie ve zpracování a prezentaci primárně nitrobuněčných jaderných molekul, které jsou rozpoznávány jako autoantigeny. Procesem makroautofagie je prostřednictvím nitrobuněčného degradačního aparátu rozkládán endogenní potenciálně antigenní materiál a je prezentován v kontextu HLA I. či II. třídy T lymfocytárnímu systému. Původní představy, že antigenní fragmenty, které se vážou na molekuly HLA I. třídy a stimulují CD8+ cytotoxické T-lymfocyty, jsou zpracovány proteazomovou cestou zcela odlišnou od cesty zpracování extracelulárně lokalizovaných antigenních podnětů, které jsou po internalizaci rozkládány v endozomálním/lyzozomálním kompartmentu, se ukázaly jako nepřesvědčivé. Analýzou navázaných antigenních fragmentů na molekulách HLA I. či II. třídy bylo prokázáno, že takovéto striktní oddělení, které by zjednodušilo procesy regulací imunitní odpovědi, neexistuje. Ukazuje se, že molekuly HLA II. třídy jsou možná až z jedné pětiny obsazeny antigenními fragmenty odvozenými od vnitrobuněčných struktur. Předpokládá se, že je to zprostředkováno právě procesem autofagie.
Zpracování a prezentace antigenních fragmentů stojí i na samém vzniku buňkami zprostředkované T lymfocytární imunity (32). Při intratymovém vyzrávání jsou tymocyty, které nesou receptor TCR náhodně vzniklý v procesu přeskupení genových segmentů, exponovány molekulám HLA a poté komplexům molekul HLA a antigenních fragmentů endogenního původu. Prezentace molekul HLA I. a II. třídy prostřednictvím kortikálních tymových epitelových buněk určí v prvním kroku v procesu tzv. pozitivní selekce, zda bude daný T-lymfocyt přežívat a zda bude připuštěn k dalším diferenciačním krokům. Určuje také, do které funkčně odlišné větve (CD4+ vs. CD8+) se daný tymocyt bude diferencovat. V pozitivní selekci převážná část vyzrávajících tymocytů hyne, protože nebyly schopny efektivně interagovat s vlastními molekulami HLA. Další diferenciační krok, tzv. negativní selekce, spojený s prezentací vlastních struktur navázaných v podobě antigenních fragmenů na molekuly HLA je opět provázen apoptózou vyzrávajících T-lymfocytů, které s vysokou afinitou reagovaly s vlastními antigenními fragmenty, tj. klonů autoreaktivných T lymfocytů. Tento proces je, jak bylo doloženo experimentem na zvířatech, zřetelně určován aktivitou autofagie.
Rozvoj autoimunitního procesu je důsledkem neadekvátních homeostatických regulací autoreaktivních T-lymfocytů. U nemocných s roztroušenou sklerózou bylo prokázáno na úrovni mRNA a také průkazem exprese proteinů zvýšené zastoupení molekuly ATG5 v T-lymfocytech periferní krve a T lymfocytech, které infiltrují postiženou mozkovou tkáň. Jejich podíl byl dále zvýšen u nemocných s relabující remitující formou roztroušené sklerózy v době relapsu. Tyto výsledky přinejmenším implikují, že procesy autofagie se významně zapojují do regulací přežívání a proliferace autoreaktivních T lymfocytů jak v experimentální modelu EAE, tak u nemocných s mozkomíšní roztroušenou sklerózou (35, 36). Možnost manipulace s autofagií otvírá další potenciální možnosti jak ovlivnit poškozující zánětovou reakci u nemocných s roztroušenou sklerózou. Otevřena v tomto ohledu jsou i jiná onemocnění postihující mozek a nervový systém (37–40).
Zkratky
- AGE – produkty pokročilé glykace (advanced glycation end products)
- ATG – autophagy-related gene
- DAMP – endogenní nebezpečné vzory (danger associated molecular patterns)
- EAE – experimentální autoimunitní encefalitida (experimental autoimmune encephalitis)
- GWS – celogenomová analýza (genome-wide studies)
- HMGB – nukleoprotein HMGB (high-mobility group box)
- IL – interleukin
- IRG – GTPázy spojené s imunitou (immunity-related GTPases)
- MAPK – mitogenem aktivované proteinové kinázy (mitogen activated protein kinase)
- MBP – myelinový bazický protein (myelin basic protein)
- NFκB – transkripční faktor kappa B (nuclear factor kappa B)
- NLR –nod like receptors
- NLRP – složka inflamazomu
- PAMP – nebezpečné vzory patogenů (pathogen associated molecular patterns)
- PRR – receptory nebezpečných vzorů (pattern recognition receptors)
- RAGE – receptor pro produkty pokročilé glykace (receptors for AGE)
- SLR – sequestasome-like-receptors
Práce vznikla s podporou VZ MŠMT ČR č. MSM0021620812, dále byla podpořena specifickým výzkumným projektem č. 262902.
Za vytvoření obrázků v elektronické podobě autoři děkují paní Haně Kotlandové.
Adresa pro korespondenci:
prof. RNDr. Jan Krejsek, CSc.
Ústav klinické imunologie a alergologie LF UK a FN
Sokolská 581, 500 05 Hradec Králové
fax: +420 495 832 015, e-mail: krejsek@fnhk.cz
Sources
1. Deretic V. Autophagy in immunity and cell–autonomous defense against intracellular microbes. Immunol Rev 2011; 240(1): 92–104.
2. Deretic V. Links between autophagy, innate immunity, inflammation and Crohn’s disease. Dig Dis 2009; 27(3): 246–251.
3. Dinarello CA. Interleukin-1 in the pathogenesis and treatment of inflammatory diseases. Blood 2011; 117(14): 3720–3732.
4. Brodsky IE, Medzhitov R. Pyroptosis: macrophage suicide exposes hidden invaders.Curr Biol 2011; 21(2): R72–75.
5. Yazdi AS, Guarda G, D’Ombrain MC, Drexler SK. Inflammatory caspases in innate immunity and inflammation. J Innate Immun 2010; 2(3): 228–237.
6. Krejsek J, Kuneš P, Andrýs C, Holická M, Novosad J, Kudlová M, Koláčková M. Přirozená imunita, receptory pro exogenní a endogenní nebezpečné vzory v imunopatogenezi aterosklerózy. I. část: Přirozená imunita, rozlišení signálů nebezpečí. Čas Lék čes 2005; 144(12): 785–789.
7. Krejsek J, Kuneš P, Andrýs C, Holická M, Novosad J, Kudlová M, Koláčková M. Přirozená imunita, receptory pro exogenní a endogenní nebezpečné vzory v imunopatogenezi aterosklerózy. II. část: Receptory TLR, význam polymorfizmu receptorů pro nebezpečné vzory. Čas Lék čes 2005; 144(12): 790–794.
8. Krejsek J, Berglová I, Jankovičová K, Krčmová I, Andrýs C. Imunitní systém jako integrální součást zánětové odpovědi – základní principy funkce. Ortopedie 2011; 4 : 124–128.
9. Krejsek J, Berglová I, Jankovičová K, Krčmová I, Andrýs C. Osteoimunologie – vzájemné interakce mezi kostí a imuitním systémem. Ortopedie 2011; 4 : 136–139.
10. Aimanianda V, Haensler J, Lacroix–Desmazes S, Kaveri SV, Bayry J. Novel cellular and molecular mechanisms of induction of immune responses by aluminium adjuvants. Trends Pharmacol Sci 2009; 30(6): 287–295.
11. Martinon F. Signaling by ROS drives inflammasome activation. Eur J Immunol 2010; 40(3): 616–619.
12. Murphy DM, O’Byrne PM. Recent advances in the pathophysiology of asthma. Chest 2010; 137(6): 1417–1426.
13. Sidiropoulos PI, Goulielmos G, Voloudakis GK, Petraki E, Boumpas DT. Inflammasomes and rheumatic diseases: evolving concepts. Ann Rheum Dis 2008; 67(10): 1382–1389.
14. Delgado MA, Deretic V. Toll-like receptors in control of immunological autophagy. Cell Death Differ 2009; 16(7): 976–983.
15. Martinon F, Tschopp J. NLRs join TLRs as innate sensors. Trends Immunol 2005; 26(8): 447–454.
16. Tattoli I, Travassos LH, Carneiro LA, Magalhaes JG, Girardin SE. The nodosome: Nod1 and Nod2 control bacterial infections and inflammation. Semin Immunopathol 2007; 29(3): 289–301.
17. Bauernfeind F, Ablasser A, Bartok E, Kim S, Schmid-Burgk J, Cavlar T, Hornung V. Inflammasomes: current understanding and open questions. Cell Mol Life Sci 2011; 68(5): 765–783.
18. Kuneš P, Holubcová Z, Koláčková M, Krejsek J. The counter-regulation of antherogenesis: a role for interleukin-33. Acta Medica 2010; 53(3): 125–129.
19. Andrys C, Drahosova M, Hornychova J, Tambor V, Musilova I, Tosner J, Flidrova E, Kacerovsky M. Umbilical cord blood concentrations of IL-6, IL-8, and MMP-8 in pregnancy complicated by preterm premature rupture of the membranes and histological chorioamnionitis. Neuroendocrinol Lett 2010; 31(6): 101–107.
20. Goldbach-Mansky R, Kastner DL. Autoinflammation: The prominent role of IL-1 in monogenic autoinflammatory diseases and implications for common illnesses. J Allergy Clin Immunol 2009; 124(6): 1141–1149; quiz 1150–1151.
21. Vance RE. Inflammasome activation: how macrophages watch what they eat. Cell Host Microbe 2010; 7(1): 3–5.
22. Lamkanfi M, Dixit VM. Manipulation of host cell death pathways during microbial infections.Cell Host Microbe 2010; 8(1): 44–54.
23. Lamkanfi M, Dixit VM. Inflammasomes: guardians of cytosolic sanctity.Immunol Rev 2009; 227(1): 95–105.
24. Yang D, Oppenheim JJ. Alarmins and antimicrobial immunity. Med Mycol 2009; 47(Suppl 1): S146–153.
25. Srikrishna G, Freeze HH. Endogenous damage-associated molecular pattern molecules at the crossroads of inflammation and cancer. Neoplasia 2009; 11(7): 615–628.
26. Wewers MD, Sarkar A. P2X7 receptor and macrophage function. Purinergic Signal 2009; 5(2): 189–195.
27. Alexopoulou L, Kontoyiannis D. Contribution of microbial-associated molecules in innate mucosal responses. Cell Mol Life Sci 2005; 62(12): 1349–1358.
28. Magalhaes JG, Tattoli I, Girardin SE. The intestinal epithelial barrier: how to distinguish between the microbial flora and pathogens. Semin Immunol 2007; 19(2): 106–115.
29. Sewell GW, Marks DJ, Segal AW. The immunopathogenesis of Crohn’s disease: a three-stage model. Curr Opin Immunol 2009; 21(5): 506–513.
30. Shih DQ, Targan SR, McGovern D. Recent advances in IBD pathogenesis: genetics and immunobiology. Curr Gastroenterol Rep 2008; 10(6): 568–575.
31. Villani AC, Franchimont D. The contribution of genetic studies in shifting the immunopathogenesis paradigm of Crohnęs disease. Expert Rev Clin Immunol 2009; 5(4): 361–364.
32. Eisenbarth SC, Flavell RA. Innate instruction of adaptive immunity revisited: the inflammasome. EMBO Mol Med 2009; 1(2): 92–98.
33. Lamkanfi M, Kanneganti TD. Nlrp3: an immune sensor of cellular stress and infection. Int J Biochem Cell Biol 2010; 42(6): 792–795.
34. Brand S. Crohn’s disease: Th1, Th17 or both? The change of a paradigm: new immunological and genetic insights implicate Th17 cells in the pathogenesis of Crohn’s disease. Gut 2009; 58(8): 1152–1167.
35. Alirezaei M, Fox HS, Flynn CT, Moore CS, Hebb AL, Frausto RF, Bhan V, Kiosses WB, Whitton JL, Robertson GS, Crocker SJ. Elevated ATG5 expression in autoimmune demyelination and multiple sclerosis. Autophagy 2009; 5(2): 152–158.
36. Klein L, Munz C, Lunemann JD. Autophagy-mediated antigen processing in CD4+ T cell tolerance and immunity. FEBS Lett 2010; 584(7): 1405–1410.
37. Coutinho AE, Chapman KE. The anti-inflammatory and immunosuppresive effects of glucocorticoids, recent developments and mechanistic insights. Mol Cell Endocrinol 2011; 335(1): 2–13.
38. Fornai F, Longone P, Ferrucci M, Lenzi P, Isidoro C, Ruggieri S, Paparelli A. Autophagy and amyotrophic lateral sclerosis: The multiple roles of lithium. Autophagy 2008; 4(4): 527–530.
39. Mavers M, Ruderman EM, Perlman H. Intracellular signal pathways: potential for therapies. Curr Rheumatol Rep 2009; 11(5): 378–385.
40. Pasquali L, Longone P, Isidoro C, Ruggieri S, Paparelli A, Fornai F. Autophagy, lithium, and amyotrophic lateral sclerosis. Muscle Nerve 2009; 40(2): 173–194.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Thyroid tumors – moleculargenetic causes and choices for target therapy
- Autophagy and its role in protective and damaging inflammatory response
- Children obesity and its metabolic outcomes
- Seminar for HPH coordinators (Health Promoting Hospitals) and WHO HPH Autumn School 2011 held in Prague
- Factors influencing the experimentation with smoking: Observed in ELSPAC Study
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autophagy and its role in protective and damaging inflammatory response
- Children obesity and its metabolic outcomes
- Thyroid tumors – moleculargenetic causes and choices for target therapy
- Factors influencing the experimentation with smoking: Observed in ELSPAC Study
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

