-
Medical journals
- Career
Nové možnosti očkování proti chřipce
: R. Chlíbek
: Univerzita obrany Brno a Fakulta vojenského zdravotnictví Hradec Králové doc. MUDr. Roman Chlíbek, Ph. D.
: Čas. Lék. čes. 2010; 149: 111-114
: Topic
Jednou z cest jak zvýšit velice nízkou proočkovanost české populace proti chřipce je zavádění nových možností očkování, kterou může být metoda aplikace chřipkové vakcíny v podobě intradermálního podání. Tato cesta aplikace využívá vysokého imunitního potenciálu kůže, kde se nachází velké množství dendritických buněk, makrofágů, lymfocytů a bohaté kapilární a lymfatické zásobení. Inovativní mikrojehličkový systém aplikace umožňuje přesnost podání přímo do dermis a konzistentnost dávky bez nutnosti velkých zkušeností a tréninku intradermálního podání. S nižším obsahem antigenu a menším objemem vakcíny je dosahováno srovnatelných výsledků imunogenity jako u intramuskulární aplikace u dospělých osob do 59 let. Při použití stejného množství antigenu jako u intramuskulární aplikace u osob starších 60 let je dosahováno významně lepších výsledků. Nová intradermální vakcína IDflu je zaregistrována v Evropě pro osoby od 18 let věku a je další alternativní cestou zvýšení obliby chřipkové vakcinace u laické i odborné veřejnosti. Pro lékaře systém mikrojehličkové intradermální aplikace přináší snadnější způsob očkování s aplikací menšího objemu vakcíny, u kterého odpadá nutnost odstraňování vzduchu ze stříkačky a nutnost aspirace. Na českém trhu se vakcína objeví před chřipkovou sezonou 2010/2011. Klíčová slova: vakcinace, chřipka, intradermální aplikace.
Úvod
Chřipka je jedno z nejčastějších infekčních onemocnění. Každý rok je možné označit rokem chřipky. Její dopady postihují v podobě zdravotních potíží nejenom nemocného jedince, ale v sociální oblasti postihují populaci na celém světě. Chřipkové epidemie typické pro zimní měsíce roku jsou známé svou explozivností a typickým šířením. Zpočátku bývá nejvyšší nemocnost mezi dětmi, zvláště pak mezi mladšími školáky. Mortalita této věkové skupiny je extrémně nízká. Tyto nemocné děti pak relativně snadno přenášejí onemocnění dále v populaci a infikují zejména vlastní rodiče, kteří nemoc šíří dál. Starší část populace je obvykle poslední cílovou skupinou chřipky, ovšem je hlavní skupinou v riziku vzniku komplikací a následných úmrtí. Chřipka je onemocnění, které i přes znalost původce, klinického obrazu, možností léčby a prevence, stále překvapuje něčím novým. Objevila se postupná adaptace ptačích chřipkových virů na savce včetně člověka a došlo již k prvním interhumánním přenosům. Stoupá počet rezistencí na dostupná antivirotika, dosud není zaregistrovaná vakcína proti A/H5N1 viru a stále probíhá vývoj technologie přípravy možné pandemické vakcíny. Rozšiřují se indikační skupiny vakcinace, která je již v řadě zemí doporučována jako rutinní i u dětí. Objevily se i nové možnosti v expresní diagnostice chřipky do 30 minut, která se stále více posouvá i do ordinací lékařů prvního kontaktu s minimálními požadavky na materiálové vybavení.
Přesto, že chřipce lze snadno předejít vakcinací a na trhu je dostatek registrovaných štěpených i subjednotkových vakcín, není ochrana proti chřipce dostatečná. Důvodem je velice nízká proočkovanost v mnoha zemích světa a cíle Světové zdravotnické organizace – proočkovat 75 % starší populace v roce 2010 – nebude dosaženo. Proočkovanost proti chřipce se významně liší mezi jednotlivými zeměmi Evropa i světa. V západní Evropě nejvyšší proočkovanosti dosahuje Německo, Itálie, Velká Británie, s více jak dvojnásobnou spotřebou chřipkových vakcín než je například v Norsku nebo v České republice. Česká republika se spolu s Irskem a Slovenskou republikou svojí proočkovaností pohybuje na posledních místech v Evropě. Odhadovaná proočkovanost v sezoně 2008/2009 byla 8 % a bohužel má spíše klesající tendenci (v roce 2006 více jak 10 %, rok 2007 8,5 %). Proto dochází k intenzivnějším aktivitám směřujícím ke zvýšení proočkovanosti nejenom starší populace, ale i osob v produktivním věku a specifických skupin obyvatel, jako jsou například zdravotničtí pracovníci. Nejčastěji uváděné důvody nezájmu o tento typ očkování jsou neúčinnost vakcinace, strach z nežádoucích účinků očkování, strach z injekcí, podceňování dopadů chřipky, strach z onemocnění chřipkou bezprostředně po očkování. Cest jak zvýšit proočkovanost proti chřipce je několik a je nezbytné jejich současné uplatňování. Jednak praktičtí lékaři pro dospělé a lékaři prvního kontaktu musí být sami přesvědčeni o významu a správnosti očkování a toto očkování svým pacientům aktivně nabízet, dále musí dojít k prodloužení možného období pro očkování (do začátku epidemie, tedy od září do prosince/ledna), k propagaci významu očkování v médiích a známými osobnostmi. Další cestou je zvyšování compliance vakcinace proti chřipce, např. méně bolestivou aplikací vakcíny. Jednou z možností jak zmírnit strach z bolestivé aplikace a neopodstatněný strach z injekcí je nová metoda aplikace chřipkové vakcinace v podobě intradermálního podání.
Intradermální aplikace v akcín
V souvislosti s očkováním bylo poprvé využito kůže (dermis) v roce 1908, kdy Charles Mantoux zavedl intradermální (ID) aplikaci tuberkulínu jako diagnostickou metodu průkazu protilátek proti TBC, dnes nazývanou tuberkulínovou zkouškou (Mantoux test) (1). První publikace o ID aplikaci vakcín se objevily v roce 1930. Kromě tuberkulínové zkoušky se intradermální cestou aplikovaly v minulosti zejména živé atenuované vakcíny proti žluté zimnici, variole, TBC a spalničkám, ale i inaktivované vakcíny proti vzteklině. V posledních 5 letech probíhá řada klinických hodnocení intradermálních aplikací, zejména u chřipkových vakcín (2, 3). Kůže je jedno z nejvhodnějších míst pro aplikaci vakcinálních antigenů. Díky přítomnosti velkého množství dendritických buněk, makrofágů, lymfocytů a bohatému kapilárnímu a lymfatickému zásobení hraje kůže klíčovou úlohu v cirkulaci imunokompetentních buněk a je místem, kde může být vakcinální antigen nejlépe nabízen buňkám imunitního systému. Imunitní odpověď pak bývá silnější a k navození dostatečné protekce stačí menší množství antigenu, tedy i objemu vakcíny (4). Většímu rozšíření této účinné aplikační metody pro vakcinaci doposud bránila nedostatečná zkušenost a zdatnost očkujícího zdravotnického personálu v intradermální aplikaci, která se často nepoužívá. Při běžné intradermální aplikaci léčivých přípravků se obvykle používá jehla 26 G 3/8, která je vedena paralelně s kožním povrchem a proniká do kůže s následnou pomalou aplikací léčiva za vzniku anemického pupence vzhledu pomerančové kůry. Tato technika vyžaduje dostatek cviku a praktických zkušeností. Správnost provedené aplikace je ovlivněna řadou negativních faktorů, jako jsou snížená elasticita kůže, anatomické změny kůže dané vyšším věkem apod. Intradermální aplikace byla dosud většinou lékaři odmítána, právě z těchto všech důvodů. Ani farmaceutický průmysl nepreferoval přípravu vakcín pro intradermální podání a klinické použití. Rozdílné zbytky vakcíny ve stříkačce po aplikaci a různé přístupy při odstraňování vzduchových bublin očkujících lékařů ovlivňovaly konzistentnost dávek (5). Proto se intradermální aplikace v České republice dosud rutině používala pouze pro BCG vakcinaci. Další světově častou intradermální aplikací je očkování proti vzteklině. Intradermální aplikace anti-rabických vakcín se používá nejvíce v rozvojovém světě, protože nižší objem vakcíny zlevňuje vakcinaci a umožní při stejných finančních nákladech očkovat větší množství osob.
Výhodou ID aplikace je snadná přístupnost kůže, vysoká hustota dendritických buněk v kůži, dobrá imunogenita takto aplikovaných vakcín u dětí, dospělých i starších osob, úspora očkovací látky, nižší bolestivost aplikace – možnost lokálního znecitlivění, není nutné provádění aspirace pro vyloučení možného intravenózního přístupu. Naopak nevýhodou ID aplikace může být technická obtížnost aplikace, riziko nesprávného – např. subkutánního podání vakcíny s následným selháním účinku vakcinace, neznámý vliv modulace imunitní odpovědi ultrafialovým zářením nebo teplem (6). Ideální ID aplikační systém současnosti by měl splňovat podmínku jistoty aplikace antigenu přímo do dermis, snadnost použití bez nároků na velkou zručnost a zkušenost, nízké náklady, minimální riziko poranění o jehlu a nízkou bolestivost aplikace. Jedním z takovýchto nových aplikačních systémů je mikroinjekční vakcína proti chřipce přicházející na evropský trh.
IDFLU – nová intradermální chřipková vakcína
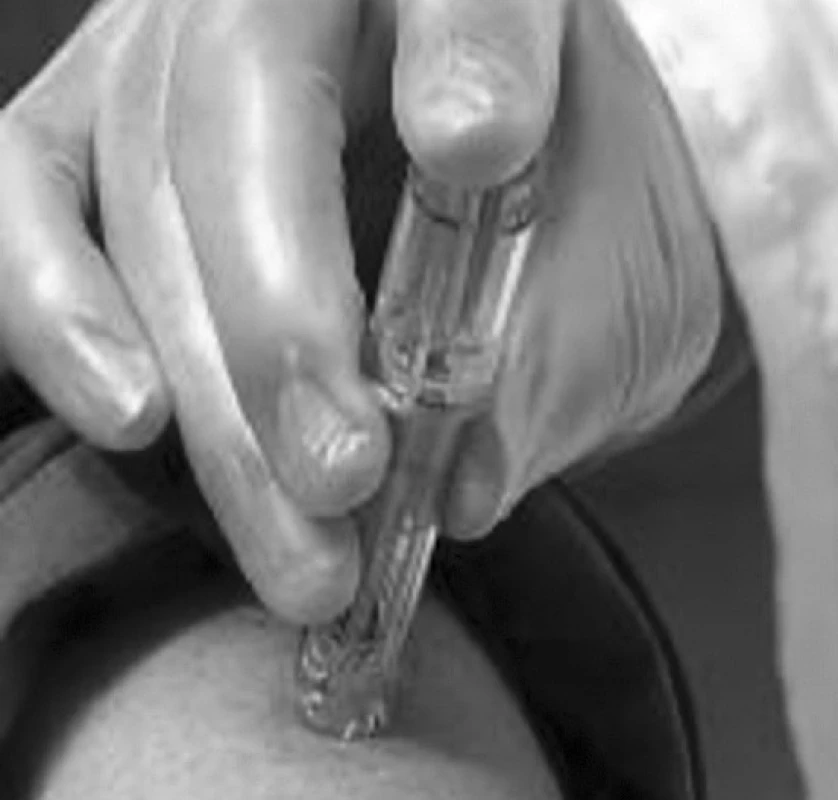
Imunologicky potvrzený význam dendritických buněk v kvalitě postvakcinační odpovědi vedl k obnovení zájmu o kožní aplikace vakcín. Byly hodnoceny metody transdermálních náplastí, ultrazvukových systémů působících na kůži a aplikace pomocí intradermálních mikrojehel. Většímu rozšíření a obliby intradermální aplikace vakcín by měl přispět i nově vyvinutý systém intradermální mikroinjekce. Nová vakcína proti chřipce – IDflu (Sanofi Pasteur) byla zaregistrována Evropskou lékovou agenturou (EMEA) 24. února 2009 a v České republice byla poprvé představena 19. března 2009. Intradermální mikroinjekční systém se skládá z předplněné stříkačky s obsahem pouze 0,1 ml vakcíny, což je 5× menší obsah než u intramuskulárních (IM) vakcín. K aplikaci je použita mikrojehlička o síle 0,31 mm (klasická jehla k IM aplikaci má rozměr 0,51 mm) a velmi krátké délky 1,5 mm (IM jehla je 10× delší – 16 mm) (obr. 1). Mikrojehla je zabezpečena plastovým krytem, který se bezprostředně před aplikací odstraní. Po dezinfekci příslušné části kůže – nejlépe v oblasti deltového svalu nedominantní horní končetiny, se aplikační systém pouze přiloží kolmo ke kůži (obr. 2). Vzhledem k 1,5 mm délce jehličky je zabezpečeno, že po přiložení ke kůži a zatlačení, pronikne automaticky jehlička pouze do kůže. Následně je pomocí mechanického stlačení pístu injikována vakcína přímo do kůže. Před aplikací není nutné odstraňovat vzduch ani provádět aspiraci. Po aplikaci se dalším zatlačením na píst aktivuje ochranný kryt, který se přesune přes jehlu a zabrání případnému poranění či znovu použití jehly (obr. 3). Vakcína se skladuje při teplotách 2–8 oC v původním obalu a před aplikací se ohřívá na pokojovou teplotu. V opakovaných klinických hodnoceních u obou pohlaví, různých etnik, různého věku (18–70 let), u obézních osob se prokázala optimální aplikace vakcíny do dermis při použití jehličky o délce 1,5 mm, s vakcinací do kůže deltové oblasti (průměrná tloušťka kůže 2,02 mm), supraskapulární oblasti (průměr 2,54 mm), přední oblasti stehna (průměr 1,55 mm) a oblasti pasu (1,91 mm) (7). Jako nejoptimálnější aplikační oblast u dětí i dospělých je horní část deltové oblasti. Použití mikroinjekčního systému zajistilo konzistentnost aplikované dávky při snadnosti použití i pro netrénované jedince, kteří použili tento systém poprvé (8).
1. Schéma mikroinjekčního systému ID vakcíny A – kryt jehly; B – mikrojehlička délky 1,5 mm; C – okénko pro kontrolu obsahu vakcíny; D – místo pro uchopení; E – místo stlačení pístu 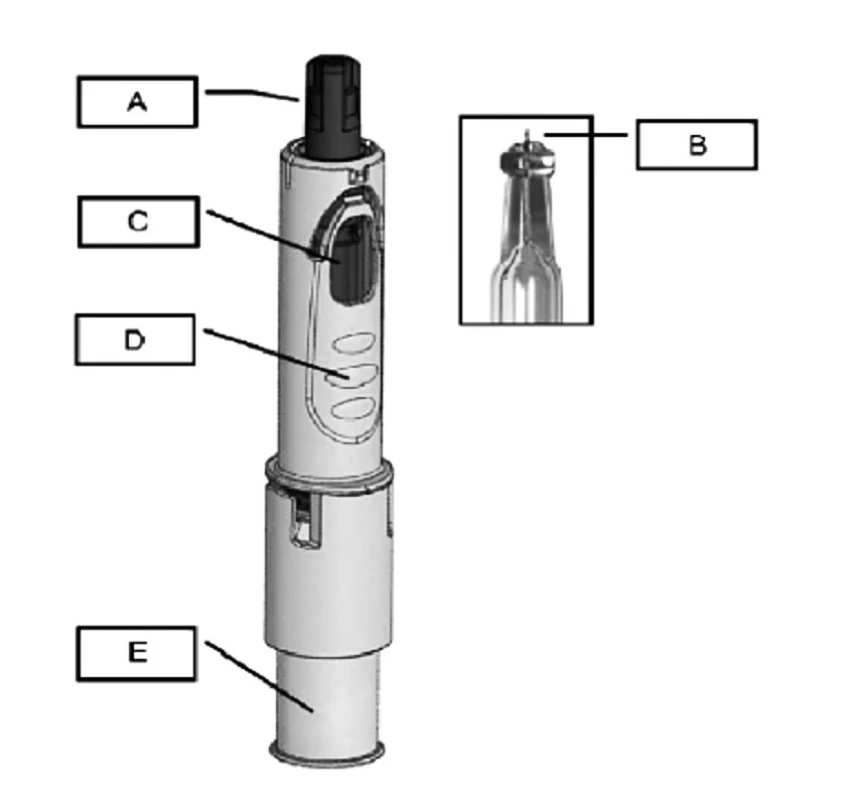
Vakcína IDflu je zaregistrována pro ID aplikaci pouze u dospělých osob ve věku od 18 let, pro podávání u dětí a mladistvých zatím nejsou dostatečné údaje o bezpečnosti a účinnosti, proto se nedoporučuje. Jedná se o štěpenou, inaktivovanou, trivalentní vakcínu (2× antigen chřipkového kmene A, 1× chřipkového kmene B) připravenou klasickou metodou – pomnožením chřipkového viru na oplodněných slepičích vejcích. Pro osoby 18–59 let je vzhledem k vyšší imunogenitě ID vakcíny určena verze s nižším obsahem antigenu, než jsou klasické vakcíny, 3× 9 μg antigenu. Pro osoby 60 a více let pak se stejným množstvím antigenu jako u všech chřipkových vakcín, tedy 3× 15 μg.
Imunogenita ID chřipkové vakcíny byla hodnocena u 4600 dospělých osob (18–59 let) a 5200 starších osob (≥ 60 let) v klinických studiích fáze II a III v devíti zemích Evropy a Oceánie. Během těchto studií byla porovnávána ID aplikace s IM aplikací vakcíny Vaxigrip. U osob 18–59 let byla imunogenita i při nižším obsahu antigenu srovnatelná s IM aplikací. I přes to, že nebyl žádný statisticky významný rozdíl mezi ID a IM aplikací, při ID aplikaci bylo ve všech sledovaných parametrech (séroprotekce, sérokonverze a geometrické titry protilátek) dosaženo vyšších hodnot, nejvýraznějších u geometrických titrů protilátek proti A/H3N2 viru (28,2 u ID versus 20,7 u IM aplikace). U ID aplikace bylo 21 dnů po vakcinaci dosaženo více jak 90% séroprotekce (% chráněných osob) proti všem třem chřipkovým virům (A/H1N1, A/H3N2, B). V případě H1N1 bylo dosaženo 92,4% séroprotekce u ID a 88,8% u IM, pro H3N2 : 99,7%/98,7% u ID/IM aplikace a pro virus B: 90,6%/85,5% u ID/IM aplikace (9). Dynamika poklesu protilátek byla srovnatelná s IM vakcínou a hladiny protilátek byly dostatečné po dobu 12 měsíců po očkování.
Klinické studie se starší populací (≥ 60 let) prokázaly statisticky významný rozdíl v imunogenitě ID vakcíny v porovnání s IM aplikací při použití stejného množství antigenu ve vakcíně (3× 15 μg). Výsledky potvrdily jednoznačně vyšší účinnost ID vakcíny ve všech parametrech séroprotekce, sérokonverze a geometrických titrů protilátek. Geometrické titry protilátek (GMT) byly nejvyšší proti H3N2 kmenu u ID aplikace s hodnotou GMT 298 v porovnání s IM aplikací a hodnotou GMT 181, proti H1N1 bylo dosaženo hodnot GMT 81,9/69,1 u ID/IM aplikace a proti B kmenu hodnot GMT 39,9/34,9 u ID/IM aplikace (10).
3. Mikroinjekční systém: 1 – před aplikací, 2 – po aplikaci, 3 – po bezpečném zajištění jehly krytem 
Současně byla hodnocena bezpečnost ID chřipkové vakcíny. Ve všech studiích byly sledovány očekávané místní i celkové nežádoucí účinky 7 dní po očkování a neočekávané účinky 21 dní po vakcinaci. Výskyt a množství nežádoucích účinků bylo srovnatelné u ID i IM aplikace s výjimkou očekávaných místních účinků, které se častěji vyskytovaly u ID aplikace v obou věkových kohortách (18–59 let a ≥ 60 let). Výskyt místních reakcí v podobě zarudnutí, otoku, zatvrdnutí a svědění byl velmi častý, častější po ID aplikaci než u IM vakcín. Nejčastějším místním příznakem bylo zarudnutí v místě vpichu, které se vyskytovalo u více jak 80 % dospělých osob do 60 let s ID aplikací versus 70 % osob s IM aplikací. 9,6 % očkovaných ID vakcínou hlásilo zarudnutí ≥ 5 cm vs. 0,8 % očkovaných IM vakcínou (9). Většina reakcí však byla přechodná a spontánně odezněla do 1–3 dnů po aplikaci. Bolestivost v místě vpichu byla srovnatelná u ID i IM skupin. Z celkových reakcí byla u obou skupin srovnatelně nejčastější bolest hlavy. Naopak myalgie se vyskytovala častěji u osob s IM aplikací. Také výskyt neočekávaných účinků do 21 dnů po vakcinaci (pocit tepla, přechodná změna barvy kůže v místě aplikace) byl srovnatelný u ID a IM aplikace. Porovnáme-li výskyt nežádoucích účinků mezi oběma věkovými kohortami bez ohledu na aplikaci, pak byl častější u 18–59letých než u ≥ 60letých. Při opakovaných ID aplikacích (tři následující roky po sobě) nebyl zaznamenán vyšší výskyt nežádoucích účinků, podobně jako při přechodu na ID aplikaci následující po dvou letech každoročních IM aplikacích (11).
Diskuze
Nová štěpená inaktivovaná vakcína k sezonní intradermální vakcinaci proti chřipce, IDflu, s redukovaným obsahem antigenu (9 μg/kmen) je dostatečně imunogenní v jedné dávce. Její imunogenita je plně srovnatelná s intramuskulárně aplikovanou inaktivovanou vakcínou (15 μg/kmen), u osob ve věku 18–59 let. Vysoká imunogenita je zajištěna inovativní metodou efektivnější intradermální aplikace pomocí mikrojehliček. Tato metoda aplikace jasně prokazuje vyšší potenciál imunitního systému kůže než intramuskulární aplikace. Nadějné jsou i výsledky studií hodnotící imunogenitu ještě nižších intradermálních dávek antigenu (3 a 6 μg/kmen), které jsou dostatečně imunogenní, nicméně méně než IM aplikace 15 μg/kmen. Druhá verze ID vakcíny byla vyvinuta pro osoby starší 60 let. Tyto osoby jsou nejvíce vystaveny riziku onemocnění chřipkou a vzniku závažných komplikací, při tom u nich dochází vlivem věku k poklesu imunitní odpovědi na vakcinaci klasickou IM vakcínou proti chřipce. Při stejném množství antigenu jako u IM aplikace je v této věkové kategorii dosaženo významně lepších výsledků imunogenity ID aplikace. Vyšší lokální reaktogenita ID aplikace v porovnání s IM aplikací, je součástí očekávané zánětlivé a imunitní odpovědi kůže na aplikované antigeny. Je možné, že frekvence lokálních reakcí zánětlivé povahy je stejná i u IM aplikace, ale vzhledem k hloubce lokalizace reakcí jsou tyto reakce méně nápadné. Tuto myšlenku by mohl podporovat vyšší výskyt myalgií u osob s IM aplikací. I přes častější výskyt místních reakcí u ID aplikace, 96–97 % očkovaných hodnotí tyto potíže jako velmi až plně akceptovatelné.
Při jakékoliv injekční aplikaci léčivého přípravku hrozí riziko poranění jehlou a přenosu infekčního onemocnění. Ročně se provádí až 12 miliard injekčních aplikací, z toho 5 % je spojeno právě s vakcinací. Na každých 100 injekcí pak připadá v průměru pět poranění jehlou, což není nevýznamné. Proto i přítomnost ochranného krytu jehly a jeho aktivace po aplikaci může snížit riziko těchto poranění. Nezanedbatelný je i fakt, že kryt znemožní opakované použití stříkačky a jehly, což má význam zejména v rozvojových zemích, kde jsou zaznamenávány případy přenosu infekcí opakovaným používáním nesterilních jehel.
ID aplikace umožňuje plné využití imunitního potenciálu kůže. Mikroinjekční systém je intuitivní a bezpečný, vyvolává menší strach a obavy u očkovaných. Imunogenita ID chřipkové vakcíny je plně srovnatelná s IM vakcínou při nižším obsahu antigenu ve vakcíně u osob 18–59 let. Imunogenita ID vakcíny u osob starších 60 let je významně vyšší než IM chřipkové vakcíny při stejném obsahu antigenu. ID chřipková vakcína ve všech hodnocených věkových skupinách splnila všechna kritéria EMEA stanovená pro hodnocení účinnosti chřipkových vakcín.
Nová možnost ID aplikace vakcín proti chřipce je alternativní cestou jak zvýšit proočkovanost populace proti chřipce. Minimální invazivita podání, přijatelnější vzhled mikrojehličky pro osoby se strachem z injekcí, méně bolestivá aplikace a chuť vyzkoušet zcela nový systém vakcíny by mohly zvýšit atraktivitu očkování proti chřipce nejenom u laické, ale i odborné veřejnosti. Pro lékaře tento systém přináší snadný způsob aplikace, aplikace menšího objemu vakcíny, u kterého odpadá nutnost odstraňování vzduchu ze stříkačky a nutnost aspirace. Tato metoda aplikace může také zvýšit ochranu osob starších 60 let, kteří hůře odpovídají na klasické IM cesty podání. ID vakcína se objeví na českém trhu poprvé pro chřipkovou sezonu 2010/2011. Rozšířenějšímu používání by neměla bránit ani cena očkovací látky, která se v lékárnách předpokládá do 300 Kč.
Zkratky
- ID – intradermální
- IM – intramuskulárních
- GMT – geometrické titry protilátek
Adresa pro korespondenci:
doc. MUDr. Roman Chlíbek, Ph.D.
Fakulta vojenského zdravotnictví UO
Třebešská 1575, 500 01 Hradec Králové
e-mail: chlibek@pmfhk.cz
Sources
1. Mantoux C. L`intradermo-reaction a la tuberkuline et son interpretation clinique. Presse Medicale 1910; 18 : 10–13.
2. Belshe RB, Newman FK, Canon J, et al. Serum antibody response after intradermal vaccination against influenza. N Engl J Med 2004; 351 : 2286–2294.
3. La Montagne JR, Fauci AS. Intradermal influenza vaccination-can less be more? N Engl J Med 2004; 351 : 2230–2232.
4. Azad N, Rojanasakul Y. Vaccine delivery-current trends and future. Curr Drug Deliv 2006; 3 : 137–146.
5. Strauss K, Van Zindert K, Frid A, Costiglioda V. Pandemic influenza preparedness: the critical role of the syringe. Vaccine 2006; 24 : 4874–4882.
6. Ward BJ. The potential Benefits of Intradermal Vaccination. Presentation on the 13th International Congress on Infectious Diseases, Kuala Lumpur, Malaysia, 21 June 2008.
7. Laurent A, Mistretta F, Bottigioli D, et al. Echographic measurement of skin thickness in adults by high frequency ultrasound to assess the appropriate microneedle lenght for intradermal delivery of vaccines. Vaccine 2007; 25 : 6423-6430.
8. Laurent PE, Bonnet S, Alchas P, et al. Evaluation of the clinical performance of a new intradermal vaccine administration technique and associated delivery system. Vaccine 2007; 25 : 8833–8842.
9. Leroux-Roels I, Vets E, Freese R, et al. Seasonal influenza vaccine delivered by intradermal microinjection: A randomised controlled safety and immunogenicity trial in adults. Vaccine 2008; 26 : 6614–6619.
10. Holland D, Booy R, De Looze F, et al. Intradermal influenza vaccine administered using a new microinjection system produces superior immunogenicity in elderly adults: a randomized controlled trial. J Infect Dis 2008; 198(5): 650–658.
11. Sanofi Pasteur. Internal data. Clinical trials.gov NCT00258934.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- New options of influenza vaccination
- Urologic complications of HIV infection
- Adrenocortical insufficiency and diabetes mellitus type 1
- Impact of mechanical circulatory support on renal function in a patient with end stage heart failure
- Prediction of postoperative complications and optimization of surgical technique
- The Year of the Lung
- Practical instrument for pathological gamblers and other patients with heavy debts
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adrenocortical insufficiency and diabetes mellitus type 1
- New options of influenza vaccination
- Urologic complications of HIV infection
- Impact of mechanical circulatory support on renal function in a patient with end stage heart failure
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career