-
Medical journals
- Career
Možnosti využití stanovení minimální reziduální choroby u adenokarcinomu pankreatu pomocí metodiky real-time RT-PCR – pilotní studie
Authors: Dušan Klos 1; Martin Loveček 1; Josef Srovnal 2; Andrea Benedíková 2; Věra Růžková 2; Lenka Radová 2; Marián Hajdúch 2; Čestmír Neoral 1; Roman Havlík 1
Authors‘ workplace: Univerzita Palackého v Olomouci, Lékařská fakulta, I. chirurgická klinika FN 1; Univerzita Palackého v Olomouci, Lékařská fakulta, Dětská klinika FN, Laboratoř experimentální medicíny 2
Published in: Čas. Lék. čes. 2010; 149: 69-73
Category: Original Article
Overview
Východisko.
Minimální reziduální choroba u karcinomu pankreatu je definována jako přítomnost izolovaných nádorových buněk v těle pacienta po primárním radikálním odstranění nádoru, který je v současnosti bez známek onemocnění. Izolované nádorové buňky můžeme označit jako možné prekurzory metastáz. Stanovení minimální reziduální choroby u pacientů s tímto vysoce maligním onemocněním může vyselektovat skupinu nemocných nevhodných k chirurgickému výkonu pro rozsah onemocnění a může sloužit jako prediktivní faktor.Metody a výsledky.
Do této studie bylo zařazeno celkem 70 pacientů operovaných pro karcinom pankreatu s kurativním záměrem. Pomocí metody real-time RT-PCR (polymerázová řetězová reakce v reálném čase) byla hodnocena exprese genů nádorových buněk a to hTERT (telomeráza), EGFR1 (receptor pro epidermální růstový faktor) a CEA (karcinoembryonální antigen), a to v periferní a portální krvi, kostní dřeni, peritoneální laváži a v tumoru. Výsledky byly korelovány s klinicko-patologickými činiteli a přežíváním. Byl přitom prokázán statisticky signifikantní vztah mezi expresí EGFR v portální krvi a klinickým stadiem – pacienti s pokročilým onemocněním měli vyšší expresi EGFR v portální krvi a také peritoneální laváži oproti pacientům bez vzdálených metastáz.Závěry.
Výsledky této studie prokazují vysokou senzitivitu a specificitu metodiky RT-PCR v detekci cirkulujících nádorových buněk u pacientů s karcinomem pankreatu. Rozšíření této metodiky umožní v budoucnu použít detekci minimální reziduální choroby jako prediktivního faktoru a také posílí její význam v indikaci k chirurgickému výkonu.Klíčová slova:
karcinom pankreatu, minimální reziduální choroba, metoda real-time RT-PCR, prediktivní faktory.ÚVOD
Karcinom slinivky břišní představuje jedno z nejagresivnějších nádorových onemocnění s velmi špatnou prognózou, se stoupající incidencí a přitom, přes pokroky ve výzkumu, s neklesající mortalitou. Stává se tak jedním z nejvýznamnějších medicínských problémů moderních rozvinutých zdravotnických systémů. Jedná se o onemocnění, které je často diagnostikováno až ve velmi pokročilém stadiu, kdy jsou možnosti léčby zcela minimální. Vzdálené metastázy a karcinomatóza peritonea jsou způsobeny časnou diseminací nádorových buněk, a to buď cestou hematogenní či lymfogenní. Nejčastější příčinou lokálních recidiv tumoru je jeho perineurální šíření. V současnosti není k dispozici kvalitní screeningový program, který by byl schopen odhalit nádory pankreatu v raném stadiu. Také onkologická adjuvantní terapie je velmi omezená a v drtivé většině případů nevede k radikálnímu prodloužení přežívání nemocných. Někteří autoři tak považují toto onemocnění od počátku za systémové a v určitých fázích historického vývoje se i řada chirurgů k radikálním operacím pankreatu stavěla zdrženlivě až odmítavě. Názor je to jistě přehnaný, obzvláště za situace, kdy pacientům s kurabilně resekabilním tumorem není co jiného v managementu léčby nabídnout. Napovídá to však tomu, že karcinom pankreatu vzhledem ke své lokalizaci a biologické aktivitě představuje od počátku vysoce invazivní nádorové onemocnění.
Léčba karcinomu pankreatu je multimodální. Jedinou potenciálně kurativní metodou je R0-chirurgická resekce. Přitom radikální chirurgický výkon je možný jen u části nemocných s tímto typem nádoru. Pětileté přežívání i po radikálních resekčních výkonech na pankreatu je přesto velmi nízké a pohybuje se mezi 2–4 % (1). Jako významné nepříznivé prognostické faktory pro délku přežití po resekci jsou udávány zejména pozitivita nádoru v uzlinách, grading nádoru, velikost tumoru větší než 2,5 cm, přítomnost nádoru v resekční linii, cévní invaze, invaze nádoru přes kapsulu, což podmiňuje časnou lokální recidivu.
Jako minimální reziduální chorobu pak označujeme přítomnost cirkulujících nádorových buněk v kompartmentech mezenchymálního původu, tj. v krvi, kostní dřeni, lymfatických uzlinách a dutině peritoneální, které jsou podle současných poznatků považovány za určitých okolností za možné prekurzory rozvoje vzdálených metastáz. Jejich přítomnost však ještě neznamená jednoznačně vznik a vývoj vzdálených metastáz. Klinický význam minimální reziduální choroby proto ještě není stále přesně jasný. A nadále tedy zůstává zdrojem celé řady sporů a odborných diskuzí.
Jak už bylo zmíněno, jedinou potenciálně kurabilní metodou léčby karcinomu pankreatu zůstává radikální resekce. Přitom je nutné naprosto otevřeně konstatovat, že chirurgická metodika a technika je plně rozvinutá a žádná inovace ve smyslu miniinvazivního přístupu či rozsahu radikality a lymfadenektomie nevede k tolik žádoucímu zvýšení přežívání nemocných. V tomto smyslu je chirurgická terapie již plně vyčerpána. Další modality léčby je tak nutné hledat na úrovni molekulárně-genetické, kde nové poznatky v etiopatogenezi a mechanismech pankreatické kancerogeneze mohou vést k odhalení nových léčebných postupů, ať už ve smyslu moderní chemoterapie, metod biologické léčby či dokonce genové terapie. A z tohoto pohledu má jednoznačný význam i stanovení minimální reziduální choroby jako potenciálního diagnostického a prognostického faktoru.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Do pilotní studie bylo zařazeno 70 pacientů (tab. 1) operovaných na I. chirurgické klinice FN v Olomouci v letech 2007–2009 pro karcinom pankreatu, a to ve všech klinických stadiích dle UICC klasifikace. Rozsah výkonu zahrnoval od prosté explorace s biopsií, přes spojkové operace – choledochoduodenoanastomóza a gastroenteroanastomóza – až po radikální výkon u tumorů hlavy pankreatu v podobě pravostranné pankreatoduodenektomie. Zlatým standardem na našem pracovišti se stala pylorus šetřící pankreatoduodenektomie (pylorus preserving pancreatoduodenectomy) zavedená v roce 1944 Watsonem, v moderní modifikaci Traversa a Longmireho z roku 1978, zahrnující výslednou rekonstrukci na první kličku jejuna v tomto pořadí: 1. terminolaterální pankretojejunoanastomóza, 2. terminolaterální hepatikojejunoanastomóza a 3. antekolická terminolaterální gastroenteroanastomóza. Naše pracoviště dosahuje mortality pod 5 % a pod 10 % klesá rovněž počet pooperačních dehiscencí v oblasti pankreato-jejunálních a hepatiko-jejunálních.
Table 1. Charakteristika souboru pacientů s karcinomem pankreatu 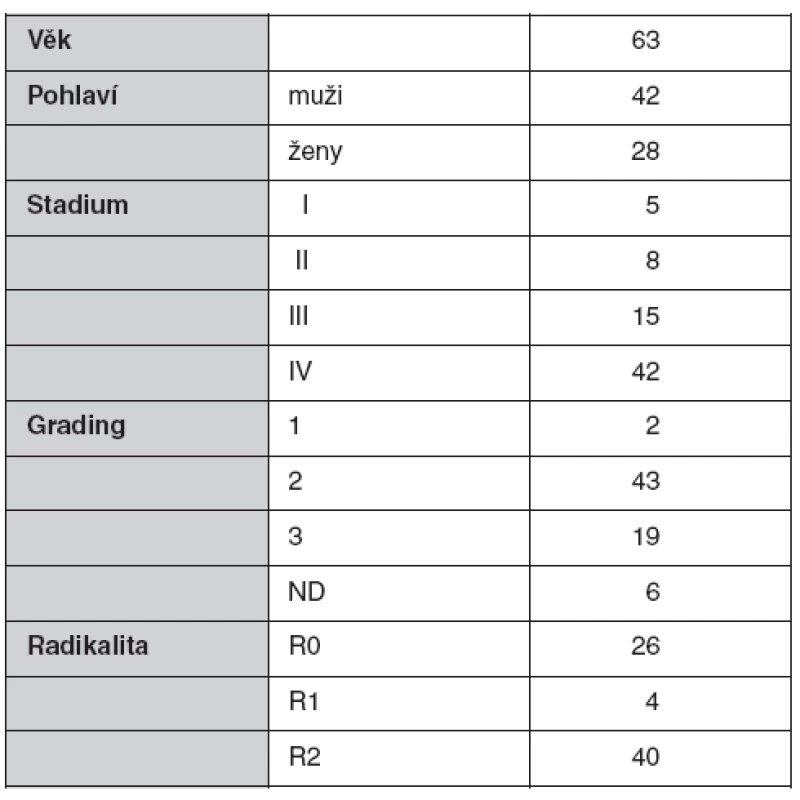
Stanovení minimální reziduální choroby probíhá ve spolupráci s Laboratoří experimentální medicíny při Dětské klinice Fakultní nemocnice v Olomouci. Jako sledované markery pro karcinom pankreatu byly stanoveny telomeráza (hTERT), receptor pro epidermální růstový faktor (EGFR1) a karcinoembryonální antigen (CEA) vyšetřované v kostní dřeni, periferní a systémové krvi, peritoneální laváži a také odběr vzorku nádoru pro případnou genovou analýzu, které ukládáme do RNA lateru. Byla stanovena také kontrolní hodnota exprese hTERT ve vzorcích 58 dobrovolných dárců krve.
Aby bylo možné stanovit specificitu dané metody stanovování minimální reziduální choroby, bylo nutné stanovit expresi jednotlivých nádorových markerů – genů v krvi, kostní dřeni a lymfatické tkáni zdravých jedinců. V této pilotní studii byly do srovnávací skupiny zařazeny vzorky krve získané od 58 dobrovolných dárců krve, dále vzorky kostní dřeně od 12 zdravých dárců a vzorky tří lymfatických uzlin odebraných u pacientů pro zánětlivá benigní onemocnění (cholecystektomie, polypektomie apod.). Byla provedena real-time RT-PCR reakce dle laboratorně standardizovaných podmínek a následně byly výsledky statisticky zpracovány. Jako cut-off hodnota pro pozitivní versus negativní hodnocení minimální reziduální choroby byl stanoven trojnásobek průměrné hodnoty exprese markeru v kontrolním souboru. Při hodnocení diagnostické specifičnosti byla jako falešně pozitivní výsledek hodnocena exprese vyšší než cut-off hodnota. Výpočet diagnostické specifičnosti byl proveden podle vzorce: správná negativita/(správná negativita + falešná pozitivita).
Stanovit senzitivitu této metody není možné, a to vzhledem k povaze vyšetření minimální reziduální choroby a z biologické povahy a proměnlivosti vzorků. Pro detekci diseminovaných nádorových buněk v těle pacienta se zhoubným nádorem, a to na podkladě exprese jednotlivých nádorových markerů, byla testována senzitivita této metodiky na základě dilučních řad. Nádorové buňky získané z reálných vzorků nativních tumorů byly přidány do vzorků jaderných buněk krve získaných od zdravých dárců – dobrovolníků v poměru 1 : 1 až 1 : 10 000 000. Poté byla provedena real-time RT-PCR o 50 cyklech s testovanými markery. Výsledná citlivost detekce diseminovaných nádorových buněk za použití CEA byla 3,3.10-7, EGFR 2,5.10-7, CK 19 a CK 20 1.10-6.
Metodický postup
Vlastní metodický postup zahrnuje:
- Izolaci RNA po lýze erytrocytů/centrifugaci peritonální laváže fenol-chloroformovou metodou dle Chomczynského (trizol) z 11 milionů jaderných buněk krve, kostní dřeně či peritoneální laváže. Solidní tkáně nádoru jsou před izolací RNA homogenizovány za pomocí homogenizéru RETSCH MM 301. Koncentrace a čistota vyizolované mRNA je stanovena UV spektrofotometricky.
- Transkripce 3 μg RNA/30 μl reakční směsi za použití random primerů, H-minus M-MuLV reverzní transkriptázy (Fermentas).
- QRT-PCR reakce – reakční směs 25 μl, směs obsahuje specifické primery, TaqMan sonda jako fluorescenční činidlo, 100 ng testované cDNA a další chemikálie běžné pro PCR reakce.
- Sekvence primerů a próby: hTERTs 5’-atgtcacggagagaccacgttt-3’, hTERTas5’-gcaccctcttcaagtgctg-3,hTERTprobe5’-tggagcaagttgcaaagcattgga-BHQ_HEX-3’.
- Absolutní kvantifikace na základě standardizační křivky (standardy-plazmová DNA).
Získané výsledky byly korelovány s klinicko-patologickými charakteristikami (velikost nádoru, klinické stadium, postižení lymfatických uzlin, přítomnost vzdálených metastáz, rozsah výkonu) a délkou přežívání nemocných.
Následovalo statistické zpracování, které bylo provedeno pomocí programu Statistica 8 od firmy StatSoft. Jako mezní hladina významnosti u všech testů byla stanovena α = 0,05. U výsledků exprese jednotlivých markerů bylo pak Shapiro-Wilkovým testem stanoveno porušení normality, proto následné statistické analýzy byly provedeny neparametricky (Kruskal-Wallisovou Anovou, Mann-Whitneyovým testem). Závislosti mezi expresí markerů byly ověřovány testem nulovosti Spearmanova korelačního koeficientu.
V analýzách přežití byla použita Kaplan-Meierovu metoda a Gehanův-Wilcoxonův test, kde počátkem sledování u každého pacienta je vždy datum operačního výkonu s odběrem vzorků. Při analýzách kontingenčních tabulek byl použit Pearsonův χ2-test.
Výsledky
Při hodnocení výsledku byla prokázána statisticky významná souvislost mezi mírou exprese EGFR v portální krvi a klinickým stadiem (p < 0,006) (obr. 1), kde pacienti s pokročilým onemocněním mají vyšší expresi EGFR v portálním řečišti než pacienti s nízkým klinickým stadiem.
Image 1. Exprese EGFR v portální krvi vzhledem ke klinickému stadiu 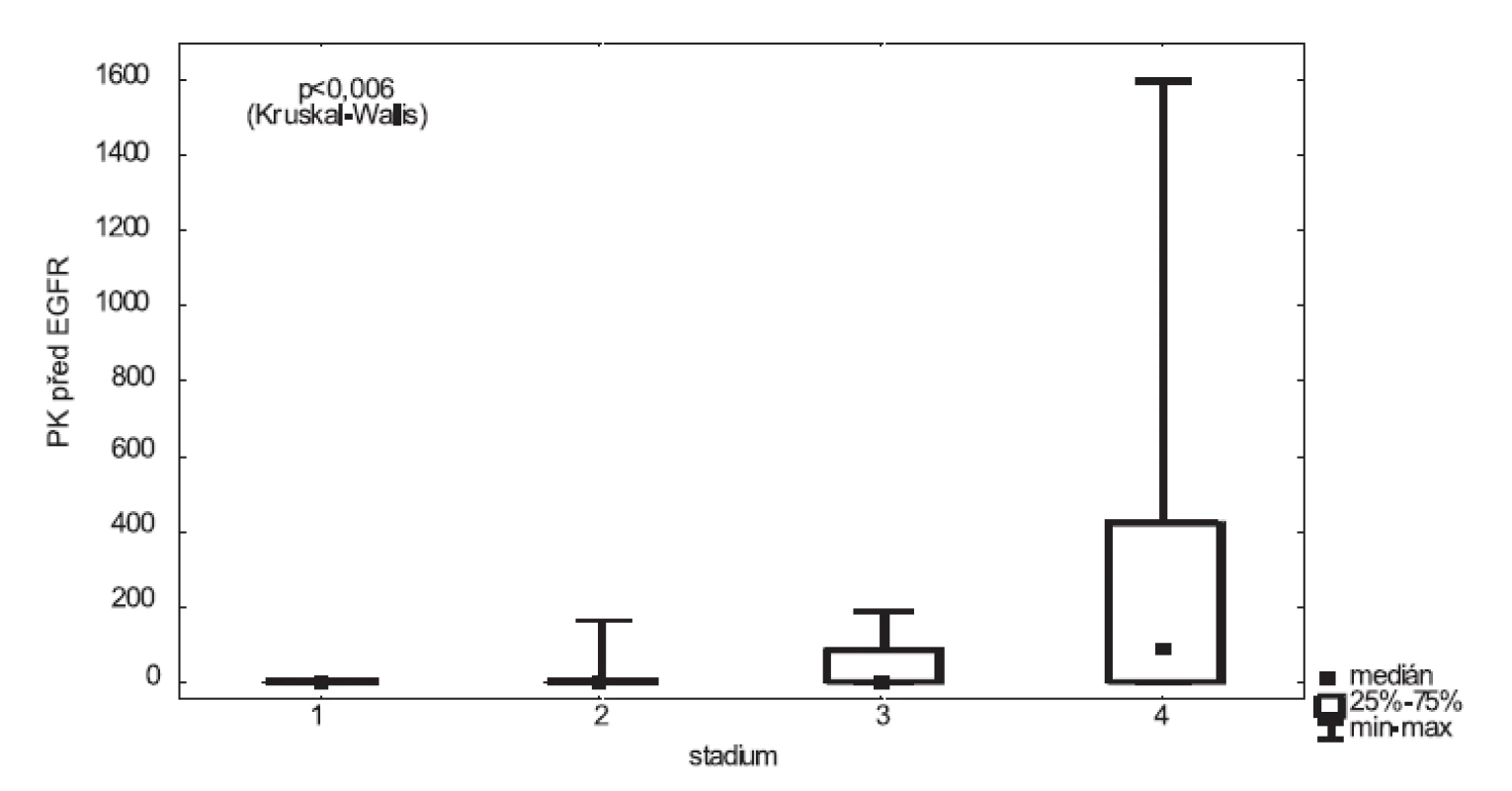
Obdobně koreluje vztah exprese EGFR v portální krvi vzhledem ke gradingu (p < 0,015), kdy mnohem vyšší exprese EGFR byla nalezena u pokročilých stadií onemocnění než u nízkých (obr. 2). Dále byla prokázána vysoká exprese EGFR v peritoneální laváži pacientů s metastatickým postižením (p = 0,01) na rozdíl od pacientů bez metastáz (obr. 3).
Image 2. Exprese EGFR v portální krvi vzhledem ke gradingu 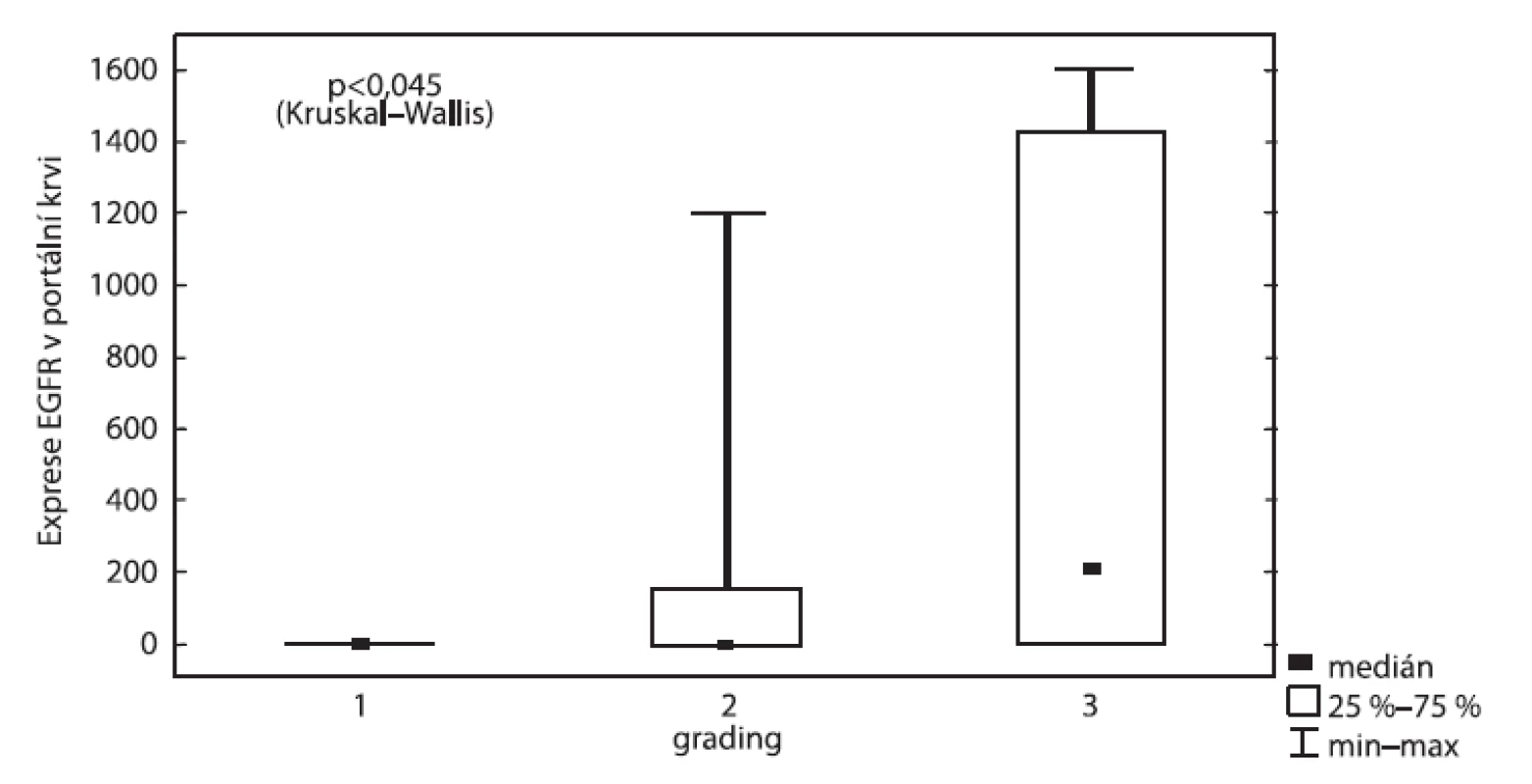
Image 3. Exprese EGFR v peritoneální laváži vzhledem k přítomnosti metastáz 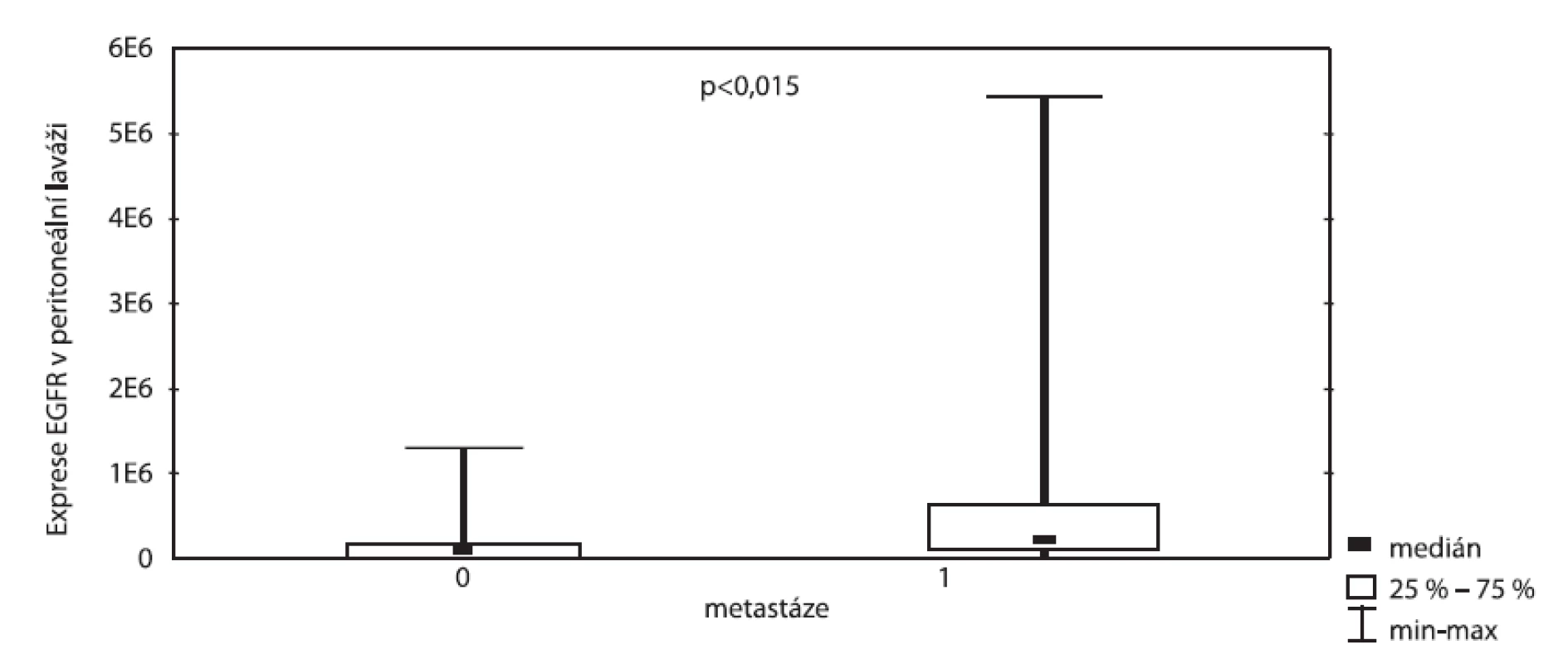
Dalším zjištěním bylo hodnocení vztahu délky přežití vzhledem k pozitivitě exprese testovaných markerů v peritoneální laváži. Byl prokázán signifikantní pokles přežívání u pacientů s pozitivní expresí EGFR a CEA v předoperační peritoneální laváži. Dále jsme prokázali, že také pozitivita hTERT v systémové a portální krvi predikuje výrazně nižší dobu přežívání (obr. 4).
Image 4. Celkové přežívání vzhledem k pozitivitě hTERT v systémové krvi 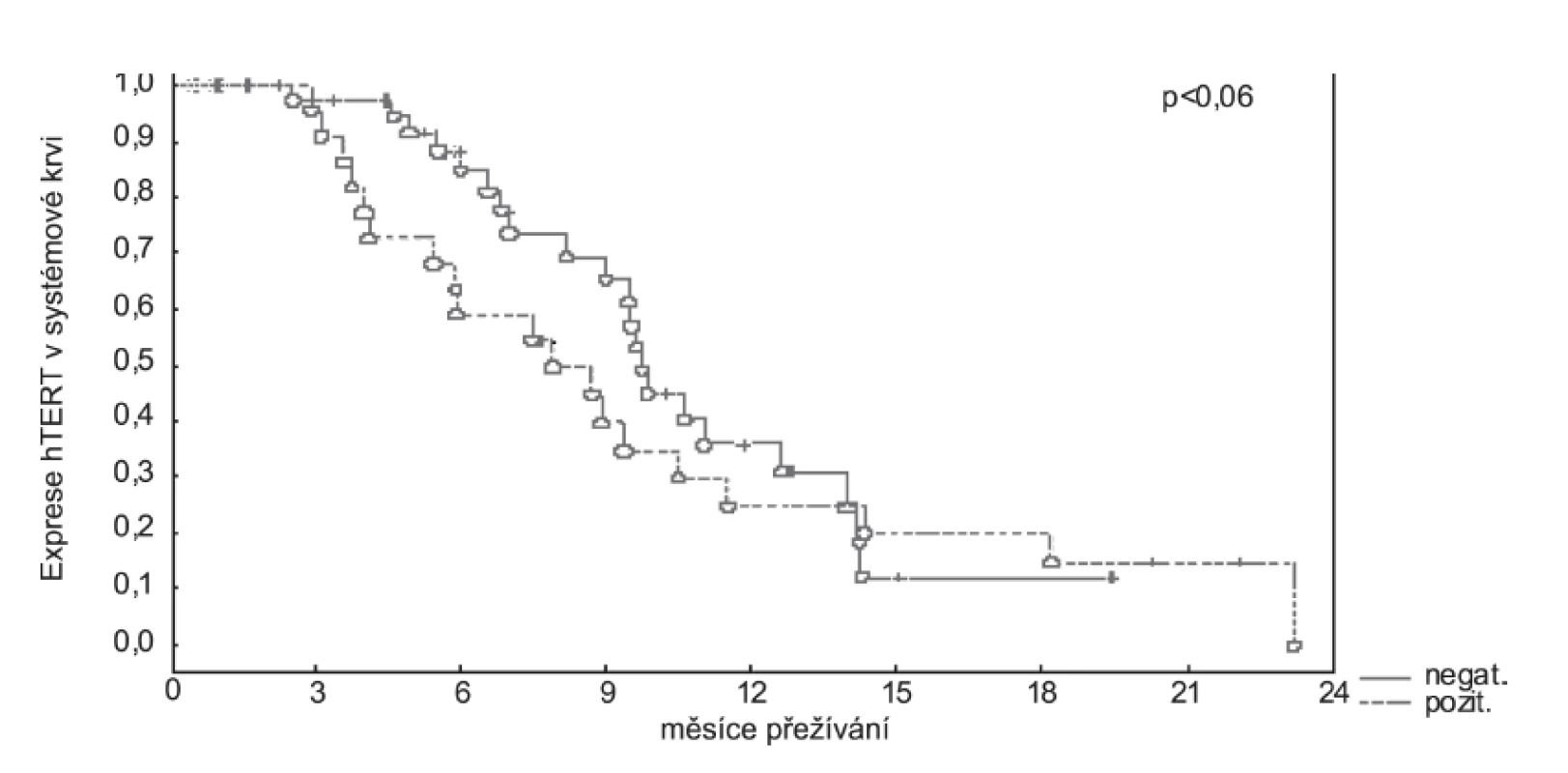
Diskuze
Pro detekci minimální reziduální choroby u solidních nádorů lze použít několika metodických postupů, které se od sebe liší v pracnosti, nákladnosti, specifičnosti a především senzitivitě. Mezi nejcitlivější metody průkazu nádorových markerů patří imunocyto(histo)chemie a moderní metody molekulární biologie. Je to především metoda real time RT-PCR, která dosahuje citlivosti 1 : 10-7 a je tedy zhruba o dva řády citlivější než imunocytochemie (2–5). Metoda RT-PCR je v podstatě studiem genové exprese, kdy jsou nádorové buňky detekovány na úrovni informační, mesengerové mRNA. Metoda tedy vyniká svou senzitivitou a v závislosti na použitém markeru nádorových buněk i svou specificitou. Tu stanovujeme na základě vyšetření zdravých jedinců, od nichž odvozujeme tzv. cut-off hodnotu jako průměr plus dvakrát směrodatná odchylka, čili 97,5 % zdravých jedinců bude MRD negativních.
Výzkumem minimální reziduální choroby metodou RT-PCR u karcinomu pankreatu se do dnešních dnů nezabývalo mnoho studií. Detekcí okultních nádorových buněk v paraaortálních lymfatických uzlinách se zabýval například Niedergethmann 2002 (3), jako marker byl použit mutantní K-ras. Postižení lymfatických uzlin bylo za pomocí standardních histopatologických metod zjištěno u 4 % ze 69 pacientů, za použití PCR metod to bylo u 17 % pacientů. Z multivariační analýzy vyplynulo toto postižení jako nezávislý prognostický marker. Podobných výsledků dosáhl i Tamagawa v roce 1997 (6). Detekce mikrometastatického postižení kostní dřeně se u karcinomu pankreatu za pomocí imunohistochemického markeru cytokeratinu 20 (CK 20) ukázala jako negativní prognostický faktor (7). Stejných výsledků dosáhla tato skupina i při vyšetření žilní krve na přítomnost diseminovaných nádorových buněk za použití CK 20. Specifickou oblastí u karcinomu pankreatu je postižení peritonea karcinomatózou. Broll (8) prokázal, že přítomnost mikrometastatického postižení peritonea v peritoneální laváži je nezávislým prognostickým faktorem. Problémem všech uvedených studií zůstává nejednotnost použitých metodik, různorodost markerů, převážné použití kvalitativních nebo semikvantitativních metod a malé soubory vyšetřených pacientů. Soeth E. et al. (9) se zabýval stanovením minimální reziduální choroby u pacientů s karcinomem pankreatu na podkladě exprese cytokeratinu 20 pomocí metodiky RT-PCR. Bylo zjištěno, že pacienti s dobře diferencovanými karcinomy G1 a G2 mají signifikantně vyšší délku přežívání (p = 0,045) než pacienti s nízce diferencovanými tumory. Pozitivita exprese CK 20 v kostní dřeni a/nebo krvi u pacientů ve skupině s tumory G1 a G2 diferenciace značí signifikantní negativní prognostický faktor (p = 0,046). Podobných výsledků dosáhl v roce 2007 Hoffmann K. et al. (10), který se zabýval detekcí diseminovaných pankreatických nádorových buněk na základě exprese cytokeratinu 19 v krvi, kostní dřeni a peritoneální laváži pomocí metodiky RT-PCR.
Cílem naší pilotní studie bylo tedy stanovit nádorové markery vhodné k určení minimální reziduální choroby u karcinomu pankreatu. Vybrali jsme telomerázu (hTERT), receptor pro epidermální růstový faktor (EGFR) a karcinoembryonální antigen (CEA). Z výše uvedených výsledků vyplývá, že dané markery, a to především EGFR a CEA, lze použít k detekci minimální reziduální choroby metodou RT-PCR u karcinomu pankreatu. Nepotvrdili jsme vhodnost hTERT jako markeru k určení minimální reziduální choroby u pacientů s karcinomem pankreatu.
Vlastní potenciál pro klinickou praxi vyplývající ze stanovení minimální reziduální choroby u karcinomu pankreatu vidíme především ve zpřesnění klasické TNM klasifikace na úroveň tzv. ultrastadia, kdy minimální reziduální choroba může sloužit jako jeden z družiny prediktivních faktorů, který bude sloužit pro předpověď prognózy a časnosti lokální recidivy či vzdálených metastáz. Protože klinický impakt minimální reziduální choroby je zatím rozporuplný, nemůže v současnosti nijak ovlivnit způsob rozřazení pacientů do kategorií pro klasickou „lege artis“ terapii.
Závěry
V naší studii byla ověřena možnost detekce minimální reziduální choroby u karcinomu pankreatu pomocí sledování nádorových buněk na základě exprese stanovených markerů, tj. karcinoembryonálního antigenu, telomerázy a receptoru pro epiteliální růstový faktor, pomocí metody real-time RT-PCR, a to s dostatečnou senzitivitou a specificitou. Stanovili jsme metodiku diagnostiky nádorových pankreatických buněk pomocí vlastního designu prób použitých v laboratorních podmínkách. Podařilo se také standardizovat metodiku odběrů systémové a portální krve, peritoneální laváže a kostní dřeně, které byly podrobeny další diagnostice. V souboru pacientů jsme pak korelovali získané výsledky stran pozitivity či negativity minimální reziduální choroby s jednotlivými patologicko-anatomickými činiteli a s délkou přežívání. Ověřili jsme tedy možnost budoucího využití detekce minimální reziduální choroby jako jednoho z potenciálních prognostických faktorů u karcinomu pankreatu.
Zkratky
CEA – karcinoembryonální antigen
EGFR1 – receptor pro epidermální růstový faktor
hTERT – telomeráza
UICC klasifikace – l’Union Internationale Contre le Cancer
Práce na tomto projektu je podporována grantem IGA MZ CR NS9937-4.
Adresa pro korespondenci:
MUDr. Dušan Klos
I. chirurgická klinika LF UP a FN
I. P. Pavlova 6, 775 20 Olomouc
e-mail: dklos@seznam.cz, dusan.klos@fnol.cz
Sources
1. Adam Z, Vorlíček J, Vaníček J, et al. Diagnostické a léčebné postupy u maligních chorob. Praha: Grada Publishing 2002.
2. Koch M, et al. Detection of Hematogenous Tumor Cell Dissemination Predicts Tumor Relapse in Patients Undergoing Surgical Resection of Colorectal Liver Metastases. Annals of Surgery 2005; 241(2): 199–205.
3. Niedergethmann M, Rexin M, Hildenbrand R, et al. Prognostic implications of routine, immunohistochemical, and molecular staging in resectable pancreatic adenocarcinoma. Am J Surg Pathol 2002; 26(12): 1578–1587.
4. Schuster R, Max N, Mann B, et al. Quantitative real-time RT‑PCR for detection of disseminated tumor cells in blood of patients with colorectal cancer using different mRNA markers. Int. J Cancer 2004; 108 : 219–227.
5. Taniguchi T, Makino M, Suzuki K, Kaibara N. Prognostic significance of reverse transcriptase-polymerase chain reaction measurement of carcinoembryonic antigen mRNA levels in tumor drainage blood and peripheral blood of patients with colorectal carcinoma. American Cancer Society 2000; 89(5): 970–976.
6. Tamagawa E, Ueda M, Takahashi S, et al. Pancreatic lymph nodal and plexus micrometastases detected by enriched polymerase chain reaction and nonradioisotopic single-strand conformation polymorphism analysis: a new predictive factor for recurrent pancreatic carcinoma. Clin Cancer Res 1997; 3(11): 2143–2149.
7. Soeth E, Grigoleit U, Moellmann B, et al. Detection of tumor cell dissemination in pancreatic ductal carcinoma patients by CK 20 RT-PCR indicates poor survival. J Cancer Res Clin Oncol 2005; 131(10): 669–676.
8. Broll R, Weschta M, Windhoevel U, et al. Prognostic significance of free gastrointestinal tumor cells in peritoneal lavage detected by immunocytochemistry and polymerase chain reaction. Langenbecks Arch Surg 2001; 386(4): 285–292.
9. Soeth E, et al. Detection of tumor cell dissemination in pancreatic ductal carcinoma patiens by CK 20 RT-PCR indicates poop survival. J Cancer Res Clin Oncol 2005; 10 : 669–676.
10. Hoffmann K, et al. Detection of disseminated pancreatic cells by amplification of cytokeratin-19 with quantitative RT-PCR in blood, bone marrow and peritoneal Lavre of pancreatic carcinoma patiens. World J Gastroenterol 2007; 2 : 257–263.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Renin, prorenin a přímý inhibitor reninu aliskiren
- Computed tomography laser mammography
- Možnosti využití stanovení minimální reziduální choroby u adenokarcinomu pankreatu pomocí metodiky real-time RT-PCR – pilotní studie
- Co poradit dospělým dětem rodičů s návykovou nemocí
- Pupilometrie jako bioindikátor účinku léčiv
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pupilometrie jako bioindikátor účinku léčiv
- Renin, prorenin a přímý inhibitor reninu aliskiren
- Computed tomography laser mammography
- Co poradit dospělým dětem rodičů s návykovou nemocí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

