-
Medical journals
- Career
Závažná autoimunitní tyreotoxikóza komplikovaná febrilní neutropenií jako nežádoucí účinek tyreostatické léčby
Authors: Marie Jarolímová; Michal Kazmíř
Authors‘ workplace: Interní oddělení, Oblastní nemocnice Kolín, a. s.
Published in: Vnitř Lék 2023; 69(E-2): 19-22
Category: Case reports
doi: https://doi.org/10.36290/vnl.2023.024Overview
Hypertyreóza je stav nadprodukce hormonů štítné žlázy. Ve většině případů jsou pacienti schopni ambulantní terapie. Vzácně však může stav rychle progredovat do život ohrožující tyreotoxické krize s nutností léčby na jednotce intenzivní péče. Základem léčby je podání vysokých dávek tyreostatik, kortikoidů, betablokátorů a řádná rehydratace, nejlépe parenterální cestou. Při nedostatečném účinku se provádí plazmaferéza.
Tyreostatika mohou mít své nežádoucí účinky. Mezi mírné řadíme vyrážku, GIT obtíže, bolesti kloubů. Mohou se vyskytnout i život ohrožující komplikace, jako je agranulocytóza nebo toxická jaterní léze vyúsťující v jaterní selhání. V této kazuistice představujeme pacientku se závažným průběhem autoimunitní tyreotoxikózy, fibrilací síní s přechodem do fibrilace komor a rozvinutým cor thyreotoxikum. Léčba byla komplikována febrilní neutropenií.
Klíčová slova:
hypertyreóza – agranulocytóza – Lugolův roztok – totální tyreoidektomie – tyreotoxická krize
Úvod
Hypertyreóza je onemocnění způsobené nadbytkem hormonů štítné žlázy. Dle laboratorních hodnot ji rozdělujeme na manifestní (snížený TSH, zvýšený T4/T3) s prevalencí 0,2–0,4 % a subklinickou (snížený TSH, normální T4/T3 v krvi) s prevalencí 2–4 %. Častěji jsou postiženy ženy. Příčiny mohou být periferní (Graves‑Basedowova nemoc, tyreoiditidy, hyperfunkční tyreoidální uzly, poléková hypertyreóza po léčbě amiodaronem), exogenní při předávkování tyreoidálními hormony, dále vzácnější centrální a ektopické (1). Příznaky dělíme do 2 skupin – z nadbytku tyreoidálních hormonů (metabolické, oběhové, kožní, svalové, neuropsychické), dále z poruchy imunitního systému (endokrinní orbitopatie, pretibiální myxedém, akropachie, periodická svalová hypokalemická paralýza). Základem léčby je zklidnění příznaků, poté se rozhodujeme o definitivním řešení (operační či terapie radiojodem). Jako tyreostatikum první volby používáme methimazol v dávce 20 až 40 mg denně s postupnou úpravou dle klinického stavu a laboratorních hodnot. Plný účinek se dostaví v řádu několika týdnů. V některých případech, vyjma gravidity, můžeme přidat malou dávku levothyroxinu (2). Při intoleranci methimazolu nebo v prvním trimestru gravidity využíváme jako druhou volbu propylthiouracil. Mezi jeho nežádoucí účinky patří kožní alergie, dyspeptické obtíže, mírná neutrocytopenie. Vzácně se může vyskytnout život ohrožující agranulocytóza, vaskulitida a hepatopatie (2). V léčbě dále využíváme betablokátory, vitaminy skupiny B a symptomatickou terapii. Definitivní řešení závisí na příčině hyperfunkce štítné žlázy, např. u Graves Basedowovy choroby může dojít k dlouhodobé remisi na konzervativní terapii, naopak při nálezu hyperfukčního uzlu je po zklidnění nutné operační řešení, další možností je terapie radiojódem, vše pak rozhoduje endokrinolog.
Tyreotoxická krize je naštěstí vzácná. Je definována jako excesivní nadbytek tyreoidálních hormonů, který ohrožuje pacienta na životě oběhovým a multiorgánovým selháním (3, 4). Podstatou je intenzivní metabolická aktivita, která významně zvyšuje nároky na oxygenaci tkání, způsobí tachykardii indukující srdeční selhání i nervové příznaky (3). Jedná se o urgentní situaci, léčba probíhá na jednotce intenzivní péče s případnou invazivní podporou ventilace (5).
Diferenciálně diagnosticky je nutno odlišit jiné příčiny tachykardie, tachyarytmie, hyperpyrexie a poruch vědomí. Laboratorně je důležité odlišit syndrom nízkého trijodtyroninu (T3), kde nacházíme snížené TSH a mírně zvýšený FT4; FT3 je ale nízký (6).
Popis případu
Doposud zdravá 53letá pacientka, s negativní osobní i rodinnou anamnézou endokrinního onemocnění, byla přivezena RZP v podvečerních hodinách na interní ambulanci Oblastní nemocnice Kolín pro zhoršení dechu a palpitace po těžké práci na zahradě. Na vstupním EKG byla zachycena fibrilace síní s rychlou odpovědí komor, frekvencí 180/min. Po podání betablokátoru – metoprolol 50 mg p. o., došlo jen k mírnému zpomalení frekvence na 150/min.
Klinicky byla pacientka klidově dušná, dominoval psychomotorický neklid a hypermobilita, byl patrný jemný třes končetin a hmatná nebolestivá struma. Subjektivně uvedla váhový úbytek cca 10 kg za měsíc, zvýšené pocení a opakovanou námahovou dušnost, bez bolesti na hrudi. Oční potíže nebo abdominální dyskomfort neměla.
Byla zajištěna LMWH v antikoagulační dávce, beta‑blokátorem (metoprolol) a uložena na telemetrické lůžko.
Laboratorní nález potvrzoval rozvinutou hypertyreózu (fT4 69,6 pmol/l, TSH 0,004 mIU/l, antiTSHR 6,5 IU/l, antiTPo 103 kU/l, antiTG neg.), NTproBNP 1926 pg/ml, dále nízké HDL (0,79 mmol/l), jinak byl bez dalších pozoruhodností.
Krátce po přijetí došlo k fibrilaci komor. Ihned byla provedena defibrilace s následnou konverzí zpět na fibrilaci síní s rychlou odpovědí komor 170/min. Poté, za asistence anesteziologa, byla provedena intubace a elektrická kardioverze, tentokrát na sinusový rytmus s frekvencí 130/min. K další léčbě byla pacientka přeložena na oddělení ARO.
Při sonografickém vyšetření štítné žlázy byla nalezena struma o objemu 32 ml, typický obraz odpovídající autoimunitní tyreoiditidě. Dle barevného mapování hypervaskularizace stupeň III. Nález odpovídal Graves‑Basedowově nemoci.
Echokardiografické vyšetření prokázalo těžkou systolickou dysfunkci, EF LK 20–25 %, těžkou difuzní hypokinezi, což podporovalo diagnózu cor thyreotoxicum. Během vyšetření byl zachycen nepravidelný rytmus při fibrilaci síní s odpovědí komor 120/min, která recidivovala již druhý den hospitalizace na ARO oddělení.
Pro závažný klinický stav a dostupnost injekčního tyreostatika jsme indikovali podávání methimazolu 40 mg i. v. po 8 hodinách spolu s betablokátory – nejprve injekční metoprolol s následným převodem na per os formu 75 mg 2× denně, hydrocortizonem 50 mg i. v. po 12 hodinách a další symptomatickou léčbou.
Po brzké extubaci byla pacientka přeložena na interní JIP. Stav byl komplikován katétrovou sepsí (CRP 112 mg/l, leukocyty 17,1 × 109/l), v hemokultuře etiologicky zjištěn Staphylococcus aureus s citlivostí na penicilinová antibiotika, odléčeno flucloxacillinem 2 g intravenózně po 6 hodinách po dobu 7 dní.
Po 14denní hospitalizaci v nemocnici byla pacientka propuštěna do domácí léčby na této medikaci: methimazol tbl. 10 mg (dávkování 2-0-2), metoprolol ZOK 100 mg (dávkování 1-0-1), ramipril 1,25 mg (1-0-0), rivaroxaban 20 mg (1-0-0), omeprazol 40 mg (1-0-0). Při dimisi byly laboratorní hodnoty krevního obrazu v normě, CRP 19 mg/l, lehká elevace GGT 1,87 μkat/l a ALP 3,04 μkat/l. Výstupní hormony štítné žlázy prokazovaly medikamentózně kontrolovanou tyreotoxikózu: fT4 – 28,4 pmol/l, TSH 0,004 IU/l. Vše viz graf 1. Na EKG přetrvávala fibrilace síní s přiměřenou odpovědí komor 80/min.
Graph 1. Tyreotoxická krize: průběh laboratorních hodnot během hospitalizace, archiv autorky 
Při druhé ambulantní kontrole po 3 týdnech od propuštění (ze které se chtěla nemocná telefonicky omluvit pro anginu léčenou penicilinem v režii praktického lékaře), byla při statimovém vyšetření krevního obrazu zachycena neutropenie (2,06 × 109/l leukocytů, z toho neutrofily 1,4 %).
Medikaci methimazolem jsme přerušili a pacientku přijali k hospitalizaci. Byly provedeny krevní odběry biochemie, dále kultivace – moče, výtěr z hrdla a hemokultura, rentgen hrudníku. V moči nález Klebsielly pneumonie, pacientka zaléčena cílenou terapií linezolidem 600 mg 2× denně po dobu 7 dní. Torpidní neutropenie přetrvávala 11 dní i přes nasazenou léčbu filgrastinem 48MU 2× denně. Po zvládnutí močové infekce byl na doporučení hematologa nasazen Prednison 20 mg s dávkováním 2-1-0, který pomohl obnovit tvorbu bílých krvinek.
Vzhledem k riziku zkřížené reakce nebyl použit propylthiouracil. Jako ultimum refugium bylo nutno primární onemocnění vyřešit operačním výkonem, a proto byla indikována totální tyreoidektomie. Po konzultaci léčby v Endokrinologickém ústavu (EÚ Praha) jsme započali lugolizaci. Jedná se o starší předoperační přípravu toxických strum, při které je využíváno tzv. Wolff‑Chaikoffova efektu, kdy podání anorganického jodu v nadbytku má dočasný inhibiční vliv na syntézu tyreoidálních hormonů.
Lugolův roztok (Jodi puri 0,2 g, Kalii jodati 2,0 g, Aquae dest. ad 20 ml) jsme podávali dle následujícího schématu: 1. den 3 × 15 kapek, 2. den 3 × 16 kapek s navyšováním do operačního dne, kdy bylo podáváno 3 × 20 kapek. Tedy po 6 dnech lugolizace byla provedena semiurgentní totální tyreoidektomie na ORL oddělení. Po výkonu následovalo postupné snižování Lugolova roztoku o 3 × 3 kapky za den až do dávky 3 × 5 kapek s vysazením.
Tyreoidektomie a pooperační období proběhly bez komplikací (Obr. 1). Histologicky se jednalo o difuzní parenchymatózní strumu s obrazem fokální lymfocytární tyreoiditidy.
Image 1. Operační preparát štítné žlázy pacientky, z archivu autorky 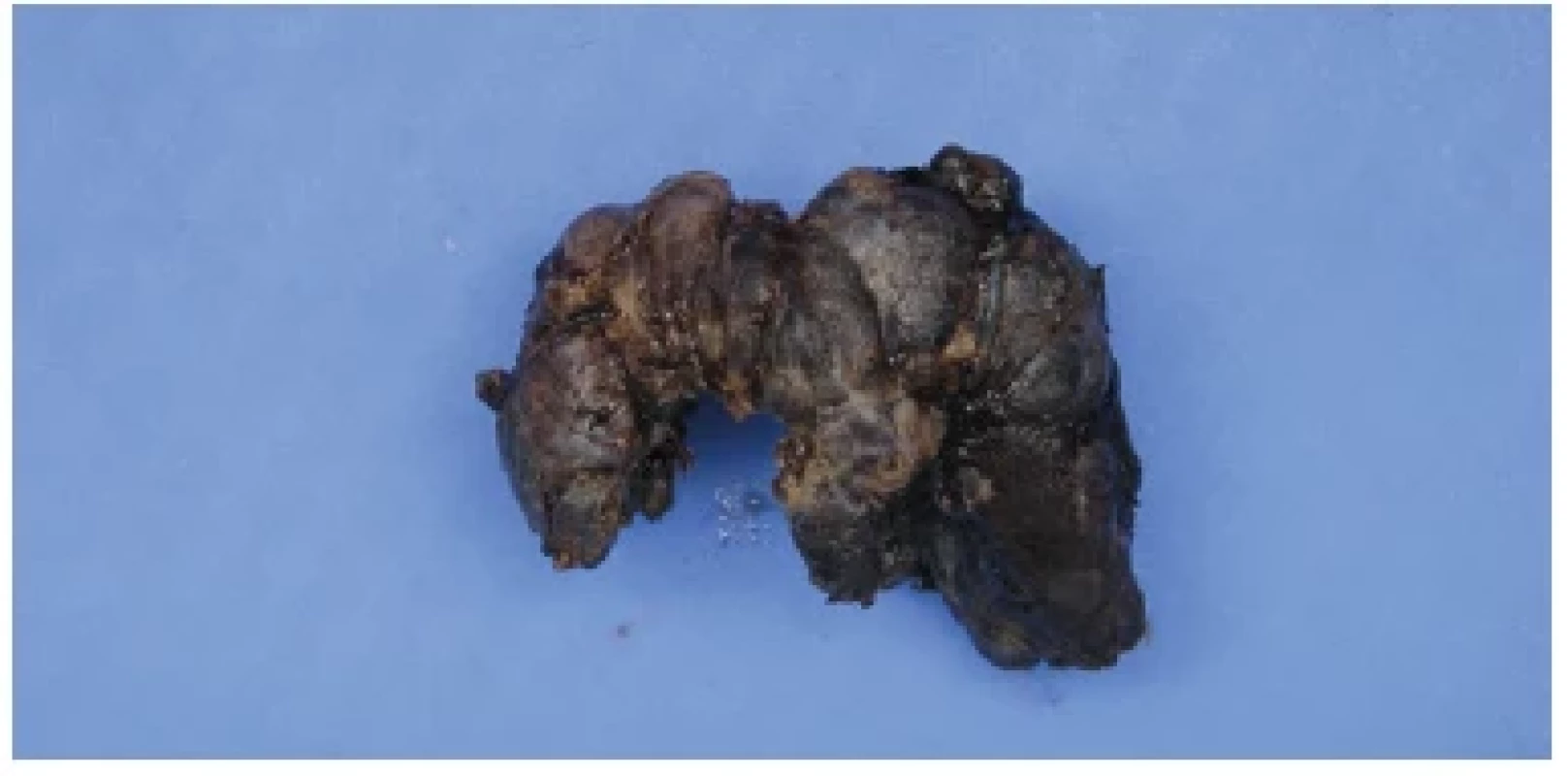
V současné době je pacientka nadále sledována v endokrinologické ambulanci a při dávce 150 mcg levotyroxinu bylo dosaženo účinné substituce. Pro opakovaně zjištěnou hypercholesterolemii, i po dosažení účinné substituce levotyroxinem byla zahájena léčba statiny – rosuvastatin 10 mg na den a pro denzitometricky potvrzenou osteopenii léčba cholekalciferolem 15 kapek týdně.
Kontrolní echokardiografické vyšetření prokázalo normalizaci nálezu včetně EF LK. V průběhu ambulantního sledování došlo ke spontánní verzi na sinusový rytmus, který nadále trvá (potvrzeno holterovskou monitorací). Proto bylo možné ukončit antikoagulační léčbu DOAC. Pacientka je nyní bez obtíží, s uspokojivou substitucí na zavedené terapii.
Použití neregistrovaného léčeného přípravku, parenterálního methimazolu, a jeho nežádoucí účinek byly nahlášeny dle zvyklostí na webových stránkách SÚKL.
Diskuze
Tyreotoxická krize je urgentní, život ohrožující komplikace hypertyreózy (3, 7). Je charakterizovaná dysfunkcí kardiovaskulárního, termoregulačního, gastrointestinálního a centrálního nervového systému. I přes moderní metody léčby je úmrtnost nadále 10–30 % (6, 7). Vzniká nejčastěji při neléčené hypertyreóze, přesný mechanismus vzhledem k malému souboru pacientů a dat není objasněn. Třikrát častěji jsou postiženy ženy (8). K jejímu rozvoji často přispívá koincidující akutní infekce, kardiovaskulární příhoda, náhlý přísun většího množství jodu, operace, trauma (3). Řádnou přípravou pacientů s hypertyreózou před operačními výkony se snížil výskyt tyreotoxických bouří způsobených operační zátěží (9). Klinicky se projevuje vystupňovanými příznaky hypertyreózy (hyperpyrexie, pocení, třes celého těla, hyperkinetická cirkulace, tachyarytmie, srdeční selhání, různý stupně poruchy vědomí, GIT obtíže – zvracení, průjem, bolesti břicha) (10). Laboratorně nacházíme supresi TSH a elevaci fT4, fT3, které ovšem nemusí být vyšší než u nekomplikované tyreotoxikózy (9). Diagnostická kritéria publikovali Burch a Wartofsky v roce 1993 (Tab. 1).
Table 1. Diagnostická kritéria tyreotoxické krize Upraveno dle Jiskra J. Akutní stavy v tyreologii. Kardiol Rev Int Med. 2015;17(2):172-177 (6) 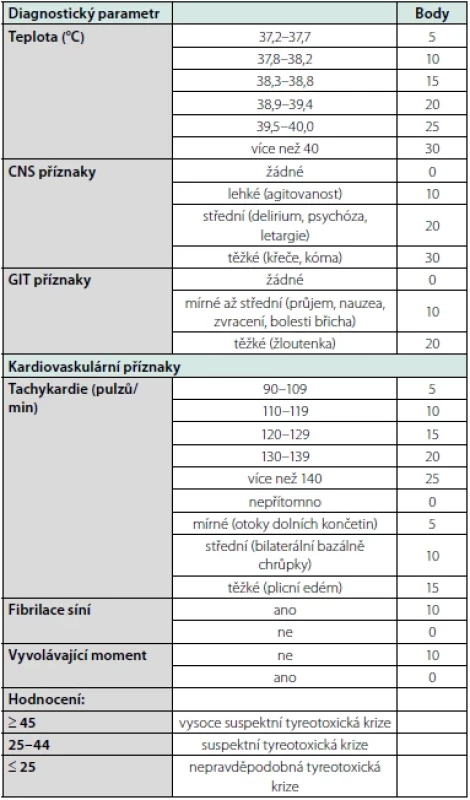
Léčba probíhá za monitorace vitálních funkcí na jednotce intenzivní péče (5). Intravenózní léčbu tyreostatiky (blokující syntézu hormonů) – methimazol 80–160 mg i. v. 2× denně kombinujeme s kortikoidy – methylprednisolon 50–100 mg i. v. 3–4× denně, betablokátory pro snížení adrenergního působení, dále hydratace, oxygenoterapie, substituce iontogramu, prevence tromboembolie, stresového vředu, antibiotická léčba při infekci, dále dle symptomatologie (1, 11). Při nedostatečném účinku samotného tyreostatika lze do léčby přidat jodové preparáty – např. Lugolův roztok, podávaný přibližně hodinu po aplikaci tyreostatika. Příznivý efekt trvá přibližně po dobu 2 týdnů, poté naopak hrozí riziko zhoršení tyreotoxikózy nebo dokonce vyvolání tyreotoxické krize (12). Z tohoto důvodu se po zvládnutí akutního stavu po 14 dnech přistupuje k provedení totální tyreoidektomie. Pokud veškerá uvedená léčba selhala, je nutno přistoupit k provedení plazmaferézy (12, 13).
V České republice nejčastěji používaný methimazol inhibuje tyreoperoxidázu ve folikulech štítné žlázy a snižuje tak organifikaci jodu do tyrozinu, čímž snižuje další syntézu hormonů štítné žlázy (2). Propylthiouracil také inhibuje peroxidázový systém, tlumí inkorporaci jodu do tyreoglobulinu, inhibuje spojování jodidovaných tyrosylových skupin do tyreoglobulinových molekul a snižuje konverzi tyroxinu na trijodtyronin (1). U závažných tyreotoxikóz je možné přechodně podávat oba léky současně (14). Musíme však být na pozoru před závažnými nežádoucími účinky, které převažují u propylthiouracilu. Proto se používá jako lék druhé volby při nesnášenlivosti methimazolu a rovněž v prvním trimestru gravidity.
Vzácnou, avšak velmi závažnou komplikací léčby je agranulocytóza, která je definována jako pokles absolutních neutrofilních granulocytů < 500 μl (13, 15) a postihuje 0,2–0,5 % pacientů. Lze ji navodit dvěma mechanismy, přímou toxicitou tyreostatik nebo vyvoláním imunitní reakce. Tyreostatika volně procházejí do kostní dřeně, kde jejich metabolity ovlivňují metabolismus kyslíku a glukózy v leukocytech (15). Tento přímý toxický efekt většinou závisí na dávce léčiva a je spojen s dlouhodobým používáním. Druhým mechanismem je poškození cirkulujícími protilátkami proti neutrofilům, indukovanými propylthiouracilem. Toto postihuje nejen zralé granulocyty, ale také jejich prekurzory. Holandská studie A. Sprikkelmana objasňuje čtyři mechanismy imunitního postižení granulocytů zkoumané v souboru 70 pacientů (16). Jako první možnost popisuje tvorbu protilátek proti tyreostatiku v době, kdy se naváže na buněčnou membránu granulocytu, což vyvolá destrukci granulocytu. Dále protilátky zneškodní molekulu léčiva, která je absorbována do granulocytu v přítomnosti plazmatické komponenty. Zatřetí, molekula léčiva spustí produkci auto‑protilátek a nebo vyvolá tvorbu protilátek interakcí antigenu na membráně granulocytu a molekuly léčiva (15).
Klinické příznaky (náhlá horečka, zimnice, bolesti v hrdle, soor nebo gingivitida v dutině ústní) se obvykle objevují v prvních 3 měsících léčby (17). Při absolutním počtu neutrofilů pod 1 000 v μl je doporučeno ihned ukončit podávání tyreostatik a zahájit intravenozní antibiotickou terapii (13), případně terapii filgrastimem po konzultaci s hematologem. Další podávání tyreostatik je kontraindikováno z důvodu zkřížené reaktivity methimazolu a propylthiouracilu ve vzniku agranulocytózy. Dále přistupujeme k chirurgickému řešení nebo terapii radiojodem.
Závěr
Cílem této práce je připomenout vzácné, ale velmi dramatické a závažné komplikace léčby tyreotoxikózy tyreotostatiky – agranulocytózu a polékovou hepatopatii. Z této kazuistiky plyne neopomínat pravidelné kontroly krevního obrazu a jaterních testů během léčby. Nezbytnou součástí komplexní péče je pečlivá edukace každého pacienta, aby zejména v případě náhlé horečky, zimnice, bolesti v hrdle nebo při objevení se ikteru přerušil léčbu a ihned kontaktoval ošetřujícího endokrinologa.
MUDr. Marie Jarolímová
Interní oddělení, Oblastní nemocnice Kolín, a. s.
marie.jarolimova@nemocnicekolin.czCit. zkr: Vnitř Lék. 2023;69(2):E19-E22
Článek přijat redakcí: 3. 10. 2022
Článek přijat po recenzích: 20. 1. 2023
Sources
1. Marek J, Hána V, et al. Endokrinologie. Galén: Praha: 2019 : 272-274. ISBN 978-80-7262-484-3.
2. Čepková J, Gabalec F, Svilias I, et at. Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let. Vnitr Lek. 2014;60(10):832-836.
3. Pokhrel B, Aiman W, Bhusal K. Thyroid Storm. In: StatPearls. Treasure Island: StatPearls Publishing; 2022. Dostupné z WWW: <https://www.ncbi.nlm.nih.gov/books/NBK448095/>.
4. Pelikánová T, Zamrazil V, et al. Akutní stavy v endokrinologii. Galén: Praha: 2007 : 44-55. ISBN 978-80-7262-478-2.
5. Chiha M, Samarasinghe S, Kabaker AS. Thyroid Storm: An Updated Review. J Intensive Care Med. 2015;30(3):131-140. Dostupné z DOI: < https://doi.org/10.1177/0885066613498053>.
6. Jiskra J. Akutní stavy v tyreologii. Kardiol Rev Int Med. 2015;17(2):172-177.
7. Lim SL, Wang K, Lui PL, et al. Crash Landing of Thyroid Storm: A Case Report and Review of the Role of Extra‑Corporeal Systems. Front Endocrinol (Lausanne). 2021; Dostupné z DOI: https:// doi.org/10.3389/fendo.2021.725559>.
8. Angell TE, Lechner MG, Nguyen CT, et al. Clinical Features and Hospital Outcomes in Thyroid Storm: A Retrospective Cohort Study. J Clin Endocrinol Metab. 2015;100(2):451-459. Dostupné z DOI: <https://doi.org/10.1210/jc.2014-2850>.
9. Maurer E, Vorländer C, Zielke A, et al. Short‑Term Outcomes of Surgery for Graves Disease in Germany. J Clin Med. 2020;9(12):4014. Available from: https://doi.org/10.3390/ jcm9124014.
10. Ross DS, Burch HB, Cooper David S, et al. American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. J Thyroid. 2016; 26(10):1343-1421 Available from: z DOI:<http://doi.org/10.1089/thy.2016.0229>.
11. Carroll R, Matfin G. Endocrine and metabolic emergencies: thyroid storm. Ther Adv Endocrinol Metab. 2010;1(3):139-45. Available from: DOI: < doi.org/10.1177/2042018810382481/>
12. Nayak B, Burman K. Thyrotoxicosis and thyroid storm. Endocrinol Metab Clin North Am. 2006;35(4):663-86, Available from: DOI: <doi.org/10.1016/j.ecl.2006. 09. 008>.
13. Abraham P, Acharya S. Current and emerging treatment options for Graves hyperthyroidism. Ther Clin Risk Manag. 2010;2(6):29-40. Available from: DOI: <https://doi.org/10.2147/ TCRM.S5229>.
14. Límanová Z. Výskyt agranulocytózy po tyreostaticích v kohortě pacientů s Gravesovou nemocí léčených radioaktivním jodem 131I v průběhu 14 let – editorial. Vnitr Lek. 2014;60(10):815-816.
15. Bai XS, Liu JH, Xiao SM. A patient with agranulocytosis following the discontinuation of methimazole treatment for 4 months: A case report. Exp Ther Med. 2014;8(3):823-825. Available from: DOI: <https://doi.org/10.3892/etm.2014.1817>.
16. Sprikkelman A, de Wolf JT, Vellenga E. The application of hematopoetic growth factors in drug‑induced agranulocytosis: a review of 70 cases. J Leukemia. 1994;8(12):2031-2036.
17. Nakamura H, Miyauchi A, Miyawaki N, et al. Analysis of 754 Cases of Antithyroid Drug‑Induced Agranulocytosis Over 30 Years in Japan. J Clin Endocrinol Metab. 2013; 98(12): 4776 - 4783. Available from: DOI: <https://doi.org/10.1210/jc.2013-2569>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2023 Issue E-2-
All articles in this issue
- Comparison of polypharmacy and pharmacotherapy among seniors in social institutions in 2001 and 2019
- Anemia of inflammatory: does eiderr knowledge mean better diagnosis and treatment?
- Severe autoimune thyreotoxicosis complicated by febrile neutropenia as a result of thyreostatic therapy
- Role of eplerenone in the threatment of cardiovascular diseases
- Diabetes mellitus urological complication
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Severe autoimune thyreotoxicosis complicated by febrile neutropenia as a result of thyreostatic therapy
- Anemia of inflammatory: does eiderr knowledge mean better diagnosis and treatment?
- Comparison of polypharmacy and pharmacotherapy among seniors in social institutions in 2001 and 2019
- Diabetes mellitus urological complication
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

