-
Medical journals
- Career
Anémia zápalu: znamenajú širšie poznatky lepšiu diagnostiku a liečbu?
Authors: Jaromír Tupý
Authors‘ workplace: FN ; Fakulta zdravotníctva, katolícka univerzita v Ružomberku ; Klinika hematológie a transfuziológie, ÚVN SNP Ružomberok –
Published in: Vnitř Lék 2023; 69(E-2): 10-18
Category: Review Articles
doi: https://doi.org/10.36290/vnl.2023.023Overview
Pri ochoreniach s prejavmi aktivácie zápalu je častým sprievodným stavom anémia, ktorá negatívne ovplyvňuje kvalitu života a výkonnosť pacientov. Táto anémia – anémia zápalu, je spôsobená poruchami metabolizmu železa, ktoré vedú k retencii železa v makrofágoch, cytokínmi sprostredkovanej inhibícii funkcie erytropoetínu a diferenciácii erytroidných progenitorových buniek a zníženým polčasom rozpadu erytrocytov. Anémia je väčšinou mierna až stredne závažná, normocytová a normochrómna. Vyznačuje sa nízkou cirkuláciou železa, ale normálnymi až zvýšenými hladinami zásobného feritínu a hormónu hepcidínu. Primárnym terapeutickým prístupom je liečba základného zápalového ochorenia. V prípade neúspechu možno zvážiť suplementáciu železa a/alebo liečbu liekmi stimulujúcimi erytropoetín. Krvné transfúzie predstavujú len núdzové riešenie život ohrozujúcej anémie. Perspektívne sa objavujú nové modality liečby so stratégiami modifikujúcimi hepcidín a stabilizátormi faktorov indukovateľných hypoxiou. Ich terapeutickú účinnosť je však potrebné overiť a vyhodnotiť v klinických štúdiách.
Klíčová slova:
diagnostika – liečba – hepcidin – anémia zápalu – homeostáza železa
Úvod
Anémia zápalu (AI – anemia of inflammatory), známejšia ako anémia chronických chorôb, je celosvetovo považovaná za druhú najrozšírenejšiu anémiu (po anémii z nedostatku železa) a za najčastejšiu anemickú jednotku pozorovanú u hospitalizovaných alebo chronicky chorých pacientov (1, 2). Charakterizovaná je aktivovaným imunitným systémom, ktorý spôsobuje poruchy metabolizmu železa, dysfunkciu erytropoetínu, suspresiu erytropoézy a zníženie prežívania erytrocytov. U pacientov s AI sa typicky vyskytuje mierna až stredne závažná normocytová, normochrómna anémia, sprevádzaná zníženým sérovým železom a normálnymi až zvýšenými zásobami železa (1).
Pôvodne bola AI spojená s chronickými infekciami a autoimunitnými ochoreniami, pri ktorých bol zápal ľahko diagnostikovateľný a pretrvávajúci. Postupne sa k súvislosti s anémiou zápalu pridávajú ďalšie skupiny ochorení, ako sú niektoré typy rakoviny a hematoonkologických malignít, chronické ochorenie obličiek a kongestívne zlyhanie srdca (3, 4). Medzi ďalšie menej preštudované príklady patrí obezita, chronické pľúcne a pečeňové ochorenia, cystická fibróza alebo pokročilá ateroskleróza so svojimi následkami (5, 6).
Železo a jeho metabolizmus
Železo (Fe) je druhým najrozšírenejším kovom na Zemi a jedným zo základných prvkov vo všetkých živých organizmoch. Za jeho biologické funkcie, ktoré ale zároveň určujú aj toxicitu, sú zodpovedné jedinečné vlastnosti železa – slúžiť ako akceptor aj donor elektrónov. Prvok je nevyhnutný na syntézu hemoproteínov (hemoglobín, myoglobín, kataláza, cytochrómy) a iných nehémových proteínov a enzýmov zapojených do životne dôležitých biologických procesov, ako sú väzba a transport kyslíka, mitochondriálne dýchanie, bunková proliferácia a diferenciácia, syntéza DNA nukleových kyselín a hormónov, metabolické reakcie a obrana hostiteľa. Na druhej strane, železo môže prostredníctvom Fentonovej reakcie viesť k tvorbe toxických voľných kyslíkových radikálov (hydroxylový radikál), ktoré prostredníctvom poškodenia DNA, proteínov a lipidových membrán vedú k oxidačnému stresu. Tieto skutočnosti vyúsťujú do potreby prísnej bunkovej aj systémovej regulácie, aby sa zabránilo nedostatku alebo preťaženiu (6, 7, 8).
Metabolizmus železa je príkladom recyklácie (Obr. 1). Len asi 10 % (1 – 2 mg) železa sa denne absorbuje v čreve, čím sa kompenzuje rovnaká strata; väčšina železa (20 – 25 mg/denne) je recyklovaná makrofágmi pri fagocytóze starnúcich erytrocytov. Zásoba železa v plazme (cca 3 mg), ktorá cirkuluje viazaná na transferín (Tf), sa uvoľňuje prostredníctvom jeho receptora. Železo je hlavne distribuované do erytroblastov kostnej drene na produkciu erytrocytov, menšie množstvá napĺňajú požiadavky všetkých ostatných orgánov a tkanív. Prebytočné železo sa ukladá v pečeni a makrofágoch ako rezerva (7, 8).
Image 1. Cyklus železa. Šípky označujú smer distribúcie a čísla sú priemerným odhadom obsahu železa. (A) Enterocyt – absorbcia železa; (B) Hepatocyt – skladovanie prebytočného železa a tvorba hepcidínu; (C) Makrofág – recyklácia železa. Modifikované podľa: Camaschella C, et al. 2020; Tupý J, a kol., 2019; González-Domínguez Á, et al. 2020; Babitt JL et al. 2021 [7, 8, 10, 13]. ![Cyklus železa. Šípky označujú smer distribúcie a čísla sú priemerným odhadom obsahu železa. (A) Enterocyt – absorbcia železa; (B) Hepatocyt –
skladovanie prebytočného železa a tvorba hepcidínu; (C) Makrofág – recyklácia železa. Modifikované podľa: Camaschella C, et al. 2020; Tupý J, a kol., 2019;
González-Domínguez Á, et al. 2020; Babitt JL et al. 2021 [7, 8, 10, 13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/0d051ad56a2026462fe5a9df6e7c9fbb.png)
DMT1: transportér dvojmocných kovov 1; ZIP: Zrt–Irt-like proteín; DcytB: duodenálny cytochróm B (cytochróm B reduktáza 1); HCP1: hemový nosičový proteín 1; PCBP: poly (rC) väzbový proteín; LIP: labilný železný pool; HO-1: hemoxygenáza 1; FPN1: ferroportín 1; HEPH: hefaestín; CP: ceruloplazmín; Tf: transferín; TfR: transferínový receptor; NCOA4: jadrový koaktivátor 4; STEAP: šesť-transmembránový epiteliálny antigén prostaty; Hb: hemoglobín; HP: haptoglobín; HPX: hempexín; CD: diferenciačná skupina; LRP: receptor lipoproteínu nízkou hustotou; HRG: gén reagujúci na hem; BMP: kostný morfogénny proteín; ERFE: erytroferón, HAMP: hepcidínový antimikrobiálny peptid Nehémové železo, ktoré sa nachádza v potravinách, predstavuje vysoko nerozpustnú a ťažko absorbovateľnú železitú formu (Fe3+). Aby sa dosiahlo vstrebávanie, železité železo sa redukuje na železnaté (Fe2+). Enterocyt redukuje trojmocné železo na svojej apikálnej membráne pomocou dvoch ferireduktáz, a to prostredníctvom duodenálneho cytochrómu B (Dcytb – duodenal cytochrome b) a šesť‑transmembránového epiteliálneho antigénu prostaty 2 (STEAP – six‑transmembrane epithelial antigen of the prostate). Po redukcii môže byť dvojmocné železo transportované do enterocytov cez transportér dvojmocného kovu 1 (DMT1 – divalent metal transporter 1) alebo transportér zinku Zrt‑Irt like proteín 14 a 8 (ZIP – Zrt‑Irt‑like protein). Napokon, enterocyty sú tiež schopné absorbovať feritín z potravy mechanizmom endocytózy (7, 9, 10). Železo viazané v héme vstupuje do bunky cez transportér, hémový nosičový proteín 1 (HCP1 – heme carrier protein 1) a následne je na železnatú formu degradované hemoxygenázou (HO-1). V enterocyte sa Fe2+ stáva súčasťou labilného poolu železa (LIP – labile iron pool). Zvyšok sa transportuje do bunkových zásob vo forme feritínu. Molekula zodpovedná za zabudovanie železa do feritínu je multifunkčný poly (rC) viažuci proteín 1 (PCBP – poly(rC) binding protein), ktorý slúži ako cytosolický železný chaperón (9, 10).
Železo sa podľa potrieb exportuje do obehu cirkulujúceho transferínu feroportínom 1 (FPN1), a to po oxidácii železnatého na železité železo multimeďnatou feroxidázou, hefaestínom (HEPH), za prítomnosti ceruloplazmínu (CP) na bazolaterálnej membráne enterocytu. FPN1 je jediným známym bunkovým exportérom železa a okrem exportu Fe z duodenálnych enterocytov je zodpovedný aj za mobilizáciu železa z hepatocytov a makrofágov recyklujúcich erytrocyty. Expresiu apikálnych DMT1 a bazolaterálnych FPN transportérov stimuluje faktor indukovaný hypoxiou 2α (HIF – hypoxia‑inducible factor) (Obr. 1A) (3, 7). Transferín, proteín viažuci železo produkovaný v pečeni, môže reverzibilne viazať dva železité ióny, čím mení svoju konformáciu na holotransferín. Zvyčajne je približne 30–40 % molekúl transferínu nasýtených železom, čo znamená, že väčšina transferínu v plazme má konformáciu nazývanú apotransferín a v prípade potreby môže tlmiť prebytok železa. Cirkulujúci holotransferín je absorbovaný prostredníctvom väzby na transferínový receptor 1 (TfR1). Následne prebehne endocytóza komplexu a vytvoria sa endozómy potiahnuté klatrínom. Po odstránení klatrínu protónové pumpy okyslia endozómovú matricu, indukujú konformačné zmeny v Tf a TfR1 a disociujú železité železo z komplexu. Tf zostáva naviazaný na svoj receptor, kým sa opäť neprenesie na bunkovú membránu (10). Železo sa potom môže redukovať na Fe2+ ďalšou feroreduktázou, šesťtransmembránovým epiteliálnym antigénom prostaty 3 (STEAP3). Napokon železnaté železo môže opustiť endozóm cez DMT1, aby ho bunka použila/uložila (7). Lysozomálna degradácia feritínu „feritinofágia“ je riadená autofagozomálnym receptorom, jadrovým koaktivátorom 4 (NCOA – nuclear receptor coactivator), ktorý sa akumuluje v bunkách v podmienkach obmedzenia železa, pôsobí ako receptor viažuci feritín a dodáva ho do lyzozómov (11) – obrázok 1 B.
Pri recyklácii železa makrofágmi sú erytrocyty začlenené do fagolyzozómu, kde sú degradované až do uvoľnenia hému. Ten je následne deštruovaný hemoxygenázou (HO-1) na biliverdín, oxid uhoľnatý a železnaté železo. Transport železa v makrofágu prebieha v troch fázach. Najprv sa hém transportuje do cytozolu cez fagozómovú membránu pomocou génu reagujúceho na hém (HRG1 – heme‑responsive gene). Po jeho degradácii je železnaté železo transportované cez cytoplazmu pomocou PCBP1 a nakoniec je dodávané do FPN1, aby bolo exportované a redukované CP v obehu, čo umožňuje jeho transport organizmom cez Tf (12).
Makrofágy tiež obnovujú hém z komplexov hemoglobín‑haptoglobín (Hb‑HP) alebo heme‑hemopexín (HPX). Pri hemolýze sa hemoglobín uvoľňuje do obehu. V plazme je viazaný haptoglobínom a komplex Hb‑HP je rozpoznávaný receptorom CD163. Ak je rýchlosť hemolýzy vysoká a haptoglobín je nasýtený, hemoglobín sa degraduje na hém a voľné hémové skupiny sa viažu na HPX. Komplex je rozpoznaný prostredníctvom proteínu LRP/CD91 (LRP – lipoprotein receptor‑related protein) súvisiaceho s lipoproteínovým receptorom s nízkou hustotou. Železo, ktoré sa intracelulárne nevyužíva, môže byť skladované vo forme feritínu – obrázok 1C (7, 10, 12).
Hlavný mechanizmus homeostázy železa sa sústreďuje na interakciu medzi regulačným hormónom železa hepcidínom, produkovaným hepatocytmi (produkt expresie génu HAMP – hepcidin antimicrobial peptide) a feroportínom, cez ktorý sa železo prenáša do krvnej plazmy (13) (Obr. 1). Hepcidín sa viaže na feroportín makrofágov a hepatocytov, eventuálne DMT1 enterocytov a vedie k internalizácii a degradácii feroportínu a transkripčnej inhibícii DMT1. V dôsledku toho sa znižuje transport železa z dvanástnika do krvného obehu, blokuje sa uvoľňovanie železa z makrofágov, ktoré recyklujú železo starnúcich erytrocytov a z hepatocytov uchovávajúcich železo. Následne je narušená recirkulácia železa a klesá hladina železa v sére. Produkcia hepcidínu sa zvyšuje ako odpoveď na preťaženie železom, zápal alebo infekciu, zatiaľ čo jeho syntéza je znížená v dôsledku nedostatku železa, zvýšenej erytropoézy a anémie/hypoxie. Z faktorov stimulujúcich erytropoézu znižujú expresiu hepcidínu erytropoetín a rastový diferenciačný faktor 15 (7, 9, 14). Expresia hepcidínu je regulovaná mnohými proteínmi – okrem iného kostným morfogénnym proteínom-6 (BMP – bone morphogenetic protein), hemojuvelínom (HJV), proteínom hemochromatózy (HFE), transferínovými receptormi TfR1 a TfR2. Ovplyvňujú ho tak zásoby železa v pečeni, ako aj obehové železo vo forme transferínu viazaného na železo (holotransferínu). Zvýšené hladiny železa stimulujú produkciu BMP-6, ktorý po väzbe na receptor vytvára komplex s HJV (koreceptor). Tento proces indukuje dráhu fosforylácie SMAD1/5/8 (SMAD – small mothers against decapentaplegic), čo vedie k zvýšenej expresii génov hepcidínu. Podobne sa na expresii HAMP podieľa aj BMP-2. BMP2/6 regulácia génu HAMP predstavuje spätnú väzbu na zabránenie preťaženiu železom s následným poškodením tkaniva (9, 14, 15).
Nedávno bol hormón erytroferrón (ERFE) spojený s erytropoézou a rovnováhou železa. ERFE produkujú erytroblasty prostredníctvom signálnej dráhy JAK/STAT5 (JAK – Janus kinase / STAT – signal transducer and activator of transcription) ako odpoveď na zvýšenú erytropoézu (erytropoetín). Ukázalo sa, že EFRE potláča transkripciu hepcidínu v hepatocytoch (viaže sa na heterodiméry BMP6 a BMP2/6 a sekvestruje ich, čím zabraňuje signalizácii BMP/SMAD na hepcidín), čím zvyšuje dostupnosť železa pri stavoch spojených s vyššou potrebou železa (16). Na bukovej úrovni je regulácia metabolizmu železa a erytropoézy primárne regulovaná hypoxiou indukovateľnými faktormi a regulačnými proteínmi železa (IRP – iron regulatory proteins) so signálnou dráhou elementu citlivého na železo (IRE – iron‑responsive element).
Za normoxických podmienok sú HIF-1α, HIF-2α hydroxylované a degradované prostredníctvom rodiny prolylhydroxyláz (PHD). V prípade hypoxie však k hydroxylácii nedochádza a nedostatok kyslíka prostredníctvom HIF vedie k aktivácii expresie matriptázy-2, ktorá štiepi HJV z komplexu HFE/TfR2/HJV, čím sa zoslabuje signalizácia BMP‑SMAD a transkripcia hepcidínu (10, 17).
Patofyziológia anémie zápalu
Anémia zápalu je spôsobená 3 hlavnými patofyziologickými dráhami, ktoré pôsobia prostredníctvom mediátorov aktivovaného imunitného systému, a to reštrikciou železa, supresiou erytropoetickej aktivity a skrátením prežívania erytrocytov. Predpokladá sa, že účasť každej z týchto ciest závisí od základných príčin a charakteru zápalu, ako aj od genetickej výbavy a premorbidného stavu pacienta, vrátane už existujúcich zásob železa, erytropoetickej kapacity drene, citlivosti produkcie renálneho erytropoetínu na anémiu a hypoxiu a odolnosti erytrocytov voči poškodeniu (3).
Reštrikcia železa
Systémová imunitná aktivácia vedie k zásadným zmenám v regulácii železa, čo vedie k reštrikcii železa v makrofágoch a k zníženej absorpcii železa z potravy. Výsledkom je hypoferémia, ako následok evolučnej stratégie reakcie na infekciu.
Imunitná aktivácia v reakcii na mikrobiálne molekuly, autoantigény alebo nádorové antigény stimuluje uvoľňovanie viacerých prozápalových cytokínov, ktoré menia systémový metabolizmus železa. Ako najdôležitejší sa javí interleukín-6 (IL-6), ktorý stimuluje expresiu HAMP v hepatocytoch, predovšetkým prostredníctvom JAK/ STAT3 signálnej dráhy. Podmienkou aktivácie hepcidínu je funkčná signalizáciu BMP‑SMAD. Hepcidín moduluje svoje regulačné účinky väzbou na feroportín, čím spôsobuje jeho bunkovú internalizáciu a degradáciu (18). Cez feroportín zvýšené koncentrácie hepcidínu inhibujú absorpciu železa v dvanástniku a blokujú uvoľňovanie železa recyklovaného v makrofágoch zo starnúcich erytrocytov do plazmy, čo spôsobuje zníženú dodávku železa pre erytropoézu (3). Stimuláciu produkcie hepcidínu spôsobujú aj iné cytokiníny (napr. IL-1, IL-22, aktivín B a ďalšie), ale ich špecifická patologická úloha je menej známa (19).
Okrem účinku IL-6 na hepcidín môžu priamo ovplyvňovať duodenálnu alebo makrofágovú homeostázu železa aj iné cytokíny, a to aj od hepcidínu nezávislého mechanizmu. Interferón gama (INF‑γ), lypopolysacharid (LPS) a tumor nekrotizujúci faktor alfa (TNF‑α) zvyšujú expresiu DMT1 a znižujú FPN1 s následným zvýšeným vychytávaním železa a zníženým uvoľňovaním železa z pozápalových makrofágov retikuloendotelového systému. Prostredníctvom FPN1 je taktiež obmedzená aj črevná absorpcia železa (20). Cytokíny IL-1, IL-6, IL-10 alebo TNF‑α podporujú prechod železa do makrofágov cez transferínový receptor (sprostredkovaná endocytóza), DMT1, prípadne aj prostredníctvom zvýšeného získavania železa laktoferínom a lipokalínom-2 (21). Súčasne IL-1β, IL-6, ale aj protizápalové cytokíny ako IL-4 a IL-13 a IL-10 rôznymi mechanizmami zvyšujú vychytávanie železa viazaného na transferín a zvyšujú reguláciu syntézy zásobného feritínu (1, 9).
Okrem toho, lipopolysacharidy prostredníctvom Toll‑like receptora 4 a produkcie interleukínu-6 indukujú cez dráhu BMP‑SMAD expresiu hepcidínu makrofágmi, ktorá sa potom zacieľuje na FPN1 autokrinným spôsobom (22).
Všetky tieto skutočnosti vedú k erytropoéze s obmedzením železa a charakteristickým zmenám pri AI: hypoferémii a hyperferitinémii. Tieto účinky sú čiastočne kompenzované stimuláciou syntézy feroportínu v makrofágoch zadržaným železom a hémom, čo možno vysvetľuje, prečo AI len zriedka dosahuje závažnosť pozorovanú pri čistej anémii z nedostatku železa (3, 6).
Zápalová supresia erytropoetickej aktivity
Okrem zníženej dostupnosti železa pre erytropoézu zápal tiež priamo zhoršuje erytropoézu tým, že znižuje produkciu a aktivitu EPO a potláča proliferáciu a diferenciáciu erytroidných progenitorových buniek.
Hladiny EPO sú napriek hypoxii a nízkym hladinám železa v sére u pacientov s AI pomerne nízke. Príčinou je priama inhibícia renálnej expresie EPO prostredníctvom IFN‑γ, IL-1β a TNF ‑ α alebo narušená signalizácia sprostredkovaná EPO (1). To potláča stimuláciu EPO sprostredkovanú hypoxiou a vyvoláva oxidačný stres, čím poškodzuje bunky epitelu obličiek produkujúce EPO (23). Znížený signál môže byť tiež spojený s nedostatkom erytroidného železa, ktoré ovplyvňuje citlivosť transferínového receptora 2 v erytroidných bunkách, čo vedie k dysregulácii Scribble (receptorového kontrolného prvku) a zníženej expresii EpoR (24). Fyziologicky EPO a hypoxia pôsobiace na podporu zvýšeného prísunu železa počas zosilnenej erytropoézy inhibujú expresiu HAMP indukciou hypoxiou indukovateľného faktora 1, erytroferónu, matriptázy-2 alebo rastového diferenciačného faktora-15. Avšak znížená dostupnosť a aktivita EPO pri AI negatívne ovplyvňuje indukciu týchto blokátorov, čím sa zhoršuje hepcidínom sprostredkovaná limitácia erytroidného železa (6, 25) a prostredníctvom začarovaného kruhu sa zhoršuje signalizácia Epo cez Scribble (Obrázok 2). Okrem toho sa rôzne zápalové mediátory (hlavne INF‑γ) priamo zameriavajú na erytroidné bunky a indukujú apoptózu prostredníctvom ceramidových alebo radikálových dráh (1).
Image 2. Patofyziologické mechanizmy anémie zápalu. Modifikované podľa Weiss G, et al., 2019; Tupý J, a kol., 2019 (3, 8). 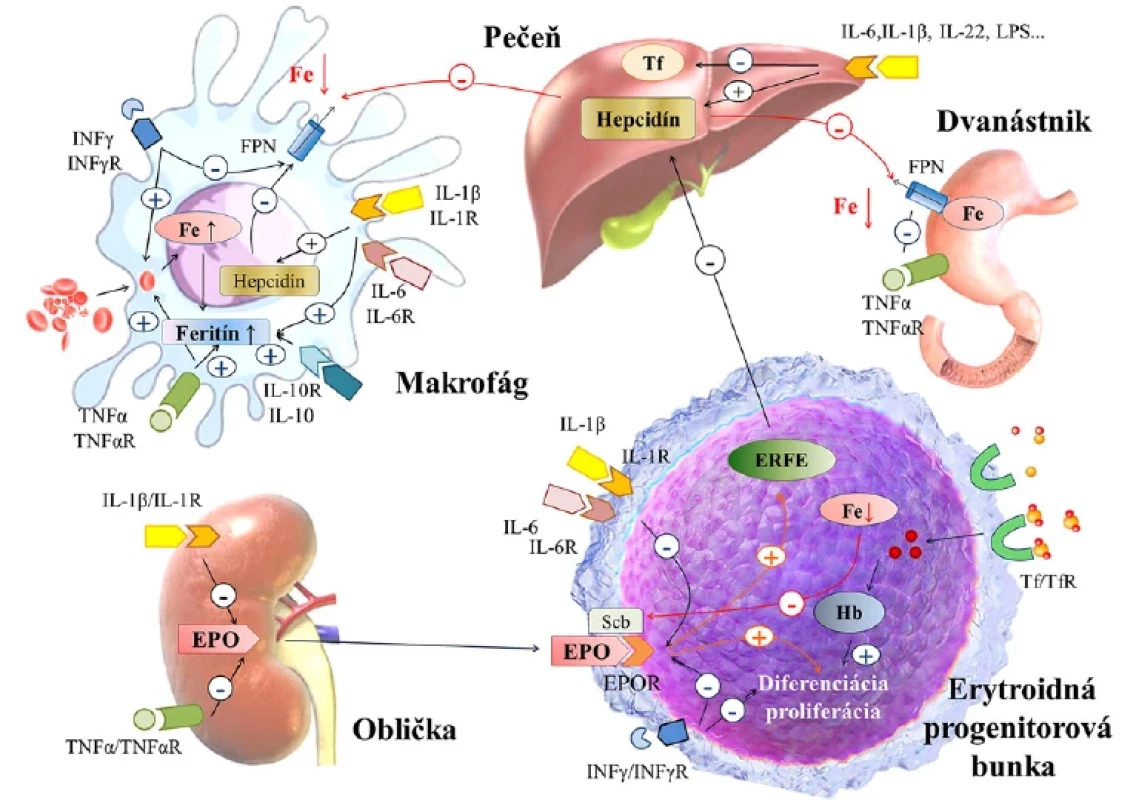
EPO: erytropoetín; EPOR: erytropoetínový receptor; ERFE: erytroferón; Fe: železo; FPN: feroportín; Hb: hemoglobín; IL: interleukín; INF: interferón; LPS: lipoplysacharidy; Scb: Scribble; Tf: transferín; TfR: tranferínový receptor; TNF: tumor nekrotizujúci faktor. Skrátenie prežívania erytrocytov
U pacientov so zápalovou anémiou sa trvalo dokazuje mierny pokles prežívania erytrocytov na približne 90 dní (3, 6). Skrátené prežívanie sa pozoruje aj u pacientov bez anémie, takže pokles hemoglobínu sa rozvinie len vtedy, ak je narušená erytropoetická kompenzácia. Heterogenita základných ochorení pri zápalovej anémii spôsobuje, že k zvýšenej deštrukcii erytrocytov prispieva viacero faktorov, vrátane aktivácie makrofágov (zmena prahu rozpoznávania starnutia erytrocytov) a vystavenia erytrocytov zápalovému poškodeniu. IFN‑γ a TNF‑α podporujú degradáciu a fagocytózu erytrocytov, čím znižujú prežívanie erytrocytov (26). Okrem toho sa ukázalo, že zápal indukuje remodeláciu lipidov erytrocytovej membrány a oxidačné poškodenie erytrocytov, čo taktiež vedie k zhoršenej funkcii erytrocytov a skrátenému prežívaniu (27).
Diagnostika
Symptómy a príznaky anémie z deficitu železa a anémie zápalu sú podobné a zahŕňajú únavu, slabosť, zníženú kardiovaskulárnu výkonnosť a toleranciu záťaže, ponámahovú dýchavičnosť a zhoršenú kapacitu učenia a pamäte (28, 29). Sú prejavmi kombinácie hypoxie so zníženým tkanivovým napätím kyslíka a nedostatku železa, ktorý zhoršuje mitochondriálnu funkciu, bunkový metabolizmus, aktivity enzýmov a syntézu neurotransmiterov (6, 28).
Anémia, definovaná koncentráciou Hb < 120 g/l u žien a < 130 g/l u mužov, môže byť diagnostikovaná na základe zmien v homeostáze železa spolu s klinickými alebo biochemickými dôkazmi zápalu, často je však potrebné vylúčiť koexistujúce príčiny, ktoré môžu vyžadovať špecifické intervencie. Charakteristicky sa AI prejavuje ako mierna až stredne ťažká normocytová a normochrómna anémia (normálny stredný objem erytrocytu – MCV – mean corpuscular volume a stredné množstvo hemoglobínu v červenej krvinke – MCH – mean corpuscular hemoglobin, čo ju zreteľne oddeľuje od mikrocytovej, hypochrómnej IDA (29).
Napriek pozoruhodnému pokroku v našom chápaní metabolizmu železa a etiopatogenézy anémie zápalu sa diagnostický prístup v poruchách železa stále opiera hlavne o tri historické testy: sérové železo, transferín (alebo celková väzbová kapacita železa – CVK, vypočítaná ako Tf × 1389) a feritín. Z nich vychádzajú ďalšie markery ako saturácia transferínu (satTf), t.j. pomer sérového železa a celkovej väzbovej kapacity pre železo, sérový solubilný transferínový receptor (sTfR), a pomer sTfR/log feritínu (28). V klinických podmienkach však mnohé z nich sú ovplyvnené samotným primárnym ochorením a sprievodným zápalom. Vzhľadom na tieto mätúce účinky na interpretáciu väčšiny biomarkerov je hodnotenie stavu železa pri anémii zápalu stále výzvou (8).
Vo všeobecnosti majú AI a IDA spoločné znížené koncentrácie plazmatického železa a znížené percento železa viazaného na transferín (saturácia transferínu), ako aj znížený počet retikulocytov. Základným diferenciačným parametrom sa zdá byť sérový feritín. Zatiaľ čo hladina feritínu < 30 μg/ml je spojená s absolútnym alebo skutočným nedostatkom železa, pacienti s AI majú v závislosti od základného ochorenia normálne alebo zvýšené hladiny feritínu (> 100 μg/l) (1).
Vysoké koncentrácie feritínu v sére pri AI sú výsledkom zvýšenej sekrécie feritínu makrofágmi zadržiavajúcimi železo, ale tiež odrážajú feritín ako proteín akútnej fázy – jeho zvýšené hladiny sú výsledkom systémového zápalu a pozitívne korelujú so závažnosťou zápalu (14). Preto je feritín u pacientov s AI často zvýšený bez ohľadu na ich zásoby železa, čo do značnej miery limituje jeho diagnostickú hodnotu ako indikátora zásob železa v tele – normálne alebo zvýšené hladiny feritínu nemôžu vylúčiť nedostatok železa pri AI (30).
Obdobne ako feritín je cez negatívnu expesiu transferínu cytokínmi ovplyvnená aj hodnota CVK, ktorá sa progresívne znižuje s mierou základného ochorenia a vedie k vyšším hladinám satTf nezávisle od stavu železa, čo znižuje dôveryhodnosť transferínu a s ním súvisiacich parametrov ako meradlo stavu železa a prah pre začatie liečby železom u pacientov s AI (3, 6).
No hlavnou výzvou a diagnostickým problémom pri stanovení diagnózy AI je však identifikácia pacientov, predstavujú 20 – 85 % pacientov s AI, s koexistenciou skutočného nedostatku železa a zápalovej anémie (strata krvi zo základného ochorenia, iatrogénne odbery, hemodialýza) alebo deficitu železa spôsobeného podvýživou, dlhotrvajúcim zápalom alebo zvýšenou potrebou železa (rastúce deti alebo tehotné ženy), pretože títo pacienti potrebujú špecifické hodnotenie zdroja straty krvi a stratégie manažmentu zamerané na železo (1, 3, 6, 8).
Jednou z možností alternatívnych diagnostických nástrojov je solubilný transferínový receptor, ktorý je produkovaný proteolýzou membránového transferínového receptora. Jeho uvoľňovanie do obehu sa zvyšuje pri nedostatku železa, preto bol sTfR hodnotený ako potenciálny biomarker nedostatku železa a dobrý diagnostický biomarker na rozlíšenie medzi AI so sprievodnou IDA alebo bez nej. Problémom je ale ovplyvnenie sTfR zápalom nezávisle od stavu železa (9). Sérová koncentrácia sTfR je zvýšená u AI pacientov s nedostatkom železa a nepriamo koreluje so železom dostupným pre erytropoézu, nie je však schopná odhaliť okultný nedostatok železa. Interpretácia je, žiaľ, „zmätená“ použitím látok stimulujúcich erytropoézu a zdá sa, že predstavuje skôr erytropoetickú aktivitu ako nedostatok železa (6). Index sTfR/logferitínu (feritínový index) sa zdá byť vhodný na detekciu vyčerpaných zásob železa aj u pacientov s príznakmi zápalu a tiež má u AI pacientov lepšiu predikčnú hodnotu ako satTf a feritín na suplementáciu železa (31). V súčasnosti feritínový index > 2 definuje pacientov s AI a IDA, zatiaľ čo hodnota < 1 definuje pacientov s AI, ktorí zanechávajú klinicky relevantnú diagnostickú šedú zónu (3, 7).
Z hľadiska potenciálu na detekciu nedostatku železa v prítomnosti zápalu sa buď samostatne alebo v kombinácii s parametrami metabolizmu železa do pozornosti dostáva niekoľko ďalších diagnostických markerov, vrátane percenta hypochrómnych červených krviniek (% Hypo), obsahu hemoglobínu v retikulocytoch (CHr), obsahu hemoglobínu v červených krvinkách (MCV) a šírky distribúcie červených krviniek (RDW) (31, 32). Hoci niektoré z týchto testov sa zdali byť sľubné, stále chýbajú jednoznačné analýzy, ktoré by zhodnotil ich skutočný diagnostický potenciál na rozlíšenie AI od AI/IDA, na predikciu odpovede na zvolenú terapiu alebo ako indikátora potenciálneho poškodenia (napr. nadmerná suplementácia železa) (32).
Hepcidín, vzhľadom na svoju ústrednú úlohu v regulácii metabolizmu železa, bol hodnotený ako biomarker stavu železa a reakcie na železo u pacientov s AI. Zatiaľ čo pacienti s AI majú vyššie koncentrácie hepcidínu v sére v porovnaní so zdravými kontrolami, pacienti s IDA majú výrazne nižšie alebo dokonca nedetegovateľné hladiny hepcidínu. Niektorí autori navrhujú určiť hladiny hepcidínu, aby si zvolili lepšiu terapeutickú cestu podávania suplementácie železa (orálne vs. intravenózne), ako aj jeho správne načasovanie a harmonogram (33). Avšak vzhľadom na cirkadiálne oscilácie hladín hepcidínu, významnú intraindividuálnu variabilitu a rýchlo sa meniace zmeny hladín v reakcii na aktivačné a inhibičné signály nie je krátkodobé meranie sérového hepcidínu užitočné ako biomarker stavu železa u pacientov s AI. Stanovenie hepcidínu je však sľubným diagnostickým nástrojom, ak sa používa v kombinácii s inými zavedenými testami alebo novými markermi, ako je erytroferrón.
Medzi ďalšie perspektívne markery môžu patriť rozpustný hemojuvelín alebo rastový diferenciačný faktor 15, avšak pre ich skutočné zhodnotenie prínosu je potrebných ešte mnoho ďalších štúdií (34). Prehľad laboratórnych ukazovateľov charakterizujúcich parametre v súvislosti s diferenciálnou diagnostikou AI sumarizuje tabuľka 1.
Table 1. Prehľad laboratórnych ukazovateľov charakterizujúcich anémiu z nedostatku železa, kombinovanú anémiu zápalu s funkčným nedostatkom železa a anémiu zápalu 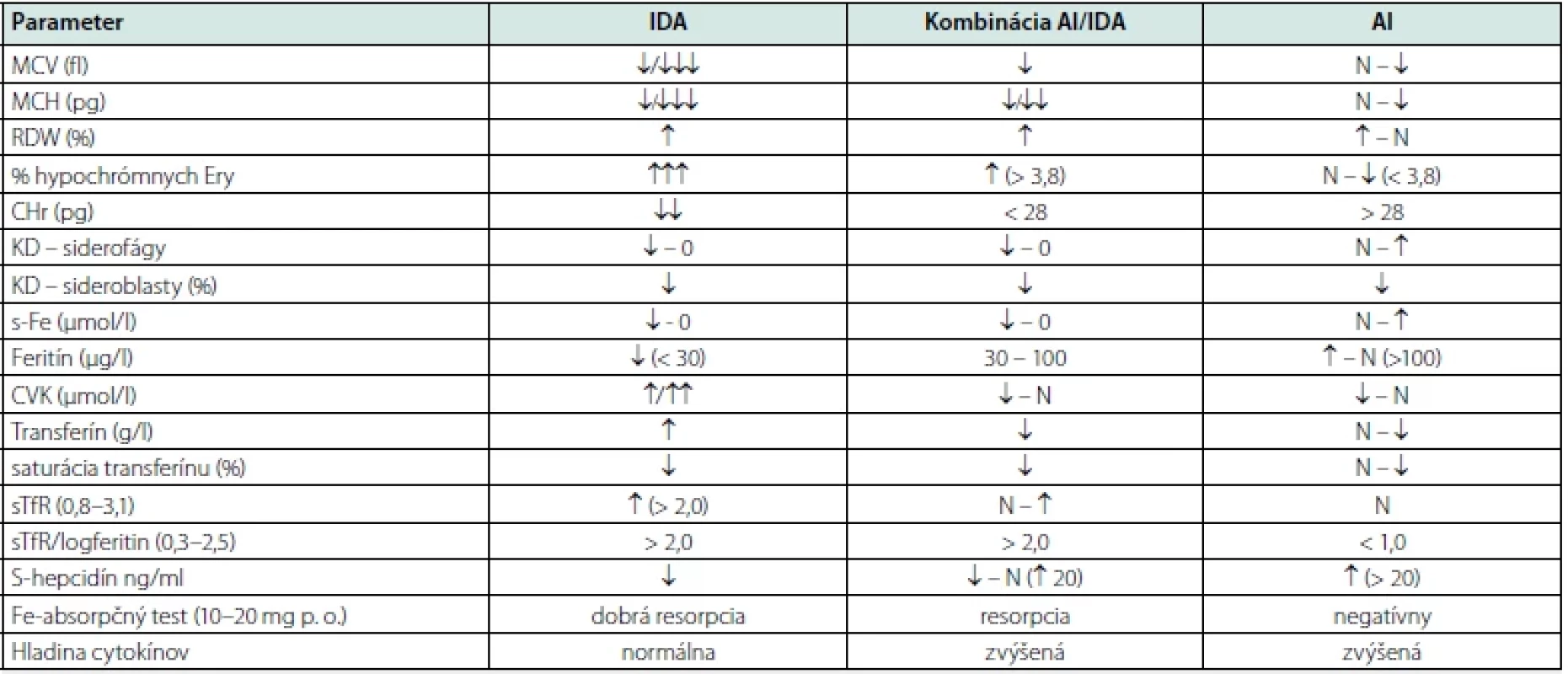
IDA – anémia z nedostatku železa; ACD – anémia chronických ochorení; MCV – stredný objem červenej krvinky; MCH – stredne množstvo hemoglobínu v červenej krvinke; RDW – distribučná šírka erytrocyov; KD – kostná dreň; s‑ Fe – hladina železa v sére; CVK – celková väzobná kapacita; sTfR – solubilný tranferínový receptor; sTfR‑ F – index sTfR/log. feritínu, KD – kostná dreň; N – normálna hodnota
Modifikované podľa: Ganz T, 2019; Tupý J a kol., 2019 (6, 8)Liečba
Primárnym terapeutickým prístupom pre AI je liečba zameraná na infekčné alebo zápalové procesy, ktorá okrem zlepšenia základného ochorenia upravuje aj anémiu. Príkladom je využitie anti‑IL - 6 receptorovej protilátky (toculizumab) pri Castlemanovej chorobe, inhibítorov TNF (infliximab, adalimumab, certolizumab pegol) v manažmente pacientov so zápalovým ochorením čriev alebo reumatoidnej artritídy, glukokortikoidov u pacientov s obrovskobunkovou arteritídou alebo IL-1β inhibítora (kanakinumab), ktorý upravil anémiu súvisiacu s aterosklerotickým ochorením. Iným príkladom je použitie antimikrobiálnych látok, ktoré zásadne vyriešilo tuberkulóznu anémiu (6, 7, 35).
Ak sa AI nevyrieši liečbou základných ochorení alebo liečba nie je dostatočná, je potrebné zvážiť iné terapeutické možnosti. Všetky úvahy o liečbe anémie zápalu však musia brať do úvahy jej evolučný kontext, keď u pacientov s aktívnou infekciou je AI v skutočnosti obrannou stratégiou tela na obmedzenie dostupnosti železa pre patogény nazývané aj „nutričná imunita“. Okrem toho má dostupnosť železa negatívne účinky na imunitnú funkciu moduláciou diferenciácie a proliferácie imunitných buniek a ovplyvňuje aj antimikrobiálne efektorové mechanizmy imunitných buniek (6). Pri liečbe anémie je teda potrebné zvážiť, či takáto liečba môže ovplyvniť aj základnú chorobu, čo vyvoláva zásadné otázky a znepokojenie pri liečbe pacientov s infekciami alebo nádorovým ochorením.
Na liečbu anémie zápalu boli zavedené dve základné terapeutické stratégie, a to suplementácia železa a liečba látkami stimulujúcimi erytropoézu (ESA – erythropoiesis stimulating agent). Krvné transfúzie sa považujú len za núdzovú liečbu (6, 8).
Náhradná terapia železa
Substitučná liečba železom predstavuje pre pacientov s AI liečbu, ktorá by sa mala zvážiť najmä u pacientov so skutočným alebo funkčným nedostatkom železa. Železo je možné doplniť buď perorálnymi alebo parenterálnymi intravenóznymi prípravkami (3). Preukázalo sa, že perorálne prípravky železa majú u pacientov so zápalovým ochorením čriev (IBD – inflammatory bowel disease), súbežným deficitom železa a nízkou aktivitou ochorenia podobnú účinnosť v porovnaní s intravenóznymi prípravkami s výhodou ľahkej samoaplikácie a nízkych nákladov (36). Biologická dostupnosť perorálnej suplementácie železa je však ovplyvnená viacerými faktormi. Zatiaľ čo vitamín C a nočné hladovanie zvyšujú príjem železa, inhibítory protónovej pumpy alebo mliečne výrobky a čaj znižujú biologickú dostupnosť železa. Vo všeobecnosti by sa perorálne prípravky železa mali užívať raz ráno v minimálnej dávke 50 mg dvojmocného železa (celková dávka zlúčeniny závisí od konkrétnej použitej soli železa alebo glykánu), pretože jeho častejšia aplikácia môže znížiť príjem železa zvýšenou produkciou hepcidínu súvisiaceho so železom (7). Nízka absorpcia perorálneho železa zvyšuje koncentrácie železa v čreve s následnými gastrointestinálnymi vedľajšími účinkami, čo potom ďalej obmedzuje komplianciu pacientov (36). Zápal (dokonca aj nízkeho stupňa) zhoršuje absorpciu železa v čreve v dôsledku internalizácie FPN1 súvisiacej s hepcidínom, čo robí perorálnu suplementáciu železa neúčinnou (37). Parenterálne intravenózne podávanie železa je preto možnou alternatívou suplementácie železa u pacientov s chronickými (zápalovými) ochoreniami s výhodou rýchlejšieho doplnenia nedostatku železa. Konkrétne novšie formy sacharidového železa umožňujú podávanie vyšších dávok až do 1 000 mg v jednej infúzii (36). Na druhej strane je potrebné vziať do úvahy vyššie náklady a veľmi zriedkavé, ale závažné anafylaktické reakcie s potrebou vybavenia na zvládnutie týchto život ohrozujúcich situácií. Hoci parenterálne podávanie železa bolo skôr vyhradené pre pacientov s intoleranciou alebo nedostatočnou odpoveďou na perorálnu suplementáciu železa, ako aj na rýchle dopĺňanie železa (36), v súčasnosti je etablované na liečbu AI so sprievodnou IDA alebo dokonca aj pri ID bez anémie u pacientov s viacerými chronickými ochoreniami, čo potvrdzuje aj metaanalýza pacientov s IBD a IDA. Chýbajú však podstatné koncové údaje o účinku takejto liečby na priebeh malígneho ochorenia, eventuálne nastávajú obavy týkajúce sa akumulácie železa v myokarde a endotéliu. Ďalším klinicky relevantným vedľajším účinkom určitých intravenóznych prípravkov je hypofosfatémia (38).
Látky stimulujúce erytropoézu
Liečba rekombinantnými ľudskými látkami stimulujúcimi erytropoézu je široko používaná liečba AI a špecificky sa používa u pacientov s chronickým ochorením obličiek alebo rakovinou (1, 3). V súčasnosti je dostupných niekoľko biosimilárnych látok Epo s rôznym polčasom rozpadu a afinitou k EpoR (39). Napriek tomu niektoré štúdie a metaanalýzy naznačujú reštriktívnejšie používanie ESA v dôsledku vedľajších účinkov vrátane zvýšenej mortality (znížené celkové prežitie pre zvýšené riziko tromboembolických komplikácií), krvácania a hypertenzie u anemických pacientov s rakovinou, stimuláciu rastu a progresiu nádoru prostredníctvom efrínového receptora a zvýšené riziko úmrtia alebo kardiovaskulárnych príhod u dialyzovaných, ale aj nedialyzovaných pacientov so slabou počiatočnou hematopoetickou odpoveďou. Preto sa v posledných rokoch zvýšil záujem o liečebné stratégie umožňujúce zníženie dávok ESA doplnením železa alebo mobilizáciou železa prostredníctvom antihepcidínových terapeutických stratégií (40).
Krvné transfúzie
Krvné transfúzie sú zavedenou a rýchlou terapiou u pacientov s ťažkou alebo život ohrozujúcou anémiou, najmä u pacientov so sprievodnými patológiami vrátane krvácania alebo anémie vyvolanej chemoterapiou (1). Avšak kvôli zvýšenému riziku nežiaducich reakcií a nedostatku dôkazov preukazujúcich zlepšenie výsledku, sa takmer pri všetkých situáciách odporúča reštriktívna stratégia transfúzie krvi (3, 41).
Nové terapeutické princípy
Na základe znalostí o patofyziológii AI sa objavujú dve nové hlavné terapeutické stratégie preskupenia zásob železa v tele, a to: modifikácia funkcie a syntézy hepcidínu a stabilizácia HIF prostredníctvom inhibície PHD (9) – Tab. 2.
Table 2. Zlúčeniny potenciálne využiteľné na liečbu anémie zápalu 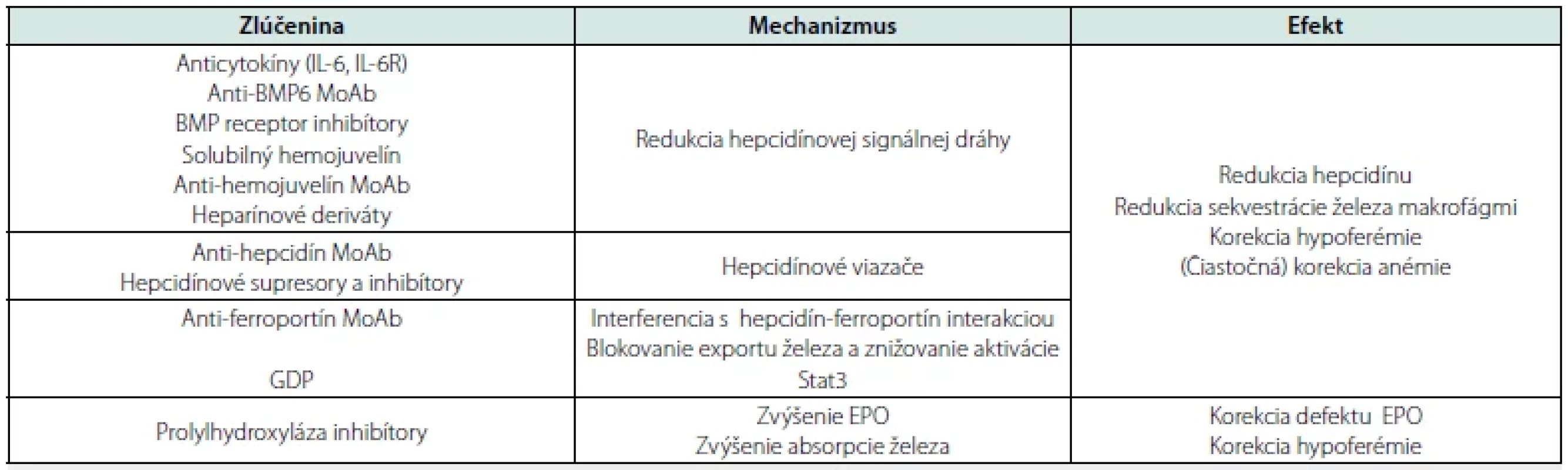
IL – interleukín; MoAb – monoklonálna protilátka; BMP – kostný morfogenetický proteín; GDP – guanozín-5'-difosfát zapuzdrený v lipidovom vezikule; Stat – transduktor signálu a aktivátor transkripcie; EPO – erytropoetín
Modifikované podľa: Weiss G, et al. 2019; Camaschella C, et al. 2020; (3, 7)Účinky hepcidínu, ako hlavného regulátora železa, možno modifikovať neutralizáciou hepcidínu v obehu, zacielením na expresiu hepcidínu v pečeni alebo antagonizáciou väzby hepcidínu na jeho receptor FPN1. Inou možnosťou je úprava syntézy hepcidínu zacielením na dráhu BMP/SMAD. Na druhej strane inhibícia prolylhydroxylázy je terapeutickou stratégiou, ktorá stabilizuje hypoxiou indukovateľný faktor, čím podporuje produkciu erytropoetínu, zvyšuje črevnú absorpciu železa a mobilizáciu zásob železa (3, 7).
V súčasnosti prebieha niekoľko štúdií, ktoré hodnotia nové stratégie na zvieracích modeloch, eventuálne prechádzajú do klinických skúšok u ľudí. Mnohé z nich sa javia optimisticky s potenciou úspešného ovplyvnenia patologického mechanizmu, a tým aj liečby anémie zápalu.
Záver
Zápalová anémia je vysoko prevládajúci syndróm spojený so systémovými prejavmi zápalu. Vo svojej najbežnejšej forme je anémia ľahko diagnostikovaná ako ľahká až stredne ťažká normocytová normochrómna anémia spojená s nízkym plazmatickým železom a saturáciou transferínu, ale vysokou hladinou feritínu v sére. Diagnostický problém však môže predstavovať jej koexistencia so skutočným nedostatkom železa. Primárnym terapeutickým prístupom je liečba základného zápalového ochorenia. V prípade neúspechu je nutné zvážiť suplementáciu železa a liečbu liekmi stimulujúcimi erytropoetín. Budúcnosť predstavuje vývoj cielených terapií, ktoré môžu ponúknuť ďalšie alternatívy liečby.
MUDr. Jaromír Tupý, PhD.
Klinika hematológie a transfuziológie, ÚVN SNP Ružomberok – FN
tupyj@uvn.skCit. zkr: Vnitř Lék. 2023;69(2):E10-E18
Článek přijat redakcí: 30. 1. 2023
Článek přijat po recenzích: 6. 3. 2023
Sources
1. Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med. 2005;352(10):1011-1023.
2. Kassebaum NJ, Jasrasaria R, Naghavi M, et al. A systematic analysis of global anemia burden from 1990 to 2010. Blood. 2014;123(5):615-624.
3. Weiss G, Ganz T, Goodnough LT. Anemia of inflammation. Blood. 2019;3;133(1):40-50.
4. Tim Goodnough L, Comin‑Colet J, Leal‑Noval S, et al. Management of anemia in patients with congestive heart failure. Am J Hematol. 2017;92(1):88-93.
5. Stauder R, Valent P, Theurl I. Anemia at older age: etiologies, clinical implications, and management. Blood. 2018;131(5):505-514.
6. Ganz T. Anemia of Inflammation. N Engl J Med. 2019;381(12):1148-115
7. Camaschella C, Nai A, Silvestri L. Iron metabolism and iron disorders revisited in the hepcidin era. Haematologica. 2020;105(2):260-272.
8. Tupý J, et al. Železo v úlohe diferenciálnej diagnostiky anémií chronických ochorení. SAP - Slovak Academic Press, 2019.
9. Lanser L, Fuchs D, Kurz K, Weiss G. Physiology and Inflammation Driven Pathophysiology of Iron Homeostasis‑Mechanistic Insights into Anemia of Inflammation and Its Treatment. Nutrients. 2021;13 : 3732.
10. González‑Domínguez Á, Visiedo‑García FM, Domínguez‑Riscart J, et al. Iron Metabolism in Obesity and Metabolic Syndrome. Int. J. Mol. Sci. 2020;21(15):5529.
11. Kawabata, H. Transferrin and transferrin receptors update. Free Radic. Biol. Med. 2019;133 : 46-54.
12. Sukhbaatar N, Weichhart T. Iron Regulation: Macrophages in Control. Pharmaceuticals. 2018;11 : 137.
13. Babitt JL, Eisenga MF, Haase VH, et al. Controversies in optimal anemia management: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Conference. Kidney International. 2021;99 : 1280-1295.
14. Glogowski T, Wojtaszek E, Malyszko J. Biomarkers of iron metabolism in chronic kidney disease. International Urology and Nephrology. 2021;53 : 935-944
15. Wang CY, Babitt JL. Liver iron sensing and body iron homeostasis. Blood. 2019;133 : 18-29.
16. Arezes J, Foy N, McHugh K, et al. Erythroferrone inhibits the induction of hepcidin by BMP6. Blood. 2018;132(14):1473-1477.
17. Ueda N, Takasawa K. Impact of inflammation on ferritin, hepcidin and the management of iron deficiency anemia in chronic kidney disease. Nutrients. 2018;10(9):1173.
18. Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004;306(5704):2090-2093.
19. Canali S, Core AB, Zumbrennen‑Bullough KB, et al. Activin B induces noncanonical SMAD1/5/8 signaling via BMP type i receptors in hepatocytes: evidence for a role in hepcidin induction by inflammation in male mice. Endocrinology. 2016;157(3):1146-1162.
20. Guida C, Altamura S, Klein FA, et al. A novel inflammatory pathway mediating rapid hepcidin ‑ independent hypoferremia. Blood. 2015;125(14):2265-2275
21. Nairz M, Theurl I, Swirski FK, Weiss G. „Pumping iron“-how macrophages handle iron at the systemic, microenvironmental, and cellular levels. Pflugers Arch. 2017;469(3-4):397-418.
22. Theurl I, Theurl M, Seifert M, et al. Autocrine formation of hepcidin induces iron retention in human monocytes. Blood. 2008;111 : 2392–2399.
23. Jelkmann W. Regulation of erythropoietin production. J Physiol. 2011;589(Pt 6):1251-1258.
24. Khalil S, Delehanty L, Grado S, et al. Iron modulation of erythropoiesis is associated with Scribble‑mediated control of the erythropoietin receptor. J Exp Med. 2018;215(2):661-679.
25. Latour C, Wlodarczyk MF, Jung G, et al. Erythroferrone contributes to hepcidin repression in a mouse model of malarial anemia. Haematologica. 2017;102(1):60-68.
26. Kim A, Fung E, Parikh SG, et al. A mouse model of anemia of inflammation: complex pathogenesis with partial dependence on hepcidin. Blood.2014;123 : 1129-1136.
27. Dinkla S, van Eijk LT, Fuchs B, et al. Inflammation‑associated changes in lipid composition and the organization of the erythrocyte membrane. BBA Clin. 2016;5 : 186-192.
28. Muckenthaler MU, Rivella S, Hentze MW. Gal, B.A. red carpet for iron metabolism. Cell. 2017;168(3):344-361
29. Camaschella C. Iron‑deficiency anemia. N Engl J Med. 2015;372(19):1832-1843
30. Lopez A, Cacoub P, Macdougall IC, Peyrin‑Biroulet L. Iron deficiency anaemia. Lancet. 2016;387 : 907-916.
31. Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron‑restricted erythropoiesis. Blood. 2010;116(23):4754-4761.
32. van Santen S, de Mast Q, Oosting JD, van Ede A, Swinkels DW, van der Ven AJ. Hematologic parameters predicting a response to oral iron therapy in chronic inflammation. Haematologica. 2014;99(9):e171-e173.
33. Bregman DB, Morris D, Koch TA, He A, Goodnough LT. Hepcidin levels predict nonresponsiveness to oral iron therapy in patients with iron deficiency anemia. Am J Hematol. 2013;88(2):97-101.
34. Thomas C, Kobold U, Thomas L. Serum hepcidin-25 in comparison to biochemical markers and hematological indices for the differentiation of iron‑restricted erythropoiesis. Clin Chem Lab Med. 2011;49(2):207-213.
35. Vallurupalli M, MacFadyen JG, Glynn RJ, et al. Effects of Interleukin-1 Inhibition on Incident Anemia: Exploratory Analyses From a Randomized Trial. Ann. Intern. Med. 2020;172 : 523-532.
36. Nielsen OH, Soendergaard C, Vikner ME, Weiss G. Rational Management of Iron‑Deficiency Anaemia in Inflammatory Bowel Disease. Nutrients. 2018;10 : 82.
37. Girelli D, Ugolini S, Busti F, Marchi G, Castagna A. Modern iron replacement therapy: Clinical and pathophysiological insights. Int. J. Hematol. 2018;107 : 16-30.
38. Zoller H, Schaefer B, Glodny B. Iron ‑ induced hypophosphatemia: An emerging complication. Curr. Opin. Nephrol. Hypertens. 2017;26 : 266-275.
39. Portolés J, Martín L, Broseta JJ, Cases A. Anemia in Chronic Kidney Disease: From Pathophysiology and Current Treatments, to Future Agents. Front. Med. 2021;8 : 642296.
40. Petzer V, Tymoszuk P, Asshoff M, Carvalho J, et al. A fully human anti‑BMP6 antibody reduces the need for erythropoietin in rodent models of the anemia of chronic disease. Blood. 2020;136 : 1080-1090.
41. Goodnough LT, Murphy MF. Do liberal blood transfusions cause more harm than good? BMJ. 2014;349:g6897.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2023 Issue E-2-
All articles in this issue
- Comparison of polypharmacy and pharmacotherapy among seniors in social institutions in 2001 and 2019
- Anemia of inflammatory: does eiderr knowledge mean better diagnosis and treatment?
- Severe autoimune thyreotoxicosis complicated by febrile neutropenia as a result of thyreostatic therapy
- Role of eplerenone in the threatment of cardiovascular diseases
- Diabetes mellitus urological complication
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Severe autoimune thyreotoxicosis complicated by febrile neutropenia as a result of thyreostatic therapy
- Anemia of inflammatory: does eiderr knowledge mean better diagnosis and treatment?
- Comparison of polypharmacy and pharmacotherapy among seniors in social institutions in 2001 and 2019
- Diabetes mellitus urological complication
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

