-
Medical journals
- Career
Zápalové markery v klinickej praxi
Authors: Štefan Sotak
Authors‘ workplace: I. interná klinika UPJŠ LF a UN LP v Košiciach
Published in: Vnitř Lék 2022; 68(E-7): 11-16
Category: Review Articles
doi: https://doi.org/10.36290/vnl.2022.100Overview
Zápal je všeobecná obranná reakcia tela proti rôznym škodlivým podráždeniam. Diagnostika zápalového procesu a monitorovanie jeho liečby je založené na kombinácii klinických a laboratórnych nálezov. Biochemické zápalové markery slúžia obvykle na podporu diagnózy infekcie, na jej monitorovanie a sledovanie efektívnosti antiinfekčnej liečby. Zápalový marker je potrebné vyberať podľa klinického stavu s ohľadom na zradnosť a nedostatky markerov, so znalosťou ich dynamiky a s ohľadom na dĺžku anamnézy. Ako optimálny postup pri zistení bakteriálnej infekcie sa odporúča vyšetrovať viaceré proteíny akútnej fázy. Je úlohou lekára určiť, kedy, za akých okolností, a ktorý marker nechať vyšetriť s ohľadom na to, aby pacient bol včas správne diagnostikovaný a dostal adekvátnu liečbu, a na druhú stranu, aby nebol zbytočne iatrogenizovaný a aby zdravotnícke zariadenie zbytočne neprichádzalo o financie.
Klíčová slova:
CRP – zápal – marker – PCT – IL 6
Úvod
Zápal je zložitý a komplexný systém obranných reakcií vaskularizovaných tkanív, ktorým organizmus reaguje na patogénny podnet rôzneho charakteru, ktorý ho vyviedol zo stavu dynamickej rovnováhy, pričom cieľom je obnoviť pôvodný stav. Rad obranných a hojivých reakcií spočíva v odstránení príčiny a následnej regenerácii alebo reparácii tkanív s obnovením metabolizmu a funkcie postihnutého orgánu do stavu dynamickej rovnováhy (1).
Odpoveď na zápalový podnet je začatá a regulovaná širokým spektrom zápalových mediátorov a je sprevádzaná aj fyzikálnymi či klinickými prejavmi:
• reakcia akútnej fázy – tzv. proteíny akútnej fázy (C reaktívny proteín (CRP), α-1-antitrypsín (α-1-AT), koagulačné faktory, C3 zložka komplementu),
• leukocytóza (prípadne leukopénia),
• febrilita (prípadne subfebrilita, ale aj normotermia),
• zvýšená sedimentácia erytrocytov,
• metabolické zmeny,
• zmeny iónovej koncentrácie,
• stresová reakcia – únava, vyčerpanosť, bolesť (1).
Reakcia akútnej fázy je uniformná adaptačná odpoveď na narušenie integrity organizmu, ktorá si zachováva obranný charakter a ktorá je časovo i rozsahom limitovaná. Je iniciovaná molekulovými vzormi spojenými s patogénom a molekulovými vzormi spojenými s poškodením, ktoré sú rozpoznávané bunkami imunitného systému, a tie následne spúšťajú humorálnu imunitnú reakciu, predovšetkým prozápalové cytokíny (tumor nekrotizujúci faktor α (TNF α), interleukíny (IL) 1 a 6 a kortikoidy. Zahŕňa deje imunitnej povahy, všetky systémové zmeny v endokrinnej a metabolickej oblasti, syntézu proteínov akútnej fázy v pečeňových bunkách, zmeny vodnej a elektrolytickej rovnováhy, pyretickú reakciu a ďalšie. Hlavný význam spočíva v udržaní homeostázy, protiinfekčnej obrane, modulácii vnímanej bolesti, odstránení nenávratne poškodených tkanív, zaistení dostatočnej ponuky energie a stavebného materiálu (najmä aminokyselín) pre tvorbu protilátok, enzýmov, hormónov a v regeneračných dejoch (1).
C reaktívny proteín
Ide o najčastejšie používaný biochemický sérový marker zápalu (2).
CRP je bielkovinový reaktant akútnej fázy zápalu, ktorý sa tvorí v pečeni (2). Jeho hladina sa dramaticky zvyšuje v závislosti od intenzity zápalovej reakcie. Má množstvo biologických aktivít súvisiacich s nešpecifickou obranou organizmu. Pôsobí ako opsonín pre baktérie, parazity a imunokomplexy a môže aktivovať komplement klasickou cestou. Pomocou kalciových iónov sa viaže na polysacharidy bakteriálnej steny a na poškodené bunky, čím sa výrazne podieľa na odstraňovaní bunkového detritu uvoľňujúceho sa z nekrotizujúceho tkaniva počas zápalu. Je schopný aktivovať niektoré zápalové mediátory. Koncentrácia sa môže zvýšiť viac ako tisícnásobne v závislosti od intenzity akútnej zápalovej reakcie. Zvýšenie sa pozoruje už asi o 6 až 12 hodín od akútneho stimulu, ktorým môže byť aj chirurgický zákrok, popálenina, zlomenina alebo nekróza v dôsledku oklúzie tepny (infarkt myokardu) (1, 2). Tvorba CRP ako odpoveď na zápal môže byť ovplyvnená aj polymorfizmom CRP génu (3). Vrcholné hladiny sa dosahujú po 36 – 50 (priemerne 48) hodinách. Biologický polčas je konštantný (1) – 19 hodín (4) –, hladiny závisia priamo od produkcie. Pri uzdravovaní sa jeho koncentrácia znižuje tiež rýchlo, približne o 50 % za deň (2). CRP je spoľahlivým ukazovateľom začiatku akútneho zápalu, účinnosti zvolenej liečby a uzdravenia pacienta. Trend poklesu koncentrácií CRP naznačuje, že liečba je úspešná a často je možné ju ukončiť, keď sa hodnoty CRP vrátia do normálu (2). Jedinou, ale výraznou nevýhodou CRP je, že pokles sa za klinikou oneskoruje o 24 – 48 h (1).
Normálna koncentrácia CRP v sére zdravého človeka je nižšia ako 5 mg/l, mierne sa zvyšuje s vekom. Zvýšené hodnoty môžu byť zaznamenané u žien v poslednej fáze gravidity (2).
Okrem pečeňového zlyhania (2) a porúch tvorby IL 1β a 6 a TNF α (4), keď sú hladiny CRP nízke napriek možnej ťažkej bakteriálnej infekcii, je ešte niekoľko známych faktorov, ktoré interferujú s produkciou CRP. Zvýšené hodnoty CRP sa zisťujú aj u pacientov s AIDS, pacientov liečených cytotoxickými liečivami, glukokortikoidmi alebo ožarovaním (2). Dlhodobo zvýšené CRP môžeme nájsť pri malignitách (lymfómy, sarkómy aj karcinómy) (hladina nad 100 mg/l je znakom zlej prognózy) a chronických aktívnych zápaloch (2). Pri ľahkých akútnych zápaloch a vírusových infekciách sú obvyklé hladiny 10 – 40 mg/l, pri akútnom zápale, bakteriálnej infekcii 40 – 200 mg/l a pri ťažkých infekciách a popáleninách sú hladiny vyššie ako 200 mg/l, obvykle však nepresahujú 350 – 400 mg/l. Z vírusových infekcií boli vyššie hladiny zaznamenané pri infekciách cytomegalovírusom alebo vírusom herpes simplex. Hladiny CRP sa monitorujú aj po transplantáciách orgánov. Počas troch dní po výkone dochádza k zvýšeniu CRP, následne by hladiny mali klesať, čo znamená dobrý prognostický znak. Pretrvávajúce vysoké hodnoty CRP môžu poukazovať na rejekciu transplantátu. Nekróza pri akútnom infarkte myokardu sa prejaví okrem iného aj maximálnym zvýšením CRP o 48 hodín od objavenia sa bolesti (2). Abdominálna obezita, hypertriacylglycerolémia, chronická obličková choroba, nikotinizmus, psychický stres, znížené hladiny HDL ‑ C cholesterolu, artériová hypertenzia a hyperglykémia pozitívne korelujú s hladinami CRP, ide o hodnoty do 10 mg/l (5, 6). Naopak, hladinu CRP znižujú niektoré liečivá (napr. aspirín o 29 %, klopidogrel o 32 %, statíny o cca 13 – 47 % v závislosti od typu, dávky, dĺžky podávania a typu ochorenia, kvôli ktorému sú nasadené v liečbe, ezetimib o 25 – 62 %, fenofibrát o 84 %, niacín o 24 %, ACE inhibítory (ramipril o 24 – 32 %), sartany o 14 – 39 %, β‑blokátory o 12 – 73 %, glitazóny (rosiglitazón o 43 %) a vitamín E o 49 – 81 %) (7, 8), iné zase zvyšujú (napr. estrogény ako substitučná terapia o 50 až 100 %) (8).
Ak infekcia trvá viac ako 7 dní, hranicou na rozlíšenie, či je infekcia bakteriálneho alebo vírusového pôvodu, je hladina CRP 25 mg/l (9). Mnohé zápalové ochorenia, aj neinfekčné, majú svoju typické hladiny CRP (tab. 1). Indikácie na stanovenie hladiny CRP z medicínskeho hľadiska sú zhrnuté v tab. 2.
Table 1. Typické hodnoty CRP pri vybraných ochoreniach 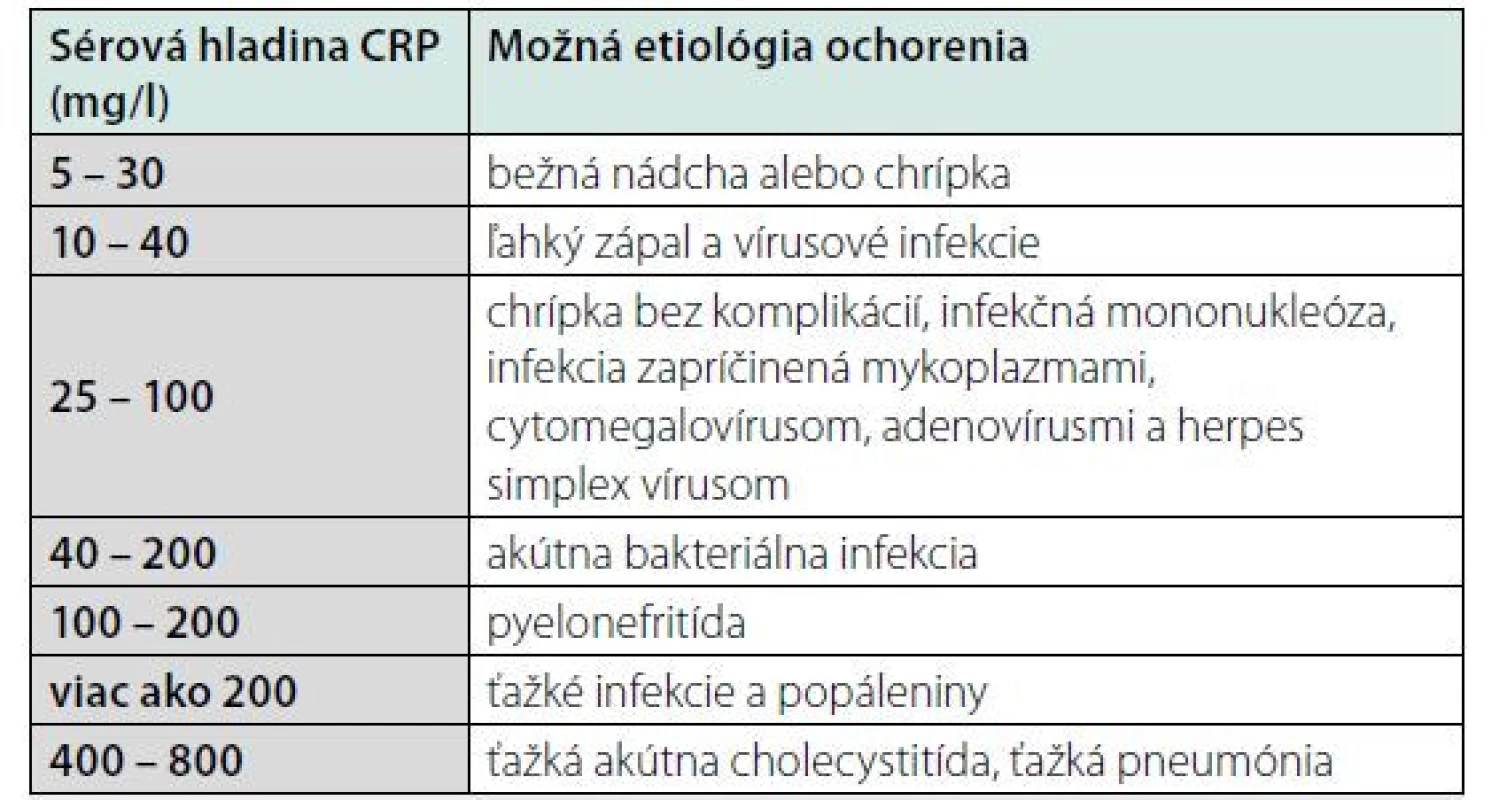
Zdroj: (1) Table 2. Indikácie na stanovenie sérovej hladiny CRP 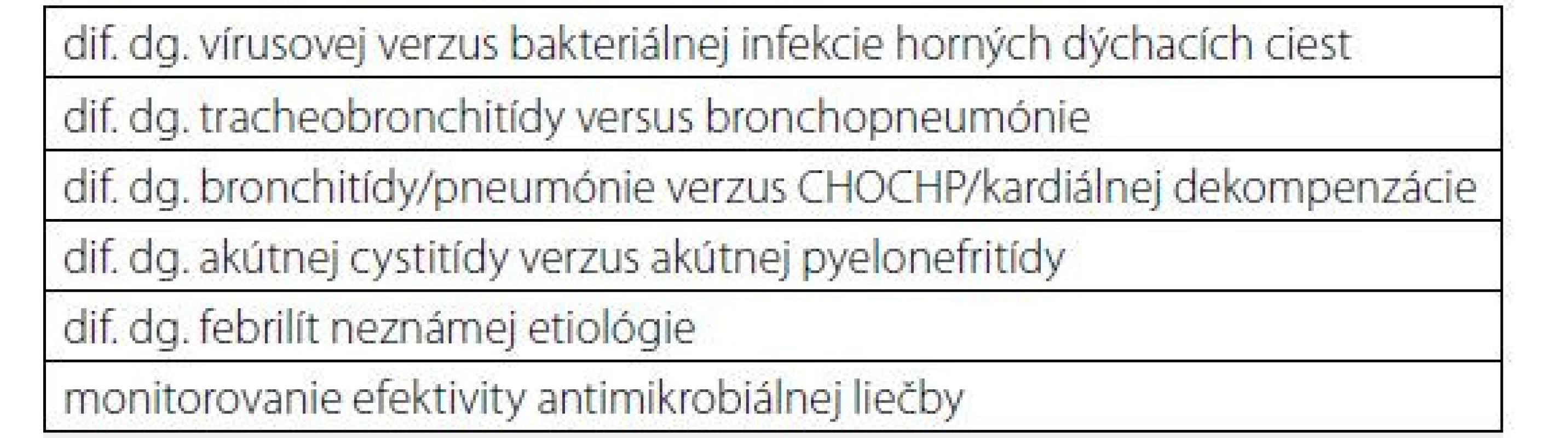
Zdroj: (2) Prokalcitonín
Ide o druhý najčastejšie používaný biochemický sérový marker zápalu (10).
Stimulom na jeho syntézu sú hlavne baktériové endotoxíny (lipopolysacharidy (LPS)), ale aj cytokíny – TNF α a IL 6 (10). Vylučuje sa obličkami, ľahká a stredne ťažká renálna insuficiencia nemá vplyv na jeho hladinu (11).
Prokalcitonín (PCT) je bielkovina syntetizovaná hlavne v pečeni, v menšej miere v neuroendokrinných bunkách čriev a pľúc, v monocytoch a makrofágoch. Pri sepse je produkovaný prakticky každou bunkou v tele. PCT začne stúpať asi 2 – 4 hodiny od spustenia zápalového procesu a dosahuje maximálne hodnoty za 12 – 24 hodín. Koncentrácia PCT sa mení paralelne so závažnosťou zápalového procesu. Ak príčina zápalu vymizne, dochádza k eliminácii PCT s polčasom 20 – 24 (t. j. cca 1 deň). Na rozdiel od CRP, produkcia PCT pri porovnateľnom polčase ustáva ďaleko rýchlejšie. Tieto vlastnosti robia z PCT výborný marker ťažkej bakteriálnej infekcie. Zvýšenie PCT pretrváva dlhšie, ako u iných indikátorov sepsy a vyskytuje sa aj u pacientov s neutropéniou. V porovnaní s CRP má PCT vyššiu špecifitu pre bakteriálnu infekciu, je vhodný na sériové monitorovanie a rozhodovanie o nasadení či vysadení ATB a reaguje aj na sekundárne infekcie. PCT sa pri sepse nekonvertuje na kalcitonín. Presný fyziologický význam prokalcitonínu nie je objasnený, predpokladá sa, že sa podieľa na regulácii zápalu a má analgetické účinky. Polčas prokalcitonínu je 1 deň a po imunitnej stimulácii vzrastá jeho sérová koncentrácia už v priebehu 2 – 3 hodín asi dvadsaťnásobne. Zvýšený sa dá pozorovať pri generalizovaných bakteriálnych, mykotických a protozoárnych infekciách, neobjavuje sa pri vírusových infekciách (10) (tab. 3). S menej výrazným vzostupom sa dá stretnúť aj v prípadoch, ktoré sú uvedené v tab. 3. Je pozitívny aj pri malobunkovom karcinóme pľúc a pri generalizácii prakticky akéhokoľvek malígneho ochorenia (12).
Table 3. Typické hodnoty PCT pri vybraných ochoreniach 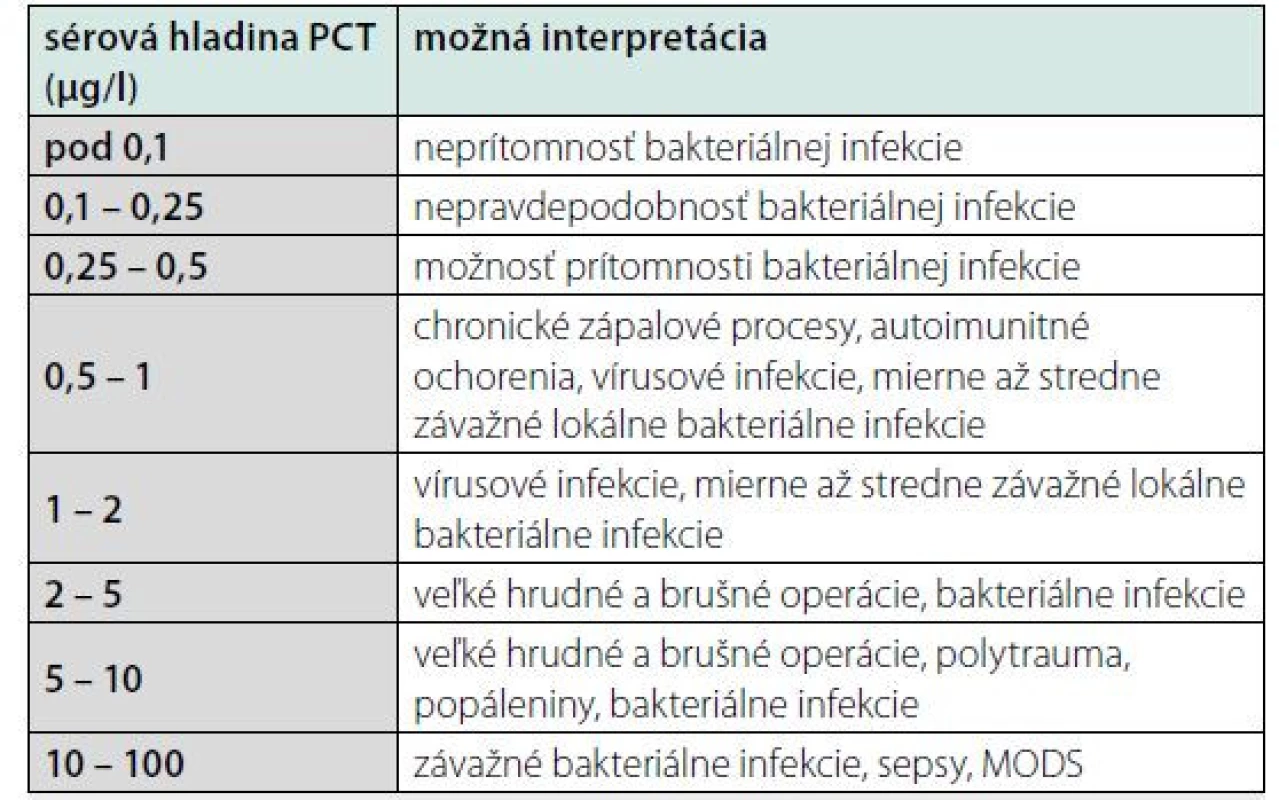
Zdroj: (15) α-1-kyslý glykoproteín (orosomukoid)
Produkuje sa v pečeni (13).
Jeho fyziologická úloha zatiaľ nie je celkom vyjasnená. In vitro bola preukázaná jeho schopnosť viazať rôzne ligandy, ktorých spektrum je veľmi široké – siahajúce od malých iónov až po steroidné hormóny a rôzne liečivá. Zdá sa teda, že orosomukoid by mohol byť primárne transportér (13).
Normálna sérová hladina je do 1,2 mg/ml. Vysoké hodnoty sú prognosticky nepriaznivým faktorom priebehu septickej reakcie. Je zvýšený aj pri malignitách, niektorých infekciách (napr. HIV), pri väčších chirurgických výkonoch, popáleninách a aj v tehotenstve. Má význam i pre hodnotenie farmakokinetiky, napríklad antidepresív, ktoré viaže. Svoje miesto má aj v diferenciálnej diagnostike primárnych a sekundárnych malignít pečene (13).
Presepsín
Presepsín je fragment glykoproteínu CD14 a vzniká ako výsledok zápalovej reakcie spôsobenej infekciou. Glykoproteín CD14 je exprimovaný na povrchu membrány monocytov, makrofágov, granulocytov, kde slúži ako receptor komplexov LPS a LPS viažucich proteínov (LPBP). Je lokalizovaný v blízkosti toll‑like receptora 4 (TLR4). Naviazaním LPBP komplexu na CD14 sa aktivuje TLR4 – špecifická prozápalová kaskáda, a tým sa spúšťa zápalová reakcia hostiteľa proti infekčnému agens. Komplex LPS‑LPBP‑CD14 je uvoľňovaný do cirkulácie a vplyvom plazmatických proteáz štiepený na subtyp sCD14-ST‑presepsín (14).
Presepsín slúži na diagnostiku a prognózu sepsy a posúdenie miery závažnosti septických stavov. Koncentrácie sú signifikantne vyššie u pacientov s bakteriálnou infekciou, ako u pacientov bez infekcie (14) (tab. 4).
Table 4. Určovanie pravdepodobnosti sepsy podľa sérovej hladiny presepsínu 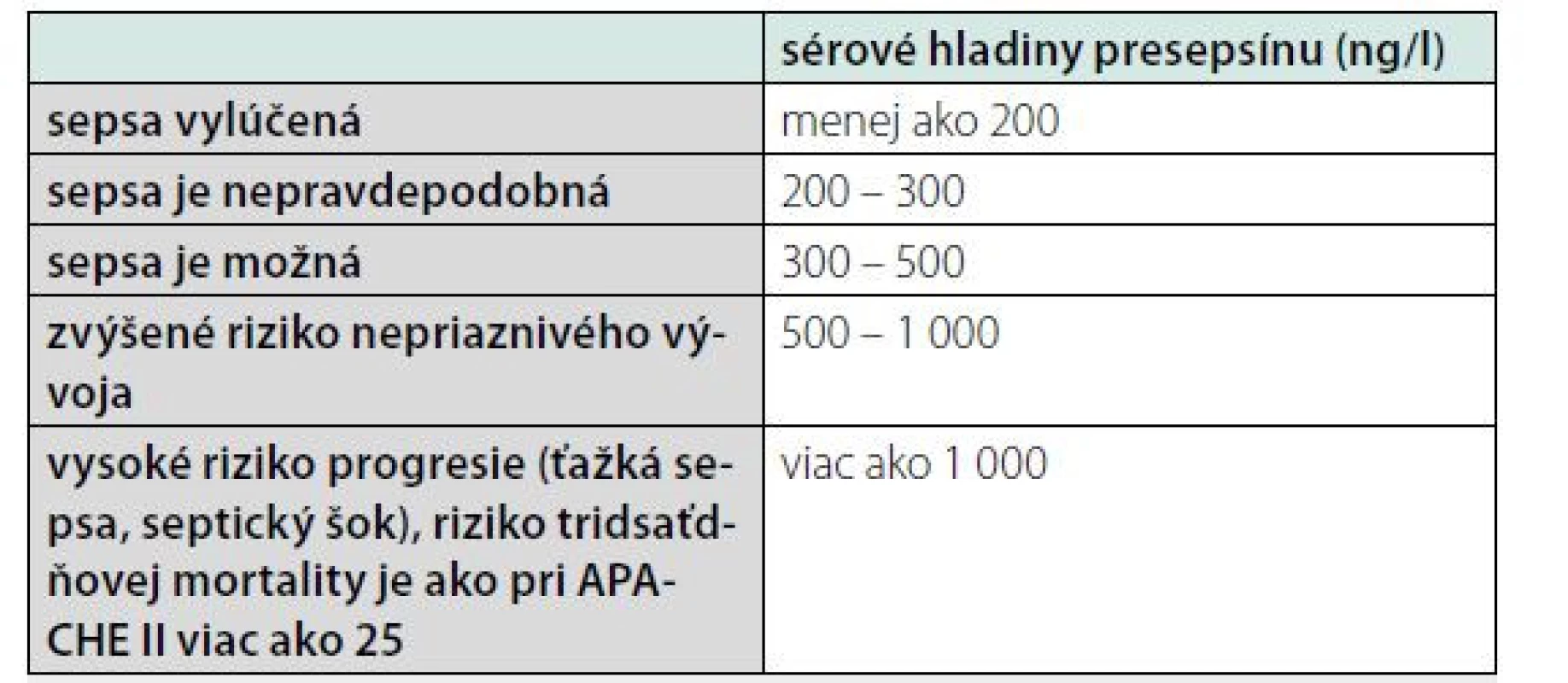
Zdroj: (15) Na rozdiel od CRP aj PCT, syntéza presepsínu nie je ovplyvnená funkciou pečene. Možno ho využiť aj v prípadoch, ak PCT je ovplyvnený interferenciou s kalcitonínom (napr. u niektorých pacientov s malobunkovým karcinómom pľúc alebo medulárnym karcinómom štítnej žľazy). Malá molekula presepsínu (13 kDa) sa filtruje v glomeruloch do moču a následne reabsorbuje a katabolizuje v tubulových bunkách. Hodnoty presepsínu bývajú preto zvýšené u pacientov so zníženou glomerulárnou filtráciou a mali by sa interpretovať s ohľadom na obličkové funkcie (14).
Feritín
Hladina feritínu, bielkoviny produkovanej v takmer všetkých ľudských tkanivách, v krvnom sére odráža predovšetkým tkanivové zásoby železa. Jeho hodnota klesá skôr, než narastie hladina transferínu (15).
Príčiny zvýšenej hladiny sú mnohoraké: zápal prakticky akejkoľvek etiológie (bakteriálne infekcie, reumatoidná artritída, systémový lupus erythematodes, Stillova choroba, nešpecifické črevné zápaly…), hepatálne ochorenia (najmä nealkoholová steatóza pečene, vírusová hepatitída B a C), obezita, abúzus alkoholu, tyreotoxikóza, rôzne malignity (predovšetkým hematologické, obzvlášť histiocytóza X), preťaženie organizmu železom (napr. hemochromatóza, časté transfúzie krvi, nadmerný prísun železa v strave…), porphyria cutanea tarda, Wilsonova choroba, neefektívna erytropoéza (sideroblastická anémia, talasémia). Preto feritín nie je vhodným ukazovateľom zápalu (1). Má však relatívne podstatný význam pri určovaní prognózy SARS‑CoV - 2. Pri vzostupe hladiny nad 1 000 μg/l je prognóza pacienta zlá (16).
Cytokíny
Cytokíny sú univerzálne mediátory zápalu produkované stimulovanými imunokompetentnými aj inými bunkami, najmä aktivovaným endotelom. Ako včasné spúšťače a regulátory zápalovej odpovede sa podieľajú na iniciácii syntézy ďalších rutinne používaných zápalových markerov (PCT, CRP). Pre svoju univerzálnosť však nedokážu dostatočne odlíšiť systémový a lokálny zápal, prípadne infekčný a neinfekčný pôvod zápalu. Laboratórnu diagnostiku cytokínov obmedzuje najmä ich krátky biologický polčas (14).
Dostatočne stabilný a laboratórnej diagnostike prístupný je len IL 6. Jeho koncentrácia sa zvyšuje veľmi skoro a dosahuje maximum 2 – 4 hodiny po nástupe syndrómu systémovej zápalovej odpovede (systemic inflammatory response syndrome, SIRS). V súčasnosti sa s úspechom u dospelých používa pri monitorovaní aktivity vzácnej Castlemanovej choroby (14). V štádiu overovania jeho prínosu do diagnostiky a sledovania dynamiky priebehu sú ďalšie chronické ochorenia, najmä autoimunitné, rejekčné reakcie, Alzheimerova choroba, vrodené aj získané imunodeficientné stavy (lymfohistiocytóza, AIDS…) a niektoré lymfómy (14).
Interleukín 6
IL 6 je cytokín so širokým spektrom funkcií, ktorý vykazuje aktivitu v B‑bunkách, T‑bunkách, krvotvorných kmeňových bunkách, hepatocytoch a mozgových bunkách. Produkcia IL 6 je vyvolaná náhle pri akútnych zápalových reakciách spojených so zranením, úrazom, stresom, infekciou, neopláziou a ďalšími závažnými stavmi. IL 6 je u dospelých užitočný pri hodnotení závažnosti SIRS, sepsy a septického šoku, ako aj pri odlíšení nesterilnej a sterilnej nekrózy pri nekrotizujúcej pankreatitíde (14) (tab. 5). U novorodencov pomáha pri rozlíšení novorodeneckej sepsy. Jeho fyziologická hodnota je do 7 ng/l (15).
Table 5. Indikácie na stanovenie sérovej hladiny IL 6 
Zdroj: (15) Zohráva úlohu aj pri chronických zápaloch, napríklad reumatoidnej artritíde, systémovom lupuse, Behçetovej chorobe, Crohnovej chorobe alebo ulceróznej kolitíde, čo treba brať do úvahy pri hodnotení akútnych zápalových stavov u týchto pacientov (15).
Zvýšené hodnoty IL 6 však nachádzame aj pri mnohých malignitách (lymfómy, mnohopočetný myelóm, leukémie, karcinómy prostaty, kolorektálny, ovariálny, mamárny, pulmonálny, pankreasu, obličky, hlavy a krku…), ateroskleróze, anémii, diabetes mellitus, depresii, roztrúsenej skleróze, AIDS a alkoholovej chorobe pečene (17).
Sérový amyloid A
Týmto pojmom sa označuje skupina proteínov patriaca do rodiny apoproteínov. Funkcie sérového amyloidu A (SAA) sú: obmedzenie transportu cholesterolu do pečene, chemotaxia a indukcia enzýmov degradujúcich extracelulárnu matrix (18).
SAA je proteín akútnej fázy, syntetizovaný prevažne v pečeni, ktorý v odpovedi na zápalový proces, infekčný alebo neinfekčný, vykazuje výrazný vzostup koncentrácie v krvi v priebehu 6 až 12 h. Nárast môže dosiahnuť sto až tisícnásobok pôvodnej koncentrácie. Jeho normálna sérová hladina je do 6,4 mg/l (19).
Stanovenie SAA je smerodajné u pacientov s vírusovými infekciami, ďalej u rejekcie transplantátov obličky (najmä u imunosuprimovaných pacientov) a tiež u pacientov s cystickou fibrózou liečenou kortikoidmi (20, 21). V prípade artritídy SAA tesne koreluje s aktivitou ochorenia. Súčasné stanovenie CRP a SAA môže zvýšiť diagnostickú senzitivitu infekcií (22).
SAA vykazuje akútne zmeny (t. j. cca 24 hod) po operácii obdobne ako CRP a IL 6. Záťaž zákroku pre organizmus, dĺžku záťaže a možné riziko 72 hod po operácii ukazujú hlavne CRP a SAA (v tomto období sú už IL 6 a leukocyty znížené prakticky na predoperačnú úroveň). Maximálna dynamika bola pozorovaná práve u SAA. SAA sa teda javí ako ukazovateľ, ktorý by mal byť zaradený medzi testy poskytujúce informácie o možných komplikáciách vo včasnom pooperačnom období (23).
Okrem toho, jeho dlhodobo zvýšená hladina predstavuje rizikový faktor aterosklerózy a môže viesť k vzniku sekundárnej amyloidózy (18).
Myxovirus resistance protein A
Po prekonaní vírusovej infekcie sú spustené interferónom (IFN) I a III indukované molekulárne reakcie: IFN I alebo III sa naviaže na svoje receptory, čo je proces vedúci okrem iného k aktivácii génov mx1 a mx2, ktoré produkujú antivírusové Mx proteíny (Mx1, nazývaný MxA, a Mx2, nazývaný MxB). Tieto proteíny sa u človeka produkujú vo všetkých jadrových bunkách, fyziologicky sa však do krvného obehu uvoľňujú len vo veľmi malých množstvách (24).
Mx gény nie sú priamo indukované vírusmi a nie sú exprimované konštitutívne. Ich expresia striktne závisí od signalizácie IFN I a III. Produkcia proteínu MxA v bunkách periférnej krvi sa ukázala ako klinicky citlivý a špecifický marker vírusovej infekcie (24).
Je dôležité spomenúť, že MxA je intracelulárny proteín. Preto sa akákoľvek metóda na jeho detekciu spolieha na uvoľnenie proteínu MxA z buniek. MxA môže byť detegovaná aj v kapilárnej krvi (24).
Koncentrácia proteínu MxA v periférnej krvi je fyziologicky pod 50 ng/ml. Je indukovaný za menej ako 1,2 hod po začatí akútnej infekcie a má polčas 2,3 dňa. MxA dosahuje maximálnu koncentráciu po 16 h a zostáva zvýšený v prítomnosti zvýšeného IFN I alebo III (24).
MxA je pozitívne pri akútnych vírusových infekciách spôsobených napr. vírusmi chrípky, vezikulárnej stomatitídy, osýpok, inými vírusmi patriacimi do čeľade Bunyaviridae, ďalej vírusmi „Semliki Forest“, opičích kiahní, togavírusu a podobne (24).
Naopak, jeho stanovovanie nemá význam pri podozrení na mengovírus, vírusy encefalomyokarditídy, vakcínie, patriace do čeľade Poxviridae atď., pretože hladina MxA na ochorenia spôsobené týmito vírusmi nezareaguje (24).
MxA je teda informatívny všeobecný marker pre najčastejšie akútne vírusové infekcie.
Obsolentné metódy
Mukoproteíny (glykoproteíny) sú tvorené bielkovinovou molekulou, ktorá je glykozylovaná. Sú súčasťou bunkových membrán, telesných tekutín (napríklad takmer všetky plazmatické proteíny sú v skutočnosti glykoproteíny a patria medzi α-1 - a α-2-globulíny) a medzibunkovej hmoty (14).
Keďže v minulosti neboli k dispozícii dostupné laboratórne testy na vyšetrovanie jednotlivých proteínov akútnej fázy zápalu, vyšetrenie mukoproteínov bolo v diferenciálnej diagnostike zápalov dýchacích ciest často požadovaným vyšetrením. V súčasnosti je už obsolentné a nahradené inými špecifickejšími vyššie uvedenými parametrami (14).
Záver
Proteíny v plazme môžu a nemusia reagovať na zápal zmenou svojej koncentrácie v čase (tab. 6 a 7). V súčasnosti neexistuje jediný dostatočne citlivý a špecifický marker zápalu, ktorý by bol schopný spoľahlivo diagnostikovať infekčný zápal a informovať o rýchlo sa meniacej situácii u septického alebo potenciálne septického. Existujúce rutinne dostupné markery je potrebné používať vo vhodných kombináciách a interpretovať ich vždy s ohľadom na konkrétnu klinickú situáciu a v kontexte s inými laboratórnymi nálezmi. Izolovaná hodnota každého zápalového markera má oveľa menší význam ako sledovanie jeho kinetiky u pacienta (tab. 8). Pre diagnostiku a monitorovanie lokalizovaných zápalov zostáva napriek svojim limitáciám najpoužívanejším markerom CRP. Diagnostika a liečba systémovej infekcie a sepsy vyžaduje interdisciplinárnu spoluprácu zdravotníckych profesionálov. Z biochemických parametrov je pre odhad rizika, diagnostiku aj monitorovanie sepsy u dospelých najlepšie validovaným markerom PCT. Okrem diagnostiky sa zápalové markery, najmä PCT, využívajú v manažmente antimikrobiálnej liečby. Začatie aj ukončenie antibiotickej liečby sú však omnoho komplexnejšie ako len posúdenie jednej či viacerých hodnôt zápalového markera. Vírusové infekcie (ale nie všetky!) zvyšujú koncentrácie MxA, zatiaľ čo koncentrácie CRP a PCT zvyšujú len mierne alebo vôbec. Preto porovnanie hodnôt MxA a CRP a/alebo PCT možno použiť na odlíšenie infekčnej etiológie. Individualizovaný koncept pozostávajúci zo zistenia orgánovej dysfunkcie, identifikácie možného zdroja infekcie, sledovania klinického vývoja a posúdenia hodnoty a kinetiky markerov zápalu zabezpečuje správny prístup k pacientovi v každodennej lekárskej praxi. Ako optimálny postup pri zistení bakteriálnej infekcie sa odporúča vyšetrovať viaceré proteíny akútnej fázy, najčastejšie to sú už spomínané CRP, PCT a taktiež IL 6. Vyšetrenie posledných dvoch menovaných je ale finančne náročnejšie. CRP, PCT a IL 6 sa nenahrádzajú, ale dopĺňajú. Niekedy je oprávnené vyšetrenie všetkých troch markerov a niekedy je vyšetrenie hoci len jedného z nich celkom zbytočné. Netreba však zabúdať, že laboratórne markery sú doplnkovým diagnostickým nástrojom a žiaden marker ani ich kombinácia nenahradia dôkladné klinické vyšetrenie pacienta a komplexné posúdenie jeho stavu.
Table 6. Zmeny sérových hladín rôznych bielkovín v reakcii na zápal 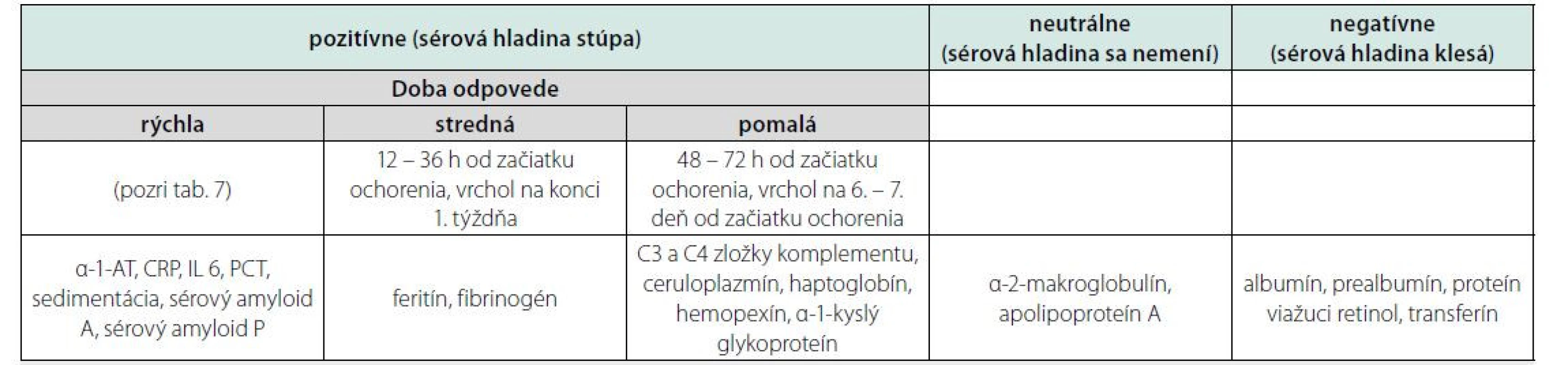
Zdroj: (15) Table 7. Doba odpovede CRP, PCT a IL 6 v čase v reakcii na zápal 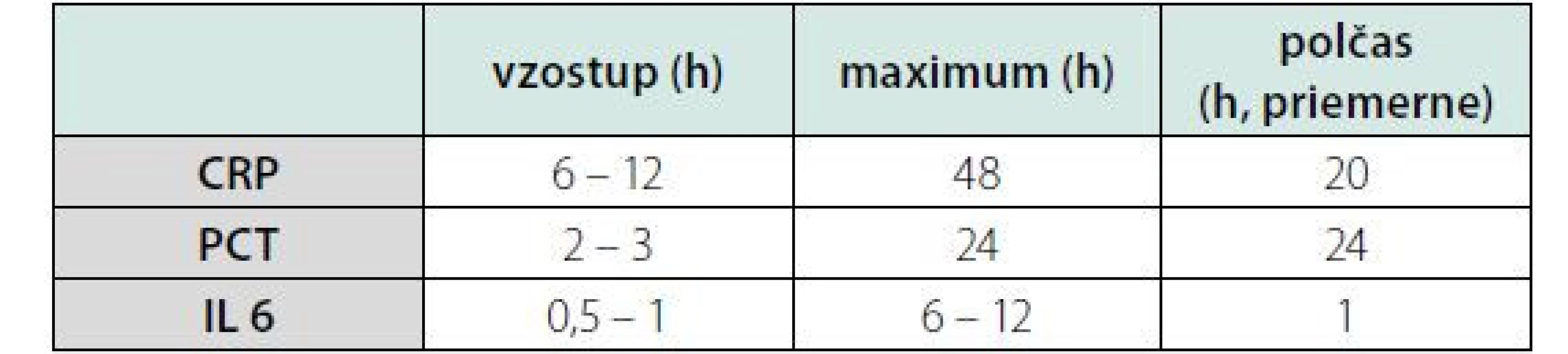
Zdroj: (15) Table 8. Kritická diferencia vybraných zápalových markerov 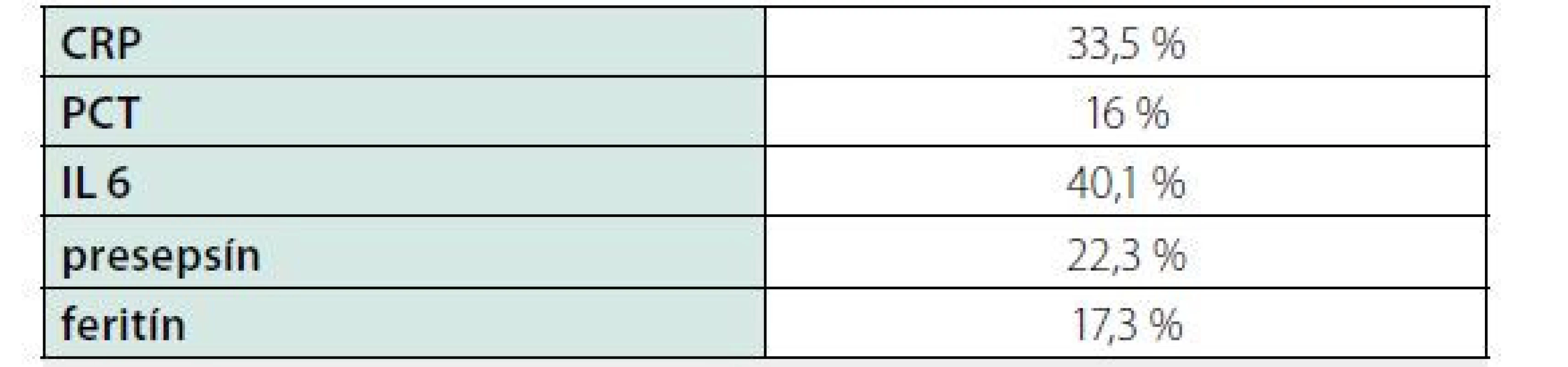
Zdroj: (23) KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Štefan Sotak, PhD., MPH, EMBA, LL.M
I. interná klinika UPJŠ LF a UN LP v Košiciach
Tr. SNP 1, 040 11 Košice
Cit. zkr: Vnitř Lék. 2022;68(7):E11-E16
Článek přijat redakcí: 30. 6. 2022
Článek přijat po recenzích: 7. 10. 2022
Sources
1. Koporcová J. Súčasná laboratórna diagnostika zápalových stavov. inVitro. 2015;3(1):28-32.
2. Kožíková K. Pozícia vyšetrenia CRP v indikácii ATB liečby v praxi všeobecného lekára. Košice: UNLP Košice 2011 [cit. 2020-10-25]. Dostupné z WWW: <http://www.unlp.sk/index.php?option=com_content & task=view & id=1173 & Itemid=95>.
3. Fadi FG, Szalai AJ. C‑Reactive Protein Gene Polymorphisms, C‑Reactive Protein Blood levels and Cardiovascular Disease Risk. JACC 2007;50(12):1115-1122.
4. Vermeire S, Van Assche G, Rutgeerts P. Laboratory markers in IBD: useful, magic or unnecessary toys? Gut. 2006;55(3):426–431.
5. Biasucci LM, Koenig W, Mair J et al. How to use C‑reactive protein in acute coronary care. EHJ. 2013;34(48):3687-3690.
6. Nehring SM, Goyal A, Bansal P et al. C Reactive Protein, 2020. [cit. 2021-05-16]. Dostupné z WWW: <https://pubmed.ncbi.nlm.nih.gov/28722873>.
7. John JM, Bhatt DL. Emerging risk factors for atherosclerosis. Indian Heart J. 2007;59 : 28-37.
8. Prasad K. C‑reactive Protein‑Lowering Agents. Cardiovasc Drug Rev. 2006;24(1):33-50.
9. Seifert B. Diagnostika CRP. 2006 [cit. 2020-10-25]. Dostupné z WWW: <https:// www.euni.cz/kurz/2210-diagnostika‑crp?presenter=Lecture>.
10. Liu HH, Guo JB, Geng Z. Procalcitonin: present and future. Ir J Med Sci. 2015;3(184):597 - 605.
11. Zazula R, Průcha M, Spálený A et al. Prokalcitonin nejen v diferenciální diagnostice zánětlivé odpovědi organismu. Anest Intenziv Med. 2002; 2 : 86-91.
12. Ban HJ, Ji SG, Chi SY et al. Usefulness of Serum procalcitonin in lung cancer patients with elevated serum C‑reactive protein level. BSJ. 2011;38(55):2803.
13. Fournier T, Medjoubi‑N N Porquet D. Alpha-1-acid glycoprotein. Biochem Biophys Acta. 2000;1482(1-2):157–171.
14. Ďurovcová E. CRP a iné markery zápalu v klinickej praxi. Interná med. 2019;19(9):341-346.
15. Vlniešková K. Biochemické zápalové markery. NEWSLAB. 2016;7(1):62-64.
16. Astigarraga I, Ollauri ‑ Ibanez C, Garcia‑Obregon S et al. Hyperferritinemia is a bad prognosis factor in COVID-19 patients and it is not specific for HLH in adults. PBC 2021;68(S1):covidwho-1107599.
17. Taher MY, Davies, DM, Maher J. The role of the interleukin (IL)-6/IL-6 receptor axis in cancer. Biochem Soc Trans. 2018;46(6):1449–1462.
18. Uhlar CM, Whitehead AS. Serum amyloid A, the major vertebrate acute‑phase reactant. Eur J Biochem. 1999;265(2):501-523.
19. Gregorová E, Klímová M. Laboratorní příručka. 2021. [cit. 2022-09-25]. Dostupné z WWW: <https://www.nempt.cz/files/lab_prirucka/_LP_01523.htm>.
20. Malle E, De Beer FC. Human serum amyloid A (SAA) protein: a prominent acute‑phase reactant for clinical practice. Eur J Clin Invest. 1996;26 : 427-435.
21. Yamada T. Serum amyloid A (SAA): a concise review of biology, assay methods and clinical usefulness. Clin Chem Lab Med. 1999;37 : 381-388.
22. Hogarth MB, Gallimore R, Savage P et al. Acute phase proteins, C‑reactive protein and serum amyloid A protein, as prognostic markers in the elderly inpatient. Age Ageing. 1997;26 : 153-158.
23. Jabor A, Franeková J, Kubíček Z. Principy interpretace laboratorních testů. 2nd ed. Grada Publishing, a. s.: Praha 2020. ISBN 9788027112722.
24. Zavyalov VP, Hämäläinen‑Laanaya H, Korpela TK et al. Interferon ‑ inducible myxovirus resistance proteins: potential biomarkers for differentiating Viral from Bacterial Infections. Clin Chem. 2019;65(6):739-750.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue E-7-
All articles in this issue
- Podiatric care from diabetologists point of view
- Inflammatory markers in clinical practice
- Pegvisomant in the treatment of acromegaly
- Primary cardiac synovial sarcoma mimicking SARS-CoV-2 associated pericarditis
- Differential diagnosis of leukocytosis and leukopenia
- Telemedicine, Innovative Technologies and Digital Health Working Group
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Differential diagnosis of leukocytosis and leukopenia
- Inflammatory markers in clinical practice
- Pegvisomant in the treatment of acromegaly
- Podiatric care from diabetologists point of view
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

