-
Medical journals
- Career
Léčba nemocnění asociovaného s imunoglobulinem IgG4
Authors: Zdeněk Adam 1; Milan Dastych 2; Aleš Čermák 3; Martina Doubková 4; Šárka Skorkovská 5; Luděk Pour 1; Zdeněk Řehák 6; Renata Koukalová 6; Zuzana Adamová 7; Martin Štork 1; Marta Krejčí 1; Ivanna Boichuk 1; Zdeněk Král 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Interní gastroenterologická klinika LF MU a FN Brno 2; Urologická klinika LF MU a FN Brno 3; Klinika nemocí plicních a tuberkulózy LF MU a FN Brno 4; Oční klinika LF MU a FN Brno 5; Oddělení nukleární medicíny, Masarykův onkologický ústav Brno 6; Oddělení chirurgie nemocnice Frýdek Místek a Chirurgické oddělení Vsetínské nemocnice 7
Published in: Vnitř Lék 2022; 68(E-6): 15-22
Category: Review Articles
doi: https://doi.org/10.36290/vnl.2022.086Overview
S imunoglobulinem IgG4 asociované onemocnění (IgG4-related disease – IgG4-RD) je heterogenní skupina chorob s multiorgánovým poškozením, která byla rozpoznána v posledních 12 letech. Cílem tohoto textu je podat přehled zkušeností s léčbou této choroby. Glukokortikoidy zůstávají stále léčbou první volby, ale dlouhodobé podávání glukokortikoidů v monoterapii je spojeno s četnými nežádoucími účinky a komplikacemi. V případě kombinace glukokortikoidů s některým z léků ze skupiny imunosupresiv je možné podávat nižší dávky glukokortikoidů po kratší čas a počet léčebných odpovědí je vyšší než při použití pouhých glukokortikoidů. Rituximab je možno použít jako monoterapii anebo v kombinaci s glukokortikoidy a imunosupresivními léky. Který z imunosupresivních léků považovat za nejvhodnější, není známo. Pouze jedna studie srovnávala léčbu kombinací glukokortikoidů a mykofenolát mofetilu s léčbou glukokortikoidy a cyklofosfamidem. Počet léčebných odpovědí byl v obou ramenech stejný, ale délka remise byla delší ve skupině pacientů léčených glukokortikoidy a cyklofosfamidem. Rituximab dosahuje vysoký počet léčebných odpovědí (90 %) i v monoterapii, ale je možné jeho účinek dále potencovat glukokortikoidy a imunosupresivy. Rituximab je nyní preferován a doporučován pro udržovací léčbu v dávce 1000 mg 1× za 6 měsíců. U pacientů s multiorgánovým postižením se nám osvědčila kombinace rituximabu, cyklofosfamidu a dexametazonu následovaná aplikací rituximabu s jednorázovou dávku dexametazonu v 6měsíčních intervalech.
V klinickém zkoušení jsou dva nové a nadějné léky: abatacept a dupilimab. Základem pro úspěšnou léčbu je podobně jako u jiných chorob časná diagnostika se zahájením léčby před vznikem ireversibilních fibrotických změn v postižených orgánech.
Klíčová slova:
sirolimus – imunosupresiva – glukokortikoidy – rituximab – takrolimus – S imunoglobulinem IgG4 asociované onemocnění – IgG4-related disease – dupilimab – abatacept
Úvod
S imunoglobulinem IgG4 asociovaná choroba, anglickým termínem immunobulin IgG4 related disease – IgG4-RD) je chronická, nemaligní, imunitním systémem vyvolaná choroba. Kód pro její klasifikaci se obtížně hledá, nalezli jsme kód mezinárodní klasifikace nemocí (MKN-10) D89.89, které se používá pro: „Other specified disorders involving the immune mechanism, not elsewhere classified“. Další kód, který jsme to tuto diagnózu našli, byl M35. Nemoc je natolik vzácná, že nemá zatím jasně ustálený kód, který by ji charakterizoval. Kód dle MKN-10 klasifikace je přitom vždy vyžadován, když píšeme žádost revizním lékařům o schválení léků na paragraf 16. Takže je důležité zavést kód, pod kterým bude tato nemoc v ČR evidována.
S imunoglobulinem IgG4 asociované choroba (neboli IgG4-RD) může postihnout kterýkoliv orgán, od mozkových plen a CNS, přes pankreatobiliární systém a hemopoetický systém až po prostatu. Příznaky nemoci jsme popsali v předchozím článku. Choroba totiž může postihnout snad všechny orgány těla, ale její histologická charakteristika, až na některé výjimky, je docela uniformní a jsou pro ni typické tyto znaky:
• storiformní fibróza,
• denzní lymfoplazmocytární infiltrace se zvýšeným počtem plazmatických buněk s pozitivním imunohistochemickým průkazem IgG4+ plazmatických buněk,
• obliterativní flebitida,
• tkáňová eozinofilie (granulomy, neutrofilní mikroabscesy a nekrotizující vaskulitida.
Etiologie, klinické projevy nemoci a diagnostická kritéria jak japonská, tak kritéria EULAR jsou uvedeny v přechozím článku časopisu Vnitřní lékařství.
V tomto článku se soustředíme na vývoj názorů na léčebné postupy. Před rozhodnutím o míře intenzity a délky léčby IgG4-RD je nutné, podobně jako před každou léčbou, stanovit rozsah postižení pomocí zobrazovacích metod. Čím více orgánů je postiženo, tím obtížněji se nemoc léčí a tím intenzivnější musí být léčba.
Základní informace přináší CT anebo MR zobrazení (1). Radionuklidové metody mají však výhodu ve stanovení nejen rozsahu choroby, ale i míry akumulace radiofarmaka v ložiscích neboli ve stanovení míry aktivity nemoci. V roce 2021 se považuje za klasickou vyšetřovací metodu FDG‑PET/ CT, tedy zobrazení s pomocí radiofarmaka fluorodeoxyglukózy (FDG) (2–4). V posledních letech začala být pro zobrazení používána speciální látka nazvaná „68Ga‑fibroblast activation protein inhibitor –FAPI“. PET/CT zobrazení s použitím tohoto nového radiofarmaka má větší citlivost pro detekci infiltrátů IgG4-RD (5, 6).
Po stanovení rozsahu nemoci je nutno udělat léčebný plán. Standardním postupem je dnes otevřít aktuální platná „doporučení pro léčbu“ vypracovaná na principech medicíny založené na důkazech (evidence based medicine) a orientovat se dle nich. Pokud však nejsou recentní, tak nutno nahlédnout do databáze medicínské literatury na publikace o léčbě nemoci z posledních let a přihlédnout k nim při plánování léčby konkrétního pacienta. Poslední mezinárodní doporučení pro léčbu je z roku 2015 (7) o dva roky později vyšlo doporučení vypracované autory z Atlanty (8). V roce 2020 vyšlo evropské doporučení pro léčbu IgG4-RD postihující trávicí trakt (9).
Z těchto tří doporučení vycházíme a připojujeme některé novější práce z oblasti léčby IgG4-RD. Tato nemoc se prolíná s četnými jinými chorobami, jak již bylo upozorněno v předchozím článku, mimo jiné se stává problémem pro hematology, protože se může překrývat s hypereozinofilním syndromem (10). Text o léčbě rozčleníme dle použitého léku.
Přehled léčby
Glukokortikoidy
Glukokortikoidy jsou léčbou první linie a absence léčebné odpovědi je důvodem k přezkoumání diagnózy. V rámci klinické studie 44 pacientů s IgG4-RD z Japonska bylo dosaženo 93 % léčebných odpovědí a 66 % kompletních remisí (11). Pacienti dostávali prednison v dávce 0,6 mg/kg/ den v iniciální dávce s postupným poklesem o 5 mg každé dva týdny (11). Názory na dávku prednisonu však nejsou jednotné. Některé práce popisují počáteční dávku prednisonu 30–40 mg denně, jiné pro iniciální léčbu používají vyšší dávky prednisonu, 0,6–1,0 mg/kg p. o. dobu 2–4 týdnů, a pak teprve následuje postupné snižování obvykle o 5 mg po 2 týdnech, respektive o 10 % dávky vždy po 2 týdnech. Celková doba glukokortikoidní léčby se pohybuje mezi 3–6 měsíci.
Po ukončení této tří až šestiměsíční iniciální léčby se uvádí možnost přejít na udržovací dávku 2,5–5 mg denně. Počet recidiv při této léčbě se pohybuje mezi 23–34 %. Agresivnější léčba se doporučuje v případě vysokých koncentrací IgG4, při multiorgánovém postižení, při léčbě recidiv a při postižení proximálních žlučových cest (7, 8).
Glukokortikoidy jsou účinnou léčbou zejména v iniciální, prefibrotické fázi nemoci, přičemž u části nemocných jsou účinné, pokud se použijí v rámci udržovací léčby. Někteří navrhují ponechat udržovací dávku 5 mg prednisonu hlavně v případě autoimunitní pankreatitidy, což by mělo snižovat počty relapsů v oblasti pankreatu (12).
Ale toxicita steroidů u pacientů s IgG4-RD není zanedbatelná, u 40 % z nich dochází k manifestaci diabetu mellitu či zhoršení kompenzace již stávajícího diabetu mellitu. Proto je třeba sledovat koncentrace glukózy v séru. A dlouhodobé podávání glukokortikoidů je spojeno s atrofií vaziva, zvýšenou fragilitou kůže, osteoporózou, vředovou nemocí gastroduodena atd. Takže léčebné odpovědi po monoterapii glukokortikoidy jsou často vykoupeny nežádoucími účinky glukokortikoidů.
Léky ze skupiny „disease‑modifying anti‑rheumatic drugs“ neboli imunosupresivních léků
Pro léčbu IgG4-RD jsou již mnoho let používány léky, které některé zahraniční práce nazývají „disease‑modifying anti‑rheumatic drugs -DMARDs, zatímco v jiných publikacích jsou tyto léky nazývány imunosupresivy. Lze tedy použít oba dva termíny. V textu budeme preferovat termín imunosupresiva, neboť je kratší. Patří sem: azathioprin, cyklosporin, mykofenolát mofetil (MMF), 6-merkaptopurin, cyklofosfamid, metotrexát, takrolimus.
První zprávy o účinnost kombinace výše uvedených léků s glukokortikoidy byly publikovány jako popisy případů či malé skupiny pacientů s IgG4-RD. Přidání kteréhokoliv z uvedených imunosupresivně působících léků umožnilo snížit kumulativní dávky glukokortikoidů a případně zkrátit interval podávání glukokortikoidů, a přesto dosáhnout vyššího počtu léčebných odpovědí než při použití monoterapie glukokortikoidy (13). Například v případě autoimunitní pankreatitidy byla účinná léčba s nižšími dávkami glukokortikoidů, než výše uvedeno, když byl přidán cyklosporin (14).
Přidání těchto imunosupresiv k iniciální léčbě umožní rychleji snižovat počáteční dávky dávku glukokortikoidů a snížit tak jejich kumulativní dávku. K dispozici je prospektivní studie, v níž bylo prokázáno, že léky ze skupiny DMARDs v kombinaci s glukokortikoidy vedly k vyššímu počtu remisi (93 %) ve srovnání s glukokortikoidy samotnými (79 %) po 6 měsících léčby. V čínské studii bylo hodnoceno 215 nově diagnostikovaných pacientů s IgG4-RD, kteří dostali v rámci iniciální léčby glukokortikoidy v monoterapii nebo v kombinaci s dalšími imunosupresivními léky a tito pacienti byli sledováni nejméně po dobu 6 měsíců. Z této skupiny nedošlo k léčebné odpovědi u 16 pacientů (20,8 %) léčených jen glukokortikoidy a 10 (7,2 %) pacientů, kteří měli glukokortikoidy v kombinaci s imunosupresivy. Pacienti, u kterých léčba selhávala, měli nejčastěji postiženy plíce a slzné žlázy. Čínští autoři uvádí, že riziko selhání léčby je vysoké u pacientů s postižením více než 5 orgánů, dakryadenitidou a eozinofilií. Pokud byly přítomny tři z uvedených faktorů, tak selhání glukokortikoidní monoterapie bylo u 71,4 % (15).
Konkrétně v této čínské studii dostávali pacienti prednison v dávce 0,5 až 1,0 mg/kg tělesné váhy denně (30 až 60 mg/den). Iniciální dávka byla podávána dva týdny až jeden měsíc a snižován o 5 mg za dva týdny na udržovací dávku 5 až 10 mg/den. Jako další lék k této léčbě by přidán u 138 pacientů cyklofosfamid, u 67 pacientů mycofenolát mofetil, u 47 pacientů methotrexát, u 12 azatioprin, u jednoho leflunomid a u jednoho cyklosporin A (15).
Tento výsledek potvrdila metaanalýza 15 observačních studií s celkem 1169 pacienty, pacienti s kombinovanou léčbou složenou z glukokortikoidů a z některého z léků ze skupiny DMARDs (neboli imunosupresiv) anebo s rituximabem měli vyšší počet léčebných odpovědí než při léčbě samotnými glukokortikoidy. Léčba samotnými glukokortikoidy měla nejvyšší počet relapsů. Nejméně relapsů bylo u pacientů, kteří dostávali rituximab v udržovací léčbě (16).
Který z léků ze skupiny DMARDs použít? Je poměrně hodně publikací, které popisují výsledky léčby glukokortikoidy s některým z uvedených léků ze skupiny imunosupresiv, cyklosporin (17), cyklofosfamid (18), mykofenolát mofetil (19), methotrexát (20). K dispozici je výše citovaná metaanalýza (16), ta ale nehodnotí, který z léků skupiny imunosupresiv je v této indikaci nejvhodnější.
V odborné literatuře je pouze jedna randomizovaná klinické studie srovnávající efekt přidaného mykofenolát mofetilu anebo cyklofosfamidu k základní léčbě glukokortikoidy. Počet léčebných odpovědí byl v obou ramenech této studie stejný, ale v případě použití cyklofosfamidu s glukokortikoidy měla léčebná odpověď delší trvání než pří kombinaci glukokortikoidů s mykofenolát mofetilem (21).
Rituximab
Glukokortikoidy nepůsobí cíleně na B‑buňky, mají mnohem širší spektrum nežádoucích účinků než antiCD20 monoklonální protilátka rituximab a nemají potenciál totálně přerušit patologickou imunitní reakci. Léčba protilátkou rituximab způsobuje v této situaci žádoucí B‑buněčnou depleci. Povrchový antigen CD20 se nachází pouze na B‑lymfocytech, proto rituximab výrazně sníží jejich počet. Tím se sníží množství buněk, z něhož se mohou rekrutovat IgG4 secernující plazmocyty. Poklesem počtu B‑buněk se také sníží jejich možné interakce s regulatorními T‑buňkami, a tím se zastaví profibrotická a proinflamatorní imunitní odpověď (22).
První zpráva o účinnosti rituximabu je z Bostonu z roku 2010, popisuje u prvního takto léčeného pacienta rychlý pokles IgG4 a ústup nemoci (23).
Stejný autor o dva roky později, v roce 2012, zveřejnil první studii, v níž bylo léčeno rituximabem celkem deset lidí. Ihned po léčbě bylo zlepšení pozorováno u 9 z 10 pacientů. V případně Riedlovy tyreoiditidy sice nedošlo k ústupu fibrotizace, ale ustoupily další projevy nemoci. U všech pacientů podání rituximabu umožnilo ukončení podávání steroidů a léků ze skupiny imunosupresiv a po podání rituximabu také signifikantně poklesla koncentrace IgG4. Ale již v této první studii u pacientů, jejichž nemoc po čase progredovala, podávali opakovaně rituximab v šestiměsíčních intervalech. Opakované podávání rituximabu vedlo k ústupu nemoci a opětovnému poklesu IgG4. Autoři této studie z roku 2012 upozorňují na fakt, že u některých pacientů s IgG4-RD může monoterapie rituximabem navodit dlouhodobou remisi, ale u nezanedbatelné části nemocných dochází k relapsům a je třeba udržovací léčby (24).
Na Mayo Clinic léčili 30 pacientů s IgG4-RD dvěma dávkami rituximabu (1000 mg), které podali ve 14denních intervalech a výsledky zveřejnili 2015. Pro hodnocení efektu léčby používali poměrně složitý systém. Zlepšení pozorovali u 97 % pacientů. Celkem 47 % nemocných se dostalo do kompletní remise při hodnocení po 6 měsících a 40 % zůstávalo v kompletní remisi po 12 měsících od léčby. U ostatních choroba recidivovala (25).
Francouzská databáze obsahuje 156 pacientů IgG4-RD. Z nich 33 bylo léčeno rituximabem a výsledky zveřejněny v roce 2017. Klinická léčebná odpověď byla pozorována u 29 z 31 (93,5 %) pacientů. U 17 (51,5 %) nemocných léčených rituximabem bylo možné po aplikaci rituximabu přerušit podávání glukokortikoidů. Během sledování po dobu 24 měsíců relabovala nemoc u 13 z 31 (41,9 %) pacientů, u nichž po iniciální léčbě byla potvrzena léčebná odpověď. Medián intervalu do relapsu byl 19 měsíců. Autoři proto doporučují udržovací léčbu rituximabem, která povede k delším bezpříznakovým obdobím a případně vyléčeni (26).
Německá studie obsahuje 46 pacientů, kteří byli léčeni alespoň základní dávkou rituximabu, za což považovali 4 aplikace v dávce 375 mg/ m2/týden, nebo dvě aplikace celkové dávky 1000 mg v intervalu 14 dní. Medián intervalu do relapsu po této léčbě byl 16 měsíců. Při mediánu sledování 71 (2–173) měsíců relabovala nemoc u 61 % takto léčených. U nich pak začali podávat udržovací dávky rituximabu v šestiměsíčních intervalech, čímž navrátili pacienty do remise (27).
Všechny tyto studie prokázaly tedy poměrně vysoký počet léčebných odpovědí po léčbě založené na rituximabu a obvykle i glukokortikoidech.
Rituximab lze podávat u IgG4-RD nejen s glukokortikoidy ale podobně jako u lymfomů i s dalšími léky. V případě hypofyzitidy a infiltrace očnice bylo dosaženo léčebné odpovědi léčebnou trojkombinací, azathioprin, glukokortikoid a rituximab (28).
U pacienta s agresivní manifestací v ORL oblasti byl k rituximabu a glukokortikoidům přidám cyklofosfamid a bylo dosaženo kompletní remise (29). Takže účinek Rituximabu u IgG4-RD je možné dále potencovat pomocí cyklofosfamidu nebo dalších léků ze skupiny imunosupresivně působících cytostatik (azathioprin) a je pravděpodobné, že touto léčbou dosažené remise budou mít delší trvání (21).
Mimo tyto výše citované klinické studie, které hodnotí přínos rituximabu pro pacienty s IgG4-RD, jsou v literatuře četné popisy případů potvrzující účinek této léčby ve všech možných lokalizacích této choroby. Poměrně hodně publikací popisuje léčebný efekt při postižení orbity, kdy dochází k ohrožení zraku (30–34).
Zcela ojedinělá je i zpráva o intraokulární aplikaci tohoto léku (35) stejně jako o intratekální aplikaci v případě hypertrofické pachymeningitidy (36). Pachymeningitida je jedním z možných projevů IgG4-RD a rituximab je účinný i v této indikaci (37) stejně jako při výjimečném projevu této nemoci, jako je hypofyzitida (38–40).
Postižení ORL oblasti obvykle způsobuje pacientům intenzivní problémy, a tak i zde byl použit rituximab s glukokortikoidy a případně s dalšími léky (29), a podobně v případě Riedlovy tyreoiditidy (41)
Rituximab byl účinný i při kožních manifestacích (42), dále v případně kombinace IgG4-RD a xatogranulomu (43) anebo IgG4-RD a Castlemanovy nemoci (44). Také v případě nefrologické manifestace, která se projevuje jako tubulointersticiální nefritida, vede léčba režimem obsahujícím rituximab k remisi nemoci (45–47).)
Choroba IgG4-RD byla objevena japonskými autory při hledání laboratorního markeru, který by odlišil imunitní pankreatitidu od neoplazie pankreatu, takže postižení pankreatu a biliárních cest bylo jednou z prvních rozpoznaných projevů této nemoci, a tak je také hodně publikací, potvrzujících účinek léčby založené na rituximabu v této indikaci (48–51) a podobné výsledky byly dosaženy u retroperitonální fibrózy (52–67).
Na našem pracovišti jsme pro léčbu pacientů s pokročilou chorobou a multiorgánovým postižením použili kombinaci rituximabu, cyklofosfamidu a dexametazonu (rituximab v dávce 375 mg/m2 infuze den 1 cyklu, dexametazon 20–40 mg jednorázově v infuzi den 1 a den 15 cyklu a cyklofosfamid 600 mg den 1 a den 15 cyklu. Těchto cyklů jsme aplikovali v měsíčních intervalech nejméně 6. U všech třech takto léčených pacientů nemoc kompletně ustoupila, jak ilustrují obrázky 1–3. V prvním případě však po 2 letech nemoc recidivovala, a tak jsme začali podávat udržovací léčbu rituximab 1000 mg v infuzi v intervalu šesti měsíců. Při této udržovací léčbě jsou dvě pacientky s touto nemocí bez recidivy.
Image 1. F–FD6 PET/CT vyšetření u pacientky s IgG4- RD a generalizovaným postižením. Červenými šipkami jsou označeny metabolicky aktivní infiltrace příušních slinných žláz, zvětšená aktivní uzlina paratracheální vpravo, metabolicky aktivní slezina, uzliny periportálně a uzliny podél zevních ilických cév oboustranně. Další nálezy: infiltrace v gll. submandibularis oboustranně, v dalších uzlinách mediastina, břicha i retroperitonea a presakrálně jsou patrny na MIP zobrazení, ale nejsou označeny. Všechna tato metabolicky aktivní ložiska při kontrolním vyšetření po léčbě rituximabem, cyklofosfamidem a dexametazonem zanikají. Jen v pravém laloku štítnice (označeno modře) se zvyšuje aktivita a při přešetření štítnice byl později prokázán papilokarcinom 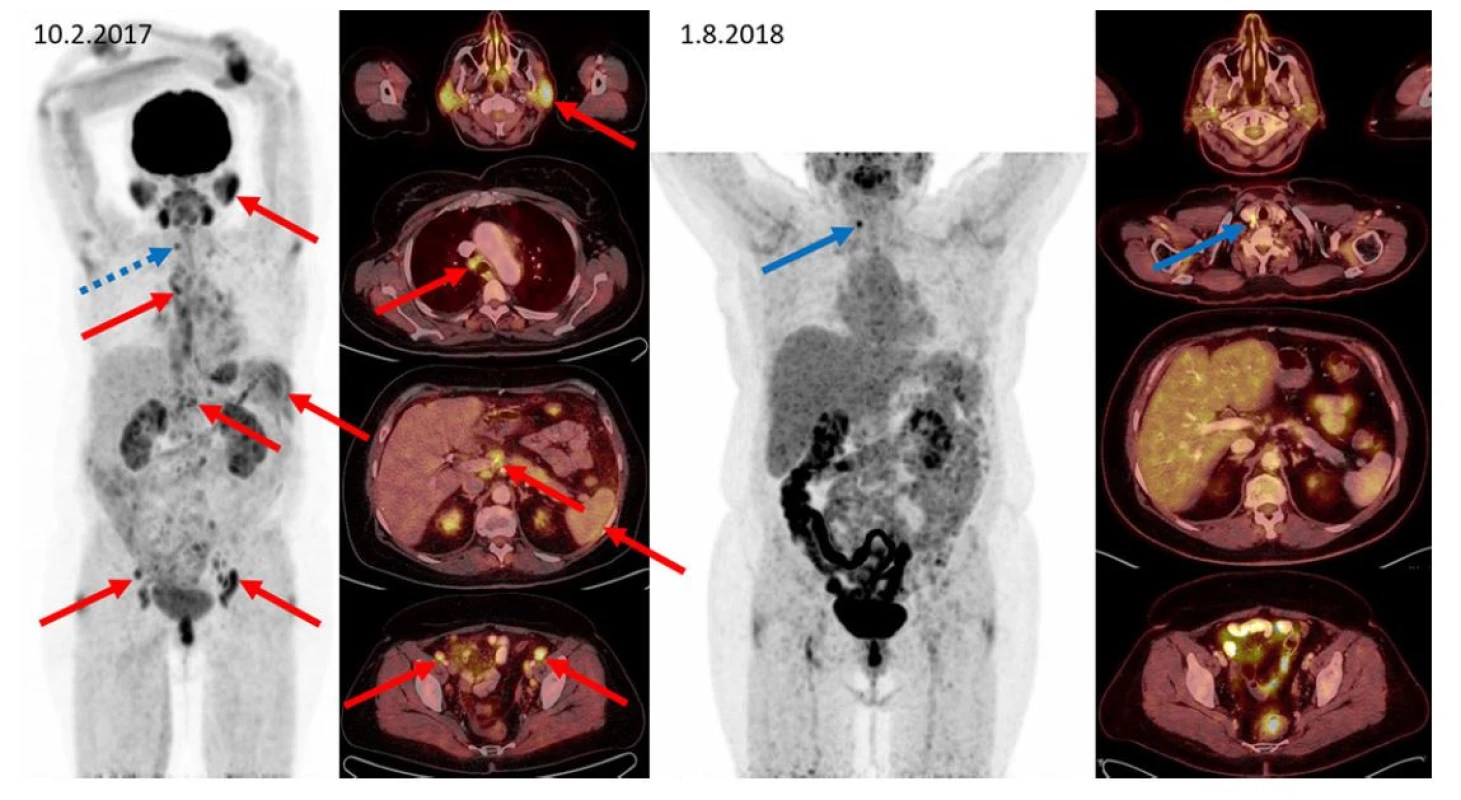
Image 2. F–FD6 PET/CT vyšetření u pacientky s bolestmi v dolní polovině břicha a zvětšením pankreatu. Šipkami jsou označeny metabolicky aktivní infiltrace příušních slinných žláz, zvětšená aktivní uzlina vpravo pod prsními svaly, infiltrace přechodu hlavy a těla pankreatu. Další méně výrazná ložiska (vlevo v gll. submandibularis, uzlinách na krku, kaudě pankreatu) jsou patrna na MIP zobrazení, ale nejsou označena. Tato metabolicky aktivní ložiska při kontrolním vyšetření zanikají, drobné reziduum bez zvýšené metabolické aktivity je patrné jen vpravo subpektorálně. Pacientka měla dva cytologické odběry z pankreatu, jeden vyšel jako zánět, druhý jako adenocarcinom. Vymizení infiltrace po léčbě rituximabem, cyklofosfamidem a dexametazonem potvrdilo etiologii v IgG4-RD a vyloučilo adenokarcinom pankreatu, který by na tuto léčbu nereagoval 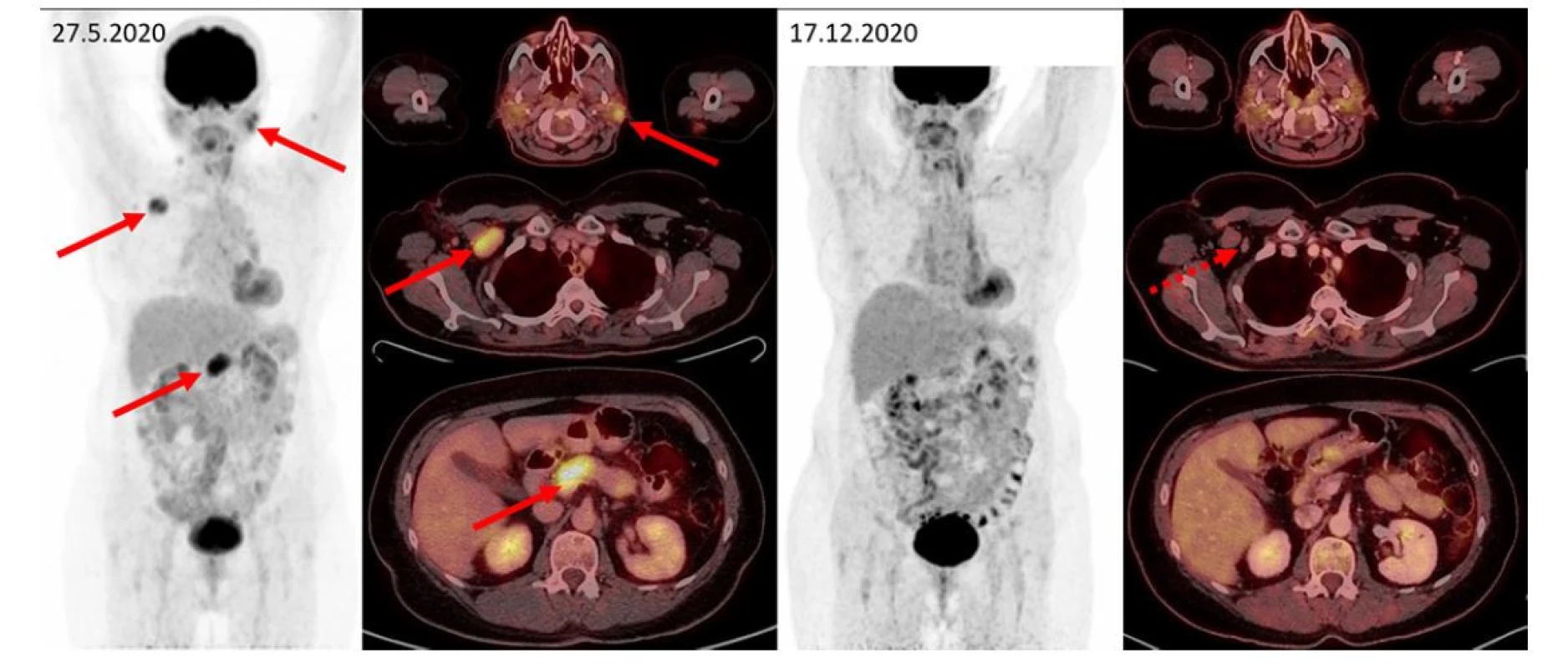
Image 3. F–FD6 PET/CT vyšetření u pacienta s ložiskem retroperitoneální fibrózy s histologicky potvrzenou diagnózou IgG4-RD. Šipkami jsou označeny kraniální i kaudální porce metabolicky aktivní infiltrace v retroperitoneu obkružující kaudální část břišní aorty, oblast bifurkace a dále odstup pravostranných společných ilických cév (v infiltrátu je zavzat pravostranný ureter s JJ stentem). Pacient byl léčen rituximabem, dexametazonem a cyklofosfamidem. Po této léčbě tato metabolicky aktivní infiltrace při kontrolním vyšetření zaniká. Další akumulace radiofarmaka v rámci variant fyziologického zobrazení 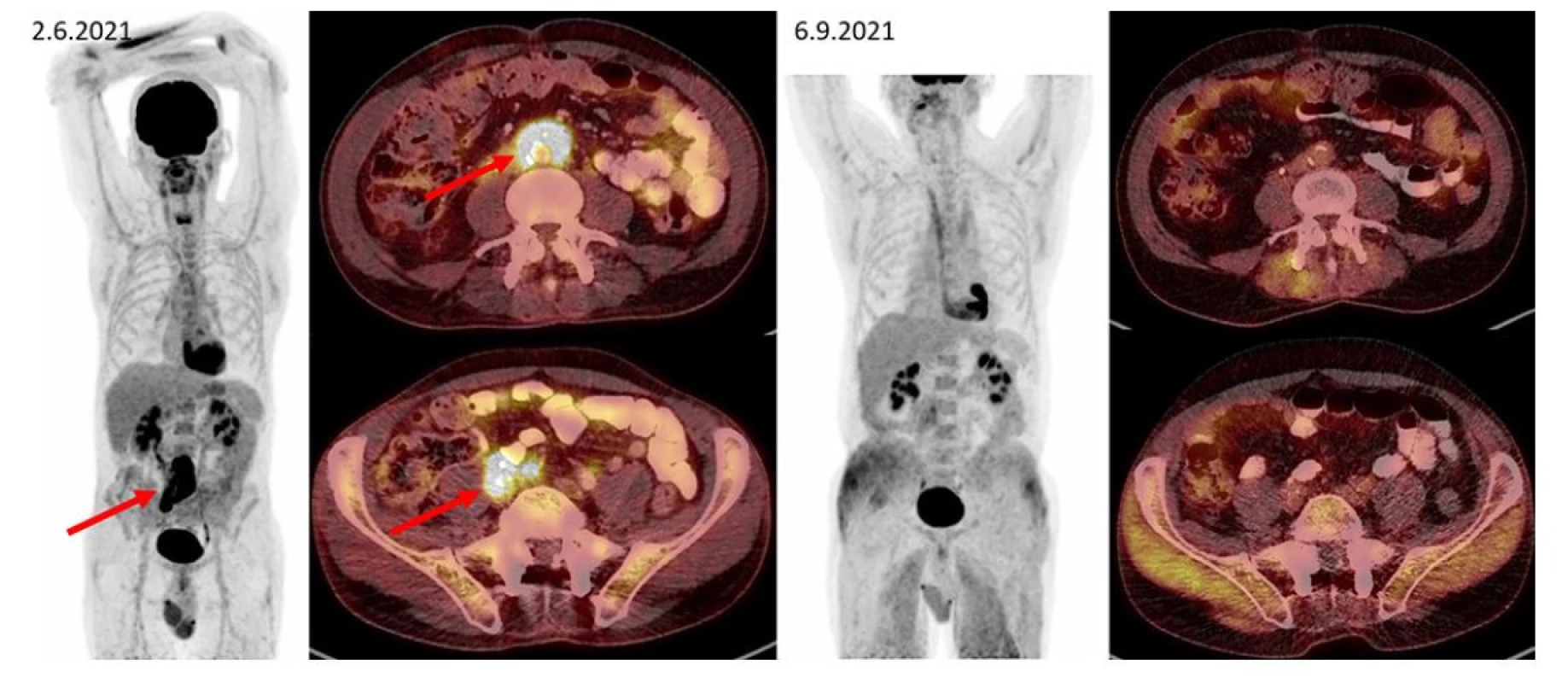
Udržovací léčba onemocnění asociovaného s imunoglobulinem IgG4
Mnoho prací tedy prokazuje, že rituximab s vysokou účinností a minimálními nežádoucími účinky dosahuje léčebné odpovědi. Poměr žádoucích a nežádoucích účinků je jednoznačně nejpříznivější ze všech léčebných alternativ. Jenže nemoc má tendenci po ukončené aplikaci rituximabu recidivovat (68, 69). A z toho vyplývá nutnost udržovací léčby, jak je zmíněna v první studii z roku 2012 (24).
Italská studie, do níž bylo zařazeno 14 pacientů, prokázala přínos udržovací léčby podávané v intervalu 6 měsíců, což odstranilo relapsy u takto léčených pacientů (70).
Studie z Mayo Clinic obsahuje již 40 pacientů, z toho 14 nedostalo udržovací léčbu a 26 pacientů dostávalo pravidelně udržovací léčbu rituximabem. Ve skupině bez udržovací léčby IgG4-RD relabovala neomc po 3 letech u 45 % pacientů, zatímco ve skupině s udržovací léčbou relabovalo jen 11 % pacientů. Proto doporučují udržovací léčbu (71), podobně jako japonští autoři (72).
V následujících letech budou klinické studie testovat optimální dávky rituximabu pro udržovací léčbu. Ale do klinických studií se nyní dostávají i biosimilars (73).
Další používané léky
V odborné lékařské literatuře jsou popsány i další úspěšné léčebné alternativy, i když zatím zcela výjimečně použité. Jedna publikace popsala úspěšnou léčbu bortezomibem (74) a monoklonální protilátkou anti‑TNF alfa (75). Účinek těchto dvou léků nebyl potvrzen dalšími publikacemi. V jedné zprávě byl popsán léčebný efekt sirolimu (76) a v dalších dvou pak takrolimu (77, 78).
Další vývoj léčby se odvíjí od postupného pronikání do patofyziologie této nemoci a snaží cílit na patofyziologicky nejdůležitější cíle. Zcela novým lékem je preparát jménem abatacept, cytotoxický fúzní protein cílený na T lymfocyty, který redukuje počet Tfh buněk a dosahuje dobrých léčebných odpovědí. Zatím nejsou však k dispozici prospektivní randomizované studie vyhodnocující účinek a tolerance abataceptu v této indikaci, ale u pacientů, kterým byl tento lék podán, byla popsána rychle nastupující léčebná odpověď (79, 80). S jednoznačným hodnocením přínosu tohoto léku u IgG4-RD je třeba vyčkat dalších zkušeností.
Naproti tomu preparát jménem dupilimab, což je monoklonální protilátka proti receptoru pro Il-4, má již ověřenou účinnost u této nemoci. Ve srovnání s abataceptem má užší cíl, jen blokádu Il-4, což je považováno za přednost (81–83). Indikace dupilimabu jsou zřejmě širší než jenom IgG4-RD (84).
Závěr
Podali jsme přehled zkušeností s léčbou této nemoci. Jak již v úvodu bylo napsáno, důležitou roli pro vyhodnocování efektivity léčby mají zobrazovací metody a speciální zobrazovací metody používající radionuklidy.
Pro sledování léčebné odpovědi se dále používá flow‑cytometrické monitorování počtu plazmablastů v periferní krvi. To však vyžaduje speciální vícebarevnou průtokovou cytometrii a zavedené hodnocení počtu plazmocytů a plazmablastů v periferní krvi i v kostní dřeni.
Pokud byla vstupně zvýšená koncentrace imunoglobulinu IgG4 v séru, což nemusí být vždy, pak je monitorování této koncentrace také součástí vyhodnocování léčby. Stanovení hodnoty IgG4 je ale dostupné pouze v laboratořích klinické imunologie a není prováděno v ČR v běžných biochemických laboratořích. Zvýšené koncentrace IgG4 však nejsou obligátní, u evropské populace provází zvýšení subtypu IgG4 asi 70 % případů IgG4-RD. Mírné zvýšení koncentrace IgG4 (1,5–5 g/l) je nespecifické, ale výrazné zvýšení (>5 g/l) je z 90 % specifické pro IgG4-RD. Podrobnosti o metodice stanovení IgG4 a interpretaci jejich hodnot je podrobně uvedené v článku Zity Chovancové: „IgG4 podtřída imunoglobulinů a s ní související patologické stavy aneb jak účinně imitovat nádorové onemocnění“ a v dalších publikacích (85, 86). Pro úspěch léčby je ale nejdůležitější, podobně jako je tomu u maligních chorob, časné stanovení diagnózy, protože počáteční stadia velmi dobře reagují na výše uvedené léčebné postupy, ale při pozdní diagnóze, kdy již dominují fibrotické změny v postižených orgánech, jsou tyto změny již špatně či málo ovlivnitelné. A tak časná diagnostika je základem pro úspěšnou léčbu i v případě IgG4-RD.
Publikace byla vytvořena na podporu těchto aktivit MZ ČR – RVO (FNBr, 65269705) a MOÚ: MZ ČR – RVO (MOÚ, 00209805)
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika, LF MU a FN Brno
Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék. 2022;68(6):E15-E22
Článek přijat redakcí: 1. 12. 2021
Článek přijat po recenzích: 11. 8. 2022
Sources
1. Fathala A. Multimodalities Imaging of Immunoglobulin 4-related Cardiovascular Disorders. Curr Cardiol Rev. 2019;15(3):224-229. doi: 10.2174/1573403X15666190117101607.
2. Mitamura K, Arai‑Okuda H, YamamotoY et al. Disease activity and response to therapy monitored by [18F]FDG PET/CT using volume‑based indices in IgG4-related disease. EJNMMI Res. 2020 Dec 9;10(1):153. doi: 10.1186/s13550-020-00743-w.
3. Vankadari K, Mittal BR, Kumar R et al. Isolated Involvement of Prostate Gland by Immunoglobulin G4-Related Disease Diagnosed With the Help of FDG PET/CT. Clin Nucl Med. 2019 Sep;44(9):e537-e539. doi: 10.1097/RLU.0000000000002689.
4. Martinez‑Pimienta G, Noriega‑Álvarez E, Simó‑Perdigó M. Study of systemic disease IgG4. Usefulness of 2-[18 F]-fluoro-2-deoxy‑D‑glucose -positron emission tomography/computed tomography for staging, selection of biopsy site, evaluation of treatment response and follow‑up. Eur J Rheumatol. 2017;4(3):222-225. doi: 10.5152/eurjrheum.2017.16118.
5. Luo Y, Pan Q, Yang H et al. Fibroblast Activation Protein - Targeted PET/CT with 68Ga‑FAPI for Imaging IgG4-Related Disease: Comparison to 18F‑FDG PET/ CT. J Nucl Med. 2021;62(2):266-271. doi: 10.2967/jnumed.120.244723.
6. Pan Q, Luo Y, Zhang W. Recurrent Immunoglobulin G4-Related Disease Shown on 18 F‑FDG and 68Ga‑FAPI PET/CT. Clin Nucl Med. 2020;45(4):312-313. doi: 10.1097/ RLU.0000000000002919. PMID: 31977476.
7. Khosroshahi A, Wallace ZS, Crowe JL et al. Second International Symposium on IgG - 4-Related Disease. International Consensus Guidance Statement on the Management and Treatment of IgG4-Related Disease.Arthritis Rheumatol. 2015;67(7):1688-99. doi: 10.1002/art.39132.
8. Abraham M, Khosroshahi A. Diagnostic and treatment workup for IgG4-related disease. Expert Rev Clin Immunol. 2017;13(9):867-875. doi:10.1080/1744666X.2017.1354698.)
9. Löhr JM, Beuers U, Vujasinovic M. UEG guideline working group.European Guideline on IgG4-related digestive disease – UEG and SGF evidence‑based recommendations. United European Gastroenterol J. 2020;8(6):637-666. doi: 10.1177/2050640620934911. Epub 2020 Jun 18.
10. Moussiegt A, Müller R, Ebbo M et al for French IgG4-RD Study Group. IgG4-related disease and hypereosinophilic syndrome: Overlapping phenotypes. Autoimmun Rev. 2021 Sep;20(9):102889. doi:10.1016/j.autrev.2021.102889. Epub 2021 Jul 5.
11. Masaki Y, Matsui S, Saeki T et al. A multi ‑ center phase II prospective clinical trial of glucocorticoid for patients with untreated IgG4-related disease. Mod Rheumatol. 2017;27(5):849–854.
12. Masamune A, Nishimori I, Kikuta K, et al. Randomised controlled trial of long‑term maintenance corticosteroid therapy in patients with autoimmune pancreatitis. Gut. 2017;66(3):487–494.
13. Hart PA, Topazian MD, Witzig TE et al. Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab: the Mayo Clinic experience. Gut. 2013;62(11):1607 – 1615.
14. Yoshikawa M, Muro Y, Ogawa‑Momohar, M.A. case with overlapping features of IgG4-related autoimmune pancreatitis, Sjögren’s syndrome and anti‑aminoacyl‑tRNA synthetase syndrome. Mod Rheumatol Case Rep. 2021 Jan;5(1):82-86. doi: 10.1080/24725625.2020.1816675.,
15. Wang L, Zhang P, Wang M et al. Failure of remission induction by glucocorticoids alone or in combination with immunosuppressive agents in IgG4-related disease: a prospective study of 215 patients. Arthritis Res Ther2018; 20 : 65. doi:10.1186/s13075-018-1567 - 2 pmid:29636109
16. Omar D, Chen Y, Cong Y, Dong L. Glucocorticoids and steroid sparing medications monotherapies or in combination for IgG4-RD: a systematic review and network meta‑nalysis[ Oxford]. Rheumatology (Oxford)2019;kez380. doi:10.1093/rheumatology/kez380
17. Bektaş M, Ağargün BF, Torun ES et al. Pure Red Cell Aplasia in IgG4-Related Disease: Successful Treatment With Cyclosporine. J Clin Rheumatol. 2020 Dec 14. doi: 10.1097/ RHU.0000000000001666. Epub ahead of print.
18. Yunyun F, Yu C, Panpan Z et al. Efficacy of cyclophosphamide treatment for immunoglobulin G4-related disease with addition of glucocorticoids. Sci Rep. 2017;7(1):6195-6198.
19. Yunyun F, Yu P, Panpan Z et al. Efficacy and safety of low dose Mycophenolate mofetil treatment for immunoglobulin G4-related disease: a randomized clinical trial. Rheumatology( Oxford). 2019;58(1):52-60. doi: 10.1093/rheumatology/key227.
20. Drobysheva A, Fuller J, Pfeifer CM, Rakheja D. Orbital Granulomatosis With Polyangiitis Mimicking IgG4-Related Disease in a 12-Year‑Old Male. Int J Surg Pathol. 2018 Aug;26(5):453 - 458. doi: 10.1177/1066896917754252.
21. Luo X, Peng Y, Zhang P et al. Comparison of the Effects of yclophosphamide and Mycophenolate Mofetil Treatment Against Immunoglobulin G4-Related Disease: A Retrospective Cohort Study. Front Med (Lausanne). 2020 Jul 7;7 : 253. doi: 10.3389/fmed.2020.00253.
22. Yamamoto M. B cell targeted therapy for immunoglobulin G4-related disease. Immunol Med. 2021 Feb 14 : 1-7. doi: 10.1080/25785826.2021.1886630.
23. Khosroshahi A, Bloch DB, Deshpande V et al. JH. Rituximab therapy leads to rapid decline of serum IgG4 levels and prompt clinical improvement in IgG4-related systemic disease. Arthritis Rheum 2010;62(6):1755-1762.
24. Khosroshahi A, Carruthers MN, Deshpande V et al. Rituximab for the treatment of IgG - 4-related disease: lessons from 10 consecutive patients. Medicine (Baltimore). 2012;91(1):57 - 66.
25. Carruthers MN, Topazian MD, Khosroshahi A et al. Rituximab for IgG4-related disease: a prospective, open ‑ label trial. Ann Rheum, DiS. 2015;74(6):1171–1177.
26. Ebbo M, Grados A, Samson M, et al. Long‑term efficacy and safety of rituximab in Ig - G4-related disease: Data from a French nationwide study of thirty‑three patients. PLoS One 2017;12(9):e0183844. Published online 2017 Sep 15. doi: 10.1371/journal.pone.0183844
27. Backhus J, Neumann C, Perkhofer L et al. A Follow‑Up Study of a European IgG4-Related Disease Cohort Treated with Rituximab. J Clin Med. 2021;10(6):1329. doi: 10.3390/ jcm10061329.
28. Gu WJ, Zhang Q, Zhu J et. al. Rituximab was used to treat recurrent IgG4-related hypophysitis with ophthalmopathy as the initial presentation: A case report and literature review. Medicine (Baltimore) 2017;96(24):e6934.
29. Shao SAN, Chia‑der LIN, Sheng‑ta TSAI et al. Immunoglobulin G4-Related Disease Presented as Recurrent Otitis Media and Mixed Hearing Loss Treated With cyclophosphamide and Rituximab: Arch Rheumatol. 2019;34 (2):233–237.
30. Wu A, Andrew NH, Tsirbas A et al. Rituximab for the treatment of IgG4-related orbital disease: experience from five cases. Eye (Lond) 2015;29 (1):122-128.
31. Aouidad I, Schneider P, Zmuda M et al. IgG4-Related Disease With Orbital Pseudotumors Treated With Rituximab Combined With Palpebral Surgery. JAMA Dermatol 2017; 153(3):355-356.
32. Berta AI, Agaimy A, Braun JM, et al. Bilateral Orbital IgG4-Related Disease with Systemic and Corneal Involvement Showing an Excellent Response to Steroid and Rituximab Therapy: Report of a Case with 11 Years Follow‑Up. Orbit 2015;34(5): 299-301.
33. Caso F, Fiocco U, Costa L et al. Successful use of rituximab in a young patient with immunoglobulin G4-related disease and refractory scleritis. Joint Bone Spine. 2014; 81(2):190-192.
34. Chen TS, Figueira E, Lau OC et al. Successful „medical“ orbital decompression with adjunctive rituximab for severe visual loss in IgG4-related orbital inflammatory disease with orbital myositis. Ophthal Plast Reconstr Surg. 2014;30(5):e122-125.
35. Savino G, Battendieri R, Siniscalco A et al. Intraorbital injection of Rituximab in idiopathic orbital inflammatory syndrome: case reports. Rheumatol Int. 2015;35(1): 183-188.,
36. Della‑Torre E, Campochiaro C, Cassione EB et al. Intrathecal rituximab for IgG4-related hypertrophic pachymeningitis. J Neurol Neurosurg Psychiatry2018; 89 : 441-444. doi:10.1136/ jnnp-2017-316519 pmid:28819060
37. Mageau A, Shor N, Fisselier M, et al. Rituximab for corticosteroid‑resistant relapsing Ig - G4-related intracranial pachymeningitis: report of two cases. Pract Neurol. 2018;18(2):159 - 161. doi: 10.1136/practneurol-2017-001826.
38. Gu WJ, Zhang Q, Zhu J, et. al. Rituximab was used to treat recurrent IgG4-related hypophysitis with ophthalmopathy as the initial presentation: A case report and literature review. Medicine (Baltimore) 2017 : 96(24 :e6934.)
39. Bullock DR, Miller BS, Clark HB, Hobday PM. Rituximab treatment for isolated IgG4-related hypophysitis in a teenage female. Endocrinol Diabetes Metab Case Rep. 2018;2018 : 18 - 0135. doi: 10.1530/EDM-18-0135. Epub 2018 Dec 28.
40. Boharoon H, Tomlinson J, Limback‑Stanic C et al. A Case Series of Patients with Isolated IgG4-related Hypophysitis Treated with Rituximab. J Endocr Soc. 2020 Apr 21;4(6):bvaa048. doi: 10.1210/jendso/bvaa048.
41. Mammen SV, Gordon MB. Succesful use of rituximab in case of Riedel thyreoiditis A resistant to treatment with prednisone and tamoxifem. AACE Clin Case Rep. 2019 Apr 25;5(3):e218-e221. doi: 10.4158/ACCR-2018-0352.
42. Jalilian C, Prince HM, McCormack C et al. IgG4-related disease with cutaneous manifestations treated with rituximab: case report and literature review. Australas J Dermatol. 2014;55 (2):132-136.
43. Pomponio G, Olivari D, Mattioli M et al. Sustained clinical response after single course of rituximab as first ‑ line monotherapy in adult‑onset asthma and periocular xanthogranulomas syndrome associated with IgG4-related disease: A case report. Medicine (Baltimore). 2018;97(26):e11143. doi: 10.1097/MD.0000000000011143
44. Mochizuki H, Kato M, Higuchi T et al. Overlap of IgG4-related Disease and Multicentric Castleman’s Disease in a Patient with Skin Lesions. Intern Med 2017;56 (9):1095-1099.
45. McMahon BA, Novick T, Scheel PJ et al. Rituximab for the Treatment of IgG4-Related Tubulointerstitial Nephritis: Case Report and Review of the Literature. Medicine (Baltimore) 2015;94 (32) e1366.
46. Quattrocchio G, Barreca A, Demarchi A et al. IgG4-related kidney disease: the effects of a Rituximab‑based immunosuppressive therapy. Oncotarget. 2018;9(30):21337–21347. doi: 10.18632/oncotarget.25095.
47. Eroglu E, Sipahioglu MH, Senel S et al. Successful treatment of tubulointerstitial nephritis in immunoglobulin G4-related disease with rituximab: A case report. World J Clin Cases. 2019;7(16):2309-2315. doi:
48. Lanzillotta M, Della‑Torre E, Wallace ZS et al. Efficacy and safety of rituximab for IgG - 4-related pancreato‑biliary disease: A systematic review and meta‑analysis. Pancreatology. 2021 Oct;21(7):1395-1401. doi:10.1016/j.pan.2021. 06. 009. Epub 2021 Jul 3. PMID: 34244040.
49. Gillispie MC, Thomas RD, Hennon TR. Successful treatment of IgG-4 related sclerosing disease with rituximab: a novel case report. Clin Exp Rheumatol 2015;33 (4):549-550.
50. Nikolic S, Panic N, Hintikka ES et al. Efficacy and safety of rituximab in autoimmune pancreatitis type 1: our experiences and systematic review of the literature. Scand J Gastroenterol. 2021;56(11):1355-1362. doi: 10.1080/00365521.2021.1963837. Epub 2021 Aug 19.
51. Terumi Kamisawa, Takahiro Nakazawa, Susumu Tazuma, et al. Clinical practice guidelines for IgG4-related sclerosing cholangitis. J Hepatobiliary Pancreat Sci. 2019 Jan; 26(1): 9–42.
52. Peisen F, Thaiss WM, Ekert K et al. Retroperitoneal Fibrosis and its Differential Diagnoses: The Role of Radiological Imaging. Rofo. 2020;192(10):929-936. doi: 10.1055/a-1181-9205. Epub 2020 Jul 22. PMID:32698236.
53. Kawano M, Saeki T, Nakashima H. IgG4-related kidney disease and retroperitoneal fibrosis: An update. Mod Rheumatol. 2019;29(2):231-239. doi:10.1080/14397595.2018.15543 21. Epub 2019 Jan 8.
54. Forestier A, Buob D, Mirault T et al. No specific imaging pattern can help differentiate IgG4-related disease from idiopathic retroperitoneal fibrosis: 18 histologically proven cases. Clin Exp Rheumatol. 2018;36(3):371-375.
55. Raglianti V, Rossi GM, Vaglio A. Idiopathic retroperitoneal fibrosis: an update for nephrologists. Nephrol Dial Transplant. 2021;36(10):1773-1781.doi: 10.1093/ndt/gfaa083.
56. Wallwork R, Wallace Z, Perugino C et al. Rituximab for idiopathic and IgG4-related retroperitoneal fibrosis. Medicine (Baltimore). 2018;97(42):e12631. doi: 10.1097/ MD.0000000000012631.
57. Boyeva V, Alabsi H, Seidman MA et al. Use of rituximab in idiopathic retroperitoneal fibrosis. BMC Rheumatol. 2020;4 : 40. doi: 10.1186/s41927-020-00140-9. PMID: 32775962;
58. Almeqdadi M, Al‑Dulaimi M, Perepletchikov A, et al. Rituximab for retroperitoneal fibrosis due to IgG4-related disease: A case report and literature review. Clin Nephrol Case Stud. 2018 Apr 27;6 : 4-10. doi 10.5414/CNCS109321
59. Hamdan A, Moeen Z, Tariq H et al. An Interesting Case of Immunoglobulin G4-Related Retroperitoneal Fibrosis Treated With Rituximab. Cureus. 2021 Sep 13;13(9):e17940. doi:10.7759/cureus.17940.
60. Rossi GM, Rocco R, Accorsi Buttini E et al. Idiopathic retroperitoneal fibrosis and its overlap with IgG4-related disease. A. Intern Emerg Med. 2017;12 : 287–299.
61. Kermani TA, Crowson CS, Achenbach SJ. Idiopathic retroperitoneal fibrosis: a retrospective review of clinical presentation, treatment, and outcomes. Mayo Clin Proc. 2011;86 : 297–303.
62. Marcolongo R, Tavolini IM, Laveder F et al. Immunosuppressive therapy for idiopathic retroperitoneal fibrosis: a retrospective analysis of 26 cases. Am J Med. 2004;116 : 194–197
63. Scheel PJ, Feeley N, Sozio SM Combined prednisone and mycophenolate mofetil treatment for retroperitoneal fibrosis: a case series. Ann Intern Med. 2011;154 : 31–36.
64. Marzano A, Trapani A, Leone N et al. Treatment of idiopathic retroperitoneal fibrosis using cyclosporin. Ann Rheum, DiS. 2001;60 : 427–428.
65. Fenaroli P, Maritati F, Vaglio A. Into Clinical Practice: Diagnosis and Therapy of Retroperitoneal Fibrosis. Curr Rheumatol Rep. 2021 Feb 10;23(3):18. doi: 10.1007/s11926-020 - 00966-9. PMID: 33569638.
66. Nikiphorou E, Galloway J, Fragoulis GE. Overview of IgG4-related aortitis and periaortitis. A decade since their first description. Autoimmun Rev. 2020 Dec;19(12):102694. doi: 10.1016/j.autrev.2020.102694.
67. Marvisi C, Accorsi Buttini E, Vaglio A. Aortitis and periaortitis: The puzzling spectrum of inflammatory aortic diseases. Presse Med. 2020 Apr;49(1):104018. doi: 10.1016/j. lpm.2020.104018.
68. Shinoda K, Taki H, Sugiyama T. Recurrence of IgG4-related disease following treatment with rituximab. Mod Rheumatol. 2013; 23 (6): 1226-1230.
69. Wallace ZS, Mattoo H, Mahajan VS et al. Predictors of disease relapse in IgG4-related disease following rituximab. Rheumatology (Oxford) 2016; 55 (6): 1000-1008
70. Campochiaro C, Della‑Torre E, Lanzillotta M et al. Long‑term efficacy of maintenance therapy with Rituximab for IgG4-related disease. Eur J Intern Med 2019; S0953 - 6205(19)30467-4. doi:10.1016/j.ejim.2019. 12. 029
71. Majumder S, Mohapatra S, Lennon RJ et al. Rituximab Maintenance Therapy Reduces Rate of Relapse of Pancreaticobiliary Immunoglobulin G4-related Disease. Clin Gastroenterol Hepatol. 2018;16(12):1947-1953. doi: 10.1016/j.cgh.2018. 02. 049.
72. Yamamoto M, Awakawa T, Takahashi H. Is rituximab effective for IgG4-related disease in the long term? Experience of cases treated with rituximab for 4 years. Ann Rheum, DiS. 2015; 74 (8):e46.
73. Della‑Torre E, Lanzillotta M, Campochiaro C et al. Efficacy and safety of rituximab biosimilar (CT‑P10) in IgG4-related disease: an observational prospective open ‑ label cohort study. Eur J Intern Med. 2021 Feb;84 : 63-67. doi: 10.1016/j.ejim.2020. 12. 006.
74. Khan ML, Colby TV, Viggiano RW, Fonseca R. Treatment with bortezomib of a patient having hyper IgG4 disease. Clin Lymphoma Myeloma Leuk. 2010; 10(3):217-219.
75. Jalaj S, Dunbar K, Campbell A et al. Treatment of Pediatric IgG4-Related Orbital Disease With TNF ‑ α Inhibitor. Plast Reconstr Surg. 2018 Jan/Feb;34(1):e10-e12.
76. Poo SX, Pepper RJ, Onwordi L et al. Sirolimus use in patients with subglottic stenosis in the context of granulomatosis with polyangiitis (GPA), suspected GPA, and immunoglobulin G4-related disease. Scand J Rheumatol. 2021;50(1):52-57. doi:10.10 80/03009742.2020.1777324.
77. Takanashi S, Kaneko Y, Takeuchi T. Effectiveness of takrolimus on IgG4-related disease. Mod Rheumatol. 2019;29(5):892-894. doi:10.1080/14397595.2018.1532560.
78. Peng L, Zhang P, Zhang X, et al. Clinical features of immunoglobulin G4-related disease with central nervous system involvement: an analysis of 15 cases. Clin Exp Rheumatol. 2020;38(4):626-632. Epub 2020 Feb 14. P
79. Yamamoto M, Takahashi H, Takano K et al. Efficacy of abatacept for IgG4-relateddisease over 8 months. Ann Rheum, DiS. 2016;75(8):1576-8. doi:10.1136/annrheumdis-2016-209368.
80. Lanzillotta M, Fernàndez‑Codina A, Culver E et al. Emerging therapy options for Ig - G4-related disease.Expert Rev Clin Immunol. 2021 May;17(5):471-483. doi:10.1080/17446 66X.2021.1902310.
81. Della‑Torre E, Lanzillotta M, Yacoub MR. Dupilumab as a potential steroid‑sparing treatment for IgG4-related disease. Ann Rheum, DiS. 2020 Jan14: annrheumdis-2020-216945. doi: 10.1136/annrheumdis-2020-216945. Epub ahead of print.
82. Yamamoto M, Yoshikawa N, Tanaka H. Efficacy of dupilumab reveals therapeutic target for IgG4-related disease: simultaneous control of inflammation and fibrosis. Ann Rheum, DiS. 2020 Feb 7:annrheumdis-2020-217076. doi: 10.1136/annrheumdis-2020-217076. Epub ahead of print.
83. Simpson RS, Lau SKC, Lee JK. Dupilumab as a novel steroid‑sparing treatment for IgG4-related disease. Ann Rheum, DiS. 2020 Apr;79(4):549-550. doi 10.1136/annrheumdis - 2019-216368. Epub 2019 Dec 19. PMID: 31857343.
84. Hoy SM. Dupilumab: A Review in Chronic Rhinosinusitis with Nasal Polyps. Drugs. 2020 May;80(7):711-717. doi: 10.1007/s40265-020-01298-9. PMID: 32240527
85. Chovancová Z. IgG4 podřída imunoglobulinů a s ní související patologické stavy aneb jak účinně imitovat nádorové onemocnění. Klinická onkologie, přijato do tisku.
86. Chovancová Z. Immunosenescence - the sunset over the immune system. Vnitř. Lék.2020;66(6):353-358.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue E-6-
All articles in this issue
- Evaluation of medication errors in the hospital environment
- Clinical experience with the use of newer antibiotics in internal medicine
- Therapy of immunoglonuline IgG4 related disease (IgG4-RD)
- New onset of diabetes mellitus and weight loss as a manifestation of pancreatic cancer
- EFIM Academy
- European Summer School of Internal Medicine (12.–18. 6. 2022, El Escorial, Madrid, Španělsko)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Evaluation of medication errors in the hospital environment
- Clinical experience with the use of newer antibiotics in internal medicine
- Therapy of immunoglonuline IgG4 related disease (IgG4-RD)
- New onset of diabetes mellitus and weight loss as a manifestation of pancreatic cancer
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

