-
Medical journals
- Career
SGLT-2 inhibice užitečným nástrojem v léčbě srdečního selhání se sníženou i zachovalou ejekční frakcí
Authors: Jiří Slíva
Authors‘ workplace: Ústav farmakologie, 3. lékařská fakulta UK, Praha
Published in: Vnitř Lék 2022; 68(6): 393-397
Category: Review Articles
doi: https://doi.org/10.36290/vnl.2022.080Overview
Srdeční selhání je v populaci vysoce prevalentní a z dlouhodobého hlediska prognosticky stále obtížně léčitelné onemocnění. Jakkoliv se v jeho léčbě nabízí řada medikamentózních řešení, jsou zde stále velké rezervy. Lékové portfolio bylo recentně rozšířeno o využití inhibitorů SGLT-2, zprvu u selhání se sníženou a nyní i se zachovalou ejekční frakcí. V textu je diskutována otázka možnosti využití těchto látek, a to se zaměřením na možné vysvětlení jejich terapeutického přínosu.
Klíčová slova:
srdeční selhání – glifloziny – empagliflozín – SGLT-2 – ejekční frakce
Úvod
Srdeční selhání (HF) je klinický syndrom charakterizovaný poruchou plnění komor s odpovídající ejekcí krve, jejímž důsledkem je neschopnost srdce zajistit adekvátní perfuzi tkání při zachování normálních srdečních plnících tlaků. HF je spojeno s řadou vzájemně souvisejících strukturálních, funkčních a neurohumorálních změn s prospěšnými i maladaptivními účinky. Právě na základě aktuálně zjištěné hodnoty ejekční frakce levé komory (LVEF) rozlišujeme HF se zachovalou (preserved, HFpEF), nebo sníženou (reduced, HFrEF) ejekční frakcí.
Zatímco mortalita v důsledku ischemické choroby srdeční v posledních dekádách ve vyspělých zemích zvolna klesá, bohužel opak je pravdou pro srdeční selhání. V ČR, stejně tak jako v jiných zemích EU, trpí srdečním selháním 1 až 2 % populace, přičemž v populaci starší 70 let jde až o 10 %. V celosvětovém měřítku se pak odhaduje okolo 60 milionů nemocných.
V rámci farmakoterapie je využíváno plejády léčivých látek z několika lékových skupin. Klíčové je využívání diuretik, látek potlačujících aktivitu systému renin‑angiotensin‑aldosteron (RAAS) a beta‑blokátorů. U mnoha nemocných je stále využíván kardiotonicky působící digoxin, své uplatnění nachází ivabradin či fixní kombinace inhibitoru neprilysinu, sakubitrilu, s valsartanem. Mnozí nemocní vyžadují odpovídající antikoagulační léčbu, nasazení antiarytmik aj. V posledních letech do farmakoterapeutického armamentaria překvapivě pronikla podskupina perorálních antidiabetik s inovativním mechanismem účinku známá jako glykosurika či glifloziny neboli SGLT-2 inhibitory. Ostatně dapagliflozin je prvním představitelem, jenž byl na evropském trhu schválen k léčbě HFrEF pro jasně prokázaný klinický přínos na základě výsledků studie DAPA‑HF (n = 4 744; NYHA II‑IV). Při mediánu 18,2 měsíce se primárně sledovaný kompozitní ukazatel (zhoršení srdečního selhání nebo úmrtí z KV příčiny) vyskytl u 386 z 2373 pacientů (16,3 %) ve skupině s dapagliflozinem a u 502 z 2371 pacientů (21,2 %) ve skupině s placebem – HR: 0,74 (95% CI: 0,65 až 0,85; p < 0,001) (1). Jasně prokazatelný klinický přínos byl ve stejné indikaci prokázán též u empagliflozinu, jenž navíc prokázal terapeutický přínos i u osob se srdečním selháním při ejekční frakci nad 40 %, a právě v této indikaci mu bylo koncem letošního ledna Komisí pro humánní léčivé přípravky (CHMP) při Evropské lékové agentuře (EMA) vydáno kladné stanovisko, na základě kterého je jako první zástupce své skupiny registrován v indikaci HFpEF. Pro úplnost uveďme, že aktuálně očekáváme výsledky klinické studie DELIVER s dapagliflozinem 10 mg u pacientů s HFpEF s EF > 40 %.
Stručně k patologii srdečního selhání
HFpEF je charakterizována normální LVEF, normálním enddiastolickým objemem levé komory a abnormální diastolickou funkcí, často s koncentrickou remodelací nebo hypertrofií komory, ovšem někdy i s normální geometrií komor. Dominantní abnormalita tedy spočívá v diastole, jakkoliv existují abnormality v systolické funkci, levé síni, plicním řečišti, pravé komoře, tepnách a kosterní svalovině. Většina autorit definuje HFpEF jako LVEF ≥ 50 % (2, 3).
Naproti tomu je HFrEF charakterizováno hlubšími abnormalitami v systolické funkci, než jaké jsou pozorovány u HFpEF, obvykle s progresivní dilatací komory a excentrickou remodelací. HFrEF je nyní nejčastěji definována LVEF ≤ 40 % (3, 4). Z klinického pohledu se často zmiňuje i třetí skupina pacientů se střední nebo mírně sníženou LVEF (HFmrEF), u kterých se zdá, že sdílejí rysy HFrEF i HFpEF. I když v této kohortě existuje jen málo prospektivních studií, některá data naznačují, že klinický průběh onemocnění u těchto pacientů je nejvíce podobný pacientům s HFrEF (5, 6).
HFrEF a HFpEF jsou odlišné syndromy, nikoli spojité spektrum poruch (4). Rozdíly mezi HFpEF a HFrEF zahrnují epidemiologické rozdíly, morfologické rozdíly levé komory a také rozdíly v kardiomyocytech a extracelulární matrix (7). Přechod HFpEF do HFrEF je neobvyklý, a jestliže nastane, pak je to např. z důvodu infarktu myokardu či jiné obdobně významné léze. Jak již bylo zmíněno výše, HFpEF je často spojena s koncentrickou remodelací, která postihuje primárně levou komoru (dále však též levou síň i pravou komoru), avšak řada nemocných s jednoznačným hemodynamickým průkazem HF takovou remodelaci postrádá. To ovšem diagnózu HFpEF nevylučuje. Naproti tomu pacienti s HFrEF typicky vykazují vzor excentrické remodelace se zvýšením enddiastolického objemu, zvýšením hmoty LK, ale malým zvýšením tloušťky stěny a podstatným snížením poměru hmoty k objemu a tloušťky k poloměru (2, 4).
Uvedené rozdíly mají i své mikroskopické koreláty. U HFpEF kardiomyocyt vykazuje zvětšený průměr s malou nebo žádnou změnou délky, což odpovídá zvětšení tloušťky stěny komory beze změny jejího objemu. Naproti tomu u HFrEF jsou kardiomyocyty prodloužené s malou nebo žádnou změnou v průměru, což odpovídá zvětšení objemu beze změny tloušťky stěny komory. U HFpEF někdy dochází ke zvýšení množství kolagenu s odpovídajícím přírůstkem šířky a kontinuity fibrilárních složek extracelulární matrix. Zatímco u HFpEF je typicky více intersticiální fibrózy než u zdravých kontrol, rozdíly nejsou vždy výrazné a mnoho pacientů nemusí vykazovat známky fibrózy. Naproti tomu HFrEF je spojována s degradací a narušením fibrilárního kolagenu. V konečném stadiu HFrEF mohou fibróza a regionální ischemické jizvy vést k celkovému zvýšení fibrilárního kolagenu v extracelulární matrix (2, 4).
Potenciální mechanismy účinku SGLT-2 inhibitorů
Glifloziny jsou inovativně působící antidiabetika selektivně inhibující sodíko‑glukózový kotransportér (SGLT-2), v důsledku čehož dochází ke glykosurii a poklesu glykemie. Připomeňme, že za fyziologických okolností ledviny denně reabsorbují až 180 g glukózy a do moči se dostává méně než 1 % z filtrovaného množství. K patologické glykosurii dochází teprve tehdy, když hodnota glykemie přesáhne 11 mmol/l. Uvedený kotransportér SGLT slouží k aktivnímu transportu glukózy ve střevě a v ledvinách. Zatímco SGLT2 má vysokou kapacitu a primárně se nachází především v proximálních tubulech, SGLT1 má nízkou kapacitu a nachází se především v enterocytech tenkého střeva, v menším množství nicméně rovněž v proximálních tubulech.
Využití inhibice SGLT-2 jako terapeutického cíle vychází z patofyziologie familiární renální glykosurie, tedy onemocnění, u kterého je zjišťována mutace v genu SLC5A2 kódujícího právě SGLT-2. Třebaže u těchto nemocných je chronicky přítomná glykosurie, není zjišťováno výrazně vyšší riziko chronických onemocnění ledvin nebo infekcí močových cest. Z hlediska ovlivnění glykemie je žádoucí primární omezení reabsorpce glukózy v ledvinách, tedy selektivní inhibice SGLT-2, neboť výraznější inhibice SGLT-1 zvyšuje riziko osmotických průjmů.
Jakkoliv SGLT-2 inhibitory prokazují svůj přínos nikoliv pouze z pohledu snižování hodnoty glykemie, respektive glykovaného hemoglobinu, nýbrž také z pohledu významného snižování srdečních příhod, hospitalizace pro srdeční selhání, mortality či z pohledu zachování činnosti ledvin, nejsme prozatím schopni dané účinky spolehlivě vysvětlit. Velmi pravděpodobně půjde o souhru více mechanismů, jejichž výslednicí je právě uvedený příznivý klinický účinek.
Mechanismus může zahrnovat zlepšení podmínek pro plnění komor, zlepšení srdečního metabolismu a bioenergetiky, modulaci Na+/ H+ výměníku apod. (8). Na rozdíl od většiny jiných antidiabetik nabízejí SGLT-2 inhibitory na inzulinu nezávislý mechanismus snížení glykemie zvýšením exkrece glukózy močí (9). Určitou roli by zde mohl hrát i dnes již dobře známý vliv těchto látek na snižování krevního tlaku a tělesné hmotnosti (10).
Přínos SGLT-2 inhibitorů nicméně stejně tak dobře může pocházet právě ze specifické inhibice SGLT-2. Důsledkem je primárně zvýšená diuréza s následným zlepšením maladaptivních renálních arteriolárních odpovědí souvisejících s diabetem. Tyto hemodynamické a renální účinky jsou pravděpodobně velmi přínosné u pacientů s klinickou nebo subklinickou srdeční dysfunkcí. Konečným výsledkem těchto procesů je pak zlepšení srdeční systolické a diastolické funkce, a tím i nižší riziko hospitalizace pro srdeční selhání a riziko náhlé srdeční smrti (11).
Inhibitory SGLT-2 mohou také snižovat objem plazmy selektivním snížením intersticiální tekutiny s následným snížením preloadu, snížením arteriální tuhosti a krevního tlaku, což by naopak snížilo afterload a zlepšilo koronární cirkulaci (12). Nepochybně zajímavou se zdá i možnost inhibice již zmíněného Na+/H+ výměníku (NHE) 1 se snížením intracelulární koncentrace sodíku a kalcia za současného zvýšení mitochondriální koncentrace kalcia (13–15).
Kromě uvedených dílčích pozorování a hypotéz je v literatuře poukazováno rovněž na modulaci oxidačního stresu, zlepšení endoteliální dysfunkce, ovlivnění tvorby adipokinů či neurohormonální a protizánětlivé účinky. Na přesné vysvětlení příznivého působení SGLT-2 inhibitorů u nemocných s HF si tedy nejspíš ještě budeme muset počkat.
Empagliflozin v léčbě srdečního selhání
Ke dnešnímu dni lze v odborné literatuře dohledat řadu prací svědčících o příznivém působení SGLT-2 inhibitorů v léčbě srdečního selhání. V loňském roce dokonce byla publikována meta‑analýza 34 randomizovaných klinických studií dokládající přínos jejich podávání u nemocných s diabetem typu 2 nebo srdečním selháním z pohledu významně nižšího rizika výskytu síňových arytmií či náhlé srdeční smrti (16). Zde však připomeňme dvě hlavní studie, které jsou klíčové z pohledu průkazu přínosu empagliflozinu u nemocných s HFrEF (17) a HFpEF (18).
Účinnost empagliflozinu u nemocných s HFrEF byla hodnocena ve dvojitě zaslepené randomizované klinické studii (EMPEROR‑Reduced Trial) s HF NYHA II‑IV a ejekční frakcí 40 % a méně (n = 3 730). Na pozadí standardní léčby byli navíc léčeni empagliflozinem v denní dávce 10 mg nebo užívali placebo. Primárně hodnoceným byl kompozitní ukazatel sestávající z KV‑úmrtí a hospitalizace pro srdeční selhání. Při mediánu sledování 16 měsíců se tento vyskytl u 361 z 1 863 pacientů (19,4 %) ve skupině s empagliflozinem a u 462 z 1867 pacientů (24,7 %) ve skupině s placebem – HR: 0,75 (95% CI: 0,65 až 0,86; p < 0,001), a to bez zřejmé souvislosti s přítomností diabetu (Obr. 1). Celkový počet hospitalizací pro srdeční selhání byl významně nižší ve skupině s empagliflozinem – HR: 0,70 (95% CI: 0,58 až 0,85; p < 0,001). Autoři studie navíc pozorovali i výrazně pomalejší pokles zhoršujících se renálních funkcí, a sice -0,55 vs. -2,28 ml/min/1,73 m2/rok (p < 0,001) (17).
Image 1. Účinnost empagliflozinu u nemocných s HFrEF ve studii EMPEROR‑Reduced Trial (dle (17)) 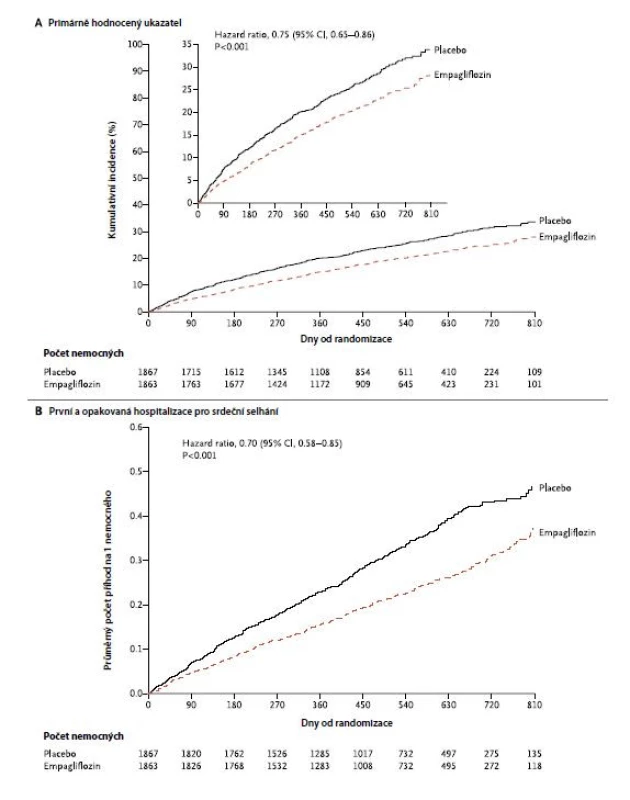
Klinická studie EMPEROR‑Preserved Trial hodnotila přínos empagliflozinu u osob s HFpEF (n = 5 988). I tentokrát šlo o dvojitě zaslepenou randomizovanou klinickou studii. Nemocní měli HFpEF, tj. hodnota jejich EF byla vyšší než 40 %. Léčba i primárně hodnocený ukazatel účinnosti byly stejné jako v předchozí studii. Při mediánu sledování 26,2 měsíce se daný kompozitní ukazatel vyskytl u 415 z 2 997 pacientů (13,8 %) ve skupině s empagliflozinem a u 511 z 2 991 pacientů (17,1 %) ve skupině s placebem – HR: 0,79 (95% CI: 0,69 až 0,90; p < 0,001) (Obr. 2). Tento efekt souvisel především s nižším rizikem hospitalizace pro srdeční selhání (407 s empagliflozinem a 541 s placebem – HR: 0,73 (95% CI: 0,61 až 0,88; p < 0,001)). Ani v této studii nebyla zaznamenána jakákoliv souvislost s přítomností diabetu (18).
Image 2. Přínos empagliflozinu u osob s HFpEF ve studii EMPEROR‑Preserved Trial (dle (18)) 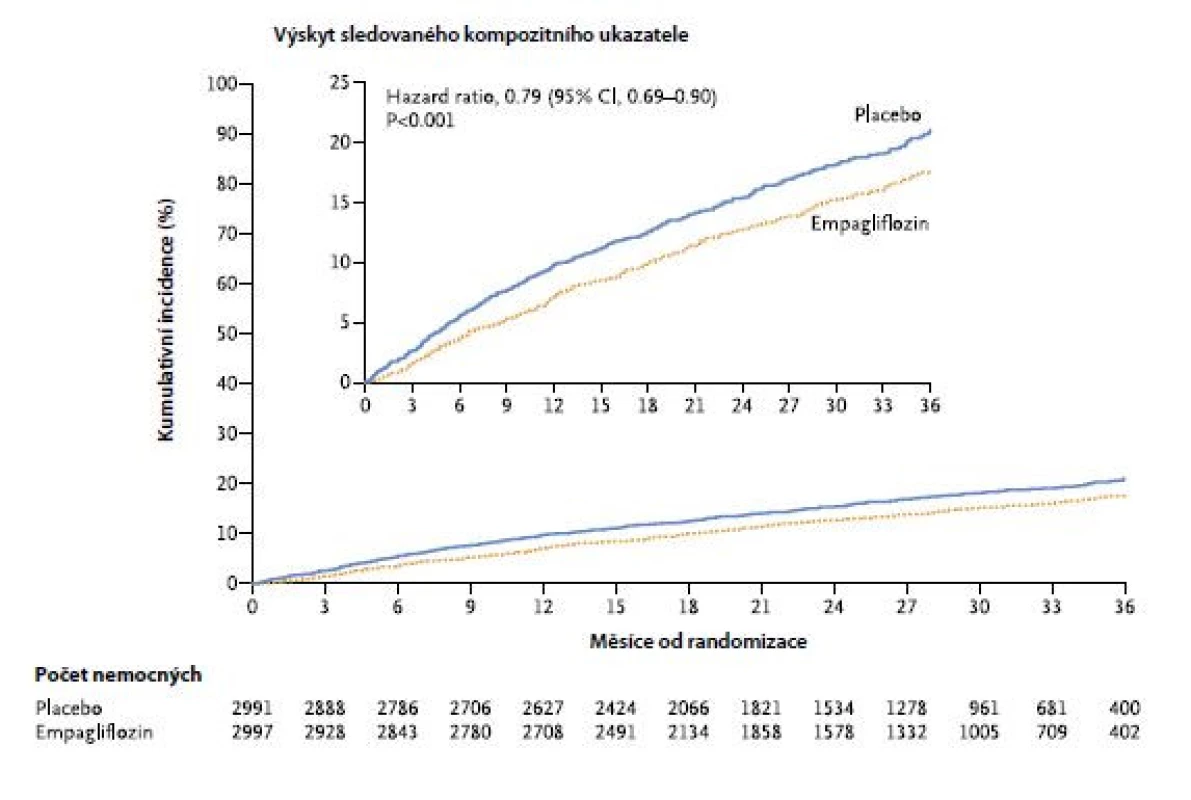
Obě citované klinické studie tedy jasně prokázaly přínos užívání empagliflozinu u nemocných se srdečním selháním. Z klinického pohledu je významné především inovativní zjištění, že terapeutický přínos je zřetelný u všech nemocných se selháním, tj. bez ohledu na aktuální hodnotu ejekční frakce.
Závěr
SGLT-2 inhibitory jsou inovativní podskupinou perorálně užívaných antidiabetik s přesahem svého účinku nad rámec pouhého ovlivnění glykemie. Jejich přínos je patrný z pohledu ovlivnění kardiovaskulárního rizika, pročež jednotliví zástupci začínají být využíváni nikoliv pouze u srdečního selhání se sníženou, nýbrž nově též se zachovalou ejekční frakcí. To vše za veskrze příznivého bezpečnostního profilu – nejčastěji uváděny jsou dnes pouze vyšší výskyt urogenitálních infekcí, případně hypotenze. Její výskyt byl nicméně v obou výše popsaných studiích s empagliflozinem srovnatelný s užíváním placeba.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Jiří Slíva, Ph.D.
Ústav farmakologie 3. LF UK
Ruská 2411, 100 00 Praha 10
Cit. zkr: Vnitř Lék. 2022;68(6):393-397
Článek přijat redakcí: 7. 7. 2022
Článek přijat po recenzích: 8. 8. 2022
Sources
1. McMurray JJV, Solomon SD, Inzucchi SE et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019 Nov 21;381(21):1995-2008.
2. Borlaug BA. The pathophysiology of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2014 Sep;11(9):507-15.
3. McDonagh TA, Metra M, Adamo M et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Sep 21;42(36):3599-3726.
4. Borlaug BA, Redfield MM. Diastolic and systolic heart failure are distinct phenotypes within the heart failure spectrum. Circulation. 2011 May 10;123(18):2006-13.
5. Borlaug BA. Defining HFpEF: where do we draw the line? Eur Heart J. 2016 Feb 1;37(5):463-
6. Solomon SD, Claggett B, Lewis EF et al. Influence of ejection fraction on outcomes and efficacy of spironolactone in patients with heart failure with preserved ejection fraction. Eur Heart J. 2016 Feb 1;37(5):455-62.
7. Lee DS, Gona P, Vasan RS et al. Relation of disease pathogenesis and risk factors to heart failure with preserved or reduced ejection fraction: insights from the framingham heart study of the national heart, lung, and blood institute. Circulation. 2009 Jun 23;119(24):3070-7.
8. Verma S, McMurray JJV. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state‑of‑the‑art review. Diabetologia. 2018 Oct;61(10):2108-2117.
9. Marsenic O. Glucose control by the kidney: an emerging target in diabetes. Am J Kidney, DiS. 2009 May;53(5):875-83.
10. Monami M, Nardini C, Mannucci E. Efficacy and safety of sodium glucose co‑transport - 2 inhibitors in type 2 diabetes: a meta‑analysis of randomized clinical trials. Diabetes Obes Metab. 2014 May;16(5):457-66.
11. Sattar N, McLaren J, Kristensen SL et al. SGLT2 Inhibition and cardiovascular events: why did EMPA‑REG Outcomes surprise and what were the likely mechanisms? Diabetologia. 2016 Jul;59(7):1333-1339. doi: 10.1007/s00125-016-3956-x. Epub 2016 Apr 25. Erratum in: Diabetologia. 2016 Jul;59(7):1573-4.
12. Lytvyn Y, Bjornstad P, Udell JA et al. Sodium Glucose Cotransporter-2 Inhibition in Heart Failure: Potential Mechanisms, Clinical Applications, and Summary of Clinical Trials. Circulation. 2017 Oct 24;136(17):1643-1658.
13. Werner N, Nickenig G, Sinning JM. Complex PCI procedures: challenges for the interventional cardiologist. Clin Res Cardiol. 2018 Aug;107(Suppl 2):64-73.
14. Uthman L, Baartscheer A, Bleijlevens B et al. Class effects of SGLT2 inhibitors in mouse cardiomyocytes and hearts: inhibition of Na+/H+ exchanger, lowering of cytosolic Na+ and vasodilation. Diabetologia. 2018 Mar;61(3):722-726.
15. Baartscheer A, Schumacher CA, Wüst RC et al. Empagliflozin decreases myocardial cytoplasmic Na+ through inhibition of the cardiac Na+/H+ exchanger in rats and rabbits. Diabetologia. 2017 Mar;60(3):568-573.
16. Fernandes GC, Fernandes A, Cardoso R et al. Association of SGLT2 inhibitors with arrhythmias and sudden cardiac death in patients with type 2 diabetes or heart failure: A meta‑analysis of 34 randomized controlled trials. Heart Rhythm. 2021 Jul;18(7):1098-1105.
17. Packer M, Anker SD, Butler J et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020 Oct 8;383(15):1413-1424.
18. Anker SD, Butler J, Filippatos G et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021 Oct 14;385(16):1451-1461.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue 6-
All articles in this issue
- Hlavní téma – Digestivní endoskopie
- Endoscopic treatment of early colorectal cancer
- Early gastric cancer
- Comprehensive approach to a patient with arterial hypertension and dyslipidemia
- What is a risk heart rate at various stages of the cardiovascular continuum?
- SGLT-2 inhibition a useful tool in the treatment of heart failure with reduced and preserved ejection fraction
- Chronic lung diseases and sleep
- Spontaneous coronary artery dissection, two case reports of men
- What is the goal blood pressure in kidney transplant recipients?
- Opustil nás MUDr. Tomáš Klíma
- Current trends in the diagnosis of pancreatic cancer
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Early gastric cancer
- Endoscopic treatment of early colorectal cancer
- Comprehensive approach to a patient with arterial hypertension and dyslipidemia
- Current trends in the diagnosis of pancreatic cancer
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

