-
Medical journals
- Career
Tumorom indukovaná osteomalácia
Authors: Lenka Filipová 1; Ivica Lazúrová 2
Authors‘ workplace: Endokrinologická ambulancia, Nemocnica Agel Košice Šaca, a. s. 1; IK UNLP a LF UPJŠ Košice 2
Published in: Vnitř Lék 2021; 67(E-8): 19-22
Category: Review Articles
Overview
Tumorom indukovaná osteomalácia (TIO) je vzácny paraneoplastický syndróm spôsobený typicky malými endokrinnými nádormi, ktoré vylučujú fibroblastový rastový faktor 23 (FGF23). TIO je klinicky charakterizovaná progresívnou muskuloskeletálnou bolesťou, únavou, slabosťou proximálnych svalov a viacnásobnými zlomeninami, ktoré vedú k dlhodobej invalidite. Kvôli nešpecifickým symptómom ochorenia môže trvať aj niekoľko rokov, kým sú pacienti správne diagnostikovaní a liečení a preto je dôležité zvýšiť povedomie o tomto vzácnom paraneoplastickom syndróme.
Klíčová slova:
FGF23 – hypofosfatémia – tumorom indukovaná hypofosfatémia
Úvod
Tumorom indukovaná osteomalácia (TIO) alebo onkogenná osteomalácia je vzácny paraneoplastický syndróm spôsobený nadprodukciou fibroblastového rastového faktora 23 (FGF23) nádormi väčšinou mezenchýmového pôvodu, ide o tzv. fosfaturické mezenchýmové nádory (1). Tumory je náročné lokalizovať, sú väčšinou solitárne a benígne, len veľmi zriedkavo sa malígne transformujú a metastázujú (2). Lokalizované môžu byť kdekoľvek v kosti alebo v mäkkých tkanivách (3). Presná prevalencia TIO nie je známa, vo svete je opísaných približne 1 000 prípadov TIO (1). Ak sa TIO vyskytuje v detstve, spôsobuje rachitídu, v dospelosti je príčinou hypofosfatemickej osteomalácie.
Patofyziológia
Tumorom indukovaná osteomalácia je spôsobená excesívnou nadprodukciou FGF23, ktorá vedie k hyperfosfatúrii a k hypofosfatémii. FGF23 je hormón produkovaný osteoblastmi a osteocytmi podieľajúci sa na regulácii Ca‑P metabolizmu spolu s parathormónom a kalcitriolom. FGF23 suprimuje reabsorpciu fosfátov a tiež inhibuje tvorbu aktívnej formy vitamínu D inhibíciou obličkovej 1-alfa hydroxylázy. Fyziologicky je tvorba FGF23 odpoveďou na zvýšené hladiny fosforu a 1,25(OH)2D. FGF23 je teda kontraregulačný hormón (4). Chronická hypofosfatémia môže nakoniec viesť k neadekvátnej mineralizácii kostí, ktorá sa prejavuje ako osteomalácia (5).
Klinický obraz
Príznaky a symptómy TIO nie sú špecifické, udáva sa, že viac ako 95 % prípadov je nesprávne diagnostikovaných a nesprávne liečených. Pacienti skutočne čakajú niekoľko rokov na presnú diagnózu (6). Pacienti s TIO majú najskôr dosť nešpecifické príznaky, sťažujú sa na bolesti svalov, bolesti kostí, niekedy nechutenstvo. Bolesti muskuloskeletálneho systému postupne progredujú, často dochádza k fraktúram kostí a pacienti sú schopní chôdze len s barlami, alebo sú nútení používať invalidný vozík. Typicky dochádza k fraktúram v oblasti panvy, os sacrum, rebier, distálnych častí tibie, na rozdiel od typických osteoporotických fraktúr (7).
Laboratórny nález
K charakteristickým biochemickým znakom TIO patrí hypofosfatémia v dôsledku strát fosfátov obličkami (8). V rámci diferenciálnej diagnostiky hypofosfatemickej osteomalácie je dôležité vyšetriť nielen fosfatúriu/24 hod, ktorá je často v norme, ale aj frakčnú exkréciu fosforu, ktorá býva v prípade TIO zvýšená (9). Zistenie strát fosfátov obličkami je kľúčom k správnej diagnóze (10). Pri zistení hypofosfatémie je veľmi dôležité vyšetriť hladinu 1,25(OH)2D, ktorého nízke hladiny sú v súlade s inhibíciou obličkovej 1-alfa hydroxylázy zvýšenými hladinami FGF23. Hladina kalcia je normálna s normálnou hladinou parathormónu (PTH), zvýšená je hladina ALP, tiež je zvýšená hladina bALP – kostný izoenzým (8). Diagnostický algoritmus TIO schematicky znázorňuje Obr. 1.
Image 1. 68Ga DOTA TATE PET/CT – fosfaturický mezenchýmový tumor 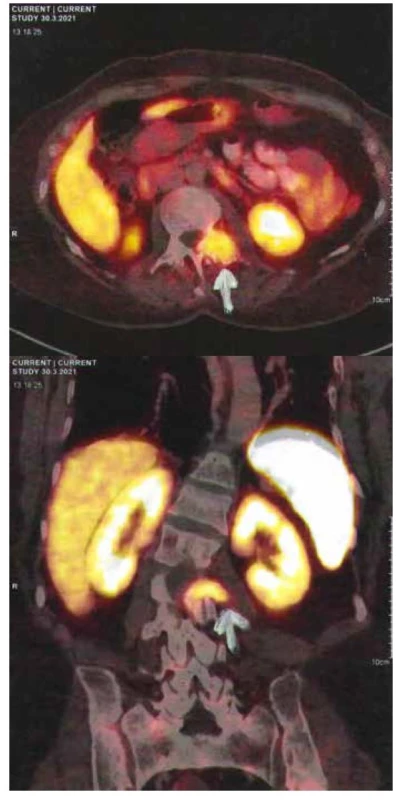
Zobrazovacie metódy – lokalizácia tumoru
Na lokalizáciu TIO sa doporúča indikovať 68Ga DOTA TATE PET/CT (Obr. 2), ktorý má celkovú špecificitu 97,7 % (42 zo 43), čo je oveľa vyššia špecificita ako majú ostatné rádiodiagnostické zobrazovacie modality v tejto indikácii (11). V analýze 287 pacientov s TIO boli najčastejšími nádorovými lokalizáciami dolné končatiny (59,6 %), nasledované kraniofaciálnymi oblasťami (24,0 %), trupom (9,4 %) a hornými končatinami (6,9 %) (12). Po lokalizovaní tumoru je možné indikovať CT s kontrastom alebo MRI (Obr. 3) za účelom potvrdenia konkrétnej polohy tumoru, tiež zistenia vzťahu tumoru k okolitým štruktúram (1).
Image 2. MRI LS oblasti – fosfaturický mezenchýmový tumor lokalizovaný v L2 stavci 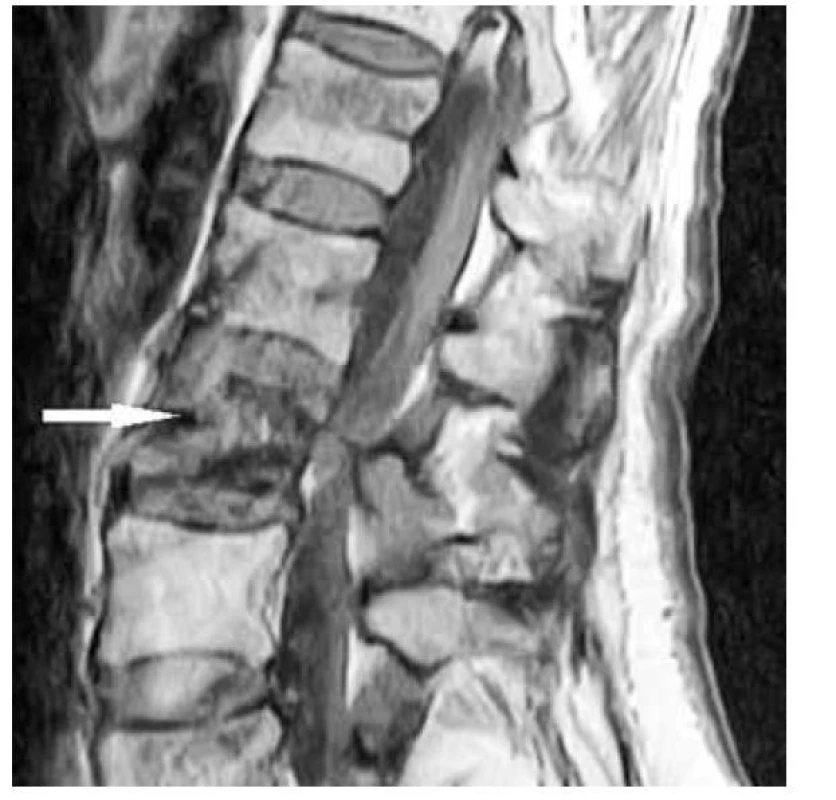
Image 3. Diagnostický algoritmus TIO 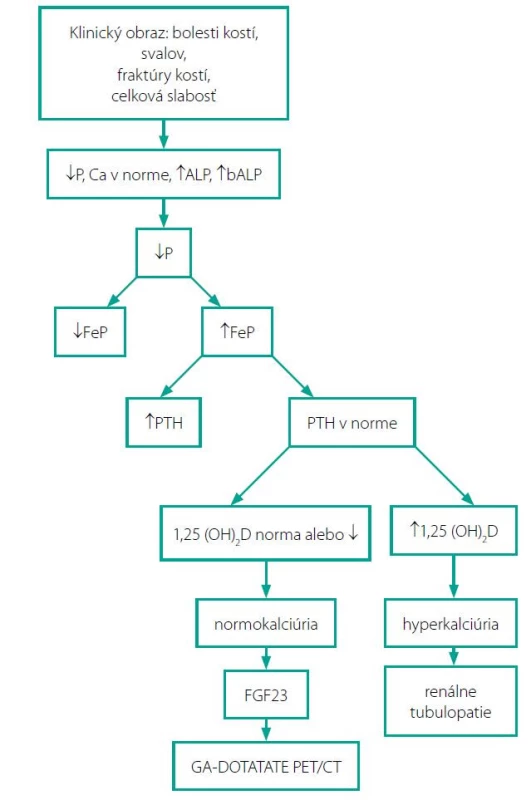
FeP – frakčná exkrécia fosforu, PTH – parathormón, bALP – kostný izoenzým alkalickej fosfatázy Diferenciálna diagnostika
V diferenciálnej diagnostike hypofosfatemickej osteomalácie je dôležité odlíšiť formy vrodené – autozómovo dominantná hypofosfatemická rachitída, autozómovo recesívna hypofosfatemická rachitída, hereditárna hypofosfatemická rachitída s hyperkalciúriou, na X chromozóm viazaná hypofosfatémia (mutácia PHEX génu), ktoré sa manifestujú v detstve, od foriem získaných (4, 13, 14). Všeobecne platí, že čím je pacient mladší, tým väčšia je pravdepodobnosť, že hypofosfatémia je spôsobená skôr genetickou etiológiou než TIO (10). Zo získaných foriem pri diagnostike TIO je dôležité vylúčiť hyperparatyroidizmus – primárny, alebo sekundárny, vylúčiť renálne tubulopatie – Fanconiho syndróm (FS) – v dospelosti sekundárny, renálnu tubulárnu acidózu I. typu a častejšie II. typu (4, 13, 14). Fanconiho syndróm je charakterizovaný nedostatočnou reabsorpčnou aktivitou v proximálnom tubule, ktorá vedie ku glykosúrii, aminoacidúrii, hyperfosfatúrii, hypofosfatémii, hyponatriémii, hypokaliémii, hypokalciémii, k metabolickej acidóze. Pri TIO je prítomná hypofosfatémia pri izolovanej fosfatúrii v dôsledku supresie reabsorpcie fosfátov (15, 16).
Liečba
TIO je liečiteľný stav, ak je tumor správne lokalizovaný a úplne odstránený. Liečbou prvej voľby a zároveň kauzálnou liečbou TIO, v prípade, že sa tumor podarí lokalizovať a je operabilný, je chirurgická resekcia tumoru so širokým okrajom, aby sa zabránilo recidíve tumoru. (10, 17). Chirurgická resekcia lokalizovaného tumoru vedie k úprave fosforu a FGF23 do niekoľkých dní po operácii (18). Osteomalatická kosť sa začne remineralizovať bezprostredne po obnovení homeostázy fosforu, čo má za následok veľmi rýchle a niekedy aj výrazné zvýšenie kostnej hustoty (19). V závislosti od závažnosti ochorenia môže trvať aj rok, kým dôjde k úprave kostných zmien, či zlepšeniu celkového klinického stavu pacienta (10). Ak je nádor lokalizovaný, ale nie je prístupný definitívnej resekcii z dôvodu anatomickej polohy alebo rizika významnej morbidity po chirurgickej resekcii, je možné zvážiť menej invazívne spôsoby, ako je rádioterapia alebo CT‑riadená rádiofrekvenčná ablácia. Nedávne série prípadov ukázali, že rádiofrekvenčná ablácia riadená CT bola účinná a dobre tolerovaná u pacientov s TIO, aj keď dlhodobá účinnosť nie je známa (20).
U pacientov, u ktorých nie je možné nádor identifikovať alebo úplne odstrániť, je indikovaná farmakoterapia. Štandardnou liečbou pre dospelých je perorálny elementárny fosfor v dennej dávke 1 – 3 g rozdelený do 4 až 5 dávok a 1,25 (OH) 2 D v dávke 0,75 – 3 μg/deň rozdelený do 2 až 3 dávok. Podávanie je rozdelené do niekoľkých dávok denne, pretože hladina sérového fosfátu klesá 1 až 2 hodiny po podaní. Úvodným častejším monitorovaním sérových hladín kalcia, fosforu, kreatinínu, ALP, PTH, vyšetrením odpadov Ca, kreatinínu/24 hod a úpravou dávky kalcitriolu sa snažíme predísť hyperkalcémii, hyperkalciúrii, nefrolitiáze, nefrokalcinóze a hyperparatyreóze (10). Užívanie perorálnych preparátov fosforu je pre pacientov náročné najmä pre jeho nepríjemnú chuť, potrebné vysoké dávky a často sa vyskytujúcu gastrointestinálnu intoleranciu, preto je potrebnejšia účinnejšia farmakoterapia, najmä u pacientov, ktorých nie je možné liečiť chirurgicky (21)
V USA bol v júni 2020 na liečbu dospelých a pediatrických pacientov s TIO schválený burosumab. Burosumab je humánna monoklonálna protilátka proti FGF23. V USA v 144-týždňovej štúdii u 14 dospelých pacientov s TIO burosumab (0,3 – 2,0 mg/kg subkutánne každé 4 týždne) zlepšil niekoľko ukazovateľov ochorenia – hladiny fosforu do 144. týždňa, osteomaláciu pri kostnej biopsii v 48. týždni, hojenie zlomenín a zníženie počtu nových zlomenín v 144. týždni. Pri liečbe burosumabom počas 144 týždňov sa nezaznamenali žiadne závažné nežiaduce účinky (22). Podobné výsledky boli pozorované s burosumabom u japonských a kórejských pacientov s TIO (23). Aj keď v súčasnosti nie sú na liečbu TIO schválené žiadne ďalšie terapeutické možnosti, skúmalo sa množstvo alternatívnych prístupov so zmiešanými výsledkami. Sľubné výsledky boli nedávno publikované aj s inhibítorom tyrozínkinázy pan‑FGFR, infigratinibom, v prípade metastatického TIO (24).
Ženské pohlavie, nádory chrbtice, nádory zahrnuté v kostnom tkanive, malignita a nízke predoperačné hladiny fosforu v sére boli identifikované ako rizikové faktory refraktérnych výsledkov (2). Pri liečbe pacienta by sme nemali opomenúť aj algeziologické vyšetrenie, pretože väčšina pacientov trpí výraznými bolesťami svalov a kostí. V pooperačnom období je veľmi dôležitá aj rehabilitačná liečba najmä pri ťažkých formách, keď došlo k atrofizácii svalstva a imobilizácii (21).
Pacientom s osteomaláciou sa nepodávajú inhibítory kostnej resorpcie (denosumab, bisfosfonáty), pretože okrem biochemických zmien môže dôjsť k výraznému zhoršeniu klinického stavu pacienta (25).
Záver
Cieľom tohto článku bolo prispieť k zvýšeniu povedomia o zriedkavom paraneoplastickom syndróme – tumorom indukovanej osteomalácii. Stanovenie FGF23 spolu so zvýšeným povedomím o tomto zriedkavom ochorení pomôže urýchliť diagnostiku pacientov s TIO väčšinou trpiacich progredujúcou slabosťou a invalidizujúcimi bolesťami muskuloskeletálneho systému. Na lokalizáciu fosfaturického mezenchymálneho tumoru sa odporúča použite 68GaDOTATATE PET/ CT. Včasná diagnostika a radikálna chirurgická resekcia tumoru vedie normalizácii sérového fosforu a do jedného roka po odstránení tumoru aj k normalizácii kostných zmien. Pre včasnú diagnostiku týchto tumorov je tiež dôležité, aby sme mysleli na diagnózu osteomalácie, ak máme pred sebou pacienta s bolesťami kostí, zlomeninami a zvýšenými hladinami alkalickej fosfatázy (21).
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Lenka Filipová
Endokrinologická ambulancia, Nemocnica Agel Košice Šaca, a.s., Lúčna 57, 040 15 Košice Šaca
Cit. zkr: Vnitř Lék 2021; 67(8): E19–E22
Článek přijat redakcí: 25. 10. 2021
Článek přijat po recenzích: 9. 11. 2021
Sources
1. Florenzano P, Hartley IR, Jimenez M, Roszko K, Gafni RI, Collins MT. Tumor‑Induced Osteomalacia. Calcif Tissue Int. 2021 Jan;108(1):128-142.
2. Li X, Jiang Y, Huo L, et al. Nonremission and Recurrent Tumor‑Induced Osteomalacia: A Retrospective Study. J Bone Miner Res. 2020;35(3):469-477.
3. Agaimy A, Michal M, Chiosea S, Petersson F, Hadravsky L, Kristiansen G, et al. Phosphaturic mesenchymal tumors: clinicopathologic, immunohistochemical and molecular analysis of 22 cases expanding their morphologic and immunophenotypic spectrum. The American Journal of Surgical Pathology. 2017;41(10):1371–1380.
4. Huang X, Jiang Y, Xia W. FGF23 and Phosphate Wasting Disorders. Bone Res. 2013 Jun 28;1(2):120-32.
5. Yin Z, Du J, Yu F, Xia W. Tumor‑induced osteomalacia. Osteoporos Sarcopenia. 2018;4(4):119-127.
6. Feng J, Jiang Y, Wang O, Li M, Xing X, Huo L, Li F, Yu W, Zhong DR, Jin J, Liu Y, Qi F, Lv W, Zhou L, Meng XW, Xia WB. The diagnostic dilemma of tumor induced osteomalacia: a retrospective analysis of 144 cases. Endocr J. 2017 Jul 28;64(7):675-683.
7. Tiefenbach, M, Scheel, M, Maier A et al. Osteomalazie - Klinik, Diagnostik und Therapie. Z Rheumatol 2018;77, 703–718
8. Tesár TO. An expanding family of hypophoshatemic syndromes. J Bone Miner Metab 2012; 30 : 1–9.
9. Svačina, Š. et al. Poruchy metabolizmu a výživy. Praha:Galen 2010.106-109. ISBN 978-80-7262-676-2.
10. Chong WH, Molinolo AA, Chen CC, Collins MT. Tumor‑induced osteomalacia. Endocr Relat Cancer. 2011;18(3):R53-77.
11. Zhang J., Zhu Z., Zhong D., Dang Y., Xing H., Du Y. 68Ga DOTATATE PET/CT is an accurate imaging modality in the detection of culprit tumors causing osteomalacia. Clin Nucl Med. 2015;40 : 642–646.
12. Jiang Y, Hou G, Cheng W. Performance of 68Ga‑DOTA‑SST PET/CT, octreoscan SPECT/ CT and 18 F‑FDG PET/CT in the detection of culprit tumors causing osteomalacia: a meta‑analysis. Nucl Med Commun. 2020 Apr;41(4):370-376.
13. Athonvarangkul D, Insogna KL. New Therapies for Hypophosphatemia‑Related to FGF23 Excess. Calcif Tissue Int. 2021 Jan;108(1):143-157.
14. Padidela R, Nilsson O, Makitie O, Beck‑Nielsen S, Ariceta G, Schnabel D, Brandi ML, Boot A, Levtchenko E, Smyth M, Jandhyala R, Mughal Z. The international X‑linked hypophosphataemia (XLH) registry (NCT03193476): rationale for and description of an international, observational study. Orphanet J Rare, DiS. 2020 Jun 30;15(1):172.
15. Song K, Yan Q, Yang Y, et al. Fanconi syndrome induced by adefovir dipivoxil: a case report and clinical review. J Int Med Res. 2020;48(10):300060520954713.
16. Gou M, Ma Z. Osteomalacia, renal Fanconi syndrome, and bone tumor. J Int Med Res. 2018;46(8):3487-3490.
17. Minisola S, Peacock M, Fukumoto S, et al. Tumour‑induced osteomalacia. Nat Rev Dis Primers. 2017;3 : 17044.
18. Chong WH, Andreopoulou P, Chen CC, Reynolds J, Guthrie L, Kelly M, Gafni RI, Bhattacharyya N, Boyce AM, El‑Maouche D, Crespo DO, Sherry R, Chang R, Wodajo FM, Kletter GB, Dwyer A, Collins MT. Tumor localization and biochemical response to cure in tumor‑induced osteomalacia. J Bone Miner Res. 2013 Jun;28(6):1386-98.
19. Piemonte S, Romagnoli E, Cipriani C, De Lucia F, Pilotto R, Diacinti D, Pepe J, Minisola S. Six‑year follow‑up of a characteristic osteolytic lesion in a patient with tumor‑induced osteomalacia. Eur J Endocrinol. 2013 Nov 29;170(1):K1-4.
20. Mishra SK, Kuchay MS, Sen IB, Garg A, Baijal SS, Mithal A. Successful Management Of Tumor‑Induced Osteomalacia with Radiofrequency Ablation: A Case Series. JBMR Plus. 2019 Feb 28;3(7):e10178.
21. Dahir, K., Zanchetta, M. B., Stanciu, I., Robinson, C., Lee, J. Y., Dhaliwal, R., Charles, J., Civitelli, R., Roberts, M. S., Krolczyk, S., & Weber, T. Diagnosis and Management of Tumor‑induced Osteomalacia: Perspectives From Clinical Experience. Journal of the Endocrine Society, 1021;5(9), bvab099.
22. Jan De Beur S, Miller P, Weber T, et al. Burosumab improves the biochemical, skeletal, and clinical symptoms of tumor‑induced osteomalacia syndrome. J Endocr Soc. 2019;3(Suppl_1):OR13-1.
23. Imanishi Y, Ito N, Rhee Y, et al. Interim analysis of a phase 2 open‑label trial assessing burosumab efficacy and safety in patients with tumor‑induced osteomalacia. J Bone Miner Res. 2021;36(2):262-270.
24. Hartley IR, Miller CB, Papadakis GZ, et al. Targeted FGFR blockade for the treatment of tumor‑induced osteomalacia. N Engl J Med. 2020;383(14):1387-1389.
25. Cundy T, Que L, Hassan IM, Hughes L. Bisphosphonate‑Induced Deterioration of Osteomalacia in Undiagnosed Adult Fanconi Syndrome. JBMR Plus. 2020 Jun 5;4(8):e10374.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue E-8-
All articles in this issue
- Dlouhodobá mechanická srdeční podpora v terapii chronického srdečního selhání – reálná praxe
- Přehled české literatury zaměřený na terminologii adherence k léčbě
- Imunitní odpověď na vakcinaci u starších lidí
- Tumorom indukovaná osteomalácia
- Th1, Th2 a Th17 lymfocyty u autoimunitních tyreopatií
- Letálne prípady intoxikácie etylalkoholom: zamyslenie sa nad príčinami
- 24hodinová mortalita seniorů akutně hospitalizovaných pro interní onemocnění – může být ovlivněna přítomností diabetu jako komorbidity?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Th1, Th2 a Th17 lymfocyty u autoimunitních tyreopatií
- Dlouhodobá mechanická srdeční podpora v terapii chronického srdečního selhání – reálná praxe
- Tumorom indukovaná osteomalácia
- Přehled české literatury zaměřený na terminologii adherence k léčbě
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

