-
Medical journals
- Career
Th1, Th2 a Th17 lymfocyty u autoimunitních tyreopatií
Authors: Karolína Absolonová; Petr Matucha; Ivan Šterzl
Authors‘ workplace: Endokrinologický ústav, Oddělení klinické imunoendokrinologie, Praha
Published in: Vnitř Lék 2021; 67(E-8): 23-28
Category: Original Contributions
Overview
Mezi nejčastější orgánově specifická autoimunitní onemocnění patří autoimunitní tyreopatie. Zaměřili jsme se na význam stanovení Th1, Th2 a Th17 lymfocytů u autoimunitních tyroiditid (AT). Soubor tvořilo 136 léčených pacientů v plném klinickém rozvoji AT (24 mužů, prům. věk 41,0 ± 16,8 let a 112 žen, prům. věk 44,6 ± 17,6 let). Kontrolní soubor tvořilo 17 zdravých mužů (prům. věk 44,0 ± 5,0 let). Ke statistickým výpočtům jsme použili Box‑Coxovu transformaci dat, t‑testy a Pearsonovu korelační analýzu. Subpopulace lymfocytů jsme stanovili průtokovou cytometrií. Zjistili jsme statisticky významné korelace mezi Th a Tc lymfocyty (r = -0,5605, p = 0,0000), celkovými T a B lymfocyty (r = -0,4877, p = 0,0000), Th1 a Th17 lymfocyty (r = 0,4346, p = 0,0000), Tc a Th1 lymfocyty (r = 0,4124, p = 0,0000), IRI a Th1 lymfocyty (r = -0,4076, p = 0,0000), celk. T lymfocyty a NK buňkami (r = -0,8175, p = 0,0000), paměťovými Th a Th1 lymfocyty (r = 0,7982, p = 0,0000), naivními Th a Th1 lymfocyty (r = -0,7995, p = 0,0000), Tc lymfocyty a NK buňkami (r = -0,4014, p = 0,0000), Tc a celk. T lymfocyty (r = 0,4551, p = 0,0000), Th a celk. T lymfocyty (r = 0,4135, p = 0,0000). Stanovení subpopulací lymfocytů je pomůckou při diagnostice a léčbě autoimunitních chorob, pomáhá objasnit klinické projevy onemocnění a může doplnit interpretaci běžně stanovovaných autoprotilátek. Může pomoci určit, zda jde o fázi destrukční (Th1, Th17, Tc lymfocyty), nebo protektivní (Th2 lymfocyty, protilátky).
Klíčová slova:
autoimunitní tyreopatie – cytometrie průtoková – pomocné T lymfocyty
Úvod
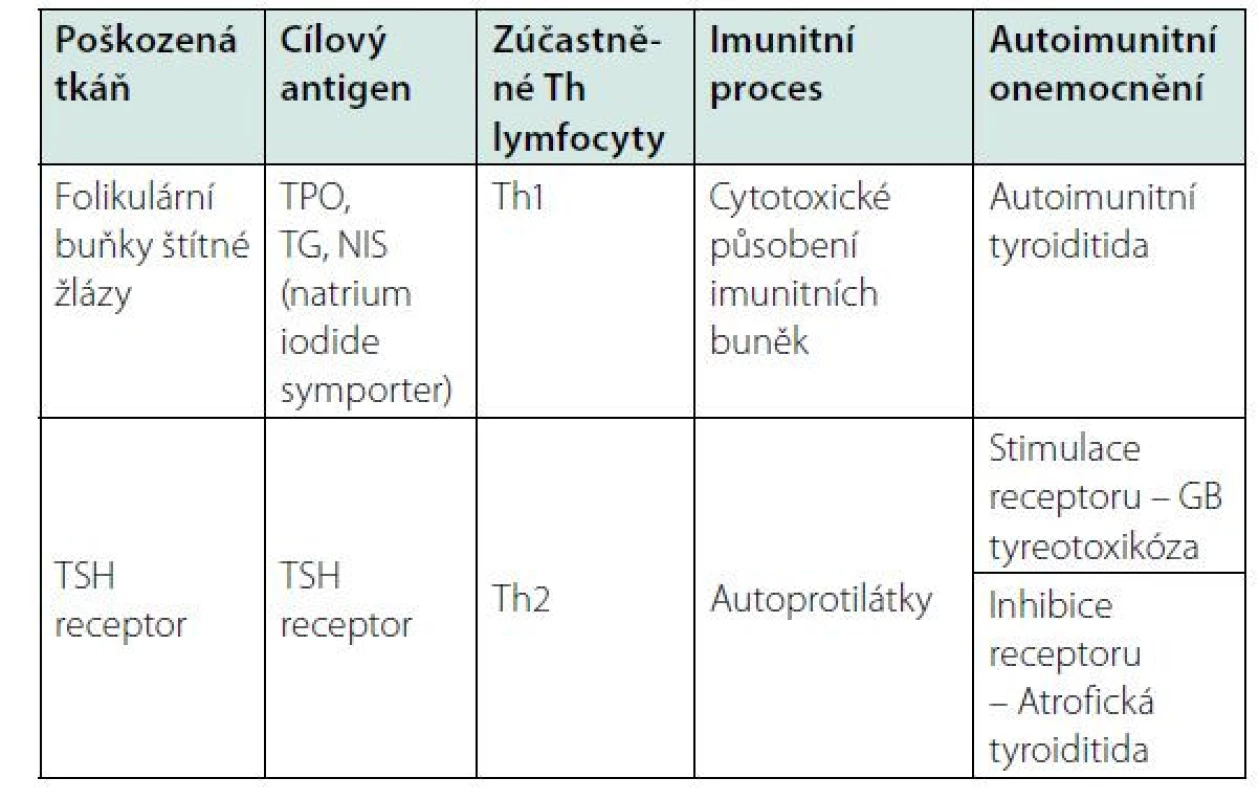
Autoimunitní tyreopatie (AIT) jsou časté, postihují asi 5 % populace, u žen po menopauze až 20 %. Patří sem autoimunitní tyroiditida (AT) a Graves‑Basedowova (GB) tyreotoxikóza. AT se dále dělí na Hashimotovu, juvenilní, poporodní, silentní, atrofickou, fibrózní, Riedlovu a léky indukovanou tyroiditidu – po léčbě cytokiny IFN‑γ (interferon gamma) a IL-2 (interleukin 2) (1). Vývoj autoimunitních endokrinopatií ovlivňuje zejména genetická predispozice. Mezi epigenetické faktory patří poruchy regulace v mikroprostředí cílového orgánu (stav hladin cytokinů produkovaných Th1 a Th2 lymfocyty), virové, bakteriální a parazitární infekce, těžké kovy, farmaka (inhibitory tyrosinkinázy, některé imunologické léky – biolog. léčba), vakcíny, vysoký příjem jódu a deficit vitaminu D (2, 3).
K autoimunitnímu poškození endokrinních buněk dochází postupně, zároveň se organismus snaží udržet homeostázu. Průběh nemoci je pozvolný, dlouho inaparentně, kde dochází k pozvolné destrukci štítné žlázy, vývojem hypotyreózy a nodulací. Vzácně začíná tlakem na krku s přechodnou hyperfunkcí štítné žlázy (hashitoxikóza, silentní tyreoiditis). V této době můžeme proces autoimunity detekovat pouze laboratorně, a to především detekcí autoprotilátek, které se mohou vyskytovat i několik let před klinickou manifestací onemocnění. Autoprotilátky se mohou tvořit proti třem typům antigenů. Jsou to povrchové receptory molekul (např. receptor tyreotropního hormonu TSH – thyroid stimulating hormone), intracelulární enzymy (např. tyreoidální peroxidáza – TPO) a sekreční produkty (např. tyreoglobulin – TG). Autoprotilátky byly dříve mylně interpretovány jako laboratorní autoimunitní syndrom a přes rozvoj subklinických příznaků nebyli pacienti v tomto stadiu léčeni; ukazuje se, že u časného rozvoje autoimunitního procesu je vhodné nasadit tzv. izohormonální terapii (2). Autoprotilátky mají patognomický význam, který spočívá v detekci uvolněného antigenu z destruovaných cílových buněk endokrinního orgánu buňkami zprostředkovanou imunitní reakcí (např. anti‑TPO, anti‑TG). Pouze autoprotilátky proti TSH receptoru (TRAK) mají patogenetický význam při rozvoji GB tyreotoxikózy. Ta se může rozvinout tvorbou stimulačních protilátek proti TSH receptoru. Plně rozvinuté onemocnění, kdy nastává destrukce více než 90 % funkčních endokrinních buněk, je již stav nevratný a pacienta je možné již jen substituovat chybějícími hormony. Proto je nutná včasná laboratorní diagnostika (2).
U některých AIT může být hladina autoprotilátek i přechodně negativní, kde diagnóza spočívá především v sonografickém vyšetření potvrzujícím destruktivní autoimunitní složku. Dochází k tomu v případě převahy aktivace Th1 a suprese Th2 lymfocytů (Th – T helper lymphocyte, pomocný T lymfocyt) vlivem inhibice příslušnými cytokiny nebo při vymizení antigenu.
Autoimunitní endokrinopatie jsou často doprovázeny výskytem i dalších orgánově specifických autoprotilátek. U AIT je častá pozitivita protilátek proti cílovým antigenům dalších orgánů, charakterizující autoimunitní polyglandulární syndrom (APS I.-III. typ, tab. 1 a 2). U AT je častý výskyt autoprotilátek proti steroidy produkujícím buňkám – proti nadledvinám a ovariím (2).
Table 2. Klasifikace APS III, upraveno podle (20) 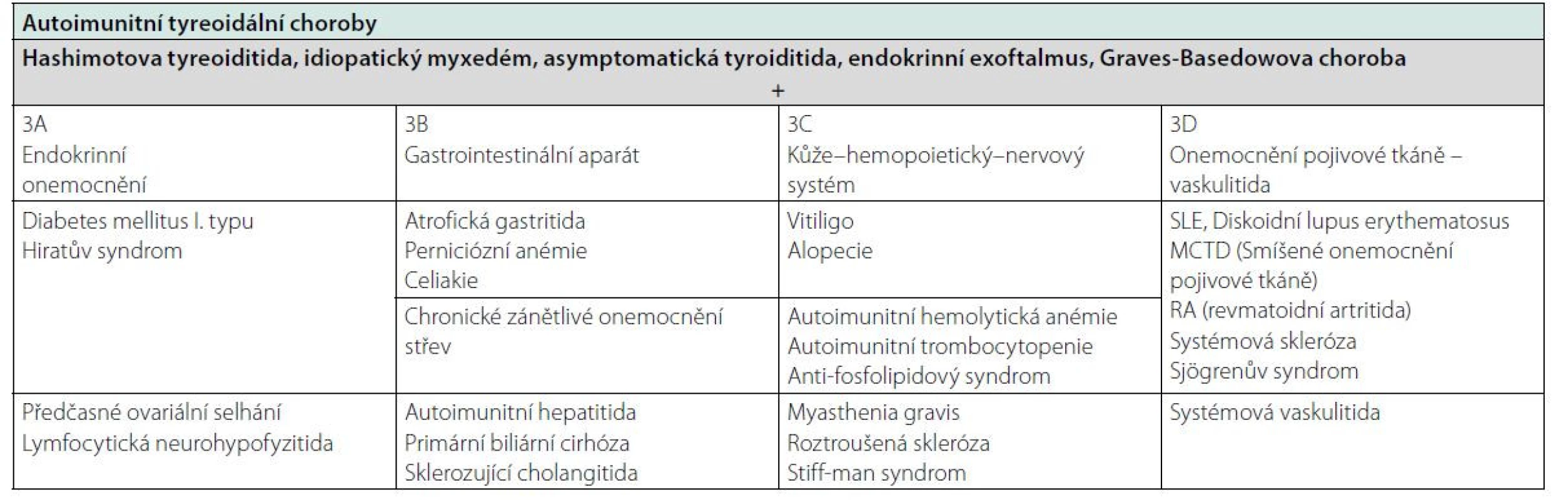
Efektorové Th lymfocyty se vyvíjejí z antigenem neaktivovaných naivních Th0 buněk (4). Ty se aktivují po vazbě svého T‑buněčného receptoru (TCR – T‑cell receptor) na komplex antigen‑MHC II. třídy (MHC – major histocompatibility complex, hlavní histokompatibilní komplex) a svého receptoru CD28 (CD – cluster of differentiation) na molekulu CD80 nebo CD86 na povrchu antigen prezentující buňky (APC – antigen‑presenting cell). Antigenem aktivované Th0 lymfocyty se diferencují vlivem okolního prostředí do subpopulací efektorových buněk – Th1, Th2, Th17 a T regulačních buněk (Treg) (5, 6). Na diferenciaci Th0 buněk mají vliv také cytokiny produkované APC buňkami i samotnými Th lymfocyty. Th lymfocyty se mohou zpětně měnit v jiné typy Th buněk vlivem různých cytokinů, např. v podmínkách zánětu (6).
Th1 lymfocyty jsou prozánětlivé, produkují cytokiny IL-2, IFN‑γ, TNF‑α (tumor necrosis factor α, faktor nádorové nekrózy α). Jejich cytokiny spouští prozánětlivou imunitní odpověď a zvyšují proliferaci a cytotoxickou aktivitu NK buněk (NK – natural killer cells, přirození zabíječi) (7–10). Th1 lymfocyty stimulují buněčnou imunitu (přeměna makrofágů na aktivované makrofágy, aktivace cytotoxických Tc lymfocytů a NK buněk), která může vést k autoimunitní destrukci cílové tkáně. To má za následek rozvoj autoimunitních tyroiditid, projevujících se jako autoimunitní zánět štítné žlázy. Rozlišuje se několik typů tohoto onemocnění (1). U Hashimotovy tyroiditidy jsou ve tkáni štítné žlázy přítomny především Th1 lymfocyty (5).
Th2 lymfocyty produkují IL-4, IL-5, IL-6, IL-9, IL-10 a IL-13. Podporují protilátkovou imunitní odpověď, stimulují žírné buňky, eosinofily a bazofily. Podporují produkci všech tříd imunoglobulinů včetně IgE a potlačují buněčnou imunitu (6, 7, 11). Ovlivňují produkci paměťových protilátek aktivovanými B lymfocyty, které mohou navodit stimulaci nebo inhibici cílového funkčního receptoru. Protilátky proti TSH receptoru (TRAK) jsou stimulující nebo blokující – při stimulaci receptoru dochází k rozvoji GB tyreotoxikózy, při jeho inhibici k atrofické tyroiditidě. U GB tyreotoxikózy dochází k nadměrné tvorbě protilátek, které po vazbě na TSH receptor podněcují štítnou žlázu k růstu a vyšší produkci hormonů. U tohoto onemocnění také často nacházíme endokrinní orbitopatii. Lymfocytární infiltrace tyreoidey u GB tyreotoxikózy je tvořena převážně Th2 lymfocyty.
Th1 a Th2 lymfocyty působí jako protihráči, regulují se navzájem a jejich vybalancovaný poměr je znakem dobré imunologické funkce (3). Cytokiny Th1 a Th2 lymfocytů podporují růst vlastních buněk a tlumí růst a diferenciaci opačné subpopulace. Převaha Th1 aktivity se uplatňuje u zánětů a některých autoimunitních onemocnění, převaha Th2 aktivity u alergií a nádorových stavů (4, 5, 10).
Diferenciace Th0 buněk je závislá na jejich bezprostředním okolí, což lze využít i v léčbě. DHEA (dehydroepiandrosteron) podporuje Th1 diferenciaci a tudíž buněčnou imunitu. Kortizol a kortikoidy (obecně imunosuprese s dominantním využitím kortikoidů a v poslední dekádě i biologik, např. rituximab), používané např. při léčbě orbitopatie, podporují Th2 lymfocyty a tedy protilátkovou odpověď. Protilátky při Th2 reakci mají často ochranný charakter proti cytotoxicitě. Při změně na Th1 reakci (cytotoxickou) často dochází ke zhoršení zdravotního stavu pacienta.
Diferenciace Th17 lymfocytů je ovlivněna přítomností TGF‑β (TGF – transformující růstový faktor, transforming growth factor), IL-6 a IL-21. IL-6 je produkován dendritickými buňkami stimulovanými mikrobiálním agens, IL-21 zesiluje odpověď Th17 lymfocytů a aktivuje NK buňky. Pro udržení a funkci buněk Th17 je důležitý IL-23, který je produkován aktivovanými makrofágy a dendritickými buňkami (3, 7, 10). Th17 lymfocyty jsou prozánětlivé, tvoří cytokiny IL-17, IL-21, IL-22, IL-6 a TNF‑α. Ovlivňují migraci neutrofilů a makrofágů do místa zánětu, expanzi myeloidních, dendritických i T buněk, tvorbu antimikrobiálních peptidů, zvyšují zapojení dalších Th17 buněk do zánětlivého procesu a hrají roli ve slizniční bariéře (6, 10). Stimulují B lymfocyty k produkci protilátek (IgG, IgA, IgM, ale ne IgE). Cytokin IL-17 zesiluje expresi chemokinů a prozánětlivých faktorů, podporuje proliferaci, maturaci a migraci neutrofilů a monocytů do místa zánětu, působí kostimulačně na T lymfocyty a zesiluje maturaci dendritických buněk (5, 7). Jeho produkce byla prokázána u autoimunitních chorob, které mají spíše chronický nebo rekurentní průběh, z AIT zejména u dle Volpého Hashimotovy tyroiditidy (1, 3, 5–7, 10).
Treg lymfocyty udržují imunologickou toleranci tím, že blokují efektorové Th1 lymfocyty a tím destrukci tkání Tc lymfocyty, tlumí aktivaci B lymfocytů, produkci protilátek a funkci APC buněk. Porucha v jejich počtu nebo funkci vede k rozvoji autoimunitních chorob (5, 8, 10, 11). Treg lymfocyty tlumí aktivitu Th17 lymfocytů, proto je důležité sledovat index Th17/Treg. Při jeho zvýšení se rozvíjejí autoimunitní choroby (3, 6). Zvýšený počet Th17 lymfocytů může hrát roli u Hashimotovy tyroiditidy, snížený počet Treg lymfocytů u GB tyreotoxikózy (12).
Materiál a metodika
Pro stanovení Th lymfocytů jsme použili průtokový cytometr Navios se 3 lasery. Použili jsme plnou krev, odebranou do zkumavky s heparinátem sodným (zelený uzávěr). Pro stimulaci produkce cytokinů byly použity zkumavky DurActive 1 (C11101). Pro zpracování buněk jsme použili PerFix nc kit (B31167). Pro stanovení CD znaků a cytokinů byly použity značené protilátky CD4-APC‑Alexa Fluor 750 (A94682) pro všechny Th lymfocyty, anti‑IFN‑γ - FITC (IM2716U) pro Th1, anti‑IL - 4-PE (IM2719U) pro Th2 a anti‑IL - 17A‑Pacific Blue (B76266) pro Th17 lymfocyty.
Měřili jsme i další parametry buněčné imunity: Celkové T lymfocyty (CD3+), pomocné Th lymfocyty (CD3+CD4+), cytotoxické Tc lymfocyty (CD3+CD8+), dvojitě negativní T lymfocyty (CD3+CD4-CD8-), regulační Treg lymfocyty (CD4+CD25+CD127dim/-), paměťové Th lymfocyty (CD4+CD45RO+), naivní Th lymfocyty (CD4+CD45RA+), B lymfocyty (CD3-CD19+) a NK buňky (CD3-CD16+CD56+). Byly vypočteny indexy IRI (CD4+/CD8+), Th1/Th2 a Th17/Treg. Pro stanovení celkových T, Th, Tc, dvojitě neg. T, B lymfocytů a NK buněk byly použity protilátky CYTO‑STAT tetraCHROME CD45-FITC/CD56-RD1/CD19-ECD/CD3-PC5 (6607073), CD8-PC7 (737661), CD16-PE (A07766) a CD4-APC‑Alexa Fluor 750 (A94682). Pro stanovení paměťových a naivních Th lymfocytů byly použity protilátky CD45RO‑PE (A07787), CD45RA‑ECD (B49193) a CD4-APC‑Alexa Fluor 750 (A94682). Pro Treg lymfocyty jsme použili protilátky CD25-PC5 (IM2646), CD127-PE (B49220) a CD4-APC‑Alexa Fluor 750 (A94682).
Cytometr jsme kalibrovali pomocí Flow‑Check Pro Fluorospheres (A63493). Jako kontrolní materiál byly použity IMMUNO‑TROL Cells (6607077) a pro lýzu erytrocytů VersaLyse Lysing Solution (A09777). Ke zpracování dat byl využit program Navios Software.Ink. Analyzátor i reagencie byly dodány výrobcem Beckman Coulter Inc.
Sledovali jsme sérové hladiny TSH, FT3, FT4 (ECLIA, Roche s. r. o., Cobas 6000), protilátek proti TG a TPO (ELISA, Aesku.Diagnostics GmbH & Co. KG, Immunomat Base), potvrzující diagnózu AT.
Statistické zpracování
Soubor tvořilo 136 pacientů s AT (dg E063), 24 mužů (průměrný věk 41,0 ± 16,8 let) a 112 žen (průměrný věk 44,6 ± 17,6 let). Šlo o pacienty, u kterých došlo k plnému rozvoji AT a jejího klinického stavu (potvrzené laboratorně a sonograficky). Tito pacienti byli substitučně léčeni. Počáteční fázi onemocnění jsme neměli k dispozici, jelikož jsme následné pracoviště, kam jsou odesíláni pacienti již s probíhající terapií a stanovenou diagnózou. Kontrolní soubor tvořilo 17 zdravých mužů (průměrný věk 44,0 ± 5,0 let). Box‑Coxova transformace dat, t‑testy a Pearsonova korelační analýza byly provedeny pomocí programu Statgraphics (Manugistics, USA).
Výsledky
Zaznamenali jsme množství statisticky významných korelací, které zde ale neuvádíme, protože byly velmi slabé až slabé, kdy |r| < 0,4000. Uvádíme pouze korelace středně až velmi silné, kde |r| ≥ 0,4000 (13).
V souboru pacientů s E063 jsme zjistili tyto statisticky významné korelace:
Mezi Th a Tc lymfocyty (r = -0,5605, p = 0,0000), celk. T a B lymfocyty (r = -0,4877, p = 0,0000), Th1 a Th17 lymfocyty (r = 0,4346, p = 0,0000), Tc a Th1 lymfocyty (r = 0,4124, p = 0,0000), IRI a Th1 lymfocyty (r = -0,4076, p = 0,0000), celk. T lymfocyty a NK buňkami (r = -0,8175, p = 0,0000), paměť. Th a Th1 lymfocyty (r = 0,7982, p = 0,0000), naiv. Th a Th1 lymfocyty (r = -0,7995, p = 0,0000), Tc lymfocyty a NK buňkami (r = -0,4014, p = 0,0000), Tc a celk. T lymfocyty (r = 0,4551, p = 0,0000), Th a celk. T lymfocyty (r = 0,4135, p = 0,0000). Mezi subpopulacemi lymfocytů a hodnotami TSH, FT3, FT4, anti‑TG a anti‑TPO jsme nalezli jen slabé statisticky významné korelace (|r| < 0,4000). Korelace zjištěné u jednotlivých pohlaví zde s ohledem na rozsah textu neuvádíme, protože ref. meze lymfocytů se obvykle uvádějí bez rozlišení pohlaví.
Statisticky významný rozdíl mezi kontrolním souborem a souborem pacientů s E063 jsme nalezli u Th1 (p = 0,0270), Th2 (p = 0,0309) a Th17 lymfocytů (p = 0,0070) (Obr. 1).
Image 1. Rozdíl mezi souborem s dg E063 a kontrolním souborem 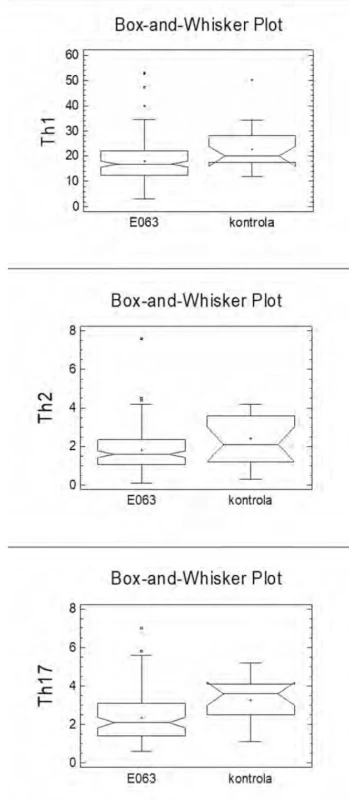
U kontrolního souboru jsme zjistili tyto statisticky významné korelace: Mezi Th lymfocyty a NK buňkami (r = -0,5936, p = 0,0120), mezi Th lymfocyty a FT3 (r = -0,5218, p = 0,0317), mezi Tc a B lymfocyty (r = -0,7059, p = 0,0015), mezi Tc lymfocyty a FT3 (r = 0,4880, p = 0,0469), mezi Tc a celk. T lymfocyty (r = 0,6008, p = 0,0108), mezi Th a celk. T lymfocyty (r = 0,5115, p = 0,0358), mezi celk. T lymfocyty a NK buňkami (r = -0,7260, p = 0,0010), mezi IRI a B lymfocyty (r = 0,6968, p = 0,0019), mezi B lymfocyty a FT4 (r = -0,6724, p = 0,0031), mezi dvojitě neg. T lymfocyty a Treg (r = -0,4949, p = 0,0434), mezi IRI a FT3 (r = -0,5489, p = 0,0225), mezi Th1 a Treg lymfocyty (r = 0,5798, p = 0,0147) a mezi Treg lymfocyty a anti‑TPO (r = 0,4955, p = 0,0431), mezi naiv. Th a Th1 lymfocyty (r = -0,7614, p = 0,0004), mezi paměť. Th a Th1 lymfocyty (r = 0,7612, p = 0,0004).
Diskuze
Mezi Th1 a Th17 lymfocyty jsme nalezli pozitivní korelaci. Je to v rozporu s literaturou, která uvádí, že cytokin Th1 lymfocytů IFN‑γ inhibuje diferenciaci Th17 lymfocytů (10).
Mezi Th1 lymfocyty a NK buňkami jsme statisticky významnou korelaci nenalezli, ačkoli literatura uvádí, že Th1 lymfocyty zvyšují působením svých cytokinů proliferaci NK buněk (9).
V našem souboru pacientů jsme nenalezli ani statisticky významnou korelaci mezi Th17 lymfocyty a NK buňkami. V literatuře se však uvádí, že IL-21 produkovaný Th17 lymfocyty aktivuje NK buňky (7, 10).
Nenalezli jsme statisticky významnou korelaci mezi buňkami Th17 a Treg. Tuto korelaci jsme očekávali, jelikož dle literatury by měly Treg lymfocyty tlumit aktivitu Th17 lymfocytů a zvýšený poměr Th17/Treg má význam při rozvoji autoimunitních onemocnění (3, 6). Možným vysvětlením může být, že některé Treg buňky jsou schopny produkovat IL-17 (3). Rovněž existují buňky Th1/17, které produkují IFN‑γ a IL-17. Ty mohou svou produkcí cytokinů zkreslit výsledky měření, i když se jejich výskyt uvádí jako nízký (<1 % z Th lymfocytů) (3, 5). Jinde bylo zjištěno, že Treg lymfocyty byly u pacientů s AIT snížené, zatímco Th17 zůstaly stejné jako u zdravých jedinců (14). Rozdíly mezi výsledky studií mohou být také ovlivněny odlišným genetickým pozadím probandů nebo různým uspořádáním testů (3).
Očekávali jsme pozitivní korelaci mezi Th2 lymfocyty a indexem Th17/Treg, kterou jsme sice nalezli, ale nebyla dostatečně silná (r = 0,3373). Pouze u mužů s dg E063 měla tato korelace r = 0,5336. Literatura říká, že IL-6 produkovaný Th2 lymfocyty zvyšuje index Th17/ Treg, podporuje diferenciaci Th17 a tlumí vznik Treg (7, 10). Korelace mezi Th2 a Treg nebyla v našem souboru statisticky významná.
Mezi Th2 a B lymfocyty jsme nenalezli statisticky významnou korelaci, ačkoli mezi nimi existuje funkční vztah, kdy Th2 lymfocyty podporují funkci B lymfocytů. Tuto korelaci jsme proto očekávali.
Th1 lymfocyty stimulují buněčnou imunitu včetně Tc lymfocytů. Tento předpoklad se potvrdil, nalezli jsme mezi nimi pozitivní korelaci. V kontrolním souboru a u mužů s dg E063 tato korelace nebyla statisticky významná. Může zde tedy být i vliv pohlaví.
Zajímavé je, že ačkoli Th1 lymfocyty mají zvyšovat aktivitu NK buněk a zároveň Tc lymfocytů, v našem souboru jsme nalezli negativní korelaci mezi Tc lymfocyty a NK buňkami. Zde se zřejmě také projevil vliv pohlaví, jelikož v kontrolním souboru a u mužů s dg E063 nebyla tato korelace statisticky významná.
Určitým problémem při klinickém využití Th1, Th2 a Th17 lymfocytů může být nedostatek údajů o jejich referenčních mezích v literatuře. Laboratoře používají různé buněčné znaky ke stanovení subpopulací lymfocytů, takže nelze ref. meze mnohdy zcela převzít. Jeden z návrhů podali Italové (15) (Tab. 3), kteří použili povrchové CD znaky buněk. My jsme použili intracelulární značení cytokinů (IFN‑γ, IL-4, IL-17A) spolu s povrchovým značením buněk (CD4). Japonští a čínští autoři (16, 17) použili obdobné značení buněk jako my (Tab. 4, 5). Každá laboratoř musí při přebírání ref. mezí hledět na to, na základě jakých znaků byly jednotlivé subpopulace stanoveny. I přes tyto obtíže si myslíme, že stanovení Th1, Th2 a Th17 lymfocytů může přinést užitečnou informaci o možné převaze cytotoxické nebo protilátkové reakce.
Table 3. Referenční meze pro Th1, Th2 a Th17 lymfocyty v plné krvi od 19 let věku, upraveno podle (15) 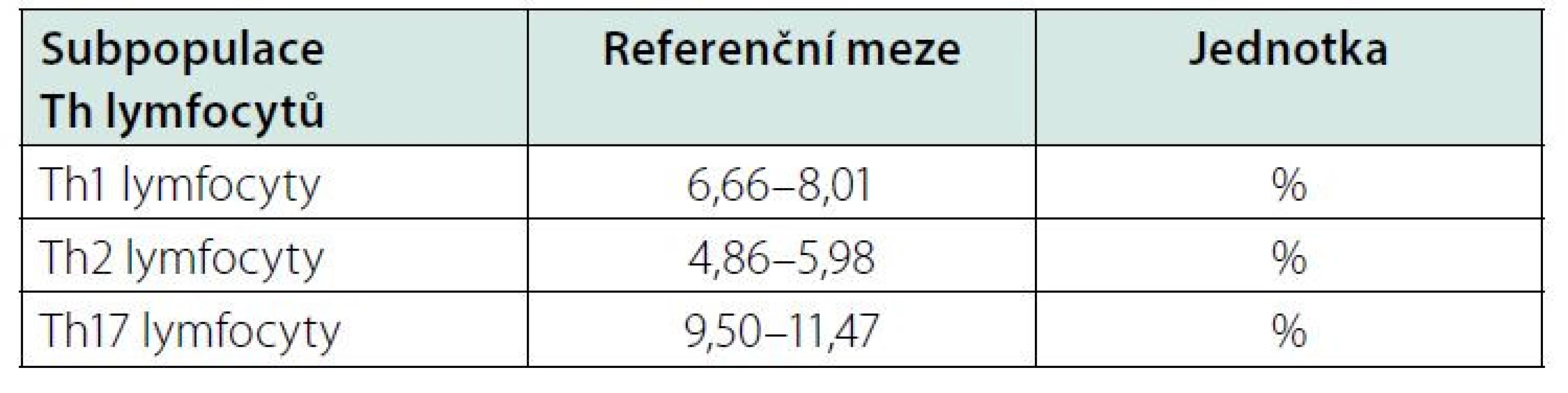
Table 4. Referenční meze pro Th1 a Th2 lymfocyty v plné krvi u japonských dospělých, upraveno podle (16) 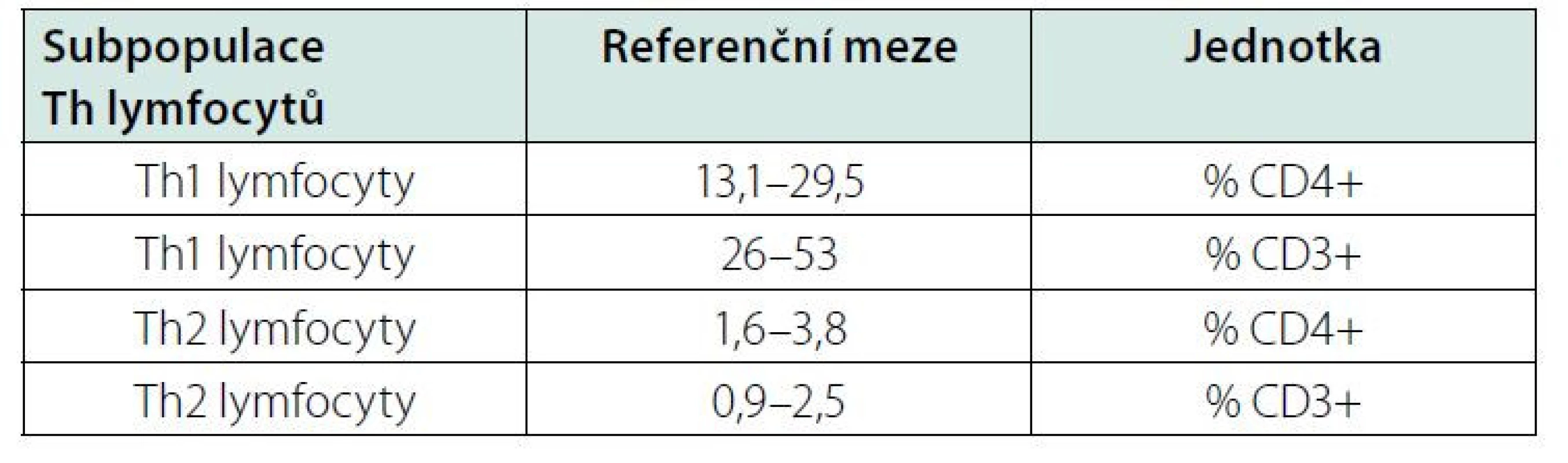
Table 5. Referenční meze pro Th1, Th2 a Th17 lymfocyty u čínských dospělých, upraveno podle (17) 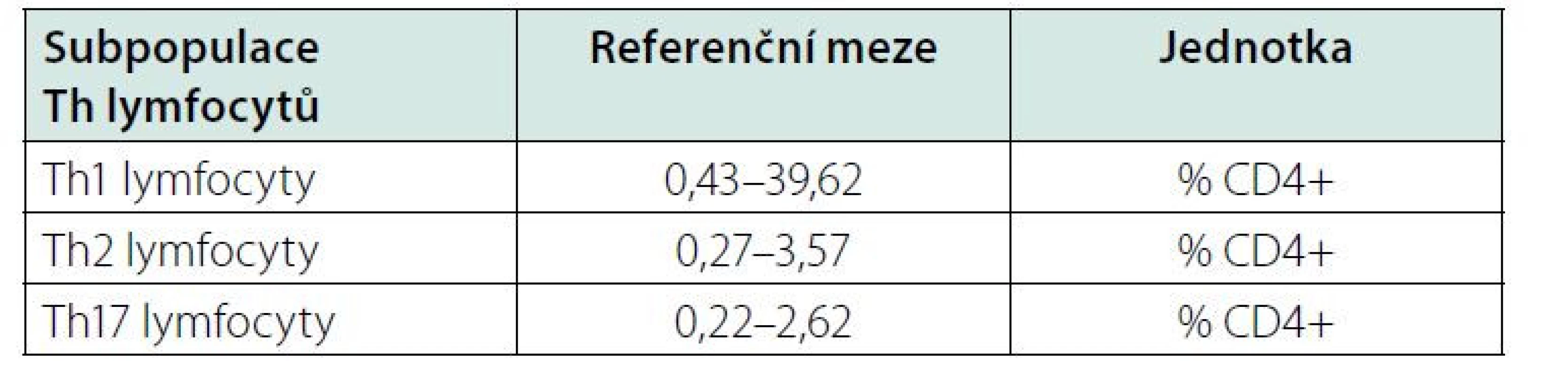
Je důležité brát v úvahu i další aspekty. Absolutní počty a/nebo procentuální zastoupení Th lymfocytů se mohou lišit podle pohlaví, kouření, těhotenství nebo menstruačního cyklu (MC). U žen je počet i procento Th buněk vyšší než u mužů, stejně tak u kuřáků oproti nekuřákům. Menstruující ženy mají vyšší procento Th než nemenstruující, v proliferační fázi MC je vyšší procento Th než ve fázi sekreční. Období ovulace odlišnosti nevykazuje. Změny v MC se týkají pouze procenta buněk, nikoliv absolutních počtů. Užívání antikoncepce odlišnosti nevykazuje (18). Odlišnosti mezi pohlavími byly nalezeny i u NK buněk a celkových T lymfocytů (19). Nadváha se projevuje u absolutního počtu celk. T, Th a B lymfocytů. Kouření má vliv na téměř všechny parametry lymfocytů. Sportující jedinci se od nesportujících neliší (19). Protože odborná literatura obvykle uvádí referenční meze lymfocytů bez rozlišení pohlaví, použili jsme pro naše výpočty soubor pacientů s dg E063 jako celek. Mezi pohlavími jsme nalezli rozdíl pouze v celkových T lymfocytech (p = 0,0139), B lymfocytech (p = 0,0462), dvojitě negativních T lymfocytech (p = 0,0055), TSH (p = 0,0459) a FT3 (p = 0,0000). Kouření, těhotenství a MC nebylo u našeho souboru k dispozici. Významným prvkem variability výsledků je podle některých autorů také značka průtokového cytometru, množství vzorku, postup přípravy vzorku a protilátky různých výrobců (19).
Stanovení subpopulací Th lymfocytů je vhodným předmětem dalšího zkoumání, včetně zjištění a zhodnocení vlivu věku a pohlaví na vztah Th lymfocytů k dalším laboratorním parametrům u pacientů s AIT.
Závěr
Stanovení subpopulací lymfocytů může být významnou pomůckou při diagnostice a léčbě autoimunitních chorob, způsobených buněčnou cytotoxicitou. Diagnóza závisí na kombinaci a převaze jednotlivých imunokompetentních buněk, které se při rozvoji autoimunity uplatňují. Ty mohou charakterizovat i odlišnosti stejné diagnózy u mladého a staršího jedince.
Pokusili jsme se zjistit, zda analýza Th1, Th2 a Th17 lymfocytů zlepšuje možnosti diagnostiky u autoimunitních tyroiditid. Zastoupení subpopulací Th lymfocytů můžeme stanovit pomocí průtokové cytometrie. Tato informace nám pomůže objasnit klinické projevy a imunopatologické mechanismy, u kterých se mohou uplatnit Th, případně Tc lymfocyty. Tato metodika by se mohla stát doplněním stanovení B a T lymfocytů a může představovat zlepšení interpretace autoprotilátek anti‑TG a anti‑TPO. V případě, že se výsledek některé ze subpopulací Th lymfocytů dostane mimo své ref. meze, může nám to pomoci odhadnout, zda jde o fázi destrukční (Th1, Th17, Tc lymfocyty), nebo protektivní (Th2 lymfocyty, protilátky). Předpokládáme, že při převaze Th1 a Th17 lymfocytů dochází ke zhoršení stavu pacienta, naopak při převaze Th2 a Treg lymfocytů můžeme očekávat zlepšení nebo zpomalení rozvoje destrukce cílových buněk (tyreocytů). Interpretace fenotypizace lymfocytů je u každého pacienta individuální, s přihlédnutím k dalším laboratorním parametrům a klinickému stavu.
Stanovení subpopulací Th lymfocytů může přinést detailnější vhled do průběhu onemocnění zejména u pacientů v prvotních fázích choroby. Může být užitečné také u mladých jedinců, kde lze zasáhnout izohormonální terapií. U plně rozvinutého onemocnění, kde je léčba již jen substituční, nemá při běžné udržovací terapii velký význam.
Podpořeno MZ ČR - RVO (Endokrinologický ústav – EÚ, 00023761)
KORESPONDENČNÍ ADRESA AUTORA:
Mgr. Karolína Absolonová, Ph.D.
Endokrinologický ústav, Odd. klinické imunoendokrinologie Národní 8, 110 00 Praha 1
Cit. zkr: Vnitř Lék 2021; 67(8): E23–E28
Článek přijat redakcí: 27. 8. 2021
Článek přijat po recenzích: 4. 11. 2021
Sources
1. Volpé R. The immunology of human autoimmune thyroid disease. In: Volpé R (ed). Autoimmune endocrinopathies. Contemporary Endocrinology, vol 15. Humana Press: Totowa, NJ 1999 : 217-244. ISBN 978-1-4757-4572-6.
2. Hrdá P, Šterzl I. Autoimunitní endokrinopatie. Med. Pro Praxi 2008; 5(5): 196–199.
3. Li Q, Wang B, Mu K et al. The pathogenesis of thyroid autoimmune diseases: New T lymphocytes – Cytokines circuits beyond the Th1-Th2 paradigm. J Cell Physiol. 2019 Mar; 234(3): 2204–2216.
4. Yamamoto J, Adachi Y, Onoue Y et al. Differential expression of the chemokine receptors by the Th1 - and Th2-type effector populations within circulating CD4+ T cells. J Leukoc Biol. 2000 Oct; 68(4): 568–574.
5. Nanba T, Watanabe M, Inoue N et al. Increases of the Th1/Th2 cell ratio in severe Hashimoto’s disease and in the proportion of Th17 cells in intractable Graves’ disease. Thyroid. 2009 May; 19(5): 495–501.
6. Lee GR. The Balance of Th17 versus Treg Cells in Autoimmunity. Int J Mol Sci. 2018 Mar 3; 19(3): 730.
7. Bettelli E, Oukka M, Kuchroo VK. TH-17 cells in the circle of immunity and autoimmunity. Nat Immunol. 2007 Apr; 8(4): 345–350.
8. Ursaciuc C, Surcel M, Ciotaru D et al. Regulatory T cells and TH1/TH2 cytokines as immunodiagnosis keys in systemic autoimmune diseases. Roum Arch Microbiol Immunol. Apr-Jun 2010; 69(2): 79–84.
9. Neuschlová M, Nováková E, Kompaníková J. Imunológia – ako pracuje imunitný systém. KO&KA spol. s. r. o.: Bratislava 2017. ISBN 978-80-8187-031-6.
10. Svobodová M, Štourač P. Role specifické buněčné imunity v patogenezi roztroušené sklerózy se zaměřením na Th17 a Treg lymfocyty. Cesk Slov Neurol N 2017; 80/113(2): 173–179.
11. Kutukculer N, Azarsiz E, Aksu G et al. CD4+CD25+Foxp3+ T regulatory cells, Th1 (CCR5, IL-2, IFN-γ) and Th2 (CCR4, IL-4, Il-13) type chemokine receptors and intracellular cytokines in children with common variable immunodeficiency. Int J Immunopathol Pharmacol. 2016 Jun; 29(2): 241–251.
12. Li C, Yuan J, Zhu YF et al. Imbalance of Th17/Treg in Different Subtypes of Autoimmune Thyroid Diseases. Cell Physiol Biochem. 2016; 40(1–2): 245–252.
13. Evans JD. Straightforward statistics for the behavioral sciences. Thomson Brooks/Cole Publishing Co: Pacific Grove (CA, USA) 1996. ISBN 10 0534231004.
14. Zhou J, Bi M, Fan C et al. Regulatory T cells but not T helper 17 cells are modulated in an animal model of Graves’ hyperthyroidism. Clin Exp Med. 2012 Mar; 12(1): 39–46.
15. Sorrenti V, Marenda B, Fortinguerra S et al. Reference Values for a Panel of Cytokinergic and Regulatory Lymphocyte Subpopulations. Immune Netw. 2016 Dec; 16(6): 344–357.
16. Tanaka K, Kemmotsu K, Ogawa K et al. Flow cytometric analysis of helper T cell subsets (Th1 and Th2) in healthy adults. Rinsho Byori. 1998 Dec; 46(12): 1247–1251.
17. Niu HQ, Zhao XC, Li W et al. Characteristics and reference ranges of CD4+T cell subpopulations among healthy adult Han Chinese in Shanxi Province, North China. BMC Immunol. 2020 Aug 3; 21(1): 44.
18. Maini MK, Gilson RJ, Chavda N et al. Reference ranges and sources of variability of CD4 counts in HIV-seronegative women and men. Genitourin Med. 1996 Feb; 72(1): 27–31.
19. Santagostino A, Garbaccio G, Pistorio A et al. An Italian national multicenter study for the definition of a reference ranges for normal values of peripheral blood lymphocyte subsets in healthy adults. Haematologica. 1999 Jun; 84(6): 499–504.
20. Betterle C, Dalpra C, Greggio N et al. Autoimmunity in isolated Addison’s disease and in polyglandular autoimmune diseases type 1, 2 and 4. Ann Endocrinol (Paris). 2001 Apr; 62(2): 193–201.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue E-8-
All articles in this issue
- Dlouhodobá mechanická srdeční podpora v terapii chronického srdečního selhání – reálná praxe
- Přehled české literatury zaměřený na terminologii adherence k léčbě
- Imunitní odpověď na vakcinaci u starších lidí
- Tumorom indukovaná osteomalácia
- Th1, Th2 a Th17 lymfocyty u autoimunitních tyreopatií
- Letálne prípady intoxikácie etylalkoholom: zamyslenie sa nad príčinami
- 24hodinová mortalita seniorů akutně hospitalizovaných pro interní onemocnění – může být ovlivněna přítomností diabetu jako komorbidity?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Th1, Th2 a Th17 lymfocyty u autoimunitních tyreopatií
- Dlouhodobá mechanická srdeční podpora v terapii chronického srdečního selhání – reálná praxe
- Tumorom indukovaná osteomalácia
- Přehled české literatury zaměřený na terminologii adherence k léčbě
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career