-
Medical journals
- Career
Syndrom post-intenzivní péče
Authors: Otakar Pšenička; Jarmila Křížová
Authors‘ workplace: 3. interní klinika, VFN a 1. LF UK v Praze
Published in: Vnitř Lék 2021; 67(E-6): 8-12
Category: Review Articles
Overview
Díky pokrokům v intenzivní péči se zvyšuje počet pacientů propuštěných z jednotek intenzivní péče. Spolu s tím roste také zájem o sledování dlouhodobých následků prodělaného kritického onemocnění. Ukazuje se, že velká část pacientů po propuštění z jednotek intenzivní péče trpí postižením kognitivních, mentálních a fyzických funkcí. Soubor těchto následků je označován jako Post-intensive care syndrome (PICS). Spolu s pacienty jsou zvláště psychickými obtížemi často postiženy i jejich blízké osoby (PICS-Family, PICS-F). Dlouhodobé a trvalé následky po prodělání kritického onemocnění mohou vést ke ztrátě soběstačnosti, snížené kvalitě života, častým rehospitalizacím a četným dalším zdravotním a ekonomickým důsledkům. V předcházení rozvoje PICS je zásadní soubor preventivních opatření, uplatňujících se již během hospitalizace na JIP. Jedná se zejména o zamezení extenzivní sedace, management deliria a taktéž o časnou mobilizaci a důslednou rehabilitaci. Velmi diskutovaným tématem je také další ambulantní sledování propuštěných pacientů v různých zařízeních post-intenzivní péče.
Klíčová slova:
intenzivní péče – kvalita života – kritické onemocnění – syndrom post-intenzivní péče
Úvod a definice
V posledních dekádách došlo k velkému pokroku v intenzivní péči o kriticky nemocné pacienty. Díky tomu roste počet těch, kteří kritické onemocnění přežijí, a do popředí zájmu se dostává sledování dlouhodobých zdravotních následků, přetrvávajících po propuštění z jednotek intenzivní péče. Soubor těchto následků je označován jako Post-intensive care syndrome (PICS).
Ačkoliv v současnosti neexistuje oficiální jednotná definice, nejčastěji je termínem PICS označována nově vzniklá porucha či zhoršení funkce v jedné či více ze tří základních domén: kognitivní funkce, duševní zdraví, fyzické funkce (Obr. 1) u pacientů po prodělání kritického onemocnění a přetrvávající po propuštění ze zařízení akutní péče (1). To se týká jak pacientů v domácím prostředí, tak i těch hospitalizovaných v různých zařízeních následné péče. Do příznakového souboru PICS naopak nejsou zahrnuti pacienti s traumatickým poškozením mozku či cévní mozkovou příhodou.
Image 1. PICS diagram 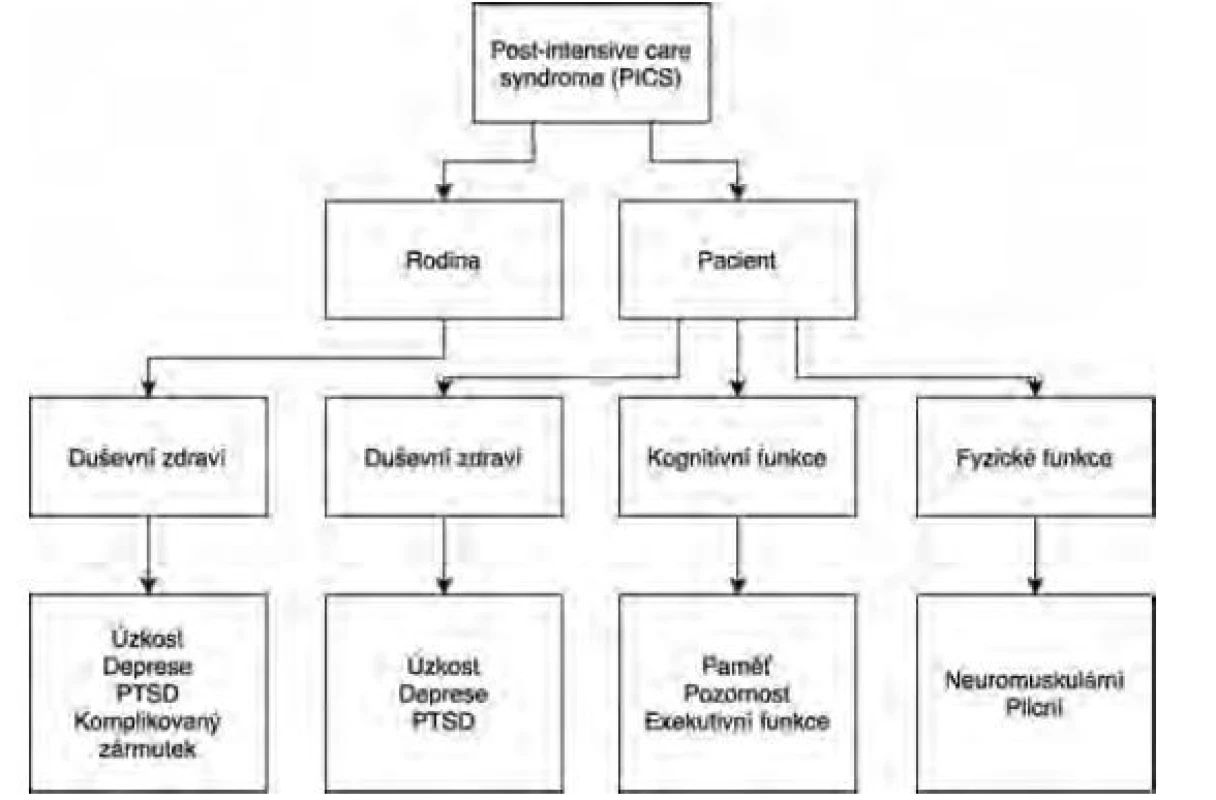
Volně podle Needham DM et al. (1) Termínem PICS-Family (PICS-F) jsou označovány příznaky u rodinných příslušníků či jiných blízkých osob, prožívané během kritického onemocnění, po propuštění nebo v případě úmrtí blízké osoby. Nejčastěji se jedná o symptomy spojené s úzkostí, depresí, post-traumatickou stresovou poruchou (PTSD) či tzv. komplikovaným zármutkem (complicated grief), ovlivňujícím běžné denní aktivity i po více než 6 měsících od ztráty blízké osoby (2).
Epidemiologie a rizikové faktory
Ačkoliv důsledky PICS představují obrovskou zátěž pro zdravotnictví a ekonomiku, jeho přesná prevalence není známa. Nejvíce dat z jednotek intenzivní péče pochází ze Spojených států amerických. V USA je na JIP každoročně přijímáno 5,7 milionů pacientů, z toho přibližně 4,8 milionů pobyt na ICU přežije. Odhaduje se, že nejméně polovina z těchto pacientů trpí některou z komponent PICS.
Relativně nejlépe jsou prozkoumány kognitivní příznaky, které se podle poměrně rozsáhlé studie BRAIN-ICU vyskytovaly po 3 měsících u více než poloviny sledovaných pacientů (oproti 6 % premorbidních kognitivních dysfunkcí) a u většiny pacientů kognitivní deficit přetrvával i po 12 měsících (3). Patogeneze rozvoje kognitivní dysfunkce je multifaktoriální. Nejvýznamnějším faktorem se zdá být přítomnost deliria. Dle prospektivních studií je doba trvání deliria na JIP nezávisle asociována s pozdějším rozvojem kognitivní dysfunkce (3). Dalšími rizikovými faktory jsou sepse a ARDS (4), předchozí kognitivní deficit či alkoholismus. Kognitivní poruchy může dále zhoršovat přítomnost hypoxemie (CHOPN, městnavé srdeční selhání, syndrom spánkové apnoe), hypotenze, dysregulace glukózového metabolismu, sedativní medikace a použití náhrady renálních funkcí (5).
Psychiatrická onemocnění s příznaky deprese, úzkosti a posttraumatické stresové poruchy (PTSD) jsou u pacientů po prodělaném kritickém onemocnění taktéž velice časté. Dle různých studií jejich výskyt kolísá v širokém rozmezí od jednoho do dvaašedesáti procent. Ve zmíněné studii BRAIN-ICU vykazovalo symptomy deprese 37 procent pacientů (3). Systematické přehledy observačních kohort identifikovaly klinicky signifikantní depresivní symptomy v průměru u 28 procent a symptomy PTSD u 22 procent pacientů. Rizikové faktory pro jejich vývoj jsou podobné výše zmíněným rizikovým faktorům pro vývoj kognitivních dysfunkcí. Zahrnují tedy těžkou sepsi, ARDS, respirační selhání, trauma, hypoglykemii a hypoxemii. Riziko dále zvyšuje ženské pohlaví, věk < 50 let, nižší stupeň vzdělání či nezaměstnanost, sedativa a analgetika užívaná za hospitalizace na JIP (6).
Nejčastějším typem fyzického postižení u kriticky nemocných je polyneuromyopatie kriticky nemocných (ICUAW – intensive care unit acquired weakness), která postihuje více než 25 procent pacientů. Rizikovými faktory silně asociovanými s rozvojem ICUAW jsou prolongovaná umělá plicní ventilace (více než 7 dní) a delší čas strávený na lůžku („bedrest“), a dále sepse a MODS (7–9).
Klinické projevy
Klinické projevy zahrnují širokou škálu kognitivních, psychiatrických a fyzických dysfunkcí, s nutnou podmínkou nově rozpoznaného stavu či jeho zhoršení po prodělání kritického onemocnění. Mezi třemi hlavními komponentami PICS existuje komplexní vztah, kdy dominantní postižení jedné z komponent ústí v rozvoj nové dysfunkce či zhoršení funkce v jiné doméně (20). Vztah ale platí i naopak – rehabilitace fyzických funkcí vede taktéž ke zlepšení kognitivních funkcí a psychiatrické morbidity (10–11). V intervenční studii, ve které byl sledován vliv časné mobilizace a rehabilitace na outcome mechanicky ventilovaných pacientů, bylo prokázáno, že intervenovaná skupina má nejen lepší funkční nezávislost při propuštění, ale taktéž kratší trvání deliria, a tedy i nižší riziko neuropsychiatrické morbidity (10–11).
Mezi běžné klinické projevy PICS patří poruchy paměti, pozornosti a koncentrace a taktéž postižení exekutivních funkcí. Tyto dysfunkce navíc negativně ovlivňují dodržování doporučené následné terapie (např. adherenci k doporučené medikaci, omezení v dietě, ambulantní kontroly atd.). Mezi další časté projevy PICS patří úzkosti, deprese a symptomy PTSD. Psychiatrická morbidita je asociována se sníženou kvalitou života jak u pacientů, tak i u jejich rodinných příslušníků (12). Typickými příznaky jsou podrážděnost, neklid, únava, nespavost a sexuální dysfunkce. V neposlední řadě trpí pacienti svalovou slabostí, jejíž projevy a závažnost může kolísat od obecného snížení mobility a výskytu opakovaných pádů, až po kvadruparézu (4, 7, 8). Všechny tyto projevy vedou ve svém důsledku k závažným omezením v činnostech běžného života, ztrátě soběstačnosti a snížené kvalitě života (12).
Diagnostika
Post-intensive care syndrom je velmi poddiagnostikován, zejména proto, že neexistuje žádný specifický screeningový test k jeho identifikaci. V diagnostice PICS se uplatňuje množství metod a testů. Pro diagnostiku kognitivní dysfunkce jsou používány dotazníkové metody (MMSE, The Mini-Cog, The Montreal Cognitive Assessement – MoCA), které jsou ověřeny v běžné populaci. K diagnostice PICS se jeví vhodnější MoCA (obr. 2), neboť lépe identifikuje mírné postižení kognitivních funkcí. Pro identifikaci psychických poruch existuje množství screeningových testů, z nichž však žádný není cílen specificky na PICS. Používány jsou sebeposuzující dotazníky (PHQ-2, PHQ-9) i dotazníky, které vyplňuje lékař (PRIME-MD, MINI). V diagnostice svalové slabosti se uplatňují metody vycházející z klinického hodnocení, například škála Medical Research Council (MRC), síla stisku ruky (hand grip strength), ultrazvukové vyšetření svalů, či vyšetření ke zhodnocení síly respiračních svalů (nejsnáze změřitelným parametrem je FEV1, tedy usilovně vydechnutý objem vzduchu za jednu sekundu) (13). Ke zhodnocení funkční zdatnosti se používá například šestiminutový test chůze (6 - MWT) či TUG test (Timed‚ Up & Go‘). Při šestiminutovém testu chůzí je měřena vzdálenost, kterou pacient ujde za šest minut, při TUG testu je měřen čas, za který sedící pacient vstane ze židle, ujde tři metry, otočí se a sedne si zpět. Elektrofyziologické vyšetření (neurografie, EMG) není vzhledem k invazivitě a také časové a ekonomické náročnosti používáno rutinně v klinické praxi, uplatnění nachází spíše ve výzkumné oblasti (13).
Image 2. MoCA test 
(Zdroj: https://www.mocatest.org/) Prevence vzniku PICS – přístup ABCDE a další management
Součástí adekvátního managementu pacientů s kritickým onemocněním, zvláště těch v rekonvalescentní fázi, je vždy myslet na možnost rozvoje PICS a snažit se předcházet jeho vzniku. Stejně jako u mnoha jiných diagnóz zde platí, že prevence je lepší než léčba. V prevenci rozvoje PICS se osvědčil soubor evidence-based postupů, označovaných jako přístup ABCDE (tab. 1). „Awaking and Breathing Coordination“ značí snahu o koordinaci hloubky sedace a mechanické ventilace pomocí cílených protokolů, za kombinace denních zkoušek spontánního probouzení a testů spontánního dýchání (14, 15). Písmeno „D“ označuje monitorování a management Deliria. Dle výsledků klinických studií ovlivňuje hloubku a délku deliria již volba léčiv užívaných k sedaci a analgezii. Rizikové je zejména podání benzodiazepinů. Ve studii zkoumající různé klinické parametry u pacientů sedovaných midazolamem v porovnání s dexmedetomidinem měla skupina pacientů léčených dexmedetomidinem méně delirií a strávila méně času na mechanické ventilaci. V neposlední řadě je kladen důraz na časnou mobilizaci a cvičení (Early mobility and Exercise) již během hospitalizace na JIP (14, 15).
Table 1. Přístup ABCDE v prevenci PICS 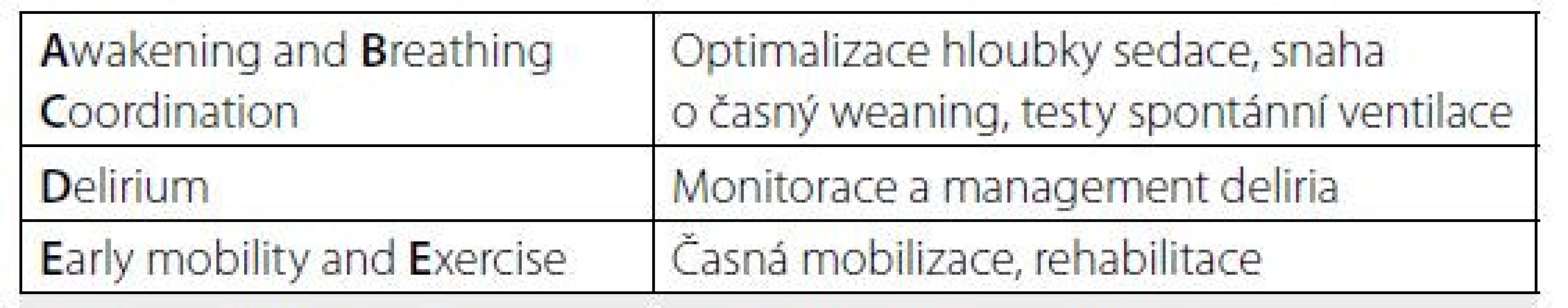
Volně podle Morandi et al. (14) Dále je nutné brát zřetel na časný záchyt a management hypoglykemie (dle některých studií je škodlivá zejména výraznější glykemická variabilita) a zajištění adekvátní výživy. Mezi důležitá preventivní opatření patří také snaha o zamezení spánkové deprivace pacienta. Studie zkoumající různé farmakologické i nefarmakologické metody však přinesly rozporuplné výsledky, optimální metody zajištění kvalitního spánku kriticky nemocných pacientů tedy nejsou známy. Podle některých prací může mít pozitivní efekt například použití ušních ucpávek či terapie melatoninem.
Zásadní je bezpochyby důkladná edukace pacienta a jeho blízkých o všech aspektech onemocnění a jeho léčby. Nápomocné mohou být také deníky z pobytu na JIP, vedené zdravotnickým personálem či rodinou pacienta. Ukazuje se, že vyplnění výpadků paměti z pobytu na JIP má efekt na redukci výskytu úzkostných poruch a příznaků PTSD (16).
Často diskutovaným tématem je další sledování pacientů v různých institucích post-intenzivní péče. V některých zemích, například ve Velké Británii, existují již řadu let kliniky post-intenzivní péče. Velký rozmach zažívá post-intenzivní péče ve Spojených státech amerických (17). Zatím jsou však data ze sledování přeživších velmi limitovaná a efektivita sledování je tedy otazná (18). Metodika prováděných kontrol navíc není standardizována. Nicméně studie, ve kterých jsou dotazováni přímo pacienti, ukazují, že je follow-up samotnými klienty vnímán velmi pozitivně (19).
Kromě péče o pacienty je důležitá také komplexní péče o jejich blízké. Nutná je dobrá komunikace mezi zdravotnickým personálem a rodinou pacienta. V redukci výskytu psychických poruch a dalších složek PICS-F se osvědčily i informační brožury či webové stránky (20).
Závěr
Zkušenosti poslední dekády ukazují, že další obrovskou výzvou pro obor intenzivní péče je zlepšení dlouhodobé prognózy a kvality života pacientů, kteří prodělali kritické onemocnění. Zvláště pro lékaře, zdravotní sestry a další personál jednotek intenzivní péče je velice důležité mít povědomí o souboru více či méně trvalých následků, kterými jejich pacienti po propuštění trpí, a snahu těmto následkům předcházet. Pacienti by neměli být přehnaně sedováni, naopak je důležitá jejich časná aktivizace, mobilizace a rehabilitace. Nutná je kvalitní komunikace s jejich rodinnými příslušníky a v ideálním případě i další ambulantní sledování.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jarmila Křížová, Ph.D.
3. interní klinika, VFN a 1. LF UK v Praze, U Nemocnice 504/1, 128 08 Praha 2
Cit. zkr: Vnitř Lék 2021; 67(e6): e8–e12
Článek přijat redakcí: 30. 1. 2021
Článek přijat po recenzích k publikaci: 14. 7. 2021
Sources
1. Needham DM, Davidson J, Cohen H et al. Improving long-term outcomes after discharge from intensive care unit: report from a stakeholders' conference. Crit Care Med. 2012 Feb; 40(2): 502–9. doi: 10.1097/CCM.0b013e318232da75.
2. Davidson JE, Jones C, Bienvenu OJ. Family response to critical illness: postintensive care syndrome-family. Crit Care Med. 2012 Feb; 40(2): 618–24. doi: 10.1097/ CCM.0b013e318236ebf9.
3. Pandharipande PP, Girard TD, Jackson JC et al. BRAIN-ICU Study Investigators. Long - -term cognitive impairment after critical illness. N Engl J Med. 2013 Oct 3; 369(14): 1306 – 16. doi: 10.1056/NEJMoa1301372.
4. Iwashyna TJ, Ely EW, Smith DM et al. Long-term cognitive impairment and functional disability among survivors of severe sepsis. JAMA. 2010 Oct 27; 304(16): 1787–94. doi: 10.1001/jama.2010.1553.
5. Sakusic A, O'Horo JC, Dziadzko M et al. Potentially Modifiable Risk Factors for Long-Term Cognitive Impairment After Critical Illness: A Systematic Review. Mayo Clin Proc. 2018 Jan; 93(1): 68–82. doi: 10.1016/j.mayocp.2017.11.005.
6. Wade DM, Howell DC, Weinman JA et al. Investigating risk factors for psychological morbidity three months after intensive care: a prospective cohort study. Crit Care. 2012 Oct 15; 16(5): R192. doi: 10.1186/cc11677.
7. Fan E, Dowdy DW, Colantuoni E et al. Physical complications in acute lung injury survivors: a two-year longitudinal prospective study. Crit Care Med. 2014 Apr; 42(4): 849–59. doi: 10.1097/CCM.0000000000000040.
8. Hermans G, Van Mechelen H, Clerckx B et al. Acute outcomes and 1-year mortality of intensive care unit-acquired weakness.A cohort study and propensity-matched analysis. Am J Respir Crit Care Med. 2014 Aug 15; 190(4): 410–20. doi: 10.1164/rccm.201312–2257OC.
9. Needham DM, Wozniak AW, Hough CL et al. National Institutes of Health NHLBI ARDS Network. Risk factors for physical impairment after acute lung injury in a national, multicenter study. Am J Respir Crit Care Med. 2014 May 15; 189(10): 1214–24. doi: 10.1164/rccm. 201401–0158OC.
10. Hopkins RO, Suchyta MR, Farrer TJ et al. Improving post-intensive care unit neuropsychiatric outcomes: understanding cognitive effects of physical activity. Am J Respir Crit Care Med. 2012 Dec 15; 186(12): 220–8. doi: 10.1164/rccm.201206–1022CP.
11. Bienvenu OJ, Colantuoni E, Mendez-Tellez PA et al. Cooccurrence of and remission from general anxiety, depression, and posttraumatic stress disorder symptoms after acute lung injury: a 2-year longitudinal study. Crit Care Med. 2015 Mar; 43(3): 642–53. doi: 10.1097/CCM.0000000000000752.
12. Griffiths J, Hatch RA, Bishop J et al. An exploration of social and economic outcome and associated health-related quality of life after critical illness in general intensive care unit survivors: a 12-month follow-up study. Crit Care. 2013 May 28; 17(3): R100. doi: 10.1186/cc12745.
13. Latronico N, Bolton CF. Critical illness polyneuropathy and myopathy: a major cause of muscle weakness and paralysis. Lancet Neurol. 2011 Oct; 10(10): 931–41. doi: 10.1016/ S1474–4422(11)70178–8.
14. Morandi A, Brummel NE, Ely EW. Sedation, delirium and mechanical ventilation: the 'ABCDE' approach. Curr Opin Crit Care. 2011 Feb; 17(1): 43–9. doi: 10.1097/MCC. 0b013e3283427243.
15. Balas MC, Vasilevskis EE, Olsen KM et al. Effectiveness and safety of the awakening and breathing coordination, delirium monitoring/management, and early exercise/mobility bundle. Crit Care Med. 2014 May; 42(5): 1024–36. doi: 10.1097/ CCM.0000000000000129.
16. Barreto BB, Luz M, Rios MNO et al. The impact of intensive care unit diaries on patients' and relatives' outcomes: a systematic review and meta-analysis. Crit Care. 2019 Dec 16; 23(1): 411. doi: 10.1186/s13054–019–2678–0. doi: 10.1186/s13054–019–2678–0.
17. Stollings JL, Caylor MM. Postintensive care syndrome and the role of a follow-up clinic. Am J Health Syst Pharm. 2015 Aug 1; 72(15): 1315–23. doi: 10.2146/ajhp140533.
18. Lasiter S, Oles SK, Mundell J et al. A Scoping Review of Interventions and Outcomes. Clin Nurse Spec. 2016 Jul-Aug; 30(4): 227–37. doi: 10.1097/NUR.0000000000000219.
19. Farley KJ, Eastwood GM, Bellomo R. A feasibility study of functional status and follow - -up clinic preferences of patients at high risk of post intensive care syndrome. Anaesth Intensive Care. 2016 May; 44(3): 413–9. doi: 10.1177/0310057X1604400310.
20. Mistraletti G, Umbrello M, Mantovani ES et al. A family information brochure and dedicated website to improve the ICU experience for patients' relatives: an Italian multicenter before-and-after study. Intensive Care Med. 2017 Jan; 43(1): 69–79. doi: 10.1186/cc7769.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue E-6
Most read in this issue- Syndrom post-intenzivní péče
- Šokový stav a další komplikace po uštknutí jedovatým hadem
- 24-hodinová mortalita seniorov akútne hospitalizovaných pre internistické ochorenie
- Za doc. MUDr. Janem Malým, CSc.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

