-
Medical journals
- Career
Doporučená očkování pro diabetiky
Authors: Petra Macounová; Rastislav Ma Ar
Authors‘ workplace: Ústav epidemiologie a ochrany veřejného zdraví, Lékařská fakulta, Ostravská univerzita
Published in: Vnitř Lék 2020; 66(5): 301-307
Category:
Overview
Diabetes mellitus je název skupiny chronických onemocnění, při kterých vlivem absolutního či relativního nedostatku inzulinu dochází k hyperglykemii. Hyperglykemické prostředí způsobuje poruchy buněk přirozené imunity, což vede ke snížené funkci imunitního systému, a proto jsou diabetici náchylnější k infekcím. Kvůli imunitní dysfunkci jsou u nich infekce nejen častější, ale mívají také závažnější průběh a vyšší úmrtnost než lidé bez diabetu. Přesto je u diabetiků zachována adekvátní imunitní odpověď na podání očkovací látky, tudíž je možné využít jednu z nejefektivnějších možností prevence infekcí, kterou představuje právě očkování. Při vakcinaci diabetiků je vhodné preferovat inaktivované vakcíny, jejichž použití je bezpečné i u imunokompromitovaných osob, samozřejmě při respektování obecných kontraindikací. Tento článek je zaměřen na pět nejčastějších, očkováním preventabilních infekcí, včetně vakcín, které jsou diabetikům doporučovány.
Klíčová slova:
diabetes mellitus – infekce – prevence – očkování – očkování diabetiků – vakcinace
Diabetes mellitus
Diabetes mellitus (DM) je pojem označující skupinu chronických onemocnění, která se vyznačují hyperglykemií zapříčiněnou absolutním či relativním nedostatkem inzulinu. Dle současné klasifikace jsou popsány čtyři typy diabetu: DM 1. typu, DM 2. typu, ostatní specifické typy DM a gestační DM. Onemocnění DM 1. typu je způsobeno absolutním nedostatkem inzulinu a vzniká v důsledku autoimunitního procesu, při kterém dochází k selektivní destrukci β‑buněk Langerhansových ostrůvků pankreatu. Nejčastější metabolickou poruchou je DM 2. typu, při kterém je nedostatek inzulinu relativní, avšak onemocnění progreduje a po vyčerpání β‑buněk dochází také ke vzniku absolutního nedostatku inzulinu (1–3). Dle Ústavu zdravotnických informací a statistiky ČR (ÚZIS) trpí 91,5 % hlášených diabetiků právě DM 2. typu. Za posledních 20 let došlo dle statistických údajů k dvojnásobnému nárůstu diabetiků 2. typu v ČR (1, 4). DM představuje závažný zdravotnický problém jak v ČR, tak i celosvětově, jelikož počet pacientů s diabetem stále závratným tempem narůstá. V roce 1980 bylo dle Světové zdravotnické organizace (WHO) na světě 108 milionů diabetiků, dále se odhadovalo, že v roce 2025 bude ve světě 380 milionů diabetických pacientů, přičemž ve skutečnosti bylo podle WHO už v roce 2014 ve světě dokonce 422 milionů diabetiků (5, 6).
Infekce a očkování diabetiků
Infekční onemocnění se u diabetiků obecně vyskytují častěji a/nebo mají závažnější průběh, což potenciálně vede k vyšší morbiditě a mortalitě proti běžné zdravé populaci. Větší náchylnost k infekcím je zapříčiněna hyperglykemickým prostředím, které jednak zvyšuje virulenci některých patogenů, ale zejména způsobuje poruchy buněk přirozené imunity, jako je například zhoršená funkce neutrofilů, monocytů a makrofágů, snížená chemotaxe a fagocytóza a nižší produkce interleukinů v reakci na infekci, kvůli čemuž dochází k imunitní dysfunkci. U diabetiků tedy vlivem hyperglykemie a hyperinzulinemie dochází ke změnám funkčních vlastností vrozeného imunitního systému, ale funkce adaptivního imunitního systému nejsou ovlivněny vůbec nebo jen velmi málo (6, 7). Při očkování dochází ke stimulaci imunitního systému na různých úrovních. Aplikace vakcíny aktivuje přirozené imunitní procesy, ale nepředstavuje žádné mimořádné zatížení. Pacienti s diabetem mají obvykle zachovanou adekvátní odpověď imunitního systému na podanou očkovací látku. Při vakcinaci diabetiků by mělo být upřednostněno použití inaktivovaných (usmrcených) vakcín, které jsou navrženy tak, aby jejich aplikace byla bezpečná i u osob se zdravotními poruchami. V případě podání živých atenuovaných vakcín je třeba vyšší obezřetnosti a pečlivého zvážení rizik a benefitů tohoto očkování, zvláště pak u pacientů s nestabilní glykemií a významnou poruchou imunitního systému. Při výběru očkovací látky je rovněž vhodné preferovat ty, které obsahují na thymu závislé (dependentní) antigeny, exogenní (TD‑Ex) či endogenní (TD‑En). Na rozdíl od na thymu nezávislých antigenů, které přímo stimulují B‑lymfocyty proliferující v plazmatickou buňku produkující imunoglobuliny, u antigenů na thymu závislých jsou nejprve v přítomnosti Th2 u TD‑Ex a Th1-lymfocytů u TD‑En zpracované antigen prezentující buňkami. Poté dochází ke stimulaci B‑lymfocytů a cytotoxických T‑lymfocytů. Aplikace vakcíny, jejíž antigen musí být prezentován v buňkách prezentujících antigen, vede k lepší, intenzivnější a komplexnější imunitní odpovědi, a proto jsou pro diabetiky (nebo obecně imunosuprimované osoby) vhodnější (8–10). Kromě toho, že diabetičtí pacienti mívají závažnější průběh některých infekcí, mohou tyto infekce také způsobit závažné metabolické komplikace, jako např. ketoacidózu, hypoglykemii nebo kóma. Uvádí se, že diabetickou ketoacidózu vyvolá infekční onemocnění až v 75 % případů, přičemž míra úmrtnosti pacientů s kombinací infekce a ketoacidózy je 43 %, z čehož jasně vyplývá, jak důležité je chránit diabetiky před infekcemi, například právě očkováním (1, 7). V případě povinného očkování, které se týká především dětských diabetiků 1. typu, nejsou třeba žádná mimořádná opatření a vakcíny lze aplikovat v souladu s platným očkovacím kalendářem (9). Následující text proto bude zaměřen zejména na očkovací látky nad rámec pravidelného (povinného) očkování, stručný přehled popsaných vakcín je vyobrazen v tabulce 1.
Table 1. Přehled doporučených vakcín pro dospělé diabetiky 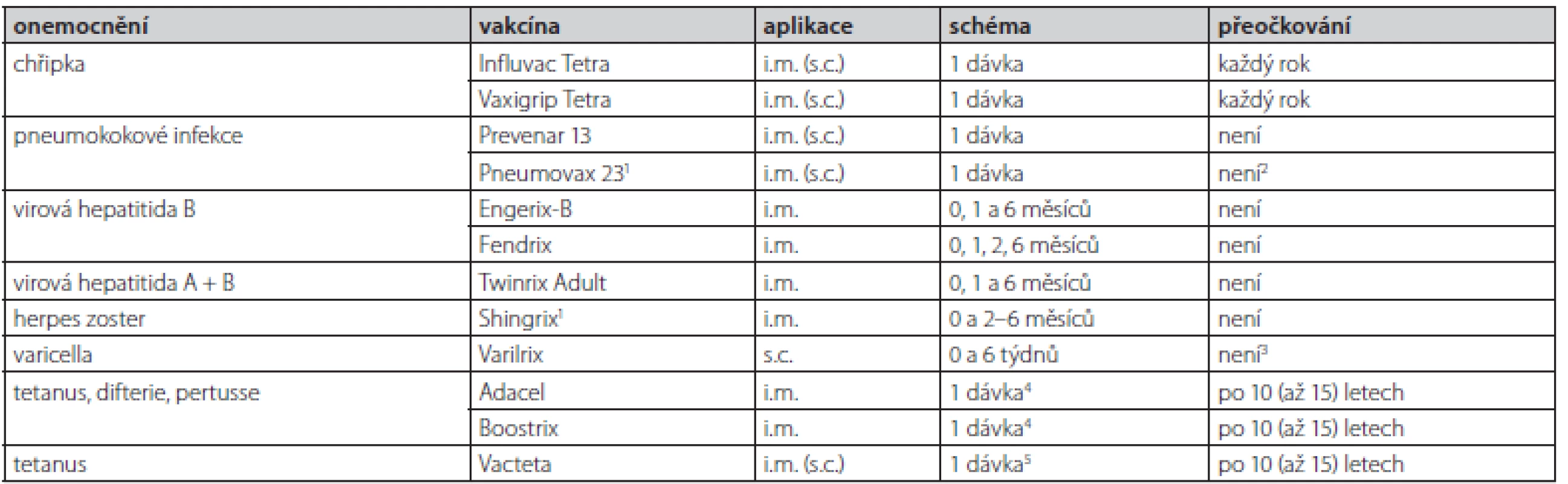
1Vakcíny již registrovány v ČR, zatím však nejsou na trhu
2 U pacientů s vysokým rizikem IPO je dle SPC možné zvážit přeočkování po 5 letech
3U vysoce rizikových pacientů se dle SPC doporučuje sledovat hladinu protilátek a při poklesu případně přeočkovat
4Pouze v rámci pravidelného přeočkování po kompletním očkování proti tetanu, vakcíny nemají být podány osobám s nekompletním nebo chybějícím základním očkováním difterickým nebo tetanovým toxoidem
5Pokud nebyl jedinec dosud očkován, či uplynulo více než 15 let od posledního očkování, je třeba zaočkovat 3 dávkami ve schématu 0, 4–6 týdnů, 6–12 měsícůInfekce a farmakologická léčba diabetu
Pro farmakologickou léčbu DM se využívají perorální antidiabetika (PAD) a inzulin, či kombinace obojího. Některé PAD způsobují nežádoucí účinky, které mohou vést k většímu riziku vzniku infekcí či zhoršovat jejich průběh, například u nasopharyngitid, infekcí horních cest dýchacích, infekcí urogenitálního traktu (11–13). Infekce horních cest dýchacích a nasopharyngitidy jsou popsány jako nežádoucí účinky při léčbě gliptiny, tedy inhibitory DPP-4, konkrétně např. sitagliptin, vildagliptin (velmi vzácné), saxagliptin (časté), alogliptin (časté), u linagliptinu je uvedena nasopharyngitida jako méně častý nežádoucí účinek (14). Infekce urogenitálního traktu způsobují jak gliptiny (častý nežádoucí účinek u saxagliptinu), tak zejména glifoziny (dapagliflozinum, canagliflozinum, empagliflozinum), vzhledem k navozené glykosurii při jejich užívání (3). Občas se vyskytují také nežádoucí účinky v podobě poruch krvetvorby (agranulocytóza, trombocytopenie, leukopenie, granulocytopenie nebo aplazie kostní dřeně), což může vést ke snížené imunitní odpovědi organismu zejména proti infekcím bakteriálního původu. Poruchy krvetvorby a lymfatického systému způsobují deriváty sulfonylurey – glimepirid, gliclazid, glichidon a glyburid (14). Dalším problémem může být kontraindikace užívání PAD v případě těžkých infekcí, poruchy renálních či jaterních funkcí nebo respirační insuficience. Z těchto důvodů je u diabetiků zvýšené riziko komplikací při nákaze např. virovými hepatitidami či respiračními nákazami (11–13).
Infekce dýchacích cest
Diabetici jsou náchylní k infekcím dýchacích cest, nejčastěji těch způsobených bakterií Streptococcus pneumoniae nebo chřipkovými viry. Během chřipkových epidemií jsou dle statistik osoby s DM hospitalizovány až šestkrát častěji než nediabetičtí pacienti. Diabetici navíc mají vyšší úmrtnost na pneumonie oproti lidem bez DM. Poradní výbor pro imunizační praktiky Centra pro kontrolu a prevence nemocí (CDC – Centers for Disease Control and Prevention) proto doporučuje diabetikům očkování proti chřipce a pneumokokům. Imunizace vakcínami snižují počet těchto onemocnění, počet hospitalizací a jejich délku, počet úmrtí a samozřejmě také související náklady vynaložené na léčbu těchto pacientů (6).
Chřipka
Očkování diabetiků proti chřipce doporučují uznávané zdravotnické organizace, jako například WHO, CDC, Americká asociace pro diabetes (ADA – American Diabetes Association) nebo americká Poradní komise pro imunizační postupy (ACIP – Advisory Committee on Immunization Practices), jakož i Česká diabetologická společnost ČLS JEP, podle které je v ČR očkování této skupiny pacientů stále podceňováno. Kromě toho, že u diabetiků je 6× vyšší pravděpodobnost hospitalizace během epidemie chřipky, je u nich pozorována také výrazně vyšší smrtnost na chřipku, která se pohybuje mezi 5–15 %. Řada studií již prokázala, že vakcinace diabetiků proti chřipce představuje účinnou a nákladově efektivní metodu snižování počtu hospitalizací a souvisejících komplikací (9) (15). V roce 2018 (Dos Santos et al.) byl publikován systematický přehled patnácti studií poskytujících údaje o imunogenitě, bezpečnosti, účinnosti a/nebo nákladové efektivnosti sezónního očkování proti chřipce u diabetických pacientů. Imunogenita sezónního očkování proti chřipce u diabetických pacientů byla obecně srovnatelná s imunitou zdravých účastníků. Sezónní očkování proti chřipce snížilo riziko hospitalizace a úmrtnosti u diabetických pacientů, zejména u pacientů ve věku nad 65 let. Tyto přehledy dokazují potřebu a význam každoročního očkování proti chřipce u diabetických pacientů, zejména při zmírňování závažných komplikací, snižování počtu hospitalizací a úmrtí (16). Například ve studii z roku 2014 (Rodriguez‑Blanco et al.) bylo očkování proti chřipce u diabetiků nad 65 let spojeno se statisticky významným snížením úmrtnosti ze všech příčin o 33 %, což je v souladu s výsledky předchozí nizozemské studie, která ukázala snížení o 28 % (17). Existují také důkazy, že chřipka může u diabetiků vyvolat akutní kardiovaskulární příhody, jako například infarkt myokardu nebo cévní mozkovou příhodu, přičemž riziko těchto komplikací je 2–4× vyšší oproti nediabetickým pacientům. Vakcína proti chřipce tak chrání nejen proti chřipce samotné, ale může mít také účinek v podobě snížení kardiovaskulární úmrtnosti (15).
Očkování proti sezónní chřipce je možné indikovat u osob starších 6 měsíců, a to jednou dávkou očkovací látky každý rok, ideálně na podzim. U dětí do 9 let, které nebyly v minulosti očkovány, se doporučuje podání druhé dávky s minimálním odstupem 4 týdny po dávce první. Chřipkové vakcíny se aplikují intramuskulárně či subkutánně do deltového svalu. V současnosti jsou k dispozici čtyřvalentní vakcíny Influvac Tetra a Vaxigrip Tetra, které postupně nahrazují dříve používané trivalentní vakcíny, v souladu s doporučením České vakcinologické společnosti ČLS JEP. Obě tyto vakcíny jsou podle zákona o veřejném zdravotním pojištění rizikovým skupinám osob, mezi kterými jsou vyjmenovány právě i osoby trpící diabetem, plně hrazeny ze zdravotního pojištění. Přechod na tetravalentní vakcíny je uskutečňován zejména z důvodu širší ochrany před viry chřipky, tetravalentní vakcína totiž obsahuje kromě dvou vybraných subtypů chřipky A také oba kmeny chřipky B (trivalentní chrání pouze proti jednomu kmenu chřipky B). Je také vhodné upřednostnit splitové štěpené vakcíny s obsahem TD‑Ex, které se vyznačují nízkou reaktogenitou a současně vysokou imunogenitou, před vakcínami celovirionovými, které jsou poměrně reaktogenní. Nižší reaktogenitu a přitom dobrou imunogenitu vykazují vakcíny subjednotkové, u nichž však převažují na thymu nezávislé antigeny, a proto by u diabetiků měly být upřednostňovány vakcíny štěpené, které vyvolávají pro ně vhodnější typ imunitní odpovědi. Zároveň se doporučuje očkování zdravotnických pracovníků a členů rodiny, kteří jsou s diabetikem v častém kontaktu (9, 18).
Pneumokokové infekce
Podobně jako očkování proti chřipce, také to proti pneumokokovým infekcím patří mezi základní vakcíny pro diabetiky. Bylo prokázáno, že diabetici jsou vnímavější vůči pneumokokům, zejména ti starší 65 let. U diabetiků je riziko vzniku pneumonie a invazivních pneumokokových onemocnění (IPO) 1,4–6× vyšší. Zvýšené riziko pneumokokového onemocnění u diabetických pacientů je způsobeno poškozujícím účinkem hyperglykemie na imunitní a/nebo plicní funkci. Zmíněné riziko může být u pacientů nad 65 let dokonce 9× vyšší, přičemž se ještě zvyšuje v případě přítomnosti dalších komorbidit (jako např. chronické srdeční choroby, kouření, chronická onemocnění jater, alkoholismus, astma a chronická plicní nemoc) (9, 19). Podle posledních doporučení ACIP mají být rizikoví pacienti očkováni pneumokokovou konjugovanou vakcínou s nejširším pokrytím, což je v současnosti 13valentní vakcína Prevenar 13 (PCV13), určená pro děti od 6 týdnů věku i dospělé osoby. Dle zákona o veřejném zdravotním pojištění je očkování proti pneumokokovým infekcím vakcínou Prevenar 13 plně hrazeno osobám nad 65 let a od roku 2018 nově také rizikovým skupinám pojištěnců bez ohledu na věk. U dospělých osob nastává po intramuskulární aplikaci 1 dávky této vakcíny dlouhodobá ochrana, nutnost přeočkování nebyla stanovena (9, 20). V klinických studiích vakcíny Prevenar 13 u dospělých nad 18 let, včetně osob starších 65 let, a to jak zdravých, tak i těch se stabilními základními onemocněními, která jsou predispozicí k pneumokokovým infekcím (jmenovitě i diabetes mellitus), byla prokázána dobrá imunogenicita a bezpečnost podání této vakcíny. Prevenar 13 může být aplikován současně se sezónní trivalentní inaktivovanou chřipkovou vakcínou, nebo s tetravalentní inaktivovanou chřipkovou vakcínou. V případě simultánního očkování proti pneumokokům a chřipce je vhodné preferovat tetravalentní chřipkovou vakcínu, nejen z důvodu širší ochrany proti chřipce, ale také kvůli nesnížené imunitní odpovědi. Při současném podání Prevenaru 13 s trivalentní vakcínou totiž dochází ke snížené imunitní odpovědi na některé sérotypy pneumokoků. Během simultánního očkování se preferuje aplikace vakcín do dvou různých míst, zpravidla každá do jedné paže, případně obě do stejné paže se vzdáleností aplikačních míst minimálně 3 cm (21). Na trhu je rovněž dostupná konjugovaná 10valentní pneumokoková vakcína Synflorix, ta je však určena pouze dětem ve věku od 6 týdnů do 5 let. Dříve bylo doporučováno po aplikaci PCV13 rozšířit ochranu proti IPO a přeočkovat jedince polysacharidovou 23valentní vakcínou (PPSV23), s minimálním odstupem 8 týdnů od PCV13, avšak u k tomu účelu používané očkovací látky Pneumo 23 byla v roce 2017 celosvětově ukončena výroba, tudíž tento postup již není možné dodržet. Naopak osoby, kterým byla v minulosti aplikována Pneumo 23, by měly být v rozmezí 1–5 let poté přeočkovány PCV13. Již nedostupnou Pneumo 23 by mohla na českém trhu nahradit ekvivalentní očkovací látka Pneumovax 23 (taktéž PPSV23), která je v zahraničí běžně dostupná a u nás v roce 2019 získala registraci od Státního ústavu pro kontrolu léčiv. Pneumovax 23 je určen dětem od 2 let, dospívajícím i dospělým, aplikuje se intramuskulárně či subkutánně. U zdravých osob se podává 1 dávka vakcíny, bez nutnosti přeočkování, to lze dle SPC zvážit u osob se zvýšeným rizikem pneumokokových infekcí, které byly očkovány před více než 5 lety. Je možné současné podání s chřipkovou vakcínou, přičemž se opět každá z nich aplikuje do jiného místa. I přes to, že je Pneumovax 23 v ČR registrován, na trhu se zatím neobjevil. Až se tak stane, bude pravděpodobně doporučení k revakcinaci osob s významným rizikem IPO upraveno dle místních vakcinačních autorit (22).
Virová hepatitida B
Virová hepatitida typu B (VHB) je infekce napadající jaterní tkáň, s průběhem akutním nebo také chronickým, která se přenáší nejčastěji krví a dalšími tělními tekutinami. Dle WHO patří mezi největší zdravotnické problémy současnosti, zejména v rozvojových zemích. I přesto, že v ČR je v posledních letech pozorován příznivý trend výskytu VHB, což lze považovat za úspěch dlouhodobě probíhajícího pravidelného očkování naší populace, u diabetiků je riziko nákazy mnohem vyšší než u zdravých lidí. Příčinou zvýšeného rizika infekce VHB u diabetiků je častý kontakt s krví, zejména při pravidelném měření hladiny glukózy v krvi a při aplikaci inzulinu. Podle ACIP byl přenos VHB dokumentován během asistovaného monitorování hladiny glukózy v krvi, a to kvůli vícenásobnému použití jednorázového zařízení pro odběr kapilární krve z prstu a nedostatečné dezinfekci a čištění glukometrů mezi pacienty. Přenos VHB tímto způsobem byl zaznamenán v různých prostředích, jako jsou například zařízení dlouhodobé péče, nemocnice, zařízení sociální péče, ambulantní chirurgická centra nebo soukromé ordinace. Riziko infekce se u diabetiků zvyšuje také kvůli přidruženým komplikacím diabetu, jako jsou špatně se hojící, dlouhodobě otevřené rány, které jsou snadnou vstupní branou infekce (23). Výsledky nedávné čínské studie (Zhang et al., 2019) ukazují, že riziko infekce VHB je vyšší u jedinců s diagnózou diabetes mellitus, jelikož relativní riziko infekce hepatitidou B u pacientů s diabetem bylo o 43 % vyšší než u osob bez diabetu (24). Na reprezentativním vzorku populace v USA se ukázala dokonce o 60 % vyšší séroprevalence protilátek proti jádrovému antigenu hepatitidy B (svědčící o přítomné nebo proběhlé infekci VHB) u osob ve věku ≥ 18 let s diagnostikovaným diabetem ve srovnání s osobami bez diabetu. Kromě zvýšeného rizika nákazy hrozí diabetikům také vyšší riziko komplikací a závažnějšího průběhu hepatitidy B. V americké populaci byla pozorována vyšší úmrtnost na akutní VHB u osob s diagnostikovaným diabetem ve srovnání s osobami bez diabetu, ačkoli rozdíl nebyl statisticky významný. U zdravých dospělých progreduje akutní infekce do chronicity přibližně v 5 % případů, u diabetiků je však pozorováno procento vyšší. Chronická infekce vede k cirhóze a rakovině jater u ≥ 15 % dospělých, přičemž studie veteránů v USA ukázala, že diabetes sám o sobě u dospělých zvyšuje riziko chronického nealkoholického onemocnění jater a hepatocelulárního karcinomu přibližně dvojnásobně oproti osobám bez diabetu (23).
Z těchto důvodů se očkování proti hepatitidě typu B doporučuje všem dosud neočkovaným diabetikům, což jsou u nás osoby narozené před rokem 1989, u kterých ještě nebylo zavedeno povinné očkování proti VHB, samozřejmě v případě, že nebyly zaočkovány z jiných důvodů (zvláštní očkování u některých profesí či očkování na vlastní žádost). Podle doporučení ACIP by mělo být očkování proti hepatitidě B zahájeno co nejdříve po diagnostikování diabetu. Vakcína proti hepatitidě B může být bezpečně podávána osobám jakéhokoli věku. V mladším věku je imunitní odpověď na vakcínu podobná u dospělých s diabetem i bez něj, tzn. že vysoké hladiny séroprotekce jsou bezpečně dosaženy u dětí s diabetem, avšak dospělí s diabetem mají sníženou odpověď na očkování. Podíl dospělých, kteří dosáhnou séroprotekce (≥ 10 mIU/ ml protilátky na povrchový antigen hepatitidy B anti‑HBs) po obdržení 3-dávkového schématu, se snižuje s věkem, obezitou, kouřením, imunosupresí a komorbidními stavy včetně diabetu. Řešením může být podávání schémat s prodlouženým intervalem poslední dávky, podání čtyř místo tří dávek nebo další přeočkování po absolvování standardního schémata, což může pomoci dosáhnout séroprotekce u větší části dospělých s diabetem, včetně těch, kteří nereagují na počáteční dávky vakcíny. Revakcinace dalšími 1–3 dávkami vakcíny proti hepatitidě B dle doporučení ACIP bezpečně zvyšuje podíl dospělých, kteří dosáhnou ochranné úrovně anti‑HBs ≥ 10 mIU/ml, u nás se však revakcinace proti VHB rutinně neprovádí. Postvakcinační délka ochrany před infekcí VHB u zdravých osob trvá > 22 let, trvání imunity u osob s diabetem není známo (23, 25). Proto se u těchto vysoce rizikových, imunokompromitovaných pacientů doporučuje každoroční vyšetření anti‑HBs protilátek. V případě, že koncentrace anti‑HBs v séru poklesne pod ochrannou úroveň, je vhodné zvážit podání booster dávky (9).
Dostupné údaje nepotvrzují výhodu nějaké specifické vakcíny proti hepatitidě B, dávkování nebo konkrétního očkovacího plánu pro dospělé s diabetem. K vakcinaci diabetiků je tedy možné použít jakoukoliv z dostupných vakcín proti VHB (23). Monovalentní vakcína Engerix‑B 10 μg je určena dětem do věku 15 let, včetně novorozenců, v případě že neabsolvovali pravidelné očkování hexavakcínou, která proti VHB chrání. Doporučuje se očkovací schéma složené ze tří dávek aplikovaných intramuskulárně do deltového svalu, případně anterolaterální strany stehna u novorozenců a kojenců, ve věku 0, 1 a 6 měsíců. Je možné využít zrychlené schéma 0, 1 a 2 měsíce, které zajistí rychlejší ochranu, ale pro zajištění dlouhodobé imunity je vhodné podat 4. dávku vakcíny 12 měsíců po tomto schématu. Osobám starším 16 let je určena vakcína Engerix‑B 20 μg, která se aplikuje do svalu ramene stejným schématem jako předchozí vakcína. U osob starších 18 let lze ve výjimečných případech, například u osob cestujících do vysoce endemických oblastí, kdy je nutná rychlejší indukce ochrany, aplikovat 3 dávky vakcíny ve schématu 0, 7 a 21 dnů. Pro zajištění dlouhodobé imunity je vhodné podání 4. dávky po 12 měsících. Dospělým a mladistvým nad 15 let věku s renální insuficiencí je určena očkovací látka Fendrix. Očkovací schéma se skládá ze 4 dávek podaných do deltového svalu v 0, 1, 2, 6 měsíci. Možné je i využití kombinované vakcíny proti virovým hepatitidám typu A a B. K tomuto účelu je v současnosti na českém trhu dostupná pouze vakcína Twinrix. Twinrix Adult je kombinovaná vakcína proti VHA a VHB, určená k imunizaci dospívajících a dospělých od 16 let. Očkovací schéma se skládá ze tří dávek, přičemž druhá se podává měsíc po první dávce a třetí 6 měsíců od první dávky. Vakcína se podává intramuskulárně do deltoidní oblasti. Pro děti a dospívající od 1 roku do 15 let věku existuje také vakcína proti hepatitidám A a B Ambirix s dvoudávkovým očkovacím schématem, která ovšem, podobně jako její alternativa Twinrix Paediatric není na českém trhu dostupná (26).
Herpes zoster
Herpes zoster (HZ) neboli pásový opar je infekční onemocnění vyvolané reaktivací viru varicella zoster (VZV). Primární infekce VZV se většinou u dětí manifestuje jako plané neštovice, virus poté v latentní formě přežívá v nervových gangliích. V případě, že dojde k reaktivaci, projevuje se VZV jako pásový opar, který se vyznačuje bolestivou kožní vyrážkou trvající až několik týdnů. Pokud bolest přetrvává více než 90 dní, hovoříme o postherpetické neuralgii (PHN), jejímž dominujícím příznakem je neuropatická bolest, jež výrazně snižuje kvalitu života pacienta a je příčinou zvýšených nákladů na zdravotní péči. Bylo prokázáno, že pacienti s diabetem 2. typu kvůli HZ infekci více navštěvují zdravotnická zařízení, bývá jim preskribováno více léčiv, mají vyšší riziko nutnosti hospitalizace a delší dobu pracovní neschopnosti než pacienti bez diabetu. Incidence HZ prudce roste s věkem, zejména nad 50 let. Diabetes mellitus je, vzhledem ke stavu snížené specifické imunity, rizikovým faktorem pro herpes zoster, jelikož tento stav usnadňuje reaktivaci VZV. Navíc enzym degradující inzulin, který může být spojen s patogenezí převládajícího diabetu 2. typu, je buněčný receptor zprostředkující infekci VZV a její šíření z buňky do buňky. To jsou zřejmě hlavní důvody toho, že diabetičtí pacienti mají zvýšené riziko vzniku HZ (9, 27). Nedávná španělská retrospektivní populační studie (Muñoz‑Quiles et al., 2017) k vyhodnocení dopadu základního diabetu na riziko rozvoje HZ prokázala, že diabetes zvyšuje riziko HZ o 20 %. Také se ukázalo, že pacienti s diabetem jsou náchylní k rozvoji HZ v mladším věku než pacienti bez diabetu. U diabetiků je navíc vyšší riziko postherpetické neuralgie, která mívá závažnější, perzistující průběh (28). V dřívější retrospektivní studii (Suaya et al., 2014) na americké populaci se ukázal dokonce o 78 % vyšší výskyt HZ u jedinců s diabetem než bez a míra výskytu PHN byla o 50 % vyšší. Jedinci s diabetem měli o 45 % vyšší upravené riziko (hazard ratio) HZ a o 18 % vyšší ODDS ratio PHN. Kromě toho může HZ vyvolat zhoršení glykemie u pacientů s diabetem a vést k jeho dekompenzaci (29).
Z výše uvedených důvodů jsou diabetici považováni za rizikovou skupinu pro HZ a je jim doporučováno chránit se očkováním. I přesto, že HZ postihuje diabetiky i v mladším věku, CDC, ACIP a další instituce uvádí potřebu vakcinace u osob starších 50 let. Jak již bylo zmíněno, po padesátce se riziko HZ zvyšuje, a zřejmě i proto jsou obě existující vakcíny určeny právě osobám starším 50 let. Starší živá atenuovaná vakcína s názvem Zostavax, která se u nás běžně používala již však od konce roku 2019 není do ČR dodávána. Nahradit by ji mohla novější rekombinantní očkovací látka Shingrix, která byla v Evropské unii, stejně tak u nás, registrována v roce 2018, na trhu se ale zatím neobjevila. Až se tak stane, bude se očkovat 2 dávkami, kdy se druhá dávka aplikuje 2 měsíce po té první, případně za 2–6 měsíců. Shingrix je určen pro intramuskulární podání do deltového svalu, na rozdíl od dříve používaného Zostavaxu se subkutánní nebo intramuskulární aplikací. Zostavax bylo možné očkovat zároveň s inaktivovanou vakcínou proti chřipce, avšak současné podání s PPSV23 vedlo ke snížené imunogenicitě. Oproti tomu Shingrix může být podán souběžně s neadjuvovanou inaktivovanou vakcínou proti sezónní chřipce, PPSV23 nebo vakcínou proti tetanu‑difterii‑pertusi se sníženým obsahem antigenů (Tdap). Opět platí pravidlo aplikace každé očkovací látky do jiného místa (27, 30). U jedinců, kteří jsou vnímaví k VZV (nebyli očkováni proti varicelle, ani ji v minulosti neprodělali), je vhodné zvážit rovněž očkování proti varicelle, jelikož u dospělých osob obecně, zejména pak u chronicky nemocných, bývá průběh těžší s častějšími komplikacemi, a očkování zároveň snižuje riziko vzniku HZ. Vzhledem k tomu, že se jedná o živou atenuovanou vakcínu (Varilrix), je však třeba vyšší obezřetnost při očkování diabetických pacientů, tak aby byly dodrženy kontraindikace podání vakcíny, zejména v souvislosti s přidruženými komorbiditami. Zároveň je třeba počítat s možnou sníženou imunitní odpovědí u imunokompromitovaných pacientů (31).
Tetanus, difterie, pertusse
Samozřejmě ani u diabetiků by se nemělo zapomínat na pravidelné přeočkování proti tetanu podle očkovacího kalendáře, tj. po 10 až 15 letech, u osob nad 60 let po 10 letech, jelikož bylo zjištěno, že průměrný titr antitoxinu klesá se zvyšujícím se věkem. U pacientů s diabetem navíc existuje zvýšená náchylnost k tetanové infekci, a to kvůli přidruženým komplikacím (zejména syndrom diabetické nohy) v kombinaci se snížením funkce imunitního systému. Byl zdokumentován statisticky významný rozdíl v hladinách tetanového antitoxinu mezi skupinami lidí s diabetem 2. typu a zdravými kontrolami, diabetičtí pacienti mají nižší hladinu antitoxinu. Zranitelnost diabetických pacientů vůči pomalu se hojícím vředům nohou navíc může poskytnout cestu spor C. tetani a následné infekci tetanem (32, 33).
Podle doporučení CDC, ACIP by měl být každý dospělý člověk alespoň 1× za život přeočkován jednou dávkou vakcíny proti tetanu, difterii a pertussi (Tdap), která obsahuje tetanický toxoid, snížené množství difterického toxoidu a acelulární pertusovou složku. K tomuto účelu jsou v ČR dostupné 2 identické vakcíny Adacel a Boostrix, které se aplikují intramuskulárně do deltového svalu. Tyto vakcíny mohou být aplikovány místo samostatné tetanové vakcíny při pravidelném přeočkování, nebo kdykoliv mezi těmito dávkami, avšak s minimálním odstupem 1 roku od poslední dávky tetanové vakcíny. Vakcíny Tdap však nejsou, na rozdíl od samostatné tetanové vakcíny (Vacteta), hrazeny ze zdravotního pojištění, existuje však možnost získat na ně příspěvek od zdravotní pojišťovny (liší se u jednotlivých zdravotních pojišťoven). CDC doporučuje diabetikům přeočkování proti tetanu každých 10 let.
Závěr
Diabetici jsou vzhledem ke snížené funkci imunitního systému a/nebo kvůli přidruženým komplikacím náchylnější k infekcím. Některé z těchto infekcí jsou preventabilní očkováním, čehož by se mělo využít ve pro spěch těchto pacientů. Navzdory tomu je však proočkovanost v obecné populaci i u rizikových skupin, včetně diabetických pacientů, stále nedostatečná. Výše uvedená doporučení jsou v souladu s doporučeními věrohodných institucí, a to zejména CDC a ACIP, doplněná o poznatky získané rešerší literatury a aktuálních vědeckých studií. Je tedy úlohou lékařů (nejen primární péče), aby přispěli ke zvýšení proočkovanosti a tím i ochraně zdraví svých pacientů.
Sources
1. Souček M, Svačina P. Vnitřní lékařství v kostce. 1. vydání. Praha: Grada Publishing, 2019. ISBN 978-80-271-2289-9.
2. Škrha J. Diabetologie. 1. vyd. Praha: Galén, 2009. ISBN 978-80-7262-607-6.
3. Pelikánová T, Bartoš V. Praktická diabetologie. 6. aktualizované a doplněné vydání. Praha: Maxdorf, 2018. Jessenius. ISBN 978-80-7345-559-0.
4. Stručný přehled činnosti oboru diabetologie a endokrinologie za období 2007–2016. Ústav zdravotnických informací a statistiky ČR [online]. 2016 [cit. 2020-01-08]. Dostupné z: https://www.uzis.cz/publikace/zdravotnictvi-cr-strucny-prehled-cinnosti-oboru-diabetologie - endokrinologie-za-obdobi-2007
5. Roglic G. Global report on diabetes. Geneva, Switzerland: World Health Organization, 2016. ISBN 9789241565257.
6. Alves C, Casqueiro J, Casqueiro J. Infections in patients with diabetes mellitus: A review of pathogenesis. Indian Journal of Endocrinology and Metabolism [online]. 2012, 16(7) [cit. 2020-01-10]. DOI: 10.4103/2230-8210.94253. ISSN 2230-8210. Dostupné z: http://www.ijem. in/text.asp?2012/16/7/27/94253
7. Geerlings S, Hoepelman A.Immune dysfunction in patients with diabetes mellitus (DM). FEMS Immunology & Medical Microbiology [online]. 1999; 26(3–4): 259–265 [cit. 2020-01 - 10]. DOI: 10.1111/j.1574-695X.1999.tb01397.x. ISSN 09288244. Dostupné z: https://academic. oup.com/femspd/article-lookup/doi/10.1111/j.1574-695X.1999.tb01397.x
8. Maďar R, Benešová D, Brandejská D, et al. Vaccination of Patients with Diabetes Mellitus – a Retrospective Study. Central European Journal of Public Health [online]. 2011; 19(2): 98–101 [cit. 2020-05-14]. DOI: 10.21101/cejph.a3634. ISSN 12107778. Dostupné z: http://cejph. szu.cz/doi/10.21101/cejph.a3634.html
9. Jeseňák M, Urbančíková I. Očkovanie v špeciálnych situáciách. 2., preprac. a rozšír. vyd. Praha: Mladá fronta, 2019. Aeskulap. ISBN 978-80-204-4324-3.
10. Beran J. Diabetes mellitus a imunizace: Diabetes mellitus and immunization. Vnitřní lékařství. Praha: Česká lékařská společnost J. Ev. Purkyně, 2006; 52(5): 438–442. ISSN 0042-773X.
11. Slíva J, Votava M. Farmakologie. 1. vyd. Praha: Triton, 2011. Lékařské repetitorium. ISBN isbn9788073875008.
12. Farmakoterapeutické informace – Měsíčník pro lékaře a farmaceuty: Perorální antidiabetika v léčbě diabetes mellitus 2. typu. 2009, . ISSN 1211-0647. Dostupné z: http://www. sukl.cz/sukl/brezen-2009
13. Šmahelová A. Perorální antidiabetika skupiny derivátů sulfonylurey [online]. Praha: Remedia, 2008, [cit. 2020-07-02]. ISSN 0862-8947. Dostupné z: http://www.remedia.cz/ Clanky/Prehledy-nazory-diskuse/Peroralni-antidiabetika-skupiny-derivatu-sulfonylurey /6-F-zN.magarticle.aspx
14. Suchopár J, Valentová Š. Compendium: Léčiva používaná v podmínkách ČR. 5. vyd. Panax Co, s.r.o., 2018. ISBN 978-80-902806-7-0.
15. Kesavadev J, Misra A, Das AK, et al. Suggested use of vaccines in diabetes. Indian Journal of Endocrinology and Metabolism [online]. 2012; 16(6) [cit. 2020-05-14]. DOI: 10.4103/2230-8210.102982. ISSN 2230-8210. Dostupné z: http://www.ijem.in/text. asp?2012/16/6/886/102982
16. Dos Santos G, Tahrat H, Bekkat-Berkani R. Immunogenicity, safety, and effectiveness of seasonal influenza vaccination in patients with diabetes mellitus: A systematic review. Human Vaccines & Immunotherapeutics [online]. 2018; 14(8): 1853–1866 [cit. 2020-05-14]. DOI: 10.1080/21645515.2018.1446719. ISSN 2164-5515. Dostupné z: https://www.tandfonline. com/doi/full/10.1080/21645515.2018.1446719
17. Rodriguez-Blanco T, Vila-Corcoles A, De Diego C, et al. Relationship between annual influenza vaccination and winter mortality in diabetic people over 65 years. Human Vaccines & Immunotherapeutics [online]. 2014; 8(3): 363–370 [cit. 2020-05-14]. DOI: 10.4161/hv.18548. ISSN 2164-5515. Dostupné z: http://www.tandfonline.com/doi/ abs/10.4161/hv.18548
18. Kynčl J, Havlíčková M. Význam očkování proti chřipce a jeho optimální načasování. Státní zdravotní ústav [online]. [cit. 2020-01-15]. Dostupné z: http://www.szu.cz/tema/prevence/ vyznam-ockovani-proti-chripce-a-jeho-optimalni-nacasovani
19. Lelekis M, Stefani D. Prevention of Pneumococcal Disease in Patients with Chronic Cardiometabolic Diseases. International Journal of Caring Sciences [online]. 9(2), 1124–1128 [cit. 2020-01-20]. Dostupné z: https://www.semanticscholar.org/paper/Prevention-of-Pneumococcal - Disease-in-Patients-with-Lelekis-Stefani/578ff7d91fd2633e949fa76c45b816ad690c86f1
20. Jackson L, Gurtman A, Van Cleeff M, et al. Influence of initial vaccination with 13-valent pneumococcal conjugate vaccine or 23-valent pneumococcal polysaccharide vaccine on anti-pneumococcal responses following subsequent pneumococcal vaccination in adults 50 years and older. Vaccine [online]. 2013; 31(35), 3594–3602 [cit. 2020-05-14]. DOI: 10.1016/j.vaccine.2013.04.084. ISSN 0264410X. Dostupné z: https://linkinghub.elsevier. com/retrieve/pii/S0264410X13005860
21. PREVENAR 13: Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv [online]. [cit. 2020-05-19]. Dostupné z: http://www.sukl.cz/modules/medication/detail.php? ‑ code=0194312&tab=texts
22. PNEUMOVAX 23: Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv [online]. [cit. 2020-05-19]. Dostupné z: http://www.sukl.cz/modules/medication/detail.php? ‑ code=0236387&tab=texts
23. Sawier M, Hoerger T, Murphy T, et al. Use of hepatitis B vaccination for adults with diabetes mellitus: Recommendations of the Advisory Committee on Immunization Practices (ACIP): Recommendations of the Advisory Committee on Immunization Practices (ACIP). JAMA The Journal of the American Medical Association. 2012; 307 : 659–662.
24. Zhang X, Zhu X, Ji Y, et al. Increased risk of hepatitis B virus infection amongst individuals with diabetes mellitus. Bioscience Reports [online]. 2019; 39(3) [cit. 2020-05-15]. DOI: 10.1042/BSR20181715. ISSN 0144-8463. Dostupné z: https://portlandpress.com/bioscirep/ article/doi/10.1042/BSR20181715/111013/Increased-risk-of-hepatitis-B-virus-infection
25. Schillie S, Spradling P, Murphy T. Immune Response of Hepatitis B Vaccine Among Persons With Diabetes: A systematic review of the literature. Diabetes Care [online]. 2012; 35(12): 2690–2697 [cit. 2020-05-15]. DOI: 10.2337/dc12-0312. ISSN 0149-5992. Dostupné z: http://care.diabetesjournals.org/cgi/doi/10.2337/dc12-0312
26. Macounová P. Virové hepatitidy v Pardubickém kraji. Ostrava, 2019.. Diplomová práce. Ostravská univerzita, Lékařská fakulta. Vedoucí práce RNDr. Aleš Hozák.
27. Papagianni M, Metallidis S, Tziomalos K. Herpes Zoster and Diabetes Mellitus: A Review. Diabetes Therapy [online]. 2018; 9(2): 545–550 [cit. 2020-05-19]. DOI: 10.1007/s13300-018 - 0394-4. ISSN 1869-6953. Dostupné z: http://link.springer.com/10.1007/s13300-018-0394-4
28. Muñoz-Quiles C, López-Lacrot M, Ampudia-Blasco F, et al. Risk and impact of herpes zoster on patients with diabetes: A population-based study, 2009–2014. Human Vaccines & Immunotherapeutics [online]. 2017; 13(11): 2606–2611 [cit. 2020-05-19]. DOI: 10.1080/21645515.2017.1368600. ISSN 2164-5515. Dostupné z: https://www.tandfonline. com/doi/full/10.1080/21645515.2017.1368600
29. Suaya J, Chen S-Y, Qian LI, et al. Incidence of Herpes Zoster and Persistent Post-Zoster Pain in Adults With or Without Diabetes in the United States. Open Forum Infectious Diseases. 2014, 1(2). DOI: 10.1093/ofid/ofu049. ISSN 2328-8957. Dostupné z: https://doi. org/10.1093/ofid/ofu049
30. SHINGRIX: Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv [online]. [cit. 2020-05-20]. Dostupné z: http://www.sukl.cz/modules/medication/detail.php? ‑ code=0222844&tab=texts
31. VARILRIX: Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv [online]. [cit. 2020-06-30]. Dostupné z: http://www.sukl.cz/modules/medication/detail.php? ‑ code=0010277&tab=texts
32. Kiliç, D. Seroprevalence of tetanus immunity among noninsulin-dependent diabetes mellitus patients. Journal of Diabetes and its Complications [online]. 2003; 17(5): 258–263 [cit. 2020-05-20]. DOI: 10.1016/S1056-8727(02)00255-6. ISSN 10568727. Dostupné z: https:// linkinghub.elsevier.com/retrieve/pii/S1056872702002556
33. Soulsby H, Russell-Jones D. Does diabetes put you at risk of tetanus?. Practical Diabetes International [online]. 2010; 27(9): 381–382 [cit. 2020-05-20]. DOI: 10.1002/pdi.1530. ISSN 13578170. Dostupné z: http://doi.wiley.com/10.1002/pdi.1530
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 5-
All articles in this issue
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

