-
Medical journals
- Career
Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
Authors: Libor Červinek
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno
Published in: Vnitř Lék 2020; 66(5): 309-313
Category:
Overview
Interferon alfa (IFN‑α) je používán přes 30 let v léčbě myeloproliferativních onemocnění. IFN‑α prokázal schopnost indukovat klinickou, hematologickou, molekulární a histopatologickou remisi, ale jeho toxicita zůstala limitací jeho širšího užití. Vývoj pegylovaných forem s lepší tolerancí přináší pacientům nové možnosti. Klinické studie fáze 3, ropeginterferon‑α versus hydroxyurea: PROUD-PV a CONTINUATION-PV, prokázaly dlouhodobou superioritu v efektivitě a bezpečnosti ve srovnání ropeginterferonu alfa-2 b s hydroxyureou. Léčebné použití interferonů je nutnou součástí léčebného schématu u mladších rizikových pacientů v 1. linii, ale do současnosti žádný nepegylovaný i pegylovaný interferon neměl v SPC léčbu pacientů s pravou polycytémií. Jako první a jediný získal registraci Ropeginterferon alfa-2 b (Besremi®) a je dostupný v Evropské unii i v ČR pro léčbu pacientů s pravou polycytémií bez symptomatické splenomegalie.
Klíčová slova:
ropeginterferon alfa-2 b – myeloproliferativní onemocnění – PROUD-PV – CONTINUATION-PV
Doporučené léčebné postupy pro pacienty s pravou polycytémií (PV) byly v posledních letech revidovány na základě výsledků publikovaných klinických studií, nových poznatků o molekulárně genetické patofyziologii onemocnění, a i v souvislosti s novými léky (1, 2). Pacienti s nízce rizikovým onemocněním jsou léčeni pomocí léčebných venepunkcí a preventivním podáním antiagregačních léků. Naším cílem je udržet hladinu hematokritu pod 45 %. Venepunkce jsou jistě účinnou a bezpečnou léčebnou modalitou, ale mnoho pacientů z této léčby přechází na medikamentózní terapii, nejčastěji podáním cytoreduktivních léků. Problém může být intolerance venepunkce ze strany pacientů, dále rozvoj deficitu železa a také opakované venepunkce naráží na problém s venózním vstupem. Pacienti s vysoce aktivním onemocněním, kteří mají progresivní splenomegalii, leukocytózu, kardiovaskulární rizikové faktory nebo s onemocněním asociované symptomy, jako je svědění, hubnutí či noční pocení, jsou indikováni k cytoreduktivní terapii. Jako vhodná léčba u těchto pacientů se jeví podání interferonu alfa.
Pacienty s vysoce rizikovým onemocněním stratifikujeme dle věku a přítomnosti závažných komorbidit. Pacienti do 70 let věku bez závažných komorbidit léčíme v první linii podáním pegylovaného interferonu alfa, pokud pacienti na tuto léčbu neodpovídají, je v další linii indikována cytoredukční léčba hydroxyureou či podáváním JAK1/2 inhibitoru.
Pro pacienty se závažnými komorbiditami či věkem nad 70 let je v první linii léčba hydroxyureou či pegylovaným interferonem alfa, v druhé linii poté JAK1/2 inhibitor. V klinické praxi se snažíme především u mladších pacientů preferenčně podávat interferon s přihlédnutím k možnému leukemogennímu vlivu hydroxyurey při dlouhodobém užití. Pacientky, které plánují těhotenství a potřebují cytoreduktivní terapii, by měly být preferenčně léčeny interferonem z důvodu potenciální teratogenity hydroxyurey či busulfanu.
Použití inhibitorů JAK1/JAK2 tyrozinkinázy v druhé linii léčby pravé polycytémie je limitováno chybějící úhradou preparátu ze strany plátců zdravotní péče. Ruxolitinib prokázal v klinických studiích u pacientů s pravou polycytémií účinnost stran jak redukce velikosti sleziny, tak i udržení cílového hematokritu.
Již přibližně 30 let je v léčbě myeloproliferativních onemocnění používán interferon alfa. Používání interferonu alfa v oblasti chronické myeloidní leukémie bylo vytlačeno selektivními inhibitory BCR‑ABL fúzního genu. V oblasti Ph negativních (Onemocnění bez filadelfského chromozomu) myeloproliferací zůstalo použití interferonu jednou z doporučených léčebných možností s účinností limitovanou množstvím nežádoucích účinků. Jednou z limitujících vlastností léčby interferonem alfa je nutnost časté parenterální aplikace preparátu a mnohé celkové nežádoucí účinky (flu‑like syndrom, účinky na psychiku, hematologická toxicita, manifestace autoimunitních onemocnění, jaterní toxicita, oční komplikace) (3). V klinické praxi byly v rámci léčby pacientů s polycytemia vera používány standardní preparáty interferon alfa-2 b a interferon alfa-2 a oba tyto preparáty nejsou již v České republice dostupné ke komerčnímu použití. V rámci výzkumu byly vyvinuty pegylované formy interferonu, jež umožnují snížení frekvence podání i četnosti výskytu nežádoucích účinků. V současnosti je na některých pracovištích používán pegylovaný interferon alfa-2 a (Pegasys). Preparát nemá v SPC léčbu pravé polycytemie a jeho výroba bude v následujících měsících z rozhodnutí výrobce ukončena. Inovativním preparátem ze skupiny interferonů je ropeginterferon alfa-2 b, což je preparát obsahující jednu izoformu interferonu, což se projevuje zvýšením snášenlivosti přípravku a pegylační úpravu umožňující snížení frekvenci aplikace na jednou za 2 týdny, v dlouhodobém podání i aplikaci jednou za 3 až 4 týdny.
Srovnání ropeginterferonu alfa-2 b versus standardní léčba pravé polycytemie bylo ověřeno v otevřené multicentrické randomizované klinické studii fáze III PROUD‑PV a v následné extenzi studie CONTINUATION‑PV (4).
V rámci studie bylo zúčastněno 48 center v Evropě a ve studii bylo v obou větvích léčeno celkově 254 dospělých pacientů s PV. Jedním z center bylo i naše pracoviště s celkovým počtem 10 léčených pacientů, tudíž s tímto preparátem máme vlastní 6leté zkušenosti, 5 pacientů z našeho souboru dosud pokračuje v rámci studie CONTINUATION‑PV.
Jelikož se jedná o dosud jedinou publikovanou randomizovanou multicentrickou studii fáze III přímo srovnávající léčbu hydroxyureou s ropeginterferonem alfa-2 b, mohou výsledky ovlivnit léčebná doporučení pro léčbu pacientů s pravou polycytémií.
V rámci klinické studie PROUD‑PV byli zařazení pacienti náhodně rozděleni do dvou ramen v poměru 1 : 1, a to jedné skupiny léčené ropeginterferonem alfa-2 b a do druhé skupiny léčené hydroxyureou, v rámci studie nebylo umožněno pacientům přejít mezi oběma rameny. Primárním cílem klinické studie byla non‑inferiorita ropeginterferonu alfa-2 b vůči hydroxyuree. Hlavní vstupní kritéria pro zařazení do klinické studie byl věk více či rovno 18 let a diagnóza pravé polycytémie dle kritérií WHO z roku 2008, včetně mutace JAK2. Bylo vyžadováno, aby dosud neléčení pacienti byli indikováni k zahájení medikamentózní léčby. Vstup do studie byl umožněn i pacientům dosud léčeným hydroxyureou, pokud byla doba léčby kratší než 3 roky a pokud na této léčbě nebyli pacienti v kompletní remisi nemoci, nebo k léčbě hydroxyureou vykazovali rezistenci či intoleranci dle ELN (Evropská leukemická síť) kritérií. Pokud pacienti dokončili studii PROUD‑PV, byla jim nabídnuta účast v následné extenzivní studii CONTINUATION‑PV. Pacienti, kteří byli v studii PROUD‑PV ve větvi s ropeginterferonem alfa-2 b, pokračovali v této léčbě, pacienti v standardní léčbě pokračovali v užívání hydroxyurey nebo konvenčními nestudiovými interferony, inhibitory JAK2 či podáním anagrelidu, fosforu - 32 či busulfanu (dle rozhodnutí zkoušejícího lékaře).
Randomizace pacientů do jednotlivých ramen studie byla na základě věku, předléčenosti hydroxyureou a historie tromboembolických komplikací. V rámci 12 měsíců trvání klinické studie PROUD‑PV byli pacienti léčeni podkožní aplikací ropeginterferonu alfa-2 b každé 2 týdny. Zahajovací dávka ropeginterferonu alfa-2 b byla 100 μg. Pacienti, již byli dosud léčeni hydroxyureou, začínali léčbu ropeginterferonem v dávce 50 μg. Zahajovací dávka hydroxyurey byla 500 mg/den. Léčebná dávka obou preparátů byla navyšována až do dosažení cílových hodnot hematokritu menšího než 45 % (bez nutnosti venepunkce) a normalizace hladiny trombocytů a leukocytů. Všichni pacienti užívali antiagregační terapii kyselinou acetylsalicylovou či jinou antikoagulační léčbu. V 3měsíčních intervalech byli pacienti v rámci rozšířených vizit vyšetřováni stran kompletního krevního obrazu, laboratorních biochemických a imunologických parametrů, ultrazvukového vyšetření sleziny a srdce a v neposlední řadě i pomocí dotazníků na kvalitu života. Zvláště obezřetně byly sledovány možné tromboembolické příhody, ať již makro - či mikrovaskulární, a specifické projevy nemoci, jako svědění a bolesti hlavy. Po skončení PROUD‑PV studie byli pacienti vyšetřeni stran velikosti sleziny na CT či MR přístroji.
Každých 6 měsíců byla centrálně stanovena alelická nálož mutace JAK2. Primárním složeným cílem studie PROUD‑PV byla hematologická odpověď a normalizace velikosti sleziny. Sekundárními cíli studie bylo stanovení nálože JAK2 mutace, doba do léčebné odpovědi, trvání léčebné odpovědi, potřeba provedení venepunkcí, změna s onemocněním spojených symptomů, změna kvality života dle metodiky (EQ-5D-3L) a nežádoucí příhody dle metodiky GCP (Správná klinická praxe). Primárním cílem klinické studie CONTINUATION‑PV bylo dlouhodobé hodnocení efektivity a bezpečnosti podávání ropeginterferonu alfa-2 b. Složeným primárním cílem byl počet pacientů, kteří dosáhli kompletní hematologické odpovědi a normalizace velikosti sleziny, dále byly hodnoceny s onemocněním spojené příznaky, jako porucha mikrocirkulace, svědění či bolesti hlavy. Sekundárními cíli studie byla změna alelické nálože JAK2, změna hematologických parametrů a velikosti sleziny od zahájení léčby, doba do léčebné odpovědi a trvání léčebné odpovědi, nutnost venepunkcí, změna kvality života a nežádoucí příhody.
Výsledky
V klinické studii PROUD‑PV bylo od 17. září 2013 do 13. března 2015 sledováno 306 pacientů, randomizováno bylo 257 pacientů, z toho 127 pacientů do ramene ropeginterferon alfa-2 b a 130 pacientů do ramene s hydroxyureou (3 pacienti z této větve po randomizace ze studie odstoupili). Viz tabulka 1.
Table 1. Charakteristiky pacientů při screeningu v rámci studie PROUD-PV 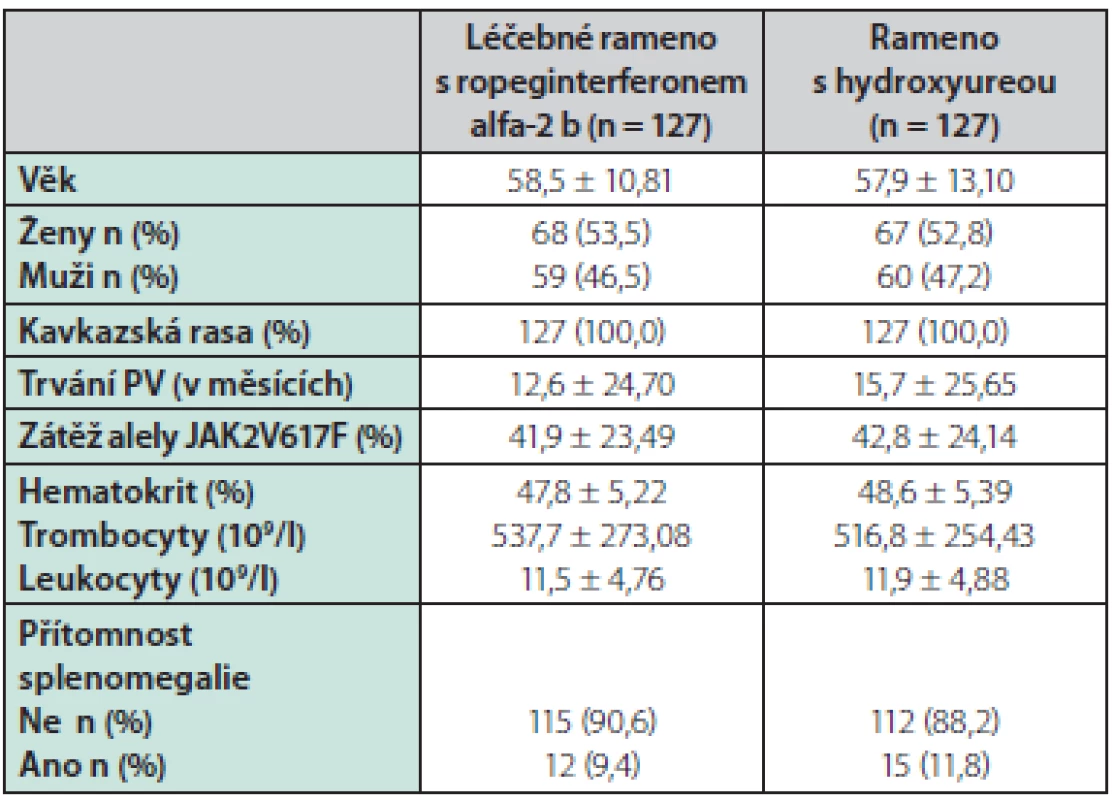
21 pacientů (17 %) ze 127 pacientů léčených ropeginterferonem alfa-2 b a 16 pacientů (13 %) v rameni s hydroxyureou předčasně léčbu ukončilo. 217 pacientů studii PROUD‑PV dokončilo a 171 pacientů pokračovalo do studie CONTINUATION‑PV. Z těchto 95 pacientů (75 %) pokračovalo v léčbě ropeginterferonem alfa-2 b a 76 (60 %) pokračovalo v léčbě běžně dostupnými preparáty. V době statistické analýzy 17 (18 %) pacientů léčených ropeginterferonem a 7 (9 %) léčených standardní studii ukončilo. Medián doby sledování v prvním roce léčby byl v obou větvích 52 týdnů. Medián celkového sledování byl 182,1 týdne (166,3–201,7) v rameni s ropeginterferonem a 164,5 týdne (144,4–159,3) ve větvi s hydroxyureou. Střední efektivní dávky léku bylo dosaženo za přibližně 3,7 měsíce ve větvi s ropeginterferonem a 2,6 měsíce ve větvi s hydroxyureou. V 36. měsíci byl medián dávky ropeginterferonu 425 μg a 1000 mg pro hydroxyureu.
V klinické studii PROUD‑PV 26 (21 %) z 122 pacientů v rameni s ropeginterferonem a 34 (28 %) z 123 pacientů v rameni s hydroxyureou splnilo primární cíl studie kompletní hematologické odpovědi a normalizace velikosti sleziny v 12 měsících léčby. 95% interval spolehlivosti rozdílu v odpovědi byl -17,23 do 4,09, což nesplňovalo kritérium non inferiority (p= 0,23). Kompletní hematologická odpověď bez zahrnutí velikosti sleziny ve 12 měsících – odpovědi byly v obou ramenech obdobné, předléčení hydroxyureou nemělo na dosažení kompletní hematologické odpovědi signifikantní dopad.
V klinické studii CONTINUATION‑PV bylo zastoupení pacientů s kompletní hematologickou odpovědí signifikantně vyšší v rameni s ropeginterferonem alfa-2 b než ve skupině léčených hydroxyureou. Zastoupení pacientů s kompletní hematologickou odpovědí narůstalo od 24. měsíce a bylo nejvyšší v 36. měsíci studie. Rozdíl mezi oběma rameny v dosažení léčebné odpovědi byl v 36. měsíci signifikantní. Kompletní hematologická odpověď včetně normalizace velikosti sleziny u pacientů léčených ropeginterferonem alfa-2 b se s časem navyšovala z 27 (30 %) z 91 pacientů v 12. měsíci na 38 (42 %) z 90 pacientů ve 36. měsíci. Během 36měsíčního léčebného období byl podíl pacientů, kteří vykazovali léčenou odpověď, významně vyšší ve skupině alfa-2 b ropeginterferonu ve srovnání s hydroxyureou (37 [39 %] z 95 pacientů oproti 11 [15 %] z 76 pacientů, p = 0,0011; 28 [30 %] z 95 vs. 11 [15 %] 76, p = 0,025). Viz tabulka 2.
Table 2. Odpověď onemocnění po 24 a 36 měsících léčby ropeginterferonem alfa-2 b 
Molekulární odpovědi na léčbu nebyly ve studii PROUD‑PV ve 12 měsících signifikantně odlišné (42 [34 %] ze 123 v ropeginterferonu alfa-2 b skupiny vs. 52 [42 %] ze 123 ve skupině hydroxyurey, p = 0,19). V obou skupinách došlo po 12 měsících léčby ke snížení průměrné hodnoty zátěže alely JAK2 (z 41,9 % [SD 23,49] na 30,7 % [SD 22,66] v rameni ropeginterferonu alfa-2 b a z 42,8 % [SD 24,14] na 25,9 % [SD 21,49] ve skupině hydroxyurey).
V studii CONTINUATION‑PV byl počet pacientů s molekulární odezvou významně vyšší ve skupině alfa-2 b ropeginterferonu než ve skupině hydroxyureou. Pacienti léčení ropeginterferonem alfa-2 b vykázali v 36. měsíci pokles střední nálože alely JAK2 na méně než polovinu vstupní hladiny z 42,8 % [SD 23,4] na 19,7 % [SD 21,3], zatímco ve skupině hydroxyurey byl pokles alelické zátěže přechodný a v 36. měsíci došlo k návratu k původní hladině (42,9% [SD 23,0] při vstupu a 39,3% [SD 25,91]). Viz tabulka 3.
Table 3. Zátěž alely JAK2V617F a změny v prodloužené studii CONTINUATION-PV oproti výchozímu stavu 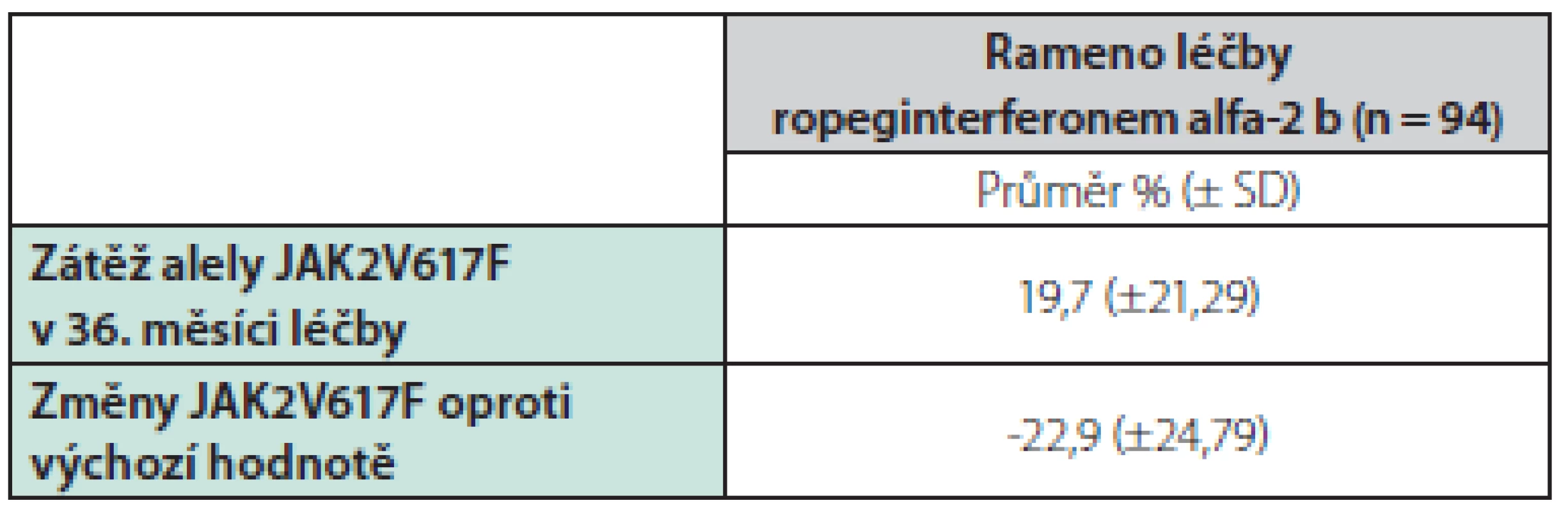
V post‑hoc analýze snížení alelické zátěže JAK2 korelovalo s úplnou hematologickou odpovědí ve 12, 24 a 36 měsících ve skupině s ropeginterferonem alfa-2 b (Pearsonova korelace -0,45 [p <0,0001], -0,24 [p = 0,037] a -0,31 [p = 0,009]). Údaje o kvalitě života hodnocené pomocí EQ-5D-3L dotazníku neprokázaly mezi jednotlivými skupinami v 36. měsíci signifikantní rozdíly.
Nežádoucí účinky v rámci klinické studie vyžadovaly snížení dávky u 51 (40 %) ze 127 pacientů ve skupině alfa-2 b ropeginterferonu a 74 (58 %) ze 127 pacientů ve standardní léčebné skupině a přerušení dávky u 29 (23 %) ze 127 pacientů a 23 (18 %) ze 127 pacientů, resp. 11 pacientů (8 %) ze 127 pacientů ve větvi s ropeginterferonem alfa-2 b ukončilo studii předčasně kvůli toxicitě léčby, ve skupině s hydroxyureou pět (4 %) ze 127 pacientů přerušilo léčbu z důvodu toxicity.
Nejčastěji hlášené nežádoucí účinky (> 10 % pacientů) u 127 pacientů ve skupině ropeginterferonu alfa-2 b byly trombocytopenie (28 [22 %]), leukopenie (25 [20 %]), zvýšená y‑glutamyltransferáza (24 [19 %]), únava (17 [13 %]), zvýšená alaninaminotransferáza (17 [13 %]), anémie (16 [13 %]), zvýšená aspartátaminotransferáza (13 [10 %]), bolesti hlavy (15 [12 %]), artralgie (15 [12 %]) a závratě (14 [11 %]). Nejčastěji hlášené nežádoucí účinky u 127 pacientů ve standardní terapeutické skupině byly trombocytopenie (37 [29 %]), anémie (32 [25 %]), leukopenie (29 [23 %]), únava (18 [14 %]), bolesti hlavy (16 [13 %]), nevolnost (15 [12 %]), průjem (14 [11 %]) a nazofaryngitida (13 [10 %]). Nežádoucí události, které byly investigátory hodnoceny jako s léčbou asociované, byly hlášeny u 95 (75 %) ze 127 pacientů ve skupině ropeginterferonu alfa-2 b a u 100 (79 %) ze 127 pacientů ve standardní terapeutické skupině. Počet závažných nežádoucích událostí stupně tři nebo vyšší byly podobné v obou léčebných skupinách. Závažné nežádoucí účinky se vyskytly u tří (2 %) ze 127 pacientů ve skupině s ropeginterferonem alfa-2 b skupina a pěti (4 %) ze 127 pacientů na hydroxyurey. Byl hlášen jeden případ akutní leukémie v souvislosti léčbou s hydroxyureou. Byla zaznamenána další tři úmrtí, všechna nesouvisející s léčbou.
Kardiovaskulární nežádoucí účinky, jež jsou v souvislosti se základním onemocněním, byly hlášeny v obou ramenech studie, u ropeginterferonu alfa-2 b (16 událostí u 13 [10 %] ze 127 pacientů) a ve standardní terapeutické skupině (25 událostí u osmi [6 %] ze 127 pacientů). Frekvence závažných tromboembolických nežádoucích účinků – události byly mezi ropeginterferonem alfa-2 b podobné se skupinou standardní terapie.
Nejčastěji hlášeným nežádoucím účinkem 3. a 4. stupně v souvislosti s léčbou byla zvýšená y‑glutamyltransferáza (sedm [6 %] ze 127 pacientů) a zvýšená alaninaminotransferáza (čtyři [3 %] ze 127 pacientů) ve skupině ropeginterferon alfa-2 b a leukopenie (šest [5 %] ze 127 pacientů) a trombocytopenie (pět [4 %] ze 127 pacientů) ve standardní terapeutické skupině. Frekvence hlášených novotvarů byla podobná ve skupině ropeginterferonu alfa-2 b (devět [7 %] ze 127) a ve standardní léčbě hydroxyureou (deset [8 %] ze 127). Ve skupině pacientů léčených hydroxyureou byla hlášena leukémie u dvou [2 %] ze 127 pacientů a rakovina kůže v souvislosti s léčbou u 3 [2 %] ze 127 pacientů.
Diskuze
Publikovaná randomizovaná multicentrická studie fáze III přímo srovnávající léčbu hydroxyureou s ropeginterferonem alfa 2-b přináší několik velmi důležitých výsledků. Studie prokázala signifikantně lepší výsledky užití ropeginterferonu vůči hydroxyuree v 36. měsíci léčby, a to jak ve smyslu dosažení kompletní hematologické remise onemocnění, tak i ve snížení mutační zátěže alely JAK2. Interferon alfa má inhibiční účinek na proliferaci hematopoetických buněk a progenitorových buněk fibroblastů kostní dřeně a antagonizuje působení růstových faktorů a dalších cytokinů. V rámci studie byl zřetelně dokumentován pomalejší nástup léčebného účinku ropeginterferonu ve srovnání s hydroxyureou. Nová aplikační forma Ropeginterferon alfa 2-b umožnila oproti konvenčním i ostatním pegylovaným interferonům snížení frekvence aplikace léku a tím nižší výskyt s aplikací asociovaných nežádoucích účinků interferonu. Srovnání s hydroxyureou prokázalo vysokou účinnost a bezpečnost ropeginterferonu, velkou výhodou interferonu je to, že preparát nemá potenciální rizika stran leukemogeneze.
Publikovaná studie zahrnovala především pacienty s časnou diagnózou pravé polycytémie, a to jak pacienty dosud bez léčby či do 3 let léčby hydroxyureou. Jelikož bylo do studie zařazeno vstupně poměrně málo pacientů s manifestní splenomegalií, bylo by vhodné efekt ropeginterferonu v této skupině pacientů porovnat s podáním inhibitorů JAK1/JAK2 tyrozinkinázy, a to v kombinaci či v přímém srovnání preparátů.
Závěr
Výsledky prezentovaných klinických studií u pacientů s pravou polycytémií dokumentují v dlouhodobém horizontu lepší účinnost a bezpečnost ropeginterferonu alfa-2 b v porovnání s hydroxyureou. Léčebné použití interferonů je nutnou součástí léčebného schématu u mladších rizikových pacientů v 1. linii, ale žádný do současnosti dostupný interferon nemá v SPC léčbu pacientů s pravou polycytémií. Ropeginterferon alfa-2 b (Besremi®) získal jako jediný interferon registraci v rámci Evropské unie pro léčbu pacientů s pravou polycytémií bez symptomatické splenomegalie. Díky tomu, že ropeginterferon alfa-2 b (Besremi®) prokázal účinnost a bezpečnost u mladších pacientů s PV ve vysokém riziku v klinických studií v první linii léčby, patří mu toto místo i v léčbě našich pacientů s PV.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Libor Červinek, Ph.D., Cervinek.libor@fnbrno.cz
Interní hematologická a onkologická klinika FN Brno a LF MUČlánek přijat redakcí: 28. 5. 2020
Článek přijat po recenzích k publikaci: 11. 6. 2020
Sources
1. Barbui T, Tefferi A, Vannuchi AM, et al. Philadelphia chromoseme‑negative classical myeloproliferative neoplasm: revised management recommendations from European Leu‑kemia Net Leukemia 2018 May; 32(5): 1057–1069.
2. Hatalova A, Schwarz J, Gotic M, et al. Recommendations for the diagnosis and tre‑atment of patients with polycythaemia vera Eur J Haematol 2018; 101(5): 654–664.
3. Kissova J. Interferon‑alfa v léčbě myeloproliferativních onemocnění Vnitř. Lék 2019; 65 (11): 699–704.
4. Gisslinger H, Klade C, Georgiev P, Mayer J, et al. Ropeginterferon alfa-2 b versus stan‑dard therapy for poly cythaemia vera (PROUD‑PV and CONTINUATION‑PV): a randomised, non inferiority, phase 3 trial and its extension study. Lancet Haematol 2020 Mar; 7(3): e196–e208.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 5-
All articles in this issue
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

