-
Medical journals
- Career
Praluent (alirokumab)
Authors: Tomáš Král
Authors‘ workplace: Kardiovaskulární oddělení, FN Ostrava
Published in: Vnitř Lék 2020; 66(5): 96-100
Category:
Overview
Inhibitory PCSK9 (proproteinové konvertázy subtilisin/kexinového typu 9) jsou slibnou léčebnou strategií, díky níž dochází ke snížení koncentrace aterogenního lipoproteinu o nízké hustotě (low density lipoprotein, LDL) i cholesterolu v něm obsaženého. Alirokumab je jedním ze dvou inhibitorů PCSK9 uvolněných do klinické praxe. Alirokumab je rekombinantní technikou získaná specifická protilátka proti PCSK9. Vazba protilátky s izoenzymem PCSK9 zabrání vytvoření komplexu PCSK9 s receptorem pro LDL a umožní tak další recirkulaci receptoru pro LDL. Zvýšení nabídky receptoru pro LDL na buněčných membránách zvýší internalizaci LDL do buněk a vede k poklesu koncentrace LDL cholesterolu. Doloženo je příznivé působení alirokumabu na aterogenní lipoproteiny (pokles koncentrace LDL cholesterolu o více než 50 %) jak v monoterapii, tak v kombinaci se statiny či s jinými hypolipidemiky. Studie Odyssey Outcomes přinesla zcela zásadní informace, které se již nyní odrazily i ve změně postupů léčby nemocných s AKS. Alirokumab po přidání k intenzivní statinové léčbě u těchto nemocných významně snižoval výskyt KV-příhod a v následných analýzách se prokázalo i snížení celkové mortality. Nejvýrazněji byl pozitivní účinek alirokumabu vyjádřen ve skupině s vyšším vstupním LDL-C. Léčba alirokumabem se navíc ukázala jako bezpečná, s minimem nežádoucích příhod.
Klíčová slova:
alirokumab – inhibitory PCSK9 – LDL – hypolipidemika – kardiovaskulární riziko – Odyssey Outcomes
Farmakologická skupina
Alirokumab je inhibitor proproteinové konvertázy subtilisin/kexinového typu 9 na bázi humánní monoklonální protilátky. Vlastní monoklonální protilátka (třídy IgG1) je plně humánní, získaná rekombinantní DNA technologií. Po farmakologické stránce patří alirokumab do skupiny hypolipidemik, podskupiny inhibitorů PCSK9 (1, 6).
Mechanismus účinku
Proproteinové konvertázy jsou rodinou serinových proteáz, které konvertují neaktivní proproteiny na proteiny biologicky aktivní (zejména enzymy, cytokiny, hormony, membránové proteiny či glykoproteiny). Vlastní aktivace proproteinu je dosaženo zpravidla odštěpením části řetězce a odhalením jeho biologicky účinného místa. Druhá část původního názvu – subtilisin/kexin like – označuje strukturální podobnost s enzymy bakteriální stěny (subtilisiny) či s enzymy stěny kvasinek (kexiny). Číslovka 9 znamená, že se jedná o poslední z devíti izoenzymů. Rodina proproteinových konvertáz hraje významnější úlohu, než je jen řízení metabolismu aterogenních lipoproteinů, uplatňují se např. v metabolismu glycidů, v ukládání triglyceridů do tukové tkáně, v kontrole krevního tlaku, ve vývoji a funkci CNS, v onkogenezi či v imunitních procesech (1).
Alirokumab je humánní monoklonální protilátka selektivně vázající a inaktivující izoenzym PCSK9. Hypolipidemický účinek je cílen na snížení koncentrace LDL cholesterolu. Mechanismus účinku spočívá ve stimulaci vychytávání lipoproteinu o nízké hustotě v cílových tkáních, tj. zejména v játrech a ve steroidogenních orgánech. Transport cholesterolu do buněk, tedy internalizaci LDL, zajišťuje vazba apolipoproteinu B100 na membránový receptor vázající LDL (LDL‑R). Hustota osazení membrán receptorem (membránová exprese) reguluje rychlost clearance tohoto lipoproteinu. Po internalizaci LDL dojde v buněčném endosomu k odloučení vlastní lipidové části od LDL R a od apoB100. Cholesterol a ostatní lipidy jsou využity v buňce, naopak obě proteinové části jsou zachovány pro opětovné použití, LDL‑R např. recirkuluje 100× až 200×. Vlastní recyklace obou proteinových částí je pod kontrolou specifického proteinu – PCSK9. Volný izoenzym PCSK9 se váže na LDL‑R a zabrání jeho recyklaci, tj. komplex PCSK9/LDL‑R podléhá lyzosomální degradaci. Snížená nabídka LDL‑R na buněčných membránách tak zpomalí vychytávání LDL ve tkáních, koncentrace aterogenního lipoproteinu LDL roste. Naopak blokáda PCSK9 (navázáním na protilátku – alirokumab) významně zvýší recirkulaci LDL‑R, hustota receptoru na membráně stoupá a je stimulováno vychytávání LDL ve tkáních. Spolu s poklesem koncentrace lipoproteinu LDL logicky klesá i plazmatická koncentrace cholesterolu v těchto částicích. Tak se snižuje aterogenní potenciál. Tento účinek se zřejmě rozhodující měrou podílí na hypolipidemickém a antiaterogenním působení alirokumabu. Není však účinkem jediným (1, 6).
Nejasným zůstává mechanismus, jakým je snižována koncentrace aterogenního a trombogenního lipoproteinu a, internalizace pomocí LDL‑R je ve srovnání s LDL menší a nevysvětluje významný pokles jeho koncentrace po inhibici PCSK9. Pro plné pochopení účinku PCSK9 v metabolismu LDL je nutno osvětlit jeho „autoregulační“ funkci. Izoenzym PCSK9 se váže jak na LDL‑R, tak na apolipoprotein B100. V plazmě je izoenzym PCSK9 z velké části vázán na cirkulující LDL, konkrétně na apoB100. Vazba PCSK9 na LDL zabrání jeho vazbě na LDL‑R. Při vyšší koncentraci LDL je vázáno více izoenzymu PCSK9 a nabídka jeho volné frakce pro vazbu na LDL‑R se snižuje. Receptor LDL tak déle recirkuluje, jeho koncentrace na membránách stoupá a zvyšuje se internalizace LDL. Snížení nabídky LDL v plazmě zvýší podíl volného PCSK9, a umožní tak vazbu tohoto izoenzymu na LDL‑R, který je zvýšeně degradován. Změna poměru volného a vázaného izoenzymu PCSK9 jemně reguluje recirkulaci LDL‑R a tím i plazmatickou koncentraci LDL. Inhibice PCSK9 na bázi specifické monoklonální protilátky tak umožňuje zvýšit přesun LDL do tkání a snížit jeho plazmatickou koncentraci. Tato strategie patří z hlediska poklesu hodnot LDL k nejúčinnějším. Na rozdíl od ostatních léčebných postupů cílených na snížení koncentrace LDL cholesterolu (tj. dieta, inhibice absorpce cholesterolu v enterocytu, blokáda syntézy cholesterolu), které vedou ke snížení nabídky cholesterolu a k určité depleci cholesterolu v tkáních, nedochází ke snížení saturace tkání cholesterolem. Oba postupy – snížení nabídky cholesterolu (tj. dieta, ezetimib, statiny) a zvýšení vychytávání cholesterolu v tkáních (inhibitory PCSK9) – tak lze s výhodou kombinovat (1).
Farmakodynamické vlastnosti
Dominantním účinkem alirokumabu stejně jako ostatních inhibitorů PCSK9 je snížení koncentrace cholesterolu v LDL. V rozmezí schválených a užívaných dávek (75–150 mg jedenkrát za 2 týdny) byl doložen pokles koncentrace LDL cholesterolu asi o 50 % při nižším dávkování a asi o 60 % při dávkování vyšším (1). Pokles hladiny LDL cholesterolu je ale závislý na reziduální aktivitě LDL‑R, tedy u pacientů s homozygotní FH může být efekt nulový. Koncentrace celkového cholesterolu klesla při léčbě alirokumabem asi o 40–45 %. Snížení koncentrace LDL cholesterolu je dáno nižší koncentrací LDL, nikoliv tím, že by klesla velikost částic tohoto lipoproteinu či se snížil obsah cholesterolu v nich. Vzhledem k tomu, že každá částice LDL má jen jednu molekulu apoB, koncentrace apoB nás informuje o aktuální koncentraci tohoto lipoproteinu. Paralelní pokles koncentrace LDL cholesterolu (o 47 %) i apoB (o 40 %) dokládá, že skutečně dochází ke snížení počtu LDL částic v plazmě, a nikoliv jen ke snížení obsahu cholesterolu v nich (1, 6). Přínosem je též snížení hodnot vysoce aterogenního a trombogenního lipoproteinu a, jeho koncentrace se snížila při léčbě o 20–30 %. Ostatní hypolipidemika tento lipoprotein významně neovlivňují, pokles při léčbě alirokumabem byl významný (1). Jediné hypolipidemikum, které bylo schopno snižovat hladinu Lp(a), byla kyselina nikotinová (v kombinaci s laropiprantem lék Tredaptive), který byl ale stažen z trhu pro neuspokojivé výsledky následných klinických studií. V neposlední řadě byl doložen též mírný účinek na vzestup hodnot HDL cholesterolu, ten se pohyboval v rozmezí 5–10 % (1).
Indikace, kontraindikace a klinické zkušenosti
Na základě předložených dat byl alirokumab schválen k užití v léčbě dospělých pacientů s primární hypercholesterolemií (s heterozygotní familiární hypercholesterolemií a s nefamiliární hypercholesterolemií) nebo se smíšenou dyslipidemií jako doplněk k dietním opatřením:
- v kombinaci se statinem nebo se statinem a s jinou hypolipidemickou léčbou u pacientů, u kterých nelze dostáhnout cílových hodnot LDL cholesterolu maximální tolerovanou dávkou statinů
- samostatně či v kombinaci s jinou hypolipidemickou léčbou u pacientů, kteří netolerují statiny nebo u kterých je podávání statinů kontraindikováno (5).
Obecně vzato, je lék vhodný prakticky pro každého pacienta s hypercholesterolemií, pokud má pacient zachovánu alespoň reziduální aktivitu LDL‑R.
Z klinických zkušeností ale vyplývá, že někteří pacienti nereagují na léčbu iPCSK9 očekávaným poklesem LDL, někteří dokonce nereagují na léčbu vůbec. Jedním z mechanismů může být tvorba protilátek proti účinné molekule nebo mutace v genu pro PCSK9. U pacientů s tvorbou protilátky proti alirokumabu lze vyzkoušet switch na jinou molekulu (evolokumab).
Absolutní kontraindikací je přecitlivělost na účinnou látku, léčba se nedoporučuje v těhotenství, omezená data jsou u pacientů s pokročilou jaterní nebo renální insuficiencí. Zde je dle SPC třeba podávat lék s opatrností, důsledně zvážit indikaci a možný benefit pro pacienta. Data pro používání u této populace pacientů jsou velmi omezená.
Problematikou, která se do budoucna bude objevovat stále častěji, je situace, kdy pacient již nějaké „biologikum“ užívá, a nyní se dostane do situace, že je u něj indikováno další – tentokrát biologická léčba hypercholesterolemie. Zkušenosti s kombinaci více biologik najednou jsem velmi omezené, nicméně to nepředstavuje kontraindikaci léčby. Pacienta je nutné důsledně monitorovat a cíleně pátrat po možných nežádoucích účincích léčby, samozřejmostí je informovat specialistu, který je zodpovědný za management léčby dalšího biologika, a tedy úzká mezioborová spolupráce.
V našem centru je průměrný pokles LDL cholesterolu ve 24. týdnu léčby na dávce 150 mg alirokumabu s.c. co 2 týdny 56,6% a na dávce 75 mg s.c. co 2 týdny 56,3%. U 83leté pacientky s anamnézou revmatoidní artritidy jsme léčbu ukončovali na žádost pacientky pro udávanou progresi bolestí kloubů po nasazení alirokumabu, u 65letého pacienta s anamnézou polyvalentní lékové alergie a intolerance jsme léčbu ukončovali na žádost pacienta pro udávanou bolest dolních končetin (myalgie) po nasazení alirokumabu. U 77leté pacientky jsme zaznamenali nulový efekt léčby alirokumabem i následně po provedení switch na evolokumab, jako příčinu nulového efektu léčby předpokládáme nejspíše mutaci v genu pro PCSK9.
Lékové interakce
Eliminace alirokumabu je dvojího typu – rychlejší je závislá na vazbě alirokumabu s PCSK9, kdy je komplex eliminován v retikuloendotelovém systému. Vyšší hodnoty izoenzymu PCSK9, s nimiž se setkáváme při léčbě jinými hypolipidemiky (statiny, ezetimibem či fibráty), tak urychlují plazmatickou eliminaci a snižují expozici alirokumabu o 20–40 %. Klinický význam však toto snížení nemá, hypolipidemický účinek se významně nemění. Vzhledem k tomu, že monoklonální protilátky neovlivňují aktivitu metabolických a transportních systémů, nehrozí riziko lékových interakcí s klasickými léčivy (1).
Dávkování
Alirokumab je aplikován v podkožních injekcích v základní dávce 75 mg vždy po dvou týdnech či v dávce dvojnásobné, tj. 150 mg, opět jedenkrát za dva týdny. Vyšší dávkování je indikováno při nedostatečném účinku základní dávky (určeném po 12 týdnech léčby) či v případě nutnosti dosažení maximálního účinku při velmi vysokých hodnotách LDL cholesterolu a při vysokém kardiovaskulárním riziku. Dávkování je jednotné u různých populací, tj. senioři, nemocní s renálním či s hepatálním selháním nevyžadují snížení dávky.
Alirokumab je dodáván v předplněných injekcích určených k autoaplikaci. Injekční stříkačky skladujeme při teplotě 2–8 °C. Před vlastním podáním je nutné ohřát stříkačku na pokojovou teplotu, poté alirokumab neprodleně podáme. Vhodnými místy pro injekční aplikaci jsou stehna, břicho, paže. Místa vpichu postupně měníme. Po zacvičení nečiní autoaplikace nemocným potíže, je však nutno pacienty instruovat (6).
Výsledky klinických studií, design studie ODYSSEY OUTCOMES
Jednalo se o multicentrickou, randomizovanou, dvojitě zaslepenou, placebem kontrolovanou studii sponzorovanou společnostmi Sanofi a Regeneron Pharmaceuticals.
Do studie mohli být zařazeni nemocní starší 40 let, kteří byli hospitalizováni pro akutní koronární syndrom 1–12 měsíců před randomizací a měli hodnotu LDL ‑ C alespoň 1,8 mmol/l navzdory nejméně 2týdenní intenzivní nebo maximální tolerované léčbě statinem. Intenzivní statinová léčba byla definována jako atorvastatin 40–80 mg nebo rosuvastatin 20–40 mg denně (2).
Nemocní byli randomizováni 1 : 1 k léčbě alirokumabem nebo dostávali placebo. Alirokumab byl iniciálně podáván v dávce 75 mg s.c. každé 2 týdny. V rámci studie byl vytvořen speciální protokol úpravy léčby s cílem dosáhnout ve skupině s alirokumabem hladiny LDL‑C 0,6–1,3 mmol/l a současně zabránit trvalému snížení hladiny LDL‑C pod 0,4 mmol/l. U jedinců, u nichž nebylo dosaženo cílového rozmezí a hladina LDL ‑ C zůstávala vyšší, byla proto dávka alirokumabu zaslepeně zvýšena na 150 mg jednou za 2 týdny. Naproti tomu u nemocných, u nichž hladina LDL‑C zůstávala pod 0,4 mmol/l, byla dávka alirokumabu buď zaslepeně snížena (ze 150 na 75 mg s. c. každé 2 týdny), nebo bylo podávání alirokumabu zaslepeně nahrazeno placebem. Hodnota LDL‑C 0,4 mmol/l byla nastavena jako bezpečnostní hranice, protože v době plánování ODYSSEY OUTCOMES nebyly k dispozici téměř žádné údaje o snižování LDL ‑ C k těmto extrémně nízkým hodnotám (2).
Hlavním výsledkem studie ODYSSEY OUTCOMES bylo ovlivnění výskytu primárního kompozitního cílového ukazatele hodnocením nezohledňujícím další příhody u jedince, který již prodělal KV‑příhodu zahrnutou v primárním ukazateli. Bylo tedy použito hodnocení, které je dnes zlatým standardem pro primární cílový ukazatel ve velkých studiích. Nedávno však byla publikovaná další analýza této studie, která se zaměřila na ovlivnění všech KV‑příhod, tedy i druhých, třetích a dalších následných. Do hodnocení byly zahrnuty IM, cévní mozková příhoda, NAP, koronární revaskularizace z důvodu ischemie a hospitalizace pro srdeční selhání (Obr. 1). Zatímco prvních příhod bylo zaznamenáno 3 064, všech příhod bylo celkem 5 425, tedy o 77 % více. Jestliže alirokumab zabránil 190 prvním příhodám, tak v případě hodnocení všech příhod jich bylo méně dokonce o 385. Pozitivní účinek alirokumabu na výskyt KV‑příhod se tedy při hodnocení všech příhod ještě zvýrazní. Z analýzy všech příhod také vyplývá, že stačí léčit 18 pacientů po dobu 4 let, abychom zabránili jedné příhodě (2).
Image 1. Hlavní nežádoucí kardiovaskulární příhody: MACE 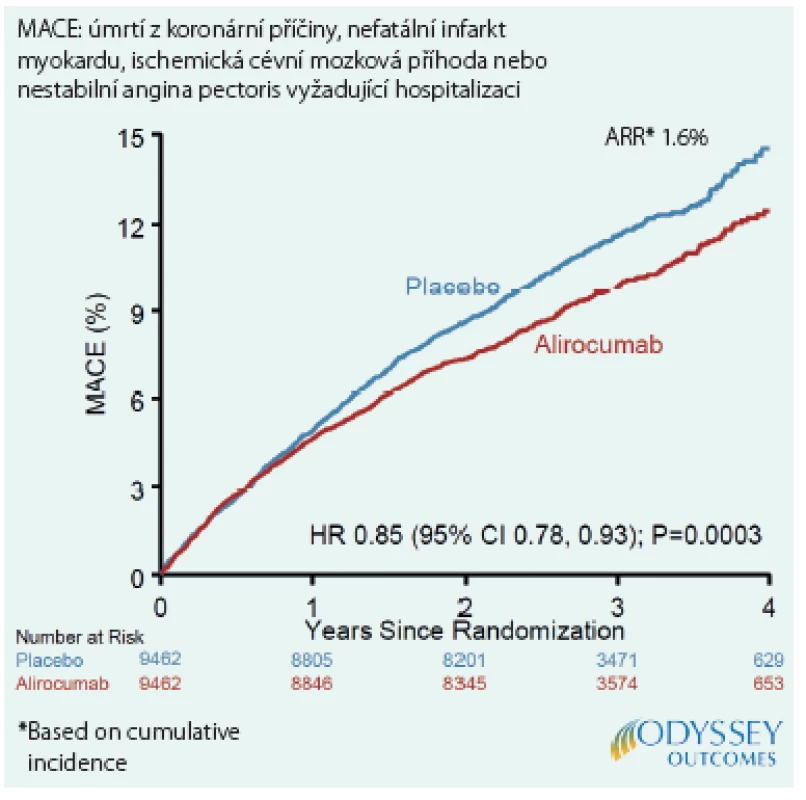
Léčba alirokumabem byla spojena s nižší celkovou mortalitou (3,5 % vs. 4,1 %; HR 0,85; 95% CI 0,93–0,98; P = 0,03). Nicméně vzhledem k předem stanovenému hierarchickému hodnocení cílových ukazatelů je třeba P pro mortalitu považovat za „nominální“, protože nebyly významně ovlivněny ukazatele, které jsou v hierarchii hodnocení nad celkovou mortalitou, tedy KV‑mortalita (P = 0,15) a mortalita z koronární příčiny (P = 0,38). Nicméně pokud se podíváme i na další složku celkové mortality, a to mortalitu z jiných než KV‑příčin (non‑KV), zjistíme, že byl zaznamenán trend k nižšímu riziku úmrtí ve skupině s alirokumabem (P = 0,06). Autoři další analýzy studie ODYSSEY OUTCOMES si proto dali za cíl podívat se na otázky ovlivnění mortality blíže. Především se zabývali otázkou, zda může být vztah mezi nefatálními KV‑příhodami, jejichž výskyt byl prokazatelně snížen alirokumabem, a non‑KV‑mortalitou. Hypoteticky, například nemocný s těžkou nefatální cévní mozkovou příhodou by mohl být ve vyšším riziku non‑KV‑úmrtí (např. na pneumonii). V této práci byl nalezen významný vztah mezi rizikem nefatální KV‑příhody a úmrtím z non‑KV‑příčiny (P < 0,0001). Je tedy možné, že alirokumab mohl příznivě ovlivnit celkovou mortalitu i tím, že měl vliv na non‑KV‑mortalitu, což ovšem nebylo zohledněno v předem stanovené hierarchické posloupnosti hodnocení výsledků. Tato analýza tedy nadále posiluje pravděpodobnost, že léčba alirokumabem po AKS může snížit i celkovou mortalitu (2) (Obr. 2).
Image 2. Úmrtí ze všech příčin 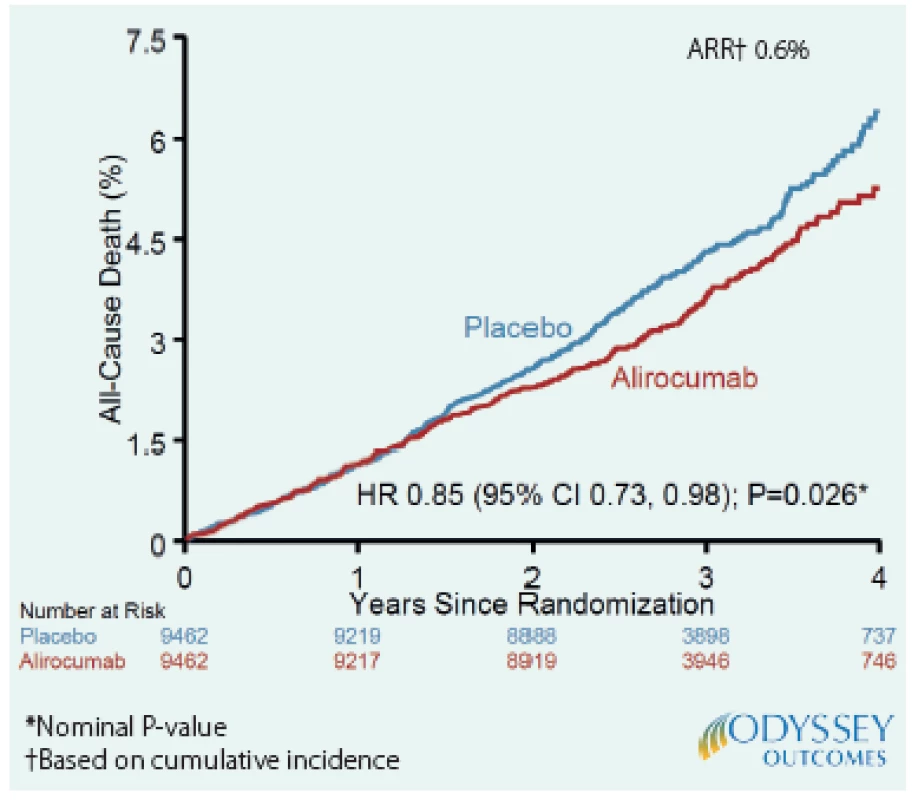
V rámci studie ODYSSEY OUTCOMES bylo předem specifikováno několik subpopulací pacientů, kterým se věnují další analýzy.
Subpopulace podle vstupní hladiny LDL‑C:
Analýzy ukázaly, že vstupní hladina LDL‑C měla vliv na výsledky. Nejvýraznější pozitivní účinek měl alirokumab v podskupině s nejvyšší vstupní hladinou cholesterolu, tedy > 2,6 mmol/l. V této podskupině bylo podání alirokumabu spojeno jak s výraznějším snížením primárního cílového ukazatele (HR 0,76; 95% CI 0,65–0,87) a snížením výskytu všech KV‑příhod (HR 0,79; 95% CI 0,70–0,88), tak s větší redukcí celkové mortality (HR 0,71; 95% CI 0,56–0,90) (2–4). V podskupině s LDL ‑ C > 2,6 mmol/l je třeba léčit pouhých 16 nemocných po dobu 4 let, aby se zabránilo jedné příhodě z primárního cílového ukazatele (2).
Subpopulace podle doby sledování ve studii:
Výraznější účinek alirokumabu byl nalezen také v podskupině nemocných, kteří byli léčeni déle než 3 roky. V této podskupině byla výrazněji nižší celková mortalita (HR 0,78; 95% CI 0,65–0,94).
Jedna z nejzásadnějších informací, které studie ODYSSEY OUTCOMES přinesla, je, že se léčba alirokumabem ukázala jako bezpečná. Mezi skupinami s alirokumabem a placebem nebyl rozdíl v celkovém výskytu nežádoucích příhod a laboratorních abnormalit.
Jedinou nežádoucí příhodou, která byla častěji pozorována po alirokumabu, byla lokální reakce v místě vpichu (3,8 % vs. 2,1 %; P < 0,001); skupiny se však nelišily ani ve výskytu závažných nežádoucích příhod, ani ve vzniku či zhoršení diabetu, srovnatelný byl i výskyt alergických reakcí, neurokognitivních poruch či hemoragických cévních mozkových příhod (2) (Tab. 1).
Table 1. Nežádoucí účinky alirocumabu během studie Odyssey Outcomes 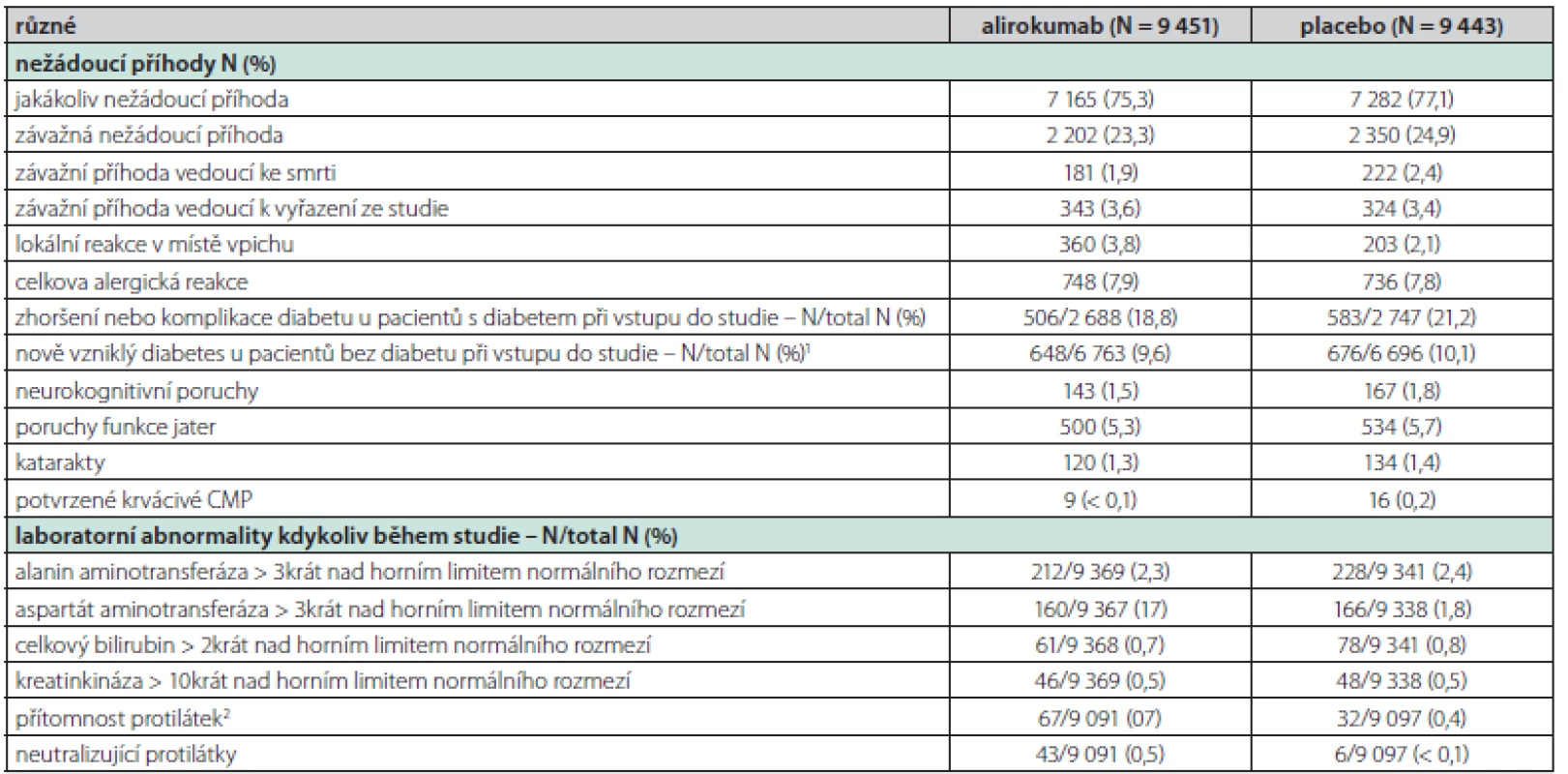
1 Nově diagnostikovaný diabetes byl definován podle přítomnosti jednoho nebo více z následujících faktorů, s potvrzením diagnózy zaslepeným externím posouzením odborníků v oblasti diabetu: hlášení o nežádoucích účincích, nový předpis na léčbu diabetu, hladina glykovaného hemoglobinu nejméně 6,5 % (a výchozí hladina < 6,5 %) při dvou měřeních, nebo hladina glykemie nalačno nejméně 126 mg/dl (7,0 mmol/l) při dvou měřeních (a výchozí hladina < 126 mg/dl).
2 Protilékové protilátky byly definovány podle přítomnosti pozitivních reakcí, které byly zjištěny po zahájení zkoušeného léčebného režimu v nejméně dvou po sobě odebraných vzorcích séra po stanovení základních hodnot, kdy mezi odebráním vzorků uplynula doba nejméně 16 týdnů.Některé jiné studie a jejich analýzy vyslovily obavu, že by velmi nízké sérové hladiny LDL cholesterolu mohly zvyšovat riziko vzniku hemoragické CMP. Analýza studie Odyssey Outcomes však prokázala, že u pacientů po nedávném akutním koronárním syndromu navzdory vysoce intenzivní statinové terapii redukovala léčba alirokumabem riziko výskytu ischemické CMP bez zvýšení rizika hemoragické CMP. Efekt léčby byl numericky vyšší u pacientů s vyšší vstupní sérovou hladinou LDL cholesterolu. Léčba alirokumabem v prevenci CMP měla stejný benefit u pacientů s již prodělanou CMP nebo bez ní, absolutní benefit však byl vyšší u pacientů po již prodělané CMP, protože se jednalo o rizikovější populaci (3).
Na letošní konferenci American College of Cardiology 2020 byly prezentovány výsledky studie Odyssey HoFH, která testovala léčbu alirokumabem u pacientů s homozygotní familiární hypercholesterolemií. Pacienti byli randomizováni léčbě alirokomabem 150 mg s.c. co 2 týdny anebo k placebu přidané k předchozí hypolipidemické léčbě. Primárním výsledkem měla být změna hladiny LDL cholesterolu v porovnání s placebem vůči bazální hodnotě po 12 týdnech léčby. Pacienti léčení alirokumabem dosáhli v porovnáni s jedinci užívající placebo vyšší redukci LDL cholesterolu v průměru o 1,9 mmol/l. Porovnání efektu alirokumabu u jedinců s HeFH a HoFH ukazuje, že u obou skupin došlo k podobné absolutní redukci hladiny LDL cholesterolu přibližně o 2 mmol/l. Relativní snížení hladiny LDL cholesterolu bylo nižší u pacientů s HoFH. To souvisí s patofyziologií onemocnění, a tedy se závažností genetického defektu. Při HoFH kombinace dvou afunkčních mutací v genu pro LDL‑R, apoB, PCSK9 nebo LDL‑receptor adaptér protein 1 snižuje odpověď na jakýkoliv typ léčby. U této populace pacientů je nutná personalizace léčby a provedení farmakogenetických studií s vyšším počtem pacientů (4).
Na základě výsledků studií s evolokumabem (Fourier) a alirokumabem (Odyssey Outcomes) doporučila Evropská kardiologická společnost a Evropská společnost pro aterosklerózu cílové hodnoty LDL‑C pod 1,4 mmol/l u pacientů ve velmi vysokém riziku, a dokonce hodnoty pod 1,0 mmol/l pro pacienty, u kterých byly pozorovány rekurentní kardiovaskulární příhody v průběhu dvou let (4).
Inhibitory proprotein konvertázy subtilizin‑kexin 9 (PCSK9i) dostávají v guidelines léčby dyslipidemií verze 2019 vyšší úroveň doporučení. Alirokumab a evolokumab mají být zváženy, pokud nelze dosáhnout stanovených cílových hodnot při použití maximálně tolerované dávky statinu v kombinaci s ezetimibem.
U pacientů po akutním koronárním syndromu, pokud není dosaženo cílové hodnoty LDL maximálními tolerovatelnými dávkami statinu v kombinaci s ezetimibem během 4–6 týdnů, je doporučeno zahájit léčbu inhibitory PCSK9. U pacientů, u nichž není dosaženo kontroly LDL ‑ C maximální tolerovanou dávkou statinu a ezetimibem a vznikne u nich AKS, má být zvážena časná indikace PCSK9 ihibitoru, je‑li to možné, ještě za hospitalizace (7).
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Tomáš Král, tomas.kral@fno.cz
Fakultní nemocnice Ostrava, 17. listopadu 1790/5 , 708 52 Ostrava-PorubaČlánek přijat redakcí: 14. 6. 2020
Článek přijat po recenzích k publikaci: 7. 7. 2020
Sources
1. Bultas J. Alirocumab. Remedia 2016; 26 : 431–435.
2. Ošťádal P. Vliv alirokumabu na kardiovaskulární příhody: Co ukázala studie ODYSSEY OUTCOMES? AtheroRev 2019; 4(1): 53–60.
3. Murín J. Horúce novinky zo štúdie ODYSSEY OUTCOMES. AtheroRev 2020; 5(1): 55–59.
4. Tkáč I. Nové poznatky o liečbě alirokumabom zo společnej konferencie American College of Cardiology a World Congress of Cardiology 2020. AtheroRev 2020; 5(2): 124–126.
5. Češka et al. Společné stanovisko odborných společností k předepisování PCSK9-inhibitorů. AtheroRev 2018; 3(3): 201–207.
6. SPC Praluent 150mg, 75mg inj.
7. Vráblík M, et al. Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019. AtheroRev 2019; 4(3): 126–137.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 5-
All articles in this issue
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

