-
Medical journals
- Career
Diabetes mellitus 2. typu v praxi – balancování mezi rezistencí a sekrecí
Authors: Barbora Pavlíková; Martina Vodičková; Vojtěch Česák; Michal Krčma; Zdeněk Rušavý
Authors‘ workplace: I. interní klinika LF UK a FN Plzeň
Published in: Vnitř Lék 2020; 66(1): 21-27
Category: Main Topic
Overview
Diabetes mellitus 2. typu je onemocnění, které je charakterizováno progresivním selháním funkce B‑buněk na pozadí významné inzulinové rezistence. Individuální přístup má smysl zejména u dlouhodobě dekompenzovaných pacientů, u nichž poznání vedoucího patofyziologického mechanismu nemoci může napomoci ke správnému směřování terapie. Pacient s téměř vyhaslou sekrecí nebude jistě profitovat z terapie sekretagogy či inkretiny, naopak pacient s vyšší rezistencí, který dospěl k inzulinoterapii, je ohrožen vznikem circulus vitiosus ve smyslu navyšování dávek – přibírání na váze díky anabolickému efektu inzulinu s možným podílem dojídání hypoglykemií – další zvýšení rezistence – další zvýšení dávky inzulinu a takto stále dokola. Práce je zamyšlením nad přístupem k pacientům s dekompenzovaným diabetem mellitem 2. typu s již vyčerpanými možnostmi intenzifikace léčby. Jak rozpoznat pacienty, kteří by profitovali z komplexní změny terapie ve smyslu snížení či vysazení inzulinu a převodu na jinou léčbu (zejména inkretiny), od pacientů, u nichž by takováto změna vedla jen k další dekompenzaci? Jistě důležitým nástrojem je odhalení převládající patofyziologie u daného nemocného. V první části práce jsou zmíněny existující metody ke stanovení poruchy sekrece a míry inzulinové rezistence, se zamyšlením nad jejich možným použitím v klinické praxi. V další části se publikace snaží porovnáním výsledků intervenčních studií na obdobné populaci poukázat na možné faktory předvídající úspěšnost zvolené změny terapie u tohoto typu pacientů (v tomto případě převod na GLP-1 analogy či razantní snížení hmotnosti).
Klíčová slova:
diabetes mellitus 2. typu – diagnostika – inzulinová rezistence – inzulinová sekrece – léčba
Úvod
Diabetes mellitus 2. typu je onemocnění charakterizované progresivním selháním funkce B‑buněk na pozadí významné inzulinové rezistence (1). V posledních letech je v literatuře deficit B‑buněk (masy i funkce) brán jako hlavní patofyziologický mechanismus diabetes mellitus (2). Rozdíl mezi prvním a druhým typem diabetu je poté v příčině progresivní ztráty těchto buněk, kdy se u diabetu 1. typu jedná o autoimunitní proces, u diabetu 2. typu naproti tomu hlavní roli hraje zvýšená inzulinová rezistence a s ní spjatá glukotoxicita, lipotoxicita a „přepracování“ B‑buněk. Pracujeme tedy s progresivním onemocněním, jehož hlavní patofyziologická složka se s časem proměňuje – na začátku je nejvýraznějším prvkem inzulinová rezistence, s časem nabývá na významu porucha sekrece. Z logiky věci vyplývá, že u každého pacienta je v daném čase jiný podíl těchto dvou složek (s odlišným terapeutickým přístupem k nim), a lékař je proto při optimalizaci terapie často stavěn před složitější rébus.
Základní algoritmus k nastavení terapie je součástí evropských doporučení vydaných Evropskou asociací pro studium diabetu (EASD) a Americkou dietetickou asociací (ADA) v roce 2018 (3). Prvotně jde o změnu životního stylu, dále též farmaka ovlivňující inzulinovou rezistenci bez vlivu na sekreci (metformin). S progresí nemoci lze eskalovat terapii glifloziny či inkretiny – skupiny léčiv s rozdílným mechanismem, nicméně i zde lze rozeznat společný cíl, kterým je snížení nebo alespoň zachování tělesné hmotnosti pacienta. Zjednodušeně tím sledujeme nezvyšování inzulinové rezistence. Vše ve snaze zabránit vzniku circulus vitiosus přírůstek hmotnosti – inzulinorezistence – externě dodaný či stimulovaný inzulin – přírůstek hmotnosti – zvýšení inzulinorezistence.
Předpokladem indikace inzulinoterapie je pak neefektivita předcho ‑ zích postupů, přičemž patofyziologický proces v organismu – tedy progresivní ztráta vlastní sekrece inzulinu – není nikde hodnocen a v přístupu k terapii v doporučeních EASD není brán v potaz (3). Problém nastává u pacienta dlouhodobě dekompenzovaného i na intenzifikovaném inzulinovém režimu, kde další titrace inzulinoterapie vede právě k výše zmíněnému bludnému kruhu. V tomto případě doporučení konstatují nutnost individualizace terapie s tím, že v některých případech je nutná další titrace inzulinu, v jiných naopak redukce či dokonce vysazení současné terapie (3). Článek obsahuje zamyšlení nad existujícími metodami, které by mohly pomoci rozlišit tyto dvě skupiny pacientů, a možnostmi uplatnění zmíněných metod v praxi.
Laboratorní metody posouzení sekrece a rezistence
Jednou stranou poruchy metabolismu inzulinu, kterou je potřeba v rozhodnutí o terapii zvážit, je sekrece inzulinu u daného pacienta. B‑buňky pankreatu jsou jediným místem syntézy a sekrece inzulinu. Tyto děje podléhají složitým regulačním mechanismům, jejichž vychýlení se může projevit nedostatkem vylučovaného inzulinu. Hormon se syntetizuje nejdříve ve formě proinzulinu, ze kterého poté po odštěpení C‑peptidu vzniká aktivní inzulin (4).
Jednorázová hladina inzulinu v krvi není pro posouzení sekrece vhodná, biologický poločas inzulinu je velice krátký a jeho hladina vel ‑ mi proměnlivá v závislosti na mnoha parametrech. Navíc k posouzení vlastní sekrece by bylo nutné znát hladinu prehepatického inzulinu (z portální krve) – až 50 % vylučovaného inzulinu je ihned utilizováno játry. Hladina inzulinu v periferní krvi je však důležitým faktorem pro odhad sekrece či rezistence u daného pacienta.
U zdravého člověka je možno v periferní krvi nalačno prokázat asi 5–10 % proinzulinu a jeho produktů (4). Pro diabetes mellitus 2. typu je příznačný zvýšený podíl proinzulinu v krvi, který pozitivně koreluje s regresivními změnami B‑buněk. V literatuře je zvažováno měření podílu proinzulinu k C‑peptidu, resp. proinzulinu k inzulinu, k odhalení časných fází diabetu 1. typu, méně často je zvažováno toto měření k predikci rozvoje diabetu 2. typu (5). Nicméně u již existujícího diabetika 2. typu zatím neexistuje nástroj, který by konkrétní hladinu proinzulinu daného pacienta dal do vzájemného vztahu s funkcí B‑buněk. V praxi se tedy stanovení hladiny proinzulinu v krvi v rozhodování o terapii zatím nevyužívá.
K posouzení sekrece inzulinu se dále nabízí měření hladin C‑peptidu. V klinické praxi se jedná o jednoduchou metodu k orientačnímu posouzení funkčnosti B‑buněk daného pacienta. Bez ohledu na typ diabetu je jako absolutní deficit sekrece inzulinu brána hodnota C‑peptidu nalačno menší než 0,08 nmol/l, nebo menší než 0,2 nmol/l po tolerančním testu s jídlem (mixed meal test – MTT) (6).
U 2. typu diabetu se však většinou s takto významnou deplecí sekrece nesetkáváme. I přes množství studií zabývajících se dalšími možnostmi je role měření C‑peptidu u těchto pacientů zatím omezena pouze na vyloučení absolutní dependence na inzulinu (zejména v případě nejistoty ohledně typu diabetu). Zejména v Japonsku je C‑peptid jako možný faktor v rozhodování o terapii hojně studován. V rámci predikce nutnosti inzulinoterapie u diabetiků 2. typu se tak např. jako relativně vhodný ukazatel zdá být poměr postprandiálního C‑peptidu 2 hodiny po jídle ke glykemii v témže čase (postprandial C‑peptide to glucose ratio – PCPRI) (7).
V souvislosti s C‑peptidem pak nelze nezmínit glukagonový stimulační test (GST). Metoda je založená na měření C‑peptidu nalačno a 6 min po stimulaci 1 mg glukagonu. Indikována je především u pacientů s nejasným typem diabetu, resp. k odlišení jedinců s vyhaslou sekrecí inzulinu. Hodnota stimulovaného C‑peptidu pod 0,2 nmol/l je známkou slabé funkce B‑buněk a brzké nutnosti zahájení inzulinoterapie (8). V menší studii se pak glukagonový test (a při něm měřený stimulovaný C‑peptid) ukázal jako zajímavý ukazatel pozitivní odpovědi na terapii liraglutidem (9).
K měření C‑peptidu nutno podotknout, že naměřená hodnota je ovlivňována více vlivy, včetně významné hyperglykemie. Dalšími faktory jsou významná triglyceridemie, hyperbilirubinemie či renální insuficience (10). Při vyšetření stimulované složky má zásadní vliv dodržení klidu po stimulaci, v případě MTT i přesné složení definovaného jídla. Další metody k posouzení inzulinové sekrece jsou v jednoduchosti popsány v tabulce 1.
Table 1. Výběr metod k posouzení inzulinové sekrece 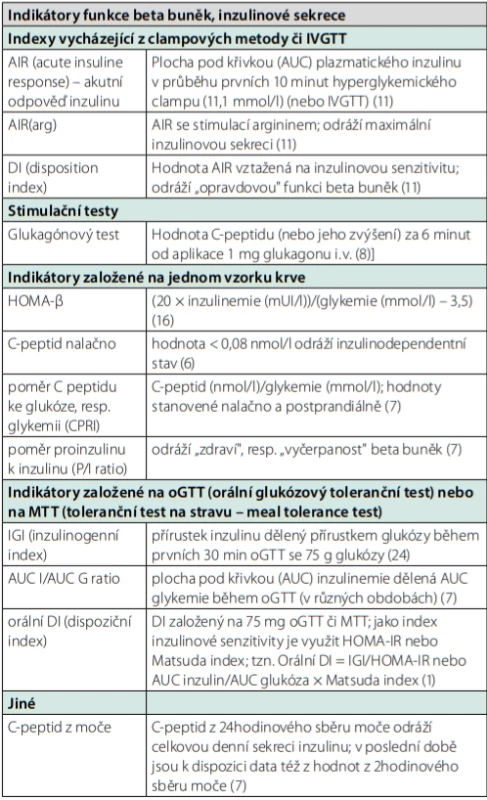
Sekrece inzulinu je pouze jedním ze dvou zásadních procesů, druhým je působení inzulinu v cílových tkáních, neboli inzulinová senzitivita. Tento efekt se promítá zejména ve svalech, játrech a tukové tkáni. V praxi je spíše používán termín inzulinová rezistence (IR), rozdíl mezi těmito veličinami je zanedbatelný a pojmy se často volně zaměňují. Až součet obou faktorů (sekrece a rezistence), neboli účinek inzulinu, vytváří klinický obraz u daného pacienta. Ke stanovení účinku inzulinu pak mohou být použity testy dynamické (clampy, supresní testy, intravenózní toleranční test) nebo indexy.
Dynamické testy
Zlatým standardem v hodnocení inzulinové rezistence je hyper‑inzulinemický euglykemický clamp (HEC), metoda zavedená De Fronzem již v roce 1979 (11). Jedná se zatím o nejpřesnější posouzení účinku inzulinu. Ve stejné práci je pak poprvé uveden hyperglykemický clamp jako metoda posouzení senzitivity B‑buněk ke glukóze. Pro klinickou praxi jsou obě metody příliš náročné, používány jsou spíše ke studijním účelům.
Druhou metodou, která je obecně považována po clampových testech za nejspolehlivější v odhadu inzulinové rezistence a sekrece, je intravenózní glukózový toleranční test s frekventním odběrem vzorků (frequently sampled intravenous glucose tolerance test – IVGTT resp. FSIGT) neboli „minimální model“ zavedený Bergmanem ve stejném roce jako HEC De Fronzem (11). Nejčastěji zjišťovanými parametry u IVGTT jsou akutní odpověď inzulinu (acute insulin response – AIR) a dispoziční index (DI). AIR je dána průměrným vzestupem inzulinemie v prvních 5–10 min testu a vypovídá o první fázi sekrece inzulinu, která se u diabetiků 2. typu ztrácí již v časných stadiích nemoci (13). Není bez zajímavosti, že obnovení této první fáze u pacientů bylo pozorováno při cíleném razantním úbytku tělesné hmotnosti (33). Obdobně lze měřit akutní inzulinovou odpověď po aplikaci intravenózního bolusu argininu (AIR (arg)), molekuly, která podněcuje sekreci inzulinu více než glukóza. Tento postup je znám též jako argininový test (13). AIR je poté základem výpočtu dispozičního indexu (DI): DI = AIR x SI1 kde SI představuje index inzulinové senzitivity získaný pomocí matematického modelování z IVGTT. Jedná se o nejčastěji využívanou metodu hodnocení sekrece při dané inzulinové senzitivitě. Vychází z jednoduché představy, že adaptace funkce B‑buněk na rezistenci sleduje striktní hyperbolu (charakterizovanou právě daným DI). Až vychýlení od této hyperboly ukazuje na relativní nedostatek inzulinu u daného jedince (13). K výpočtu těchto parametrů však IVGTT vyžaduje častý odběr vzorků s velkou přesností, zkušený personál a nejlépe i specializovaný software. I přes snahy různých autorů o zjednodušení testu je IVGTT, vzhledem k interindividuální variabilitě a náročnosti provedení, stále rezervován spíše pro populační studie zjišťující rozdíly v sekreci či působení inzulinu mezi většími skupinami osob (např. etniky) (4). Navíc inzulinová odpověď na intravenózní podání glukózy je vždy nefyziologickým mechanismem, kdy je zcela vyřazen efekt inkretinových hormonů, které v reálné praxi hrají důležitou roli.
Před zavedením HEC a IVGTT se k hodnocení inzulinové senzitivity používaly supresní testy. Původně se jednalo pouze o prosté infuze inzulinu a glukózy, později byly testy zdokonaleny využitím jiných suprimujících molekul – ať už somatostatinu či octreotidu. I když je prokázána významná korelace mezi výsledky supresních testů a HEC v měření inzulinové senzitivity, nejsou v žádném ohledu výhodnější a jejich využití upadá (4).
K zjištění vzorce inzulinové sekrece za fyziologičtějších podmínek byly do praxe zavedeny testy s perorálním zatížením glukózou či kom ‑ plexnějšími sacharidy, tedy orální glukózový toleranční test (oGTT) (14), resp. toleranční test s jídlem (mixed meal tolerance test – MTT) (15). Odhad množství sekretovaného inzulinu je dán plochou pod křivkou inzulinemie (area under curve – AUC) měřené v průběhu celého oGTT, resp. MTT. Trvání standardního oGTT s podáním 75 g glukózy bývá většinou 120 min (příp. 180 min), plocha pod křivkou v první půl hodině testu po podání glukózy pak odpovídá první fázi sekrece inzulinu. Obdobně je tomu u MTT, délka testu bývá obvykle delší, vzhledem k pozdnímu nástupu hyperglykemizujícího účinku nesacharidových složek potravy (tuky, bílkoviny). Fakt, že zapojení inkretinů je zejména u diabetiků 2. typu mechanismem, který by neměl být při odhadu první fáze sekrece inzulinu opomíjen, dobře ilustruje práce Ahréna et al (16). V případě IVGTT testu je první fáze sekrece téměř neznatelná, v případě oGTT je i přes jasné opoždění oproti zdravým kontrolám již patrná. Rovněž plocha pod křivkou inzulinemie je ovlivněna (Obr. 1). Složitější modely oGTT dovolují též odhad inzulinové senzitivity a výpočet orálního dispozičního indexu. Významnost těchto metod (zejména pak oGTT) ilustruje existence množství indexů k výpočtu inzulinové rezistence, např. Matsuda či Stumvoll index, jejichž základem je provedení tolerančního testu. Limitací oGTT je, že oproti skutečné stravě je test založen pouze na glukóze. V reálném životě však mají ostatní složky stravy vliv na vstřebávání sacharidů ze střeva, resp. na celkový vývoj glykemie. Na druhou stranu je oGTT jasně definován, naopak výsledky MTT se významně liší podle složení a velikostí porcí podávané potravy. OGTT je snadno reprodukovatelný, jeho opakované provedení u pacienta může napomoci ve sledování vývoje rezistence či úpadku sekrece u daného jedince, pro ambulantní praxi se ale stále jedná o časově náročnou metodu.
Image 1. Typická plazmatická kinetika inzulinu v průběhu IVGTT (a) a oGTT testu (b) NGT – normální glukózová tolerance, T2DM – diabetes mellitus 2. typu, IGT – porušená glukózová tolerance. Upraveno podle (16) 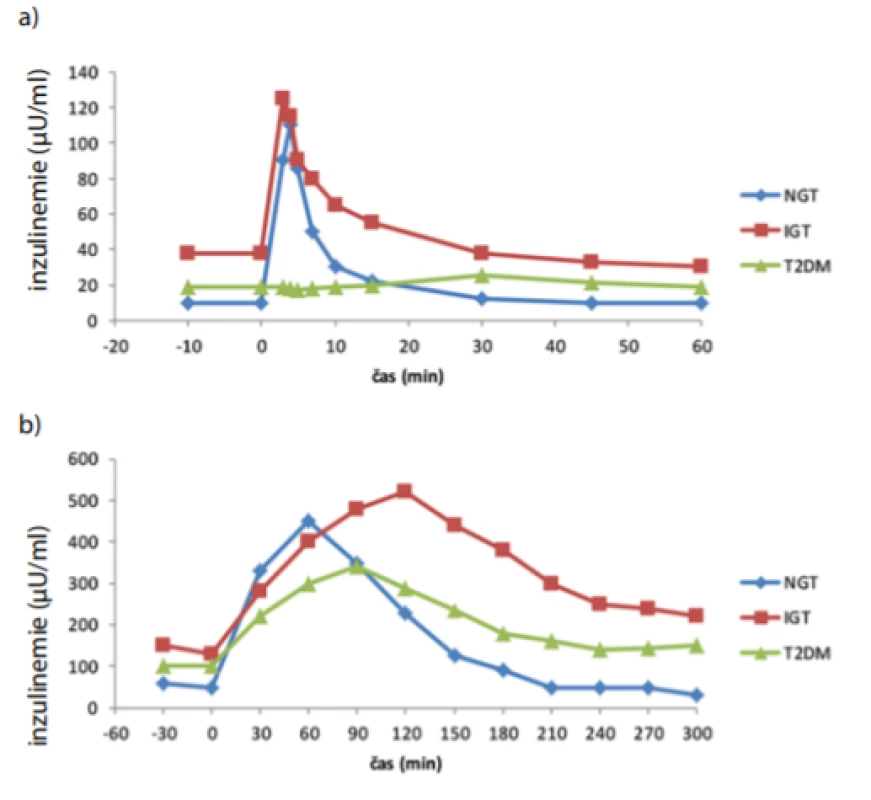
Indexy inzulinové senzitivity a sekrece
K rychlému zhodnocení rezistence a sekrece bylo v minulosti vypracováno množství metod založených na výpočtech – tzv. indexy. Schopnost daným indexem odhadnout senzitivitu, resp. sekreci je pak posuzována stupněm korelace s výsledky z clampových metod. Indexy lze rozdělit do 2 podskupin:
- vycházející z jednorázového měření hodnot plazmatické koncentrace inzulinu, glykemie a triglyceridů,
- vycházející z hodnot inzulinu a glykemie naměřených během standardního oGTT se 75 g glukózy.
Do 1. skupiny patří zejména HOMA‑IR, QUICKI a McAuleyho index, do 2. skupiny pak Matsuda index a inzulinogenní index, z méně známých indexy Belfiore, Cederholm, Avignon nebo Stumvoll. Ze zmíněných indexů se nejvíce využívá HOMA‑IR, QUICKI a Matsuda index, ostatní jsou užívány sporadicky.
Homeostatický model neboli HOMA (homeostasis model assessment) navržený Matthewsem v roce 1985, se dá využít k hodnocení jak inzulinové rezistence (pak mluvíme o HOMA‑IR), tak ke zhodnocení sekrece B‑buněk (HOMA‑β). Využívá jednorázově změřenou hodnotu lačné glykemie a inzulinemie (či C‑peptidu) ke zhodnocení rovnováhy hepatální glukoneogeneze a sekrece inzulinu B‑buňkami v bazálním stavu organismu (16, 17). HOMA‑IR na rozdíl od clampových metod špatně vyjadřuje rezistenci k inzulinu v periferních tkáních. Celý vztah pro HOMA‑IR je vyjádřen rovnicí:
HOMA-IR = l 0 × G0 /22,5
Pro zhodnocení funkce B‑buněk pak:
HOMA-β (%) = 20 × l0 /G0 – 3,5
Inzulinemii je třeba zadávat v jednotce mU/l, glykemie v mmol/l. Jako normální inzulinová rezistence jsou brány hodnoty do 2–2,5, přesný bod pro daného jedince však určit nelze. Z provedených studií vyplývá, že optimální cut‑off hodnoty se zásadně liší pro různé po ‑ pulace i skupiny osob v jednotlivých populacích. Metodu lze použít pro sledování vývoje rezistence ve větších populacích (kohortové a epidemiologické studie), u jednotlivého pacienta jde o nástroj velmi diskutabilní a nedoporučovaný. Jednorázově nemá tento test u jedince vypovídající hodnotu, jak pro posouzení inzulinorezistence, tak pro náhled na funkci B‑buněk. Je však možné jej použít ke sledování vývoje rezistence v čase. I zde je doporučováno použít pro jednotlivé měření více vzorků sérového inzulinu. Nutná je opatrnost v interpretaci výsledku u pacientů léčených sekretagogy či inzulinem, a to i v rámci hodnocení výsledků studií. V případě sekretagog je funkce B‑buněk, reprezentovaná hladinou inzulinu při dané glykemii, zkreslena medikací a neodpovídá skutečnému stavu. V případě inzulinoterapie postrádá vyhodnocení sekrece B‑buněk pomocí hladin inzulinu v těle smysl. Situaci lze obejít použitím modelu nahrazujícím inzulinemii hladinou C‑peptidu, nicméně metoda zatím není ověřena. Možnosti vyhodnocení senzitivity pomocí HOMA při inzulinoterapii jsou předmětem výzkumu (18).
V roce 1998 Levy et al model HOMA upravili tak, aby lépe odrážel různé hodnoty rezistence (hepatální i periferní) a cirkulujícího proinzulinu, a zároveň dokázal dát přesnější výsledek při glykemiích vyšších než 10 mmol/l. Výsledkem bylo vytvoření indexů HOMA2-IR, resp. HOMA2-β (19). Matematický model pro HOMA2 přesahuje rámec této publikace, limitace modelu pro posouzení stavu rezistence a sekrece u jednotlivého pacienta jsou však stejné.
Kvantitativní index inzulinové senzitivity neboli QUICKI (quantitative insulin‑sensitivity check index) je de facto logaritmickou funkcí HOMA‑IR indexu:
QUICKI = 1 = 1 /log (I0 × G0 ) - 1/log (22,5 × HOMA – IR)
Hodnoty pod 0,30 značí menší senzitivitu k inzulinu, resp. větší rezistenci (20). Tento model, zavedený v roce 2000 Katzem et al, má podobné výhody, ale i nevýhody jako index HOMA‑IR, oproti kterému však vykazuje lepší korelaci s clampovými metodami (21). Model ale nedokáže vyhodnotit druhou část „spojité nádoby“ – sekreci inzulinu B‑buňkami. Jednorázový test je tedy pouze malou pomocí v rozhodování o další terapii u pacienta s dekompenzovaným diabetem 2. typu, zejména je‑li již na inzulinoterapii.
Matsuda index je metoda vycházející z měření v průběhu standardního testu oGTT se 75 g glukózy. Index vykazuje vysokou korelaci s daty z HEC (22). Pro kompletní zhodnocení je potřeba vícero měření v rámci jednoho testu oGTT. Samotný vzorec je pak:
Matsuda index = 10 000/ 2 √(I0 × G0 ) × (Imean × Gmean)
Matsuda index prokázal schopnost s větší přesností odhalit jedince s rizikem inzulinorezistence než HOMA‑IR, zvláště v nejistých případech s minimálně zvýšenou IR oproti normálu. Zdá se, že by tento index mohl být oproti HOMA‑IR výhodnější při sledování výsledků intervenčních studií (23). Na druhou stranu se však vyskytly pochybnosti o spolehlivosti jak Matsuda indexu, tak HOMA‑IR ve sledování IR v rámci studií dlouhodobých (24). U dekompenzovaného diabetika 2. typu je navíc jistá míra inzulinorezistence takřka jistotou, Matsuda index tedy oproti HOMA‑IR nepřináší žádnou další informaci, která by přispěla k rozhodnutí o vhodnosti určité terapie v daný okamžik.
Pomocí dat z oGTT pak lze zhodnotit i první fázi sekrece inzulinu, a to pomocí inzulinogenního indexu (IGI) (24, 25). Zjednodušeně lze index popsat jako obdobu AIR pro potřeby oGTT, v tomto případě je posuzován rozdíl mezi přírůstkem inzulinemie a glykemie ve 30. min testu:
IGI = ∆I (0–30 min)/ ∆G (0–30 min)
Oproti AIR je inzulinogenní index odrazem komplexnějších pochodů (např. i vlivu inkretinů). I tak je ale přes svou jednoduchost schopen odhalit základní abnormality funkce B‑buněk. Přínos metody u dekompenzovaného diabetika 2. typu je však otazný, porucha první fáze sekrece je totiž u takového pacienta zpravidla vždy přítomna.
Charakteristiky predikující úspěšnost změny terapie
Z výše uvedeného vyplývá, že neexistuje jasná metoda, která by v danou chvíli s jasností určila, která terapie u daného pacienta povede k úspěchu. Jednorázově uplatňované testy jsou buď příliš náročné, nebo vypovídají pouze o jedné ze dvou důležitých poruch – inzulinorezistenci či poruše inzulinové sekrece, aniž by je dokázaly propojit a říci, která z nich je pro pacienta rozhodující. Léčbu samozřejmě nelze uplatňovat pouze na jeden z faktorů, nicméně pacient s převažující poruchou sekrece bude profitovat z jiné terapie než pacient s převažující poruchou rezistence. Některé intervenční studie napomáhají najít charakteristiky, podle kterých by bylo možné odhadnout reakci na léčbu u konkrétního pacienta. Často zvažovanou změnou terapie u dekompenzovaného diabetika, který je již delší dobu na inzulinoterapii, je převod či přidání inkretinů do léčby, a dále radikální redukce hmotnosti, přičemž oboje cílí na redukci inzulinové rezistence, inkretiny též na podporu sekrece. U studií zabývajících se touto problematikou lze vysledovat vstupní parametry rozlišující skupinu „responderů“ a „nonresponderů“ na zvolenou terapii. Z hlediska skupiny responderů lze zmínit skupinu studií s převodem diabetiků 2. typu léčených inzulinem na agonisty glukagonu podobného peptidu (GLP-1 – glucagon‑like peptid-1). Přehledné zhodnocení faktorů ukazuje tabulka 2. Prediktorem úspěšné změny terapie byla obecně zejména kratší délka trvání diabetu a menší celková denní dávka inzulinu (26–29). Naopak se zdá, že z hlediska kompenzace po převodu nemá na úspěšnost vliv věk pacienta ani jeho body mass index (BMI) (26–30). V případě asijských studií je většina studované populace diabetiků 2. typu bez nadváhy, u euroamerické populace jsou však zahrnuti i pacienti s vyšším stupněm obezity. U asijské populace se zdá být přínosné i měření C‑peptidu nalačno (28). Naopak v evropské ani americké studii nebyl mezi respondery a nonrespondery v tomto parametru prokázán signifikantní rozdíl, což odpovídá představě o odlišné patofyziologii 2. typu diabetes mellitus u těchto populací (26, 29).
Table 2. Porovnání vybraných faktorů před změnou inzulinoterapie na GLP-1 agonistu u responderů a nonrespoderů na danou změnu 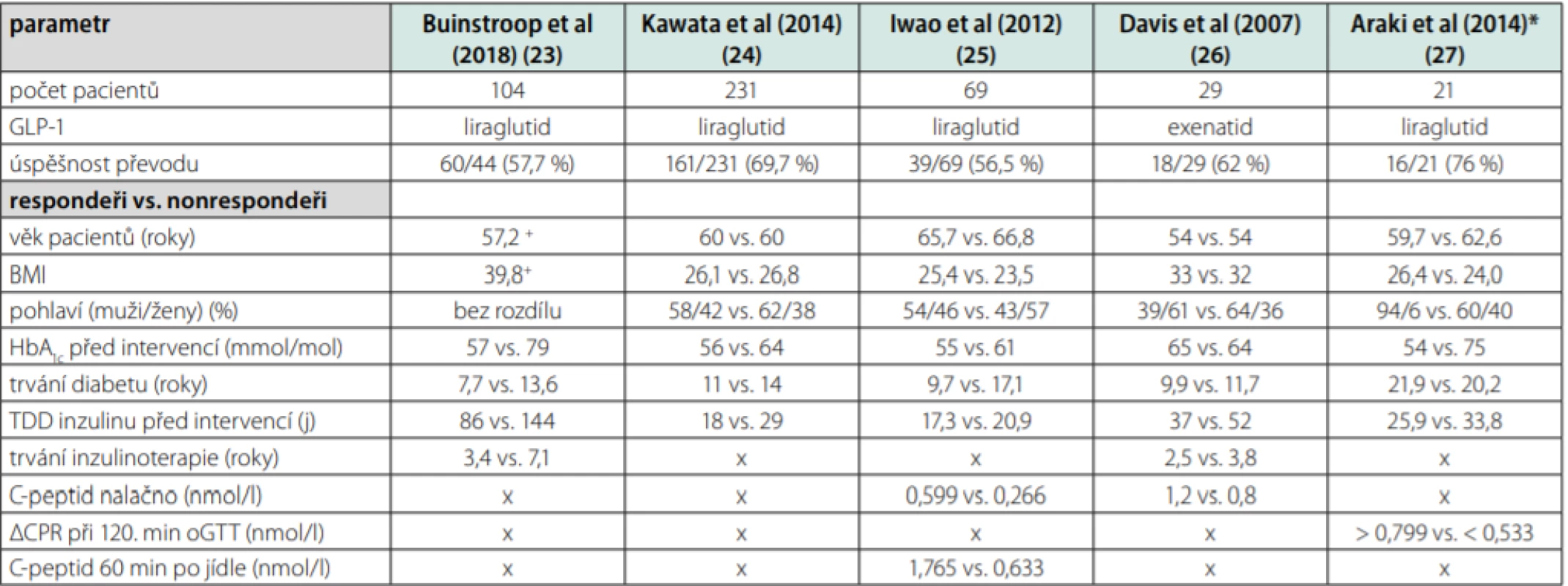
+studie pro statistickou nevýznamnost rozdílu neuvádí přesná data pro respondery a nonrepondery zvlášť (23); *studie s pacienty s GFR < 1ml/s/1,73 m2 (27) Z hlediska radiální redukce hmotnosti se lze zabývat bariatrickými výkony či výsledky velmi nízkokalorických diet. U bariatrie stojí za zmínku nově upravený skórovací systém DiaRem Advanced, který díky kombinaci faktorů dokáže předvídat pravděpodobnost remise diabetu u určitých bariatrických operací (Tab. 3) (31). Výhodou tohoto systému je, že byl vytvořen na evropské populaci, a tudíž by měl být platný i pro pacienty v ČR. Hodnota skóre se pohybuje mezi 0–21, s vysokou pravděpodobností remise diabetu až do 5 let po bariatrii při hodnotě 0–7. Správnost klasifikace dosahuje více než 80 % (pro Roux‑en‑Y bypass a sleeve gastrektomii, o něco méně u bandáže žaludku) (32). Faktory použité pro výpočet skóre jsou většinou anamnestické, s výjimkou aktuální hodnoty glykovaného hemoglobinu (HbA1c), díky tomu je systém snadno použitelný v praxi. Bohužel dekompenzovaný pacient na inzulinoterapii může často spadnout do rozmezí tzv. „šedé zóny“.
Table 3. Advanced DiaRem – skórovací systém pro odhad výsledku bariatrické chirurgie. Upraveno podle (28) 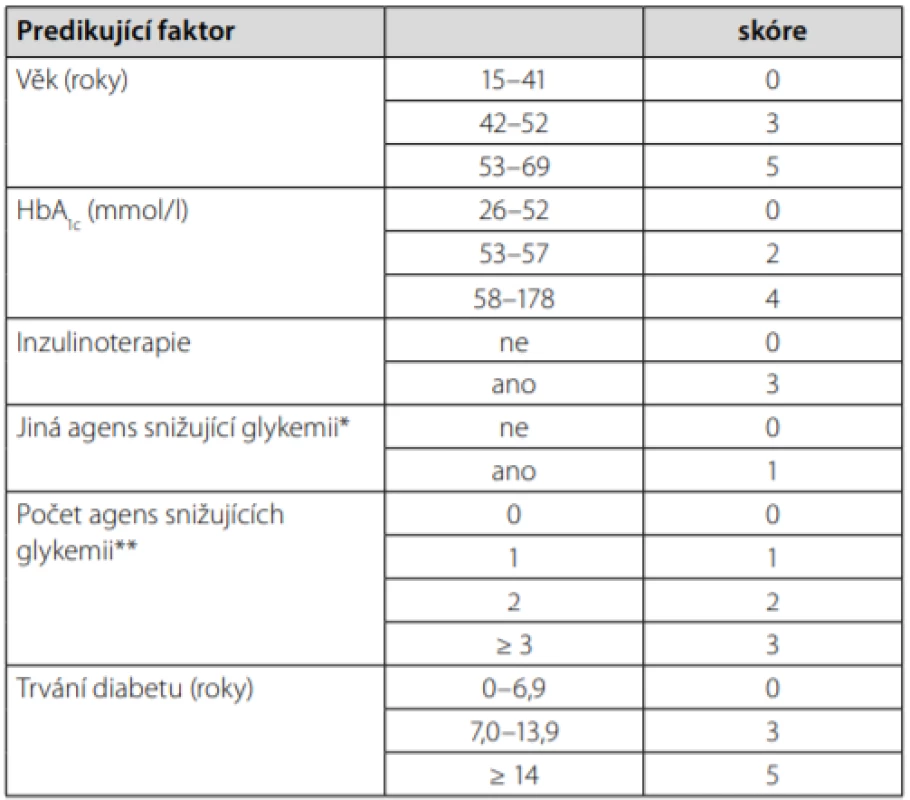
* deriváty sulfonylurey, glitazony
** metformin, deriváty SU, glitazony, inkretiny, inzulin a jinéVe studiích newcastelské pracovní skupiny, zabývající se vlivem velmi nízkokalorických diet (very low calorie diet – VLCD) na průběh diabetu, se podařilo náhle vytvořenou negativní energetickou bilancí dosáhnout u pacientů výrazných metabolických změn, vedoucích u některých z nich dokonce ke klinické remisi diabetu (33). Tato skupina responderů je ve studii definována přítomností lačné glykemie menší než 7 mmol/l, a to i po 6 měsících od ukončení VLCD. Respondeři se vstupně od nonresponderů lišili některými jasně sledovatelnými parametry. Závěry je potřeba brát s jistou rezervou – jedná se o malý soubor 30 pacientů, navíc s heterogenní terapií diabetu na vstupu, která není zohledněna. Každopádně jasně příznivým faktorem, napovídají ‑ cím o možné remisi diabetu při VLCD, je znovu délka trvání diabetu (v tomto případě menší než 4 roky), nižší glykovaný hemoglobin na vstupu, nižší glykemie nalačno, vyšší inzulinemie, ale též nižší hladina alaninaminotransferázy v séru. BMI bylo v obou skupinách v průměru stejné, respondeři se však od nonresponderů lišili nižším podílem tuku na celkové tělesné hmotnosti.
Závěr
Péče o chronicky dekompenzované diabetiky 2. typu je výzvou pro každého lékaře. Pomineme‑li pacienty, u nichž je dekompenzace způsobena pouze malcompliancí, je nutno se při snaze o lepší kompenzaci zaměřit na vhodnost dosud používané terapie u daného pacienta v kontextu patofyziologických mechanismů onemocnění (porucha sekrece, zvýšení inzulinorezistence). Existuje množství metod, jak u pacientů s chronicky dekompenzovaným diabetem zhodnotit inzulinovou rezistenci a sekreci, dvou hlavních patofyziologických mechanismů tohoto onemocnění, které se vzájemně ovlivňují. Všechny používané metody mají své výhody, ale i úskalí, žádná z nich sama o sobě nedokáže vyhodnotit komplexní propojení těchto dějů u daného pacienta, a tak s jednoznačností určit převažující poruchu a jasně ukázat na další směr terapie. Vytvořit všeobjímající algoritmus péče o chronicky dekompenzovaného diabetika tak zatím není možné, přístup musí být individuální. Laboratorní metody mohou pomoci s odhalením jasných odchylek, např. absence sekrece s nutností inzulinoterapie. Mnohé jsou však v praxi nevyužitelné, jiné jednorázově nepodávají dostatek informací. Největší možnosti nabízí zátěžové testy, jako orální glukózový toleranční test, případně z něj počítané indexy. U dlouhodobě dekompenzovaného diabetu je nutno se zaměřit na vliv v minulosti použité medikace nejen na glykemie, ale také na hmotnost, a tím potažmo na další zhoršování rezistence. Jistým vodítkem při té či které zvažované změně terapie mohou být výchozí parametry u pacienta, a to zejména délka trvání diabetu, glykovaný hemoglobin nebo používaná terapie, resp. celková denní dávka inzulinu. Správnost změny terapie u pacienta však i při dnešních možnostech nakonec ukáže až reakce na tuto změnu. A to nejen s vyhodnocením samotného glykovaného hemoglobinu, ale též s přihlédnutím na glykemické profily pacienta, vývoj jeho hmotnosti a obecné spokojenosti s léčbou.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Barbora Pavlíková,
Diabetologické centrum I. interní kliniky LF UK a FN,
Alej Svobody 80,
304 60 Plzeň
Cit. zkr: Vnitř Lék 2020; 66(1): 21–27
Článek přijat redakcí: 25. 3. 2019
Článek přijat k publikaci: 25. 8. 2019
Sources
1. Cersosimo E, Solis‑Herrera C, Trautmann P, et al. Assessment of Pancreatic β‑Cell Function: Review of Methods and Clinical Applications. Current Diabetes Reviews 2014; 10 : 2–42.
2. Butler AE, Janson J, Bonner‑Weir S et al. B‑Cell Deficit and Increased B‑Cell Apoptosis in Humans With Type 2 Diabetes. Diabetes 2003; 52 : 102–110.
3. Davies MJ, D’alessio DA, Fradkin J et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2018; 61 : 2461–2498.
4. Škrha J Biochemie a patofyziologie. Diabetologie. Praha: Galén 2009, 33–75.
5. Loopstra‑Masters RC, Haffner SM, Lorenzo C et al. Proinzulin‑to‑C-peptide ratio versus proinzulin‑to‑inzulin ratio in the prediction of incident diabetes: the Inzulin Resistance Atherosclerosis Study (IRAS). Diabetologia 2011; 54 : 3047–3054.
6. Jones AG, Hattersley AT. The clinical utility of C‑peptide measurement in the care of patients with diabetes. Diabetic Medicine 2013; 30 : 803–817.
7. Saisho Y. Postprandial C‑Peptide to Glucose Ratio as a Marker of β Cell Function: Implication for the Management of Type 2 Diabetes. International Journal of Molecular Sciences 2016; 17 : 214–223.
8. Leighton E, Sainsbury CAR, Jones GC. A Practical Review of C‑Peptide Testing in Diabe ‑ tes. Diabetes Therapy 2017; 8 : 475–487.
9. Takabe M, Matsuda T, Hirota Y et al. C‑peptide response to glucagon challenge is correlated with improvement of early insulin secretion by liraglutide treatment. Diabetes Research and Clinical Practice 2012; 98: e32–e35.
10. Covic AMC, Schelling JR, Constantiner M et al. Serum C‑peptide concentrations poorly phenotype type 2 diabetic end‑stage renal disease patients. Kidney International 2000; 58 : 1742–1750.
11. Defronzo RA, Tobin JD, Andres AR. Glucose clamp technique: a method for quantifying inzulin secretion and resistance. American Journal of Physiology‑Endocrinology and Metabolism 1979; 237 : 138–144.
12. Bergman RN, Ider YZ, Bowden CR et al. Quantitative estimation of insulin sensitivity. American Journal of Physiology‑Endocrinology and Metabolism 1979; 236: XXX–XXX.
13. Roden M Clinical diabetes research: methods and techniques. Chichester, West Sussex, England: John Wiley, 2007.
14. Cretti A, Lehtovirta M, Bonora E et al. Assessment of beta‑cell function during the oral glucose tolerance test by a minimal model of insulin secretion. European Journal of Clinical Investigation 2001; 31 : 405–416.
15. Hovorka R, Chassin L, Luzio SD et al. Pancreatic β‑Cell Responsiveness during Meal Tolerance Test: Model Assessment in Normal Subjects and Subjects with Newly Diagnosed Noninsulin‑Dependent Diabetes Mellitus 1. The Journal of Clinical Endocrinology & Me ‑ tabolism 1998; 83 : 744–750.
16. Ahren B, Pratley R, Soubt M et al. Clinical Measures of Islet Function: Usefulness to Characterize Defects in Diabetes. Current Diabetes Reviews 2008; 4 : 129–145.
17. Matthews DR, Hosker JP, Rudenski AS et al. Homeostasis model assessment: inzulin re ‑ sistance and beta‑cell function from fasting plasma glucose and inzulin concentrations in man. Diabetologia 1985; 28 : 412–419.
18. Wallace TM, Levy JC, Matthews DR. Use and Abuse of HOMA Modeling. Diabetes Care 2004; 27 : 1487–1495.
19. Levy JC, Matthews DR, Hermans MP. Correct Homeostasis Model Assessment (HOMA) Evaluation Uses the Computer Program. Diabetes Care 1998; 21 : 2191–2192.
20. Katz A, Nambi SS, Mather K, et al. Quantitative Insulin Sensitivity Check Index: A Simple, Accurate Method for Assessing Insulin Sensitivity In Humans. The Journal of Clinical Endocrinology & Metabolism 2000; 85 : 2402–2410.
21. Chen H, Sullivan G, Quon MJ. Assessing the Predictive Accuracy of QUICKI as a Surrogate Index for Insulin Sensitivity Using a Calibration Model. Diabetes 2005; 54 : 1914–1925.
22. Matsuda M, Defronzo RA. Insulin sensitivity indices obtained from oral glucose tolerance testing: comparison with the euglycemic insulin clamp. Diabetes Care 1999; 22 : 1462–1470.
23. Lorenzo C, Haffner SM, Stančáková A et al. Fasting and OGTT‑derived Measures of Insulin Resistance as Compared With the Euglycemic‑Hyperinsulinemic Clamp in Nondiabetic Finnish Offspring of Type 2 Diabetic Individuals. The Journal of Clinical Endocrinology & Metabolism 2015; 100 : 544–550.
24. Xiang AH, Watanabe RM, Buchanan TA. HOMA and Matsuda indices of insulin sensitivity: poor correlation with minimal model‑based estimates of insulin sensitivity in longitudinal settings. Diabetologia 2014; 57 : 334–338.
25. Pacini G, Mari A. Methods for clinical assessment of insulin sensitivity and β‑cell function. Best Practice & Research Clinical Endocrinology & Metabolism 2003; 17 : 305–322.
26. Bruinstroop E, Meyer L, Brouwer CB et al. Retrospective Analysis of an Insulin‑to‑Liraglutide Switch in Patients with Type 2 Diabetes Mellitus. Diabetes Therapy 2018; 9 : 1369–1375.
27. Kawata T, Kanamori A, Kubota A et al. Is a Switch From Insulin Therapy to Liraglutide Possible in Japanese Type 2 Diabetes Mellitus Patients? Journal of Clinical Medicine Research 2014; E744.
28. Iwao T, Sakai K, Sata M. Postprandial serum C‑peptide is a useful parameter in the prediction of successful switching to liraglutide monotherapy from complex insulin therapy in Japanese patients with type 2 diabetes. Journal of Diabetes and its Complications 2013; 27 : 87–91.
29. Davis SN, Johns D, Maggs D et al. Exploring the Substitution of Exenatide for Insulin in Patients With Type 2 Diabetes Treated With Insulin in Combination With Oral Antidiabetes Agents. Diabetes Care 2007; 30 : 2767–2772.
30. Araki H, Tanaka Y, Yoshida S et al. Oral glucose‑stimulated serum C‑peptide predicts successful switching from insulin therapy to liraglutide monotherapy in Japanese patients with type 2 diabetes and renal impairment. Journal of Diabetes Investigation 2014; 5 : 435–441.
31. Aron‑Wisnewsky J, Sokolovska N, Liu Y et al. The advanced‑DiaRem score impro ‑ ves prediction of diabetes remission 1 year post‑Roux‑en‑Y gastric bypass. Diabetologia 2017; 60 : 1892–1902.
32. Dicker D, Golan R, Aron‑Wisnewsky J et al. Prediction of Long‑Term Diabetes Remissi ‑ on After RYGB, Sleeve Gastrectomy, and Adjustable Gastric Banding Using DiaRem and Advanced‑DiaRem Scores. Obesity Surgery 2019; 29 : 796–804.
33. Steven S, Hollingsworth Kg, Al‑Mrabeh A et al. Very Low‑Calorie Diet and 6 Months of Weight Stability in Type 2 Diabetes: Pathophysiological Changes in Responders and Nonresponders. Diabetes Care 2016; 39 : 808–815.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 1-
All articles in this issue
- Ve spojení a jednotě je síla
- Hlavní téma: Metabolický syndrom
- Léčba hypertenze u metabolického syndromu – update 2019
- Aterogenní dyslipidemie typické pro metabolický syndrom
- Diabetes mellitus 2. typu v praxi – balancování mezi rezistencí a sekrecí
- Hepatotoxicita indukovaná bodybuilding suplementami
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Sarkopenická obezita – aktuální přehled problematiky
- Autoimunitní hepatitida
- Dvacet let cesty nefrologa do hlubin toxicity fosforu
- Monitorovanie a individualizácia liečby inhibítormi P2Y12 ADP receptorov
- Infarkt myokardu u pacienta s metabolickým syndromem a prokázaným syndromem obstrukční spánkové apnoe
- Úskalí v diagnostice srdeční amyloidózy a možnosti terapie
- Bolesti a deformace dolní čelisti – projev fibrózní dysplazie čelisti
- K čemu lze využít výsledek vyšetření koncentrace celkového cholesterolu?
- Několik poznámek ze čtení posledních doporučených postupů pro léčbu DLP verze 2019
- Založení profesního spolku SAI – sdružení ambulantních internistů, z. s.
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Prevalence a rizikové faktory T buňkami zprostředkované rejekce u pacientů po transplantaci jater od zemřelého dárce – retrospektivní studie v desetiletém období
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sarkopenická obezita – aktuální přehled problematiky
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Autoimunitní hepatitida
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

