-
Medical journals
- Career
Bolesti a deformace dolní čelisti – projev fibrózní dysplazie čelisti
Authors: Tomáš Křiva 1; Zdeněk Adam 2; Marek Brumla 3; Ctirad Macháček 3; Tomáš Nebeský 4; Zdeněk Řehák 5; Luděk Pour 2; Renata Koukalová 5; Marta Krejčí 2; Zdeněk Král 2
Authors‘ workplace: Klinika ústní, čelistní a obličejové chirurgie LF MU a FN Brno, pracoviště Bohunice 1; Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice 2; Radiodiagnostická oddělení nemocnice Třebíč 3; Ústav patologie LF MU a FN Brno, pracoviště Bohunice 4; Radiodiagnostická klinika LF MU a FN Brno, pracoviště Bohunice 5; Oddělení PET CT a RECAMO Masarykova onkologického ústavu Brno 6
Published in: Vnitř Lék 2020; 66(1): 78-86
Category: Case Report
Overview
Popisujeme případ fibrózní dysplazie mandibuly. Onemocnění začalo bolestí zubů a otokem čelisti a přilehlé části krku. Panoramatický snímek čelisti a CT zobrazení čelisti prokázaly deformitu mandibuly, která mohla souviset jak s osteomyelitidou, tak s nádorovým procesem. Histologické vyšetření materiálu odebraného z mandibuly a histologické vyšetření regionálních mízních uzlin prokázalo fibrózní dysplazii mandibuly a zánětlivé změny v regionálních uzlinách. FDG-PET/CT zobrazení prokázalo, že jde o jednoložiskovou formu onemocnění. Po zvážení všech publikovaných informací o přínosu léků ze skupiny bisfosfonátů jsme se rozhodli pro léčbu ibandronatem v perorální formě s cílem snížit intenzitu bolestí v oblasti čelisti. V případně nedostatečného snížení bolestí při použití perorální formy budeme testovat vliv nitrožilně podávaných bisfosfonátů na intenzitu bolesti ve standardních dávkách, jaké používáme u pacientů s maligní formou osteolýzy. Pacient je dlouhodobě dispenzarizován na Klinice ústní, čelistní a obličejové chirurgie LF MU a FN Brno, pracoviště Bohunice, protože je zde riziko jak progrese nemoci, tak i transformace nemoci v sarkom. Riziko maligní transformace je ale menší než 1% ročně.
Klíčová slova:
fibrózní dysplazie – ibandronat – mandibula
Úvod
Fibrózní kostní dysplazie je choroba, při níž je kostní tkáň nahrazována vazivovou tkání, v které zůstávají neorganizované kostní ostrůvky. Způsobuje deformitu kosti. Biologicky se tato choroba chová benigně, jen zcela výjimečně může dojít k transformaci v sarkom. Nejčastěji se vyskytuje v oblasti obličejového skeletu. Podezření na tuto nemoc možno vyslovit při zjevné pomalu vznikající deformaci obličeje nebo jiné kosti a typickém nálezu na CT zobrazení postiženého skeletu. Diagnózu je třeba stanovit histologicky.
Popis pacienta
Potíže nemocného se datují asi od léta roku 2017, kdy mu začaly bolesti v levé části dolní čelisti s patrným otokem i v přilehlé části krku. To jej přivedlo k zubními lékaři. Ten vyslovil podezření, že příčinou jsou zuby dolní čelisti 35, proto byla provedena trepanace zubu 35, ale bez odeznění potíží a úlevy od bolesti. Pacient byl proto odeslán na Kliniku ústní, čelistí a obličejové chirurgie (KÚČOCH) Brno, pracoviště Bohunice s podezřením na osteomyelitidu dolní čelisti. Bylo provedeno CT zobrazení a na základě něho byla započata léčba chronického zánětu typu osteomyelitidy. Vzhledem k přetrvávajícím potížím byly extrahovány zuby 35 a 37. Protože bolesti trvaly i po extrakci, byl posléze znovu odeslán na KÚČOCH FN Brno, pracoviště Bohunice.
Pro přetrvávající potíže a otok i po extrakci zubů 35 a 37 bylo rozhodnuto provést revizi dolní čelisti s dekortikací a odběrem vzorku kosti na histologické a bakteriologické vyšetření. Během operačního výkonu nebylo jasné, zda se jedná o osteomyelitidu, nebo nádorový proces. Bakteriologicky byl nalezen Streptococcus α-haemolyticus. Patolog dostal k hodnocení 3 regionální lymfatické uzliny, v nichž popsal reaktivní lymfadenopatii. Dále patologovi byla zaslána změněná kostní tkáň, odebraná z mandibuly. V ní byla diagnostikována fibrózní dysplazie kosti (Obr. 1).
Image 1. Na přiloženém snímku histologického preparátu jsou v levé části (asi 2/3 snímku) patologické změny diagnostické pro fibrózní dysplazii, v pravé části je pro srovnání nepostižená kost, které s ložiskem sousedí 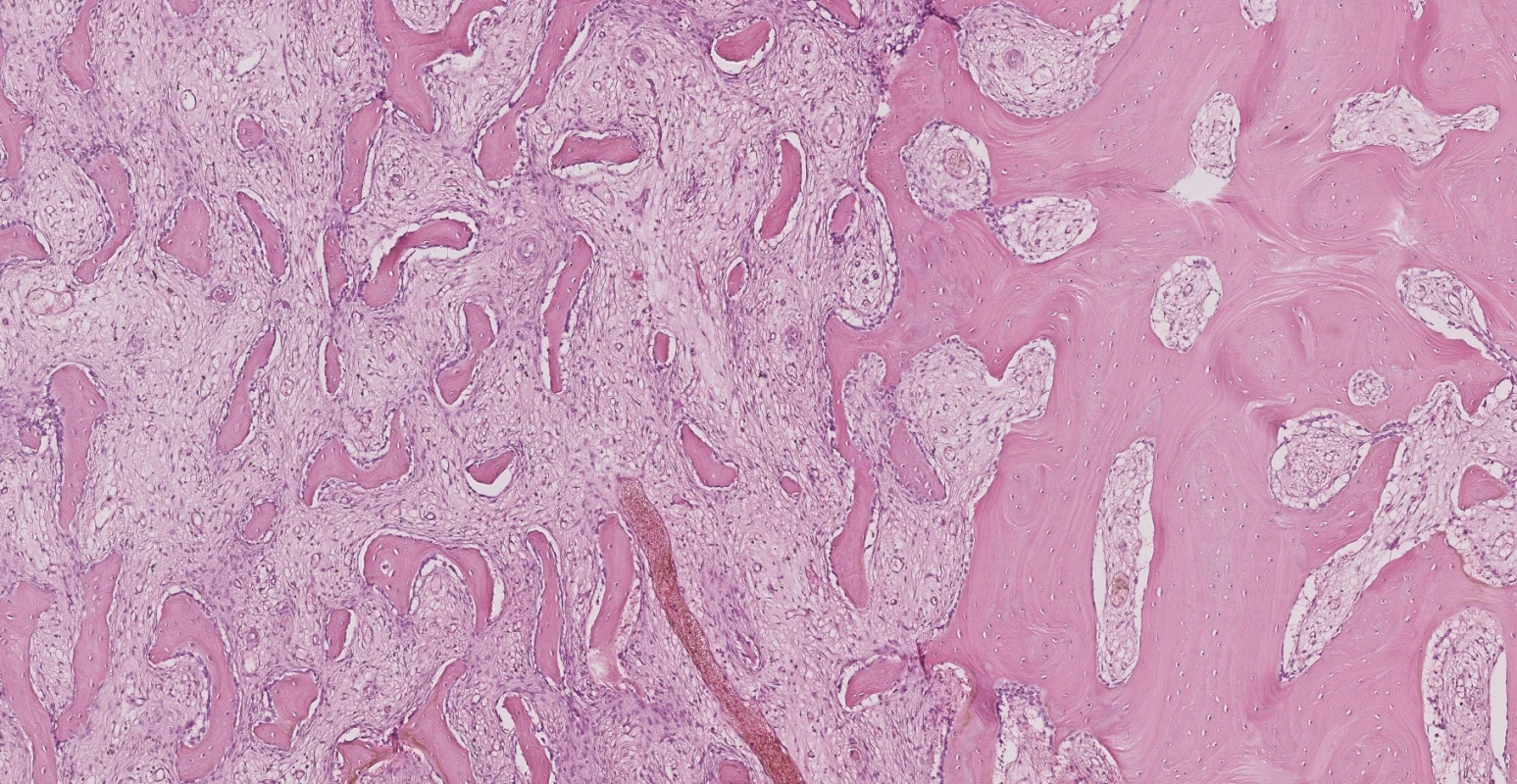
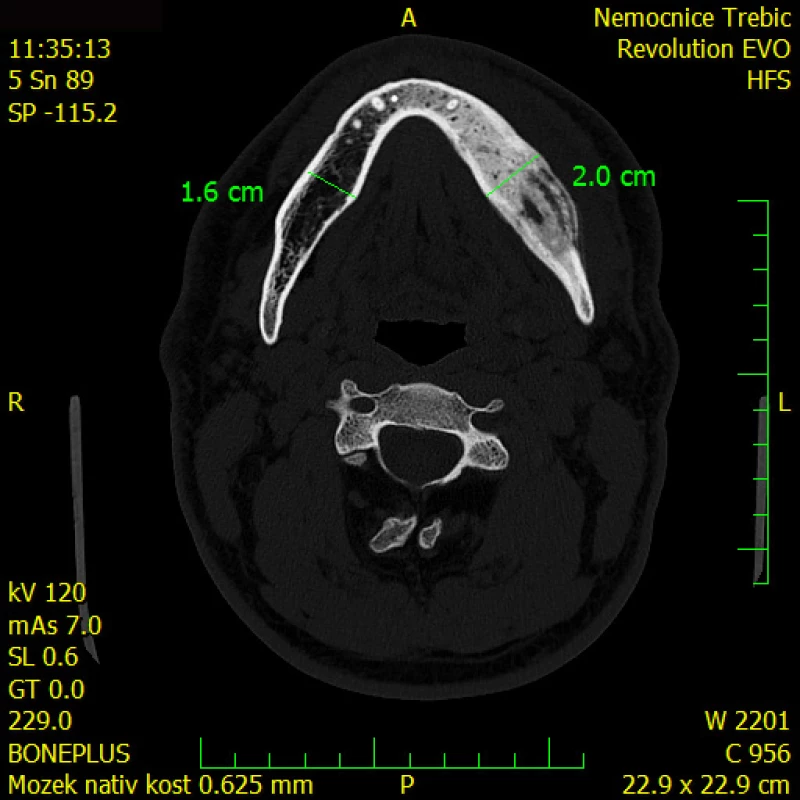
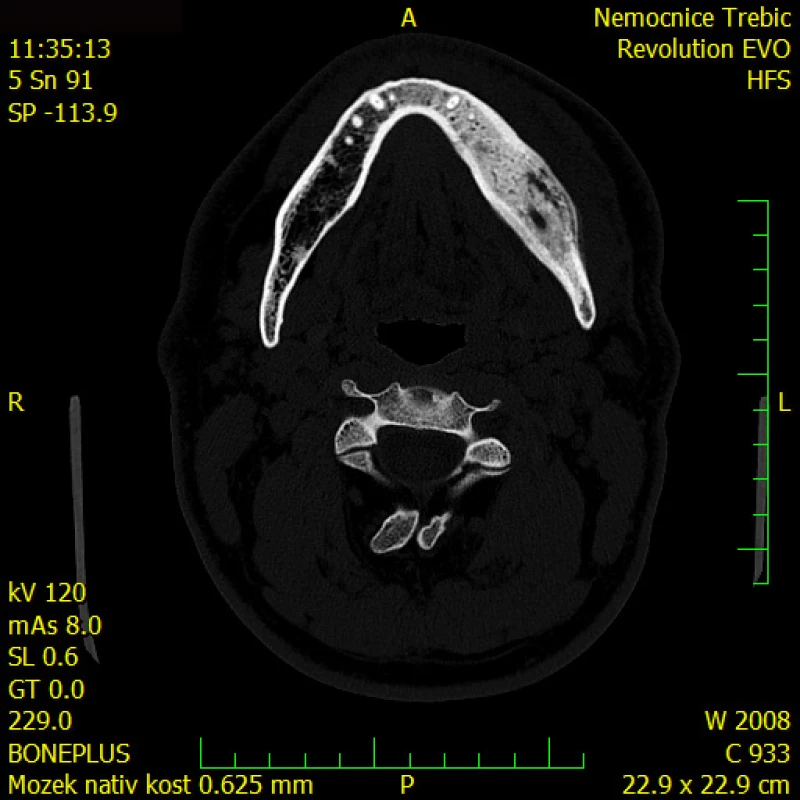
Panoramatický snímek čelisti a CT zobrazení čelisti jsou na Obr. 2 a 3.
Image 2. Panoramatický snímek čelisti (OPG): levá část těla mandibuly vykazuje lehké známky expanze s nehomogenním zahuštěním struktury (mléčný vzhled bez periostální reakce) 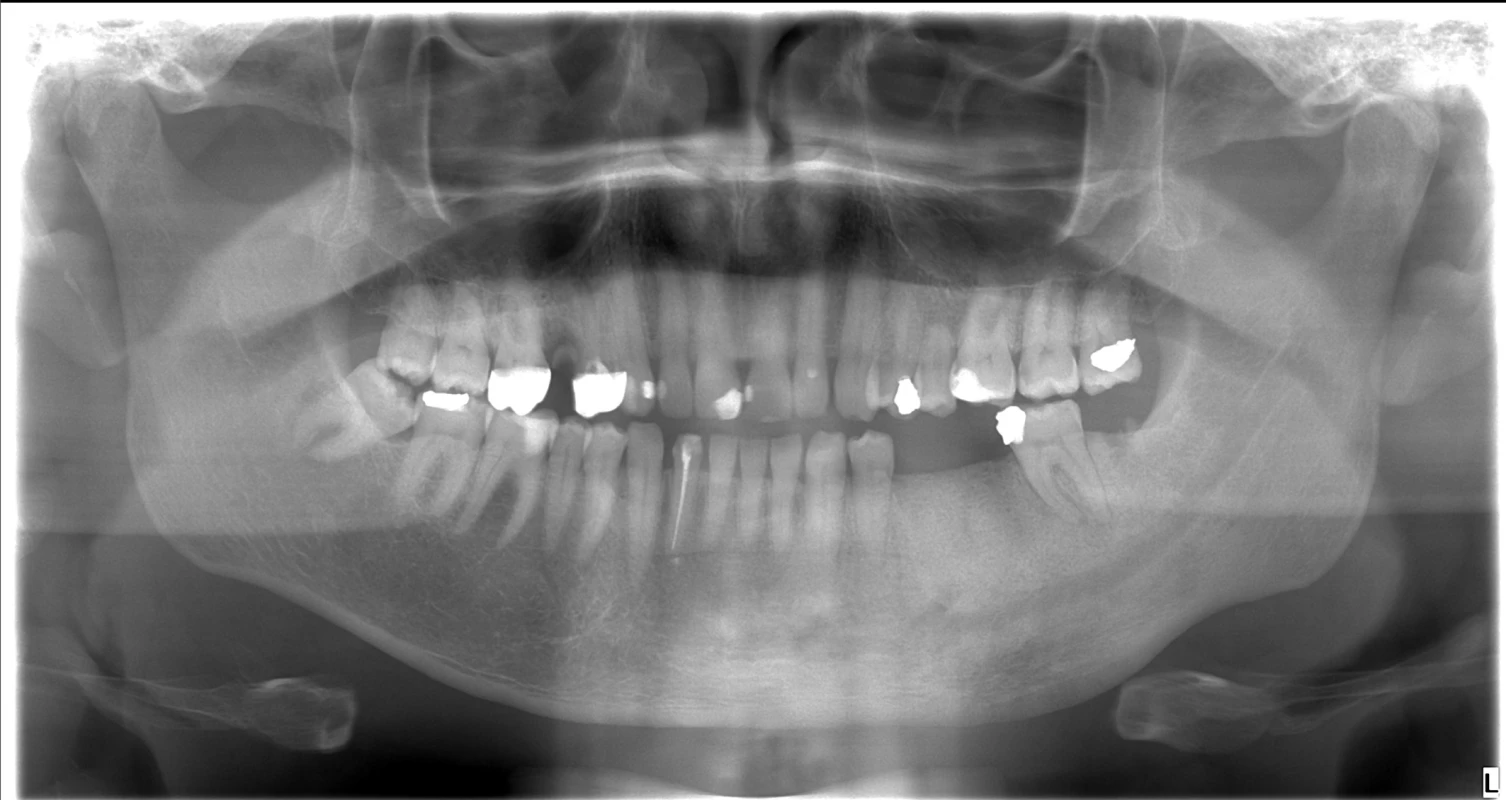
Image 3. CT zobrazení čelisti pro srovnání, jak je proces vidět na OPG a jak na CT zobrazení. Levá část především těla mandibuly vykazuje známky expanze a smíšený osteoskleroticko-lytický proces především v kostní dřeni, patrné je zesílení kortikalis bez periostální reakce. K expanzi těla mandibuly došlo vlevo v premolárním- molárním regionu se známkami sklerózy, intrakortikální osteolýzy, tvorbou nepravidelných sklerotických lemů. Nápadné je rozšíření kanálu n. alveolaris inferior včetně větvení pro n. incisivus 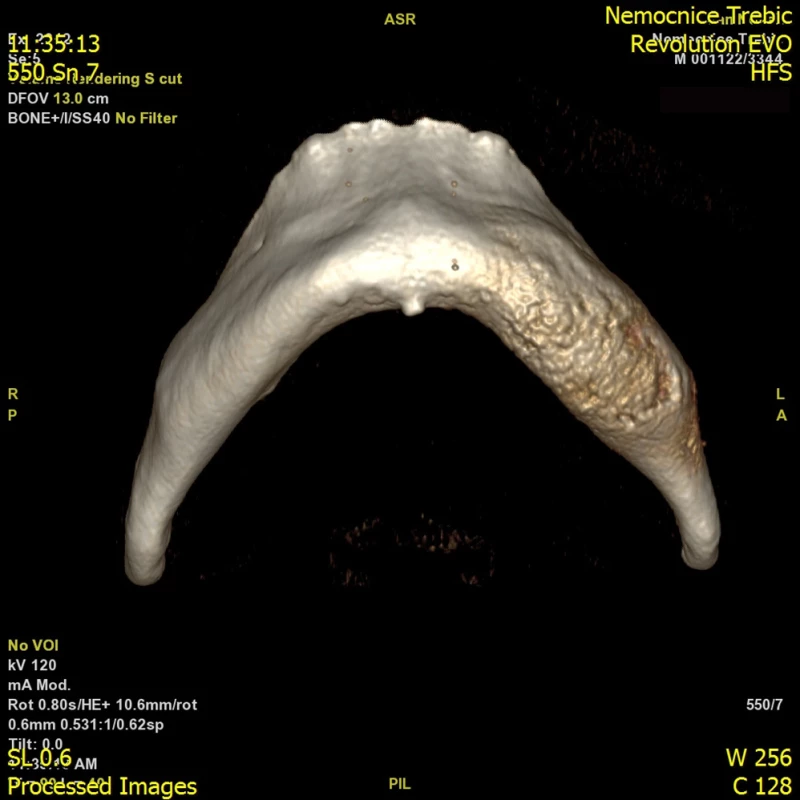
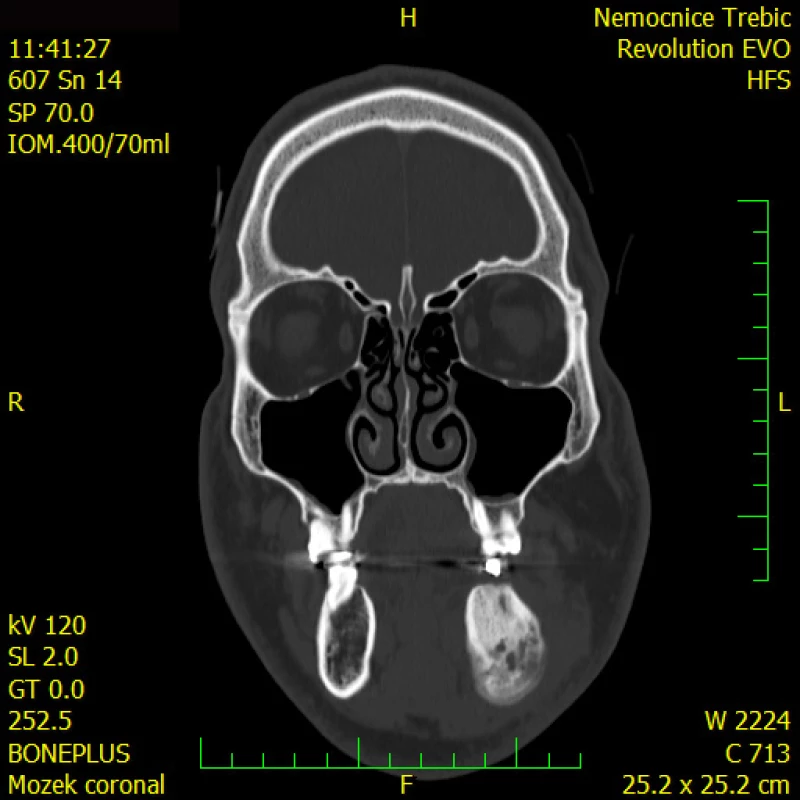
Po operaci se pacient zhojil a byl odeslán na myelomovou ambulanci Interní hematologické a onkologické kliniky LF MU a FN Brno, pracoviště Bohunice, k dalšímu došetření. Pro zodpovězení otázky, zda se jedná o monoostotickou formu či polyostotickou formu, bylo provedeno PET/CT celotělové vyšetření s radiofarmakem fluorodeoxyglukózou (FDG), výsledek je na Obr. 4–6.
Další ložiska nebyla nalezena, vysoká akumulace FDG byla pouze v oblasti mandibuly. A tak jsme pacientovi nabídli nitrožilní léčbu bisfosfonáty (ibandronat nebo zoledronat), ale pacient preferoval tabletovou formu, a tak jsme mu předepsali ibandronat v tabletové formě (Bondronat), který dobře toleruje. Po zahájení léčby uvedl zmenšení bolesti. Ale teprve delší sledování ukáže, zda uvedené pozitivní subjektivní hodnocení byl placebo efekt, nebo skutečný trvalý efekt léčby Bondronatem.
Diskuze
Fibrózní dysplazie je nemaligní proliferace, v rámci níž je normální kost nahrazována fibrózní tkání, a neuspořádanou kostní strukturou. Ložiska fibrózní dysplazie se skládají z různě buněčného kolagenního vaziva, ve kterém jsou rozloženy nepravidelné trámečky nelamelární pletivové kosti. Některé trámce kosti mívají tvar písmene O nebo C. Na povrchu některých trámců bývají většinou jen v malém množství přítomny osteoblasty, někdy s příměsí osteoklastů. Vazivová složka může být silněji buněčná, zejména u mladších individuí, někdy s naznačenou uzlovitou či rohožkovitou úpravou. U některých jedinců může být myxoidně prosáklá (1, 2).
Postižena může být jen jedna kost, nebo více kostí. Příčinou je somatická mutace podjednotky α stimulačního proteinu G, který je kódován genem GNASGNAS (2–4). Fenotyp této choroby je variabilní a může být izolován na jedno ložisko v kosti (monoostotická forma) nebo na více ložisek v kosti (polyostotická forma) nebo může být asociována s kožními a endokrinologickými projevy jako tzv. McCuneAlbright syndrom (3). Proto pokud tato nemoc postihuje dospívající, je žádoucí zaměřit se na možné endokrinologické poruchy, na funkci štítné žlázy a abnormality hypofyzárních hormonů a taktéž na možné poruchy reabsorpce fosfátů.
Monoostotická forma fibrózní dysplazie je nejčastější forma manifestace této nemoci, je asi 4krát častější než polyostotická forma. Nejčastější lokalizací je kraniofaciální oblast, dále pak proximální femur a žebra (4, 5). V rámci monoostotické formy je ponejvíce postižena oblast obličejového skeletu včetně čelistí. Méně častá polyostotická forma často postihuje také kraniofaciální oblast a přední část lební báze.
U našeho pacienta byla postižena pouze mandibula, zobrazení celého skeletu pomocí PET/CT zobrazení s radiofarmakem fluorodeoxyglukózy (FDG) neprokázalo žádné další ložisko.
Choroba se projevuje deformitami a asymetrií tváře. Deformity mohou způsobit poruchy zraku, poruchy sluchu, pocity ucpaného nosu a také bolesti či parestezie v postižené oblasti. Někteří nemocní jsou dlouho bez symptomů a ke stanovení diagnózy dojde, když potkají někoho, s kým se delší dobu neviděli, a tato osoba si všimne a upozorní je na vzniklou asymetrii obličeje, kterou nezpozorují lidé, s nimiž se vidí denně. A někdy se na diagnózu přijde zcela náhodně při RTG či CT zobrazení kalvy z jiného důvodu. Fibrózní dysplazie se projevuje jako pomalu, indolentně rostoucí ložisko, které však může způsobit závažné komplikace, narušením průběhu optického nervu, očnice, výstupu lícního nervu, či uvolňováním a bolestí zubů, jak to bylo v popsaném případě.
U dětí v pubertě či u adolescentů se popisuje agresivnější chování a rychlejší růst (5–12).
Nemoc je v České i Slovenské republice vzácná. Její incidence nebo prevalence není stanovena. Ale o výjimečnosti této diagnózy svědčí to, že všechna publikovaná sdělení ze Slovenska a Čech popisují jeden a zcela výjimečně více případů (13–36). Pacienty s fibrózní dysplazií je třeba systematicky sledovat, protože přece jenom je zde malé, ale nepřehlédnutelné riziko maligní transformace, která je popisována v méně než 1% případů. Fibrózní dysplazie se může transformovat do osteosarkomu, fibrosarkomu, chondrosarkomu a do maligního fibrohistiocytomu. Rozlišení low-grade osteosarkomu od fibrózní dysplazie je obzvláště obtížné. Taktéž na diferenciální diagnózu osteomyelitidy je nutno myslet.
Pro potvrzení diagnózy je pak zásadní biopsie. Histologické hodnocení však neinformuje o biologickém chování této malformace. Uvádí se, že ložiska fibrózní dysplazie jsou bohatě prokrvena a mohou snadno krvácet. V případech, kdy histologická biopsie není proveditelná, a jsou typické zobrazovací nálezy, lze diagnózu stanovit na podkladě typického zobrazovacího nálezu.
Léčba je dominantně operační. A protože se operuje v obličejové části, každý zákrok má své negativní dopady. Proto se doporučuje sledovat vývoj ložiska a operovat jen tehdy, když je to nezbytné. Medikamentózní léčba je omezena na vhodná analgetika. Uvádí se, že podávání bisfosfonátů, alendronatu, pamidronatu či zoledronatu, redukuje bolesti a redukuje také rychlost progrese. Nicméně klinické studie, které popisují efekt bisfosfonátů, nemají zcela jednotné výsledky. Plotkin (43) hodnotil léčbu pamidronatem u 18 dětí a adolescentů. Popsal snížení bolesti, snížení aktivity alkalické fosfatázy v séru a snížení koncentrace N-telopeptidu v moči. Ale radiograficky ke zlepšení nedošlo. Matarazzo (44) popsal 13 pacientů léčených pamidronatem po dobu 2–6 let, a popsal snížení intenzity bolestí, snížení markerů osteolýzy a zvýšení kostní denzity při vyšetření metodou DEXA. Chan (45) popsal léčbu 3 dětí léčbu pamidronatem po probíhající po dobu 2,5–5 let. Popsal snížení bolestí v dlouhých kostech a snížení počtu fraktur, ale nezastavila se progrese ložisek v dlouhých kostech (45). Chao (46) uvádí, že při perorální léčbě alendronatem se snížila v průběhu prvních 6 měsíců intenzita bolestí hlavy a byly sníženy dávky analgetik. Zmiňuje také, že v průběhu krátkého sledování nepozorovali k progresi. K podobným závěrům, že „bisfosfonáty snižují intenzitu bolesti, i když na biologický průběh nemoci nemají zásadní vliv,“ dospěli také autoři dalších publikací (47–53). O efektu denosumabu u této diagnózy toho víme méně. Léčbu fibrózní dysplazie hodnotí pouze 2 publikace, s pozitivními závěry (54, 55).
Medicína založená na důkazech však vyžaduje prokázání účinku v randomizovaných klinických studiích. U pacientů s fibrózní dysplazií byla provedena pouze jedna, v níž byl testován alendronat v různých dávkách. Autoři konstatovali, že perorálně podávaný alendronat netlumil dostatečně kostní bolesti způsobené fibrózní dysplazií. Alendronat sice zvýšil kostní denzitu ložisek fibrózní dysplazie, ale neovlivnil nijak zásadně jejich radiografický obraz a obraz na kostním skenu. Svoji studii uzavírají slovy, že tablety alendronatu nejsou indikované u pacientů s fibrózní dysplazií a že by bylo vhodné v rámci randomizované klinické studie ověřit účinek nitrožilně podávaných bisfosfonátů nebo denosumabu (56).
V současnosti se doporučuje otestovat podávání bisfosfonátů u pacientů s bolestivou formou kostní dysplazie (57, 58), a pokud bisfosfonát snižuje intenzitu bolesti, tak v něm dlouhodobě pokračovat. Zásadní však je přesné histologické klasifikování (59).
V našem případě jsme podali pacientovi Bondronat tablety, a pokud by prvotní pozitivní vliv na bolestivost vymizel, tak bude léčen nitrožilními preparáty ibandrontu (Bondronat) nebo zoledronatu (Zometa).
Image 7. FDG-PET/CT zobrazení dolní čelisti. Patologický proces v dolní čelisti akumuluje FDG (a podobně i jiná radiofarmaka vcelku) ochotně. Dle FDG-PET/CT však nelze rozlišit fibrózní dysplazii od jiných kostních (nádorových) patologií. V tomto případně bylo prokázáno jen toto jediné izolované kostní ložisko v mandibule 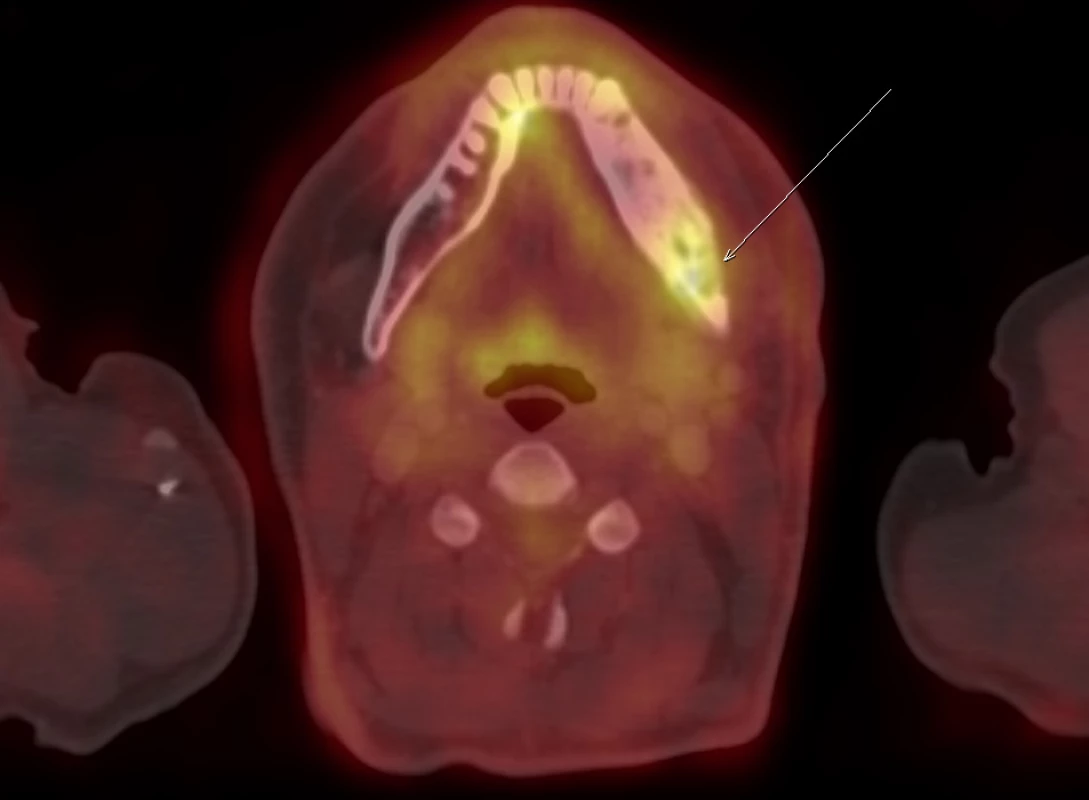
Image 8. FDG-PET/CT trupu, bez průkazu další patologické akumulace FDG a tedy bez průkazu dalšího ložiska fibrózní dysplazie 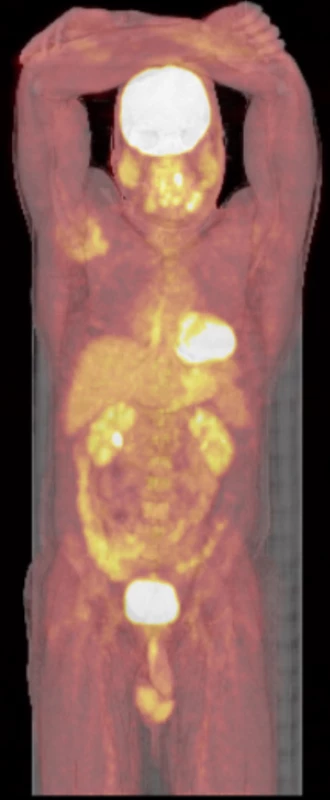
Závěr pro praxi
- Při dlouhodobé bolesti v oblasti obličeje je nutno myslet na fibrózní dysplazii a provést odpovídající vyšetření.
- Fibrózní dysplazie je indolentní proces, operační výkony se provádějí, jen když jsou nezbytné.
- Medikamentózní léčba bisfosfonáty měla v nerandomizovaných studiích analgetický efekt. Existuje jediná randomizovaná studie s alendronatem, a ta analgetický efekt alendronatu nepotvrdila.
KORESPONDENČNÍ ADRESA AUTORA:doc. MUDr. Luděk Pour, Ph.D.,Interní hematologická a onkologická klinika LF MU a FN Brno,pracoviště BohuniceJihlavská 2,625 00 BrnoCit. zkr: Vnitř Lék 2020; 66(E-1): e41–e49Článek přijat redakcí: 10. 10. 2018Článek přijat k publikaci: 19. 11. 2018
Sources
1. Riminucci M, Fisher LW, Shenker A, et al. Fibrous dysplasia of bone in the McCune-Albright syndrome: abnormalities in bone formation. The Amer J Pathol 1997; 151 : 1587–1600.
2. Riminucci M, Liu B, Corsi A, et al. The histopathology of fibrous dysplasia of bone in patients with activating mutations of the Gs alpha gene: site-specific patterns and recurrent histological hallmarks. J Pathol 1999; 187 : 249–258.
3. Albright FBA, Hampton AO, Smith P. Syndrome characterized by osteitis fibrosa disseminata, areas of pigmentation and endocrine dysfunction, with precocious puberty in females: report of five cases. N Engl J Med 1937; 216 : 727–746.
4. Parekh SG, Donthineni-Rao R, Ricchetti E, et al. Fibrous dysplasia. The Journal of the American Academy of Orthopaedic Surgeons 2004; 12 : 305–313.
5. Ricalde P, Horswell BB. Craniofacial fibrous dysplasia of the fronto-orbital region: a case series and literature review. J Oral Maxillofac Surg 2001; 59 : 157–167.
6. Wei WJ, Sun ZK, Shen CT, et al. Value of (99m)Tc-MDP SPECT/CT and (18)F-FDG PET/CT scanning in the evaluation of malignantly transformed fibrous dysplasia. Am J Nucl Med Mol Imaging 2017; 7 : 92–104.
7. Sasikumar A, Joy A, Pillai MRA, et al. 68Ga-PSMA PET/CT in Osteosarcoma in Fibrous Dysplasia. Clin Nucl Med 2017; 42 : 446–447.
8. Pack SE, Al Share AA, Quereshy FA, et al. Osteosarcoma of the Mandible Arising in Fibrous Dysplasia – A Case Report. J Oral Maxillofac Surg 2016; 74 : 2229.e1–2229.e4.
9. Qu N, Yao W, Cui X, et al. Malignant transformation in monostotic fibrous dysplasia: clinical features, imaging features, outcomes in 10 patients, and review. Medicine (Baltimore) 2015; 94: e 369.
10. Mardekian SK, Tuluc M. Malignant sarcomatous transformation of fibrous dysplasia. Head Neck Pathol 2015; 9 : 100-103.
11. Garg MK, Bhardwaj R, Gupta S, et al. Sarcomatous transformation (Leiomyosarcoma) in polyostotic fibrous dysplagia. Indian J Endocrinol Metab 2013; 17 : 1120–1123.
12. Cheng J, Yu H, Wang D, et al. Spontaneous malignant transformation in craniomaxillofacial fibrous dysplasia. J Craniofac Surg 2013; 24 : 141–145.
13. Yao Y, Liu Y, Wang L, et al. Clinical characteristics and management of growth hormone excess in patients with McCune-Albright syndrome. Eur J Endocrinol 2017; 176 : 295–303.
14. Xu J, Li X, Lv CS, et al. Treatment protocols for growth hormone-secreting pituitary adenomas combined with craniofacial fibrous dysplasia: A case report of atypical McCune-Albright syndrome. Exp Ther Med 2014; 8 : 877–880.
15. Madsen H, Borges MT, Kerr JM, et al. McCune-Albright syndrome: surgical and therapeutic challenges in GH-secreting pituitary adenomas. J Neurooncol 2011; 104 : 215–224.
16. Řehák Z, Bencsikova B, Zambo I, et al. Fibrous dysplasia presenting as a cold spod in 18FFLT PET/CT Imaging Clinical nuclear med 2016; 41 : 5100–5111.
17. Kačerovská D, Němcová J, Pomahačová R, et al. Cutanous and superficial soft tissue lesions associated with Albright hereditary osteodystrophy. Study of 4 cases inscuding novel mutation of GNAS gene. Amer J Dermatopathology 2008; 30 : 417–424.
18. Kurinec F, Rudinský B Marinčák L. Chirurgická liečba rozsiahled fibróznes dysplaie v kraniofaicální oblasti. Česká a slovesnká neurologie a neurochir 2016; 79 : 723–727.
19. Pečený, J, Šťastný E, Wagenknecht L, et al. Fibrózní dysplazie – patofyziologie a ortopedická léčba. Pediatrie pro praxi 2018; 19 : 72–78.
20. Hodan R, Čermákoává R, Syrovátka J, et al. Fibrózní dysplazie u dětského pacienta léčená bisfosfonáty. Česká stomatologie a Praktické zubní lékařství 2008; 56 : 48–52.
21. Černá H, Machač J, Šlapák I. Fibrózní dysplázie a cholesteatom. Otorinolaryngologie a foniatrie 2008; 57 : 102–104.
22. Zídková H, Kolář J, Matějovský Z. Malignizace, či agresivní růst fibrózní kostní dysplazie? Československá radiologie 1993; 47 : 139–149.
23. Chrobok V, Brtková J. Fibrózní dysplazie spánkové kosti (kazuistika). Choroby hlavy a krku 1998; 7 : 18–21.
24. Mihál V, Michálková K, Ehrmann J, et al. Fibrózní dysplazie lebky. Pediatrie pro praxi 2013; 14 : 58–59.
25. Doležal J. Neobvyklá akumulace 67Galium-citrátu ve fibrózní dysplazii kosti temporální u pacientky s maligním melanomem. Česká radiologie 2010; 64 : 266–268.
26. Hrabal P, Kaltofen K, Kostyšyn R, et al. Fibrózní dysplazie žeber a páteře: multioborové řešení – kazuistika. Česká a slovenská neurologie a neurochirurgie 2010; 73 : 734–737.
27. Žižiková K. Osteofibrózní dysplazie Campanacci. Československá radiologie 1993; 47 : 22–23.
28. Matenalli H, Meisner J. Výskyt fibrózní dysplazie. Československá pediatrie 1994; 49 : 441–442.
29. Koudelová, J, Koudela K, Kunešová M, et al. Metafyzární fibrózní defekt. Acta chirurgiae orthopaedicae et traumatologiae Čechoslovaca 2005; 72 : 355–362.
30. Heuer L, Hrušák D, Andrle P, et al. Benigní fibrooseální léze čelistních kostí. StomaTeam (Praha) 2011; 11 : 19–25.
31. Povýšil C, Matějovský Z, Horák M. Klasický adamantinom, diferencovaný adamantinom a osteofibrózní dysplazie dlouhých kostí. Časopis lékařů českých 2004; 143 : 329–335.
32. Mazánek J, Povýšil C, Dobrová M. Neobvyklé klinické obrazy fibrózní dysplazie. Česká stomatologie a Praktické zubní lékařství 1998; 46 : 48–62.
33. Širůček P, Hodan R, Havel M. Neobvyklá příčina zduření mandibuly. První linie 2012; 2 : 8–9.
34. Statelová D, Sitár J, Stiffel W. Fibrózna dysplázia maxilofaciálneho skeletu. Stomatológ (Martin) 1999; 9 : 15–17.
35. Poruban D, Chynoranský M, Kurill E. Fronto-orbito-zygomatiko-maxilárna fibrózna dysplázia - Kazuistika. Stomatológ (Martin) 1999; 9 : 37–39.
36. Zídková H, Kolář J, Matějovský Z. Aggressive features of pelvic fibrous dysplasia. RöFo. Fortschritte auf dem Gebiete der Röntgenstrahlen und der neuen bildgebenden Verfahren 1994; 161 : 183–185.
37. Ebata K, Usami T, Tohnai I, et al. Chondrosarcoma and osteosarcoma arising in polyostotic fibrous dysplasia. J Oral Maxillofac Surg 1992; 50 : 761–764.
38. Kaushik S, Smoker WR, Frable WJ Malignant transformation of fibrous dysplasia into chondroblastic osteosarcoma. Skeletal radiology 2002; 31 : 103–106.
39. Diniz AF, Filho JA, Alencar RC, et al. Low-grade central osteosarcoma of the mandible: a case study report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 103 : 246–252.
40. Bertoni F, Fernando Arias L, Alberghini M, et al. Fibrous dysplasia with degenerative atypia: a benign lesion potentially mistaken for sarcoma. Arch Pathol Lab Med 2004; 128 : 794–796.
41. Khairallah E, Antonyshyn O, Farb R, et al. Progressive unilateral mandibular swelling in adolescence: a diagnostic dilemma. J Craniofac Surg 1997; 8 : 32–37.
42. Ruggieri P, Sim FH, Bond JR, et al. Malignancies in fibrous dysplasia. Cancer 1994; 73 : 1411–1424.
43. Plotkin H, Rauch F, Zeitlin L. Effect of pamidronate treatment in children with polyostotic fibrous dysplasia of bone. J Clin Endocrinol Metab 2003; 88 : 4569–4575.
44. Matarazzo P, Lala R, Masi G, et al. Pamidronate treatment in bone fibrous dysplasia in children and adolescents with McCune-Albright syndrome. J Pediatr Endocrinol Metab 2002; 15(Suppl. 3): 929–937.
45. Chan B, Zacharin M. Pamidronate treatment of polyostotic fibrous dysplasia: failure to prevent expansion of dysplastic lesions during childhood. J Pediatr Endocrinol Metab 2006; 19 : 75–80.
46. Chao K, Katznelson L. Use of high-dose oral bisphosphonate therapy for symptomatic fibrous dysplasia of the skull. Journal of neurosurgery 2008; 109 : 889–892.
47. Majoor BC, Appelman-Dijkstra NM, et al. Therapy in McCune-Albright Syndrome and Polyostotic Fibrous Dysplasia. J Bone Miner Res 2017; 32 : 264–276.
48. Florez H, Peris P, Vidal-Sicart S, et al. Lack of scintigraphic response of fibrous dysplasia to bisphosphonate treatment. Rheumatology (Oxford) 2016; 55 : 1735.
49. Chapurlat RD, Gensburger D, Jimenez-Andrade JM, et al. Pathophysiology and medical treatment of pain in fibrous dysplasia of bone. Orphanet J Rare Dis 2012; 7(Suppl. 1): S3.
50. Chapurlat RD. Medical therapy in adults with fibrous dysplasia of bone. J Bone Miner Res 2006; 21(Suppl. 2): P114–P119.
51. Kitagawa Y, Tamai K, Ito H. Oral alendronate treatment for polyostotic fibrous dysplasia: a case report. J Orthop Sci 2004; 9 : 521–515.
52. Mansoori LS, Catel CP, Rothman MS. Bisphosphonate treatment in polyostotic fibrous dysplasia of the cranium: case report and literature review. Endocr Pract 2010; 16 : 851–854.
53. Wu D, Ma J, Bao S, et al. Continuous effect with long-term safety in zoledronic acid therapy for polyostotic fibrous dysplasia with severe bone destruction. Rheumatol Int 2015; 35 : 767–772.
54. Benhamou J, Gensburger D, Chapurlat R. Transient improvement of severe pain from fibrous dysplasia of bone with denosumab treatment. Joint Bone Spine 2014; 81 : 549–550.
55. Ganda K, Seibel MJ. Rapid biochemical response to denosumab in fibrous dysplasia of bone: report of two cases. Osteoporos Int 2014; 25 : 777–782.
56. Boyce AM, Kelly MH, Brillante BA, et al. A randomized, double blind, placebo-controlled trial of alendronate treatment for fibrous dysplasia of bone. J Clin Endocrinol Metab 2014; 99 : 4133–4140.
57. Simm PJ, Biggin A, Zacharin MR, et al. Bone Mineral Working Group. Consensus guidelines on the use of bisphosphonate therapy in children and adolescents. J Paediatr Child Health 2018; 54 : 223–233.
58. Lee JS, Fitz Gibbon EJ, Chen YR, et al. Collins MT, et al. Clinical guidelines for the management of craniofacial fibrous dysplasia. Orphanet J Rare Dis 2012; 7(Suppl. 1): S2.
59. Povýšil C, et al. Patomorfologie chorob kostí a kloubů. Praha: Galén 2017, 409 s.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 1-
All articles in this issue
- Ve spojení a jednotě je síla
- Hlavní téma: Metabolický syndrom
- Léčba hypertenze u metabolického syndromu – update 2019
- Aterogenní dyslipidemie typické pro metabolický syndrom
- Diabetes mellitus 2. typu v praxi – balancování mezi rezistencí a sekrecí
- Hepatotoxicita indukovaná bodybuilding suplementami
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Sarkopenická obezita – aktuální přehled problematiky
- Autoimunitní hepatitida
- Dvacet let cesty nefrologa do hlubin toxicity fosforu
- Monitorovanie a individualizácia liečby inhibítormi P2Y12 ADP receptorov
- Infarkt myokardu u pacienta s metabolickým syndromem a prokázaným syndromem obstrukční spánkové apnoe
- Úskalí v diagnostice srdeční amyloidózy a možnosti terapie
- Bolesti a deformace dolní čelisti – projev fibrózní dysplazie čelisti
- K čemu lze využít výsledek vyšetření koncentrace celkového cholesterolu?
- Několik poznámek ze čtení posledních doporučených postupů pro léčbu DLP verze 2019
- Založení profesního spolku SAI – sdružení ambulantních internistů, z. s.
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Prevalence a rizikové faktory T buňkami zprostředkované rejekce u pacientů po transplantaci jater od zemřelého dárce – retrospektivní studie v desetiletém období
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sarkopenická obezita – aktuální přehled problematiky
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Autoimunitní hepatitida
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career