-
Medical journals
- Career
Ambulantní léčba proximální hluboké žilní trombózy
: Dalibor Musil
: I. interní klinika kardiologická LF UP a FN Olomouc
: Vnitř Lék 2018; 64(9): 887-892
: Actualities
Léčba hluboké žilní trombózy (HŽT) se opírá o antikoagulaci hepariny, warfarinem a přímými orálními antikoagulancii. Podle 9. doporučení American College of Clinical Pharmacy má u pacientů s HŽT dolních končetin, u kterých to klinický stav a domácí podmínky umožňují, přednost domácí léčba před hospitalizací. Přesto je u nás většina pacientů s akutní HŽT stále hospitalizována, zejména pokud se jedná o proximální trombózu od podkolenní žíly výše. Doporučení přitom nerozlišují proximální (ileofemorální) HŽT jako výjimečnou a závažnější. Randomizované a observační studie prokázaly rychlejší ústup bolesti a otoku u pacientů v režimu časné mobilizace s nasazenou kompresí oproti pacientům dodržujícím klid na lůžku, přičemž incidence nových případů plicní embolizace byla u obou skupin stejná. V akutní fázi onemocnění je chůze s kompresí klíčová, spolu s vnitřními trombolytickými mechanizmy organizmu urychluje rekanalizaci a rozvoj kolaterálního řečiště v hlubokém svalovém kompartmentu dolní končetiny. Na dvou kazuistikách je demonstrován ambulantní přístup k terapii proximální HŽT.
Klíčová slova:
kompresní léčba – nízkomolekulární heparin – přímá orální antikoagulancia – žilní tromboembolická nemoc
Úvod
Hluboká žilní trombóza (HŽT) je spolu s plicní embolií (PE) jedním z klinických projevů žilní tromboembolické nemoci (TEN). Zařazujeme sem také pozdní komplikace TEN, které se objevují s několikaměsíční, někdy s mnohaletou latencí po akutní trombotické příhodě v podobě posttrombotického syndromu (PTS) na postižené končetině nebo pod obrazem chronické tromboembolické plicní hypertenze (CTEPH). Léčba tromboembolické nemoci se od 50. let 20. století opírá o antikoagulaci založenou na heparinech a antagonistech vitaminu K, v posledních letech také na přímých orálních antikoagulanciích (Direct Oral Anticoagulants – DOAC), která v těchto případech nabývají na stále větším významu. Nezbytnou součástí léčby je chůze s elastickou kompresí postižené končetiny. Důležitá změna v 10. doporučení American College of Clinical Pharmacy (ACCP) z roku 2016 uvádí u neonkologických pacientů s akutní TEN jako léky první volby všechny DOAC (síla doporučení 2B) [1].
Přes velký pokrok, který v léčbě TEN v poslední době nastal, se lékaři potýkají s řadou problémů a otázek. Který lék nebo kombinaci léků z dnes už poměrně široké palety u konkrétního pacienta zvolit a jak léčbu načasovat? Kam směřovat pacienty s akutní HŽT? K hospitalizaci nebo do domácí péče? Přestože je účinnost a bezpečnost ambulantní léčby HŽT ověřena randomizovanými klinickými studiemi a byla zařazena již do 8. ACCP doporučení v roce 2008, je u nás většina pacientů s akutní HŽT stále hospitalizována, zejména pokud se jedná o proximální HŽT zasahující od podkolenní žíly výše.
Na našem pracovišti řadu let standardně ambulantně léčíme pacienty s distální i proximální HŽT, již od doby, kdy byl jedinou alternativou perorální léčby warfarin. Nezbytnými předpoklady jsou souhlas pacienta, dobrý klinický stav bez závažných komorbidit a zvýšeného rizika krvácení a vyhovující domácí podmínky. Příchodem DOAC se ambulantní léčebný přístup pro pacienty i lékaře značně zjednodušil. DOAC jsou v léčbě TEN stejně účinná jako warfarin, ale bezpečnější, s nižším rizikem velkého a intrakraniálního krvácení. Navíc u DOAC existuje bezpečnostní pojistka v podobě specifického antidota rušícího v naléhavých situacích antikoagulační účinek DOAC během několika minut. Na následujících dvou kazuistikách bychom chtěli podrobněji ilustrovat ambulantní léčbu proximální HŽT.
60letá žena s nachlazením a hlubokou žilní trombózou sahající až do pánve
Pacientka byla odeslána do angiologické ambulance praktickým lékařem k vyloučení hluboké žilní trombózy na levé dolní končetině (LDK). Před 7 dny začala být nachlazená, měla subfebrilie 37–37,5 °C a bolesti hlavy, proto ulehla. Po 4 dnech klidu na lůžku, 2 dny před vyšetřením, zjistila na LDK nebolestivý otok nártu a kolem kotníků, který se rychle rozšířil na bérec a stehno. Oteklá končetina měla poněkud temnější barvu, ale stále byla nebolestivá a neomezovala ji v chůzi. Žádné další potíže se neobjevily. Nachlazení ustupovalo, teplota klesla, nebyla dušná, neměla kašel ani bolesti na hrudníku.
Se žílami na dolních končetinách se nikdy v minulosti neléčila, hlubokou žilní trombózu a plicní embolii neprodělala. 30 let užívala léky na arteriální hypertenzi, před půl rokem podstoupila totální výměnu levého kyčelního kloubu za endoprotézu a před 30 lety jednostrannou ovarektomii. Pro onemocnění kloubů byla v invalidním důchodu, dříve pracovala jako dělnice na dráze, nekouřila. Její sestra prodělala před lety hlubokou žilní trombózu, ale bližší okolnosti neznala, jinak se tromboembolická nemoc v rodině nevyskytla.
Objektivní nález: obézní žena (BMI 32 kg/m2), bez cyanózy, kardiopulmonálně kompenzovaná, TK 135/85 mm Hg, TF 78/min, DF 12/min, LDK na nártu, kolem kotníků, na bérci a stehně oteklá, všude v těchto místech lze dobře vymáčknout zřetelný důlek (tzv. pitting edém), kůže od nártu až po tříslo tmavě růžová, na pohmat ve srovnání s pravou dolní končetinou (PDK) teplejší, na stehnech a bércích ojedinělé venektazie a retikulární žíly, hluboká palpace lýtek, Homansovo a plantární znamení na obou DK negativní (obr. 1).
1. Akutní proximální HŽT LDK postihující v. iliaca externa, v. femoralis communis, v. femoralis, v. poplitea a v. fibularis. Končetina je oteklá od třísla po nárt s patrným temnějším zbarvením kůže ve srovnání s PDK 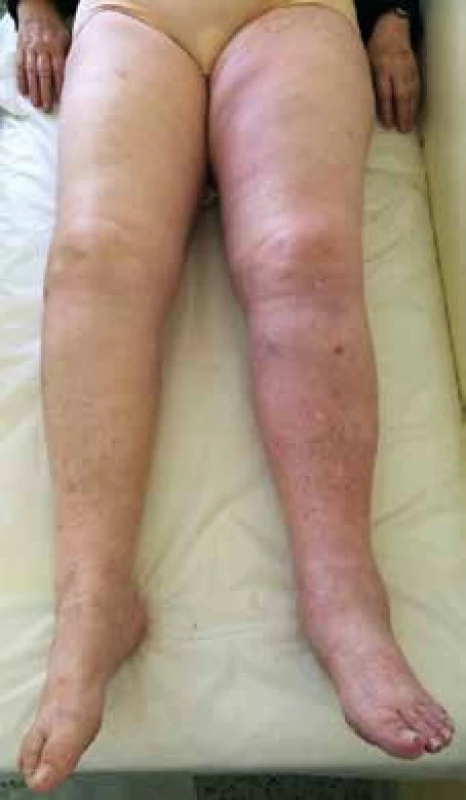
Laboratorní vyšetření: KO – leukocyty 12,4 × 109/l, jinak normogram, biochemie v normě, D-dimery 6,08 mg/l (norma podle věku pacientky do 0,60 mg/l). Barevná duplexní sonografie žil LDK – úplná obliterace v. iliaca externa, v. femoralis communis, v. femoralis, částečný uzávěr v. poplitea a jednoho ze dvou kmenů v. fibularis, oba kmeny vv. tibiales posteriores a svalové žíly lýtka volně stlačitelné (obr. 2). Echokardiografie neprokázala plicní hypertenzi ani dilataci nebo poruchu kinetiky pravé komory. Zadopřední RTG hrudníku negativní.
2. USG nález před zahájením domácí antikoagulační léčby LMWH ukazuje úplný uzávěr v. iliaca externa, modročerveně se barví a. iliaca externa. CFM, podélné zobrazení 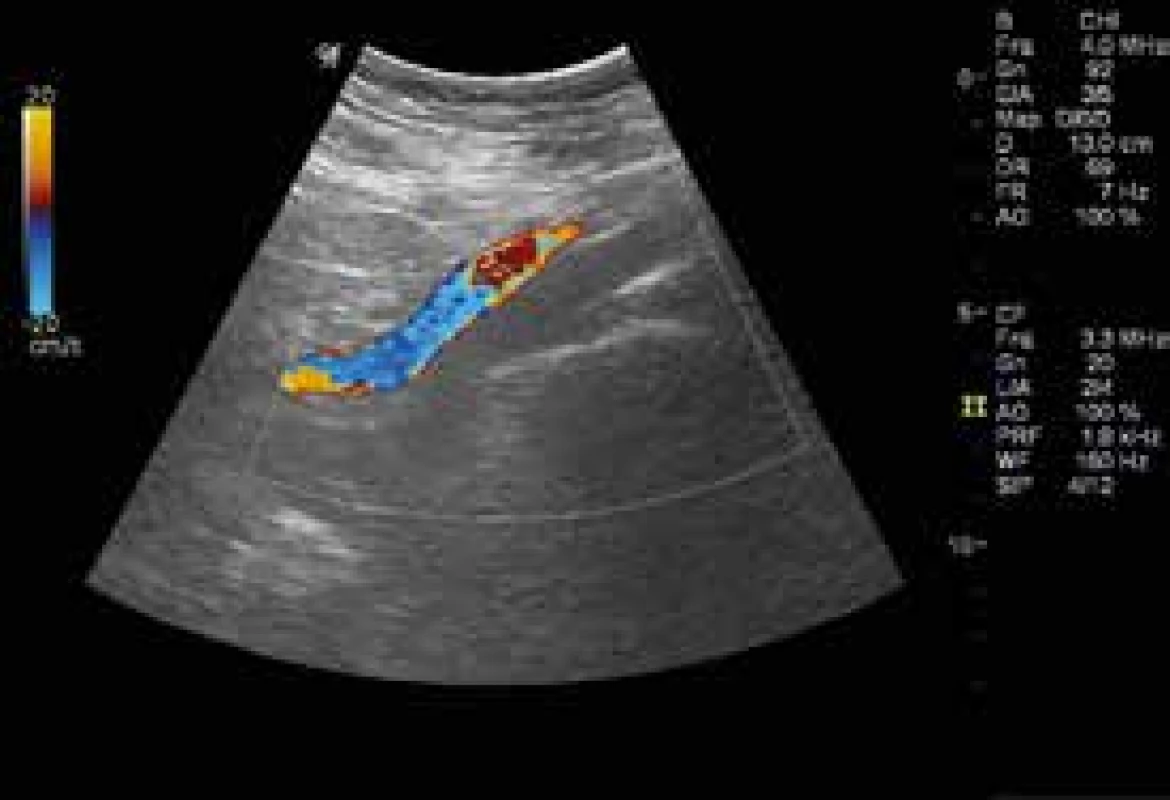
Byla zahájena ambulantní antikoagulační léčba Fraxiparinem F 0,8 ml s.c. inj. 1krát denně (tělesná hmotnost 82 kg) a doporučena chůze s nasazenou elastickou kompresivní bandáží naloženou od prstů po tříslo. Při kontrole za 4 dny otok LDK ustoupil a pacientka si již mohla pohodlně navléci kompresivní stehenní punčochu, za kterou vyměnila elastickou bandáž. Hladina D-dimerů poklesla na 5,54 mg/l. Domácí aplikace injekcí Fraxiparinu F 0,8 ml probíhala bez potíží a krvácivých projevů. Po 12 dnech ambulantní antikoagulační léčby zarudnutí a otok LDK vymizely a hladina D-dimerů dále poklesla na 2,03 mg/l.
Léčba Fraxiparinem F 0,8 ml pokračovala bez komplikací celkem 30 dnů, poté byla nahrazena přípravkem Pradaxa 150 mg 1–0-1 tbl., kterou nemocná užívala 8 měsíců, po té byla zaměněna za Anopyrin 1krát 100 mg. Onkologický screening (biochemie, ultrasonografie/USG břicha, gynekologické vyšetření včetně mamografie, vyšetření stolice na OK) byl negativní a u pacientky se na LDK zatím neobjevily známky a symptomy posttrombotického syndromu.
58letá žena s hlubokou žilní trombózou pravé horní končetiny
Pacientka byla odeslána praktickým lékařem pro nebolestivý otok pravé horní končetiny (PHK). Tři dny před vyšetřením zjistila ráno po probuzení nebolestivý, mírně začervenalý otok pravé ruky sahající od prstů po loket, bez omezení hybnosti nebo jemné motoriky. Žádné jiné potíže neměla. Horní končetiny jí nikdy předtím neotekly. Vzniku otoku nepředcházel úraz, nadměrné zatěžování nebo jakákoliv imobilizace, chůze o berlích, aplikace nitrožilních injekcí či infuzí, akutní onemocnění nebo operace. Pacientka neměla zavedený centrální žilní katétr ani kardiostimulátor, nebyla nikdy onkologicky nemocná.
Žilní tromboembolickou nemoc předtím neprodělala. Jedenáct let se léčila pro arteriální hypertenzi, dyslipidemii a hyperurikemii, 6 let pro diabetes mellitus 2. typu – dietní opatření kombinovaná s perorálními antidiabetiky a inzulinem. Neprodělala žádnou operaci ani vážnější úraz. Dvacet let kouřila 10 cigaret denně, pracovala v kanceláři. Tromboembolická nemoc se v rodině nevyskytla.
Objektivní nález: těžce obézní žena (BMI 40 kg/m2), bez cyanózy, kardiopulmonálně kompenzovaná, TK 160/90 mm Hg, TF 74/min, DF 14/min, dorzum pravé ruky oteklé, zarudlé až cyanotické, na pohmat nebolestivé, proximálně otok sahal na předloktí (obr. 3), na vnitřní straně pravé paže byly dilatované podkožní žíly.
3. Otok a temně rudé až cyanotické zbarvení pravé ruky při hluboké žilní trombóze zcela uzavírající v. subclavia, v. axillaris a částečně obliterující v. brachialis 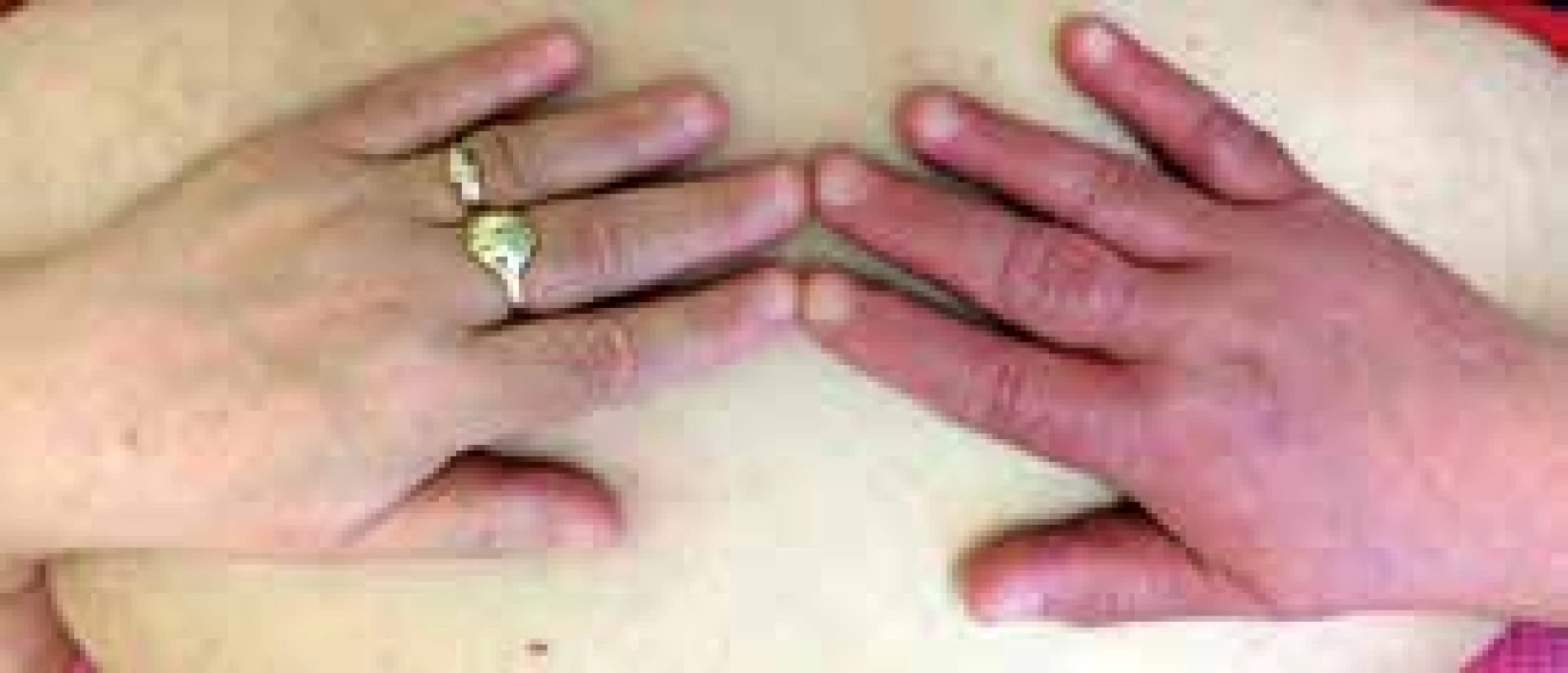
Laboratorní vyšetření: KO – normogram, biochemie v normě, D-dimery 0,86 mg/l (norma podle věku pacientky do 0,60 mg/l). Barevná duplexní sonografie žil PHK – úplná obliterace v. subclavia a v. axillaris, částečná obliterace vv. brachiales, volně komprimovatelné vv. radiales a vv. ulnares na předloktí a na krku v. jugularis interna a externa (obr. 4). Zadopřední a levý boční RTG hrudníku negativní.
4. USG nález na žilách PHK před zahájením domácí antikoagulační léčby LMWH. A – úplný uzávěr v. subclavia a jejího přítoku (CFM, příčné zobrazení) B – úplný uzávěr v. axillaris, červeně se barví krevní průtok tepnou (CFM, příčné zobrazení) C – distální konec trombózy ve v. brachialis asi 10 cm nad loketní jamkou (CFM, podélné zobrazení) 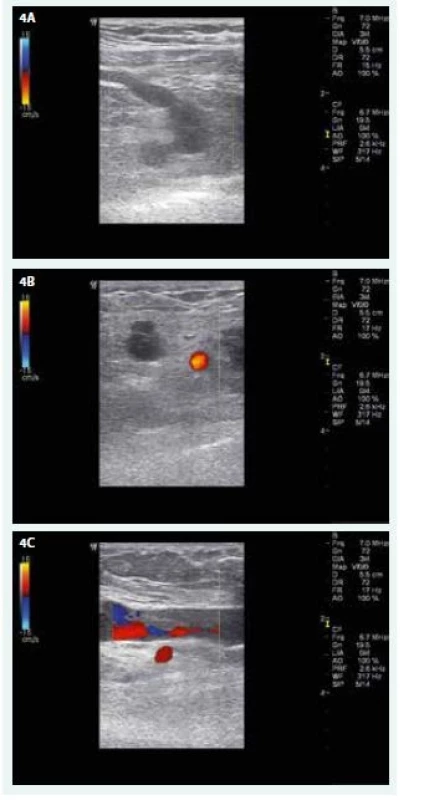
Byla zahájena ambulantní antikoagulační léčba Fraxiparinem F 1,0 ml s.c. inj. 1krát denně (tělesná hmotnost 110 kg) a nasazen kompresivní pažní návlek. Při kontrole za 10 dnů otok PHK zcela vymizel a hladina D-dimerů se téměř normalizovala na 0,68 mg/l. Při kontrolním ultrasonografickém vyšetření 7 týdnů od začátku léčby byla zjištěna kompletní rekanalizace všech postižených žil (obr. 5). Fraxiparine F 1,0 ml byl doma aplikován bez komplikací 6 týdnů, poté byl nahrazen přípravkem Pradaxa 150 mg 1–0-1 tbl. Antikoagulační léčba trvala celkem 5 měsíců. Onkologický screening, zahrnující biochemii, vyšetření stolice na OK, USG břicha, gynekologické vyšetření včetně mamografie, zadopřední a levý boční snímek hrudníku a kontrolní snímky s odstupem 3 měsíců, plicní vyšetření, byl zatím negativní.
5. USG nález na žilách PHK 7 týdnů od zahájení domácí antikoagulační léčby LMWH ukazuje úplnou rekanalizaci všech postižených žil. A1,2 – v. subclavia a její přítok (CFM a B-flow, příčné zobrazení) B – v. axillaris (CFM, příčné zobrazení) C1,2 – v. brachialis (CFM a B-flow, podélné zobrazení) 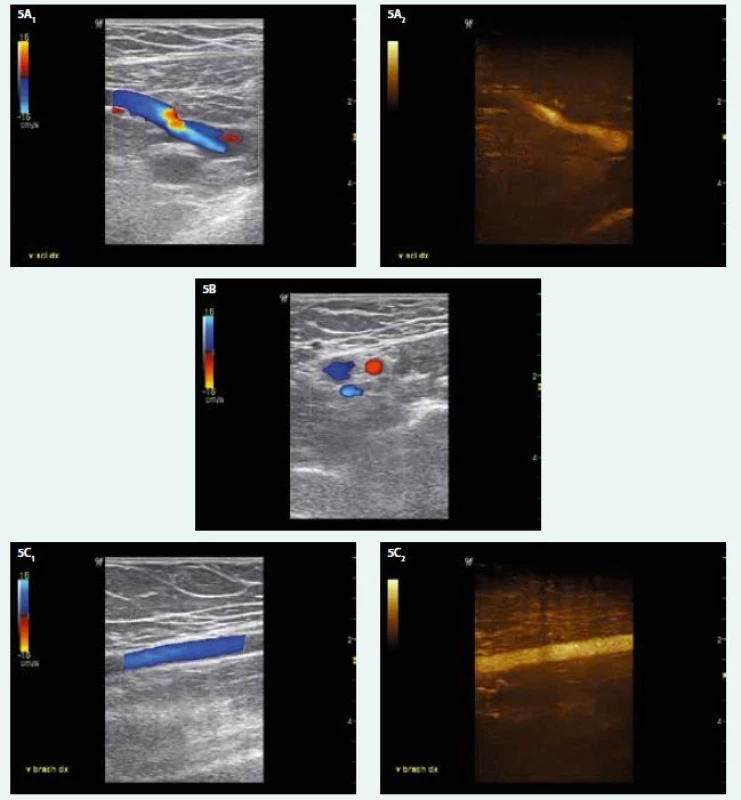
Diskuse
Iniciální fáze léčby TEN se musí zaměřit na rychlé a bezpečné navození plné antikoagulace. Jejím cílem je zabránit časné recidivě onemocnění, prevence nárůstu a migrace trombózy. Tato akutní fáze trvá prvních 5–10 dnů od vzniku potíží a pro další průběh léčby je rozhodující [1]. Opožděná nebo nedostatečná či kolísající antikoagulace zvyšuje riziko časné i pozdní recidivy, plicní embolie, riziko trvalých posttrombotických změn v žilním řečišti, a tedy nebezpečí rozvoje pozdních komplikací (PTS, CTEPH). Proto je tak důležité každé klinické podezření na HŽT ověřit USG vyšetřením do 24 hod.
Subkutánní aplikace nízkomolekulárních heparinů (Low Molecular Weight Heparin – LMWH) navodí plnou antikoagulaci během několika minut. Antitrombotický účinek poté přetrvává dlouho, takže je možné lék podávat 1krát denně. Tomuto podávání by měla být dána přednost před aplikací 2krát denně (síla doporučení 2C) [1]. Hlavním mechanizmem působení je nepřímá, antitrombinem zprostředkovaná, neselektivní inhibice faktoru Xa a faktoru IIa s vyšší selektivitou pro faktor Xa. Uplatňuje se také stimulace inhibitoru tkáňového faktoru, aktivace fibrinolýzy a snížení krevní viskozity. Antikoagulační působení je předvídatelné, u většiny nemocných bez nutnosti monitorace účinku. Aplikace je jednoduchá a bezpečná, dobře zvládnutelná v domácích podmínkách, takže pacient nemusí být upoutaný na lůžko, ale může s nasazenou kompresí chodit. LMWH jsou dobře tolerovány, s minimem lékových interakcí [2]. Účinnost a bezpečnost ambulantní léčby HŽT LMWH v režimu podávání jednou denně byla ověřena klinickými studiemi [3].
Podle 9. ACCP doporučení má u pacientů s HŽT dolních končetin, u kterých to domácí podmínky umožňují, jednoznačně přednost domácí léčba před hospitalizací (síla doporučení 1B). Doporučení nerozlišují proximální (ileofemorální) HŽT jako výjimečnou a závažnější. Naopak, u pacientů s akutní izolovanou distální HŽT je explicitně doporučený stejný přístup jako u pacientů s akutní proximální HŽT (síla doporučení 1B) [1]. Domácí léčba s dobrým zázemím je pro pacienta pohodlná. Podmínkou je, aby byl pacient ochotný a schopný být léčen doma, měl zajištěnu aplikaci LMWH a přístup k telefonu s možností hospitalizace při zhoršení stavu. Pro špatně spolupracující, úzkostné a dementní pacienty, při závažných komorbiditách a zvýšeném riziku krvácení není tento způsob léčby většinou vhodný [1].
Během akutní fáze léčby je velmi důležitá chůze s nasazenou kompresí a účinnou antikoagulační léčbou. Imobilizace na nemocničním lůžku je právě v kritickém období prvních 5–10 dnů spojena s venostázou, která spolu s poškozením cévního endotelu a hyperkoagulačním stavem patří do Virchowovy triády patofyziologických mechanizmů vedoucích k vzniku TEN. Vždyť právě časná mobilizace a komprese patří k základním pravidlům prevence TEN u chirurgických a ortopedických pacientů [1,4]. V první kazuistice byly nesporně důležitými faktory vzniku žilní trombózy několikadenní imobilizace a obezita. Prospektivní studie sledující pacienty hospitalizované pro proximální a distální HŽT, prokázaly USG vyšetřením provedeným při přijetí a po 5–14denní hospitalizaci progresi trombózy ve 4 %, resp. 9,5 % případů, navzdory antikoagulační léčbě LMWH [5,6].
Imobilizace je jistě významný rizikový faktor nejen vzniku, ale také nárůstu a migrace již existující trombózy a jednou z příčin časné recidivy TEN. Vede ke zpomalení žilního proudění a k venostáze. Stagnací krve zaniká smykové napětí, které vytváří proudící krev na žilní stěně. Dochází k porušení a postupnému vymizení glykokalyx a odkrytí adhezivních molekul na povrchu endotelu. K žilní stěně adherují leukocyty a trombocyty, které pronikají pod endotel, dochází k zánětu a vzniku trombózy. Fyziologické, pulzatilní, laminární proudění vytváří na povrchu cévní stěny smykové napětí uvolňující z endotelu faktory potlačující zánět a tvorbu volných radikálů. Všechny tyto mechanizmy fungují nejen v žilním, ale i tepenném řečišti, v němž jsou příčinou aterosklerózy [7].
Komprese zabraňuje venostáze. Vyprazdňuje krev z povrchových do hlubokých žil, a zvyšuje tak objem a rychlost krve protékající hlubokými žílami, odkud pravidelné kontrakce lýtkových svalů při chůzi odčerpávají krev z dolní končetiny zpět k srdci. V akutní fázi onemocnění urychluje chůze s nasazenou kompresí rekanalizaci vnitřními trombolytickými mechanizmy organizmu a rozvoj kolaterálního řečiště v hlubokém svalovém kompartmentu. Randomizované a observační studie prokázaly rychlejší ústup bolesti a otoku u pacientů v režimu časné mobilizace s nasazenou kompresí oproti pacientům dodržujícím klid na lůžku, přičemž incidence nových případů PE, hodnocená plicními scany 10 dnů po léčbě, byla u obou skupin stejná [8].
Důvodem k hospitalizaci pacientů s proximální HŽT může být v některých případech zvažování trombolytické léčby. Stále však platí, že u akutní proximální HŽT by měla mít přednost antikoagulační léčba (síla doporučení 2C) a lokální, katétrová trombolýza, pouze pokud je velká pravděpodobnost benefitu, tedy prevence vzniku PTS u mladších pacientů s nízkým rizikem krvácení [1,9].
Jasné důkazy účinnosti lokální trombolýzy v prevenci PTS stále chybí, výsledky randomizovaných klinických studií se rozcházejí. V norské studii CaVenT katétrová trombolýza provedená do 21 dnů od začátku potíží u 209 pacientů ve věku 18–75 let s první ileofemorální HŽT snížila po 24 měsících statisticky významně riziko PTS v porovnání se standardní antikoagulační léčbou. Rozdíl ve výskytu PTS odpovídal absolutnímu snížení rizika o 14,4 % [10]. Na druhé straně, americká studie srovnávající u 692 pacientů s akutní proximální HŽT antikoagulační léčbu samotnou s antikoagulační léčbou kombinovanou s farmakomechanickou trombolýzou nezjistila ve výskytu PTS po 6 a 24 měsících od ukončení léčby mezi oběma skupinami žádný významný rozdíl, ale v intervenované skupině významně narostlo riziko velkého krvácení [11].
Závěr
Léčba akutní proximální HŽT by měla přednostně probíhat ambulantně, bez ohledu na rozsah žilního postižení zjištěný USG vyšetřením. Rozhodující je klinický stav pacienta a jeho ochota a možnosti podrobit se domácímu léčebnému režimu. O tyto nemocné by měl v první řadě pečovat angiolog, který zvolí vhodnou léčbu, dohlédne na rychlé a bezpečné navození plné antikoagulace, nasazení a nošení komprese a pacienta po celou dobu léčby bude pravidelně klinicky a ultrasonograficky sledovat. Ve spolupráci s praktickým lékařem provede v indikovaných případech onkologický screening a vyšetření laboratorní trombofilie. Rozhodne o délce a ukončení antikoagulace, případně o další navazující léčbě. Doporučí opatření pro adekvátní sekundární tromboprofylaxi opřenou o medicínu důkazů.
doc. MUDr. Dalibor Musil, Ph.D.
I. interní klinika kardiologická LF UP a FN Olomouc
Doručeno do redakce 29. 8. 2018
Sources
1. Kearon C, Akl EA, Ornelas J et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest 2016; 149(2): 315–352.
2. Bultas J, Karetová D. Nízkomolekulární hepariny – jejich význam v současné praxi. Interní Med 2011; 13(11): 440–444.
3. Hacobian M, Shetty R, Niles CM et al. Once daily enoxaparin for outpatient treatment of acute venous thrombosis: a case-control study. Clin Appl Thromb Hemost 2010; 16(1): 21–25.
4. Guyatt HG, Akl EA, Crowther M et al. Atithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians, evidence-based clinical practice guidelines. Chest 2012; 141 (Suppl 2): 7S-47S.
5. Masuda EM, Kessler DM, Kistner RL et al. The natural history of calf vein thrombosis: lysis of thrombi and development of reflux. J Vasc Surg 1998; 28(1): 67–73.
6. Musil D. Regrese hluboké žilní trombózy. Vnitř Lék 2000; 56(1): 16–18.
7. Bergan JJ, Schmid-Schönbein GW, Coleridge Smith PD et al. Chronic venous disease. N Engl J Med 2006; 355(5): 488–498.
8. Kearon C, Kahn SR, Agnelii G et al. Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133(Suppl 6): 454S-545S.
9. Chen G, Shi W, He X et al. Feasibility of continuous, catheter-directed thrombolysis using low-dose urokinase in combination with low molecular-weight heparin for acute iliofemoral venous thrombosis in patients at risk of bleeding. Exp Ther Med. 2017; 13(2): 751–758.
10. Enden T, Haig Y, Kløw NE et al. Long-term outcome after additional catheter-directed thrombolysis versus standard treatment for acute iliofemoral deep vein thrombosis (the CaVenT study): a randomised controlled trial. Lancet 2012; 379(9810): 31–38.
11. Vendantham S, Goldhaber SZ, Julian JA et al. Pharmacomechanical catheter-directed thrombolysis for deep-vein thrombosis. N Engl J Med 2017; 377(23): 2240–2252.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 9-
All articles in this issue
- Pathophysiology, causes and epidemiology of chronic heart failure
- What we know about epidemiology of heart failure in Slovakia and globally
- Diagnosis of heart failure: the new classification of heart failure
- Pharmacological therapy for chronic heart failure
- Comorbidities in heart failure
- Arrhythmias and conductance disturbances and heart failure
- Otto Kahler and his family (on the 125th anniversary of his death): I. Ancestors
- Outpatient treatment of proximal deep vein thrombosis
- The heart transplantation
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnosis of heart failure: the new classification of heart failure
- Pathophysiology, causes and epidemiology of chronic heart failure
- Outpatient treatment of proximal deep vein thrombosis
- What we know about epidemiology of heart failure in Slovakia and globally
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

