-
Medical journals
- Career
Dva pohľady na venózny tromboembolizmus u onkologických pacientov
: Patrik Palacka 1; Jana Hirmerová 2,3
: II. onkologická klinika LF UK a Národného onkologického ústavu Bratislava, Slovenská republika 1; II. interní klinika LF UK a FN Plzeň 2; Biomedicínské centrum LF UK, Plzeň 3
: Vnitř Lék 2017; 63(6): 431-440
: Reviews
Tento přehledný referát slovenského onkologa a české angioložky byl redakci poskytnut v mateřském jazyce obou autorů a redakce se rozhodla jej ponechat v jazykovém znění rukopisu.
Zvýšené riziko venózneho tromboembolizmu (VTE) u pacientov so zhubným nádorovým ochorením v porovnaní s bežnou populáciou je determinované rizikovými faktormi, ku ktorým patrí aj použitá protinádorová liečba, najmä niektoré hormonálne lieky, cytostatiká, inhibítory vaskulárneho endotelového rastového faktoru (VEGF) a receptoru pre epidermálny rastový faktor (EGFR), imunomodulačné látky a erytropoetíny. Populácia onkologických chorých sa z hľadiska prístupu k liečbe VTE rozdeľuje na skupinu jedincov s anamnézou zhubného nádorového ochorenia v kompletnej remisii a pacientov s aktívnym (lokálne pokročilým alebo metastatickým) malígnym ochorením.
Tromboembolická nemoc (TEN) výrazně zhoršuje prognózu pacienta s malignitou. Onkologičtí nemocní mají vyšší riziko recidivy TEN, ale také vyšší riziko krvácení při antikoagulační léčbě. K iniciální i následné léčbě je doporučen nízkomolekulární heparin po dobu minimálně 3–6 měsíců. Specifický přístup vyžadují pacienti s trombocytopenií, renální insuficiencí, s recidivou TEN vzniklou navzdory antikoagulační léčbě. Kontroverzním tématem je léčba incidentální plicní embolie. Přístup k pacientovi s TEN a nádorovým onemocněním by měl být individualizovaný, s přihlédnutím k jeho celkové prognóze a zhodnocením poměru riziko/prospěch.Kľúčové slová:
antikoagulačná liečba – nádorové ochorenie – rizikové faktory – venózny tromboembolizmusPohľad onkológa
Patrik Palacka
Úvod
Pre zhubné nádorové ochorenie je charakteristický hyperkoagulačný stav, následkom ktorého môže vzniknúť venózny (žilový) tromboembolizmus (VTE) – hlboká venózna (žilová) trombóza (HŽT) a/alebo pľúcna embolizácia (PE). Riziko VTE je u onkologických pacientov determinované prítomnosťou množstva rizikových faktorov [1].
Rizikové faktory VTE u onkologických pacientov
Nádorové faktory
Nádorové bunky pôsobia prokoagulačne, čo vedie k tvorbe trombínu. Prehľad zhubných nádorov s najvyšším rizikom VTE uvádza tab. 1. Prokoagulačne navyše pôsobia aj nenádorové tkanivá ako odpoveď na existenciu zhubného tumoru v ľudskom organizme.
1. Prehľad zhubných nádorov s najvyšším rizikom VTE. 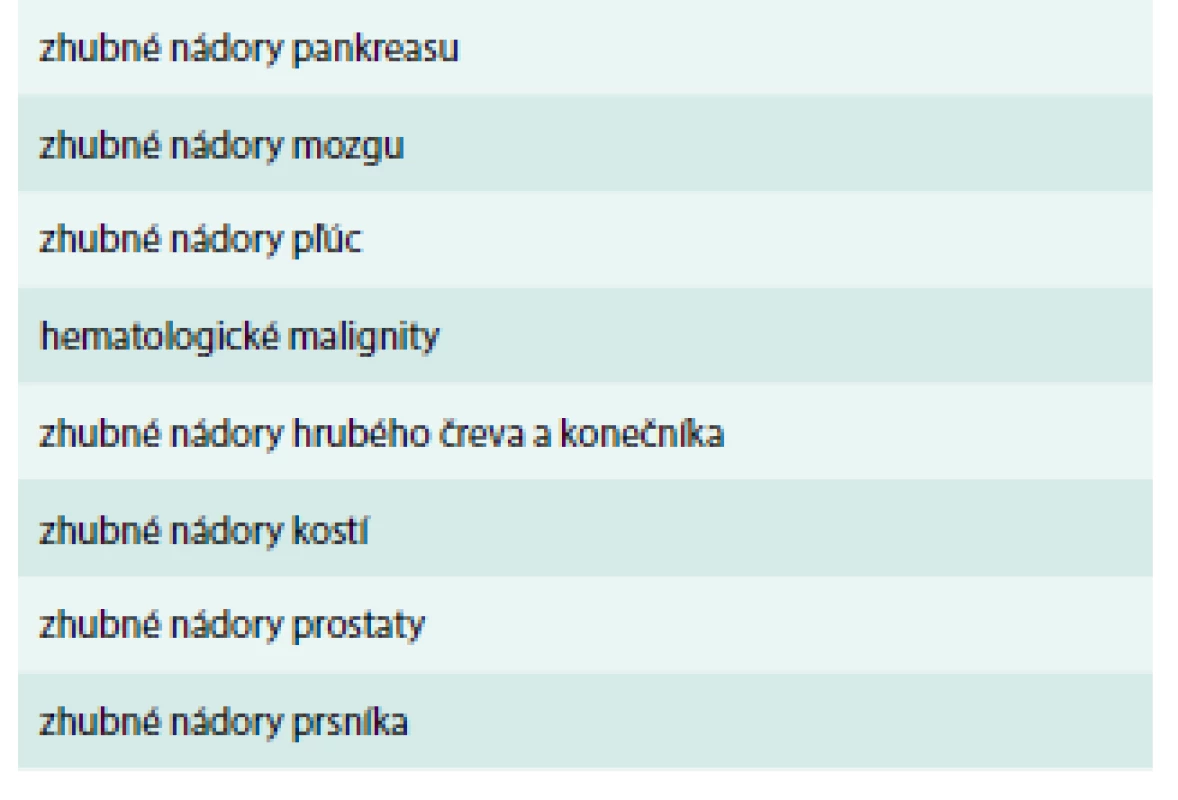
Upravené podľa [1] V patogenéze hyperkoagulačného stavu zohrávajú kľúčovú úlohu:
- transmembránový proteín tkanivový faktor, exprimovaný nádorovými bunkami sarkómov, melanómov, neuroblastómov, lymfómov, adenokarcinómov pankreasu, hrubého čreva, konečníka, ovárií a akútnej promyelocytovej leukémie, vytvára komplex s faktorom VII, ktorý aktivuje faktory IX a X a následne spúšťa hemokoagulačnú kaskádu [2]
- kalcium dependentná cysteínová proteáza nádorový prokoagulant [3], exprimovaný nádorovými bunkami adenokarcinómov hrubého čreva, prsníka, pľúc, obličiek, melanómu a akútnej promyelocytovej leukémie, aktivuje priamo faktor X
- plazmový tkanivový faktor naviazaný na mikročastice: viac ako dve tretiny pacientov, u ktorých stanovili tkanivový faktor naviazaný na mikročastice, tvorili jedinci s adenokarcinómami pankreasu [4].
Anatomické faktory
Niektoré malígne nádory zvyšujú riziko VTE vonkajšou kompresiou alebo priamou inváziou do veľkých ciev. K týmto zhubným tumorom patria:
- nádory v mediastine (napr. primárne mediastinálne tumory z germinatívnych buniek, lymfómy), ktoré môžu komprimovať vény horných končatín
- lymfadenopatia v axile (napr. pri karcinóme prsníka), ktorá môže rovnako stláčať žily horných končatín
- nádory v abdomene, resp. retroperitoneálnom priestore (napr. karcinóm ovárií resp. primárne retroperitoneálne tumory z germinatívnych buniek) môžu komprimovať veľké cievy, následkom čoho vzniká HŽT dolných končatín.
- hepatocelulárny karcinóm môže stláčať hepatálne vény alebo môže do nich priamo invadovať
- svetlobunkový karcinóm (adenokarcinóm) obličky (RCC) infiltruje v. cava inferior (dolná dutá žila) do približne 10 % všetkých prípadov [5]
- nádory v panve (napr. karcinóm močového mechúra, karcinóm prostaty) môžu stláčať veľké cievy, následkom čoho vzniká HŽT dolných končatín.
Faktory súvisiace s pacientom
K faktorom súvisiacim s pacientom patria venózny tromboembolizmus v anamnéze, vek, obezita alebo vrodená trombofília.
Faktory súvisiace s liečbou
Na margo faktorov súvisiacich s liečbou je potrebné poznamenať, že v onkológii sa používajú viaceré skupiny liekov ako sú hormonálne preparáty, cytostatiká, inhibítory VEGF (vaskulárny endotelový rastový faktor), inhibítory EGFR (receptor pre epidermálny rastový faktor), imunomodulačné látky, erytropoetíny a ďalšie, takže sa v žiadnom prípade nie je možné obmedziť na zjednodušené konštatovanie, že onkologická liečba zvyšuje riziko VTE. Každá zo skupín liekov používaných v onkológii má totiž rôzny potenciál zvyšovať riziko VTE. Rôzny trombogénny potenciál môžu mať dokonca lieky v rámci jednej skupiny.
Hormonálne preparáty zvyšujúce riziko VTE
K hormonálnym preparátom, ktoré zvyšujú riziko VTE, patria:
- selektívne modulátory estrogénového receptora (SERM), z ktorých sa v onkologickej klinickej praxi najčastejšie používa tamoxifen v adjuvantnej (zaisťovacej) liečbe karcinómu prsníka, v liečbe pokročilého alebo metastatického karcinómu prsníka a v liečbe karcinómu endometria. Podľa metaanalýzy [6] je riziko VTE 2,8 % u postmenopauzálnych žien s karcinómom prsníka liečených tamoxifenom v adjuvantnej intencii signifikantne vyššie (OR 0,55, 95% CI 0,46–0,64) v porovnaní s niektorým z aromatázových inhibítorov (1,6% výskyt VTE)
- aromatázové inhibítory (AI), ktoré majú takmer rovnaké indikácie ako tamoxifen
- progestíny (megestrol), používaný v liečbe karcinómu prsníka, karcinómu endometria a nádorovej kachexie. Megestrol v porovnaní s aromatázovým inhibítorom signifikantne zvyšuje riziko HŽT v druhej línii liečby postmenopauzálnych žien s pokročilým karcinómom prsníka [7]
Cytostatiká zvyšujúce riziko VTE
Najviac preskúmaným cytostatikom z hľadiska vzťahu k VTE je platinový derivát cisplatina. Liečebné režimy s cisplatinou signifikantne (RR 1,67, 95% CI 1,25–2,23) zvyšujú incidenciu VTE oproti terapeutickým režimom bez cisplatiny [8]. Ďalším cytostatikom, ktoré zvyšuje riziko VTE, je L-asparagináza používaná ako súčasť kombinovanej liečby akútnej lymfoblastovej leukémie (ALL). Enzým asparagináza katalyzuje hydrolýzu asparagínu na kyselinu asparágovú pri súčasnej deplécii asparagínu. Zvýšené riziko VTE pravdepodobne súvisí so zníženou syntézou antikoagulačného faktora antitrombínu. Medián času do vzniku VTE bol pritom 3,5 mesiaca (rozsah 0,5–10,1 mesiacov) [9]. Mechanizmus vzniku pravdepodobne spočíva v znížení syntézy antikoagulačného faktora antitrombínu, ktorý neesenciálnu aminokyselinu asparagín. Enzým asparagináza katalyzuje hydrolýzu asparagínu na kyselinu asparágovú pri súčasnej deplécii asparagínu.
Inhibítory VEGF zvyšujúce riziko VTE
Do skupiny inhibítorov VEGF patrí monoklonálna protilátka bevacizumab používaná v liečbe metastatického adenokarcinómu hrubého čreva a konečníka, adenokarcinómu pľúc, karcinómu cervixu a recidivujúceho karcinómu ovárií. Podľa metaanalýzy [10] bevacizumab pridaný k štandardnej protinádorovej liečbe signifikantne zvyšuje riziko VTE oproti samotnej cytostatickej terapii. Výsledky ďalších metaanalýz [11,12] však boli v rozpore s uvedeným záverom, takže liečbu bevacizumabom nepovažuje za významný rizikový faktor VTE v onkológii.
Pridanie afliberceptu, inhibítora VEGF, k štandardnej cytostatickej liečbe pacientov s metastatickým karcinómom hrubého čreva alebo konečníka signifikantne zvýšilo riziko VTE [13].
Inhibítory EGFR zvyšujúce riziko VTE
K inhibítorom EGFR zaraďujeme monoklonálne protilátky cetuximab (používaný v liečbe metastatického karcinómu hrubého čreva a konečníka a epidermoidného karcinómu hlavy a krku) a panitumumab (používaný v liečbe metastatického karcinómu hrubého čreva a konečníka). Dve metaanalýzy [14,15] dokázali, že cetuximab a panitumumab signifikantne zvyšujú riziko VTE oproti konvenčnej cytostatickej liečbe.
Imunomodulačné látky zvyšujúce riziko VTE
Imunomodulačná látka talidomid a jeho analóg lenalidomid používané v liečbe mnohopočetného myelómu signifikantne zvyšujú riziko VTE, avšak iba v kombinácii s kortikosteroidmi a/alebo cytostatikami [16].
Erytropoézu stimulujúce látky zvyšujúce riziko VTE
Poslednou skupinou liekov v onkológii s vplyvom na výskyt VTE sú erytropoetíny alebo erytropoézu stimulujúce látky, ku ktorým patrí epoetín a darbepoetín. Podľa metaanalýzy [17] je riziko VTE u pacientov liečených erytropoetínmi signifikantne vyššie oproti chorým, ktorí uvedenú terapiu nedostávajú (RR 1,52; 95% CI 1,34–1,74). Prehľad liekov zvyšujúcich riziko VTE v onkológii je uvedený v tab. 1.
2. Protinádorové lieky s významným vplyvom na riziko VTE 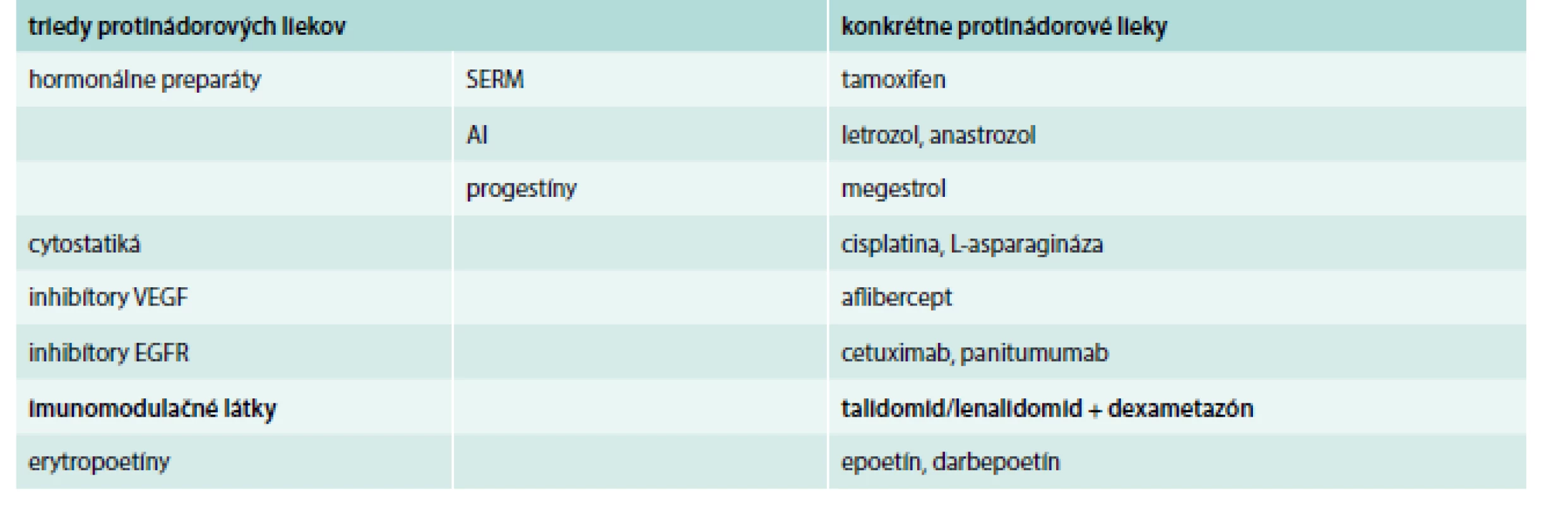
AI – aromatázové inhibítory EGFR – receptor pre epidermálny rastový faktor SERM – selektívne modulátory estrogénového receptora VEGF – vaskulárny endotelový rastový faktor Protinádorové lieky, ktoré vyžadujú profylaxiu VTE, sú zvýraznené tučným písmom. Liečba VTE u pacientov so zhubným nádorovým ochorením
U pacientov so zhubnými nádorovými ochoreniami máme pre liečbu VTE v súčasnosti k dispozícii nízkomolekulové heparíny (LMWH), nefrakcionovaný heparín, anatagonistu vitamínu K warfarín a priame perorálne antikoagulanciá, t.j. priame inhibítory trombínu a priame inhibítory faktoru Xa.
Z hľadiska terapie VTE je potrebné rozdeliť populáciu chorých so zhubnými nádorovými ochoreniami na 2 skupiny.
- prvú skupinu predstavujú vyliečení observovaní onkologickí pacienti v kompletnej remisii a jedinci po radikálnej operácii, u ktorých je pri liečbe VTE potrebné zohľadniť určité špecifiká systémovej terapie podávanej v adjuvantnej intencii (napr. trombocytopénia ako súčasť obrazu hematologickej toxicity niektorých cytostatík)
- druhú skupinu predstavujú jedinci s aktívnym (lokálne pokročilým alebo metastatickým) malígnym ochorením.
Účinnost a bezpečnosť LMWH vs warfarín
Priame porovnanie účinnosti a bezpečnosti LMWH s warfarínom u pacientov so zhubným nádorovým ochorením priniesli predovšetkým štúdie CLOT [18], LITE [20], CATCH [21], CANTHANOX [22] a ONCENOX [23].
Štúdia CLOT
Do štúdie CLOT [18] randomizovali pacientov so zhubným nádorovým ochorením a súčasne diagnostikovaným akútnym VTE do 2 ramien. Porovnávaná bola 6-mesačná liečba LMWH dalteparínom 200 IU/kg s.c. raz denne počas 1. mesiaca s následným 5-mesačným podávaním dalteparínu 150 IU/kg s.c. raz denne oproti konvenčnej terapii (kontrola) dalteparínom 200 IU/kg s.c. raz denne počas 5–7 dní s následným podávaním warfarínu p.o. do 6 mesiacov od začiatku liečby. Dalteparín v čase 6 mesiacov od začatia terapie signifikantne znížil výskyt recidív VTE (9 %) v porovnaní s kontrolou (17 %), a to bez významných rozdielov vo výskyte krvácavých komplikácií (14 % pri dalteparínu oproti 19 % pri kontrole), závažného krvácania (6 % pri dalteparínu oproti 4 % pri kontrole) a v celkovej mortalite (39 % pri dalteparíne oproti 41 % pri kontrole).
Dodatočná podskupinová analýza [19] jedincov bez metastatického postihnutia ukázala, že v čase 12 mesiacov od začatia liečby dalteparínom, to znamená 6 mesiacov od jej ukončenia, bola celková mortalita signifikantne nižšia v ramene liečenom LMWH (20 % pri dalteparíne oproti 36 % pri kontrole).
Štúdia LITE
Podobný dizajn ako štúdia CLOT mala aj štúdia LITE [20], v ktorej bola porovnávaná štandardná (konvenčná) liečba warfarínom s LMWH tinzaparínom (na Slovensku nedostupným) u pacientov s malígnym ochorením a súčasnou akútnou VTE. Tinzaparín signifikantne znížil výskyt recidív VTE (16 % pri warfaríne v porovnaní so 7 % pri tinzaparíne). Výskyt krvácavých komplikácií bol porovnateľný (27 % pri warfaríne a 24 % pri tinzaparíne), mortalita bola v čase 12 mesiacov od začatia liečby v oboch ramenách rovnaká (47 %).
Štúdia CATCH
V randomizovanej štúdii CATCH [21] porovnávali u pacientov so malignitami a VTE liečbu LMWH tinzaparínom (175 IU /kg raz denne) s konvenčnou terapiou (tinzaparín iniciálne s následnou liečbou warfarínom). Rozdiel vo výskyte recidív v čase 6 mesiacov od začatia terapie bol nevýznamný (7 % pri tinzaparíne oproti 11 % pri konvenčnej liečbe), rovnako ako aj rozdiely v mortalite a vo výskyte závažného krvácania.
Štúdia CANTHANOX
Štúdia CANTHANOX [22], ktorá bola pre pomalý nábor uzavretá predčasne, predstavovala porovnanie 3-mesačnej liečby VTE u pacientov so zhubnými nádorovými ochoreniami warfarínom s LMWH enoxaparínom 1,5 mg/kg s.c. V čase 3 mesiacov bol v enoxaparínovom a warfarínovom ramene porovnateľný výskyt recidív VTE.
Štúdia ONCENOX
Do štúdie ONCENOX [23] randomizovali chorých so zhubným nádorovým ochorením na liečbu enoxaprínom 1 mg/kg každých 12 hod s.c. počas 5 dní a následne enoxaparínom 1 mg/kg s.c. alebo 1,5 mg/kg s.c. raz denne alebo konvenčnú terapiu (enoxaparín 1 mg/kg každých 12 hod s.c. počas najmenej 5 dní a následne warfarín do 6 mesiacov). V čase 180 dní od randomizácie neboli rozdiely vo výskyte recidív VTE alebo krvácania medzi 2 ramenami signifikantné.
Metanalýza štúdií z Cochrane Database of Systematic Reviews
Počtom pacientov najväčšia metaanalýza [24] porovnávajúca účinnosť a bezpečnosť LMWH oproti warfarínu v liečbe VTE u pacientov so zhubným nádorovým ochorením potvrdila signifikantne menší výskyt recidív VTE pri terapii LMWH (HR 0,47), avšak bez vplyvu na prežívanie a bez rozdielov vo výskyte závažného krvácania a trombocytopénie [24].
Priame perorálne antikoagulanciá
Priame perorálne antikoagulanciá (NOAC) majú v porovnaní s warfarínom výhodu fixnej dennej dávky bez potreby pravidelného laboratórneho monitorovania, terapeutický účinok dosahujú do 4 hod od perorálneho podania. K nevýhodám patria podstatne menšie klinické skúsenosti s ich dlhodobým podávaním a početné liekové interakcie, zatiaľ v praxi chýbajúce antidotum priamych inhibítorov faktoru Xa (rivaroxaban, apixaban, edoxaban). Pre priamy inhibítor trombínu dabigatran existuje antidotum idarucizumab [25].
V post-hoc analýze [26] pacientov s VTE porovnávali priamy inhibítor faktoru Xa apixaban so štandardnou antikoagulačnou terapiou (iniciálne enoxaparín, následne warfarín). Medzi chorými s aktívnym zhubným nádorovým ochorením zistili porovnateľný výskyt recidív VTE (4 % pri apixabane a 6 % pri konvenčnej liečbe) a krvácavých komplikácií (2 % pri apixabane a 5 % pri konvenčnej liečbe). Porovnateľné boli výsledky aj v podskupinovej analýze pacientov s onkologickým ochorením v kompletnej remisii.
Štúdie RECOVER a EINSTEIN
Dve samostatné poolované analýzy pacientov s HVT liečených dabigatranom v štúdii RECOVER [27] a rivaroxabanom v štúdii EINSTEIN [28] hodnotili účinnosť a bezpečnosť priamych perorálnych antikoagulancií v porovnaní s warfarínom u jedincov s onkologickým ochorením. Výsledkom bol porovnateľný výskyt recidív VTE a krvácavých komplikácií v oboch ramenách. Vyšší výskyt recidív VTE a častejšie krvácavé komplikácie sa zaznamenali u chorých so zhubnými nádorovými ochoreniami liečenými priamymi perorálnymi antikoagulanciami pri porovnaní s neonkologickou populáciou.
Metanalýza štúdií evidovaných v MEDLINE, EMBASE a CENTRAL
Metaanalýza 6 štúdií, porovnávajúcich priame perorálne antikoagulanciá s konvenčnou terapiou (LMWH a následne warfarín) HVT u pacientov so zhubným nádorovým ochorením, potvrdila porovnateľný výskyt recidív VTE (3,9 % pri priamych perorálnych antikoagulanciách a 6 % pri konvenčnej liečbe) a závažného krvácania (3,2 % pri priamych perorálnych antikoagulanciách a 4,2 % pri konvenčnej liečbe) [29].
Účinnost a bezpečnosť NOAC vs warfarín
Výsledky dostupných štúdií síce naznačujú podobnú účinnosť a bezpečnosť priamych perorálnych antikoagulancií s warfarínom v liečbe VTE u pacientov s malígnymi ochoreniami, avšak ich interpretácia je problematická najmä z nasledujúcich dôvodov:
- všetky údaje pochádzajú alebo zo subanalýz štúdií, ktorých primárnym cieľom nebolo zhodnotiť bezpečnosť a účinnosť priamych inhibítorov trombínu, alebo priamych inhibítorov faktoru Xa v liečbe VTE u pacientov so zhubným nádorovým ochorením, resp. metaanalýz takýchto subanalýz
- do štúdií boli randomizovaní jedinci s anamnézou zhubného nádorového ochorenia v kompletnej remisii a chorí s malígnym ochorením po ukončení systémovej liečby s nízkym rizikom recidívy VTE
- do štúdií neboli zaraďovaní pacienti s aktívnym (lokálne pokročilým alebo metastatickým) onkologickým ochorením, ani jedinci liečení systémovou terapiou
- populácia onkologických pacientov v štúdiách bola heterogénna
- účinnosť a bezpečnosť priamych perorálnych antikoagulancií bola porovnávaná výlučne s warfarínom, ktorý u jedincov s aktívnym onkologickým ochorením nepovažujeme za liek prvej voľby pri VTE
Záver
Záverom uvádzame, že u pacientov s anamnézou onkologického ochorenia, ktoré je v kompletnej remisii, postupujeme v liečbe VTE rovnako ako u neonkologických chorých (bežná populácia).
U pacientov so zhubným nádorovým ochorením, ktorí dostávajú adjuvantnú liečbu, by sme mohli postupovať ako v prípade bežnej populácie, avšak je potrebné zohľadniť určité špecifiká zaisťovacej terapie. Relatívne najčastejšou toxicitou najmä cytostatickej liečby je hematologická toxicita vrátane trombocytopénie, pre ktorú v zásade nie je možné liečiť pacienta warfarínom ani priamymi perorálnymi antikoagulanciami, preto do skončenia adjuvantnej terapie preferujeme v liečbe VTE LMWH.
V prípade aktívneho (lokálne pokročilého a metastatického) onkologického ochorenia je pre liečbu VTE liekom prvej voľby LMWH v dĺžke 6 mesiacov. U jedincov so súčasnou renálnou insuficienciou je potrebné monitorovať terapeutické hladiny anti-Xa alebo zvážiť liečbu nefrakcionovaným heparínom, ktorý považujeme za liek druhej voľby. Nefrakcionovaný heparín možno použiť aj v prípade, že liečba LMWH nie je dostatočne účinná. Ak nie je možné v liečbe VTE u pacientov so zhubným nádorovým ochorením použiť heparíny, uprednostňujeme warfarín pred priamymi perorálnymi antikoagulanciami.
Pohled angiologa
Jana Hirmerová
Tromboembolická nemoc u onkologických pacientů
Riziko tromboembolické nemoci (TEN) u nemocných se zhoubnými nádory (ZN) je 4–7krát zvýšeno. Nejvyšší je v prvních 3 měsících po stanovení diagnózy ZN (až 53krát zvýšené), poté sice postupně klesá, ale dlouho setrvává na vyšší úrovni oproti pacientům neonkologickým, vyrovnává se až po 15 letech [30]. Incidence TEN v onkologii dokonce v posledních letech vzrostla. Souvisí to paradoxně s účinnější protinádorovou léčbou – nemocní přežívají déle a vyšší věk je rovněž rizikovým faktorem TEN; některé onkologické léky mají protrombotický efekt (viz s. 432n); pacienti mívají často dlouhodobě zavedený centrální žilní katétr; podíl na zvýšené incidenci mají nepochybně i dokonalejší diagnostické metody. Tromboembolické komplikace u pacienta s malignitou výrazně zhoršují jeho prognózu a představují druhou nejčastější příčinu úmrtí v onkologii [31]. Oproti pacientům neonkologickým mají pacienti se ZN vyšší riziko recidivy TEN, ale také vyšší riziko krvácení při antikoagulační léčbě [32,33].
Etiopatogeneze
Etiopatogeneze TEN u nemocných s malignitou je multifaktoriální, uplatňují se různé mechanické i humorální vlivy související s nádorovým onemocněním a zasahující do všech složek Virchowovy triády, např. snížená mobilita, útlak žil nádorem, poškození endotelu navozené chemoterapií či operací; hyperkogulační stav spojený s nádorovým onemocněním, vzniklý následkem aktivace koagulační kaskády, indukce zánětlivé reakce a inhibičního vlivu na fibrinolýzu.
Tromboembolické riziko u onkologického nemocného jednak souvisí s nádorovým onemocněním a jeho léčbou, jednak přímo s individuálními rizikovými faktory pacienta. Mezi ně patří věk ≥ 65 let, pohlaví (vyšší riziko u žen), obezita, některé komorbidity (renální insuficience, plicní onemocnění, neutropenie, infekce), imobilizace, přítomnost varikózních žil, pozitivní anamnéza předchozí TEN, pozitivní rodinná anamnéza TEN nebo hereditární trombofilie [34].
Diagnostika
Diagnostika a léčba TEN u onkologických nemocných má svá specifika. Např. využití D-dimer testu jako součásti diagnostických algoritmů při podezření na TEN je u pacientů s malignitou výrazně limitováno. U neonkologických nemocných D-dimer test vhledem ke své vysoké negativní prediktivní hodnotě umožní až u třetiny vyšetřovaných s podezřením na akutní TEN tuto diagnózu spolehlivě vyloučit, bez nutnosti použití dalších (zobrazovacích) metod. Sama přítomnost ZN však mnohdy vede k nespecifickému zvýšení hladiny D-dimeru. I u onkologických nemocných sice platí, že v případě nízké či střední klinické pravděpodobnosti TEN a zároveň negativního výsledku D-dimer testu je diagnóza TEN spolehlivě vyloučena, avšak negativní výsledek je u nich zjišťován jen v 10–15 % [35,36].
Klinická manifestace
Obvyklé klinické manifestace TEN jsou hluboká žilní trombóza (HŽT) na dolní končetině a/nebo plicní embolie (PE), u onkologických pacientů se však také setkáváme (častěji než u neonkologických) s dalšími projevy: s HŽT obou dolních končetin, s ileokavální lokalizací trombózy, s trombózou na horní končetině (díky častému použití centrálního žilního katétru), s trombózami v atypických lokalizacích, např. Buddův-Chiariho syndrom, trombóza portální či mezenterické žíly [31,37].
Historicky je známa i souvislost trombózy povrchových žil a malignity. Často citovaný Armand Trousseau před 150 lety sám u sebe diagnostikoval nádorové onemocnění na podkladě povrchové tromboflebitidy, jež se u něj objevila na horní končetině [34]. Asociaci trombózy povrchových žil a ZN sice v praxi pozorujeme, avšak přesných epidemiologických údajů není v literatuře k dispozici příliš mnoho. Byla popsána souvislost s tumory prsu, tlustého střeva, pankreatu, ovarií, kůže a s hematoonkologickými chorobami [38].
Léčba
Iniciální
K iniciální léčbě TEN u onkologických pacientů lze použít parenterální antitrombotické léky – heparin (unfractionated heparin – UFH), nízkomolekulární heparin (low molecular weight heparin – LMWH), případně fondaparinux. LMWH představuje atraktivnější variantu oproti UFH, umožňuje též ambulantní způsob léčby. Ten je u selektovaných onkologických pacientů použitelný, bezpečnost tohoto postupu byla dokumentována i v odborné literatuře [39]. Léčba LMWH se vyznačuje nižším rizikem vzniku heparinem indukované trombocytopenie (HIT), navíc byla u nemocných s malignitami zjištěna signifikantně nižší mortalita po užití LMWH ve srovnání s UFH. LMWH by tedy měl být preferovanou volbou, UFH je doporučován u nemocných se závažnou renální insuficiencí (clearance kreatininu < 30 ml/min) a fondaparinux se jeví jako vhodný v případě anamnézy HIT [40].
V nejzávažnějších případech TEN přichází v úvahu léčba trombolytická – systémová u plicní embolie (PE) s vysokým rizikem a lokální (katétrově řízená) v případě rozsáhlé (obvykle ileofemorální) HŽT. Ve většině studií s trombolytickou léčbou však byla přítomnost ZN vylučovacím kritériem. Úroveň důkazů pro použití trombolýzy u onkologických nemocných je tedy velmi nízká, k dispozici jsou jen výsledky z malých retrospektivních studií. Nelze však obecně kontraindikovat použití trombolýzy u pacienta se závažnou TEN jen na základě přítomnosti malignity. Je nutno se rozhodovat individuálně, trombolytická léčba je kontraindikována při postižení centrálního nervového systému a při jiných rizikových faktorech krvácení [40].
Dlouhodobá
Pro dlouhodobou léčbu TEN u onkologických pacientů je odbornými společnostmi doporučován LMWH, resp. LMWH je preferovanou volbou jak pro iniciální, tak i pro následnou léčbu TEN (1. měsíc v plné dávce adjustované dle váhy a poté v dávce redukované na 75–80 %). Někteří odborníci připouštějí i použití warfarinu s cílovým INR 2–3 [40–42]. Léčba warfarinem má však u nemocných se ZN celou řadu úskalí – je spojena s vyšším rizikem jak recidivy TEN, tak i závažného krvácení [33]. Naopak studie s LMWH u TEN v onkologii potvrdily lepší účinnost LMWH ve srovnání s warfarinem. Léčba LMWH navíc obvykle nevyžaduje laboratorní kontroly, umožňuje krátké přerušení v případě potřeby, nemá významnější interakce s jinými léky či s potravou. Nevýhodou LMWH je samozřejmě nutnost denních subkutánních injekcí a vyšší cena.
Nová (přímá) antikoagulancia
Nová (přímá) antikoagulancia (non vitamin K antagonist oral anticoagulants – NOAC) se jeví jako komfortnější alternativa antikoagulační léčby, o jejich podávání u onkologických nemocných s TEN je však zatím k dispozici relativně málo dat. Ve studiích s NOAC bylo zastoupeno jen 3–9 % procent pacientů s malignitami. Rizikem jsou i případné interakce NOAC s protinádorovými léky, neboť z těch jsou mnohé induktory či inhibitory enzymatického systému cytochromu P450 – formy CYP 3A4 nebo P-glykoproteinu (efluxní transmembránový transportér). Výraznější riziko interakcí hrozí např. po podání paklitaxelu, vinblastinu, vinkristinu, antracyklinů, prednisonu, cyklofosfamidu, bikalutamidu, inhibitorů tyrozinkinázy, cyklosporinu, tamoxifenu aj [43]. Dalším argumentem limitujícím v současné době užití NOAC v onkologii je fakt, že přímé srovnání NOAC s LMWH v léčbě TEN u nemocných se ZN nebylo provedeno, resp. studie takto zaměřené probíhají, ale dosud nebyly ukončeny a publikovány [44].
Optimální trvání léčby
Optimální trvání antikoagulační léčby u onkologických pacientů není jasně stanoveno, resp. jednoznačná data v tomto směru nejsou k dispozici. Doporučená minimální délka léčby by měla být 3–6 měsíců, další extenze je vhodná, trvá-li aktivita nádorového onemocnění nebo trvá-li protinádorová léčba. Rizikovým faktorem recidivy TEN je pokročilejší stadium ZN, přítomnost metastáz, pokračující chemoterapie nebo předchozí TEN v anamnéze [45]. Při prodloužení léčby nad 6 měsíců je volba antikoagulancia opět nejasná, resp. tato problematika je nedostatečně podložena daty z klinických studií. Lze pokračovat v LMWH nebo přejít na warfarin, je vhodné vzít v úvahu i preference pacienta a pravidelně přehodnocovat poměr riziko/prospěch.
Data z reálné praxe naznačují, že ve skutečnosti léčba neprobíhá vždy v souladu s odbornými doporučeními. To se týká zejména doporučené preference LMWH. Až 21 % pacientů LMWH vynechá pro nežádoucí účinky (diskomfort či lokální bolestivost v místě vpichu, tvorba hematomů, alergické reakce, ev. závažnější komplikace – HIT) [46]. Dlouhodobé podávání LMWH je potenciálně také spojeno s rizikem osteopenie či osteoporózy.
Léčba TEN při trombocytopenií
Poměrně častým problémem, vzniklým v souvislosti s nádorovým onemocněním či jeho léčbou je trombocytopenie. Navrhovaný algoritmus úpravy léčby TEN při této komplikaci je uveden ve schématu 1.
Schéma 1. Algoritmus úpravy léčby TEN u pacientů s trombocytopenií. 
LMWH – nízkomolekulární heparin TEN – tromboembolická nemoc Upraveno podle [35] Léčba TEN při renální insuficienci
U onkologických nemocných s TEN a s renální insuficiencí, resp. s kreatininovou clearance < 30 ml/min lze buď podávat LMWH s úpravou dávky podle laboratorních kontrol aktivity anti-Xa nebo zvolit léčbu warfarinem.
Strategie léčby při recidivě TEN
Nemocní, u nichž dojde k recidivě TEN navzdory antikoagulační léčbě, mají vysokou morbiditu i mortalitu [47]. Schéma 2 uvádí navrhované strategie v této situaci.
Schéma 2. Postup při selhání antikoagulační léčby v sekundární prevenci TEN u onkologických nemocných. 
LMWH – nízkomolekulární heparin TEN – tromboembolická nemoc Upraveno podle [35] Užití filtrů dolní duté žíly
Užití filtrů dolní duté žíly u onkologických pacientů je dokumentováno v literatuře spíše jen daty z retrospektivních monocentrických studií či z kazuistik. Akutní i následné komplikace implantace filtrů nejsou zanedbatelné. Obecně platí, že obdobně jako u nemocných bez ZN lze kavální filtr doporučit jen v případě akutní TEN a současně přítomné kontraindikace antikoagulační léčby, ev. při recidivě PE i přes dobře vedenou antikoagulační léčbu [40]. Nedávno publikovaná práce z jednoho amerického centra zaznamenala velmi častou implantaci filtrů u onkologických nemocných (ve 20 %), užití filtrů však nevedlo ke zlepšení přežití ani k redukci rizika recidivy PE, a navíc bylo spojeno s vyšším výskytem recidivy HŽT [48].
Incidentální plicní embolie
Paradoxním následkem dokonalejší péče o onkologické nemocné i dokonalejší zobrazovací techniky je častější výskyt incidentální PE, tj. náhodně diagnostikované – obvykle u pacienta vyšetřovaného výpočetní tomografií (CT) v rámci stagingu. Nemocný je obvykle asymptomatický či oligosymptomatický, příznaky se také mohou překrývat s projevy onkologického onemocnění. Bylo však prokázáno, že riziko recidivy, krvácivých komplikací, ale i mortalita jsou v těchto případech srovnatelné se stavem u onkologických pacientů se symptomatickou TEN [49]. Proto se doporučuje, pokud možno, léčit antikoagulačně i pacienty s incidentální PE. Spojená (poolovaná) analýza studií onkologických pacientů s incidentální PE dokumentovala dvojnásobnou redukci rizika recidivy TEN u pacientů léčených LMWH či antagonisty vitaminu K (VKA) oproti těm, kteří byli ponecháni bez léčby (nemocní léčení LMWH však měli 3krát méně závažného krvácení oproti léčeným VKA) [50].
Subsegmentální formy plicní embolie
Subsegmentální formy PE jsou méně rozsáhlé a méně závažné, u neonkologických pacientů je v některých doporučeních již uvedena možnost upřednostnit v těchto případech klinické sledování před antikoagulační léčbou [41]. Nicméně, nemocní se ZN mají i při PE v subsegmentální lokalizaci (dokonce i v případě incidentální subsegmentální PE) vyšší riziko recidivy, a proto se u nich spíše doporučuje antikoagulační léčba (nejsou-li kontraindikace) [50,51].
Distální (bércová) HŽT u onkologických pacientů
Distální (bércová) HŽT, podobně jako subsegmentální PE, je považována za méně závažnou formu TEN, ne vždy nutně vyžadující antikoagulační léčbu [41]. Přítomnost onkologického onemocnění či chemoterapie je však hodnocena jako významný rizikový faktor extenze trombózy či recidivy TEN, proto se doporučuje postupovat u onkologických pacientů stejně, jako by šlo o proximální trombózu, a podat plnou antikoagulační léčbu [52].
„Katétrová“ trombóza
Poměrně častou komplikací u onkologických pacientů je „katétrová“ trombóza na horní končetině. Její léčba opět není podložena přesvědčivými daty, doporučení spíše vychází z konsenzu odborníků. Diagnóza by měla být potvrzena ultrasonografickým vyšetřením a v případě postižení hlubokých žil (tj. axilární či subklaviální) se doporučuje antikoagulační léčba (LMWH či LMWH s přechodem na warfarin) po dobu alespoň 3 měsíců. Trombóza brachiálních žil, cefalické či bazilické žíly vyžaduje pečlivé klinické nebo ultrasonografické sledování, antikoagulační léčba není nezbytná. Odstranění katétru obvykle rovněž není nutné za předpokladu, že je nadále funkční a bez známek infekce [53].
Závěr
Pacienti s nádorovým onemocněním a TEN tvoří skupinu dosti specifickou a zároveň velmi heterogenní. Odborná doporučení se shodují v preferenci LMWH pro iniciální i následnou léčbu, resp. po dobu minimálně 3–6 měsíců. Extenze léčby je vhodná, trvá-li aktivita nádorového onemocnění nebo trvá-li protinádorová léčba, volba antikoagulancia je poté již méně jednoznačná. Pacientům lze změnit léčbu LMWH na léčbu warfarinem. Použití NOAC zatím v této skupině pacientů není příliš doporučováno, resp. není založeno na důkazech.
Specifický přístup (adjustaci dávky LMWH či změnu antikoagulancia) vyžadují pacienti s trombocytopenií, renální insuficiencí, s recidivou TEN vzniklou navzdory antikoagulační léčbě.
Kontroverzním tématem je léčba incidentální PE. Převládá však doporučení i tyto případy, pokud možno, antikoagulačně léčit.
Kavální filtr lze doporučit jen v případě akutní TEN a současně přítomné kontraindikace antikoagulační léčby, ev. při recidivě PE i přes dobře vedenou antikoagulační léčbu.
Přístup lékaře k onkologickému nemocnému s tromboembolickou komplikací by měl být individualizovaný. Vždy je nutno vzít v úvahu typ a aktivitu nádorového onemocnění, tolerabilitu léčby, poměr riziko/prospěch, prognózu pacienta, kvalitu jeho života i jeho vlastní preference.
doc. MUDr. Jana Hirmerová, Ph.D.
hirmerova@fnplzen.cz
II. interní klinika LF UK a FN Plzeň
www.fnplzen.cz
Doručeno do redakce 2. 5. 2017
Přijato po recenzi 16. 6. 2017
Sources
1. Horsted F, West J, Grainge MJ. Risk of venous thromboembolism in patients with cancer: A systematic review and meta-analysis. PLoS Med 2012; 9(7): e1001275. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pmed.1001275>.
2. Kasthuri RS, Taubman MB, Mackman N. Role of tissue factor in cancer. J Clin Oncol 2009; 27(29): 4834–4838. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2009.22.6324>.
3. Gordon SG, Franks JJ, Lewis B. Cancer procoagulant A: a factor X activating procoagulant from malignant tissue. Thromb Res 1975; 6(2): 127–137.
4. Zwicker JI, Liebman HA, Neuberg D et al. Tumor-derived tissue factor-bearing microparticles are associated with venous thromboembolic events in malignancy. Clin Cancer Res 2009; 15(22): 6830–6840. Dostupné z DOI: <http://dx.doi.org/10.1158/1078–0432.CCR-09–0371>.
5. Hedderich, GS, O‘Connor RJ, Reid EC et al. Caval tumor thrombus complicating renal cell carcinoma: a surgical challenge. Surgery 1987; 102(4): 614–621.
6. Amir E, Seruga B, Niraula S et al. Toxicity of adjuvant endocrine therapy in postmenopausal breast cancer patients: a systematic review and meta-analysis. J Natl Cancer Inst 2011; 103(17): 1299–1309. Dostupné z DOI: <http://dx.doi.org/10.1093/jnci/djr242>.
7. Thürlimann B, Castiglione M, Hsu-Schmitz SF et al. Formestane versus megestrol acetate in postmenopausal breast cancer patients after failure of tamoxifen: a phase III prospective randomised cross over trial of second-line hormonal treatment (SAKK 20/90). Swiss Group for Clinical Cancer Research (SAKK). Eur J Cancer 1997; 33(7): 1017–1024.
8. Seng S, Liu Z, Chiu SK et al. Risk of venous thromboembolism in patients with cancer treated with cisplatin: a systematic review and meta-analysis. J Clin Oncol 2012; 30(35): 4416–4426. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2012.42.4358>.
9. Grace RF, Dahlberg SE, Neuberg D et al. The frequency and management of asparaginase-related thrombosis in paediatric and adult patients with acute lymphoblastic leukaemia treated on Dana-Farber Cancer Institute consortium protocols. Br J Haematol 2011; 152(4): 452–459. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2010.08524.x>.
10. Nalluri SR, Chu D, Keresztes R et al. Risk of venous thromboembolism with the angiogenesis inhibitor bevacizumab in cancer patients: a meta-analysis. JAMA 2008; 300(19): 2277–2285. Dostupné z DOI: <http://dx.doi.org10.1001/jama.2008.656>.
11. Scappaticci FA, Skillings JR, Holden SN et al. Arterial thromboembolic events in patients with metastatic carcinoma treated with chemotherapy and bevacizumab. J Natl Cancer Inst 2007; 99(16): 1232–1239. Erratum in J Natl Cancer Inst 2008; 100(2): 156. J Natl Cancer Inst 2008; 100(9): 685.
12. Hurwitz HI, Saltz LB, Van Cutsem E et al. Venous thromboembolic events with chemotherapy plus bevacizumab: a pooled analysis of patients in randomized phase II and III studies. J Clin Oncol 2011; 29(13): 1757–1764. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2010.32.3220>.
13. Van Cutsem E, Tabernero J, Lakomy R et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012; 30(28): 3499–3506.
14. Petrelli F, Cabiddu M, Borgonovo K et al. Risk of venous and arterial thromboembolic events associated with anti-EGFR agents: a meta-analysis of randomized clinical trials. Ann Oncol 2012; 23(7): 1672–1679. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mdr592>
15. Miroddi M, Sterrantino C, Simmonds M et al. Systematic review and meta-analysis of the risk of severe and life-threatening thromboembolism in cancer patients receiving anti-EGFR monoclonal antibodies (cetuximab or panitumumab). Int J Cancer 2016; 139(10): 2370–2380. Dostupné z DOI: <http://dx.doi.org/10.1002/ijc.30280>.
16. Palumbo A, Rajkumar SV, Dimopoulos MA et al. Prevention of thalidomide - and lenalidomide-associated thrombosis in myeloma. Leukemia 2008; 22(2): 414–423.
17. Tonia T, Mettler A, Robert N et al. Erythropoietin or darbepoetin for patients with cancer. Cochrane Database Syst Rev 2012; 12: CD003407. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD003407.pub5>.
18. Lee AY, Levine MN, Baker RI et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. N Engl J Med 2003; 349(2): 146–153
19. Lee AY, Rickles FR, Julian JA et al. Randomized comparison of low molecular weight heparin and coumarin derivatives on the survival of patients with cancer and venous thromboembolism. J Clin Oncol 2005; 23(10): 2123–2129.
20. Hull RD, Pineo GF, Brant RF et al. Long-term low-molecular-weight heparin versus usual care in proximal-vein thrombosis patients with cancer. Am J Med 2006; 119(12): 1062–1072.
21. Lee AY, Kamphuisen PW, Meyer G et al. Tinzaparin vs Warfarin for Treatment of Acute Venous Thromboembolism in Patients With Active Cancer: A Randomized Clinical Trial. JAMA 2015; 314(7): 677–686. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2015.9243>.
22. Meyer G, Marjanovic Z, Valcke J et al. Comparison of low-molecular-weight heparin and warfarin for the secondary prevention of venous thromboembolism in patients with cancer: a randomized controlled study. Arch Intern Med 2002; 162(15): 1729–1735.
23. Deitcher SR, Kessler CM, Merli G et al. Secondary prevention of venous thromboembolic events in patients with active cancer: enoxaparin alone versus initial enoxaparin followed by warfarin for a 180-day period. Clin Appl Thromb Hemost 2006; 12(4): 389–396.
24. Akl EA, Kahale L, Barba M et al. Anticoagulation for the long-term treatment of venous thromboembolism in patients with cancer. Cochrane Database Syst Rev 2014; (7): CD006650. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD006650.pub4>.
25. Pollack jr. CV, Reilly PA, Eikelboom J et al. Idarucizubam fo dabigatran reversal. N Engl J Med 2015; 373(6): 511–520. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1502000>.
26. Agnelli G, Buller HR, Cohen A et al. Oral apixaban for the treatment of venous thromboembolism in cancer patients: results from the AMPLIFY trial. J Thromb Haemost 2015; 13(12): 2187–2191. Dostupné z DOI: <http://dx.doi.org/10.1111/jth.13153>.
27. Schulman S, Goldhaber SZ, Kearon C et al. Treatment with dabigatran or warfarin in patients with venous thromboembolism and cancer. Thromb Haemost 2015; 114(1): 150–157. Dostupné z DOI: <http://dx.doi.org/10.1160/TH14–11–0977>.
28. Prins MH, Lensing AW, Bauersachs R et al. Oral rivaroxaban versus standard therapy for the treatment of symptomatic venous thromboembolism: a pooled analysis of the EINSTEIN-DVT and PE randomized studies. Thromb J 2013; 11(1): 21. Dostupné z DOI: <http://dx.doi.org/10.1186/1477–9560–11–21>.
29. Vedovati MC, Germini F, Agnelli G et al. Direct oral anticoagulants in patients with VTE and cancer: a systematic review and meta-analysis. Chest 2015; 147(2): 475–483. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.14–0402>.
30. Blom JW, Doggen CJ, Osanto S et al. Malignancies, prothrombotic mutations, and the risk of venous thrombosis. JAMA 2005; 293(6): 715–722.
31. Timp JF, Braekkan SK, Versteeg HH et al. Epidemiology of cancer-associated venous thrombosis. Blood 2013; 122(10): 1712–1723. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2013–04–460121>.
32. Gussoni G, Frasson S, La Regina M et al. Three-month mortality rate and clinical predictors in patients with venous thromboembolism and cancer. Findings from the RIETE registry. Thromb Res 2013; 131(1): 24–30. Dostupné z DOI: <http://dx.doi.org/10.1016/j.thromres.2012.10.007>.
33. Prandoni P, Lensing AW, Piccioli A et al. Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis. Blood 2002; 100(10): 3484–3488.
34. Ay C, Pabinger I, Cohen AT. Cancer-associated venous thromboembolism: Burden, mechanisms, and management. Thromb Haemost 2017; 117(2): 219–230. Dostupné z DOI: <http://dx.doi.orG/10.1160/TH16–08–0615>.
35. Righini M, Le Gal G, De Lucia S et al. Clinical usefulness of D-dimer testing in cancer patients with suspected pulmonary embolism. Thromb Haemost 2006; 95(4): 715–719.
36. Carrier M, Lee AY, Bates SM et al. Accuracy and usefulness of a clinical prediction rule and D-dimer testing in excluding deep vein thrombosis in cancer patients. Thromb Res 2008; 123(1): 177–183. Dostupné z DOI: <http://dx.doi.org/10.1016/j.thromres.2008.05.002>.
37. Cosmi B, Filippini M, Tonti D et al. A randomized double-blind study of low-molecular-weight heparin (parnaparin) for superficial vein thrombosis: STEFLUX (Superficial ThromboEmbolism and Fluxum). J Thromb Haemost 2012; 10(6): 1026–1035. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1538–7836.2012.04727.x>.
38. Mouton WG, Kienle Y, Muggli B et al. Tumors associated with superficial thrombophlebitis. Vasa 2009; 38(2): 167–170. Dostupné z DOI: <http://dx.doi.org/10.1024/0301–1526.38.2.167>.
39. Ageno W, Grimwood R, Limbiati S et al. Home-treatment of deep vein thrombosis in patients with cancer. Haematologica 2005; 90(2): 220–224.
40. Lee AY, Peterson EA. Treatment of cancer-associated thrombosis. Blood 2013; 122(14): 2310–2317. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2013–04–460162>.
41. Kearon C, Akl EA, Ornelas J et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest 2016; 149(2): 315–352. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chest.2015.11.026>.
42. Kessler P. Prophylaxis and treatment of thromboembolism in oncology. Vnitř Lék 2009; 55(3): 219–222.
43. Short NJ, Connors JM. New Oral Anticoagulants and the Cancer Patient. Oncologist 2014; 19(1): 82–93. Dostupné z DOI: <http://dx.doi.org/10.1634/theoncologist.2013–0239>.
44. Sardar P, Chatterjee S, Herzog E et al. New oral anticoagulants in patients with cancer: current state of evidence. Am J Ther 2015; 22(6): 460–468. Dostupné z DOI: <http://dx.doi.org/10.1097/MJT.0000000000000055>.
45. Louzada ML, Carrier M, Lazo-Langner A et al. Development of a clinical prediction rule for risk stratification of recurrent venous thromboembolism in patients with cancer-associated venous thromboembolism. Circulation 2012; 126(4): 448–454. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.111.051920>.
46. van der Wall SJ, Klok FA, den Exter PL et al. Continuation of low-molecular-weight heparin treatment for cancer-related venous thromboembolism: a prospective cohort study in daily clinical practice. J Thromb Haemost 2017; 15(1): 74–79. Dostupné z DOI: <http://dx.doi.org/10.1111/jth.13563>.
47. Schulman S, Zondag M, Linkins L et al. Recurrent venous thromboembolism in anticoagulated patients with cancer: management and short-term prognosis. J Thromb Haemost 2015; 13(6): 1010–1018. Dostupné z DOI: <http://dx.doi.org/10.1111/jth.12955>.
48. Brunson A, Ho G, White R et al. Inferior vena cava filters in patients with cancer and venous thromboembolism (VTE) does not improve clinical outcomes: A population-based study. Thromb Res 2017; 153 : 57–64. Dostupné z DOI: <http://dx.doi.org/10.1016/j.thromres.2017.03.012>.
49. den Exter PL, Hooijer J, Dekkers OM et al. Risk of recurrent venous thromboembolism and mortality in patients with cancer incidentally diagnosed with pulmonary embolism: a comparison with symptomatic patients. J Clin Oncol 2011; 29(17): 2405–2409. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2010.34.0984>.
50. van der Hulle T, den Exter PL, Planquette B et al. Risk of recurrent venous thromboembolism and major hemorrhage in cancer-associated incidental pulmonary embolism among treated and untreated patients: a pooled analysis of 926 patients. J Thromb Haemost 2016; 14(1): 105–113. Dostupné z DOI: <http://dx.doi.org/10.1111/jth.13172>.
51. O‘Connell C. How I treat incidental pulmonary embolism. Blood 2015; 125(12): 1877–1882. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2014–08–551879>.
52. Palareti G How I treat isolated distal deep vein thrombosis (IDDVT). Blood 2014; 123(12): 1802–1809. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2013–10–512616>.
53. Carrier M, Lazo-Langner A, Shivakumar S et al. Clinical challenges in patients with cancer-associated thrombosis: Canadian expert consensus recommendations. Curr Oncol 2015; 22(1): 49–59. Dostupné z DOI: <http://dx.doi.org/10.3747/co.22.2392>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 6-
All articles in this issue
- Risk factors for cardiovascular diseases in the descendants of patients after early myocardial infarction
- “Snags” connected with establishing the vitamin D
- Clinical study FOURIER
- Primary testicular lymphoma
- Rivaroxaban in high-risk patients
- Two perspectives on venous thromboembolism in oncology
- Insulin pump in type 2 diabetes: B-cell focused treatment
- Predictors of quality of life in Czech female breast cancer survivors following treatment with special interest to coping strategies
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Primary testicular lymphoma
- Insulin pump in type 2 diabetes: B-cell focused treatment
- “Snags” connected with establishing the vitamin D
- Two perspectives on venous thromboembolism in oncology
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

