-
Medical journals
- Career
Kardiovaskulární komplikace nádorů a jejich léčby
Authors: Jiří Vyskočil 1,2; Katarína Petráková 3; Petr Jelínek 1; Michal Furdek 1,2
Authors‘ workplace: Oddělení anesteziologie a resuscitace/jednotka intenzivní péče MOÚ, Brno 1; Interní ambulance MOÚ, Brno 2; Klinika komplexní onkologické péče LF MU a MOÚ, Brno 3
Published in: Vnitř Lék 2017; 63(3): 200-209
Category: Reviews
Overview
Incidence zhoubných novotvarů v populaci stále narůstá a odhaduje se že, každý třetí člověk onemocní nějakou formou rakoviny. S narůstajícím věkem populace přibývá malignit mezi seniory, což s sebou přináší nové výzvy, zvláště s ohledem na vyšší incidence kardiovaskulárních onemocnění (KVO) u této populace pacientů. Zároveň se zlepšují léčebné možnosti a prodlužuje se celkové přežívání pacientů a rakovina se stává v mnoha případech chronickým onemocněním. Častěji se budeme setkávat s pacienty, u kterých v důsledku protinádorové léčby dochází k rozvoji nového KVO nebo ke zhoršení stávajícího onemocnění. Mezi kardiovaskulární komplikace samotných nádorů můžeme řadit lokální mechanické působení nádorů v mediastinu (útlak, výpotky), zvýšené riziko tromboembolické nemoci (TEN), arytmie či např. tzv. karcinoidové srdce. Kardiotoxicita medikamentózní léčby nádorů se projevuje velmi rozmanitě. Nejobávanějším projevem je rozvoj chronického srdečního selhání (CHSS), ať již přímým vlivem antracyklinů či antiHER2 terapie, nebo jako důsledek jiných negativních vlivů terapie na kardiovaskulární aparát. Mezi významné rizikové faktory kardiotoxicity patří léčbou indukovaná či akcelerovaná arteriální hypertenze (AH). Mezi léky, které mohou vést k rozvoji/akceleraci AH, patří inhibitory angiogeneze (bevacizumab, aflibercept, ramucirumab, multikinázové inhibitory) i klasická cytostatika (alkylační cytostatika, cisplatina). Dále negativně působí kortikoidy a některá analgetika. Mezi další rizikové faktory CHSS patří fibrilace síní (AF) jako projev nejčastější arytmie u onkologických pacientů. K rozvoji AF přispívá sekundární ischemie myokardu při anémii, metabolické odchylky způsobené vlastním onemocněním či léčbou, tromboembolická nemoc a uplatňuje se i přímé kardiotoxické působení onkologické léčby (cisplatina, ifosfamid, taxany, gemcitabin, 5-fluorouracil, etoposid). V neposlední řadě se na rozvoji CHSS podílí i ischemická choroba srdce, která je závažnou pozdní komplikací týkající se zvláště dlouhodobě přežívajících pacientů s nádory typickými pro mladší věk (nádory varlat, nádory dětského věku, hematologické malignity) nebo i pacientek po léčbě karcinomu prsu. K rozvoji ICHS přispívá i radioterapie nebo rozvoj dyslipidemie u pacientek na terapii inhibitory aromatáz nebo alkylačními cytostatiky navozená endotelová dysfunkce. Pacienti dlouhodobě přežívající onkologické onemocnění jsou významnou rizikovou skupinou pro rozvoj kardiovaskulárních onemocnění. Je třeba myslet na to, že k rozvoji „typických“ KVO může docházet ve výrazně mladším věku ve srovnání s normální populací a u vysoce rizikových pacientů je nutné KVO aktivně vyhledávat.
Klíčová slova:
antracykliny – fibrilace síní – ICHS – kardiotoxicita – srdeční selhání – TENTromboembolická nemoc
Vztah mezi nádory a tromboembolickou nemocí (TEN) je dobře znám mnoho let. Trousseau byl první, kdo popsal vztah mezi nádorem a rozvojem flebotrombózy a rekurentní migrující tromboflebitidy [1]. Celkově se odhaduje, že pacienti s nádory mají riziko rozvoje TEN ve srovnání se zdravou populací zvýšeno 6–7krát. Jako nejrizikovější se jeví některé hematologické malignity, u nichž může být riziko zvýšeno až 28krát. V rámci solidních nádorů jsou nejrizikovější nádory pankreatobiliárního původu, nádory mozku, vaječníků, žaludku; přičemž pacienti s metastatickým onemocněním mají až 20krát větší pravděpodobnost rozvoje TEN ve srovnání s pacienty s lokalizovaným onemocněním [2,3], což je jen potvrzeno až 50% záchytem TEN v pitevních souborech.
Patofyziologie TEN u onkologických pacientů je velmi komplexní. Uplatňuje se jak přímé působení nádorů na koagulační kaskádu, tak i vlivy nepřímé. U nádorů (stejně jako u sepse) dochází k uvolňování tkáňového faktoru (TF) do intravaskulárního kompartmentu. Exprese TF nádory má řadu konsekvencí. Za prvé, komplex TF faktor VIIa, spolu s povrchovými membránovými integriny, spouští signalizaci cestou interakcí mezi proteázami aktivovaným rozštěpením receptoru 2 a fosforylací TF cytoplazmatické domény a tato signální dráha aktivuje angiogenezi a nádorový růst. Za druhé, TF faktor VIIa přímo aktivuje koagulaci štěpením a aktivací faktoru X. Nádorové buňky, zvláště epiteliálního původu, mohou spontánně uvolňovat drobné (0,1–1 μm) TF vázající mikročástice. Tyto mikročástice neexprimují pouze TF, ale také negativně nabité fosfolipidy včetně fosfatidylserinu. Nádorové buňky také na svém povrchu exprimují enzymy, které jsou schopny přímo ovlivňovat prokoagulační a fibrinolytické mechanizmy. Cancer procoagulans je cysteinová proteáza exprimovaná na povrchu mnoha nádorů, která přímo aktivuje faktor X. Nádorové buňky také exprimují aktivátor tkáňového plazminogenu a jeho inhibitory I a II. Z nepřímých vlivů nádoru na koagulaci je potřeba zmínit zvýšené formování tzv. NETS (Neutrophil Extracellular Traps). NETS jsou extracelulární vlákna vypuštěna po degranulaci neutrofilů jako reakce na prozánětlivé stimuly (IL1,TNFα) a jsou tvořena matrix granul a jaderných částic, včetně DNA a histonů. NETS se podílejí na baktericidním účinku neutrofilů, ale také přímo ovlivňují prokoagulační mechanizmy vazbou a aktivací trombocytů. Riziko dále zvyšuje kromě chirurgické léčby i chemoterapie (s relativním rizikem 2,2), hormonální terapie (tamoxifen, progesteron), antiangiogenní terapie (talidomid a lenalidomid u mnohočetného myelomu, bevacizumab a tyrozinkinázové inhibitory u mnohých solidních nádorů), přítomnost centrálních žilních katétrů či konkomitantní aplikace erytropoetinů [2,3,6–10].
V rámci diagnostiky TEN je potřeba zdůraznit, že testování D-dimerů není pro nízkou specificitu u onkologických pacientů doporučováno a stejně tak prediktivní modely (Wellsův model) nelze zatím na tuto populaci pacientů aplikovat [11].
Vzhledem k vysokému riziku TEN u onkologických pacientů je doporučeno u hospitalizovaných pacientů s aktivním onemocněním či podezřením na malignitu zahájit profylaktickou aplikaci nízkomolekulárním heparinem (low-molecular-weight heparin – LMWH), např. enoxaparinem, dalteparinem, nandroparinem. V případě kontraindikace se doporučuje zajistit alespoň mechanickou profylaxi (pneumatické bandáže, kompresní punčochy). V případě potvrzené flebotrombózy u pacientů s absolutní kontraindikací k antikoagulační terapii je doporučeno zvážit zavedení dočasného kaválního filtru k prevenci masivní plicní embolie. Profylaktická aplikace LMWH u ambulantních pacientů až na výjimky (např. pacienti s mnohočetným myelomem na terapii s lenalidomidem) se nedoporučuje [11].
V léčbě TEN u onkologických pacientů je třeba vzít v úvahu prognózu pacienta, rozsah onemocnění a vysoké riziko intervenčních zákroků (kanylace, evakuace výpotků, urgentní operace atd). Při absenci kontraindikací se doporučuje okamžité zahájení aplikace heparinu, LMWH či fondaparinuxu u všech pacientů. S ohledem na vysokou incidenci TEN je vhodné zahájit terapii již při vyslovení podezření na TEN. Indikace k trombolytické léčbě se neodlišují od standardních doporučení a je třeba přísně sledovat kontraindikace (tab. 1).
Table 1. Kontraindikace k trombolýze. Upraveno podle [13] ![Kontraindikace k trombolýze. Upraveno podle [13]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e6989ddc3d0ee60fb68ee5c368f46191.png)
Léčba terapeutickými dávkami LMWH/heparinu/fondaparinuxu by měla trvat 5–7 dní s následným možným převedením pacientů na warfarin, respektive ponecháním LMWH v redukované dávce na 75 % [12]. Při warfarinizaci je třeba vzít v potaz celkový rozsah onemocnění a léčbu, neboť ne vždy je snadné udržet INR v požadovaném rozmezí 2–3, ať již vlivem lékových interakcí či nežádoucích účinků (nevolnost, zvracení, omezený příjem potravy). U onkologických pacientů je antikoagulační terapie doživotní u pacientů s aktivním onemocněním, nebo po dobu onkologické léčby, nebo pokud přetrvávají rizikové faktory (imobilizace, lymfedém). Zvláštní kapitolu tvoří flebotrombózy asociované s centrálními žilními vstupy. U těchto pacientů je vhodné katétr ponechat in situ (pokud nejsou známky infekce a katétr je používán a funkční). Pokud je rozhodnuto o extrakci katétru, doporučuje se před extrakcí terapie LMWH po dobu 5–7 dní jako prevence uvolnění trombu a následná terapie po dobu 3 měsíců. Takzvaná NOACs, nová perorální antikoagulancia (dabigatran, apixaban, rivaroxaban, edoxaban), zatím nejsou u onkologických pacientů doporučena, neboť schází dostatečná data o účinnosti a bezpečnosti [11]. Doufejme, že probíhající studie potvrdí předběžné pozitivní výsledky a NOACs se prosadí i v léčbě onkologických pacientů.
Karcinoidové srdce
Postižení srdce u pacientů s neuroendokrinními nádory (dříve karcinoidy) je poměrně vzácnou, ale zajímavou a důležitou komplikací ovlivňující funkčnost trikuspidální a pulmonální chlopně vedoucí k významné morbiditě a mortalitě způsobené pravostranným srdečním selháním [14]. Karcinoid je dnes již zastaralé označení pro neuroendokrinní nádory (neuroendocrine tumor – NET), většinou dobře a středně diferencované produkující vazoaktivní substance (serotonin, histamin, vazoaktivní intestinální peptid, prostaglandiny a jiné). Jedná se o skupinu vzácných nádorů, jejichž charakteristickou vlastností je právě endokrinní diferenciace a produkce biologicky aktivních látek. Incidence NET je asi 2–3 případy na 100 000 obyvatel, přičemž tzv. karcinoidů je diagnostikováno v ČR asi 200 případů ročně [15]. Většina (asi 90 %) těchto nádorů vychází z gastrointestinálního traktu (ileum, appendix), dále bývají postiženy plíce či gonády. Metastatické formy těchto nádorů, které si ponechaly sekreční schopnost, způsobují tzv. karcinoidový syndrom (flushing – zarudnutí obličeje, průjmy, bronchokonstrikce, hypotenze, tachykardie) vyvolaný nadprodukcí dominantně serotoninu, který není dostatečně odbouráván játry. Velmi závažná je potom tzv. karcinoidová krize, což je vystupňování příznaků karcinoidového syndromu vyžadující většinou hospitalizaci na jednotkách intenzivní péče. V terapii karcinoidové krize je zásadní intravenózní aplikace analog somatostatinu, dostatečná hydratace, ev. je nutno použít bronchodilatancia a kortikosteroidy. Je potřeba uvést, že aplikace katecholaminů v terapii karcinoidové krize je spíše kontraproduktivní, protože jen prohlubují účinky serotoninu.
K rozvoji karcinoidového srdce dochází u 50 % pacientů s karcinoidovým syndromem, kteří mají zároveň metastatické postižení jater, protože serotonin a jiné vazoaktivní substance tak uniknou eliminaci játry. V patofyziologii se předpokládá serotoninem nastartovaná kaskáda vedoucí k rozvoji fibrózních depozit v endokardu. Typickým patologickým nálezem jsou tak endokardiální fibrózní plaky, které zahrnují trikuspidální a pulmonální chlopně, pravostranné srdeční oddíly, dolní dutou žílu, plicní arterii a koronární sinus. Postižení chlopní fibrózními plaky pak vede ke stenotizaci, regurgitaci či obojímu. Přednostní postižení pravostranných srdečních oddílů je vysvětlováno inaktivaci vazoaktivních substancí plicní tkání, proto je v případě vzácného levostranného postižení (5–10 %) potřeba vyloučit foramen ovale patens (může být ale i u masivních karcinoidů plic či extenzivního postižení jaterních parenchymu metastatickým procesem). Pacienti s rozvinutým karcinoidovým srdcem dosahují 3letého přežití asi v 31 %, 97 % pacientů má postižení trikuspidální chlopně, z toho 90 % středně těžkou až těžkou regurgitaci, naproti tomu 88 % pacientů má postižení pulmonální chlopně, z toho 81 % má regurgitaci a 51 % stenózu.
V rámci diagnostiky je potřeba hlavně na tuto závažnou komplikaci myslet, proto NCCN (National Cancer Comprehensive Network) doporučuje kardiologické vyšetření každé 2–3 roky u pacientů s karcinoidy [16]. Klinicky je u pacientů s karcinoidovým srdcem vždy přítomen karcinoidový syndrom, poslechově slyšíme prekordiální šelest a stav může progredovat do pravostranného srdečního selhání, na EKG můžeme pozorovat P pulmonale, známky bloku pravého raménka Tawarova, sinusovou tachykardii či nespecifické ST-T změny. Zásadní pro diagnostiku je tak echokardiografické vyšetření, které nejčastěji zachytí dilataci pravostranných srdečních oddílů s trikuspidální respektive pulmonální regurgitací.
V terapii pacientů s karcinoidovým srdcem se uplatňuje kauzální onkologická léčba (analoga somatostatinu) a standardní internistická léčba pravostranného srdečního selhání. V případě přistoupení k chirurgické léčbě se preferuje výměna chlopně nad valvuloplastikou právě pro přetrvávající vliv vazoaktivních aminů na srdeční aparát. Pacienti s karcinoidovým srdcem umírají častěji v důsledku pravostranného srdečního selhání než v důsledku progrese základního onemocnění, proto je třeba o kardiochirurgické intervenci zvažovat u všech pacientů [17].
Arteriální hypertenze
Arteriální hypertenze (AH) je nejčastější interní komorbiditou onkologických pacientů (incidence 37 % vs 30–45 % v běžné populaci) [18]. Jako taková je významným rizikovým faktorem, který je třeba zohlednit u pacientů, kteří podstupují potenciální kardiotoxickou léčbu (typicky chemoterapie s antracykliny nebo antiHER2 terapie), protože AH vedle věku, diabetes mellitus, obezity či ICHS představuje významný rizikový faktor pro trvalé poškození srdce onkologickou léčbou [19].
Arteriální hypertenze ovšem nepředstavuje jen onemocnění, které si sebou pacient přináší. K rozvoji hypertenze či její významné akceleraci dochází i v průběhu onkologické léčby (tab. 2).
Table 2. Etiologie arteriální hypertenze 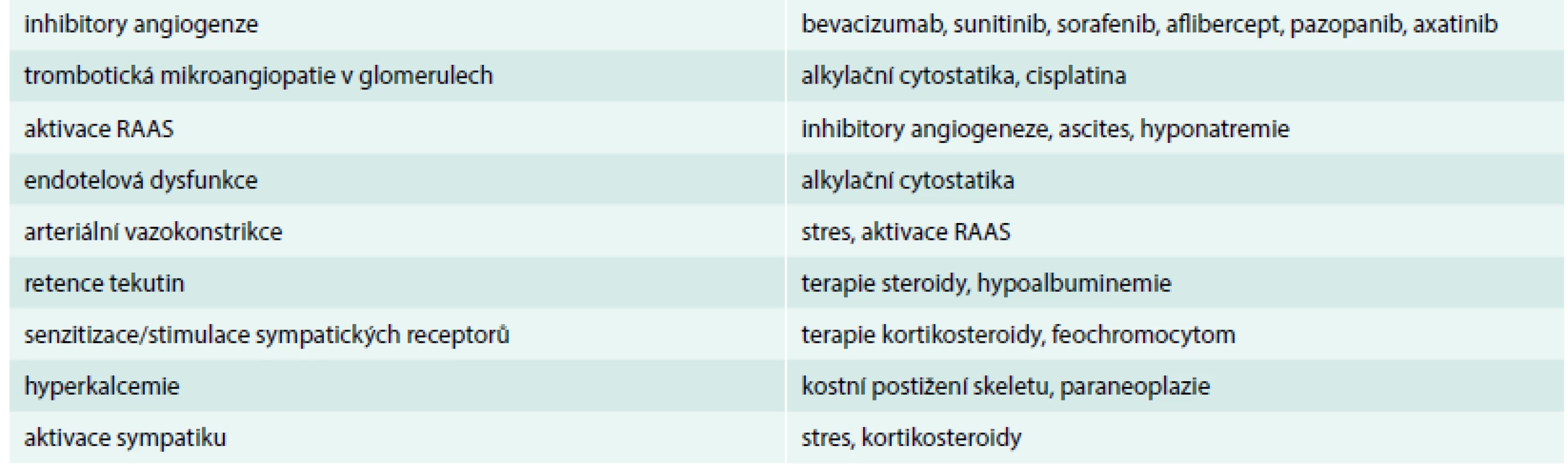
Na akceleraci AH se podílí celá řada faktorů. Důležitou úlohu jistě hraje psychická zátěž, kterou je onkologické onemocnění a jeho léčba. Indukce AH je typickým nežádoucím účinkem antiangiogenní terapie (bevacizumab, aflibercept, ramucirumab), která se stále více prosazuje v systémové léčbě onkologických pacientů (karcinomy GIT, ovariální, plicní, cervikální, prsu) [20]. Antiangiogenní léčba je v podstatě základem terapie metastatického karcinomu ledvin (multikinázové inhibitory jako sunutinib, sorafenib, pazopanib, axitinib), u kterého je ještě situace komplikována operačními zákroky na ledvinách ať již ve smyslu parciální resekce či nefrektomie. U antiangiogenní terapie se předpokládá aktivace RAAS kaskády společně s rozvojem trombotické mikroangiopatie v glomerulech. Důležitou roli hraje v rozvoji AH i endotelová dysfunkce a následná snížená produkce NO, ke které přispívá aplikace chemoterapie s alkylačními cytostatiky či radioterapie. Onkologičtí pacienti jsou dále často léčeni hypertenzi indukujícími kortikosteroidy, ať již jako součástí chemoterapeutických režimů (hematologické malignity), jako součást antiemetické premedikace před chemoterapií (režimy s antracykliny, platinovými deriváty, alkylačními cytostatiky) či jako prevence toxoalergických reakcí (před taxany, pemetrexedem) nebo jako důležitá součást symptomatické terapie. K retenci tekutin dochází také u pacientů, kteří užívají v rámci analgoterapie pravidelně nesteroidní protizánětlivé léky (NSAID) [20–22].
Neléčená či akcelerovaná arteriální hypertenze výrazně komplikuje zahájení či pokračování systémové onkologické léčby a pacienti proto v konečném důsledku mohou mít zbytečně zkrácené OS (overall survival – celkové přežití) či PFS (progression free survival – přežití bez progrese), což se týká hlavně pacientů, u nichž je antiangiogenní terapie zásadní (viz výše). Proto je třeba u pacientů před zahájením rizikové, zejména antiangiogenní terapie dobře kontrolovat aktuální stav arteriální hypertenze (TK < 140/90 mm Hg) a všechny tyto pacienty pravidelně monitorovat a včas zahájit antihypertenzní terapii. Doporučujeme týdenní kontroly krevního tlaku při první sérii léčby. Pokud jsou hodnoty TK v normě, postačuje dále měření TK lékařem po 2–3 týdnech při zahájení každé další série terapie. U rizikových pacientů (ICHS, diabetes mellitus, CHSS apod) je vhodné denní měření TK pacientem doma. Je třeba si uvědomit, že onkologickou terapii nelze odkládat a je mnohdy doživotní, proto na vyčkání efektu tzv. režimových opatření není prostor, i když samozřejmě i ta hrají důležitou roli v komplexní léčbě. V samotné léčbě arteriální hypertenze se uplatňují stejné skupiny léků jako v běžné populaci, přičemž se snažíme respektovat ostatní komorbidity i etiologii indukované/akcelerovaní arteriální hypertenze (tab. 3).
Table 3. Volba antihypertenzní medikace dle předpokládané etiologie 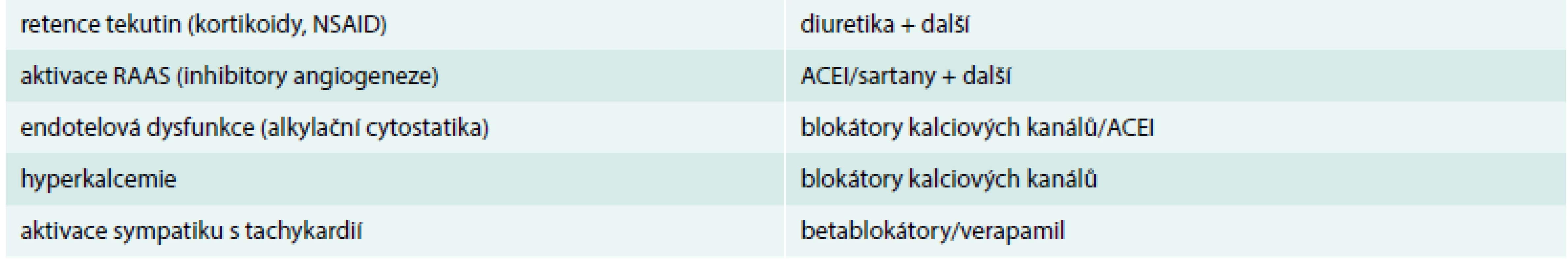
Fibrilace síní a jiné arytmie
Fibrilace síní (FISI) je u onkologických pacientů zdaleka nejčastější arytmií s předpokládanou incidencí až 3krát vyšší oproti běžné populaci, v níž činí 1–2 %. Tito pacienti mají 2krát vyšší riziko tromboembolie a 6krát vyšší riziko rozvoje srdečního selhání v porovnání s neonkologickými pacienty [23,24]. V rámci nomenklatury FISI se jedná nejčastěji o fibrilace izolované, nevalvulární, prvně diagnostikované či paroxyzmální a ve velké většině případů v kontextu onkologické prognózy uzavřené jako permanentní (viz níže).
V patofyziologii se uplatňují stejné vlivy jako u neonkologické populace s tím, že do popředí vystupují nežádoucí vlivy onkologické léčby na remodelaci myokardu (remodelace síní u dilatační kardiomyopatie, poruchy kardiomyocytů, mikrovaskulární změny či remodelace endokardu) a vlastní potenciál onkologické léčby arytmie indukovat. Velmi důležitou roli samozřejmě hraje narůstající věk onkologických pacientů, léčbou indukovaná či akcelerovaná arteriální hypertenze, rozvoj srdečního selhání, ischemická choroba srdeční, poruchy funkce štítnice (TKI – sunitinib, sorafenib a jiné), léčbou či komplikacemi léčby způsobené iontové dysbalance (sklon k hypokalemii, hypomagnezemie po antiEGFR terapii) nebo infekční komplikace a v neposlední řadě pak plicní embolie (EAP) v rámci TEN. Navíc dle některých prací může být FISI předzvěstí onkologického onemocnění, jak ukázala práce Ostenfelda et al sledující pacienty s nově vzniklou FISI [23].
Při vyšetření onkologického pacienta pátráme v anamnéze po komorbiditách (AH, CHSS, ICHS) a zajímá nás předcházející protinádorová terapie (taxany, 5-fluorouracil, cisplatina, etoposid, ifosfamid, doxorubicin, gemcitabin, mitoxantron, setrony, antiEGFR terapie) [25]. Při fyzikálním vyšetření pátráme po známkách CHSS, TEN, sepse. Kromě EKG a echokardiografie hraje důležitou roli angio CT plicní tepny všude tam, kde je jen minimální podezření na EAP jako etiologie vzniku FISI. Doplňuje se i laboratorní vyšetření včetně funkce štítné žlázy a zánětlivé parametry.
V rámci komplexní terapie FISI je důležitá terapie potenciálních vyvolávajících onemocnění (sepse, EAP, korekce vnitřního prostředí a arteriální hypertenze). Uplatňují se stejné principy kontrol rytmu nebo frekvence jako u neonkologických pacientů. Z naší praxe vyplývá, že dostačující bývá pouze vstupní kontrola frekvence (i.v. či p.o. metoprolol) a terapie vyvolávajících příčin. Komplikovaná u pacientů s FISI je otázka antikoagulační terapie. Téměř všichni pacienti jsou totiž podle CHA2DS2-VASc kandidáty trvalé antikoagulace a většina pacientů má zároveň vysoké HAS-BLED skóre. V rozhodování o zahájení antikoagulační terapie hraje důležitou roli charakter nádorového onemocnění (ascites, fluidotorax, riziko akutních intervencí) a prognóza, jiná situace bude ale u pacientů s diseminovanými solidními nádory proti např. pacientům s lymfoproliferacemi, u nichž je prognóza dramaticky příznivější. Důležitou roli hraje také např. přítomnost kardiovaskulárního onemocnění, které se na vzniku FISI spolupodílí. Tito pacienti představují rizikovou skupinu pro recidivu FISI, a měli bychom tudíž u nich tím spíše uvažovat o antikoagulační terapii. Ve vlastní antikoagulační terapii si dovoluji odkázat na terapii TEN, při níž jsou principy v terapii onkologického pacienta v podstatě shodné [11,26].
Kromě fibrilace síní je onkologická léčba spojena s ostatními arytmiemi (supraventrikulární tachykardie, komorové tachykardie, sick sinus syndrom, prodloužení QT). Z cytostatik je proarytmogenní efekt typický pro taxany (zejména paklitaxel), dále cisplatinu a již zmíněné antracykliny. Dále mohou být arytmie pozdním nežádoucím účinkem radioterapie na převodní aparát (AV blokády, sick sinus syndrom), tab. 4, [25].
Table 4. Arytmogenní působení protinádorové léčby 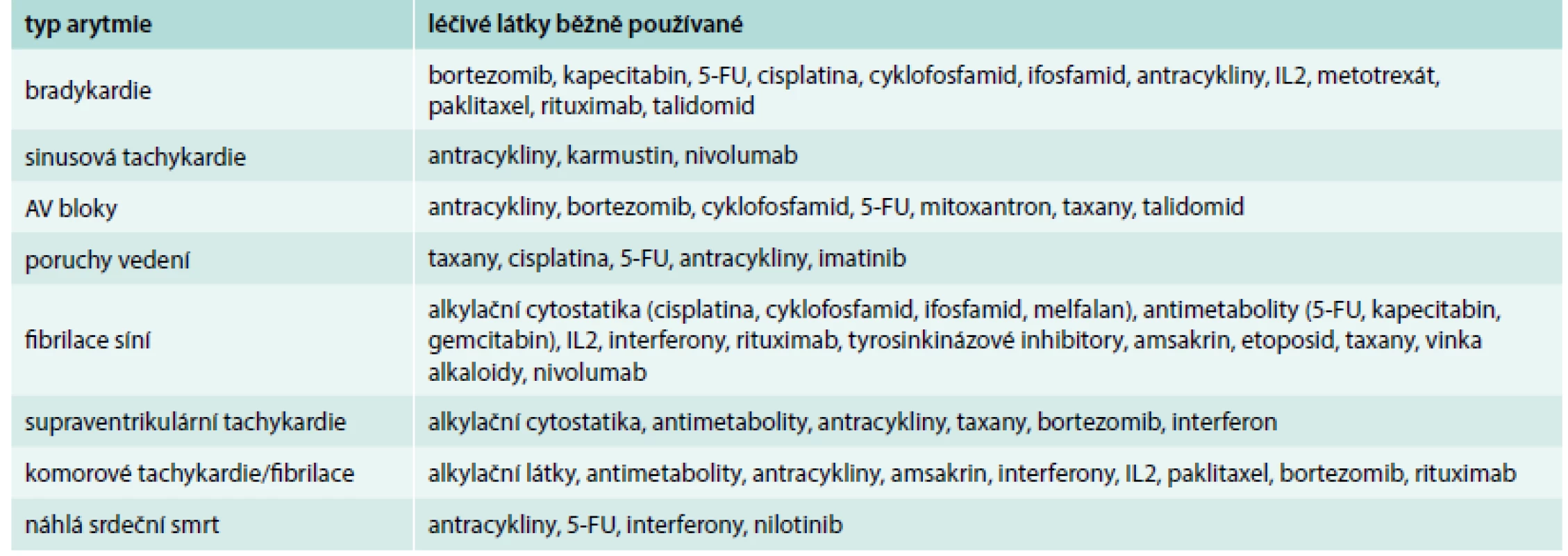
Ischemická choroba srdeční
Ischemická choroba srdeční (ICHS) ve formě akutní i pozdní je významnou komplikací onkologické léčby. Akutní formy ICHS jsou u onkologických pacientů často způsobeny vazospazmy koronárních tepen při aplikaci chemoterapie. Nejčastěji je indukce vazospazmů popisována u 5-fluorouracilu (5-FU), s incidencí v rozmezí 1–68 % a s ischemickými změnami na EKG až u 68 % pacientů, a to v průběhu vlastní aplikace chemoterapie nebo do 5 dní od ukončení aplikace. Rizikovými faktory pro rozvoj výše popsaných komplikací je kontinuální aplikace 5-FU, dávka > 800 mg/m2, předchozí radioterapie na oblast mediastina a samozřejmě anamnéza ICHS. V podstatě totéž platí i pro perorální prolék 5-FU kapecitabin, typicky podávaný kontinuálně 14 dní s následnou týdenní pauzou [25,27]. Výše uvedené preparáty jsou základními cytostatiky v léčbě nádorů gastrointestinálního traktu, což s ohledem na incidenci těchto nádorů v ČR představuje závažný medicínský problém. Dále jsou vazospazmy popisovány u cisplatiny a vinka alkaloidů (zejména vinkristin). Druhou častou příčinou akutního koronárního syndromu je sekundární ischemie v terénu preexistující aterosklerózy u léčbou způsobené tachykardie, často v kombinaci s anémií (taxany, antracykliny, anafylaktické reakce obecně) a nesmíme ani zapomínat na zvýšené riziko tepenných trombóz, typicky u antiangiogenní terapie (TKI, bevacizumab), ale i u klasických cytostatik (cisplatina aktivující trombocyty a uvolnění tromboxanu) [25,28,29].
Chronická ICHS a její akutní komplikace jsou bohužel častou velmi pozdní komplikací onkologické léčby. V její etiopatogenezi se uplatňuje celá řada vlivů. Důležitou roli hraje radioterapie, při které je zasažena oblast levé poloviny hrudníku (adjuvantní radioterapie pro karcinom prsu, radioterapie pro m. Hodgkin). Radioterapie v cílových tkáních vede k tvorbě kyslíkových radikálů, které přímo poškozující struktury DNA, což zahajuje zánětlivou kaskádu, vedoucí k poškození cév. Infiltrace endotelu zánětlivými buňkami narušuje jeho filtrační schopnosti. Bazální membrána se ztlušťuje v důsledku kolagenových depozit a fibrózy. Postupně tedy dochází k fibrotizaci s následnou stenózou koronárních tepen, typicky v ústí hlavních koronárních tepen s převahou poškození levé koronární tepny [30]. Navíc in vitro studie prokázaly uvolnění von Wilebrandova faktoru, což také teoreticky může přispět ke koronární trombotizaci [31]. Není proto překvapení, že úmrtí na ICHS jsou nejčastější nenádorovou příčinou úmrtí pacientů léčených pro m. Hodgkin [32], postihující 10 % pacientů. K rozvoji ICHS jako důsledku radioterapie dochází v rozmezí 3–30 let s maximem výskytu ve 2. a 3. dekádě po ozáření [33–35].
U pacientů s testikulárními nádory po léčbě cisplatinou byly pozorovány změny konzistentní s endotelovou dysfunkcí (mikroalbuminurie, snížená fibrinolýza a zvýšené markery zánětu), a to v mediánu 7 let po ukončení terapie [36] a ve studii van den Belt-Dusebout et al zabývající se výskytem ICHS u pacientů po léčbě pro testikulární nádory (režim cisplatina, bleomycin, vinblastin) byl medián do vzniku infarktu myokardu 14,3 roku od ukončení léčby se SIR 2,06 (standard incidence ratio) u pacientů mladších 45 let. Je potřeba dodat, že cisplatina je základním cytostatikem pro léčbu testikulárních nádorů, ovariálních karcinomů a je součástí záchranných režimů pro relabující lymfomy a jiný platinový derivát – karboplatina – se začíná stále více prosazovat v adjuvantní terapii u některých pacientek s karcinomy prsu [37–39]. Jedná se tedy o diagnózy, u kterých je mimořádně velká šance na dlouhodobé přežití. Není zcela jasné, zdali je to výsledkem přímého toxického působí cisplatiny na endotelové buňky, nebo je to následek jiných následků chemoterapie. Důležitou roli samozřejmě hraje i sekundární hypogonadizmus a změna životního stylu vedoucí k rozvoji metabolického syndromu [40]. Konečně obdobné změny lze pozorovat i u pacientek po adjuvantní léčbě pro karcinom prsu, která u velké části z nich indukuje předčasnou menopauzu [41,42]. U těchto pacientek situaci může dále zhoršit hormonální terapie inhibitory aromatáz (anastrozol, letrozol, exemestan) snižující hladinu estrogenu, která je spojena se zhoršením lipidového spektra a dále riziko ICHS zvyšuje [43]. Stejně tak je hormonální terapie zaměřená na snížení hladiny testosteronu riziková u pacientů léčených pro karcinom prostaty [44].
V rámci prevence ICHS je velmi důležité na možnost časné manifestace myslet. Důležitou roli hraje také pravidelná kontrola rizikových faktorů u vybraných pacientů (lipidové spektrum). Terapie a diagnostika ICHS u onkologických pacientů se řídí stejnými principy jako u běžné populace. Situaci však mohou komplikovat některá specifika onkologických pacientů, jako např. trombocytopenie po chemoterapii, rozvoj ICHS u pacientů čerstvě po intervenčních zákrocích či elektivní operační výkony s odstupem (interval debulking surgery u pacientek s karcinomy ovaria, operace po neoadjuvantní léčbě obecně). Zde je potřeba postupovat vždy přísně individuálně a léčebnou strategii domlouvat vždy s ošetřujícím onkologem. Zvláštní situaci představují akutní vazospastické formy ICHS způsobené chemoterapií s negativním koronarogramem. U těchto pacientů ukončujeme aplikaci rizikového cytostatika; terapie a prevence se řídí stejnými principy jako u variantní anginy pectoris (nitráty, blokátory kalciových kanálů).
Srdeční selhání
Rozvoj chronického srdečního selhání (CHSS) je nejobávanější pozdní projev onkologické terapie. K rozvoji CHSS u onkologických pacientů dochází jak přímým toxickým působením aplikovaných léčiv na srdeční sval, tak v důsledku ostatních KVO indukovaných nebo akcelerovaných onkologickou léčbou, hlavně rozvojem ICHS, arteriální hypertenzí či dysrytmiemi.
Typickým příkladem kardiotoxických cytostatik jsou antracykliny. Antracykliny patří mezi základní cytostatika jak v onkologii solidních nádorů (karcinom prsu, sarkomy), tak u hematologických malignit. Typickým představitelem je doxorubicin, dále se používají epirubicin či daunorubicin. Incidence rozvoje pozdní kardiotoxicity, tj. CHSS, se liší v závislosti na zvoleném přípravku a kumulativní dávce. Jako bezpečná kumulativní dávka se uvádí 450–550 mg/m2 pro doxorubicin; daunorubicin či epirubicin jsou pravděpodobně o něco bezpečnější, s kumulativními dávkami 800 mg/m2, respektive 900 mg/m2. Po dosažení dávky doxorubicinu 550 mg/m2 se incidence pozdního vzniku (tj. po 1 roce) CHSS manifestované jako dilatační kardiomyopatie pohybuje v rozmezí 4–36 % s tím, že rizikové faktory představují známá KVO, věk > 60 let, nebo naopak léčba v dětství, diabetes mellitus, předchozí RT hrudníku a souběžná aplikace ostatních kardiotoxických léků. Incidence akutní kardiotoxicity (akutní CHSS, SVT) po ukončení infuze s lékem se uvádí < 1 %, subakutní postižení do 1 roku od ukončení léčby se pohybuje v rozmezí 1,6–2,1 %. Je celá řada hypotéz, které vysvětlují možný mechanizmus kardiotoxicity, ale nejpravděpodobnější se jeví poškození kardiomyocytů volnými kyslíkovými radikály spolu s vystupňovanou apoptózou. Dalším lékem s podobným mechanizmem účinku je mitoxantrom, používaný zejména v hematologii, u kterého vyvine CHSS u 3–4 % pacientů po 1 roce od ukončení léčby [25,29,45].
Mezi další riziková cytostatika patří cyklofosfamid, u kterého je riziko rozvoje akutního srdečního selhání (do 10 dnů) zejména u vysokých dávek používaných ve stimulačních či vysokodávkovaných režimech [25]. Nicméně je potřeba dodat, že riziko indukce CHSS je téměř u každého cytostatika a zkušení onkologové tvrdí, že každé cytostatikum je svým způsobem kardiotoxické (pozn. autora).
Rozvoj srdečního selhání není ale jen doménou chemoterapie, v nemalém procentu se vyskytuje i u tzv. cílené biologické léčby. Týká se hlavně cílené antiHER2 terapie (zejména trastuzumab), používané v léčbě karcinomů s pozitivní expresí HER2 receptoru (asi 15 % karcinomů prsu, některé karcinomy žaludku, karcinom karotidy). Ostatní cílené antiHER2 léky (pertuzumab, T-DM1, lapatinib) se podle dosavadních dat jeví sice bezpečnější, ale i tak představují riziko pro rozvoj kardiotoxicity. Mechanizmus srdečního selhání trastuzumabu je dvojí. Jedná se jednak o interakci s dráhami hrajícími roli v kontraktilitě (SRc, FAK, ERK) a také o indukci apoptózy (schéma) [46]. To vysvětluje fakt, že u části pacientů sice dochází k poklesu ejekční frakce LK, někdy dokonce asymptomatické (zde hovoříme pouze o systolické dysfunkci), ale po přerušení terapie trastuzumabem dochází k úplné restituci funkce levé komory. Celkově incidence rozvoje SS po trastuzumabu činí 2–7 %, ale předcházející nebo dokonce konkomitantní léčba s antracykliny tuto incidenci zvyšuje až na 27 % [25,29,45].
Schéma. Mechanizmus účinku trastuzumabu v nádorové buňce a myokardu. Upraveno podle [46] ![Schéma. Mechanizmus účinku trastuzumabu v nádorové buňce a myokardu. Upraveno podle [46]](https://pl-master.mdcdn.cz/media/image/f7f4da25946707ce3c31db09233decfb.png?version=1537797704)
Dalšími, tzv. biologickými léky, které mohou indukovat rozvoj CHSS, jsou tyrozinkinázové inhibitory. Sunitinib (typicky karcinom ledviny, gastrointestinální stromální nádor – GIST) cestu inhibice ribozomální S6 kinázy indukuje apoptózu a inaktivací AMP aktivované proteinkinázy snižuje odolnost kardiomyocytů ke stresu. Obdobně působí sorafenib (karcinom ledviny, jater, GIST), který inhibicí RAF1 a BRAF kinázy ovlivňuje ERK kinázovou kaskádu, a tím zvyšuje citlivost srdečních buněk působení stresu [47]. Podobné účinky na srdeční sval mají i jiné TKI (pazopanib, imatinib, dasatinib, nilitonib, vemurafenib).
Pro biologickou léčbu obecně platí, že k rozvoji systolické dysfunkce či srdečního selhání dochází v průběhu terapie, která je chronická, tedy v řádů týdnů až měsíců a po vysazení se může funkce levé komory restituovat.
V rámci prevence rozvoje CHSS je potřeba sledovat rizikové faktory pacientů (věk > 60 let, diabetes mellitus, arteriální hypertenze, onemocnění ledvin, předchozí RT na oblast mediastina/srdce, lipidové spektrum), dále je třeba bedlivě sledovat kumulativní dávky kardiotoxických cytostatik. U výše uvedené rizikové skupiny pacientů se doporučuje dodržovat celkově nižší kumulativní dávky (400 mg/m2 pro doxorubicin, 720 mg/m2 pro epirubicin).
V prevenci kardiotoxicity antracyklinů lze aplikovat dexrazoxan, látku chelatující Fe ionty. Vzhledem k riziku zvýšené indukce sekundárních malignit u dětských pacientů je dle SPC resp. americké FDA možné použití pouze u dospělých pacientek s metastatickým nebo pokročilým karcinomem prsu po předchozí léčbě doxorubicinem v kumulativní dávce 300 mg/m2 resp. epirubicinem v kumulativní dávce 540 mg/m2, u kterých je nadále indikována léčba antracykliny [48]. Vzhledem k spornému efektu a možnému riziku zvýšené indukce sekundárních malignit jsme na našem pracovišti již od aplikace dexrazoxanu před 10 lety zcela upustili. U výše uvedené podskupiny pacientek je možné ve stejné indikaci přejít na lipozomální formy doxorubicinu, které mají výrazně příznivější kardiotoxický profil (bohužel vyvážený zvýšenou kožní toxicitou a hepatotoxicitou).
Perspektivní z hlediska kardioprotekce jsou jistě i betablokátory a ACE inhibitory. V randomizované studii OVERCOME u hematoonkologických pacientů autoři prokázali jistý protektivní vliv kombinace enalaprilu a karvedilolu proti placebu (pokles EF LK o 3,1 dle echokardiografie v rameni s placebem) [49]. Ve studii PRADA u pacientek s metastatickým karcinomem prsu na terapii antracyklin ± trastuzumab autoři prokázali protektivní vliv kandesartanu na zachování EF LK [50]. Předběžné výsledky studie MANTICORE, ve které autoři sledují efekt bisoprololu a perindoprilu jako profylaxe kardiotoxicity trastuzumabu,ukazují efekt obou léků na snížení incidence poklesu EF LK, avšak na definitivní výsledky je třeba si počkat [51].
Podobně statiny a spironolakton mohou mít kardioprotektivní potenciál, nicméně důkaz z velkých randomizovaných studií zatím chybí.
Limitací dosavadních kardioprotektivních studií je celkově malý počet pacientů, zaznamenaných událostí a krátká doba sledování. Proto je pro vyhodnocení kardioprotektivního potenciálu betablokátorů, ACE inhibitorů/sartanů či statinů třeba dalších velkých multicentrických randomizovaných studií.
Velmi důležitou roli hraje vstupní echokardiografické vyšetření (ECHO) všude tam, kde riziko poškození srdce reálně hrozí, minimálně u pacientů před terapii antracykliny a trastuzumabem [45,52]. Standardem je zatím stanovení ejekční frakce levé komory EF LK, která by měla být na začátku terapie > 50 %. U pacientů na terapii trastuzumabem se poté echokardiografické vyšetření opakuje v 3měsíčních intervalech.
Pokud dojde u asymptomatických pacientů k poklesu EF LK pod 45 %, nebo poklesu o > 10 % k hodnotám 45–49 %, tak se léčba přerušuje a měla by být zahájena terapie ACE inhibitory. Po restituci EF LK > 49 % je možné za pečlivé monitorace opětovné zahájení léčby trastuzumabem.
V případě poklesu EF LK pod 50 %, ale s EF LK > 44 % je možné v terapii trastuzumabem po zahájení medikace ACE inhibitorů pokračovat za měsíčních ECHO kontrol a eventuálně léčbu přerušit při další progresi stavu [53].
Co se antracyklinů týká, tak je kromě vstupního ECHO vyšetření vhodné vyšetření u rizikových pacientů uprostřed terapie a po ukončení terapie, dále je doporučeno provedení kontrolního ECHO po 1 a 5 letech od skončení léčby, stejně tak je doporučeno provést ECHO srdce za 5–10 let po ukončení radioterapie na mediastinum či levou polovinu hrudníku. Vhodné je také roční sledování lipidového spektra a glykemie, sporná zůstává po ukončení léčby monitorace NTproBNP a troponinu [25,54]. Naproti tomu u rizikových pacientů s preexistujícími KVO je vhodné v průběhu terapie troponin monitorovat a u pacientů s elevovanými hodnotami je potom vhodné zahájení profylaktické aplikace ACE inhibitorů a stejně tak u pacientů s rozvojem asymptomatické systolické dysfunkce levé komory je doporučeno zahájení terapie srdečního selhání (betablokátory, ACE inhibitory/sartany) [54].
Ve vlastní terapii srdečního selhání se uplatňují stejné principy jako v terapie CHSS jakékoli jiné etiologie.
Ostatní nežádoucí účinky
Perikarditida je poměrně vzácnou komplikací radioterapie i chemoterapie, ale postižení perikardu může být i manifestací základního onemocnění (akutní leukemie, nádory plic, mediastina, prsu). K rozvoji perikarditidy po radioterapii dochází na základě stejných principů jako u poškození koronárního řečiště (viz výše). Incidence akutní formy se nyní odhaduje na 2,5 %, u 10–20 % pacientů pak ale dochází k rozvoji chronické nebo konstriktivní perikarditidy 5–10 let po léčbě [30]. Chemoterapie může způsobit perikarditidu akutně v řádu dnů či týdnů od zahájení léčby, a to celou řadou mechanizmů (systémová zánětlivá odpověď u cytarabinu, kyslíkové radikály u antracyklinů) [55]. Z cytostatik byla perikarditida popsána u antracyklinů, cytarabinu, cyklofosamidu či docetaxelu. V terapii se uplatňují nesteroidní antiflogistika a kortikoidy, ev. perikardiocentéza u indikovaných pacientů.
Prodloužení QT intervalu je nežádoucím účinkem celé řady léků v onkologii běžně používaných a bohužel mnohdy se ani kombinaci těchto léků nelze vyhnout (setrony, ciprofloxacin, taxany, citalopram), proto je potřeba při nasazování antiarytmické terapie (např. amiodaron, sotalol) mít toto na paměti a pacienty pečlivě monitorovat. Navíc u onkologických pacientů dochází k prodloužení QT intervalu i v důsledku časté iontové dysbalance (hypokalemie, hypomagnezemie, hypokalcemie), dále v rámci léčbou navozené hypotyreózy a v neposlední řadě ostatními faktory, jako jsou pokročilý věk či poškození ledvinných či jaterních funkcí [54].
Závěr
Pozdním rozvojem CHSS po léčbě jsou ohroženi zejména dlouho přežívající pacienti po onkologické léčbě, hlavně pacienti po onkologické léčbě v dětském věku, dále pacientky s nádory prsu, vaječníků v počátečních stadiích, pacienti po terapii testikulárních nádorů a téměř všichni pacienti po terapii hematologických malignit. V terapii rozvinutého srdečního selhání se uplatňují stejné principy jako u pacientů neonkologických, včetně transplantační léčby, u které je pochopitelnou podmínkou dlouhodobá trvalá remise onemocnění. Je třeba myslet na to, že k rozvoji KVO může u vyléčených onkologických pacientů docházet ve výrazně mladším věku proti ostatní populaci a ev. došetření (koronarografie, zátěžové testy, ECHO, kontroly lipidového spektra u vybraných pacientů) včasně indikovat.
MUDr. Jiří Vyskočil
jiri.vyskovil@mou.cz
Oddělení ARO/JIP MOÚ, Brno
www.mou.cz
Doručeno do redakce 19. 12. 2016
Přijato po recenzi 9. 3. 2017
Sources
1. Trousseau A. Phlegmasia alba dolens. In: Trousseau A. Lectures on clinical medicine delivered at the Hotel-Dieu, Paris. 5th ed. [translated by Cormack JR]. New Sydenham Society: London 1872 : 281–295.
2. Fennerty A. Venous thromboembolic disease and cancer. Postgrad Med J 2006; 82(972): 642–648.
3. Bloom JW, Doggen CJM, Osanto S et al. Malignancies, prothrombotic mutations and the risk of venous thrombosis. JAMA 2005; 293(6): 715–722.
4. Kakkar AK, DeRuvo N, Chinswangwatanakul V et al. Extrinsic-pathway activation in cancer with high factor VIIa and tissue factor. Lancet 1995; 346(8981): 1004–1005.
5. Prandoni P, Falanga A, Piccioli A. Cancer and venous thromboembolism. Lancet Oncol 2005; 6(6): 401–410.
6. Blom JW, Vanderschoot JP, Oostindier MJ et al. Incidence of venous thrombosis in a large cohort of 66,329 cancer patients: results of a record linkage study. J Thromb Haemost 2006; 4(3): 529–535.
7. Saphner T, Tormey DC, Gray R. Venous and arterial thrombosis in patients who received adjuvant therapy for breast cancer. J Clin Oncol 1991; 9(2): 286–294.
8. Rajkumar SV, Blood E, Vesole D et al. Eastern Cooperative Oncology Group Phase III clinical trial of thalidomide plus dexamethasone compared with dexamethasone alone in newly diagnosed multiple myeloma: a clinical trial coordinated by the Eastern Cooperative Oncology Group. J Clin Oncol 2006; 24(3): 431–436.
9. Keefe D, Bowen J, Gibson R et al. Noncardiac vascular toxicities of vascular endothelial growth factor inhibitors in advanced cancer: a review. Oncologist 2011; 16(4): 432–444. Dostupné z DOI: <http://dx.doi.org/10.1634/theoncologist.2010–0271>.
10. Bennett LC, Silver SM, Djulbegovic B et al. Venous Thromboembolism and Mortality Associated With Recombinant Erythropoietin and Darbepoetin Administration for the Treatment of Cancer-Associated Anemia. JAMA 2008; 299(8): 914–924. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.299.8.914>.
11. Informace dostupné z WWW: https://www.nccn.org/professionals/physician_gls/pdf/vte.pdf.
12. Mandala M, Falanga A, Roila F Management of venous thromboembolism (VTE) in cancer patients: ESMO Clinical Practice Guidelines. Ann Oncol 2011; 22(Suppl 6): vi85-vi92. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mdr392>.
13. Konstantinides SV, Torbicki A, Agnelli G et al. [Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC)]. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014; 35(43): 3033–3069, 3069a-3069k. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehu283>.
14. Fox DJ, Khattar RS. Carcinoid heart disease: presentation, diagnosis, and management. Heart 2004; 90(10): 1224–1228.
15. [Kooperativní skupina pro neuroendokrinní nádory]. Definice a historie NET. Dostupné z WWW: http://neuroendokrinni-nadory.cz/pro-odborniky. [13.12.2016].
16. Informace dostupné z WWW: <https://www.nccn.org/professionals/physician_gls/pdf/neuroendocrine.pdf>. [13/12/2016]
17. Palaniswamy C, Frishman WH, Aronow WS. Carcinoid heart disease. Cardiol Rev 2012; 20(4): 167–176. Dostupné z DOI: <http://dx.doi.org/10.1097/CRD.0b013e31824c866e>.
18. Piccirillo JF, Tierney RM, Costas I et al. Prognostic importance of comorbidity in a hospital-based cancer registry. JAMA 2004; 291(20): 2441–2447.
19. Perez E, Morgan J. Cardiotoxicity of trastuzumab and other HER2-targeted agents. UpToDate. Dostupné z WWW: http://www.uptodate.com/contents/cardiotoxicity-of-trastuzumab-and-other-her2-targeted-agents.
20. de Jesus-Gonzalez N, Robinson E, Moslehi J et al. Management of antiangiogenic therapy-induced hypertension. Hypertension 2012; 60(3): 607–615. Dostupné z DOI: <http://dx.doi.org/10.1161/HYPERTENSIONAHA.112.196774>.
21. Mouhayar E, Salahudeen A. Hypertension in cancer patients. Tex Heart Inst J 2011; 38(3): 263–265.
22. Fraeman KH, Nordstrom BL, Luo W et al. Incidence of New-Onset Hypertension in Cancer Patients: A Retrospective Cohort Study. Int J Hypertens 2013; 2013 : 379252. Dostupné z DOI: <http://dx.doi.org/10.1155/2013/379252>.
23. Ostenfeld EB, Erichsen R, Pedersen L et al. Atrial Fibrillation as a Marker of Occult Cancer. PLoS ONE 2014; 9(8): e102861. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0102861>.
24. Kirchhof P, Benussi S, Kotecha D et al. [Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC). European Heart Rhythm Association (EHRA) of the ESC. European Stroke Organisation (ESO)]. 2016 ESC guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Europace 2016; 18(11): 1609–1678. Dostupné z DOI: https://doi.org/10.1093/europace/euw295
25. Bovelli D, Plataniotis G, Roila F. ESMO Guidelines Working Group. Cardiotoxicity of chemotherapeutic agents and radiotherapy‐related heart disease: ESMO Clinical Practice Guidelines. Ann Oncol 2010; 21(Suppl 5): v277-v282. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mdq200>.
26. Farmakis D, Parissis J, Filippatos G. Insights into onco-cardiology: atrial fibrillation in cancer. J Am Coll Cardiol 2014; 63(10): 945–953. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2013.11.026>.
27. Labianca R, Beretta G, Clerici M et al. Cardiac toxicity of 5-fluorouracil: a study on 1083 patients. Tumori 1982; 68(6): 505–510.
28. Florescu M, Cinteza M, Vinereanu D. Chemotherapy-induced Cardiotoxicity. Mædica (Buchar) 2013; 8(1): 59–67.
29. Yeh ET, Bickford CL. Cardiovascular complications of cancer therapy: incidence, pathogenesis, diagnosis, and management. J Am Coll Cardiol 2009; 53(24): 2231–2247. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2009.02.050>.
30. Jaworski C, Mariani JA, Wheeler G et al. Cardiac complications of thoracic irradiation. J Am Coll Cardiol 2013; 61(23): 2319–2328. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2013.01.090>.
31. Boerma M, Kruse JJ, van Loenen M et al. Increased deposition of von Willebrand factor in the rat heart after local ionizing irradiation. Strahlenther Onkol 2004; 180(2): 109–116.
32. Ng AK. Review of the Cardiac long-term effects of the therapy for Hodgkin lymphoma. Br J Heamatol 2011; 154(1): 23–31. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2011.08713.x>.
33. Hull MC, Morris CG, Pepine CJ et al. Valvular dysfunction and carotid, subclavian, and coronary artery disease in survivors of hodgkin lymphoma treated with radiation therapy. JAMA 2003; 290(21): 2831–2837.
34. Darby SC, Ewertz M, McGale P et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med 2013; 368(11): 987–989. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1209825>.
35. van den Belt‐Dusebout AW, de Wit R, Gietema JA et al. Treatment‐specific risks of second malignancies and cardiovascular disease in 5‐year survivors of testicular cancer. J Clin Oncol 2007; 25(28): 4370–4378.
36. Nuver J, Smit AJ, Sleijfer DT et al. Microalbuminuria, decreased fibrinolysis, and inflammation as early signs of atherosclerosis in long-term survivors of disseminated testicular cancer. Eur J Cancer 2004; 40(5): 701–706.
37. Zhoubný novotvar ovarií a tuby (C56–57). In: Modrá kniha. Česká onkologická společnost České lékařské společnosti Jana Evangelisty Purkyně. Dostupné z WWW: http://www.linkos.cz/informace-pro-praxi/modra-kniha/17-zhoubny-novotvar-ovarii-a-tuby-c56–57/ [13.12.2016].
38. Zhoubné novotvary lymfatických tkání (C81–86). In: Modrá kniha. Česká onkologická společnost České lékařské společnosti Jana Evangelisty Purkyně. Dostupné z WWW: http://www.linkos.cz/informace-pro-praxi/modra-kniha/26-zhoubne-novotvary-lymfatickych-tkani-c81–86/.[13.12.2016].
39. Dostupné z WWW: <https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf>. [13.12.2016].
40. Nuver J, Smit AJ, Wolffenbuttel BH et al. The metabolic syndrome and disturbances in hormone levels in long-term survivors of disseminated testicular cancer. J Clin Oncol 2005; 23(16): 3718–3725.
41. Partridge AH, Gelber S, Peppercorn J et al. Fertility and menopausal outcomes in young breast cancer survivors. Clin Breast Cancer 2008; 8(1): 65–69. Dostupné z DOI: <http://dx.doi.org/10.3816/CBC.2008.n.004>.
42. Partridge AH, Ruddy KJ. Fertility and adjuvant treatment in young women with breast cancer. Breast 2007; 16(Suppl 2): S175-S181.
43. Foglietta J, Inno A, de Iuliis F et al. Cardiotoxicity of Aromatase Inhibitors in Breast Cancer Patients. Clin Breast Cancer. 2017; 17(1): 11–17. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clbc.2016.07.003>.
44. Van Hemelrijck M, Garmo H, Holmberg L et al. Absolute and relative risk of cardiovascular disease in men with prostate cancer: results from the Population-Based PCBaSe Sweden. J Clin Oncol 2010; 28(21): 3448–3456. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2010.29.1567>.
45. Poprach A, Petráková K, Vyskočil J et al. Kardiotoxicita léků používaných v onkologii. Klinická onkologie 2008; 21(5): 288–293.
46. Zeglinski M, Ludke A, Jassal DS et al. Trastuzumab-induced cardiac dysfunction: A “dual-hit.” Exp Clin Cardiol 2011 Fall; 16(3): 70–74.
47. Schmidinger M, Zielinski CC, Vogl UM et al. Cardiac toxicity of sunitinib and sorafenib in patients with metastatic renal cell carcinoma. J Clin Oncol 2008; 26(32): 5204–5212.
48. FDA Statement on Dexrazoxane. Dostupné z WWW: https://www.fda.gov/Drugs/DrugSafety/ucm263729.htm. [7.3.2017].
49. Bosch X, Rovira M, Sitges M et al. Enalapril and carvedilol for preventing chemotherapy-induced left ventricular systolic dysfunction in patients with malignant hemopathies: the OVERCOME trial (preventiOn of left Ventricular dysfunction with Enalapril and caRvedilol in patients submitted to intensive ChemOtherapy for the treatment of Malignant hEmopathies). J Am Coll Cardiol 2013; 61(23): 2355–2362.Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2013.02.072>.
50. Gulati G, Heck SL, Ree AH et al. Prevention of cardiac dysfunction during adjuvant breast cancer therapy (PRADA): a 2 x 2 factorial, randomized, placebo-controlled, double-blind clinical trial of candesartan and metoprolol. Eur Heart J 2016; 37(21): 1671–1680. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehw022>.
51. Goodman A. Prophylactic Beta-Blocker Preserves Left-Ventricular Function in Patients Receiving Trastuzumab. 2016. Dostupné z WWW: <http://www.ascopost.com/issues/january-25–2016/prophylactic-beta-blocker-preserves-left-ventricular-function-in-patients-receiving-trastuzumab/>.[13.12.2016].
52. Naumann D, Rusius V, Margiotta C et al. Factors predicting trastuzumab-related cardiotoxicity in a real-world population of women with HER2+ breast cancer. Anticancer Res 2013; 33(4): 1717–1720.
53. Jones AL, Barlow M, Barrett-Lee PJ et al. Management of cardiac health in trastuzumab-treated patients with breast cancer: updated United Kingdom National Cancer Research Institute recommendations for monitoring. Br J Cancer 2009; 100(5): 684–692. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.bjc.6604909>.
54. Zamorano LJ, Lancellotti P, Munoz RD et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016; 37(36): 2768–2801.
55. Woods T, Vidarsson B, Mosher D et al. Transient effusive-constrictive pericarditis due to chemotherapy. Clin Cardiol 1999; 22(4): 316–318.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 3-
All articles in this issue
- Možnosti efektivní edukace v diabetologii – návod pro edukátory
- Nepravidelnosti dýchání při spiroergometrickém vyšetření – od mírné nepravidelnosti dechového vzoru až po periodické dýchání typu oscilující ventilace
- Přínos CT kolografie v klinické praxi
- Diabetes mellitus 2. typu a chronická obličková choroba
-
Význam zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie
Část I - Kardiovaskulární komplikace nádorů a jejich léčby
- Komentár k aktuálnym odporúčaniam v liečbe diabetu 2. typu
- Radiofrekvenční katétrová ablace pro fibrilaci síní prováděná v celkové anestezii: výsledky unicentrické randomizované studie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přínos CT kolografie v klinické praxi
- Možnosti efektivní edukace v diabetologii – návod pro edukátory
- Radiofrekvenční katétrová ablace pro fibrilaci síní prováděná v celkové anestezii: výsledky unicentrické randomizované studie
- Nepravidelnosti dýchání při spiroergometrickém vyšetření – od mírné nepravidelnosti dechového vzoru až po periodické dýchání typu oscilující ventilace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

