-
Medical journals
- Career
Léčba rituximabem jako výzva k prevenci infekčních komplikací
Authors: Pavel Polák 1,2; Miroslav Penka 1,3,4; Petr Smejkal 1,3; Gabriela Chlupová 1
Authors‘ workplace: Oddělení klinické hematologie FN Brno 1; Klinika interní, geriatrie, ošetřovatelství a praktického lékařství LF MU a FN Brno, pracoviště Bohunice 2; Katedra laboratorních metod LF MU Brno 3; Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice 4
Published in: Vnitř Lék 2016; 62(5): 398-405
Category: Reviews
Overview
Rituximab je monoklonální protilátka zaměřená proti povrchovému znaku B-lymfocytů CD20 používaná k léčbě četných hematologických, hematoonkologických a autoimunitních stavů. Po aplikaci rituximabu dochází velmi rychle k téměř kompletní depleci B-lymfocytů s výjimkou pre-B-lymfocytů a plazmatických buněk. Současně může dojít k rozvoji neutropenie a snížení koncentrací protilátek třídy IgA, IgM i IgG v séru. Tyto změny zpravidla přetrvávají 6–12 měsíců, vzácněji i několik let. Důsledkem je vyšší vnímavost takto léčených pacientů k infekcím – zpravidla bakteriálním a virovým. Současně je po aplikaci rituximabu negativně ovlivněna postvakcinační protilátková odezva, a proto je nezbytné zahájit preventivní opatření ještě před zahájením léčby. Autoři podávají ucelený přehled aktuální literatury, zdůrazňují adekvátní edukaci pacientů i ošetřujících lékařů a diskutují doporučení vakcinace proti jednotlivým preventabilním infekčním onemocněním, jako je chřipka, pneumokoková onemocnění, tetanus, difterie a pertuse.
Klíčová slova:
autoimunitní onemocnění – imunosuprese – infekční komplikace – prevence – rituximab – vakcinaceÚvod
Rituximab je chimérická monoklonální protilátka proti povrchovému buněčnému znaku CD20. Tento znak se vyskytuje virtuálně na všech B-lymfocytech a společně s diferenciačním antigenem B buněčného podpisu (B cell signature differentiation antigen) pomáhá regulovat jejich buněčný cyklus a diferenciaci. Rituximab je v klinické praxi k dispozici již téměř 20 let a je indikován v léčbě onemocnění hematoonkologických (lymfomů z B-buněk a chronické lymfatické leukemie), hematologických (autoimunitní cytopenie, získaného inhibitoru faktoru VIII, kryoglobulinemie, primární imunitní trombocytopenie, trombotické trombocytopenické purpury) a autoimunitních (revmatoidní artritidy, systémového lupus erythematodes, granulomatózy s polyangiitidou). Další indikaci představuje tzv. conditioning před transplantací kmenových buněk krvetvorby (hematopoetic stem cell transplantation – HSCT) a dále u posttransplantačních lymfoproliferativních onemocnění (posttransplant lymphoproliferative diseases – PTLD) a u PTLD způsobených virem Epsteina-Barrové (EBV). Prognóza a přežití pacientů trpících lymfoproliferativním onemocněním byla díky rituximabu radikálně zlepšena [1–6].
Léčba rituximabem aktivuje na komplementu závislou cytotoxicitu (CDC – complement depending cytotoxicity), cytotoxicitu závislou na protilátkách (ADCC – antibody dependent cytotoxicity), přímo aktivuje apoptózu a zřejmě aktivuje i fagocytózu a ADCC v součinnosti s komplementem (complement-enhanced ADCC). Důsledkem je prakticky kompletní deplece B-lymfocytů (pokles B-lymfocytů < 1,0 × 109/l), ke které dochází během 48 hod od zahájení léčby; jen ve velmi nízkých koncentracích perzistují pre-B-lymfocyty a zralé B-lymfocyty včetně plazmatických buněk, které nejsou znakem CD20 vybaveny. Tyto změny přetrvávají různě dlouhou dobu (zpravidla 2–9 měsíců), normalizace počtu B-lymfocytů však může trvat až 2 roky [1]. K repopulaci dochází nejdříve nezralými buňkami (CD38+, CD10+, CD24+), poté naivními B-lymfocyty a následně i CD27+ paměťovými B-lymfocyty [7]. Pro klinickou praxi je významné, že rituximab neovlivňuje aktivaci makrofágů ani cytotoxických T-lymfocytů. Proto jsou nejčastější infekční komplikace u pacientů léčených rituximabem způsobeny extracelulárně se množícími bakteriemi, viry (při viremické fázi onemocnění) a zřídka jednobuněčnými parazity.
Nežádoucí účinky rituximabu
Z praktických i didaktických důvodů lze možné nežádoucí účinky rituximabu rozdělit na komplikace přímo související s léčivem a jeho aplikací (akutně vzniklé a opožděné) a na zvláště vyčleněné komplikace infekční.
Akutně vzniklé nežádoucí účinky
Mezi akutní nežádoucí účinky aplikace rituximabu patří především riziko anafylaktické reakce. Dále byly v této souvislosti popsány horečka a zimnice (v důsledku uvolnění cytokinů), syndrom nádorové lýzy, srdeční arytmie, myokardiální infarkt, cefalea, nauzea, průjem, křeče, bolesti kloubů a zad apod [8].
Opožděné nežádoucí účinky
Pozdní neutropenie
Závažným nežádoucím účinkem může být rozvoj pozdní neutropenie (late onset neutropenia – LON). Kritéria LON nejsou v současnosti jednoznačně stanovena, všeobecně se uznává pokles počtu neutrofilů < 1,0 × 109/l v trvání alespoň 4 týdnů od aplikace rituximabu. Incidence LON se pohybuje kolem 0,2–8,0 %. Při intenzivní léčbě rituximabem je relativní riziko rozvoje této komplikace v porovnání s neléčenou populací zvýšeno 3,4krát [9]. Tato komplikace se rozvíjí za 1–12 měsíců od zahájení léčby. Patofyziologicky se může uplatnit tvorba antineutrofilních protilátek, kompetice o růstové faktory mezi buňkami lymfopoézy a granulopoézy a genetické polymorfizmy v genu pro buněčný receptor FCγRIIIA. Ve velké prospektivní studii u pacientů s revmatologickým onemocněním (n = 2 624) byla neutropenie pozorována u 85 jedinců léčených rituximabem. Rozvoj LON následoval nejčastěji za 4,5 měsíce od aplikace poslední dávky rituximabu a byla prokázána souvislost s frekvencí výskytu LON a četností podaných dávek léčiva. Neutropenie byla většinou mírná v rozmezí 1,0-1,5 × 109/l buněk/mm3. Je důležité zdůraznit, že dle aktuálních poznatků nepředstavuje samotný rozvoj LON kontraindikaci pro pokračování léčby rituximabem. Vyžaduje však zvýšenou obezřetnost, protože další vývoj počtu neutrofilů je nepředvídatelný a není známo, jak dlouho neutropenie potrvá [9,10].
Aplikace granulocytárních růstových faktorů (G-CSF – granulocyte colony stimulating factor) není při nekomplikovaném průběhu LON indikována a je vyhrazena pouze pro případ systémových infekčních komplikací [9].
Trombocytopenie, autoimunitní hemolytická anémie
V souvislosti s léčbou rituximabem byly popsány i trombocytopenie a Evansův syndrom (autoimunitní hemolytická anémie s imunitní trombocytopenií) [11].
Hypoglobulinemie
Dalším klinicky relevantním nežádoucím účinkem může být pokles hladin imunoglobulinů v séru v důsledku snížené produkce při depleci B-lymfocytů. U pacientů s nemaligním onemocněním léčených rituximabem dochází k nehomogennímu poklesu hladin protilátek třídy IgM i IgG; naopak u pacientů s hematoonkologickou diagnózou je často již před léčbou přítomna různě těžká hypogamaglobulinemie a po aplikaci rituximabu je zpravidla pozorován další významný pokles koncentrace těchto protilátek. Intenzivní léčba rituximabem po HSCT představuje vysoké riziko dlouhodobé hypogamaglobulinemie. Ojediněle byl popsán případ i 7 let trvající hypoglobulinemie IgG, IgM a IgA po kombinaci chemoterapie a rituximabu [7].
V retrospektivní studii 211 pacientů s B buněčným lymfomem došlo k rozvoji hypogamaglobulinemie po léčbě rituximabem ve 38,5 % (všichni jedinci měli původně normální hodnotu sérové koncentrace gamaglobulinu, IgG). Rizikem pro hypogamaglobulinemii byla především prolongovaná terapie rituximabem. Symptomatické infekce s nutností substituce nitrožilním gamaglobulinem (intravenózní imunoglobulin G – IVIG) byly pozorovány v 6,6 % souboru [12].
Další studie u pacientů s revmatologickým onemocněním prokázala, že čím jsou vstupní hodnoty imunoglobulinů třídy IgG a IgM nižší, tím vyšší je riziko perzistující hypogamaglobulinemie po léčbě rituximabem. U 22,4 % pacientů léčených rituximabem byl pozorován pokles protilátek třídy IgM a u 3,5 % současně i pokles protilátek třídy IgG po dobu delší 4 měsíců [1].
Ve velké studii (n = 3 595) sledoval van Vollenhoven dynamiku protilátek třídy IgM a IgG během léčby rituximabem. Za 4 měsíce od jeho aplikace byl pozorován pokles protilátek třídy IgM u 24,0 % souboru a hypogamaglobulinemie u 4,0 % souboru [13].
V jednoleté studii analyzoval Makatsori 114 pacientů léčených rituximabem, kteří měli před zahájením léčby normální koncentrace IgG v séru. Nadpoloviční většina pacientů obdržela rituximab z hematologické indikace. Hypogamaglobulinemie se vyskytla u 23,7 % souboru [1]. Jiní autoři vliv léčby rituximabem na humorální imunitu nezaznamenali. Např. Chen nepozoroval žádný nebo jen nevýznamný pokles protilátek a autoprotilátek po léčbě rituximabem. Jedním z vysvětlení tohoto fenoménu by teoreticky mohla být pokračující tvorba protilátek v kostní dřeni a v sekundárních lymfatických orgánech (slezině a lymfatických uzlinách), což dosud není jednoznačně doloženo [15,16].
U pacientů léčených rituximabem se mohou rovněž tvořit lidské antichimerické protilátky (HACAs – human antichimeric antibodies). Příčinou je vyšší imunogenicita monoklonálních protilátek s myší komponentou. V porovnání s inhibitory faktoru nádorové nekrózy α (TNFα – tumor necrosis factor α), které mohou rovněž indukovat tvorbu HACAs, nevede zpravidla přítomnost těchto protilátek ke ztrátě účinnosti rituximabu ani k akutním infuzním reakcím. Rituximab nesmí být s inhibitory TNFα kombinován [16].
Infekční komplikace
Infekční komplikace lze všeobecně rozdělit do několika skupin, jež se vzájemně doplňují: endogenní či exogenní; komunitní, spojené s nemocniční péčí, endemické či importované; akutní, subakutní či chronické; mezilidsky přenosné či nepřenosné; přenosné či nepřenosné vektorem a samozřejmě dle původce na virové, bakteriální, protozoární, parazitární a mykotické. Uvažování ošetřujícího lékaře ve zmíněných kategoriích může značně zpřesnit diferenciálně-diagnostické rozvahy. Možná infekční agens, jež mohou vyvolat onemocnění v souvislosti s léčbou rituximabem, jsou uvedena v tab.
Table 1. Přehled patogenů, které nejčastěji působí infekční komplikace u pacientů léčených rituximabem 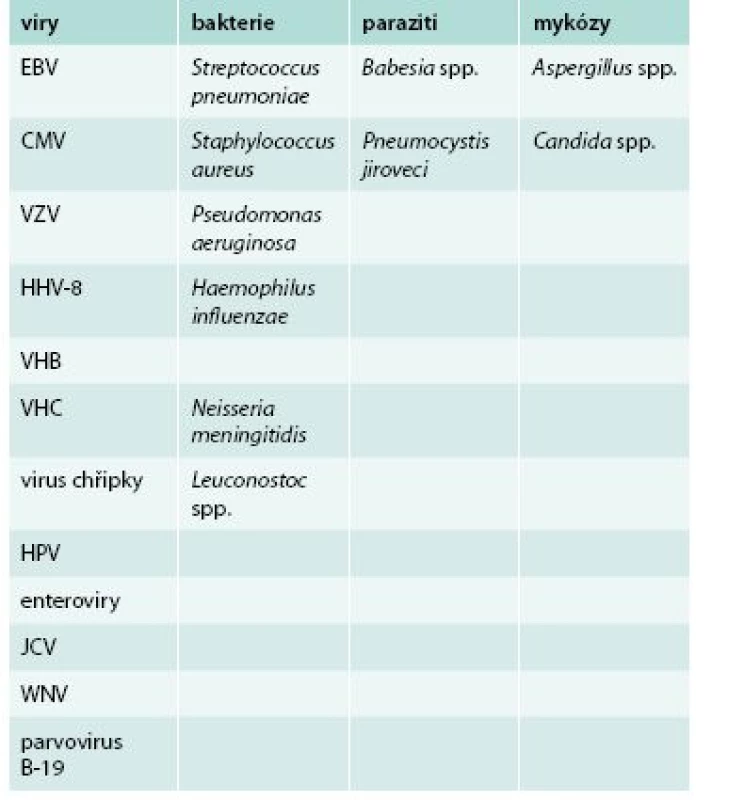
CMV – cytomegalovirus EBV – virus Epsteina-Barrové HHV8 – lidský herpetický virus 8 VHB – virus hepatitidy B VHC – virus hepatitidy C HPV – lidský papilomavirus JCV – JC virus VZV – virus varicely a zosteru WNV – virus západonilské horečky/ West Nile Virus Vzhledem k výrazné nehomogenitě jednotlivých skupin pacientů léčených rituximabem a k současné nehomogenitě jejich často dlouhodobé a kombinované imunosupresivní či imunomodulační léčby je velmi obtížné kvantifikovat, kolik infekčních komplikací přímo souvisí s léčbou rituximabem. Podle některých autorů nevede delší trvání imunosuprese navozené rituximabem nutně k nárůstu počtu infekčních komplikací. V longitudinální studii 3 194 revmatologických pacientů byl pozorován výskyt infekčních komplikací v přepočtu 3,9/1 000 pacientoroků, což bylo srovnatelné s placebem a se skupinou léčenou metotrexátem [1]. Ve velké studii u onkologicky nemocných dětí (n = 2 875) byl výskyt infekčních komplikací po léčbě rituximabem obdobný jako ve skupině bez této léčby [7]. Jiní autoři pozorovali vyšší výskyt infekčních komplikací ve skupině s hypogamaglobulinemií [13].
Některé práce však upozorňují, že incidence infekčních komplikací může po léčbě rituximabem dosahovat až 40 %; z toho se ve 2,0–7,0 % jedná o závažné infekce. Naprosto nejčastěji jsou popisovány infekce respiračního traktu. Pneumonie jsou nejčastěji bakteriální (Streptococcus pneumoniae, Staphylococcus aureus, Pseudomonas aeruginosa), virové (cytomegalovirus – CMV Haemophilus a virus varicely a zosteru – VZV) či způsobené plísněmi (Aspergillus sp.) [16].
V metaanalýze 19 infekčních komplikací u pacientů léčených rituximabem převažovaly respirační infekce způsobené Haemophilus influenzae, Pseudomonas aeruginosa, Streptococcus pneumoniae, Staphylococcus aureus; vzácněji byly pozorovány aspergilové respirační infekce nebo pneumonie způsobená VZV. Při kombinaci rituximabu s fludarabinem byla pozorována výrazně vyšší kumulativní incidence infekcí i u pacientů bez neutropenie [1].
Ve studii 69 pacientů se základní diagnózou systémový lupus erythematodes se během ročního sledování po léčbě rituximabem vyskytly závažné infekční komplikace u 17,4 % pacientů. Všechny infekce byly bakteriální, dominovaly nákazy způsobené Streptococcus pneumoniae, Staphylococcus aureus, Pseudomonas aeruginosa, Candida sp., Enterococcus faecalis a Escherichia coli. Anamnéza předchozího očkování proti pneumokokům výrazně redukovala riziko závažných infekčních komplikací. Pneumokokové infekce zpravidla probíhaly jako sinusitidy či pneumonie [17].
Významné riziko představují rovněž enterovirové infekce s projevy meningoencefalitidy (i chronické a často fatální) či myokarditidy a nákaza JC virem s následným rozvojem progresivní multifokální leukoencefalopatie (PMLE). Zvýšená náchylnost k enterovirovým infekcím je i u pacientů s agamaglobulinémií vázanou na X chromozom a dále při deficienci antigenů hlavního histokompatibilního komplexu (MHC – major histocompatibility complex) II. třídy a paradoxně při zvýšené koncentraci protilátek třídy IgM. Proto je před a pravidelně i po aplikaci rituximabu doporučena monitorace celkové koncentrace IgG k rozlišení preexistujícího a sekundárního imunodeficitu. V léčbě enterovirových komplikací lze použít inhibitor proteinu kapsidy pikornavirů pleconaril v kombinaci s vysokými dávkami IVIG a případnou aplikací imunoglobulinu intratekálně [11].
U pacientů léčených rituximabem byly popsány i meningoencefalitidy způsobené virem západonilské horečky (West Nile Virus – WNV) s fatálním průběhem [18]. Tento fakt je vzhledem k dynamické epidemiologické situaci vlivem klimatických změn třeba zohlednit v diferenciálně-diagnostické rozvaze u febrilního pacienta přijíždějícího i z oblasti Středozemního moře.
Mezi další agens, která mohou vzácněji vyvolat infekční komplikace u pacientů léčených rituximabem, patří babesie a bakterie rodu Leuconostoc. Byly popsány i závažné cytomegalovirové infekce (kolitida, retinitida a pneumonitida) a pneumonie způsobené Pneumocystis jiroveci [19–21].
Kazuisticky byly popsány: fatální cytomegalovirová infekce po léčbě kortikosteroidy a rituximabem pro granulomatózu s polyangiitidou [22], diseminovaná kryptokokóza u pacienta s lymfomem po léčbě chemoterapií a rituximabem [9], VZV hepatitida komplikovaná diseminovanou intravaskulární koagulopatií [23] a případy parvovirové infekce [24]. Hutchinson popsal případ pacienta současně trpícího pneumocystovou pneumonií, pseudomonádovou sepsí, herpetickou gingivostomatitidou, invazivní plicní aspergilózou a cytomegalovirovou pneumonitidou, který před léčbou rituximabem obdržel chemoterapii cyklofosfamidem a prednisonem. Autor zároveň apeluje na zvýšenou prevenci reaktivace endogenních infekcí a nákaz spojených s nemocniční péčí [6].
Při závažných infekčních komplikacích je indikována aplikace IVIG v dávce 0,4 g/kg tělesné hmotnosti, přičemž maximální celková dávka by neměla překročit 2 g/kg [1,19].
Jelikož je v důsledku nákazy viry Epsteina-Barrové, lidským herpetickým virem 8 (human herpes virus 8 – HHV8), lidským virem imunitní nedostatečnosti (human immunodeficiency virus – HIV) a viry hepatitid B (HBV) a C (HCV) možná lymfomová transformace, hrozí při poruše imunitního dozoru reaktivace těchto virů s následnými komplikacemi včetně např. fulminantního průběhu virové hepatitidy s 50% mortalitou [1,5]. Medián rozvoje závažných virových infekcí je po léčbě rituximabem 5 měsíců [18].
U 1 482 pacientů s lymfomem ne-Hodgkinova typu (NHL) byla reaktivace virové hepatitidy B pozorována až ve 23,0 % případů [25]. Tonziello popsal tranzientní reaktivaci virové hepatitidy B u pacienta s NHL léčeného rituximabem, a to navzdory antivirové profylaxi [26]. U pacientů s pozitivitou HBs antigenu v séru je proto doporučeno rituximab raději nepodávat [16].
Imunorekonstituce po předchozí léčbě rituximabem není dosud přesně definována, většina autorů ji popisuje jako obnovení počtu B-lymfocytů a obnovení sérových koncentrací imunoglobulinů [16].
Možnosti prevence infekčních komplikací
Nespecifická preventivní opatření
Navzdory zmíněné velké nehomogenitě pacientů léčených rituximabem a různě vyjádřenému imunodeficitu, nelze při vědomí měsíce přetrvávajícího imunodeficitu rizika infekčních komplikací u této zcela specifické populace pacientů podceňovat. Každý pacient s porušenými imunitními funkcemi by měl všeobecně znát a dodržovat režimová opatření.
Režimová opatření při prevenci infekčních komplikací u imunokompromitovaného pacienta
- nekouřit, nebýt ani pasivním kuřákem (poškození respiračního epitelu zvyšuje náchylnost k infekcím)
- neporanit se a nebýt poraněn či pokousán zvířaty
- jakékoli (i drobné) poranění ihned dezinfikovat a v případě rozvoje hnisavé sekrece časně vyhledat lékaře
- vyhýbat se evidentně nemocným lidem a v případě epidemie/pandemie i velkým kolektivům
- při plánování cesty do zahraniční konzultovat s odborníkem na cestovní medicínu
- při horečce > 38 °C časně vyhledat lékaře
Specifická preventivní opatření
Specifická preventivní opatření slouží k minimalizaci pravděpodobnosti infekčního onemocnění. U imunokompromitovaných pacientů všeobecně platí kontraindikace živých vakcín. Až 60 % pacientů po léčbě rituximabem nevykazuje adekvátní postvakcinační odezvu po dobu 1 roku [27]. Během imunosupresivní léčby je výrazně méně ovlivněna imunitní odezva na přídatnou dávku vakcíny (tzv. booster) než na primární vakcinaci – proto je důležité očkování zahájit, pokud možno, před zahájením imunosupresivní léčby. Možné negativní vlivy léčby rituximabem na funkce imunitního systému a ideální interval pro vakcinační prevenci znázorňuje schéma. Mezi hlavní příčiny morbidity a mortality u osob s dysfunkcí imunitního systému patří chřipka a jiná infekční onemocnění [28,29]. V následujících oddílech bude pojednáno o možnostech prevence jednotlivých infekčních onemocnění.
Chřipka
Virus chřipky představuje pro imunokompromitované jedince závažné riziko morbidity i mortality, velice časté jsou i sekundární bakteriální superinfekce (nejčastěji způsobené pneumokoky). Vakcinace proti chřipce má jednoznačně prokázánu vysokou účinnost i bezpečnost, a to i u imunokompromitovaných, onkologických či revmatologických pacientů, u nichž je však třeba striktně dbát na aplikaci inaktivované (neživé) vakcíny. Z těchto důvodů je nezbytné věnovat prevenci chřipky maximální pozornost. Obavy ze zhoršení základního autoimunitního onemocnění nebo jeho indukce nebyly v četných studiích věnovaných tomuto tématu potvrzeny. Pro názornost: riziko rozvoje syndromu Guillaina-Barrého je po nákaze virem chřipky asi 4–7krát vyšší než po samotné vakcinaci proti chřipce [29]. Vzhledem k tomu, že doba syntézy postvakcinačních protilátek pro dosažení protektivního titru trvá asi 10–14 dnů, je třeba zahájit vakcinaci před možnou expozicí. Ošetřující lékař by měl očkovaného imunokompromitovaného pacienta upozornit, že účinnost vakcíny může být nižší než u zdravého jedince, a proto je nezbytné dodržovat i nespecifická preventivní opatření. Vakcinace u pacientů s revmatoidní artritidou je bezpečná a účinná i při probíhající léčbě prednisonem, antiTNF a syntetickými chorobu modifikujícími léky (synthetic disease modifying antirheumatic drugs – sDMARDs), je však vhodné pokusit se o aplikaci vakcíny v době užívání co nejnižších dávek těchto léků. Předchozí léčba rituximabem může výrazně ovlivnit postvakcinační odezvu daného jedince. Ve studii u revmatologických pacientů byla pozorována výrazně horší postvakcinační protilátková odezva v podskupině léčené rituximabem ve srovnání s metotrexátem. Tento jev byl potvrzen v metaanalýze studií zaměřených na očkování proti chřipce a pneumokokům u pacientů s revmatoidní artritidou léčených rituximabem [1,30,31]. Výrazně zhoršená imunogenicita vakcíny proti viru pandemické chřipky H1N1 byla popsána po kombinované léčbě kortikosteroidy, chemoterapii a po rituximabu. Jak bylo již výše zmíněno, může tranzientní hypogamaglobulinemie perzistovat i řadu měsíců po předchozí aplikaci rituximabu. Z praktického hlediska to znamená možnost expozice 1 i více epidemiím chřipky. Ošetřující lékař by proto měl pacienta cíleně upozornit na nutnost prevence jakýchkoli infekčních onemocnění minimálně po dobu 6–12 měsíců po aplikaci rituximabu. Je-li pravděpodobnost navození adekvátní postvakcinační odezvy malá (a týká se to nejen očkování proti chřipce), pak je indikováno cílené očkování všech blízkých osob pacienta (tzv. kokonová strategie) [32].
Pneumokoková onemocnění
Invazivní pneumokoková onemocnění (IPO), kam patří pneumonie s bakteriemií, pneumokoková sepse a pneumokoková meningitida, jsou u imunokompromitovaných pacientů výrazně četnější a jsou zatížena vyšší mortalitou než u jinak zdravé populace. Výskyt pneumokokových infekcí ročně kopíruje rozvoj chřipkové epidemie [33]. Hlavním faktorem virulence pneumokoků je (obdobně jako u meningokoků) polysacharidové pouzdro, které jim umožňuje odolat obraně nespecifické složky imunitního systému. Před fagocytózou musí být antigeny polysacharidového pouzdra nejdříve opsonizovány specifickými protilátkami. Tyto protilátky jsou záhy po nákaze tvořeny paměťovými B-lymfocyty sídlícími ve slezině – proto jsou všichni jedinci s porušenou či zaniklou funkcí sleziny zvýšeně náchylní k IPO [34,35]. V současnosti je známo přibližně 100 sérotypů pneumokoků a proti 23 nejčastějším sérotypům, které působí IPO, je dostupná vakcinace. Dle mezinárodních doporučení adaptovaných i Českou vakcinologickou společností, Českou revmatologickou společností a Českou onkologickou společností platí následující očkovací schéma:
Schéma. Negativní vlivy léčby rituximabem na funkce imunitního systému a ideální interval pro vakcinační prevenci 
- jedna dávka polyvalentní konjugované vakcíny (Prevenar 13®) bez nutnosti přeočkování
- za 2–6 měsíců poté jedna dávka polyvalentní polysacharidové vakcíny (Pneumo 23®) s jednorázovým přeočkováním po 5 letech
Aplikace konjugované vakcíny jako první v pořadí je nesmírně důležitá pro navození dlouhodobé imunitní paměti, kterou polysacharidová vakcína neindukuje. Jelikož může být po aplikaci rituximabu postvakcinační odezva výrazně horší při současně značně vyšším riziku IPO, je paušálně doporučeno očkování proti pneumokokům všem pacientům před léčbou rituximabem, vakcinace by se měla dokončit alespoň 3–4 týdny před zahájením léčby [17,28,31,36,37]. V praxi to znamená, že pokud má pacient obdržet oba typy vakcín, je třeba s vakcinací začít přibližně 8–10 týdnů před zahájením léčby rituximabem! Zajímavé jsou výsledky 2leté celonárodní francouzské studie zaměřené na očkování u pacientů s imunitní trombocytopenií (n = 534). Ve skupině pacientů se zachovalou slezinou (n = 423) bylo pouze 32,4 % jedinců očkováno proti pneumokokům, 18,9 % proti Haemophilus influenzae skupiny b a 3,8 % proti meningokokům. Vakcinaci proti pneumokokům i meningokokům obdrželo pouze 3,5 % pacientů a proti všem 3 zmíněným agens bylo očkováno pouze 2,8 % jedinců. Pouze u 7,3 % pacientů v této podskupině bylo očkování dokončeno 4 týdny před zahájením léčby rituximabem. V podskupině pacientů po splenektomii bez předchozí expozice rituximabu (n = 111) bylo proti pneumokokům očkováno 57,7 %, proti Haemophilus influenzae skupiny b 37,6 % a proti meningokokům 9,9 %. Vakcinaci proti pneumokokům a meningokokům obdrželo pouze 9,0 % pacientů. Celá 1/3 všech pacientů byla očkována až během léčby rituximabem! Z toho autoři studie vyvodili logický závěr, že tato očkování je nutné zvážit a doporučit časně po stanovení diagnózy imunitní trombocytopenie, ačkoli chronická forma s případnou splenektomií či imunosupresivní léčbou (včetně rituximabu) se vyvine jen u 70 % postižených [27].
Ostatní vakcíny
Vysoké riziko systémového onemocnění způsobeného vakcinálním virem je při očkování proti žluté zimnici – toto očkování by proto mělo být přísně selektivní po zvážení přínosu a rizik. Aplikace vakcín proti viru varicely a zosteru a proti břišnímu tyfu musí být rovněž indikována individuálně. U mladých žen (do 26 let věku) trpících systémovým lupus erythematodes doporučují někteří autoři očkování proti lidským papilomavirům. Ke zvážení je aktivní pátrání po stavu očkování proti zarděnkám, spalničkám a viru parotitidy u blízkých příbuzných imunokompromitovaného jedince a případně je očkovat, respektive vakcinaci dokončit alespoň 4 týdny před zahájením léčby rituximabem (jedná se o živou vakcínu). Pro případy nutné postexpoziční profylaxe je k dispozici specifický imunoglobulin [29]. Oren ve své studii neprokázal depleci protilátek proti tetanickému toxoidu po jednom cyklu léčby rituximabem [14]. Small studoval odezvu na kombinovanou vakcínu proti difterii, tetanu a acelulární pertusi (dTap) u pacientů po transplantaci kmenových buněk periferní krve (peripheral blood stem cell transplantation – PBSCT). Nezávisle na věku, době uplynulé od transplantace a na základní diagnóze bylo zaznamenáno chybění protilátek proti tetanu i proti difterii v 1/3 souboru a chybění protilátek proti pertusi u 1/2 souboru. U 28 jedinců byla aplikována vakcína dTap (Adacel®) 36 měsíců po PBSCT, medián doby od poslední dávky rituximabu byl 31 měsíců. Před tímto očkováním nemělo žádné protilátky proti pertusi 77 % pacientů, proti tetanu 24 % a proti difterickému toxinu 28 % jedinců v souboru. U naprosté většiny z nich nebyl pozorován vzestup protilátek proti pertusi (93 %) a u žádného pacienta léčeného rituximabem nebyla zaznamenána žádná (!) postvakcinační protilátková odezva po aplikaci dTap (nejhorší parametry byly u pacientů s diagnózou non-Hodgkinova lymfomu) [38]. Tato fakta svědčí pro výrazně zvýšené riziko těchto infekčních komplikací u populace léčené rituximabem. Naopak u 39 pacientů po transplantaci ledviny léčených rituximabem byla postvakcinační protilátková odezva po aplikaci tetanického toxoidu pozorována u 31 % jedinců, a to i u některých jedinců s kompletní deplecí B-lymfocytů. V kontrolní skupině, u níž v léčbě rituximab použit nebyl, byla tato protilátková postvakcinační odezva výrazně vyšší. Postvakcinační odezva na tetanický toxoid je tedy v tuto chvíli nepředvídatelná, a proto je třeba na adekvátní prevenci pomýšlet již v době plánování léčby rituximabem. Pro klinickou praxi je významné zjistit dobu poslední aplikace tetanického anatoxinu a případně revakcinovat alespoň 2 týdny před zahájením léčby rituximabem [39].
Prevence reaktivace endogenních virových infekcí
U pacientů s přítomností anamnestických protilátek proti CMV jsou možné 2 terapeutické přístupy:
- preemptivní, kdy je v 7–14 denních cyklech monitorována koncentrace deoxyribonukleové kyseliny cytomegaloviru (CMV-DNA) v séru pacienta a dle dynamiky se případně zváží antivirová terapie anebo
- profylaktická antivirové léčba po předem definovanou dobu [22]
Jak již bylo výše uvedeno, léčba rituximabem není doporučována pacientům se sérologickými známkami dříve prodělané virové hepatitidy B pro vysoké riziko reaktivace zatížené až 50% mortalitou. Reaktivaci ostatních možných virových agens zmíněných výše nelze v současnosti zabránit.
Prevence nákaz spojených s nemocniční péčí
Pacienti léčení rituximabem jsou často komplexně nemocní a vyžadují nezřídka opakovanou či dlouhodobou péči za hospitalizace, což s sebou automaticky přináší i invazivní výkony, dlouhodobou přítomnost cizích těles v organizmu (např. katétrů) apod. Každý ošetřující lékař či konziliář by měl být seznámen s tíží imunodeficitu konkrétního nemocného a podrobně i s jeho předchozí anamnézou a adekvátně jim přizpůsobit další diagnosticko-léčebný proces [6].
Stručné shrnutí doporučení pro praxi
- edukace pacienta i ošetřujících lékařů o chronickém imunodeficitu indukovaném léčbou rituximabem; nezapomínat na rizika spjatá s cestováním a s přítomností cizích těles v organizmu
- sledovat koncentraci imunoglobulinu IgG před léčbou i po léčbě rituximabem pro možnost rozvoje hypogamaglobulinemie; z klinického hlediska je alarmující koncentrace IgG < 4 g/l
- pravidelně sledovat krevní obraz i po aplikaci rituximabu pro rizika pozdní neutropenie
- relativní kontraindikace živých vakcín
- všechny vakcíny nejlépe aplikovat před zahájením léčby rituximabem v dostatečném časovém předstihu umožňujícím syntézu protilátek
- mezi hlavní preventabilní rizika patří chřipka, invazivní pneumokoková onemocnění a reaktivace virové hepatitidy B
- v případě systémových infekčních komplikací je indikováno podání IVIG v dávce 0,4 g/kg tělesné hmotnosti do maximální celkové dávky 2,0 g/kg
Závěr
Autoři upozorňují na časné i pozdní nežádoucí účinky léčby rituximabem především v souvislosti s prevencí možných závažných infekčních komplikací. Důraz je kladen na vakcinaci v dostatečném předstihu před zahájením léčby rituximabem a na rizika spjatá s deplecí B-lymfocytů po dobu následujících měsíců. O těchto rizicích by měl být v adekvátní formě informován ošetřující lékař i pacient. Práce je současně výzvou pro vytvoření jednotného doporučení prevence infekčních komplikací u pacientů léčených rituximabem, které by bylo schváleno patřičnými odbornými společnostmi České lékařské společnosti J. E. Purkyně.
MUDr. Pavel Polák, Ph.D.
pavel.polak@fnbrno.cz
Oddělení klinické hematologie FN Brno
www.fnb.cz
Doručeno do redakce 15. 1. 2016
Přijato po recenzi 15. 2. 2016
Sources
1. Makatsori M, Kiani-Alikhan S, Manson AL et al. Hypogammaglobulinaemia after rituximab treatment-incidence and outcomes. QJM 2014; 107(10): 821–828.
2. Adam Z, Pejchalová A, Chlupová G et al. Nemoc chladových aglutininů nereagující na léčbu glukokortikoidy a na léčbu rituximabem. Jaký postup zvolit pro III. linii léčby? Popis případu a přehled literatury. Vnitř Lék 2013; 59(9): 828–840.
3. Červinek L, Černá O, Čaniga M et al. Efficacy of rituximab in primary immune thrombocytopenia: an analysis of adult pretreated patients from everyday hematological practice. Int J Hematol 2012; 96(5): 594–599.
4. Hrodek O. A phase 2 study of the safety and efficacy of rituximab with plasma exchange in acute acquired thrombotic thrombocytopenic purpura. Transfuze a hematologie dnes 2011; 17(4): 187.
5. Zappasodi R, de Braud F, Di Nicola M. Lymphoma immunotherapy: current status. Front Immunol 2015; 6 : 448.
6. Hutchinson AL, Tan YL, Kidson-Gerber G. A case of an acquired factor VIII inhibitor complicated by multiple treatment-related opportunistic infections and review of the literature. Case Rep Hematol 2013; 2013 : 703027. Dostupné z DOI: <http://dx.doi.org/10.1155/2013/703027>.
7. Worch J, Makarova O, Burkhardt B. Immunreconstitution and infectious complications after rituximab treatment in children and adolescents: what do we know and what can we learn from adults? Cancers (Basel) 2015; 7(1): 305–328.
8. Souhrn údajů o přípravku. Dostupné z WWW: <http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000165/WC500025821.pdf>.
9. Hirai Y, Ainoda Y, Shoji T et al. Disseminated cryptococcosis in a non-Hodgkin’s lymphoma patient with late-onset neutropenia following rituximab-CHOP chemotherapy: a case report and literature review. Mycopathologia 2011; 172(3): 227–232.
10. Salmon JH, Cacoub P, Combe B et al. Late-onset neutropenia after treatment with rituximab for rheumatoid arthritis and other autoimmune diseases: data from the AutoImmunity and Rituximab registry. RMD Open 2015; 1(1): e000034. Dostupné z DOI: <http://dx.doi.org/10.1136/rmdopen-2014–000034>.
11. Palacios T, Bartelt L, Scheld W et al. Fatal Coxsackie meningoencephalitis in a patient with B-cell lymphopenia and hypogammaglobulinemia following rituximab therapy. Ann Allergy Asthma Immunol 2015; 115(2): 148–150.
12. Casulo C, Maragulia J, Zelenetz AD. Incidence of hypogammaglobulinemia in patients receiving rituximab and the use of intravenous immunoglobulin for recurrent infections. Clin Lymphoma Myeloma Leuk 2013; 13(2): 106–111.
13. van Vollenhoven RF, Fleischmann RM, Furst DE et al. Longterm safety of rituximab: final report of the rheumatoid arthritis global clinical trial program over 11 years. J Rheumatol 2015; 42(10): 1761–1766.
14. Oren S, Mandelboim M, Braun-Moscovici Y et al. Vaccination against influenza in patients with rheumatoid arthritis: the effect of rituximab on the humoral response. Ann Rheum Dis 2008; 67(7): 937–941.
15. Lanini S, Molloy AC, Prentice AG et al. Infections in patients taking rituximab for hematologic malignancies: two-year cohort study. BMC Infect Dis 2013; 13 : 317. Dostupné z DOI: <http://dx.doi.org/10.1186/1471–2334–13–317>.
16. Chen DR, Cohen PL. Living life without B cells: is repeated B-cell depletion a safe and effective long-term treatment plan for rheumatoid arthritis? Int J Clin Rheumatol 2012; 7(2): 159–166.
17. Heusele M, Clerson P, Guery B et al. Risk factors for severe bacterial infections in patients with systemic autoimmune diseases receiving rituximab. Clin Rheumatol 2014; 33(6): 799–805.
18. Morjaria S, Arguello E, Taur Y et al. West Nile virus central nervous system infection in patients treated with rituximab: implications for diagnosis and prognosis, with a review of literature. Open Forum Infect Dis 2015; 2(4): ofv136. Dostupné z DOI: <http://dx.doi.org/10.1093/ofid/ofv136>.
19. Morgan C, Thomson SJ, Legg J et al. A case of fulminant hepatitis due to echovirus 9 in a patient on maintenance rituximab therapy for follicular lymphoma. Case Rep Hematol 2015; 2015 : 454890. Dostupné z DOI: <http://dx.doi.org/10.1155/2015/454890>.
20. Tsai MJ, Chou CW, Lin FC et al. Pneumocystis jiroveci pneumonia in patients with systemic lupus erythematosus after rituximab therapy. Lupus 2012; 21(8): 914–918.
21. Holik H, Coha B, Šiško M et al. Leuconostoc sp. meningitis in a patient treated with rituximab for mantle cell lymphoma. Turk J Haematol 2015; 32(3): 271–274.
22. Hilal T. Fatal cytomegalovirus disease after combination therapy with corticosteroids and rituximab for granulomatosis with polyangiitis. Case Rep Rheumatol 2015; 2015 : 538137. Dostupné z DOI: <http://dx.doi.org/10.1155/2015/538137>.
23. Okamoto A, Abe A, Okamoto M et al. Severe hepatitis associated with varicella zoster virus infection in a patient with diffuse large B cell lymphoma treated with rituximab-CHOP chemotherapy. Int J Hematol 2012; 96(4): 516–520.
24. Yang SH, Lin LW, Fang YJ et al. Parvovirus B19 infection-related acute hepatitis after rituximab-containing regimen for treatment of diffuse large B-cell lymphoma. Ann Hematol 2012; 91(2): 291–294.
25. Hsiao LT, Chiou TJ, Gau JP et al. Risk of reverse seroconversion of hepatitis B virus surface antigen in rituximab-treated non-hodgkin lymphoma patients: a large cohort retrospective study. Medicine (Baltimore) 2015; 94(32): e1321. Dostupné z DOI: <http://dx.doi.org/10.1097/MD.0000000000001321>.
26. Tonziello G, Pisaturo M, Sica A et al. Transient reactivation of occult hepatitis B virus infection despite lamivudine prophylaxis in a patient treated for non-Hodgkin lymphoma. Infection 2013; 41(1): 225–229.
27. Moulis G, Lapeyre-Mestre M, Mahévas M et al. Need for an improved vaccination rate in primary immune thrombocytopenia patients exposed to rituximab or splenectomy. A nationwide population-based study in France. Am J Hematol 2015; 90(4): 301–305.
28. Eisenberg RA, Jawad AF, Boyer J et al. Rituximab-treated patients have a poor response to influenza vaccination. J Clin Immunol 2013; 33(2): 388–396.
29. Bühler S, Eperon G, Ribi C et al. Vaccination recommendations for adult patients with autoimmune inflammatory rheumatic diseases. Swiss Med Wkly 2015; 145: w14159. Dostupné z DOI: <http://dx.doi.org/10.4414/smw.2015.14159>.
30. Westra J, van Assen S, Wilting KR et al. Rituximab impairs immunoglobulin (Ig)M and IgG (subclass) responses after influenza vaccination in rheumatoid arthritis patients. Clin Exp Immunol 2014; 178(1): 40–47.
31. Hua Ch, Barnetche T, Combe B et al. Effect of methotrexate, anti–tumor necrosis factor-α, and rituximab on the immune response to influenza and pneumococcal vaccines in patients with rheumatoid arthritis: a systematic review and meta-analysis. Arthritis Care & Research 2014; 66(7): 1016–1026.
32. Ide Y, Imamura Y, Ohfuji S et al. Immunogenicity of a monovalent influenza A(H1N1)pdm09 vaccine in patients with hematological malignancies. Hum Vaccin Immunother 2014; 10(8): 2387–2394.
33. Kozáková J, Šebestová H, Křížová P. Invazivní pneumokokové onemocnění v České republice v roce 2014. CEM - SZÚ Praha. Zprávy Centra epidemiologie a mikrobiologie 2015; 24(3): 96–101.
34. Polák P, Kosina P, Blechová Z et al. Doporučený postup péče o pacienty s porušenou či zaniklou funkcí sleziny (hyposplenismem/asplenií). Mezioborové doporučení Společnosti infekčního lékařství a České vakcinologické společnosti ČLS JEP. Dostupné z WWW: <http://www.vakcinace.eu/doporuceni-a-stanoviska>.
35. Polák P, Freibergerová M, Husa P et al. Upozornění na nebezpečí invazivních infekcí u splenektomovaných pacientů. Zkušenosti z FN Brno, 2011. Vnitř Lék 2012; 58(9): 665–667.
36. Stanovisko České revmatologické společnosti k očkování dospělých pacientů s autoimunitním revmatickým onemocněním k prevenci onemocnění způsobených Streptococcus pneumoniae (pneumokokem). Dostupné z WWW: <http://www.revmatologicka-spolecnost.cz/doporucene-postupy-crs>.
37. Vakcinace u dospělých pacientů se solidními nádory a profylaxe infekcí u nemocných po splenektomii. Dostupné z WWW: <http://www.linkos.cz/informace-pro-praxi/modra-kniha/38-vakcinace-u-dospelych-pacientu-se-solidnimi-nadory-a-profylaxe-infekci-u-nemocnych-po-splenektomii/>.
38. Small TN, Zelenetz AD, Noy A et al. Pertussis immunity and response to tetanus-reduced diphtheria-reduced pertussis vaccine (Tdap) after autologous peripheral blood stem cell transplantation. Biol Blood Marrow Transplant 2009; 15(12): 1538–1542.
39. Puissant-Lubrano B, Rostaing L, Kamar N et al. Impact of rituximab therapy on response to tetanus toxoid vaccination in kidney-transplant patients. Exp Clin Transplant 2010; 8(1): 19–28.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 5-
All articles in this issue
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
- Diagnostika cystické fibrózy u dospělých
- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Idiopatické střevní záněty jako protrombotický stav
- Klinické dôsledky syndrómu polycystických ovárií
- Léčba rituximabem jako výzva k prevenci infekčních komplikací
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Využití nových léků v primoterapii mnohočetného myelomu
- Účinnost léčby lokální reziduální neoplazie za standardizovaných podmínek
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Diagnostika cystické fibrózy u dospělých
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

