-
Medical journals
- Career
Klinické dôsledky syndrómu polycystických ovárií
Authors: Ingrid Dravecká
Authors‘ workplace: I. interná klinika LF UPJŠ a UN L. Pasteura Košice, Slovenská republika
Published in: Vnitř Lék 2016; 62(5): 392-397
Category: Reviews
Overview
Syndróm polycystických ovárií (PCOS) je heterogénne a komplexné endokrinné ochorenie, ktoré v ženskej populácii patrí medzi najrozšírenejšie endokrinopatie a je najčastejšou príčinou hyperandrogenizmu, oligoanovulácie a infertility. Inzulínová rezistencia patrí medzi dôležité patogenetické faktory ovplyvňujúce hyperandrogenémiu u väčšiny žien s PCOS (60–80 %). Medzi klinické prejavy PCOS patria reprodukčné poruchy, metabolické črty a psychologické dôsledky. Reprodukčné poruchy zahŕňajú hyperandrogenizmus, menštruačné poruchy, infertilitu a tehotenské komplikácie ako včasné potraty, gestačný diabetes a tehotenstvom indukovanú hypertenziu. K neskorým metabolickým rizikám PCOS patria diabetes mellitus 2. typu, dyslipidémia, artériová hypertenzia a porucha funkcie endotelu. Dostupné dáta potvrdzujú u žien s PCOS častejší výskyt kardiovaskulárnych ochorení. Hlavne u obéznych žien je PCOS častejšie asociovaný s nealkoholovou steatózou pečene, syndrómom spánkového apnoe a endometriálnym karcinómom. Literatúra uvádza kontroverzné údaje o asociácii medzi PCOS a autoimunitou. Ženy s PCOS sú viac náchylné k nedostatočnému sebavedomiu s častejším výskytom úzkosti, depresie, bipopárnej poruchy, anxiety a porúch príjmu potravy.
Kľúčové slová:
autoimunita – diabetes mellitus – gravidita – inzulínová rezistencia – metabolický syndróm – poruchy menštruačného cyklu – syndróm polycystických ováriíÚvod
Syndróm polycystických ovárií (PCOS) je heterogénne a komplexné endokrinné ochorenie, ktoré v ženskej populácii patrí medzi najrozšírenejšie endokrinopatie a je najčastejšou príčinou hyperandrogenizmu, oligoanovulácie a infertility [1,2]. Pacientky majú zvýšené riziko rozvoja diabetes mellitus 2. typu (DM2T), kardiovaskulárnych ochorení, gestačného diabetes mellitus (GDM) a endometriálneho karcinómu schéma [3,4].
Schéma. Reprodukčné a metabolické črty PCOS potencované hmotnosťou v priebehu života ženy. 
Upravené podľa [4] Syndróm, popísaný v roku 1935 Steinom a Leventhalom, sa vyznačoval morfologicky polycystickými ováriami (PCO), klinickými poruchami cyklu a fertility, príznakmi hyperandrogenémie a obezitou [5]. PCOS bol historicky považovaný za gynekologické ochorenie komplikované sprievodnou obezitou. Až v posledných desaťročiach vyšla najavo jeho jasná súvislosť s metabolickými ochoreniami vrátane DM2T. Okrem gynekológov patrí teda aj do starostlivosti internistov, diabetológov, endokrinológov a obezitológov [6].
Prevalencia a diagnostické kritériá fenotypov PCOS na základe rôznych kritérií
PCOS je pravdepodobne kontinuum fenotypov od ovulujúcich žien s laboratórne dokázanou hyperandrogenémiou a morfologickým nálezom PCO bez inzulínovej rezistencie cez ženy s rôznymi klinickými prejavmi hyperandrogenémie ako hirzutizmus, alopécia alebo akné relatívne bez porúch menštruačného cyklu až po ženy s chronickou anovuláciou, infertilitou a ťažkou inzulínovou rezistenciou [7]. Prevalencia PCOS sa líši v závislosti od kritérií hodnotenia. Podľa Rotterdamských kritérií je 2–3-krát vyššia (15–25 %) ako podľa NIH/NICHD (National Institute of Health/National Institute of Child Health and Human Disease) 6–8 % žien v kaukazskej populácii, kým podľa AES (Androgen Excess Society) odporúčaní je to 10–15 % [5,8]. Prevalencia v černošskej a hispánskej populácii je vyššia ako v kaukazskej [6].
Definícia PCOS je založená na prítomnosti hyperandrogenizmu, menštruačných porúch (chronickej oligo-anovulácie) a ultrasonografickom náleze PCO po vylúčení iných príčin hyperandrogenizmu [2,5,9]. Inzulínová rezistencia a s ňou asociovaná hyperinzulinémia patria medzi dôležité patogenetické faktory ovplyvňujúce hyperandrogenémiu u väčšiny žien s PCOS, hlavne obéznych, aj keď môžu byť prítomné aj u neobéznych žien s PCOS [9].
Diagnostické kritériá PCOS boli navrhnuté tromi skupinami: NIH/NICHD, ESHR/ASRM (European Society for Human Reproduction and Embryology/American Society for Reproductive Medicine) a AES tab. 1 [3,4,10]. Porovnanie rozdielnych diagnostických kritérií PCOS s následnými rozdielnymi fenotypmi uvádza tab. 2.
Table 1. Kritériá diagnózy 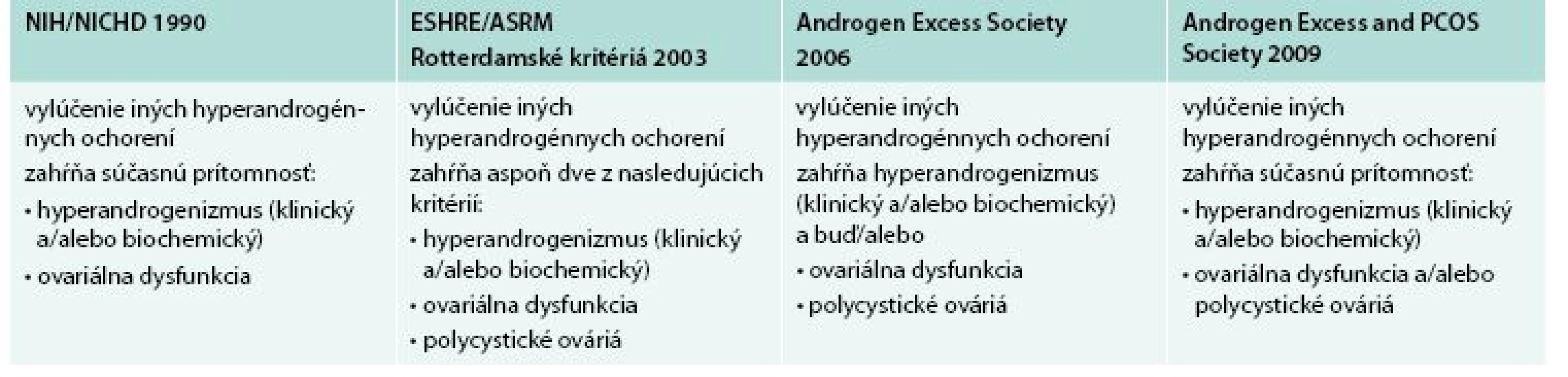
PCOS NIH/NICHD (National Institute of Health/National Institute of Child Health and Human Disease), ESHR/ASRM (European Society for Human Reproduction and Embryology and American Society for Reproductive Medicine), AES (Androgen Excess Society) Upravené podľa [5,8] Table 2. Fenotypy PCOS podľa rozdielnych diagnostických kritérií. 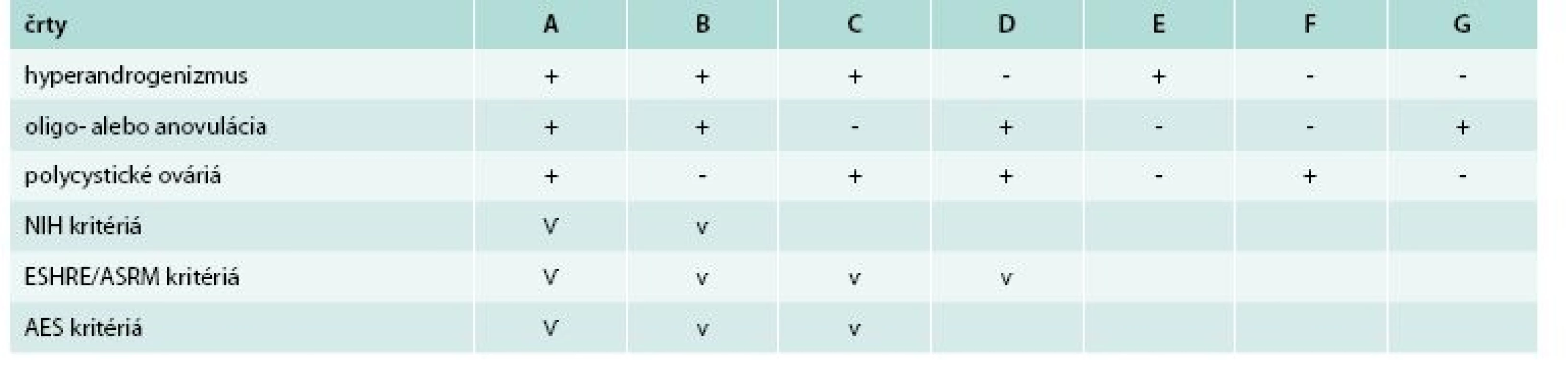
Upravené podľa [8,11,12] Pre zjednodušenie môže byť PCOS rozdelený na 4 reprodukčné fenotypy: PCOS s PCO (fenotyp A) alebo bez PCO (fenotyp B), biochemický/klinický hyperandrogenizmus s PCO, ale bez oligo/anovulácie (fenotyp C), alebo bez hyperandrogenizmu s PCO a oligo/anovuláciou (fenotyp D). Ostatné fenotypy zahŕňajú izolovanú prítomnosť hyperandrogenizmu (fenotyp E), PCO (fenotyp F) alebo oligo/anovulácie (fenotyp G) [11]. Hoci obezita a inzulínová rezistencia nie sú univerzálne a nie sú súčasťou definície, vyskytujú sa pri tomto syndróme veľmi často [12,13].
Klinické prejavy PCOS môžu byť rozdelené na 3 oblasti: reprodukčné poruchy, metabolické črty a psychologické dôsledky.
Reprodukčné poruchy PCOS
Reprodukčné poruchy zahŕňajú hyperandrogenizmus, menštruačné poruchy, infertilitu a tehotenské komplikácie ako včasné potraty, GDM, tehotenstvom indukovanú hypertenziu a novorodenecké komplikácie [11]. Ovariálna dysfunkcia, ktorá je prítomná u 70–80 % žien s PCOS, sa manifestuje ako oligomenorea a amenorea, čo je dôsledok chronickej anovulácie [14]. Oligomenorea je definovaná ako menštruačné cykly dlhšie ako 35 dní alebo menej ako 5 cyklov ročne, pričom cykly sú anovulačné. Primárna amenorea je definovaná ako chýbanie menštruácie od veku 15 rokov pri normálnom raste a vývoji sekundárnych pohlavných znakov [15]. Hoci 60 % žien s PCOS je fertilných, čas ku koncepcii je predĺžený. Obezita je nezávislý rizikový faktor infertility. Znižuje úspešnosť liečby infertility a zvyšuje tehotenské komplikácie vrátane potratov. Preto sa pred otehotnením odporúča pokles hmotnosti [14].
Metabolické črty reprodukčných fenotypov PCOS
V poslednom období vystupuje do popredia otázka súvislosti PCOS s metabolickými poruchami, predovšetkým s inzulínovou rezistenciou a obezitou. Keďže samotná etiopatogenéza PCOS nie je stále úplne objasnená, tým menej je jasné, koho a ako postihujú neskoré riziká PCOS, ku ktorým patrí DM2T, dyslipidémia, artériová hypertenzia, elevácia CRP a homocysteínu, porucha funkcie endotelu a hrubšia stena intima media. Nie je celkom jasné, či sa u žien s PCOS vyskytujú častejšie aj kardiovaskulárne príhody. Hlavne u obéznych žien je PCOS častejšie asociovaný s nealkoholovou steatohepatitídou, syndrómom spánkového apnoe a endometriálnym karcinómom [16,26].
Inzulínová rezistencia sa vyskytuje u 60–80 % žien s PCOS a u 95 % obéznych žien s PCOS. Tieto ženy majú inzulínovú rezistenciu nezávislú od obezity, ale obezita ju potencuje. Odhadovaná prevalencia metabolického syndrómu v populácii žien s klasickým PCOS v USA je 33–47 %, čo je 2–3-krát vyššie než u vekovo podobných kontrol. V ostatných krajinách je prevalencia metabolického syndrómu v populácii žien s PCOS nižšia, okolo 8–25 %, hoci po adjustácii na BMI je nižšia u neobéznych žien s PCOS [17].
PCOS je výrazný rizikový faktor poruchy glukózovej tolerancie a diabetes mellitus 2. typu. Inzulín-rezistentné pacientky s PCOS si udržiavajú svoju glykémiu vďaka kompenzačnej hypersekrécii inzulínu, čo vedie k riziku vyčerpania B-buniek [18,19]. PCOS je asociovaný s 5–8-násobným rizikom DM2T v porovnaní s vekovo a hmotnostne podobnými kontrolami bez ohľadu na etnicitu a geografickú polohu [18,20]. DM2T sa častejšie vyskytuje u obéznych žien s PCOS [9]. Konverzia z porušenej glukózovej tolerancie (PGT) na DM2T je u žien s PCOS 5–10-krát vyššia v porovnaní s vekovo porovnateľnou skupinou. Vyšší výskyt PGT a DM2T bol pozorovaný aj u štíhlych žien s PCOS [15]. Na druhej strane inzulínová rezistencia a DM2T sa nevyskytujú u všetkých žien s PCOS [21]. U 40 % žien s klasickým PCOS sa vyvinie PGT alebo DM2T do 4. dekády života [17]. Alarmujúci je výskyt PGT a DM2T už u 15 až 20-ročných dievčat s PCOS [17,21].
Ženy s PCOS majú vyššiu prevalenciu artériovej hypertenzie (10–40 %) v porovnaní s bežnou populáciou [5,18,22]. Retrospektívne štúdie potvrdili 4 až 11-krát signifikantne zvýšené riziko hypertenzie u žien s PCOS [20]. Avšak štúdie väčšinou nezohľadňovali obezitu ako rizikový faktor hypertenzie [18]. V niektorých štúdiách po adjustácii na BMI nebola asociácia medzi PCOS a hypertenziou jednoznačná [22]. Potenciálny mechanizmus hypertenzie pri PCOS zahŕňa endotelovú dysfunkciu so zvýšenou hladinou endotelínu 1 [5] a sekundárne potencovanú retenciu sodíka pri inzulínovej rezistencii s hyperinzulinémiou. Hyperandrogenémia je pri PCOS asociovaná s hypertenziou nezávisle od obezity a hyperinzulinémie. Zvýšená sympatiková aktivita taktiež prispieva k etiológii hypertenzie v tejto populácii žien. U žien s PCOS bola potvrdená signifikantná priama korelácia medzi aldosterónom a inzulinémiou nalačno, HOMA IR (index inzulínovej rezistencie), hsCRP (vysoko senzitívny C reaktívny proteín), hrúbkou intima media a priemerným krvným tlakom [22].
Dyslipidémia je najbežnejšou metabolickou abnormalitou u žien s PCOS, hoci jej typ a rozsah je variabilný [20,23]. Lipidové abnormality sa najčastejšie vyskytujú vo 4. dekáde života, čím prispievajú k faktorom zvýšeného kardiovaskulárneho rizika týchto žien. U žien s PCOS vekom výraznejšie stúpa hladina celkového a LDL-cholesterolu [24]. Paradoxné je, že väčšie rozdiely v porovnaní so zdravými kontrolami sú prítomné u mladých žien s PCOS, kým po 40.–45. roku sa rozdiely stierajú [16]. Najčastejšie sa vyskytuje tzv. aterogénny lipoproteínový fenotyp zahŕňajúci nízky HDL-cholesterol, zvýšené hladiny TAG a LDL-cholesterolu [5]. U žien s PCOS sú v porovnaní s kontrolami zvýšené malé denzné LDL-častice [25]. Prítomnosť malých denzných LDL častíc dokonca aj pri normálnom LDL-cholesterole je asociovaná s vyššou incidenciou koronárnej choroby srdca [24].
U žien s PCOS bola taktiež popísaná zvýšená prevalencia nealkoholovej steatózy pečene a steatohepatitídy [26,27]. Hlavnými faktormi steatózy u týchto žien sú obezita, inzulínová rezistencia a sprievodná hyperandrogenémia, ktorá je hlavnou črtou PCOS. Medzi dôležité terapeutické intervencie pri steatóze pečene u žien s PCOS patria zmena životného štýlu, pokles hmotnosti a z farmakologických modalít metformín, hoci stále neexistuje efektívna liečba nealkoholovej steatózy pečene [27].
PCOS je asociovaný s oxidačným stresom, pri ktorom je zvýšená produkcia voľných radikálov nasledovaná zníženou hladinou antioxidantov. Oxidačný stres sa pokladá za jeden z predispozičných faktorov rozvoja kardiovaskulárnych ochorení. Zvýšený oxidačný stres bol dokonca popísaný aj u štíhlych žien s PCOS. Pri nerovnováhe medzi oxidačnými a antioxidačnými faktormi v prospech prooxidačného stavu dochádza ku kumulácii ROS (reactive oxygen species) [24].
Dostupné dáta potvrdzujú u žien s PCOS častejší výskyt kardiovaskulárnych ochorení (KVO) [17]. Retrospektívne štúdie u žien s PCOS potvrdili 4 až 11-krát zvýšené riziko KVO [20]. U žien s PCOS sa udáva 5 až 7-násobné riziko rozvoja infarktu myokardu oproti vekovo porovnateľným kontrolám [18]. Ženy s nepravidelným menštruačným cyklom majú vyššie riziko nonfatálnej a fatálnej koronárnej choroby srdca. Nediabetické ženy s črtami PCOS majú signifikantne vyššiu prevalenciu KVO v porovnaní so ženami bez tohto fenotypu. Avšak väčšina súčasných dát je kontroverzná [22]. Podľa Wanga et al asociácia medzi nepravidelným menštruačným cyklom a zvýšeným rizikom kardiovaskulárnej mortality nebola po adjustácii na BMI štatisticky významná [28]. Tieto dáta sú v rozpore s metaanalýzou de Groota et al, ktorí popísali 2-násobne vyššie riziko koronárnej choroby srdca a cievnej mozgovej príhody u žien s PCOS v porovnaní so ženami bez PCOS aj po adjustácii na BMI [29]. Schmidt et al na základe prospektívnej 21-ročnej štúdie 35 žien s PCOS potvrdili vyššiu prevalenciu hypertenzie a vyššie hladiny triacylglycerolov (TAG). Prevalencia infarktu, cievnej mozgovej príhody, DM, karcinómov a mortality bola podobná ako u kontrolných žien s podobným BMI [30]. Na druhej strane Shaw et al v štúdii 104 postmenopauzálnych žien s klinickými črtami PCOS potvrdili, že boli častejšie diabetické, obézne, mali metabolický syndróm a častejšie angiograficky potvrdenú koronárnu chorobu srdca v porovnaní so ženami bez klinických prejavov PCOS [31].
Spánkové apnoe je nezávislým rizikovým faktorom KVO. Syndróm je asociovaný s inzulínovou rezistenciou, hypertenziou a zvýšenou hladinou proinflamačných a protrombotických faktorov, ktoré sú zahrnuté do aterogénneho procesu [22,26]. Je známa jeho nezávislá asociácia s inzulínovou rezistenciou a DM2T. U žien s PCOS sa popisuje jeho zvýšená prevalencia v porovnaní so ženami bez PCOS s podobnou hmotnosťou a vekom [26,32]. Podľa niektorých autorov je syndróm spánkového apnoe kľúčovým determinantom inzulínovej rezistencie a glukózovej intolerancie pri PCOS. Napriek vysokej prevalencii tohto syndrómu u žien s PCOS nie je známe, či jeho liečba môže upraviť kardiometabolické dôsledky a znížiť riziko skoršieho nástupu DM2T a KVO v tejto populácii [33].
Psychologické dôsledky PCOS
Dôsledky vyplývajúce z fenotypových zmien pri PCOS (akné, hirzutizmus, alopécia, obezita) spolu s infertilitou ovplyvňujú kvalitu života a majú nepriaznivý vplyv na psychické zdravie týchto žien. Ženy s PCOS sú viac náchylné k nedostatočnému sebavedomiu s častejším výskytom úzkosti, depresie, bipopárnej poruchy, anxiety a porúch príjmu potravy [6,14,26]. Pribúdajú dôkazy, že poruchy správania, predovšetkým ťažká depresia, sú nezávislými rizikovými faktormi KVO so zvýšenou prevalenciou u žien s PCOS. Štúdie popisujú zvýšený výskyt depresie a anxiety u žien s PCOS, u ktorých zhoršená kvalita života kvôli telesnému vzhľadu spôsobuje únavu, poruchy spánku, fóbiu, zmeny apetítu a prejedanie. Depresívne ženy s PCOS majú vyšší BMI a inzulínovú rezistenciu než ženy s PCOS bez depresie a bez nadbytku androgénov. Pokles hmotnosti môže viesť k úprave depresie a kvality života [17].
PCOS a gravidita
Glukózový metabolizmus je počas tehotenstva fyziologicky zmenený. Pri analýze tehotenstiev žien s PCOS a známou inzulínovou rezistenciou so ženami s PCOS bez inzulínovej rezistencie a ženami po asistovanej reprodukcii bola incidencia hypertenzie signifikantne vyššia u všetkých pacientok s PCOS, kým incidencia preeklampsie bola zvýšená len u žien s PCOS a inzulínovou rezistenciou. U pacientok s PCOS sa častejšie rozvinul GDM. Ženy s PCOS častejšie rodili sekciou a ich novorodenci častejšie vyžadovali intenzívnu starostlivosť. PCOS rovnako ako BMI nad 25 kg/m2 sú prediktormi GDM. Na druhej strane prevalencia PCOS je signifikantne vyššia u žien s anamnézou GDM [18]. Metaanalýza 27 štúdií zahŕňajúcich 4 982 žien s PCOS a 119 692 kontrol potvrdila signifikantne vyššie riziko rozvoja GDM, tehotenstvom indukovanej hypertenzie, preeklampsie, predčasného pôrodu a sekcie v porovnaní s kontrolami. Ich deti mali hranične signifikantne nižšiu pôrodnú hmotnosť [34]. U žien s PCOS, predovšetkým obéznych, sa uvádza zvýšený výskyt spontánnych potratov (30–50 %) [18]. Medzi potenciálne mechanizmy asociácie inzulínovej rezistencie a zvýšeného rizika včasných potratov patria zvýšená hladina PAI1 (riziko trombózy, čo môže viesť k placentárnej insuficiencii) a znížené hladiny glykodelínu, ktorý podporuje implantáciu embrya. Zvýšená placentárna inzulínová rezistencia priamo poškodzuje nutričnú výživu plodu a vedie k reštrikcii rastu plodu [35].
Asociácia PCOS s inými ochoreniami
Štúdie sledujúce ženy vo fertilnom veku poukázali na vyšší výskyt systémových autoimunitných ochorení. Hyperandrogenémia pozorovaná u žien s PCOS by ich teda mohla chrániť pred rozvojom autoimunitných ochorení. Stimulačný účinok estrogénov na imunitný systém by mohol byť inhibovaný progesterónom. Pacientky s PCOS majú v dôsledku oligo/anovulácie znížené hladiny progesterónu, čo by mohlo viesť k zvýšenej stimulácii imunitného systému s produkciou autoprotilátok. Literatúra uvádza kontroverzné údaje o asociácii medzi PCOS a autoimunitou [36]. U žien s PCOS bola dokumentovaná vyššia prevalencia autoimunitnej tyreoiditídy. Janssen et al v prospektívnej štúdii 175 pacientok s PCOS potvrdili 3-násobne vyššiu prevalenciu autoimunitnej tyreoiditídy (26,9 %) oproti kontrolám (8,3 %). Vyšetrenie antiovariálnych protilátok priamo v humánnych ováriách potvrdilo signifikantne vyššie koncentrácie u žien s PCOS než v kontrolnom súbore. Opakované punkcie ovariálneho tkaniva a mikrotraumatické zmeny môžu odhaliť ovariálne antigény, doteraz neznáme pre imunitný systém a indukovať odpoveď. U žien s PCOS boli popísané aj signifikantne vyššie hladiny protilátok proti FSH [37].
U žien s PCOS sa zistila normálna alebo zvýšená kostná minerálová denzita [38]. Nie sú údaje o tom, že by hirzutické ženy mali zvýšené riziko fraktúr [20]. Zvýšené hladiny estradiolu a testosterónu u žien s PCOS môžu viesť k vyššiemu píku kostnej masy a chrániť pred kostnou stratou. Štúdie potvrdili pozitívnu asociáciu medzi testosterónom, estradiolom a kostnou minerálovou denzitou [20,38]. Pri PCOS bola potvrdená od BMI nezávislá korelácia medzi inzulínom a kostnou minerálovou denzitou [20].
Ženy s PCOS majú 3 až 5-násobne vyššie riziko endometriálneho karcinómu [32,39,43]. Haoula et al na základe systematického prehľadu 14 komparatívnych a non-komparatívnych štúdií uvádzajú u žien s PCOS 3-násobne zvýšené riziko karcinómu (OR 2,89) [40]. PCOS zahŕňa väčšinu endokrinných rizikových faktorov endometriálneho karcinómu: chronickú hyperinzulinémiu, nízky IGFBP1 (insulin growth factor binding protein 1), nízky SHBG (sex hormone binding protein), zvýšené androgény a deficit progesterónu v luteálnej fáze, ktorý je hlavným rizikovým faktorom endometriálneho karcinómu u premenopauzálnych žien. Hoci PCOS zohráva kľúčovú úlohu pri rozvoji endometriálneho karcinómu, karcinóm sa môže vyskytovať aj u žien bez PCOS. V premenopauzálnom období to môžu byť iné príčiny chronickej anovulácie a deficitu progesterónu. V postmenopauzálnom období, keď je zastavená ovariálna produkcia progesterónu u žien s/bez PCOS, stúpa riziko karcinómu v dôsledku vzostupu estrogénov asociovaného s obezitou a poklesu IGFBP1 nezávisle od ovariálneho hyperandrogenizmu [41]. Nie je jasné, či samotná inzulínová rezistencia zohráva úlohu v rozvoji endometriálneho karcinómu, avšak niektoré štúdie to potvrdzujú. Hoci dáta štúdií s inzulínovými senzitizérmi sú limitujúce, potvrdzujú, že podávanie týchto liekov zvyšuje frekvenciu ovulácie s navodením menštruačného krvácania, čo vedie k najmenej 6 ovulačným menštruačným cyklom ročne u 55–85 % liečených žien s PCOS. Aj keď nebola realizovaná žiadna prospektívna štúdia sledujúca efekt inzulínových senzitizérov na prevenciu endometriálneho karcinómu, táto frekvencia ovulácie je konzistentná so súčasnými štandardami v prevencii endometriálneho karcinómu u žien s PCOS [39]. V štúdii Galazisa et al boli proteínové biomarkery u žien s PCOS podobné ako u žien s endometriálnym karcinómom. Patria sem transgelín, pyruvátkináza, glutatión S-transferáza P, leucín aminopeptidáza, peptidil-prolyl cis-transimzomeráza a cyklofilín A [42]. Intermitetntná indukcia ovulácie rôznymi preparátmi (progestagénmi, orálnou antikoncepciou) cyklicky alebo kontinuálne vedie k prevencii abnormálnej proliferácii endometria [43].
Ženy s PCOS sú už v mladom veku vystavené zvýšenému riziku rozvoja DM2T a KVO. Toto riziko je potencované prehlbujúcou sa periférnou inzulínovou rezistenciou a poruchou sekrécie inzulínu. Hlavnou abnormalitou v účinku inzulínu pri PCOS je postreceptorový defekt v inzulínovej signalizácii [15]. Výsledky štúdií potvrdzujú, že nie všetky tkanivá sú inzulín-rezistentné. Hoci molekulárne mechanizmy účinku inzulínu nie sú stále úplne objasnené, je známe, že zahŕňajú nielen klasické inzulín-senzitívne tkanivá (pečeň, tukové a kostrové tkanivo), ale aj ováriá, u ktorých sa potvrdila poškodená inzulínová signalizácia [44]. Kompenzačná hyperinzulinémia zohráva dôležitú úlohu pri nadmernej produkcii androgénov. Avšak pribúdajú dôkazy, že samotný nadbytok androgénov naopak prispieva k rozvoju inzulínovej rezistencie prostredníctvom fosforylácie intracelulárnych signálnych proteínov, čo vysvetľuje bludný kruh medzi hyperandrogenémiou a inzulínovou rezistenciou pri rozvoji hormonálneho a metabolického fenotypu PCOS [21].
MUDr. Ingrid Dravecká, PhD.
ingrid.dravecka@upjs.sk
I. interná klinika LF UPJŠ a UN L. Pasteura,
Košice,
Slovenská republika
www.fnlp.sk
Doručeno do redakce 21. 12. 2015
Přijato po recenzi 14. 2. 2015
Sources
1. de Melo AS, Dias SV, Cavalli Rde C et al. Pathogenesis of polycystic ovary syndrome: multifactorial assessment from the foetal stage to menopause. Reproduction 2015; 150(1): R11-R24.
2. Ben-Shlomo I, Younis JS. Basic research in PCOS: are we reaching new frontiers? Reprod Biomed Online 2014; 28(6): 669–683.
3. Jayasena CN, Franks S. The management of patients with polycystic ovary syndrome. Nat Rev Endocrinol 2014; 10(10): 624–638.
4. Moran LJ, Norman RJ, Teede HJ et al. Metabolic risk in PCOS: phenotype and adiposity impact. Trends Endocrinol Metab 2015; 26(3): 136–143.
5. Sirmans SM, Pate KA. Epidemiology, diagnosis, and management of polycystic ovary syndrome. Clin Epidemiol 2013; 6 : 1–13.
6. Svačina Š. Metabolické aspekty syndromu polycystických ovárií. Vnitř Lék 2002; 48(12): 1142–1146.
7. Stárka L, Cermáková I, Dusková M et al. Hormonal Profile of Men with Premature Balding. Exp Clin Endocrinol Diabetes 2004; 112(1): 24–28.
8. Livadas S, Diamanti-Kandarakis E. Polycystic Ovary Syndrome: Definitions, Phenotypes and Diagnosis Approach. Front Horm Res 2013; 40 : 1–21.
9. Pasquali R, Gamberini A. Targeting insulin sensitivity in the treatment of polycystic ovary syndrome. Expert Opin Ther Targets 2009; 13(10): 1205–1226.
10. [The Rotterdam ESHRE/ASRM-sponsored PCOS consensus Workshop Group]. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Human Reprod 2004; 19(1): 41–47.
11. Moran L, Teede H. Metabolic features of the reproductive phenotypes of polycystic ovary syndrome. Human Reprod Update 2009; 15(4): 477–488.
12. Evidence-based Methology Workshop on Polycystic Ovary Syndrome. National Institutes of Health (NIH). 3–5.12. 2012. Dostupné z WWW: <https://prevention.nih.gov/programs-events/pathways-to-prevention/past-workshops/pcos>.
13. Badawy A, Elnashar A. Treatment options for polycystic ovary syndrome. Int J Womens Health 2011; 3 : 25–35.
14. Nandi A, Chen Z, Patel R et al. Polycystic Ovary Syndrome. Endocrinol Metab Clin N Am 2014; 43(1): 123–147.
15. Diamanti-Kandarakis E, Dunaif A. Insulin Resistance and the Polycystic Ovary Syndrome Revisited: An Update on Mechanisms and Implications. Endocrine Reviews 2012; 33(6): 981–1030.
16. Vrbíkova J. Sexageny a lipidy u žen. Interní Med Prax 2005; 7(10): 430–432.
17. Wild RA, Carmina E, Diamanti-Kandarakis E et al. Assessment of Cardiovascular Risk and Prevention of Cardiovascular Disease in Women with the Polycystic Ovary Syndrome: A Consensus Statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab 2010; 95(5): 2038–2049.
18. Schröder AK, Tauchert S, Ortmann O et al. Insulin resistance in patients with polycystic ovary syndrome. Ann Med 2004; 36(6): 426–439.
19. Goodarzi MO, Korenman SG. The importance of insulin resistance in polycystic ovary syndrome. Fertil Steril 2003; 80(2): 255–258.
20. Glintborg D, Andersen M. An update on the pathogenesis, inflammation, and metabolism in hirsutism and polycystic ovary syndrome. Gynecol Endocrinol 2010; 26(4): 281–296.
21. Čermáková I, Vrbíková J, Dušková M et al. Sexuální steroidy a inzulinová rezistence. DMEV 2003; 6(3): 143–148.
22. Bajuk Studen K, Jensterie Sever M, Pfeifer M. Cardiovascular risk and subclinical cardiovascular disease in polycystic ovary syndrome. Front Horm Res 2013; 40 : 64–82.
23. Rocha MP, Marcondes JA, Barcellos CR et al. Dyslipidemia in women with polycystic ovary syndrome: incidence, pattern and predictors. Gynecol Endocrinol 2010; 27(10): 814–819.
24. Macut D, Bjekiuć-Macut J, Savić-Radjević A. Dyslipidemia and oxidative stress in PCOS. Front Horm Res 2013; 40 : 51–63.
25. Kim JJ, Choi YM. Dyslipidemia in women with polycystic ovary syndrome. Obstet Gynecol Sci 2013; 56(3): 137–142.
26. Vrbíková J. Syndrom polycystických ovarií. Vnitř Lék 2015; 61(10): 886–895.
27. Vassilatou E. Nonalcoholic fatty liver disease and polycystic ovary syndrome. World J Gastroenterol 2014; 20(26): 8351–8363.
28. Wang ET, Cirillo PM, Vittinghoff E et al. Menstrual Irregularity and Cardiovascular Mortality. J Clin Endocrinol Metab 2011; 96(1): E114-E118.
29. de Groot PC, Dekkers OM, Romijn JA et al. PCOS, coronary heart disease, stroke and the influence of obesity: a systematic review and meta-analysis. Human Reprod Update 2011; 17(4): 495–500.
30. Schmidt J, Landin-Wilhelmsen K, Brännström M et al. Cardiovascular Disease and Risk Factors in PCOS Women of Postmenopausal Age: A 21-Year Controlled Follow-Up Study. J Clin Endocrinol Metab 2011; 96(12): 3794–3803.
31. Shaw LJ, Bairey Merz CN, Azziz R et al. Postmenopasual women with a history of irregular menses and elevated androgen measurements at high risk for worsening cardiovascular event-free survival: results from the National Institutes of Health – National Heart, Lung, and Blood Institute sponsored Women´s Ischemia Syndrome Evaluation. J Clin Endocrinol Metab 2008; 93(4): 1276–1284.
32. Setji TL, Brown AJ. Polycystic Ovary Syndrome: Update on Diagnosis and Treatment. AMJMED 2014; 127(10): 912–919.
33. Tasali E, Chapotot F, Leproult R et al. Treatment of Obstructive Sleep Apnea Improves Cardiometabolic Function in Young Obese Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metab 2011; 96(2): 365–374.
34. Qin JZ et al. Obstetric complications in women with polycystic ovary syndrome: a systematic review and meta-analysis. Reprod Biol Endocrinol 2013; 11 : 56.
35. Diamanti-Kandarakis E, Christakou CD, Kandaraki E et al. Metformin: an old medication of new fashion: evolving new molecular mechanisms and clinical implications in polycystic ovary syndrome. Eur J Endocrinol 2010; 162(2): 193–212.
36. Petríková J, Lazúrová I, Yehuda S. Polycystic ovary syndrome and autoimmunity. EJIM 2010; 21(5): 369–371.
37. Janssen OE1, Mehlmauer N, Hahn S et al. High prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Eur J Endocrinol 2004; 150(3): 363–369.
38. Glintborg D, Andersen M, Hagen C et al. Association of Pioglitazone Treatment with Decreased Bone Mineral Density in Obese Premenopausal Patients with Polycystic Ovary Syndrome: A Randomized, Placebo-Controlled Trial. J Clin Endocrinol Metab 2008; 93(5): 1696–1701.
39. Diamanti-Kandarakis E, Baillargeon JP, Iuorno MJ et al. A Modern Medical Quandary: Polycystic Ovary Syndrome, Insulin Resistance, and Oral Contraceptive Pills. J Clin Endocrinol Metab 2003; 88(5): 1927–1932.
40. Haoula Z, Salman M, Atiomo W. Evaluating the Association Between Endometrial Cancer and Polycystic Ovary Syndrome. Hum Reprod 2012; 27(5): 1327–1331.
41. Kaas R, Lukanova A, Kurzer MS. Obesity, Endogenous Hormones and Endometrial Cancer Risk: A Synthetic Review. Cancer Epidemiol Biomarkers Prev 2002; 11(12): 1531–1543.
42. Galazis N, Afxentiou T, Xenophontos M et al. Proteomic biomarkers of type 2 diabetes mellitus risk in women with polycystic ovary syndrome. Eur J Endocrinol 2013; 168(2): R33-R43.
43. Saha L, Kaur S, Saha PK. Pharmacotherapy of polycystic ovary syndrome – an update. Fundam Clin Pharmacol 2012; 26(1): 54–62.
44. Diamanti-Kandarakis E, Papavassiliou AG. Molecular mechanisms of insulin resistance in polycystic ovary syndrome. Trends Mol Med 2006; 12(7): 324–332.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue 5-
All articles in this issue
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
- Diagnostika cystické fibrózy u dospělých
- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Idiopatické střevní záněty jako protrombotický stav
- Klinické dôsledky syndrómu polycystických ovárií
- Léčba rituximabem jako výzva k prevenci infekčních komplikací
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Využití nových léků v primoterapii mnohočetného myelomu
- Účinnost léčby lokální reziduální neoplazie za standardizovaných podmínek
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Diagnostika cystické fibrózy u dospělých
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

