-
Medical journals
- Career
Jaterní cirhóza a HCV
: Václav Hejda
: Oddělení gastroenterologie a hepatologie I. interní kliniky LF UK a FN Plzeň, přednosta prof. MUDr. Martin Matějovič, Ph. D.
: Vnitř Lék 2015; 61(Suppl 4): 13-23
: Reviews
Jaterní cirhóza je závěrečným morfologickým stadiem většiny jaterních onemocnění s následným rizikem vzniku dekompenzace a komplikací (portální hypertenze, HCC). V současnosti je však zjevné, že jde o dynamický obousměrný proces s možností další progrese, ale i regrese fibrózy/cirhózy v případě možnosti kauzální léčby základního hepatologického onemocnění. Určení stadia a pokročilosti jaterní fibrózy je naprosto klíčové pro další péči o nemocného, určení prognózy a eventuálně indikaci léčby. V současnosti jsou již preferovanou možností neinvazivní metody detekce jaterní fibrózy (sérové, elastografické), které v této indikaci pomalu nahrazují jaterní biopsii.
Jaterní cirhóza je závěrečným morfologickým stadiem většiny jaterních onemocnění s následným rizikem vzniku dekompenzace a komplikací (portální hypertenze, HCC). V současnosti je však zjevné, že jde o dynamický obousměrný proces s možností další progrese, ale i regrese fibrózy/cirhózy v případě možnosti kauzální léčby základního hepatologického onemocnění. Určení stadia a pokročilosti jaterní fibrózy je naprosto klíčové pro další péči o nemocného, určení prognózy a eventuálně indikaci léčby. V současnosti jsou již preferovanou možností neinvazivní metody detekce jaterní fibrózy (sérové, elastografické), které v této indikaci pomalu nahrazují jaterní biopsii. Tyto metody umožňují přesný odhad prognózy nemocného a především dlouhodobé neinvazivní sledování vývoje jaterního onemocnění. Chronická hepatitida C je jednou z nejčastějších příčin jaterní cirhózy. Vyléčení hepatitidy C je klíčové pro zlepšení prognózy pacientů a snížení rizika rozvoje komplikací. V oblasti léčby tohoto onemocnění se v posledních letech odehrála farmakologická revoluce, nevídaná v jiných oborech interní medicíny. Díky přesnému zmapování a porozumění cyklu virové replikace byla do klinické praxe uvedena řada přímo působících antivirotik, která jednak umožnila po 20 letech z léčby vyřadit interferonové preparáty (řada nežádoucích účinků), ale především zvýšila účinnost léčby HCV do oblasti 95–100 % vyléčených pacientů po 12 týdnech kombinované léčby. Tyto preparáty jsou v podstatě bez nežádoucích účinků a léčba trvá 12–24 týdnů (s možností i zkrácení na 8 týdnů). Jejich hlavní nevýhodou v současne době je extrémně vysoká cena.
Klíčová slova:
antivirotika – chronická hepatitida C – jaterní cirhóza – léčbaJaterní cirhóza
Jaterní cirhóza je způsobena celou řadou příčin, které však uniformně vedou k zánětlivým změnám v játrech (nekroinflamace) s následnou fibrogenezí s difuzní tvorbou regenerativních uzlů, které jsou ohraničeny fibrotickou tkání. Tyto změny hrubě narušují a mění jaterní mikrostrukturu a zásadním způsobem mění cévní architekturu jater [1]. Dále dochází ke zvýšení vaskulární rezistence pro průtok portální krve, a tím k rozvoji portální hypertenze a nakonec k jaterní insuficienci. Důležitým aspektem formování cirhotických uzlů je rovněž zásadní riziko jejich neoplastické transformace a vzniku hepatocelulárního karcinomu (HCC). Dlouhou dobu byla cirhóza považována za uniformní závěrečné stadium jaterního onemocnění a jediným opatřením péče o pacienty měl být screening definovaných komplikací cirhózy, tedy jícnových (ev. žaludečních) varixů a hepatocelulárního karcinomu (HCC). Vnímání cirhózy se v tomto směru v poslední době změnilo ve 2 základních aspektech:
- cirhóza je dynamický proces, který můžeme rozdělit do několika klinických stadií
- cirhóza je z jisté části reverzibilní, většinou v případě možnosti kauzální léčby základního onemocnění (např. HBV [2] nebo HCV [3])
Je zjevné, že jaterní cirhózu a její tíži musíme posuzovat v rámci jednotlivých stadií, neboť prognóza pacientů a jejich 1roční mortalita se v situaci prokázané cirhózy výrazně liší a pohybuje se v širokém rozmezí mezi 1 % a 57 % a výrazně se liší dle stadia a dle typu klinické události, která k dekompenzaci či zhoršení stavu vedla (trigger) [4]. Z výše uvedeného tedy vyplývá, že pro prognózu pacientů je klíčová včasná diagnóza základního onemocnění, přesné určení stadia jaterního onemocnění a kauzální léčba precipitujícího onemocnění, která umožní zastavit progresi jaterní cirhózy, eventuálně vést k její regresi, a tím výrazně snížit riziko rozvoje pokročilého onemocnění jater a snížit potřebu transplantace jater.
Epidemiologie a etiologie jaterní cirhózy
Jaterní cirhóza a s ní spojené komplikace jsou častou a v poslední době vzrůstající příčinou morbidity a mortality pacientů. Jaterní cirhóza je 14. nejčastější příčinou úmrtí dospělých globálně, ale 4. nejčastější příčinou smrti v Evropě a vede k asi 1 milionu úmrtí celosvětově [5], k 170 000 úmrtí ročně v Evropě [6] a 33 539 úmrtím ročně v USA [7]. Ve Velké Británii mortalita na většinu dalších onemocnění mezi roky 1970–2010 stagnuje či mírně klesá, ale mortalita na jaterní onemocnění a jejich komplikace vzrostla asi 4krát oproti roku 1970, pravděpodobně z důvodu alkoholické nemoci jater a nealkoholické steatohepatitidy [8]. V České republice je jaterní cirhóza a s ní spojené komplikace příčinou asi 2 000 úmrtí ročně [6]. Jaterní cirhóza je indikací k provedení 5 500 transplantací jater ročně v Evropě [6]. Hlavní příčinou a etiologií jaterní cirhózy v rozvinutých zemích je infekce virem hepatitidy C, dále nežádoucí a nadměrná konzumace alkoholu a ve stále větší míře nealkoholická steatóza a steatohepatitida jater (NASH). Chronická hepatitida B je oblasti střední Evropy méně častou příčinou jaterní cirhózy, její incidence z důvodu očkování výrazně klesá [6,9] a nyní dominuje především v subsaharské Africe a v některých oblastech Asie.
Přesně určit prevalenci výskytu cirhózy v populaci je obtížné, neboť většina osob je asymptomatická a diagnóza je stanovena až v době klinické manifestace. Je tedy předpoklad, že prevalence je vyšší než dosud udávané informace. Aktuálně se odhaduje na 0,3 % ve Francii (screeningový program) a roční incidence byla stanovena na 15,3–132,6 na 100 000 osob ve Švédsku a Anglii [6]. Podobné údaje uvádí i populační studie z USA z roku 2015, podle nichž je stanovená prevalence cirhózy 0,27 %, přičemž 69 % pacientů o jaterním onemocnění vůbec nevědělo. Nejvýznamnějšími proměnnými asociovanými s cirhózou jsou v této studii uváděny alkohol, HBV, HCV, mužské pohlaví a vyšší věk. Celkem 53,5 % všech případů cirhózy bylo způsobeno hepatitidou C (HCV) [10].
Diagnóza jaterní cirhózy
Většina pacientů s chronickým jaterním onemocněním je asymptomatická do doby klinické manifestace dekompenzace jaterního onemocnění (cirhózy).
Parametry a známky dekompenzace jsou:
- ascites
- sepse
- krvácení z jícnových/žaludečních varixů či z portální gastropatie
- jaterní encefalopatie
- neobstrukční ikterus
V případě známek klinické či laboratorní dekompenzace jaterního onemocnění je postačující pro diagnózu cirhózy grafické vyšetření (USG, CT, MRI) se zobrazením nodulární struktury jater s nerovným povrchem. Nejsou potřeba další invazivní diagnostické procedury, např. jaterní biopsie. Dalšími nálezy může být průkaz přítomnosti portální hypertenze a splenomegalie. V případě iniciálních stadií je však diagnóza složitější a počet potřebných vyšetření větší. Většinou jsou k hepatologickému vyšetření indikováni pacienti s náhodným záchytem elevace jaterních testů a součástí tohoto vyšetření je staging stadia jaterní léze, tedy stupně fibrózy, eventuálně přítomnosti cirhózy. Konvenční vyšetření (USG, CT, MRI) v těchto případech mají nízkou senzitivitu.
Stanovení pokročilosti jaterní fibrózy (staging stadia jaterního onemocnění)
Stadia a stupně jaterní léze je možné stanovit dle různých kritérií nebo skórovacích systémů. Nejčastěji používaným skórovacím systémem vycházejícím z vyšetření jaterní histologie je Ishakovo skóre (modifikované Knödellovo skóre), které stanovuje (kromě aktivity zánětu) stadia jaterní fibrózy do 6 stupňů (0–6), hodnota 6 odpovídá jednoznačné cirhóze [11]. Ve snaze maximálně zjednodušit tyto skórovací systémy byl do klinické praxe zaveden METAVIR skórovací systém, který je v současné době (především v oblasti virových hepatitid a zvláště HCV) široce používán [12]. Tento skórovací systém rozděluje stupně fibrózy do 5 stupňů: Metavir 0–4, přičemž stupeň F0 je nález bez fibrózy a stupeň F3 znamená bridging fibrózu bez cirhózy a F4 jaterní cirhózu. Na stanovení přesného stupně stagingu jaterní léze závisí nejen přesnost diagnózy, ale i stanovení prognózy a především indikace léčby. Dlouhou dobu byla hlavní metodou (tzv. zlatým standardem) určení stagingu fibrózy jaterní biopsie a histologické vyšetření. Toto vyšetření má však řadu nevýhod:
- invazivní procedura spojená s diskomfortem a bolestí
- definované riziko komplikací (krvácení, pneumotorax, punkce jiných orgánů)
- odlišné hodnocení vzorku jednotlivými patology (interobserver variability)
- nedostatečná velikost vzorku
- sampling error v důsledku ne zcela rovnoměrného rozložení fibrózních změn v jaterním parenchymu
- nemožnost opakovaného a dynamického sledování vývoje jaterního onemocnění
Neinvazivní možnosti detekce stupně jaterní fibrózy
Uvedené nevýhody jaterní biopsie a rovněž snaha zajistit monitoraci vývoje jaterního onemocnění obrátily v poslední době pozornost na neinvazivní detekci a stanovení stupně jaterní fibrózy. K dispozici jsou buď sérové testy zaměřené na specifické laboratorní odchylky doprovázející jaterní cirhózu, např. APRI index využívající hodnot AST a trombocytů, FIB4 index (věk, ALT, AST a trombocyty) nebo Forns index (věk, GGT, cholesterol, trombocyty) [13], nebo sérové testy využívající specifických substancí, jejichž obrat se při progresi fibrózy mění, resp. stoupá (např. kyselina hyaluronová, fragmenty kolagenu, metaloproteinázy, inhibitory metaloproteináz). Mezi tyto testy patří Fibrotest, který je asi nejužívanější a nejvíce validovaný (GGT, haptoglobin, bilirubin, A1 apolipoprotein, a2-makroglobulin) nebo Fibrometer (trombocyty, INR, makroglobulin, AST, kyselina hyaluronová, věk, urea) [13].
Druhou možností jsou přístrojová vyšetření, která využívají faktu, že v průběhu fibrózy dochází ke změně elasticity jater (játra jsou tužší) a vyšetřují tedy tzv. elasticitu jater metodou elastografie. Do jater je vysílán buď akustický či mechanický impulz a měří se rychlost prostupu těchto vln játry (a platí, že čím jsou játra tužší, tím je rychlost vyšší). Výhody těchto vyšetření jsou:
- rychlost vyšetření (řádově minuty)
- přesnost vyšetření (ve všech metodách vysoká)
- bed-side vyšetření (okamžitě, dle potřeby, u lůžka pacienta)
- možnost libovolného opakování a sledování vývoje onemocnění
V současné době máme k dispozici především následující možnosti elastografie:
- Fibroscan®
- ARFI elastografie (Siemens)
- ShearWave ElastographyTM (SWE – AixplorerTM)
Tyto metody se liší v klinickém užití, využitelnosti v pokročilých či alternativních situacích (obezita, ascites) a především ve způsobu vyšetření a jeho interpretaci (jednotky kPa nebo m/s).
Fibroscan je přístroj francouzské firmy Echosense, který neinvazivním způsobem ze sondy přiložené do mezižeberních prostor generuje střižnou vlnu (shear wave), jejíž rychlost je potom měřena sondou. Využívá průměru z 10 měření. Výsledky jsou uvedené v kPa a rozmezí měření je 2,5–75 kPa. Normální hodnoty jsou kolem 5 kPa, jaterní cirhóza je definována od hodnoty 12 kPa [14]. Přesnost pro diagnózu cirhózy, tedy odlišení stadia Metavir F4 od Metavir F0–F3, vychází v různých studiích poměrně vysoká: AUROC 94–98 se specifitou 91–98 % a senzitivitou 78–94 % [13]. Diagnóza jaterní cirhózy je tedy přesná. Nevýhodou této metody je fakt, že nemá ultrazvukové zobrazení místa měření rychlosti vlny a často selhává u obézních pacientů a není možné ji provést u pacientů s ascitem (selhání metody ve 3 % a neinterpretovatelné výsledky v 16 % měření, tedy celkem v 19 %) [15]. Tato nevýhoda bude nejspíše eliminována využitím nové sondy XL, která bude použitelná i u pacientů s BMI více než 30.
Druhou možností je metoda ARFI elastografie na přístroji Siemens. Tento přístroj využívá mechanického vybuzení tkáně pomocí krátce trvajícího akustického pulzu, který se propaguje rovněž jako střižná vlna a rychlost je měřena v m/s. Provádí se rovněž 10 měření a výstupem je průměr z těchto měření. Hlavní výhodou je, že ARFI je implementována do běžné sonografické sondy přístroje Siemens Acuson 2000 a umožňuje tedy běžné sonografické vyšetření a současně rychlé a přesné měření ARFI, a tím přesnou bed-side orientaci v diagnostice jaterního onemocnění (USG obraz + staging fibrózy). Jistou nevýhodou je užší rozsah hodnot 0,5–4,4 m/s, metavir skóre F4 (cirhóza) začíná na hodnotě 1,8 m/s [16] a tyto hodnoty se mírně liší mezi jednotlivými pracovišti. Přesnost ARFI metody pro určení F4 je shodná s Fibroscanem (zde AUROC pro F4 0,97) a počet selhání metody je nižší (lze použít i u pacientů obézních či s ascitem) [17]. Význam těchto přesných neinvazivních metod je již tak velký, že jejich rutinní doporučení pro klinickou praxi se odrazilo ve tvorbě doporučených postupů Evropské hepatologické společnosti (European Association for the Study of the Liver – EASL) [18] a Evropské společnosti pro ultrazvuk v medicíně (European federation of societies for ultrasound in medicine and biology – EFSUMB) [19]. Obr. 1 ukazuje obraz ARFI jater a sleziny při detekci jaterní cirhózy a přítomnosti portální hypertenze (elastografie sleziny). Tab. 1 ukazuje přesnost našich výsledků ARFI elastografie (dosud nepublikováno) u neselektované skupiny pacientů s různorodými jaterními chorobami, nikoliv pouze u pacientů s virovými hepatitidami.
1. Příklad ARFI elastografie jater a sleziny při detekci jaterní cirhózy a přítomnosti portální hypertenze 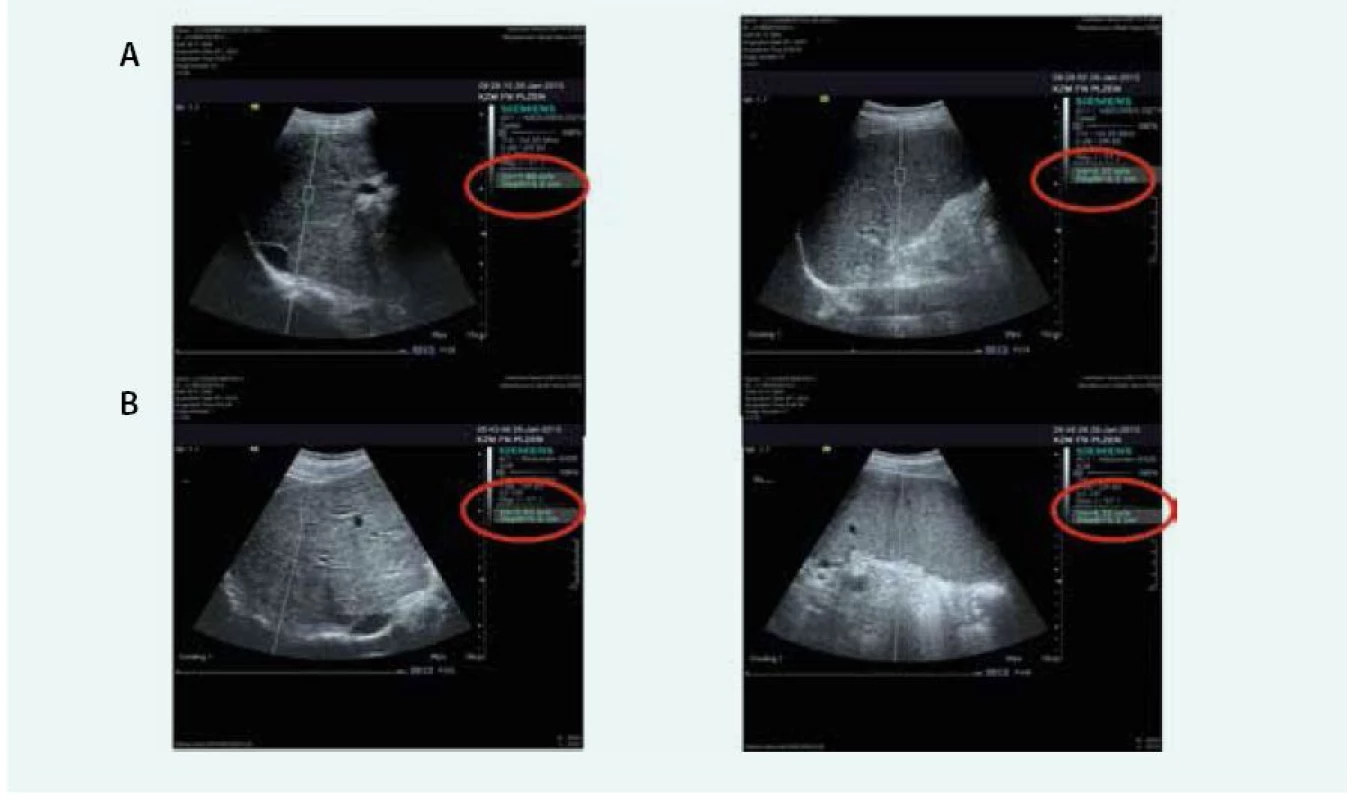
A – jaterní cirhóza, malé jícnové varixy B – jaterní cirhóza, signifikantní jícnové varixy 1. Přesnost ARFI elastografie při detekci fibrózy, pokročilé fibrózy a cirhózy v neselektované skupině pacientů (srovnáno s histologickým nálezem). 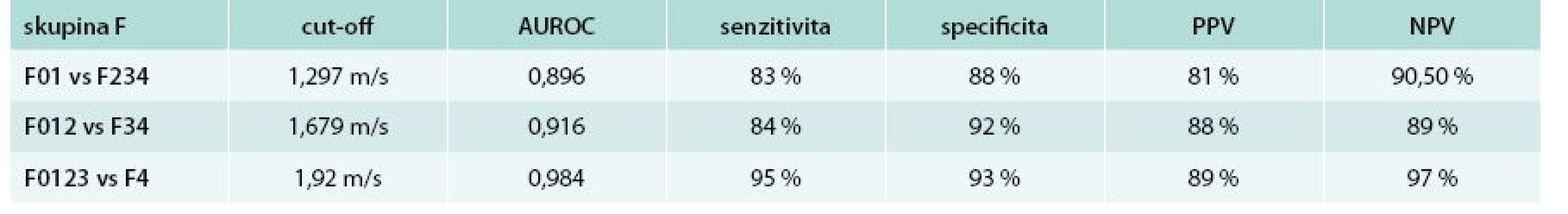
Vlastní data autora Vývoj jaterní cirhózy
Jaterní cirhózu nelze považovat nyní za zcela terminální fázi přirozeného průběhu onemocnění jater ze 2 důvodů:
- jaterní cirhózu lze dále rozdělit dle klinické manifestace do 4–5 stadií, přičemž prognóza pacienta se v každém stadiu diametrálně odlišuje (tab. 2) [4]
- jaterní cirhóza je v případě kauzální léčby částečně reverzibilní
2. Stadia jaterní cirhózy a mortalita v následujících 12 měsících 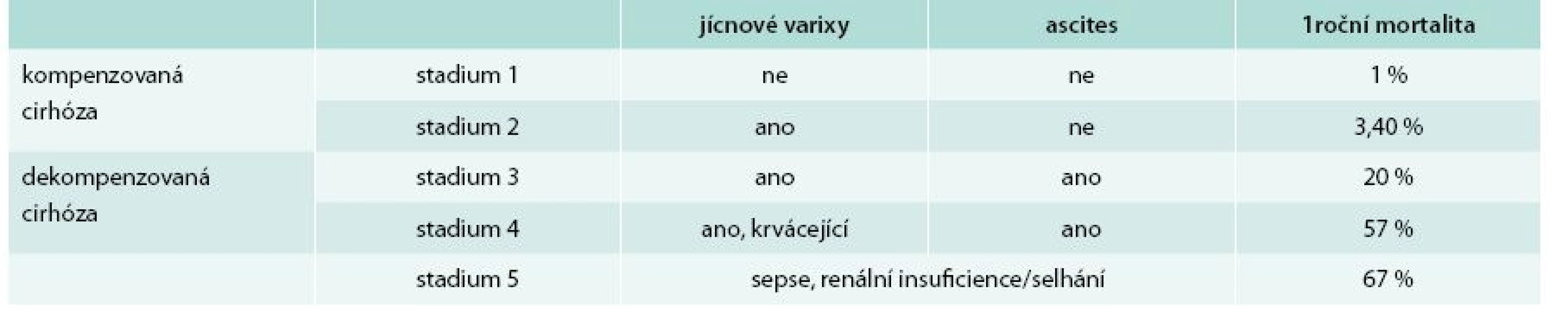
Prognóza pacientů se dramaticky liší v závislosti na přítomnosti komplikací jaterní cirhózy (jícnové varixy, ascites, krvácení). Pacienti bez anamnézy klinické dekompenzace, pouze s náhodně zjištěnou jaterní cirhózou, mají prognózu velmi dobrou s minimálním rizikem úmrtí. Avšak v případě závažné infekce či renálního selhání je 12měsíční mortalita 67 %. Pacienti s HCV i HBV, kteří mají kompenzovanou cirhózu, mají 5leté přežití kolem 80 %, naproti tomu 5leté přežití po 1. atace dekompenzace je u těchto pacientů mezi 24–48 měsíci (tedy 1–2 roky) [20].
Dekompenzace jaterní cirhózy má mortalitu kolem 30 % [21]. Nejčastějšími klinickými situacemi, které mohou vést k dekompenzaci, jsou:
- infekce
- trombóza portální žíly
- operační výkon, krevní ztráta
- hepatocelulární karcinom
Je tedy potřebné pacienty dále stratifikovat a je zjevné, že histologické vyšetření pouze s průkazem cirhózy (bez možnosti další substratifikace) je nedostatečné. Semikvantitativní či kvantitativní měření fibrózy v jaterní histologii není běžně dostupné [22]. V této indikaci se začínají velmi dobře uplatňovat neinvazivní metody měření jaterní fibrózy, které svými absolutními hodnotami poměrně dobře korelují s pokročilostí onemocnění a rizikem klinické dekompenzace a umožňují stratifikaci pokročilosti cirhózy. Fibroscan v závislosti na hodnotě v kPa umožňuje poměrně přesný odhad 5leté mortality [23].
5leté přežití dle hodnot elastografie kPa (Fibroscan):
- < 9,5 kPa: 96 %
- > 20 kPa: 66 %
- > 30 kPa: 57 %
- > 40 kPa: 47 %
- > 50 kPa: 42 %
Je zjevné, že neinvazivní detekci stupně jaterní fibrózy s možností rutinního opakování je možné využít k průběžné monitoraci vývoje jaterního onemocnění, efektu léčby a stratifikaci rizikovosti pacientů. Pomocí těchto neinvazivních metod (i s využitím měření elasticity sleziny) bude rovněž možné predikovat přítomnost komplikací jaterní cirhózy, především jícnových varixů [24].
Regrese jaterní fibrózy a cirhózy
V současné době je již k dispozici řada literárních údajů (přestože je to stále široce diskutované téma) potvrzujících předpoklad, že jaterní cirhóza je obousměrně dynamický proces, který může progredovat, ale může i regredovat a snižovat stupeň jaterní fibrózy, a to u celé řady jaterních onemocnění. Základním předpokladem regrese jaterní fibrózy/cirhózy je efektivní léčba základního onemocnění (HBV, HCV, AIH, NASH, hemochromatóza). V budoucnu se nejspíše objeví specifická antifibrotická léčba, dosud však není k dispozici. Hlavní otázkou současnosti je stadium, od kterého je již cirhóza ireverzibilní. Nyní se soudí, že pokročilá alterace struktury jater vedoucí k portální hypertenzi je tím bodem, od kterého cirhóza již reverzibilní není. V některých pracech však bylo prokázáno, že při efektivní léčbě některých onemocnění dochází ke snížení stupně portální hypertenze [25]. Vzhledem k zaměření článku je nutné uvést důkazy o možnosti regrese fibrózy či cirhózy u pacientů s chronickou virovou hepatitidou C, kteří byli vyléčeni z tohoto onemocnění (setrvalá virologická odezva – sustained virologic response/SVR). Úspěšná eradikace viru HCV vede jednoznačně k nižšímu riziku klinických komplikací včetně nižšího rizika vzniku hepatocelulárního karcinomu (HCC) a jícnových varixů [26,27]. Regrese jaterní fibrózy byla prokázána v Poynardově metaanalýze, který hodnotí 3 010 pacientů s jaterní biopsií před léčbou a po léčbě se středním časem mezi biopsiemi 20 měsíců. Ke zlepšení histologického nálezu o minimálně 1 stupeň došlo u 20 % nemocných po léčbě a k vymizení cirhózy došlo u 75 pacientů ze 153 (49 %), kteří měli cirhózu před léčbou [28]. V jiné studii bylo zařazeno 150 pacientů se SVR u HCV, kteří byli sledováni průměrně 5 let. U 49 pacientů byly k dispozici výsledky jaterní biopsie před a po léčbě, přičemž u 40 ze 49 pacientů (82 %) došlo ke snížení stupně jaterní fibrózy [29].
Regrese fibrózy a cirhózy je prokázána rovněž u chronické hepatitidy B. Největší sledovanou skupinou pacientů léčených pro HBV tenofovirem byla studie Marcellina. Pacienti měli kontrolní jaterní biopsii v 1 roce a poté v 5 letech léčby. V celé skupině sledovaných a léčených nemocných (641 pacientů) bylo 96 pacientů vstupně s cirhózou. Po 5 letech léčby tenofovirem došlo k regresi cirhózy u 74 % těchto pacientů (71/96) a u všech došlo k regresi minimálně o 2 stupně (dle Ishaka) a u žádného dalšího pacienta nedošlo k progresi histologického nálezu [30].
Regrese jaterní cirhózy při kauzální léčbě základního onemocnění byla dále dokumentována u pacientů s autoimunitní hepatitidou (AIH), s biliární obstrukcí, s hereditární hemochromatózou, Wilsonovou chorobou a NASH.
Chronická hepatitida C
Chronická hepatitida C je virové onemocnění, které primárně postihuje játra (ale může mít i extrahepatální manifestaci). Infekce probíhá většinou dlouhodobě asymptomaticky, ale může u některých pacientů přejít do cirhózy jater s rizikem dekompenzace či rozvoje HCC (HCV zodpovědná za 1/3 všech HCC globálně).
Původem onemocnění je malý RNA virus z čeledi Flaviviridae. Celkem se rozlišuje 6 genotypů viru (genotyp 1–6, přičemž genotyp 1 se dále dělí na 1a a 1b). Jednotlivé genotypy viru mají odlišnou geografickou distribuci, a především mají odlišnou citlivost na protivirovou léčbu. Určení genotypu před léčbou a indikace léčby na základě stanoveného genotypu má tedy zásadní význam.
Epidemiologie
Chronická hepatitida C je onemocněním se závažným celosvětovým dopadem, a to jednak vzhledem k počtu nemocných a k závažným důsledkům, k nimž toto onemocnění vede. Dle WHO je aktuálně celosvětově virem hepatitidy C chronicky infikováno asi 130–150 milionů obyvatel (což odpovídá 2–2,5 % celkové populace). Regionálně jsou výrazné rozdíly mezi prevalencí tohoto onemocnění. V Egyptě je infikováno virem hepatitidy C více než 10 % populace (dle WHO 2014). V Evropě se počet nemocných odhaduje na 2–5 milionů HCV pozitivních. Počet anti-HCV pozitivních osob mezi zdravými osobami (dárce krve) je 1,6 % v USA, 1,15 % v Itálii a 0,4 % v Německu [31]. V České republice je zatím stanovená prevalence nízká, asi 0,2 % infikovaných osob a ročně přibude (dle SZÚ) asi 800–1 000 nových případů [32]. Lze však připustit, že počet nově infikovaných osob je v posledních létech stabilní (změna chování uživatelů drog, lepší informovanost o způsobu přenosu). Přesnou prevalenci je těžké hodnotit, neboť velká část pacientů neví o nákaze či o chronické infekci, klinicky manifestní je nákaza jen u asi 25 % osob. Lze tedy předpokládat, že prevalence v populaci bude vyšší a je možné, že právě probíhající populační studie v ČR toto prokáže. Většina známých nákaz (pozitivita anti-HCV) je v současnosti soustředěna do věkových skupin 25–40 let věku. Onemocnění po určité fázi vývoje přejde do fibrózy a cirhózy a lze tedy očekávat zvýšení výskytu jaterní cirhózy za určitý čas u populace starší 40 let.
Z různých prací vyplývá vysoké riziko nárůstu komplikací HCV infekce v následujících desetiletích (jak ukazuje graf 1), které mohou mít pravděpodobně i závažné ekonomické důsledky pro zdravotní systémy [33–37].
1. Nárůst incidence komplikací v %. 
Upraveno podle [33–37] Nejčastější příčinou nákazy v současnosti je parenterální (interavenózní – i.v.) aplikace drog a tito uživatelé tvoří nyní asi 70 % všech nakažených [38]. Podobná je dle SZÚ situace i v ČR (65,2 % v roce 2012). Nicméně velkou skupinu nemocných s HCV a v současnosti již často ve stadiu cirhózy tvoří pacienti, kteří před rokem 1991 prodělali operační výkon s krevní náhradou, dostávali krev či její deriváty (plazma, hemofilici) nebo byli dialyzováni. V roce 1991–1992 se staly komerčně dostupné sérologické testy k detekci anti-HCV protilátek, což minimalizovalo až vyloučilo možnost přenosu HCV krví či jejími deriváty. Rok 1992 je tedy v historii tohoto onemocnění považován za přelomový.
Přenos infekce
Chronická hepatitida C patří jednoznačně mezi infekce přenášené krví a je nutná parenterální expozice viru. Jak bylo již uvedeno, většinu infikovaných (minimálně 66–70 %) v současnosti tvoří injekční uživatelé drog. I když počet nakažených v posledních letech stagnuje, tak většina i.v. uživatelů drog se nakazí během několika úvodních aplikací drogy. Nákaza ve zdravotním zařízení je v rozvinutých zemích nyní v podstatě vyloučena.
Rizikové situace pro získání anti-HCV pozitivity [39]:
- injekční aplikace drogy
- krevní transfuze a krevní deriváty před rokem 1992
- sex s uživatelem drog, eventuálně s HCV infikovanou osobou
- napadení a zranění infikovanou osobou
- poranění infikovanou jehlou, profesionální expozice
- piercing a tetování bez aseptických podmínek
- hemodialyzační léčení
- vertikální přenos z HCV pozitivní matky na novorozence (perinatální přenos)
- přenos orgánovým štěpem (před rokem 1992)
V době diagnózy někteří pacienti neudávají žádný z uvedených rizikových faktorů, i po opakovaném dotazování asi 10 % pacientů není schopno (nebo ochotno?) identifikovat žádný z rizikových faktorů.
Riziko přenosu v domácím soužití či pohlavním stykem mezi manželi (stabilními páry) je velmi nízké a velmi neobvyklé. Riziko přenosu v monogamním partnerském vztahu je extr émně nízké a je považováno za 0,01 % či nižší [40]. Vyšší výskyt HCV infekce v některých městech v Evropě a USA mezi homosexuály prokázal vyšší transmisi tohoto onemocnění v této skupině [41]. Prevalence mezi homosexuály je asi 4–8 %. Zdá se, že především slizniční poranění je predispozicí pro přenos HCV. Tento fakt bude zřejmě zásadní i pro (vzácný) přenos v heterosexuálním vztahu [42].
Přenos poraněním infikovanou jehlou je rovněž relativně vzácný. Incidence sérokonverze anti-HCV po poranění infikovaným předmětem se odhaduje na méně než 2 %, v USA se odhaduje na 1,6 % [43]. Riziko přenosu závisí na typu a hloubce poranění [44].
Klinická manifestace HCV infekce
Spektrum onemocnění je velmi široké od klinické manifestace akutní hepatitidy po chronické onemocnění, které může být klinicky němé i klinicky manifestní. Akutní infekce probíhá většinou asymptomaticky, nebo jí nemocní nevěnují adekvátní pozornost (i.v. uživatelé drog). Akutní infekce vede k chronické infekci asi v 75 % případů [45]. U symptomatických pacientů se první známky onemocnění objeví za 2–26 týdnů s mediánem 7–8 týdnů [46]. U většiny pacientů je manifestace ikterická a další známky akutní hepatitidy (únava, bolesti v pravém podžebří, tmavá moč, nechutenství) [47]. Klinická manifestace chronické hepatitidy C je dlouhodobě němá, nebo se později manifestuje jako rozvinutá cirhóza se všemi atributy. Onemocnění je obvykle pomalu progredující. Proto mnoho nemocných, kteří prodělali asymptomatickou akutní hepatitidu, nemá žádné potíže a o svém onemocnění neví a většinou je toto onemocnění diagnostikováno náhodně. Je známo, že jaterní cirhóza se rozvine u 20–30 % chronicky infikovaných pacientů po průměrné době 20–30 let od infikace (schéma).
Schéma. Průběh onemocnění chronickou hepatitidou C 
Extrahepatální manifestace HCV
Infekce virem hepatitidy C nevede pouze k hepatitidě a onemocnění jater, ale je provázena i celou řadou nepříjemných či závažných extrahepatálních manifestací. V řadě studií se incidence extrahepatální manifestace HCV udává mezi 30–40 % [48,49].
Mezi nejčastější extrahepatální manifestace HCV patří:
- hematologická onemocnění (esenciální smíšená kryoglobulinemie, lymfom)
- autoimunitní onemocnění (tyreoiditida, přítomnost řady autoprotilátek)
- onemocnění ledvin (membranoproliferativní glomerulonefritida)
- kožní manifestace (porfyria cutanea tarda, lichen planus)
- diabetes mellitus (při infikaci genotypem 3)
Přirozený průběh infekce HCV
Riziko přechodu onemocnění do chronické hepatitidy C je vysoké a dochází k němu u 60–80 % nemocných [50]. Většina z těchto pacientů má trvale a mírně zvýšené jaterní testy. Elevace jaterních testů však není bezpodmínečně nutná pro progresi fibrózy, neboť k jaterní cirhóze může dojít i u pacientů s normálními hodnotami jaterních testů [51]. Stále je otázkou, proč tato infekce přechází tak často do chronicity. Zvažuje se genetická diverzita viru, jeho schopnost mutací, a tím únik před imunitním systémem. Je ale také otázkou, proč někteří nemocní jsou schopni virus účinně eliminovat. Asi nejpravděpodobnějším vysvětlením je v současné době genetická HLA predispozice a dále genetický polymorfizmus pro gen interleukinu 28B (IL28B) [52]. Pacienti s příznivou kombinací alel (C/C) eliminovali virus v 50–55 % případů a pacienti s nepříznivou kombinací alel (T/T) pouze v 16–20 % případů [53]. Z vlastní klinické zkušenosti mohu doplnit, že z celkem 382 našich pacientů, u kterých je k dispozici vyšetřený genotyp IL28B, eliminovalo spontánně virus 9 % a všichni měli příznivý polymorfizmus C/C.
Průběh onemocnění chronickou hepatitidou C, jak ukazuje schéma, je různorodý a lze jej rozdělit do 3 možných situací. Asi 30 % pacientů se nachází ve stadiu chronické infekce bez výraznější progrese fibrózy. Asi u 40 % pacientů dochází k pomalé progresi onemocnění s rizikem vzniku cirhózy za více než 20 let od nákazy. Asi u 30 % pacientů fibróza progreduje poměrně rychle s rizikem rozvoje cirhózy do 20 let od nákazy (samozřejmě dle působení dalších exogenních faktorů, které mohou průběh HCV urychlit) [54]. Naopak ve francouzské studii je odhadovaná doba do vývoje cirhózy asi 30 let [55] (a hlavními rizikovými faktory progrese do cirhózy byl vyšší věk v době infikace, abúzus alkoholu a mužské pohlaví). Je tedy velmi pravděpodobné, že onemocnění probíhá pozvolně v horizontu 20–30 let a ne všichni pacienti jsou ohroženi cirhózou jater. Prognóza nemocných je tedy poměrně příznivá až do doby vzniku pokročilé fibrózy či cirhózy jater.
Faktory urychlující průběh fibrózy u nemocných s chronickou HCV infekcí:
- jaterní histologie – stupeň vstupní fibrózy a intenzita nekroinflamatorní aktivity
- pohlaví (muži mají vyšší riziko)
- věk (vyšší) v době infikace a vyšší věk v době diagnózy HCV
- koinfekce HIV
- koinfekce HBV
- diabetes mellitus a inzulinová rezistence
- obezita
- abúzus alkoholu – hlavní faktor urychlující progresi onemocnění
Je důležité zmínit, že pravidelná konzumace kávy (optimálně více než 4 šálky kávy denně) je spojena s nižším rizikem progrese fibrózy i s nižším rizikem rozvoje HCC [56,57].
V okamžiku rozvoje pokročilé fibrózy či jaterní cirhózy je osud nemocného vážný. Komplikace HCV se vyskytují především u nemocných s pokročilou fibrózou či cirhózou jater, neboť toto stadium má 1,5% roční riziko rozvoje hepatocelulárního karcinomu a 4–5% roční riziko dekompenzace jaterní cirhózy (ascites, krvácení při portální hypertenzi, jaterní encefalopatie). Přežití pacientů s HCV po první dekompenzaci onemocnění je velmi krátké. 5leté přežití pacientů s kompenzovanou cirhózou je 91 % oproti 50 % u nemocných po 1. dekompenzaci [58]. Eventuální přítomnost ikteru je již známkou závažného a velmi pokročilého onemocnění. Při dekompenzaci jaterní cirhózy při HCV je vždy na místě zvážit transplantaci jater a pacienta referovat do transplantačního centra, což je jediná efektivní léčba velmi pokročilé jaterní cirhózy (Child-Pugh B, dekompenzace). V USA je HCV příčinou 30 % všech případů hepatocelulárního karcinomu [58,59]. Je proto naprosto nezbytné dodržovat přesně pravidla pro screening hepatocelulárního karcinomu, tedy minimálně 1krát za 6 měsíců provést validní ultrasonografické vyšetření jater.
Léčba hepatitidy C
Zřejmě žádná jiná nemoc infekční či interní neprodělala v poslední době tak dramatickou změnu ve farmakoterapii a možnosti efektivního a definitivního vyléčení. Aktuální situaci v této oblasti lze označit nepochybně za farmakologickou revoluci. Infekce virem hepatitidy C je nyní jedinou chronickou virovou infekcí, kterou můžeme definitivně vyléčit. Vyléčení se označuje jako setrvalá virologická odezva a označuje jako SVR (sustained virologic response).
Dosažení SVR je s ohledem na rizika HCV infekce pro pacienty klíčové a zásadním způsobem mění jejich prognózu, snižuje riziko progrese do cirhózy a snižuje riziko dekompenzace onemocnění s transplantací jater a snižuje riziko rozvoje HCC. Jak již bylo uvedeno, SVR (tedy vyléčení onemocnění HCV) je spojeno s regresí jaterní cirhózy v 50–60 % případů [27,28,60]. Regrese fibrózy a cirhózy byla prokázána rovněž neinvazivní elastografií [61].
Naprosto zásadně se však po dosažení SVR mění prognóza pacientů s pokročilou fibrózou či cirhózou. Ve studii byli porovnáváni pacienti s pokročilou fibrózou či cirhózou dle toho, zda léčbou bylo dosaženo vyléčení (SVR). Riziko úmrtí z jaterních příčin bylo po 5 letech sledování (SVR vs nonSVR) 4,4 % vs 12,9 %, riziko rozvoje jaterní insuficience bylo 0 % vs 13,3 % a riziko rozvoje HCC bylo 9,2 % vs 13,1 %. Z recentních údajů dokonce vyplývá, že pacienti s již pokročilou fibrózou jater mají v případě dosažení SVR další přežití shodné s obecnou populací, na rozdíl od nemocných, kteří vyléčeni nebyli [62].
Chronická hepatitida C je onemocnění, u kterého se šance na vyléčení v 90. letech minulého století pohybovala mezi 10–30 % a postupně se na přelomu tisíciletí zvýšila na 50 % (graf 2). Toto onemocnění se nyní s příchodem nových přímo působících virostatik (direct-acting antivirals – DAAA) stalo téměř kompletně vyléčitelným. Celá desetiletí byla základem léčby kombinace interferonu α a následně pegylovaného interferonu α(PEG-IFN) a ribavirinu (RBV). Touto léčbou bylo možné dosáhnout SVR kolem 50–60 % a délka trvání léčby byla většinou 48 týdnů (relativně vzácně bylo možné léčit pacienta 24 týdnů v závislosti na vstupní viremii a na genotypu viru) a tato léčba byla provázena řadou nepříjemných i závažných nežádoucích účinků (především IFN dependentních). Mezi hlavní negativní prognostické faktory vyléčení (nízká šance na SVR) patřil vyšší věk a pokročilá fibróza, tedy klinická situace, v nichž naopak eliminace viru byla vysoce žádoucí k zastavení progrese onemocnění (pacienti dlouho infikovaní, typicky před rokem 1992).
2. Šance na dosažení SVR dle typu léčby 
V letech 2011–2012 se objevila první generace virostatik (boceprevir – BOC a telaprevir – TVR), která se kombinovala s PEG-IFN a RBV (tzv. trojkombinační léčba) a tato léčba zvýšila šanci na dosažení SVR na asi 70 %, byla však zatížena nežádoucími účinky ještě silnějšími a hlubšími (zvláště u pacientů s cirhózou) než běžná dvojkombinační léčba.
V roce 2014 se na trhu objevila první přímo působící virostatika nové generace, jejichž kombinací lze vytvořit léčebné režimy, které již neobsahují PEG-IFN, tedy tzv. IFN-free režimy [63]. Princip této léčby spočívá v kombinaci několika přímo působících virostatik (DAAA), která působí na různá místa replikace viru. Cílovými místy působení virostatik jsou:
- NS3/4A proteáza – simeprevir, paritaprevir, asunaprevir, grazoprevir
- NS5B polymeráza – sofosbuvir, dasabuvir
- NS5A replikační komplex – daclatasvir, ledipasvir, velpatasvir, ombitasvir
V roce 2016 se očekává příchod řady dalších látek na trh. Některé z těchto výše uvedených látek jsou sloučeny do 1 tablety (např. sofosbuvir a ledipasvir), takže k léčbě postačuje 1 tableta denně většinou po dobu 12 týdnů.
Kombinací uvedených přímo působících virostatik, minimálně ve dvojici či ve trojici, dosáhneme blokování virového replikačního procesu na několika místech a vysoké šance na vyléčení (95–100 %) během 12 (až 24) týdnů [63]. Některé kombinace mají shodnou efektivitu již při 8týdenní léčbě. Kombinace léků je nutné volit i dle pokročilosti jaterního onemocnění (cirhóza) a dále dle genotypu viru a dle složení předchozí léčby, která selhala. Jiné prediktivní faktory, které hrály roli při IFN léčbě, nyní již nejsou podstatné (viremie, genotyp IL28B, věk, pokročilost jaterního onemocnění atd). Další klíčovou výhodou je, že tyto IFN-free kombinace léků nejsou zatíženy žádnými závažnými či nepříjemným nežádoucími účinky (nutné ale ještě definitivně potvrdit, vzhledem ke krátké době jejich klinického využití) [64].
Velkým praktickým problémem je naopak cena těchto preparátů, zvláště pokud se užívají v kombinaci (cena jednotlivých preparátů se sčítá). Cena kombinační léčby HCV IFN-free na 12 týdnů pro jednoho pacienta se nyní v ČR pohybuje kolem 1,2–1,5 milionu Kč. Cena v okolních státech je podobná. Je zjevné (z hlediska alokace finančních prostředků), že hlavní snaha je nyní léčit pacienty s pokročilou fibrózou nebo cirhózou (s ohledem na špatnou prognózu a nízkou šanci na vyléčení při IFN léčbě) nebo pacienty s kontraindikací léčby PEG-IFN.
Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
MUDr. Václav Hejda
hejdav@fnplzen.cz
I. interní klinika LF UK a FN, Plzeň
www.fnplzen.cz
Doručeno do redakce 9. 11. 2015
Sources
1. Schuppan D, Afdhal NH. Liver cirrhosis. Lancet 2008; 371(9615): 838–851.
2. Marcellin P, Gane E, Buti M et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet 2013; 381(9865): 468–475.
3. Morgan TR, Ghany MG, Kim HY et al. Outcome of sustained virological responders with histologically advanced chronic hepatitis C. Hepatology 2010; 52(3): 833–844.
4. D‘Amico G, Garcia-Tsao G, Pagliaro L. Natural history and prognostic indicators of survival in cirrhosis: a systematic review of 118 studies. J Hepatol 2006; 44(1): 217–231.
5. Lozano R, Naghavi M, Foreman K et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380(9859): 2095–2128.
6. Blachier M, Leleu H, Peck-Radosavljevic M et al. The burden of liver disease in Europe: a review of available epidemiological data. J Hepatol 2013; 58(3): 593–608.
7. Hoyert DL, Xu J. Deaths: preliminary data for 2011. Natl Vital Stat Rep 2012; 61(6): 1–51.
8. Williams R, Aspinall R, Bellis M et al. Addressing liver disease in the UK: a blueprint for attaining excellence in health care and reducing premature mortality from lifestyle issues of excess consumption of alcohol, obesity, and viral hepatitis. Lancet 2014; 384(9958): 1953–1997.
9. Zanetti AR, Van Damme P, Shouval D. The global impact of vaccination against hepatitis B: a historical overview. Vaccine 2008; 26(49): 6266–6273.
10. Scaglione S, Kliethermes S, Cao G et al. The Epidemiology of Cirrhosis in the United States: A Population-based Study. J Clin Gastroenterol 2015; 49(8): 690–696.
11. Ishak K, Baptista A, Bianchi L et al. Histological grading and staging of chronic hepatitis. J Hepatol 1995; 22(6): 696–699.
12. Intraobserver and interobserver variations in liver biopsy interpretation in patients with chronic hepatitis C. The French METAVIR Cooperative Study Group. Hepatology 1994; 20(1 Pt 1): 15–20.
13. Castera L. Noninvasive methods to assess liver disease in patients with hepatitis B or C. Gastroenterology 2012; 142(6): 1293–1302.
14. Colombo S, Belloli L, Zaccanelli M et al. Normal liver stiffness and its determinants in healthy blood donors. Dig Liver Dis 2011; 43(3): 231–236.
15. Castera L, Foucher J, Bernard PH et al. Pitfalls of liver stiffness measurement: a 5-year prospective study of 13,369 examinations. Hepatology 2010; 51(3): 828–835.
16. Soresi M, Giannitrapani L, Cervello M et al. Non invasive tools for the diagnosis of liver cirrhosis. World J Gastroenterol 2014; 20(48): 18131–18150.
17. Friedrich-Rust M, Buggisch P, de Knegt RJ et al. Acoustic radiation force impulse imaging for non-invasive assessment of liver fibrosis in chronic hepatitis B. J Viral Hepat 2013; 20(4): 240–247.
18. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol 2015; 63(1): 237–264.
19. Bamber J, Cosgrove D, Dietrich CF et al. EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 1: Basic principles and technology. Ultraschall Med 2013; 34(2): 169–184.
20. Fattovich G, Pantalena M, Zagni I et al. Effect of hepatitis B and C virus infections on the natural history of compensated cirrhosis: a cohort study of 297 patients. Am J Gastroenterol 2002; 97(11): 2886–2895.
21. Moreau R, Jalan R, Gines P et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology 2013; 144(7): 1426–1437.
22. Kim SU, Oh HJ, Wanless IR et al. The Laennec staging system for histological sub-classification of cirrhosis is useful for stratification of prognosis in patients with liver cirrhosis. J Hepatol 2012; 57(3): 556–563.
23. Vergniol J, Foucher J, Terrebonne E et al. Noninvasive tests for fibrosis and liver stiffness predict 5-year outcomes of patients with chronic hepatitis C. Gastroenterology 2011; 140(7): 1970–1979.
24. Colecchia A, Montrone L, Scaioli E et al. Measurement of spleen stiffness to evaluate portal hypertension and the presence of esophageal varices in patients with HCV-related cirrhosis. Gastroenterology 2012; 143(3): 646–654.
25. Roberts S, Gordon A, McLean C et al. Effect of sustained viral response on hepatic venous pressure gradient in hepatitis C-related cirrhosis. Clin Gastroenterol Hepatol 2007; 5(8): 932–937.
26. Bruno S, Crosignani A, Facciotto C et al. Sustained virologic response prevents the development of esophageal varices in compensated, Child-Pugh class A hepatitis C virus-induced cirrhosis. A 12-year prospective follow-up study. Hepatology 2010; 51(6): 2069–2076.
27. Mallet V, Gilgenkrantz H, Serpaggi J et al. Brief communication: the relationship of regression of cirrhosis to outcome in chronic hepatitis C. Ann Intern Med 2008; 149(6): 399–403.
28. Poynard T, McHutchison J, Manns M et al. Impact of pegylated interferon alfa-2b and ribavirin on liver fibrosis in patients with chronic hepatitis C. Gastroenterology 2002; 122(5): 1303–1313.
29. George SL, Bacon BR, Brunt EM et al. Clinical, virologic, histologic, and biochemical outcomes after successful HCV therapy: a 5-year follow-up of 150 patients. Hepatology 2009; 49(3): 729–738.
30. Marcellin P, Gane E, Buti M et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet 2013; 381(9865): 468–475.
31. Hatzakis A, Wait S, Bruix J et al. The state of hepatitis B and C in Europe: report from the hepatitis B and C summit conference. J Viral Hepat 2011; 18(Suppl 1): 1–16.
32. SZÚ. Dostupné z WWW: <http://www.szu.cz/publikace/data/vybrane-infekcni-nemoci-v-cr-v-letech-2003–2012-absolutne. 2014>.
33. Davis GL. International Association for the Study of the Liver. Biennial scientific meeting, November 4–6, 1998. American Association for the Study of LIver Diseases, 49th annual meeting & postgraduate courses. November 6–10, 1998. Chicago, Illinois. Abstracts. Hepatology 1998; 28(4 Pt 2): A390.
34. Deuffic S, Buffat L, Poynard T et al. Modeling the hepatitis C virus epidemic in France. Hepatology 1999; 29(5): 1596–1601.
35. Deuffic S, Poynard T, Valleron AJ Correlation between hepatitis C virus prevalence and hepatocellular carcinoma mortality in Europe. J Viral Hepat 1999; 6(5): 411–413.
36. Law MG. Modelling the hepatitis C virus epidemic in Australia. Hepatitis C Virus Projections Working Group. J Gastroenterol Hepatol 1999; 14(11): 1100–1107.
37. Sagmeister M, Renner EL, Mullhaupt B et al. Simulation of hepatitis C based on a mandatory reporting system. Eur J Gastroenterol Hepatol 2002; 14(1): 25–34.
38. Sutton AJ, Hope VD, Mathei C A comparison between the force of infection estimates for blood-borne viruses in injecting drug user populations across the European Union: a modelling study. J Viral Hepat 2008; 15(11): 809–816.
39. Urbánek P, Husa P, Šperl J et al. Standardní diagnostický a terapeutický postup vchronické infekce virem hepatitidy C. Gastroent Hepatol 2015; 69(5): 455–471.
40. Vandelli CRF, Renzo F, Romano L et al. Lack of evidence of sexual transmission of hepatitis C amont monogamous couples: result of a 10-year prospecive follow-up study. Am J Gastroenterol 2004; 99(5): 855–859.
41. Rockstroh J, Grint D, Boesecke C et al. Increases in acute hepatitis C (HCV) incidence acreoss Europe: which regions and patient groups are affected? J Int AIDS Soc 2012; 15(Suppl 4): 181–186.
42. Schmidt AJ, Rockstroh J, Vogel M et al. Trouble with bleeding: risk factors for acute hepatitis C among HIV-positive gay men from Germany – a case-control study. PLoS One 2011; 6 : 17781. Dostupné z DOI: <http://doi: 10.1371/journal.pone.0017781>.
43. U.S. Public Health Service. Updated U.S. Public Health Service Guidelines for the Management of Occupational Exposures to HBV, HCV, and HIV and Recommendations for Postexposure Prophylaxis. MMWR Recomm Rep 2001; 50(RR-11): 1–52.
44. Tomkins SE, Elford J, Nichols T et al. Occupational transmission of hepatitis C in healthcare workers and factors associated with seroconversion: UK surveillance data. J Viral Hepat 2012; 19(3): 199–204.
45. Vogel M, Deterding K, Wiegand J et al. Initial presentation of acute hepatitis C viru (HCV) infection among HIV-negative and HIV-positive individuals-exprerience from 2 large German networks on the study of acute HCV infection. Clin Infect Dis 2009; 49(2): 317–319.
46. Marcellin P. Hepatitis C: the clinical spectrum of the disease. J Hepatol 1999; 31(Suppl 1): 9–16.
47. Loomba R, Rivera MM, McBurney R et al. The natural history of acute hepatitis C: clinical presentation, laboratory findings and treatment outcomes. Aliment Pharmacol Ther 2011; 33(5): 559–565.
48. Cacoub P, Renou C, Rosenthal E et al. Extrahepatic manifestations associated with hepatitis C virus infection. A prospective multicenter study of 321 patients. The GERMIVIC. Groupe d‘Etude et de Recherche en Medecine Interne et Maladies Infectieuses sur le Virus de l‘Hepatite C. Medicine (Baltimore) 2000; 79(1): 47–56.
49. Zignego AL, Craxi A. Extrahepatic manifestations of hepatitis C virus infection. Clin Liver Dis 2008; 12(3): 611–636.
50. Grebely J, Page K, Sacks-Davis R et al. The effects of female sex, viral genotype, and IL28B genotype on spontaneous clearance of acute hepatitis C virus infection. Hepatology 2014; 59(1): 109–120.
51. Shiffman ML, Stewart CA, Hofmann CM et al. Chronic infection with hepatitis C virus in patients with elevated or persistently normal serum alanine aminotransferase levels: comparison of hepatic histology and response to interferon therapy. J Infect Dis 2000; 182(6): 1595–1601.
52. Tillmann HL, Thompson AJ, Patel K et al. A polymorphism near IL28B is associated with spontaneous clearance of acute hepatitis C virus and jaundice. Gastroenterology 2010; 139(5): 1586–1592.
53. Thomas DL, Thio CL, Martin MP et al. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature 2009; 461(7265): 798–801.
54. Thein HH, Yi Q, Dore GJ et al. Estimation of stage-specific fibrosis progression rates in chronic hepatitis C virus infection: a meta-analysis and meta-regression. Hepatology 2008; 48(2): 418–431.
55. Poynard T, Bedossa P, Opolon P. Natural history of liver fibrosis progression in patients with chronic hepatitis C. The OBSVIRC, METAVIR, CLINIVIR, and DOSVIRC groups. Lancet 1997; 349(9055): 825–832.
56. Freedman ND, Everhart JE, Lindsay KL et al. Coffee intake is associated with lower rates of liver disease progression in chronic hepatitis C. Hepatology 2009; 50(5): 1360–1369.
57. Setiawan VW, Wilkens LR, Lu SC et al. Association of coffee intake with reduced incidence of liver cancer and death from chronic liver disease in the US multiethnic cohort. Gastroenterology 2015; 148(1): 118–125.
58. Fattovich G, Giustina G, Degos F et al. Morbidity and mortality in compensated cirrhosis type C: a retrospective follow-up study of 384 patients. Gastroenterology 1997; 112(2): 463–472.
59. Hu KQ, Tong MJ. The long-term outcomes of patients with compensated hepatitis C virus-related cirrhosis and history of parenteral exposure in the United States. Hepatology 1999; 29(4): 1311–1316.
60. D‘Ambrosio R, Aghemo A, Rumi MG et al. A morphometric and immunohistochemical study to assess the benefit of a sustained virological response in hepatitis C virus patients with cirrhosis. Hepatology 2012; 56(2): 532–543.
61. Poynard T, Moussalli J, Munteanu M et al. Slow regression of liver fibrosis presumed by repeated biomarkers after virological cure in patients with chronic hepatitis C. J Hepatol 2013; 59(4): 675–683.
62. van der Meer AJ, Wedemeyer H, Feld JJ et al. Life expectancy in patients with chronic HCV infection and cirrhosis compared with a general population. JAMA 2014; 312(18): 1927–1928.
63. Muir AJ. The rapid evolution of treatment strategies for hepatitis C. Am J Gastroenterol 2014; 109(5): 628–635.
64. Sadler MD, Lee SS. Revolution in hepatitis C antiviral therapy. Br Med Bull 2015; 113(1): 31–44.
Labels
Diabetology Endocrinology Gastroenterology and hepatology Internal medicine
Article was published inInternal Medicine

2015 Issue Suppl 4
Most read in this issue- Cirrhosis of the liver and HCV
- Approach to patients with liver diseases
- Possibilities of IFN-free therapy of hepatitis C
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

