-
Medical journals
- Career
Ateroskleróza: od etiologie po možnosti ovlivnění
Authors: Michal Vrablík
Authors‘ workplace: Centrum preventivní kardiologie III. interní kliniky 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Published in: Vnitř Lék 2015; 61(11): 925-931
Category: Reviews
Overview
Ateroskleróza jako zánětlivé postižení cévní stěny má více forem, které se vyskytují většinou současně. Klasická aterosklerotická léze charakterizovaná akumulací lipidů v subendoteliálním prostoru bývá často provázena změnami v hlubších vrstvách arteriální stěny, které jsou typické zmnožením extracelulární matrix a aktivací hladkosvalových buněk. Vlivem skladby rizikových faktorů může dominovat jeden nebo druhý typ postižení. Zatímco v patogenezi klasické formy aterosklerózy hrají zásadní roli aterogenní lipoproteiny (především třídy LDL), při rozvoji změn arteriální medie to jsou jiné rizikové faktory, např. hyperaktivita systému renin-angiotenzin-aldosteron (RAS). Ovlivněním těchto dvou základních mechanizmů prokazatelně zpomalujeme progresi cévních změn a příznivě ovlivňujeme prognózu nemocných. Důležitý je i fakt, že současné působení na tyto faktory má synergické působení doložené na úrovni experimentální i klinické. Důsledné využití možností nabízené intenzivním snižováním hladin aterogenních lipidů i nadměrné aktivity systému RAS snižuje riziko typických aterotrombotických komplikací (akutní koronární syndrom) i příhod podmíněných větší měrou změnami arteriální medie či hypertrofií levé komory srdeční (maligní arytmie, srdeční selhání). Tyto dva směry tak představují předpoklady úspěchu kardiovaskulární prevence.
Klíčová slova:
ateroskleróza – dyslipidemie – kardiovaskulární prevence – RAS – systémový zánětTrocha historie
Ateroskleróza provází lidstvo od nepaměti a dlouhou dobu byla považována za degenerativní proces cévní stěny podmíněný prostou akumulaci lipidů. Tato tzv. lipidová teorie vzniku aterosklerózy je postavena na prokázané souvislosti hladiny LDL-cholesterolu s progresí aterosklerózy a považuje cholesterol navázaný na lipoproteiny o nízké hustotě (LDL) za prvotní příčinu jejího vzniku [1]. Při vysoké hladině LDL-cholesterolu proniká více cholesterolu cévní stěnou do subendoteliálního prostoru, v němž dochází k hromadění lipidů a vzniku pěnových buněk, což jsou základní buněčné elementy ateromové léze. Podkladem pro vznik pěnové buňky je akumulace lipidů především ve formě esterů cholesterolu v makrofázích, jak dokumentoval Aničkov ve svých experimentech z počátku 20. století.
Zájem o etiopatogenezi aterosklerózy v 2. polovině 20. století lze zdůvodnit nárůstem počtu aterosklerózou podmíněných onemocnění i úmrtí způsobených jejími komplikacemi, k nimž došlo v rozvinutých zemích. Tak vznikla i teorie endoteliálního poškození formulovaná Rossem v roce 1976 [2], která považuje za primární příčinu vzniku aterosklerózy narušení endotelu, ke kterému dochází různými způsoby (mechanicky, chemicky, imunologicky). Endoteliální poškození představuje podmínku k adherenci trombocytů, zvýšené proliferaci hladké svaloviny, kolagenu a extracelulární matrix. Narušeným endotelem do cévní stěny migrují monocyty, z nichž aktivací vznikají makrofágy produkující cytokiny. Touto kaskádou dějů se v cévní stěně spouští zánětlivý proces a aterosklerotická léze progreduje. Akumulace lipidů v cévní stěně je podle této teorie tedy jev druhotný, následující poškození endotelu, jenž ale sám o sobě nepředstavuje příčinu vzniku aterosklerotických cévních změn.
Každá z výše uvedených teorií popisuje samotný vznik aterosklerózy odlišně a zároveň s ohledem na jeho komplexnost ne zcela dostatečně. Právě složitost aterogeneze vyžádala formulaci tzv. jednotné hypotézy, která vychází z obou dříve formulovaných teorií, na první místo ovšem staví samotnou dysfunkci endotelu následovanou zvýšením propustnosti pro lipidy a makrofágy [3]. Dle této „jednotné teorie“ je tedy ateroskleróza složitý multifaktoriální proces, na jehož vzniku i progresi se podílí celá řada faktorů, přičemž na jejím počátku stojí dysfunkce endotelu, ne tedy nutně jeho mechanické poškození. Endoteliální dysfunkce je zde definována jako postižení endotelu vedoucí ke zvýšené propustnosti cévní stěny se vznikem nerovnováhy mezi vazoaktivními mechanizmy a hemokoagulačními působky, s následnou převahou mechanizmů aterogenních, vazospastických a protrombotických [4]. Příčiny vzniku endoteliální dysfunkce jsou především mechanické, uplatňují se ale také vlivy imunologické, toxické, či infekční. Prvotní změny funkcí endotelu následuje jeho vyšší propustnost pro lipidy a makrofágy, stupňuje se oxidace LDL částic a proliferace buněk hladké svaloviny, což ve výsledku ústí ve vznik aterosklerotických lézí. Role zánětu jako důležitého faktoru vzniku a rozvoje aterosklerotické léze se objevuje v názorech na etiopatogenezi tohoto onemocnění již dlouho a zmínky o něm (jako o sekundárním ději) najdeme i ve výše uvedených teoriích. Zajímavé je, že už na sklonku století 19. postuloval Virchow teorii akcentující zánětlivou složku cévních změn provázejících aterosklerózu, kterou nazýval „endarteriitis deformans“ [5].
Současná představa o vzniku aterosklerózy: dynamický zánětlivý proces
Pohled na aterosklerózu se v průběhu let posunul od teorie prostého ukládání lipidů, přes teorii endoteliálního poškození, až k tzv. zánětlivé teorii, která pohlíží na aterosklerózu jako na zánětlivý proces v cévní stěně [6]. Probíhající zánět jde ruku v ruce s akumulací lipidů v cévní stěně, proto již v časných aterosklerotických lézích jsou kromě jiných buněk přítomné leukocyty. Zdravý endotel není za normálních okolností schopen vázat buňky bílé krevní řady, nicméně v případě aktivace endotelu vhodným stimulem dochází na povrchu endoteliálních buněk k expresi selektivních adhezivních molekul, které atrahují různé druhy leukocytů, především monocyty a T-lymfocyty [7]. Tímto prozánětlivým spouštěčem může být nevhodná dieta bohatá na nasycené tuky, dyslipidemie, abdominální obezita, hyperglykemie, inzulinová rezistence, arteriální hypertenze, kouření – všechny tyto stavy navozují endoteliální expresi adhezivních molekul, navázání leukocytů a jejich následnou migraci do cévní stěny [8]. Mezi zmíněné adhezivní molekuly patří selektiny, které podněcují rolování leukocytů po povrchu poškozeného endotelu, a tím zprostředkovávají bližší kontakt s endotelem a integriny zajišťující jejich pevnější zachycení k endotelu [9]. Uvnitř počínající ateromové léze jsou exprimovány prozánětlivé cytokiny, které mají chemotaktický potenciál zapříčiňující další adherenci leukocytů k dysfunkčnímu endotelu usnadňující jejich migraci do intimy, v níž dochází k aktivaci monocytů v makrofágy. Zánětlivé mediátory mají také na svědomí zvýšenou expresi tzv. scavengerových receptorů na povrchu aktivovaných makrofágů, vedoucí k vychytávání modifikovaných lipoproteinových částic, které jsou poté fagocytovány makrofágy za vzniku pěnových buněk, typických pro vyvíjející se ateromovou lézi. Následně dochází k replikaci a proliferaci makrofágů v intimě a produkci většího množství cytokinů a růstových faktorů, které podporují migraci a proliferaci hladkých svalových buněk a podněcují T-lymfocyty k tvorbě dalších prozánětlivých cytokinů (např. interferon γ, tumor necrosis factor β), které mohou dále stimulovat makrofágy, buňky endotelu a hladké svaloviny cévní stěny [10,11]. Akumulace buněk monocyto-makrofágového systému v cévní stěně vede k chronickému subklinickému zánětu a progresi aterosklerózy. S pokračujícím zánětlivým procesem mohou aktivované leukocyty a buňky endotelu uvolňovat mediátory fibrogeneze (zahrnující množství peptidových růstových faktorů), které podporují další proliferaci a zmnožení hladkých svalových buněk a přispívají k formaci husté extracelulární matrix, která je typická pro pokročilé ateromové léze [12]. V průběhu proliferace buněk a růstu aterosklerotické léze často dochází k apoptóze zde přítomných buněk a vzniku na lipidy bohatého nekrotického jádra plátu [13].
Zánětlivý proces kromě ovlivnění formace a růstu aterosklerotického plátu také zásadně přispívá k rozvoji trombotických komplikací. Makrofágy aktivované uvnitř léze prozánětlivými cytokiny jsou schopné produkovat proteolytické enzymy, jako je kolagenáza nebo matrixové metaloproteázy způsobující ztenčení fibrózní čepičky ateromové léze, která se tímto stává vysoce náchylnou k ruptuře. Současně dochází k utlumení syntézy kolagenu hladkými svalovými buňkami pod vlivem interferonu γ produkovaného aktivovanými T-lymfocyty, což snižuje obnovování kolagenu a fibrózní kryt ateromu se nevratně ztenčuje [14]. Makrofágy, opět pod kontrolou prozánětlivých mediátorů, také exprimují tkáňový faktor s významnou prokoagulační schopností, který v případě ruptury plátu podněcuje tvorbu nasedajícího trombu. Zánětlivý proces hraje tedy zcela zásadní roli v etiopatogenezi aterosklerózy, nicméně základním předpokladem pro vznik plátu je stále akumulace lipoproteinových částic v cévní stěně, přičemž tyto částice jsou v subedtoteliálním prostoru pod vlivem zánětlivých mediátorů mnoha způsoby modifikovány.
Lipoproteiny hrají nadále hlavní roli v rozvoji aterosklerotické léze
Lipoproteinové LDL částice zachycené v intimě podléhají oxidativní modifikaci pod vlivem různých biologicky aktivních působků, které se nacházejí v ateromové lézi (např. hydroperoxidázy). Navíc jsou zde lipoproteinové částice izolované od plazmatických antioxidantů, což dále podporuje jejich oxidativní modifikaci [15]. Oxidativně pozměněné lipidové zbytky dále aktivují endoteliální buňky, indukují expresi adhezivních molekul, chemokinů, prozánětlivých cytokinů a dalších mediátorů zánětu v makrofázích a endoteliálních buňkách. Apoproteinové zbytky lipoproteinových částic mohou v cévní stěně také podléhat podobné modifikaci, následně získávají antigenní potenciál aktivující T-lymfocyty a antigen specifickou imunitní odpověď [16]. Podobně mohou oxidativní modifikaci podléhat také ostatní lipoproteiny, jako lipoprotein o velmi nízké hustotě (VLDL) a střední hustotě (IDL). Závěry některých studií naznačují, že i samotné VLDL částice jsou schopné spustit prozánětlivou činnost endoteliálních buněk [17]. Navíc lze považovat za prokázané, že tzv. remnantní lipoproteiny (vznikající po částečné hydrolýze triglyceridů v částicích chylomikronů či VLDL zprostředkované lipoproteinovou lipázou) mají významný aterogenní potenciál. V případě jejich zmnožení, k němuž dochází typicky při všech situacích spojených s hypertriglyceridemií, se remnantní lipoproteiny stávají významným „dodavatelem“ cholesterolu pro růst aterosklerotické léze [18]. Remnantní receptory pohlcují makrofágy zachycené v cévní stěně prostřednictvím scavengerového receptoru, který nemá (na rozdíl od LDL receptoru) schopnost down-regulace v případě vzestupu intracelulární koncentrace cholesterolu [19]. Na druhou stranu, ateroprotektivní lipoproteiny o vysoké hustotě (HDL) se mohou podílet na transportu antioxidantů do cévní stěny, které mají schopnost rozkládat oxidované lipidy a neutralizovat tím jejich potenciální prozánětlivý účinek [15].
Z uvedeného vyplývá, že formace aterosklerotického plátu je velmi komplexní a složitý proces, při němž dochází k zapojení řady patofyziologických kaskád, jejichž společným jmenovatelem je zánětlivá reakce. Za spouštěče zánětu i za jeho udržování považujeme rizikové faktory kardiovaskulárních onemocnění, ať už klasické nebo tzv. nové. Ale i pohled na význam jednotlivých rizikových faktorů se v čase vyvíjí.
Rizikové faktory aterosklerózy včera a dnes
Existují různá klasifikační schémata dělící rizikové faktory (RF) podle odlišných kritérií – známé RF klasické a nové, dobře dokumentované a nově popsané, ovlivnitelné a neovlivnitelné atd. Musíme si však připomenout zásadní rozdíl mezi rizikovým faktorem a ukazatelem rizika. Zatímco změnou rizikového faktoru skutečně působíme na výskyt onemocnění v budoucnosti, ovlivnění rizikových ukazatelů v takto pozitivní efekt nevyústí. Vzpomeňme v této souvislosti příběhu homocysteinu, rizikového ukazatele aterosklerózy a oběhových onemocnění, jehož zvýšené hladiny byly pravidelně nacházeny u osob s pokročilejšími aterosklerotickými změnami. Snižování hladin homocysteinu pomocí vitaminové suplementace mělo ovlivnit výskyt kardiovaskulárních příhod. Přestože vše teoreticky nemělo vadu na kráse, teprve správně uspořádané klinické studie dokumentovaly, že tato intervence nemá žádný vliv na počty infarktů myokardu nebo cévních mozkových příhod [20]. Uvedený příklad dokládá nezbytnost dobré teoretické dokumentace kauzálního spojení sledovaného rizikového faktoru s výskytem kardiovaskulárních příhod: nemohou být založeny na víře nebo pouze experimentálních datech, ale musíme požadovat důkazy z více úrovní medicínského výzkumu (experimentální, epidemiologická i data z klinických studií). Nejdůležitější tradiční rizikové faktory shrnuje tab. 1.
Table 1. Tradiční rizikové faktory aterosklerózy 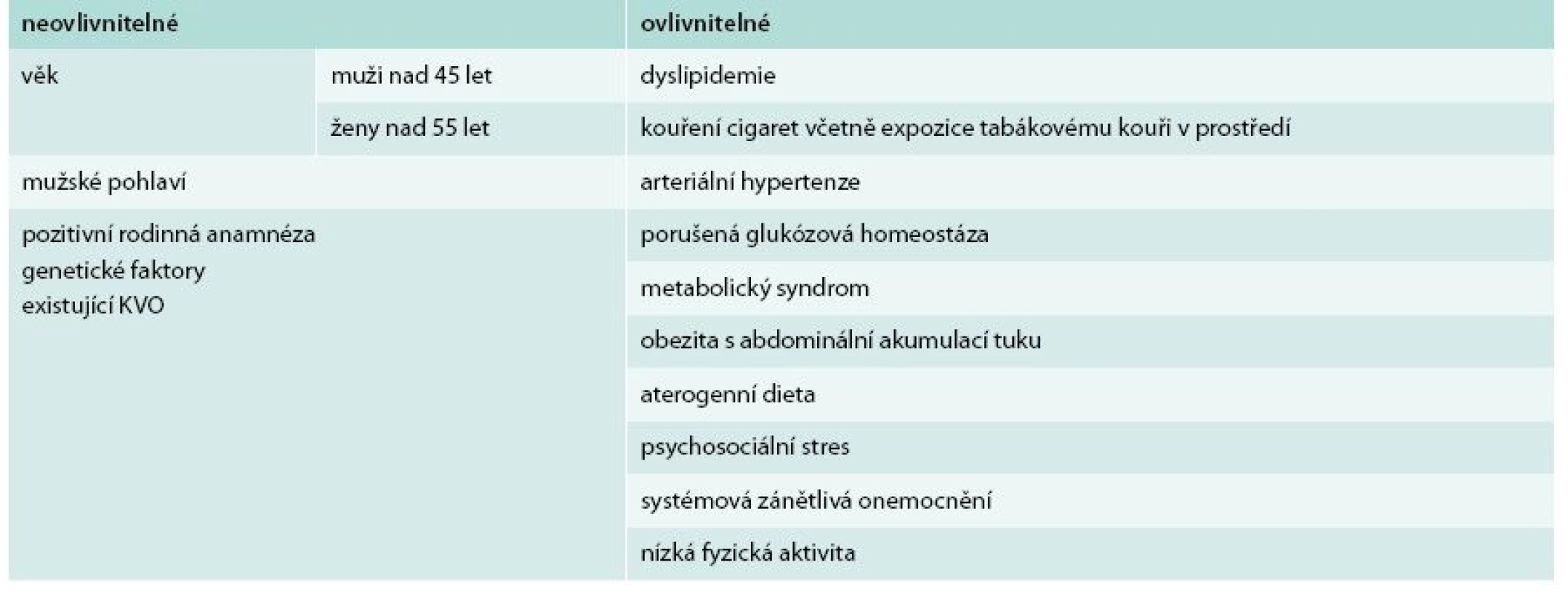
Ateroskleróza: jedno onemocnění, více forem
Existuje řada klinicky běžných situací, u kterých se setkáváme s formami aterosklerózy lišícími se různými aspekty od typického aterosklerotického cévního poškození. Tyto formy cévního poškození nejsou spouštěny a udržovány běžnými rizikovými faktory a není vzácné, že tradiční rizikové faktory u takto postižených nenacházíme. Nejlépe prozkoumaným příkladem atypické formy aterosklerotického cévního poškození může být vaskulopatie u osob po transplantaci srdce rozvíjející se v cévních strukturách štěpu. V nich dochází k nahromadění T-lymfocytů produkujících stimulační chemokiny (především interferon γ) vedoucí ke koncentrické fibroproliferativní formě aterosklerózy [21]. Obdobně atypické morfologické změny cévní stěny ale nacházíme i u nemocných s diabetes mellitus či nefropatií. Kromě běžných aterosklerotických cévních změn s maximem v subendoteliálním prostoru a lamina intima u nich nacházíme změny v hlubších vrstvách cévní stěny, především v lamina media. Tam dochází k hromadění a proliferaci buněk hladkého svalstva, lymfocytární infiltraci a kalcifikaci, což dále narušuje fyziologické funkce cévní stěny a zhoršuje prognózu nemocných.
Hlavním buněčným elementem aterosklerotické léze v tomto případě není makrofág a pěnová buňka, ale buňka hladkého svalu, která se při působení cytokinů produkovaných různými typy imunokompetentních buněk v cévní stěně (interleukin 4, tumor necrosis factor β apod) mění na buňky podobné chondrocytům nebo osteoblastům. Tím je vytvořen předpoklad pro vznik základního znaku této formy cévního poškození – vaskulární kalcifikace. Současně se mění poměrné zastoupení kolagenu a elastinu v cévní stěně, která ztrácí pružnost [20].
Uvedený příklad má sloužit k ilustraci komplexnosti problematiky a dokumentaci faktu, že ateroskleróza má různé formy, jejichž průběh mohou ovlivňovat specifické rizikové faktory. Rozdíly v patogenezi a morfologii cévního postižení nakonec zrcadlí i spektrum komplikací, které se u „typické“ aterosklerózy a popisované vaskulopatie přece jen liší. Podíváme-li se na zastoupení cévních příhod u nemocných s pokročilou fází renálního onemocnění, vidíme, že dominují komplikace typu srdečního selhání, arytmií nebo náhlého úmrtí (graf 1).
Graph 1. Příčiny mortality u pacientů s chronickým renálním onemocněním. 
Upraveno podle [23] Typické aterotrombotické cévní příhody v této populaci nacházíme podstatně méně často. Na druhé straně si připomeňme, že cévní poškození má vždy prvky obou popsaných základních forem aterosklerotického postižení, které běží současně a vzájemně se (nepříznivě) ovlivňují. To má praktický význam při úvahách o volbě léčby, která musí cílit více směry a ovlivňovat různé patofyziologické mechanizmy cévního postižení současně.
Hyperaktivita systému renin-angiotenzin-aldosteron: důležitý faktor rozvoje cévních změn
O zásadní roli systému renin-angiotenzin-aldosteron (RAS) pro regulaci krevního tlaku víme dlouhou dobu. Ani fakt, že zvýšená aktivita RAS má přímé negativní vlivy na cévní funkci, není novinkou. Zajímavým modelem se v této souvislosti jeví pacienti s primárním hyperaldosteronizmem, u kterých detekujeme pokročilejší cévní změny než u esenciálních hypertoniků [24]. Kromě zvýšení krevního tlaku je hyperaktivita RAS spojená s vyšším oxidačním stresem, endoteliální dysfunkcí, zmnožením kolagenu a extracelulární matrix v cévě, což přímo zvyšuje tuhost cévní stěny. Inhibice systému RAS má tedy z hlediska rozvoje vaskulárních změn charakterizovaných maximem patologických nálezů v mediální části cévní stěny podobně velký význam, jako má snižování hladin LDL-cholesterolu pro rozvoj klasického ateromu s subendoteliálním prostoru. I z toho důvodu patří snižování aktivity RAS k základům preventivních strategií. Hlavní možnosti snižování hyperaktivity RAS představuje blokáda angiotenzin konvertujícího enzymu či antagonizace receptorů pro angiotenzin II typu 1. Oba postupy mají prokázané pozitivní působení na cévní prognózu [25]. Zásadní odlišností s ohledem na místo blokády systému RAS je působení na kininový systém. Zatímco inhibice ACE koncentrace bradykininu zvyšuje, interference s AT1 receptory jeho koncentrace neovlivňuje. Dlouhou dobu jsme vnímali tento rozdíl především jako vysvětlení vzniku nežádoucích účinků provázejících podávání inhibitorů ACE, ale v poslední době se pohled na tuto problematiku posouvá. Bradykinin je nonapeptid s mohutnou biologickou aktivitou zprostředkovanou prostřednictvím receptorů B1R a B2R. Receptory B1R exprimují aktivované a poškozené endoteliální buňky a jejich interakce s bradykininem vede k extravazaci, zvýšení cévní propustnosti a stimulaci zánětlivé reakce indukcí a aktivací neutrofilů. Naproti tomu stimulace receptorů B2R exprimovaných konstitutivně vyústí ve zvýšení produkce oxidu dusnatého a prostacyklinu, což vede k žádoucímu vazodilatačnímu působení [26]. Tyto účinky bradykininu potencují vlastní působení inhibice ACE a snížení produkce aldosteronu a mohou být považovány za pozitivní (schéma).
Schéma. Mechanizmy ovlivnění cévní funkce bradykininem interakcí s receptory B1R a B2R 
APP – aminopeptidáza DPP4 – dipeptidyl 1 peptidáza NEP – neutrální endopeptidáza CPN – karboxypeptidáza NO – oxid dusnatý HMW – high molecular weight ↑– nárůst Je velmi pravděpodobné, že právě tyto efekty mají důležitý podíl na výsledném vlivu inhibice ACE na různé parametry cévní reaktivity a v konečném důsledku i na prognózu nemocných [27].
Cévní působení inhibice systému RAS
Snížení aktivity systému renin-angiotenzin-aldosteron (RAS) v cirkulaci vede k poklesu krevního tlaku. Ovlivněním významnější části tohoto systému lokalizovaného v tkáních (tzv. tkáňový RAS představuje asi 90 % jeho celkové aktivity) dosahujeme tkáňové ochrany [28]. Rozdíly v afinitě různých inhibitorů ACE k tkáňovému RAS byly popsány a je vhodné v této situaci připomenout, že k inhibici systému RAS lokalizovaného v tkáních potřebujeme většinou vyšší dávky účinných látek [29]. Máme k dispozici experimentální práce dokládající, že účinné snížení aktivity ACE potlačuje apoptózu endoteliálních buněk v experimentálním modelu lipopolysacharidem iniciované apoptózy endotelií [30]. Máme ale i důkazy ze studií provedených u pacientů s esenciální hypertenzí. Ve studii DAPHNET bylo podávání perindoprilu spojeno s významným vzestupem distenzibility karotických arterií měřenou metodami aplanační tonometrie [31]. Obdobou cévní remodelace na úrovni myokardu může být sledování vlivu inhibice ACE na parametry morfologie levé komory srdeční u nemocných po akutní koronární příhodě. I zde máme důkazy o příznivém působení snížení aktivity RAS na rozvoj hypertrofie levé komory srdeční při inhibici ACE, spojené se sníženou fibroprodukcí a poklesem podílu extracelulární matrix [32]. Navíc existují doklady synergického působení inhibice systému RAS s dalšími strategiemi cílenými na ovlivnění klasické formy aterosklerózy stimulované především dodávkou aterogenních lipidů. Ve studii PERSPECTIVE, podstudii známého projektu EUROPA, hodnotili autoři parametry rozsahu aterosklerotických cévních změn pomocí intravaskulární ultrasonografie u 118 pacientů po dobu 1 roku. Zatímco při správné zahrnující statin, betablokátor i antiagregační léčbu bez inhibitoru ACEI zaznamenali autoři stabilizaci aterosklerotického postižení, při této terapii obohacené o plnou dávku perindoprilu došlo k měřitelné a statisticky významné regresi rozsahu aterosklerotického postižení (pokles měřené plochy plátu o 0,18 ± 2,4 mm2 ve skupině léčené perindoprilem a nárůst o 0,19 ± 2,4 mm2 ve skupině alokované k placebu, p = 0,04) [33].
Synergie léčby hypertenze a dyslipidemie = podstatné snížení KV rizika
Veškeré úvahy o intervenci rizikových faktorů kardiovaskulárních onemocnění směřují ke společnému cíli – snížení výskytu aterotrombotických cévních příhod, omezení jejich chronických důsledků a snížení úmrtnosti z KV příčin. Proto potřebujeme pro posouzení významu třeba i dobře teoreticky doložených vlivu různých léčebných postupů klinické studie hodnotící právě zmíněné parametry. Pro rozhodnutí o vedení léčby nemocného s hypertenzí a dyslipidemií takovou úroveň důkazů máme k dispozici. Evergreen mezi studiemi zabývajícími se sledováním vlivu intervence rizikových faktorů na KV riziko – studie ASCOT – již před více než 10 lety doložila, že moderní antihypertenzivní terapie založená na kombinaci ACEi (perindopril) a blokátor kalciových kanálů (amlodipin) nabízí jednoznačně lepší výsledky než v době studie rozšířená kombinace betablokátoru (atenolol) s tiazidovým diuretikem (bendroflumetiazid) [34]. Možná méně komentovaným, ale ještě významnějším zjištěním autorů ASCOTu bylo, že přidání atorvastatinu ke kombinaci ACEi + BKK přináší léčeným další významné snížení rizika – riziko akutního infarktu myokardu a úmrtí z koronárních příčin bylo sníženo o více než polovinu (graf 2) [35].
Graph 2. Synergické působení kombinace perindopril + amlodipin + atorvastatin na výskyt koronárních příhod ve studii ASCOT 
Vysvětlení tohoto nikoli nového pozorování hledala řada prací a jistě se nepodařilo postihnout všechny aspekty, které zodpovídají za výše popsaný jednoznačně pozitivní výsledek trojkombinace použité ve studii ASCOT. Z praktického hlediska ale je důležité, že máme návod, jak postupovat v intervenci vysokého KV rizika u našich nemocných. Navíc dnes po letech od publikace výsledků ASCOT víme, že výsledky této studie nepatří do kategorie „světa klinických studií“, který se od naší každodenní rutiny značně liší. Před několika lety jsme ověřili, že inspiraci studií ASCOT lze s úspěchem přenést do našich ordinací. V projektu ATRACTIV byly podle schématu studie ASCOT léčeny více než 4 000 nemocných po dobu 1 roku a výsledky intervence byly podobně zajímavé, jako v samotném ASCOTu (graf 3) [36].
Graph 3. Změny hlavních rizikových faktorů během ročního sledování v projektu ATRACTIV 
TC – celkový cholesterol Kombinace režimových opatření s farmakoterapií dyslipidemie založené na atorvastatinu se promítla do zlepšení stavu dyslipidemie. Hladiny celkového cholesterolu se snížily o ¼ a téměř o 1⁄3 klesla koncentrace LDL-C. I přes dosažené výsledky je třeba zdůraznit, že většina osob ve sledování nedosáhla cílových hodnot TC a HDL-C pro kategorii vysokého KV rizika. Z tohoto pohledu je třeba vyčkat výsledků probíhajících analýz průměrné velikosti dávek atorvastatinu a rozložení dávkovacích rozmezí spolu s vyhodnocením % dosažení cílových hodnot. Kde budeme hledat možnosti dalšího snížení rizika cévního postižení?
S ohledem na současné poznatky o vzniku a vývoji aterosklerózy nepřekvapí směr klinického výzkumu sledující možnosti ovlivnění aterosklerózy intervencemi ovlivňujícími výhradně systémovou zánětlivou odezvu. Klinické studie testující tento koncept probíhají. Jednou z nich je rozsáhlý projekt s názvem CANTOS (Canakinumab Anti-Thrombosis Outcome Study), v rámci kterého pacienti po akutním infarktu myokardu dostávají ke standardní léčbě ještě kanakinumab – monoklonální protilátku proti interleukinu 1β. Do studie by mělo být zařazeno 10 000 nemocných a její výsledky očekáváme v roce 2017 [37]. Studie CIRT (Cardiovascular Inflammation Reduction Trial) u podobného spektra osob testuje vliv přidání 15–20 mg metotrexátu týdně k běžné léčbě pacientů v sekundární prevenci ischemické choroby srdeční na výskyt vaskulárních příhod. Studie by měla být ukončena koncem roku 2018 a zařazením plánovaného počtu 7 000 účastníků by měla mít dostatečnou sílu k zodpovězení otázky, zdali protizánětlivá léčba představuje budoucnost kardiovaskulární léčby [38].
Ateroskleróza: staré onemocnění chápané nově
Pochopení dalších patogenetických mechanizmů uplatňujících se při vzniku a progresi aterosklerózy představuje nejen velmi zajímavou výzkumnou oblast, ale především východisko pro hledání nových preventivních a léčebných postupů. Poznání role různých buněčných a humorálních komponent imunitního systému v aterogenezi umožnilo nasměrovat klinický výzkum do oblastí dosud vyhrazeným zcela jiným medicínským odvětvím. Budeme sledovat s napětím, zdali se naplní teoretické předpoklady a klinické studie potvrdí, že modifikace a tlumení systémové zánětlivé odezvy dokáží snížit riziko aterotrombotických cévních komplikací a budeme tak mít k dispozici další možnost k ovlivnění reziduálního kardiovaskulárního rizika. V každém případě už nyní disponujeme účinnými prostředky ke zpomalení cévních změn a snížení rizika vzniku a progrese aterosklerózy. Synergie strategií ovlivňujících různé formy aterosklerotického postižení, stimulovaného na jedné straně především aterogenními lipoproteiny, a na straně druhé přestavbovými změnami arteriální medie, můžeme považovat za prokázanou nejen na úrovni experimentů. Je pouze na nás, abychom možnosti zlepšení prognózy pacientů zprostředkované intenzivní léčbou dyslipidemie za současného účinného tlumení hyperaktivity systému RAS využívali důsledně u všech indikovaných pacientů.
Podpořeno grantem IGA MZ ČR NT14186–3.
doc. MUDr. Michal Vrablík, Ph.D.
vrablikm@seznam.cz
Centrum preventivní kardiologie III. interní kliniky 1. LF UK a VFN, Praha
www.vfn.cz
Doručeno do redakce 14. 11. 2015
Přijato po recenzi 23. 11. 2015
Sources
1. Getz GS, Vesselinovitch D, Wissler RW. A dynamic pathology of atherosclerosis. Am J Med 1969; 46(5): 657–673.
2. Ross R, Harker L. Hyperlipidemia and atherosclerosis. Science 1976; 193(4258): 1094–1100.
3. Steinberg D, Witzum JL. Lipoproteins and atherogenesis. Current Concepts JAMA 1990; 264(23): 3047–3052.
4. Camici GG, Savarese G, Akhmedov A et al. Molecular mechanism of endothelial and vascular aging: implications for cardiovascular disease. Eur Heart J 2015; pii: ehv587 (e-publikace v tisku).
5. Hansson GK. Immune and inflammatory mechanisms in the pathogenesis of atherosclerosis. J Atheroscler Thromb 1994; 1(Suppl 1): S6-S9.
6. Libby P. Inflammation in atherosclerosis. Nature 2002; 420(6917): 868–874.
7. Stemme S. Plaque T-cell activity: not so specific? Arterioscler Thromb Vasc Biol 2001; 21(7): 1099–1101.
8. Galkina E, Ley K. Vascular adhesion molecules in atherosclerosis. Arterioscler Thromb Vasc Biol 2007; 27(11): 2292–2301.
9. Luo BH, Carman CV, Springer TA. Structural basis of integrin regulation and signaling. Annu Rev Immunol 2007; 25 : 619–647.
10. Skålén K, Gustafsson M, Rydberg EK et al. Subendothelial retention of atherogenic lipoproteins in early atherosclerosis. Nature 2002; 417(6890): 750–754.
11. Gerrity RG. The role of the monocyte in atherogenesis: I. Transition of blood-borne monocytes in to foam cells in fatty lesions. Am J Pathol 1981; 103(2): 181–190.
12. Libby P, Simon DI. Inflammation and thrombosis: the clot thickens. Circulation 2001; 103(13): 1718–1720.
13. Geng YJ, Libby P. Progression of atheroma: a strug glebet ween death and procreation. Arterioscler Thromb Vasc Biol 2002; 22(9): 1370–1380.
14. Libby P. Collagenases and cracks in the plaque. J Clin Invest 2013; 123(8): 3201–3203.
15. Navab M. Ananthramaiah GM, Reddy ST et al. The oxidation hypothesis of atherogenesis: the role ofoxidizedphospholipids and HDL. J Lipid Res 2004; 45(6): 993–1007.
16. Dichtl W, Nilsson L, Goncalves I al. Very low-density lipoprotein activates nuclear factor-κB in endothelial cells. Circ Res 1999; 84(9): 1085–1094.
17. Hansson GK, Hermansson A. The immune system in atherosclerosis. Nat Immunol 2011; 12(3): 204–212.
18. Varbo A, Benn M, Nordestgaard BG. Remnant cholesterol as a cause of ischemic heart disease: evidence, definition, measurement, atherogenicity, high risk patients, and present and future treatment. Pharmacol Ther 2014; 141(3): 358–367.
19. Schulz C, Massberg S. Atherosclerosis-Multiple Pathways to Lesional Macrophages. Sci Transl Med 2014; 6(239):239ps2. Dostupné z DOI: <http://dx.doi.org/10.1126/scitranslmed.3008922>.
20. Bonaa KH, Njølstad I, Ueland PM et al. Homocysteine lowering and cardiovascular events after acute myocardial infarction. N Engl J Med 2006; 354(15): 1578–1588.
21. Salomon RN, Hughes CC, Schoen FJ et al. Human coronary transplantation-associated arteriosclerosis. Evidence for a chronic immune reaction to activated graft endothelial cells. Am J Pathol 1991; 138(4): 791–798.
22. Verberckmoes SC, Persy V, Behets GJ et al. Uremia-related vascular calcification: more than apatite deposition. Kidney Int 2007; 71(4): 298–303.
23. Mafham M, Emberson J, Landray MJ et al. Estimated glomerular filtration rate and the risk of major vascular events and all-cause mortality: a meta-analysis. PLoSOne 2011; 6(10): e25920. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0025920>.
24. Widimský J Jr, Štrauch B, Petrák O et al. Vascular disturbances in primary aldosteronism: clinical evidence. Kidney Blood Press Res 2012; 35(6): 529–533.
25. ONTARGET Investigators. Yusuf S, Teo KK, Pogue J et al. Telmisartan, ramipril, orbothin patients at high risk for vascular events. N Engl J Med 2008; 358(15): 1547–1559.
26. Couture R, Blaes N, Girolami JP. Kinin receptors in vascular biology and pathology. Curr Vasc Pharmacol 2014; 12(2): 223–248.
27. Savarese G, Costanzo P, Cleland JG et al. A meta-analysis reporting effects of angiotensin-converting enzyme inhibitors and angiotensin receptor blockers in patients without the art failure. J Am Coll Cardiol 2013; 61(2): 131–142.
28. Lazartigues E, Feng Y, Lavoie JL. Thetw of ACEs of the tissue renin-angiotensin systems: implication in cardiovascular diseases. Curr Pharm Des 2007; 13(12): 1231–1245.
29. Mac Fadyen RJ, Lees KR, Reid JL. Tissue and plasma angiotensin converting enzyme and the response to ACE inhibitor drugs. Br J Clin Pharmacol 1991; 31(1): 1–13.
30. Ceconi C, Francolini G, Bastianon D et al. Differences in the effect of angiotensin-converting enzyme inhibitors on the rate of endothelial cell apoptosis: in vitro and in vivo studies. Cardiovasc Drugs Ther 2007; 21(6): 423–429.
31. Tropeano AI, Boutouyrie P, Pannier B et al. Brachial pressure-independent reduction in carotid stiffness after long-term angiotensin-converting enzyme inhibition in diabetic hypertensives. Hypertension 2006; 48(1): 80–86.
32. Verdecchia P, Gentile G, Angeli F et al. Beyond blood pressure: evidence for cardiovascular, cerebrovascular, and renal protective effects of renin-angiotensin system blockers. Ther Adv Cardiovasc Dis 2012; 6(2): 81–91.
33. Rodriguez-Granillo GA, de Winter S, Bruining N et al. EUROPA/PERSPECTIVE Investigators. Effect of perindopril on coronary remodeling in sights from a multicentre, randomized study. Eur Heart J 2007; 28(19): 2326–2331.
34. Dahlöf B, Sever PS, Poulter NR et al. ASCOT investigators. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet 2005; 366(9489): 895–906.
35. Sever P, Poulter NR, Mastorantonakis S et al. ASCOT Investigators. Coronary heart disease benefits from blood pressure and lipid-lowering. Int J Cardiol 2009; 135(2): 218–222.
36. Vrablík M, Freiberger T, Lánská I et al. Projekt Atractiv: zlepšení kardiovaskulární prevence v podmínkách primární péče v České republice. Vnitř Lék 2008; 54(12): 1131–1139.
37. Ridker PM, Thuren T, Zalewski A et al. Interleukin-1ß inhibition and the prevention of recurrent cardiovascular events: rationale and design of the Canakinumab Anti-inflammatory Thrombosis Outcomes Study (CANTOS). Am Heart J 2011; 162(4): 597–605.
38. Ridker PM. Testing the inflammatory hypothesis of atherothrombosis: scientific rationale for the cardiovascular inflammation reduction trial (CIRT). J Thromb Haemost 2009; 7(Suppl 1): 332–339.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 11-
All articles in this issue
- Ateroskleróza: od etiologie po možnosti ovlivnění
- Praktický přístup ke statinové intoleranci
- Včasná diagnostika familiární hypercholesterolemie v České republice v rámci projektu MedPed
- Inhibice PCSK9 jako nová naděje pro nemocné s familiární hypercholesterolemií, statinovou intolerancí a posléze pro všechny pacienty v nejvyšším kardiovaskulárním riziku? Zaměřeno na alirokumab – Praluent®
- Evolokumab a projekt PROFICIO: první výsledky
- Postavení lipoproteinové aferézy v současnosti
- Vliv kombinace simvastatinu s ezetimibem na krevní lipidy a na kardiovaskulární příhody u diabetiků (komentář k výsledkům subanalýzy studie IMPROVE-IT)
-
Co přináší přehledný článek o důkazech redukce makrovaskulárního rizika u pacientů s aterogenní dyslipidemií?
Zpráva o konsenzu expertů o významu kombinované terapie fenofibrátem a statinem Hana Rosolová - Studie TECOS, EXAMINE a SAVOR – čím se liší a co přinášejí?
- Klinický význam nových bazálních inzulinů a inzulin Toujeo® 300 U/ml
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinický význam nových bazálních inzulinů a inzulin Toujeo® 300 U/ml
- Ateroskleróza: od etiologie po možnosti ovlivnění
- Postavení lipoproteinové aferézy v současnosti
- Praktický přístup ke statinové intoleranci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

