-
Medical journals
- Career
Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
Authors: Jiří Pařenica 1,3; Jan Maláska 4; Jiří Jarkovský 5; Kateřina Helánová 3; Petr Jabandžiev 2; Jaroslav Michálek 2; Zuzana Veselková 2; Simona Littnerová 5; Lenka Kubková 1,3; Roman Gál 4; Pavel Ševčík 6; Monika Pávková Goldbergová 7; Jiří Litzman 8; Zdena Čermáková 9,10; Jindřich Špinar 1,3
Authors‘ workplace: Interní kardiologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 1; Lékařská fakulta MU, Brno, děkan prof. MUDr. Jiří Mayer, CSc. 2; Mezinárodní centrum klinického výzkumu FN u sv. Anny, Brno, ředitel Gorazd B. Stokin, M. D., MSc., Ph. D. 3; Klinika anesteziologie, resuscitace a intenzivní medicíny LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Roman Gál, Ph. D. 4; Institut biostatistiky a analýz LF MU, Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 5; Klinika anesteziologie, resuscitace a intenzivní medicíny FN Ostrava, přednosta prof. MUDr. Pavel Ševčík, CSc. 6; Ústav patologické fyziologie LF MU, Brno, přednostka prof. MUDr. Anna Vašků, CSc. 7; Ústav klinické imunologie a alergologie LF MU a FN u sv. Anny, Brno, přednosta prof. MUDr. Jiří Litzman, CSc. 8; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Milan Dastych, CSc., MBA 9; Katedra laboratorních metod LF MU, Brno, přednosta doc. MUDr. Milan Dastych, CSc., MBA 10
Published in: Vnitř Lék 2014; 60(2): 114-122
Category: Original Contributions
Overview
Úvod:
Kardiogenní šok (KŠ) je hlavní příčinou úmrtí pacientů hospitalizovaných pro akutní infarkt myokardu. V rámci akutního infarktu myokardu a kardiogenního šoku byl pozorován rozvoj zánětlivé odpovědi. Cílem naší práce bylo popsat dynamiku interleukin 6 (IL6) u pacientů v kardiogenním šoku a porovnat ji s dynamikou interleukinu 6 u pacientů v septickém šoku (SŠ) a kontrolní skupinou pacientů s nekomplikovaným akutním infarktem myokardu s elevacemi ST (STEMI) a vyhodnotit jeho diagnostické a prognostické možnosti.Metodika a pacienti:
V prospektivní observační studii bylo zařazeno celkem 71 pacientů, kteří splnili zařazovací kritéria: 30 pacientů v kardiogenním šoku, 21 pacientů v septickém šoku a 20 pacientů se STEMI. Hladiny IL6 byly stanoveny celkem 8krát po dobu 3 měsíců. Hlavním sledovaným parametrem byla 3měsíční mortalita.Výsledky:
Nejvyšší hodnoty IL6 byly detekovány v průběhu 1. týdne u pacientů v septickém šoku s maximální hodnotou při přijetí. U pacientů v KŠ dosáhly hladiny IL6 maxima za 12–24 hodin od vzniku infarktu. Podle ROC analýzy byly zvýšené hodnoty IL6 > 357 pg/ml při přijetí (AUC 0,730; p = 0,031) typické pro KŠ v porovnání s kontrolní skupinou pacientů se STEMI. Hodnoty IL6 > 1 237 pg/ml při přijetí, resp. hodnoty IL6 > 1 071 pg/ml po 24 hodinách byly dle ROC analýzy charakteristické pro pacienty v SŠ v porovnání s pacienty v KŠ. Zjistili jsme pouze statisticky nesignifikantní trend pro IL6 v predikci mortality u pacientů v kardiogenním šoku pro hodnoty ≥ 1 854 pg/ml (AUC 0,769, p = 0,066) stanovené 12 hodin od přijetí. Nezjistili jsme žádný význam IL6 v predikci 3měsíční mortality u pacientů v septickém šoku.Závěr:
Pacienti v kardiogenním šoku produkují vyšší hladinu prozánětlivého IL6 ve srovnání s pacienty se STEMI. Maximálních hodnot IL6 dosahují pacienti v septickém šoku při přijetí na anesteziologické oddělení, pacienti v kardiogenním šoku za 12–24 hodin od přijetí. Vzhledem k výrazné interindividuální variabilitě hladiny IL6 jak u pacientů v kardiogenním, tak i septickém šoku se rutinní použití IL6 v klinické praxi nejeví jako přínosné pro predikci prognózy pacientů v kardiogenním či septickém šoku.Klíčová slova:
infarkt myokardu – interleukin 6 – kardiogenní šok – prognóza – septický šokÚvod
Pacienti s akutním infarktem myokardu (AIM) komplikovaným kardiogenním šokem (KŠ) mají špatnou prognózu s vysokou hospitalizační mortalitou 50–60 % navzdory moderní intenzivní péči [1,2] a revaskularizační léčbě [3]. U části pacientů v KŠ se nesetkáme s typickým obrazem daným kombinací těžké systolické dysfunkce levé komory doprovázeným výrazným zvýšením periferní vaskulární rezistence (systemic vascular resistance – SVR) vedoucím k obrazu studené periferie a mramorované kůže. Výsledky rozsáhlé prospektivní studie SHOCK trial provedené u pacientů s AIM komplikovaným KŠ ukázaly, že minimálně 20 % pacientů má projevy systémové zánětlivé reakce (systemic inflammatory response syndrome – SIRS) provázené normální nebo sníženou periferní vaskulární rezistencí, přičemž u 1/3 z těchto pacientů byla vyloučena přítomnost infekce [4]. Řada prací jednoznačně prokázala, že v průběhu AIM dochází ke zvýšení zánětlivých markerů, jako je C-reaktivní protein (CRP) [5,6] nebo interleukin 6 (IL6) [7]. Zvýšená plazmatická hladina IL6 byla ve skupině pacientů s AIM komplikovaným KŠ signifikantním prediktorem 30denní mortality, a to u pacientů s úspěšnou revaskularizací i bez ní [8]. V další práci Geppert et al srovnávali hodnoty IL6 mezi pacienty v kardiogenním a septickém šoku. Pacienti v SŠ měli vyšší hodnoty IL6 ve srovnání s pacienty v KŠ. Hodnota IL6 ve skupině pacientů v KŠ významně závisela na celkové tíži stavu daném rozvojem multiorgánového selhání (multiple organ failure – MOF). Hodnoty IL6 ve skupině pacientů v KŠ s MOF byli signifikantně vyšší ve srovnání s hladinami IL6 u pacientů v KŠ bez MOF a srovnatelné s hladinami IL6 u pacientů v SŠ [9]. Ve skupině pacientů v septickém šoku spíše než maximální hladiny IL6 byly s nepříznivou prognózou spojeny přetrvávající vysoké hladiny IL6 [10]. Při interpretaci těchto výsledků je nutné si uvědomit, že hladiny IL6 u pacientů v SŠ výrazně kolísají [11–13] a tvorba cytokinů jako odezva organizmu na sepsi je významně ovlivněna etiologickým agens septického stavu a původem infekce [14]. Cílem naší práce je popsat rozvoj zánětlivé reakce pomocí IL6 u pacientů s AIM komplikovaným kardiogenním šokem a porovnat ho jednak s kontrolní skupinou pacientů s nekomplikovaným akutním infarktem myokardu s elevacemi ST a zároveň ho porovnat se skupinou pacientů v SŠ, u kterých předpokládáme vysoce vystupňovanou zánětlivou reakci.
Pacienti a metodika
Protokol studie byl schválen Etickou komisí FN Brno a je v souladu s etickými principy Helsinské deklarace. Účastníci studie podepsali informovaný souhlas s účastí ve sledování při vstupu do studie nebo po nabytí plného vědomí, a v případě, že pacient vědomí nenabyl, byl souhlas získán od nejbližšího příbuzného.
Populace
Soubor představuje pacienty v kardiogenním šoku, septickém šoku a pacienty s akutním infarktem myokardu s elevacemi ST (STEMI) bez KŠ zařazené v období od ledna roku 2008 do června roku 2010. Pacienti v septickém šoku přijatí na pracoviště anesteziologické a resuscitační medicíny byli zařazeni do studie co nejdříve od okamžiku, kdy splnili kritéria pro septický šok, pacienti v KŠ a pacienti se STEMI byli zařazeni do studie při přijetí na koronární jednotku. Kritéria pro septický šok odpovídají kritériím International Sepsis Definitions Conference, ACCP/SCCM, konkrétně kritériím sepse s trvalou hypotenzí (systolický krevní tlak ≤ 90 mm Hg) přes adekvátní nálož tekutin (> 30 ml/kg) [15]. SIRS byla definována podle publikovaných kritérií [16]. Sepsí indukované selhání jakéhokoliv orgánu nesmělo při vstupu do studie trvat déle než 24 hodin.
Kardiogenní šok byl definován jako setrvalá hypotenze trvající minimálně 30 min se systolickým tlakem ≤ 90 mm Hg přes adekvátní plnění levé komory (tlak v zaklínění v plícnici – PCWP nebo enddiastolický tlak levé komory – LVEDP musel být > 15 mm Hg) nebo pacient se srdečním selháním vyžadoval podání vazopresorů (dopamin ≥ 7 µg/kg/min nebo noradrenalin ≥ 0,15 µg/kg/min) po dobu minimálně 30 min k udržení systolického krevního tlaku > 90 mm Hg a zabránění orgánové hypoperfuzi (oligurii < 20 ml/hod, encefalopatii) a periferní hypoperfuzi (studené končetiny, periferní cyanóza a mramorovaná kůže, laktátová acidóza) [17].
Diagnóza STEMI byla založena na symptomech odpovídajících myokardiální ischemii s odpovídajícími EKG známkami akutní ischemie (elevace úseku ST nebo nový blok levého Tawarova raménka) a elevací markerů myokardiální nekrózy (troponin T) [18].
Vylučovacími kritérii byl nesouhlas s účastí ve studii, hematologická či jiná malignita, známé systémové autoimunitní onemocnění, trauma nebo popáleniny vedoucí k rozvoji septického šoku, a těhotenství.
Odběr krevních vzorků
Krevní vzorky byly odebrány ihned při zařazení pacientů do studie (vzorek č. 1), po 12 hodinách (vzorek č. 2), po 24 hodinách (vzorek č. 3) a dále v následujících dnech vždy v 6 hodin ráno: 3. den (přibližně 36–48 hodin od přijetí – vzorek č. 4), 4. den (vzorek č. 5), 5. den (vzorek č. 6), 7. den nebo při propuštění (vzorek č. 7) a po 3 měsících (vzorek č. 8). Vzorky byly ihned centrifugovány v chlazené centrifuze a vzorky séra a plazmy byly uchovávány až do zpracování při -80 °C. Centrifuga i hlubokomrazící boxy byly umístěny přímo na koronární jednotce, kde probíhalo zpracování vzorků. Rutinní biochemické a hematologické vyšetření bylo prováděno při přijetí. Hodnota hs-troponinu T byla u pacientů s akutním infarktem myokardu stanovena vždy 24 hodin od vzniku symptomů. U všech pacientů v septickém šoku bylo při přijetí stanoveno APACHE II skóre (Acute Physiology and Chronic Health Evaluation) [19]. Tříměsíční sledování bylo prováděno v rámci ambulantní kontroly.
Laboratorní metody
Ve vzorcích plazmy získaných zpracováním periferní krve pacientů byly měřeny hladiny IL6 pomocí kitu Th1/Th2 11-plex (Bender Medsystems GmbH, Vídeň, Rakousko) metodikou založenou na detekci analytu pomocí kuliček potažených monoklonální protilátkou. Vzorky byly ředěny 10krát pufrem a analyzovány podle pokynů výrobce na 96jamkové destičce včetně 2 stripů pro 8 hodnot standardní křivky a blanku. Koncentrace analytů přímo úměrná intenzitě fluorescence byla měřena pomocí průtokové cytometrie na systému FACSArray (BD Biosciences, San Jose, CA, USA) a byla vyjádřena v pg/ml. Data získaná z BD FACSArray software verze 1.0.4 (BD Biosciences, San Jose, CA, USA) byla analyzována pomocí softwaru FlowCytomix™ Pro 2.4 (BD Biosciences, San Jose, CA, USA).
Troponin T byl stanoven pomocí elektrochemiluminiscence na analyzátoru Cobas® 8000 (Roche Diagnostics), rozsah měření 0,005–10 pg/ml, detekční limit 0,005 pg/ml. C-reaktivní protein (CRP) byl stanoven imunoturbidimetricky na analyzátoru Cobas® 8000 (Roche Diagnostics), rozsah měření 1,0–350 mg/l, detekční limit 0,3 mg/l.
Statistická analýza
Koncentrace markerů byly popsány mediánem a 5.–95. percentilovým rozsahem. Analýza rozptylu byla využita pro srovnání hodnot markerů mezi skupinami pacientů; analýza byla z důvodu porušení předpokladu normality dat provedena na logaritmicky transformovaných hodnotách. ROC (receiver operating characteristic) analýza byla využita pro definici cut-off markerů odlišující pacienty se septickým a kardiogenním šokem a cut-off pro mortalitu pacientů; definované cut-off byly popsány pomocí senzitivity a specificity.
Výsledky
Charakteristika populace
Do analýzy bylo zařazeno celkem 30 pacientů v kardiogenním šoku, 21 pacientů v septickém šoku a 20 pacientů s nekomplikovaným průběhem STEMI. Základní charakteristika pacientů je uvedena v tab. 1. Všechny 3 skupiny pacientů byly srovnatelné v základních demografických parametrech (věk, BMI a pohlaví). Pacienti v septickém šoku měli vstupně nejvyšší tepovou frekvenci, intraaortální balónková kontrapulzace byla zavedena u 40 % pacientů v KŠ a kontinuální podporu funkce ledvin vyžadovalo 13 % pacientů v KŠ a 57 % pacientů v SŠ. Umělou plicní ventilaci vyžadovalo 93 % pacientů v KŠ, všichni pacienti v SŠ a přechodně 1 pacient v kontrolní skupině po resuscitaci pro fibrilaci komor v úvodu akutního STEMI. Medián maximální hodnoty C-reaktivního proteinu byl nejvyšší u pacientů v SŠ (310 mg/l), u pacientů v KŠ byl výrazně vyšší ve srovnání s kontrolní skupinou pacientů se STEMI (166 vs 23 mg/l).
Table 1. Základní charakteristika souboru pacientů v kardiogenním šoku, septickém šoku a kontrolní skupiny se STEMI 
Hodnoty kontinuálních proměnných jsou uvedeny jako medián (5.–95. percentil), p (Kruskal-Wallis test nebo ML χ2) TK – krevní tlak APACHE II – Acute Physiology and Chronic Health Evaluation II BMI – Body Mass Index CRRT – kontinuální podpora renálních funkcí IABP – intraaortální balónková kontrapulzace Dynamika hodnot interleukinu 6 ve sledovaných skupinách
Jak dokládají hodnoty plazmatických hladin IL6 (tab. 2 a graf 1), existuje především u pacientů v septickém šoku výrazný interindividuální rozptyl hodnot, hodnoty 5.-95. percentilu IL6 při přijetí se pohybují v rozmezí 386–189 316 pg/ml. Pacienti v septickém a kardiogenním šoku mají při přijetí v porovnání s kontrolní skupinou pacientů se STEMI statisticky významně vyšší hodnoty IL6. Hodnoty IL6 byly ve skupině pacientů v SŠ v průběhu prvních 4 dní významně vyšší v porovnání s pacienty v KŠ. Pacienti v SŠ měli nejvyšší hodnoty při přijetí s poklesem v prvních 24 hodinách a následným vzestupem 3. den (graf 1, s. 118). Pacienti v KŠ dosáhli maximálních hodnot za 12 hodin od přijetí (tedy asi 16 hodin od vzniku infarktu myokardu), a pak postupně docházelo k poklesu hodnot na úroveň srovnatelnou s hodnotami IL6 v kontrolní skupině pacientů se STEMI. U většiny pacientů v KŠ byl zaznamenám přechodný mírný vzestup hodnot IL6 (3.–5. den od přijetí), který však není v grafu 1 (s. 118) jednoznačně patrný vzhledem ke značnému rozptylu hodnot mezi jednotlivými pacienty. Toto přechodné zvýšení hodnot IL6 u pacientů v KŠ nelze vysvětlit jednoznačně přítomností klinických známek systémové zánětlivé reakce (SIRS), která byla diagnostikována u 66 % pacientů v KŠ (graf 2, s. 120), ani rozvojem infekce, která byla diagnostikována u 33 % pacientů v KŠ (většinou se jednalo o pneumonie u pacientů na ventilátorech a o infekce močových cest, graf 3, s. 121).
Table 2. Hodnoty plazmatických hladin IL6 během prvních 24 hodin od přijetí v jednotlivých sledovaných skupinách 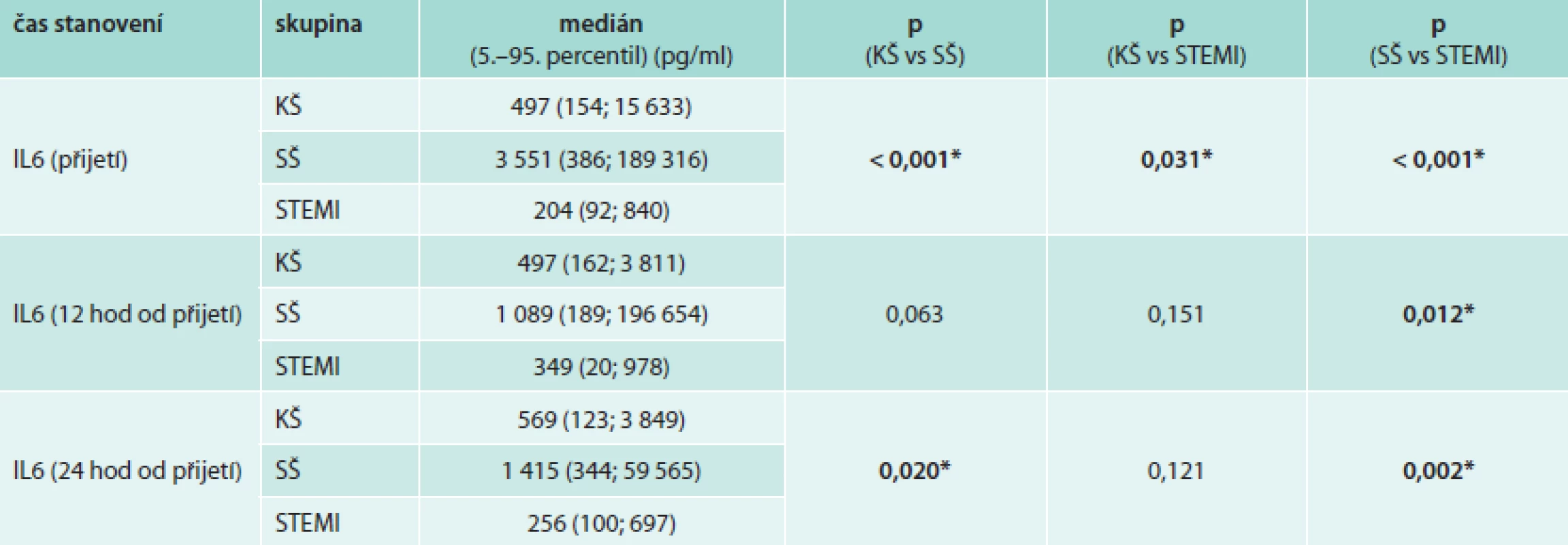
*signifikantní rozdíl, p (Kruskal-Wallis test) Graph 1. Srovnání hodnot interleukinu 6 v čase u pacientů v septickém šoku, kardiogenním šoku a u kontrolní skupiny pacientů se STEMI 
Pro srovnání hodnot IL6 mezi skupinami byla použita analýza rozptylu (ANOVA). Graph 2. Průběh IL6 u pacientů v kardiogenním šoku podle přítomnosti SIRS 
Graph 3. Průběh IL6 u pacientů v kardiogenním šoku podle diagnostikované infekce 
Rozdíly mezi hodnotami interleukinu 6 ve sledovaných skupinách
Byla provedena analýza ROC ke stanovení cut-off hodnot, které by dovolily rozlišení hodnot IL6 typických pro KŠ, SŠ a nekomplikovaný AIM. Hodnoty IL6 > 357 pg/ml při přijetí byly typické pro pacienty v kardiogenním šoku v porovnání s pacienty s nekomplikovaným STEMI (tab. 3a). Hodnoty IL6 > 1 237 pg/ml při přijetí, resp. hodnoty IL6 > 1 071 pg/ml po 24 hodinách byly charakteristické pro pacienty v SŠ v porovnání s pacienty v KŠ.
Tab. 3a. Analýza ROC pro stanovení cut-off hodnoty IL6 rozlišující pacienty v kardiogenním šoku a pacienty s nekomplikovaným STEMI 
*signifikantní AUC Tab. 3b. Analýza ROC pro stanovení cut-off hodnoty IL6 rozlišující pacienty v kardiogenním a septickém šoku 
*signifikantní AUC Interleukin 6 jako prediktor mortality
Mortalita byla během 3měsíčního sledování ve skupině pacientů v KŠ 42,8 %, ve skupině pacientů v SŠ 31,8 %. Přestože byl medián hodnot IL6 v prvních 24 hodinách ve skupině zemřelých pacientů v KŠ i SŠ vyšší v porovnání s pacienty přežívajícími (tab. 4), rozdíl nebyl statisticky významný a podle provedené analýzy ROC byl pouze u pacientů v KŠ po 12 hodinách při hodnotě IL6 > 1 854 pg/ml trend k predikci nepříznivé prognózy (při senzitivitě 0,5 a specificitě 1,0). Ve skupině pacientů v KŠ mělo vstupně 5 pacientů hodnoty IL6 nad 1 854 pg/ml (228 798 pg/ml, 15 633 pg/ml, 8 787 pg/ml, 4 047 pg/ml a 2 356 pg/ml) a všichni tito pacienti zemřeli do 48 hodin.
Table 3. Analýza ROC k predikci mortality pomocí IL6 u pacientů v septickém a kardiogenním šoku 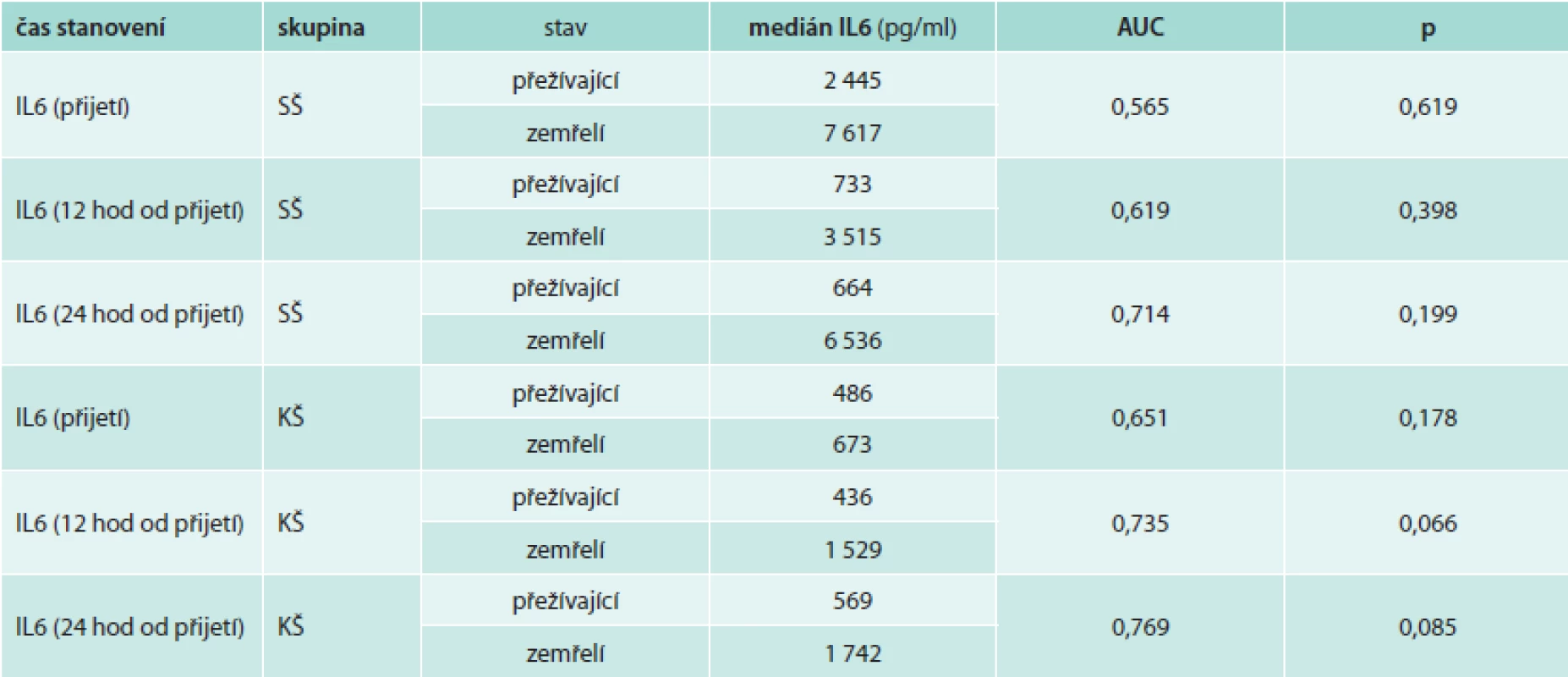
Diskuse
Hlavní výsledky naší práce lze shrnout do následujících bodů:
- při hodnocení hladin IL6 existuje výrazný interindividuální rozdíl mezi pacienty se stejnou základní diagnózou
- pacienti v septickém šoku mají v průběhu prvních 4 dní významně vyšší hodnoty IL6 ve srovnání s pacienty v KŠ a pacienty s nekomplikovaným STEMI; u pacientů v SŠ dosahují hodnoty IL6 maxima nejčastěji při přijetí, u pacientů v kardiogenním šoku hodnoty IL6 dosahují maxima za 12 hodin od přijetí; v obou skupinách dochází k dalšímu mírnému přechodnému vzestupu hodnoty IL6 mezi 3.–5. dnem od přijetí
- podle výsledků provedené analýzy ROC jsou hodnoty IL6 > 1 237 pg/ml při přijetí, resp. hodnoty IL6 > 1 071 pg/ml za 24 hodin od přijetí typické spíše pro pacienty v SŠ v porovnání s pacienty v KŠ
- vysoké hodnoty IL6 > 1 854 pg/ml u pacientů v KŠ jsou spojeny s nepříznivou prognózou, ale k časnému úmrtí došlo i u pacientů s hodnotami IL6 kolem 400 pg/ml
V současné době existuje pouze limitované množství literárních informací, které by srovnávaly pacienty v KŠ a SŠ. Geppert et al vyhodnotili hladiny IL6 u 51 pacientů v KŠ a 26 pacientů v SŠ, kontrolní skupinu tvořilo 11 pacientů hospitalizovaných na jednotce intenzivní péče, kteří nebyli v kritickém stavu [9]. Absolutní hodnoty IL6 této a naší práce nelze zcela porovnat, protože laboratorní metodika stanovení byla odlišná (Geppert et al použili metodu ELISA, R&D system, Wiesbaden, Německo), medián hodnot IL6 byl u pacientů v KŠ 112 pg/ml (95% CI 1–156), u pacientů v SŠ 250 pg/ml (95% CI 196–319). Nicméně byl prezentován obdobný trend jako v naší práci: pacienti v kardiogenním šoku měli významně vyšší hodnoty IL6 než kontrolní skupina pacientů v nekritickém stavu, ale nižší hodnoty IL6 než pacienti v SŠ. Výše hodnot IL6 u pacientů v KŠ korelovala s přítomností multiorgánového selhání a pacienti v KŠ s multiorgánovým selháním měli hodnoty IL6 srovnatelné s pacienty v SŠ.
Brunkhorst et al sledovali rozvoj zánětlivé reakce u 29 pacientů v KŠ, u kterých nebyla zjištěna žádná infekce a srovnávali ji se zánětlivou reakcí u 26 pacientů v septickém šoku [20]. IL6 byl stanoven opět jinou metodikou (EASIA – enzyme amplified sensitivity immunoassay, Medgenix Diagnostics, Fleurus, Belgie). Pacienti v SŠ měli rovněž v porovnání s pacienty v KŠ vyšší vstupní (1 640 vs 500 pg/ml) a maximální hodnoty IL6 (1 616 vs 629 pg/ml). Podobně jako v naší práci měli pacienti v SŠ maximální hodnoty IL6 při přijetí a poté došlo k jejich poklesu, pacienti v KŠ dosáhli maximálních hodnot IL6 za 24 hodin.
V práci Pudila et al byla demonstrována kinetika IL6 u pacienta se STEMI komplikovaným kardiogenním šokem. Byla pozorována 2 signifikantní maxima, první peak po 9 hodinách (362 pg/ml), poté došlo k poklesu a následnému vzestupu IL6 až na hodnotu 859 pg/ml [21]. Podobný průběh byl zaznamenán i u větší části pacientů v KŠ v naší práci. Vzhledem k velké interindividuální variabilitě hodnot IL6 a skutečnosti, že doba 2. maxima IL6 byla v závislosti na jednotlivých pacientech 3.–5. den, a vyhodnoceni byli i pacienti zemřelí před rozvojem 2. maxima, není druhý peak z grafu 1 (s. 118) zřetelně patrný. Zvažovali jsme, zda 2. maximum nesouvisí s rozvojem zánětlivé reakce nebo rozvojem infekce, ale podobný průběh hodnot IL6 s dvěma maximy měli i pacienti bez prokázané infekce nebo bez klinických projevů SIRS (graf 2 a graf 3).
V klinické praxi se setkáváme s pacienty v kardiogenním šoku, u kterých se časně do 24–48 hodin rozvinou známky zánětlivé reakce s febriliemi a vysokými hodnotami C-reaktivního proteinu, aniž by byly přítomny zjevné známky infektu (např. dýchacích cest provázené odsáváním hnisavého sputa, močová infekce a jiné) a výsledky kultivace hemokultur k vyloučení sepse nejsou ihned k dispozici. Naše výsledky srovnání pacientů v kardiogenním a septickém šoku naznačují, že hodnoty IL6 > 1 237 pg/ml při přijetí, resp. hodnoty IL6 > 1 071 pg/ml za 24 hodin jsou spíše typické pro septický šok a mohly by napomoci časně identifikovat sepsi u pacientů v KŠ, nicméně srovnáme-li hodnoty IL6 u pacientů v KŠ s prokázanou infekcí a bez infekce (graf 3), nezdá se IL6 dostatečně specifický k časné diagnostice infekce u pacientů v KŠ.
V rozsáhlé studii COMMA u pacientů se STEMI léčených primární PCI (percutaneous coronary intervention), která sledovala vliv podání monoklonální protilátky proti C5 složce komplementu na mortalitu a rozvoj kardiogenního šoku, byly vysoké hodnoty IL6, C-reaktivního proteinu a TNFα stanovené při přijetí, za 24 a 72 hodin prediktorem zvýšené mortality a rozvoje kardiogenního šoku. Tato práce jednoznačně potvrdila, že v patofyziologii akutního infarktu myokardu hraje rozvoj zánětlivé reakce důležitou roli [7]. Přestože byly vysoké hodnoty IL6 > 1 854 pg/ml i v naší práci spojeny se zvýšenou mortalitou, vzhledem k menšímu počtu pacientů a vysokému rozptylu hodnot nebyl výsledek analýzy ROC statisticky významný.
Důležitou otázkou v hodnocení hodnot IL6 jsou absolutní hodnoty IL6 u zdravých osob (kontrolní skupina). V rámci naší práce jsme stanovili hodnoty IL6 ve skupině 11 zdravých osob, hodnota mediánu IL6 byla 149 pg/ml (78–244 pg/ml, 5.–95. percentil). Vzhledem k tomu, že hodnoty IL6 významně závisí na metodice stanovení, je problematické srovnání s jinými pracemi, které stanovily IL6 u zdravých osob [22]. Naše výsledky dokumentují výraznou variabilitu hodnot IL6 i u zdravých osob.
Výsledky této práce dokládají velmi časnou produkci IL6: hodnota IL6 je zvýšená u pacientů s AIM již při přijetí ve srovnání se zdravými kontrolami a maxima dosahuje asi po 16 hodinách od vzniku infarktu myokardu. Hodnota IL6 souvisela s tíží stavu; pacienti v kardiogenním šoku měli významně vyšší hodnoty v porovnání s pacienty se STEMI a hodnoty IL6 > 1 854 pg/ml byly spojeny se zvýšenou mortalitou. Na druhé straně řada pacientů v KŠ zemřela navzdory relativně nízké hladině IL6, a proto se nám stanovení IL6 nejeví jako ideální biomarker k predikci mortality u pacientů v KŠ. U pacientů v septickém šoku je situace ještě komplikovanější z důvodu různých etiologických patogenů, původu infekce a tíže onemocnění. Přestože je dnes význam stanovení hladin cytokinů u pacientů v sepsi ve srovnání s minulostí hodnocen střízlivěji, některá pracoviště mají velmi dobré zkušenosti s využitím IL6 v klinické praxi [23] a jeho dynamika může jako relativně nespecifický zánětlivý marker odrážet aktuální stav pacienta.
Limitace
Naše práce má řadu limitací. Nejzávažnější limitací je relativně nízký počet vyhodnocených pacientů, přestože ve srovnání s obdobnými publikovanými pracemi je počet sledovaných pacientů srovnatelný [9,20].
Přestože byly základní demografické charakteristiky jednotlivých skupin srovnatelné, hladiny IL6 mohly být ovlivněny dalšími komorbiditami a rovněž průběh onemocnění mohl být u jednotlivých pacientů rozdílný.
Navzdory maximálnímu úsilí o standardizované provádění odběrů a jejich okamžité zpracování a zamrazení, by mohly preanalytické chyby ovlivnit výsledky naší práce. Tento aspekt by měl být zvažován zejména u markerů s krátkým poločasem a nízkou stabilitou [24].
Závěr
Zánětlivá reakce není typickým rysem pouze pacientů v septickém šoku, ale hraje významnou roli i v průběhu akutního infarktu myokardu komplikovaného kardiogenním šokem. Rozvoj zánětlivé reakce je heterogenní jak mezi sledovanými skupinami, tak mezi jednotlivými pacienty v kardiogenním a septickém šoku. Pacienti v SŠ mají v porovnání s pacienty v KŠ v průběhu 1. týdne významně vyšší hodnoty IL6. Pacienti v KŠ dosahují maximální hodnoty IL6 asi za 16 hodin od vzniku infarktu. Stanovení IL6 má malý prognostický význam u pacientů v kardiogenním šoku a nezjistili jsme ani žádný vztah k prognóze pacientů v septickém šoku.
Podpořeno grantem Masarykovy univerzity MUNI/A/0914/2012, projektem MZ ČR pro koncepční rozvoj výzkumné organizace 65269705 (FN Brno) a projektem European Regional Development Fund – projekt FN u sv. Anny v Brně a ICRC (No. CZ.1.05/1.1.00/02.0123).
MUDr. Jan Maláska, Ph.D.
jmalaska@fnbrno.cz
Klinika anesteziologie, resuscitace a intenzivní medicíny LF MU a FN Brno, pracoviště Bohunice, Brno
www.fnbrno.cz
Doručeno do redakce: 24. 5. 2012
Přijato po recenzi: 17. 10. 2013
Sources
1. Hochman JS, Buller CE, Sleeper LA et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. J Am Coll Cardiol 2000; 36: (3 Suppl A): 1063–1070.
2. Spinar J, Parenica J, Vitovec J et al. Baseline characteristics and hospital mortality in the Acute Heart Failure Database (AHEAD) Main registry. Critical Care 2011; 15(6): R291.
3. Kala P, Miklik R. Pharmaco-mechanic Antithrombotic Strategies to Reperfusion of the Infarct-Related Artery in Patients with ST-Elevation Acute Myocardial Infarctions. J Cardiovasc Transl Res 2013; 6(3): 378–387.
4. Kohsaka S, Menon V, Lowe AM et al. Systemic Inflammatory Response Syndrome After Acute Myocardial Infarction Complicated by Cardiogenic Shock. Arch Intern Med 2005; 165(4): 1643–1650.
5. Griselli M, Herbert J, Hutchinson WL et al. C-Reactive Protein and Complement Are Important Mediators of Tissue Damage in Acute Myocardial Infarction. J Exp Med 1999; 190(12): 1733–1740.
6. Pietllä KO, Harmoinen AP, Jokiniitty J et al. Serum C-reactive protein concentration in acute myocardial infarction and its relationship to mortality during 24 months of follow-up in patients under thrombolytic treatment. Eur Heart J 1996; 17(9): 1345–1349.
7. Theroux P, Armstrong PW, Mahaffey KW et al. Prognostic significance of blood markers of inflammation in patients with ST-segment elevation myocardial infarction undergoing primary angioplasty and effects of pexelizumab, a C5 inhibitor: a substudy of the COMMA trial. Eur Heart J 2005; 26(19): 1964–1970.
8. Geppert A, Dorninger A, Delle-Karth G et al. Plasma concentrations of interleukin-6, organ failure, vasopressor support, and successful coronary revascularization in predicting 30-day mortality of patients with cardiogenic shock complicating acute myocardial infarction. Crit Care Med 2006; 34(8): 2035–2042.
9. Geppert A, Steiner A, Zorn G et al. Multiple organ failure in patients with cardiogenic shock is associated with high plasma levels of interleukin-6. Crit Care Med 2002; 30(9): 1987–1994.
10. Pinsky MR, Vincent JL, Deviere J et al. Serum cytokine levels in human septic shock. Relation to multiple-system organ failure and mortality. Chest 1993; 103(2): 565–575.
11. Wu HP, Chen CK, Chung K et al. Serial cytokine levels in patients with severe sepsis. Inflamm Res 2009; 58(7): 385–393.
12. Mera S, Tatulescu D, Cismaru C et al. Multiplex cytokine profiling in patients with sepsis. APMIS 2011; 119(2): 155–163.
13. Bozza F, Salluh J, Japiassu A et al. Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis. Crit Care 2007; 11(2): R49.
14. Kellum JA, Kong L, Fink MP et al. Understanding the inflammatory cytokine response in pneumonia and sepsis: results of the Genetic and Inflammatory Markers of Sepsis (GenIMS) Study. Arch Intern Med 2007; 167(15): 1655–1663.
15. Levy MM, Fink MP, Marshall JC et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Intensive Care Med 2003; 29(4): 530–538.
16. Bone RC, Sibbald WJ, Sprung CL. The ACCP-SCCM consensus conference on sepsis and organ failure. Chest 1992; 101(6): 1481–1483.
17. Alexander JH, Reynolds HR, Stebbins AL et al. Effect of tilarginine acetate in patients with acute myocardial infarction and cardiogenic shock: the TRIUMPH randomized controlled trial. JAMA 2007; 297(15): 1657–1666.
18. Steg P, James SK, Atar D et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33(20): 2569–2619.
19. Knaus WA, Draper EA, Wagner DP et al. APACHE II: a severity of disease classification system. Crit Care Med 1985; 13(10): 818–829.
20. Brunkhorst F, Clark A, Forycki Z et al. Pyrexia, procalcitonin, immune activation and survival in cardiogenic shock: the potential importance of bacterial translocation. Int J Cardiol 1999; 72(1): 3–10.
21. Pudil R, Krejsek J, Pidrman V et al. Inflammatory response to acute myocardial infarction complicated by cardiogenic shock. Acta Medica (Hradec Kralove) 2001; 44(4): 149–151.
22. Matejovic M, Chvojka J, Sykora R et al. A 24-h work shift in intensive care personnel: biological pathways between work stress and ill health. J Int Med Res 2011; 39(2): 629–636.
23. Kula R, Chýlek V, Sklienka P et al. Balíčky péče pro těžkou sepsi. Postgraduální medicína 2001; 12 : 1048–1051.
24. Hosnijeh FS, Krop EJ, Portengen L et al. Stability and reproducibility of simultaneously detected plasma and serum cytokine levels in asymptomatic subjects. Biomarkers 2010; 15(2): 140–148.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 2-
All articles in this issue
- MR kompatibilní kardiostimulátory a implantabilní kardiovertery-defibrilátory
- Orální infekce a revmatická onemocnění
- Renální denervace pro léčbu arteriální hypertenze – nezodpovězené otázky
- Léčba Waldenströmovy makroglobulinemie v roce 2013
- JAK2 inhibitory v léčbě primární myelofibrózy. Dodatek k doporučením pro diagnostiku a léčbu Ph negativních myeloproliferativních onemocnění České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění České hematologické společnosti ČLS JEP (CZEMP)
- Izolovaná nonkompaktní kardiomyopatie: souhrnný článek s kazuistickým příkladem
- Septická trombóza horní duté žíly a pravé síně v souvislosti se zavedeným centrálním žilním katétrem
- Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
- Hodnocení diastolické funkce levé komory pomocí radionuklidové ventrikulografie u pacientů s chronickým srdečním selháním a sníženou ejekční frakcí
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- MR kompatibilní kardiostimulátory a implantabilní kardiovertery-defibrilátory
- Dynamika hladiny interleukinu 6 u pacientů v septickém a kardiogenním šoku a u pacientů s akutním infarktem myokardu s elevacemi ST
- Septická trombóza horní duté žíly a pravé síně v souvislosti se zavedeným centrálním žilním katétrem
- JAK2 inhibitory v léčbě primární myelofibrózy. Dodatek k doporučením pro diagnostiku a léčbu Ph negativních myeloproliferativních onemocnění České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění České hematologické společnosti ČLS JEP (CZEMP)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

