-
Medical journals
- Career
Současné postavení intravaskulární ultrasonografie v intervenční kardiologii
Authors: Tomáš Kovárník
Authors‘ workplace: II. interní klinika kardiologie a angiologie 1. LF UK a VFN Praha, přednosta prof. MUDr. Aleš Linhart, DrSc., FESC, FCMA
Published in: Vnitř Lék 2014; 60(12): 1062-1067
Category: 70. birthday prof. MUDr. Michael Aschermann, DrSc., FESC, FACC
Overview
Přestože se intravaskulární ultrasonografie používá již několik desetiletí, je v běžném provozu katetrizačních laboratoří používán při koronárních intervencích jen v jednotkách procent. Důvodem je nedostatek randomizovaných studií s jeho používáním a často i menší zkušenosti s hodnocením ultrasonografických nálezů. Data vycházející z metaanalýz observačních studií jednoznačně prokázala pozitivní ovlivnění nejdůležitějších parametrů při léčbě nemocných s ischemickou chorobu srdeční, jakými jsou mortalita a výskyt infarktu myokardu po koronárních intervencích. Proto je podle posledních guidelines pro revaskularizaci myokardu Evropské kardiologické společnosti úroveň doporučení pro používání intravaskulární ultrasonografie v kategorii IIa. Intravaskulární ultrasonografie (IVUS) nepřestává být důležitou součástí ani nových vyšetřovacích metod, která se snaží lépe popsat koronární aterosklerózu. Jde zejména o metodu NIRS (near-infrared spectroscopy) a další nové metody hodnotící složení a mechanické vlastnosti plátu. Tyto skutečnosti naznačují, že si IVUS zachová svůj přínos i v době optické koherentní tomografie a důrazu kladeném na funkční hodnocení koronárních stenóz.
Klíčová slova:
intravaskulární ultrasonografie – koronární ateroskleróza – perkutánní koronární intervenceÚvod
Intravaskulární ultrasonografie (intravascular ultrasonography – IVUS) patří již řadu let mezi běžné vyšetřovací metody v intervenční kardiologii. Jedná se o vyšetření, které přináší angiograficky nezjistitelné informace o koronárních tepnách a jejich (nejen) aterosklerotickém postižení. Rovněž umožňuje získat řadu cenných informací pro vedení koronárních intervencí. Studie s intravaskulární ultrasonografií změnily rutinní postup zejména při implantacích koronárních stentů a pomohly objasnit mnohé mechanizmy rozvoje koronárního postižení aterosklerózou i při jiných patologických stavech. IVUS umožňuje zvýšit přesnost při hodnocení angiograficky nejasných nálezů. Dále může přinést cenné údaje při vedení koronárních intervencí, a to ve smyslu určení nejvhodnější strategie, určení správné velikosti instrumentária, kontroly výsledku a diagnostiky případných komplikací. Správné zhodnocení intravaskulární ultrasonografie však vyžaduje zkušenosti získané při častém používání této diagnostické techniky, neboť pouze tak může operatér využít všech možností, které tato metoda nabízí. Při jeho správném používání však IVUS přináší mnoho jinak nezjistitelných informací, které mohou zlepšit výsledky koronárních intervencí. Role intravaskulární ultrasonografie musí být dnes nově definována v přítomnosti další morfologické metody, jakou je optická koherentní tomografie (OCT), a ve vztahu k funkčnímu vyšetřování koronárních tepen frakční průtokovou rezervou (FFR).
Popis vyšetření
Intravaskulární ultrasonografie byl poprvé použit Bomem v roce 1971 a byl zamýšlen jako metoda, která zlepší vizualizaci srdečních komor a chlopní. První ultrasonografický obraz koronárních arterií získal Yock v roce 1988. V českém písemnictví se intravaskulární ultrasonografie poprvé objevuje díky prof. Aschermannovi v roce 1992 [1].
Dnes jsou při vyšetření intravaskulární ultrasonografií používány miniaturizované sondy o velikosti 2,6–3,5 F (0,87–1,17 mm) s frekvencí 10–45 MHz (v Evropě nejčastěji 20 MHz), které jsou zaváděny po standardním intrakoronárním vodiči 0,014´´ (0,035 mm) do periferie tepny. V zásadě existují 2 typy ultrasonografických sond: mechanická a elektronická. Mechanická sonda (nejčastěji 40–45 MHz) obsahuje jeden piezoelektrický krystal generující ultrazvuk. Katétr v tepně rotuje rychlostí 1 800 otáček za min, čímž je získáván tomografický obraz tepny. V odstupu asi jednoho stupně krystal vysílá a přijímá ultrazvukový signál a výsledný obraz je tvořen z 256 radiálních scanů. Elektronické sondy (nejčastěji s frekvencí 20 MHz) mají na svém distálním konci řadu piezoelektrických krystalů, které jsou sekvenčně aktivovány [2].
Výsledný IVUS obraz je dán analýzou amplitudy odraženého signálu. Maximální amplitudě je přiřazena bílá barva a minimální černá barva, ostatním amplitudám jsou pak přiřazovány různé stupně šedé barvy. Vzniká tak známý ultrasonografický obraz (obr. 1).
Image 1. Koncentrický fibrolipidový plát 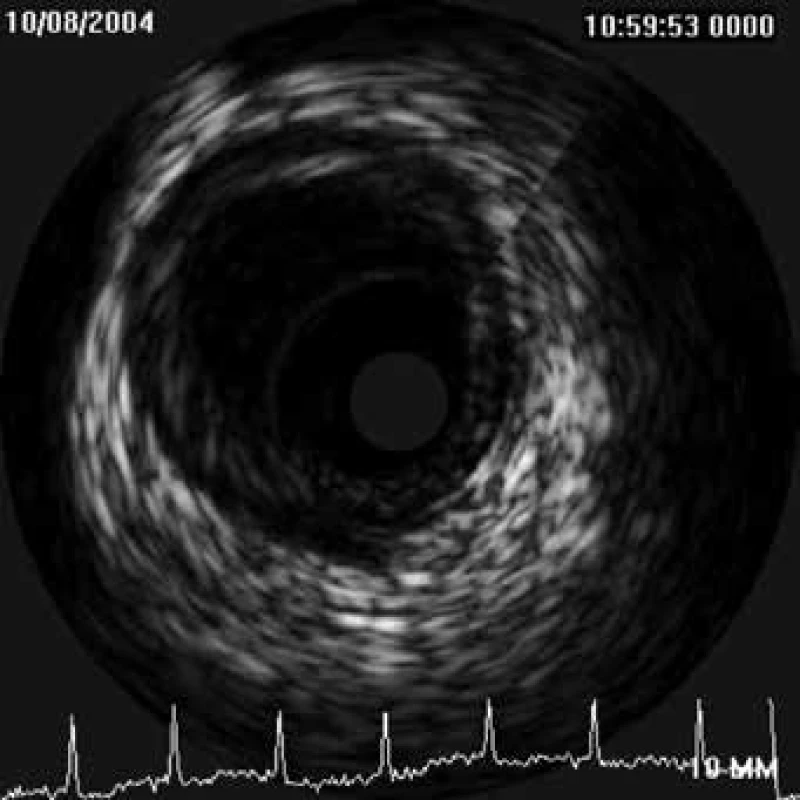
Systém dokáže rozlišit 256 různých stupňů šedi, lidské oko však dokáže z těchto odstínů rozeznat jen 8–12. Z tohoto důvodu zůstává většina zobrazovaných informací o složení plátu nevyužita. Tento nedostatek lze řešit použitím automatického hodnocení echogenity plátů generujícím numericky výstup, který pak již lze dobře použít pro různá srovnání. Další možností jak přesněji hodnotit složení plátu je tzv. radiofrekvenční analýza neupraveného (raw) signálu, tzv. RF analýza [3].
RF analýza může používat autoregresivní model, který rozděluje analyzované signály podle již existujícího klasifikačního algoritmu vyvinutého na základě korelace reálné histologie a RF analýzy in vitro prováděných IVUS vyšetření. Výsledkem je poté virtuální histologie (IVUS-VH, Volcano Therapeutics), která rozděluje tkáně plátu do čtyř kategorií: fibrózní, fibrolipidová, nekrotická a kalcifikovaná (obr. 2) [4].
Image 2. Virtuální histologie excentrického plátu s rupturou 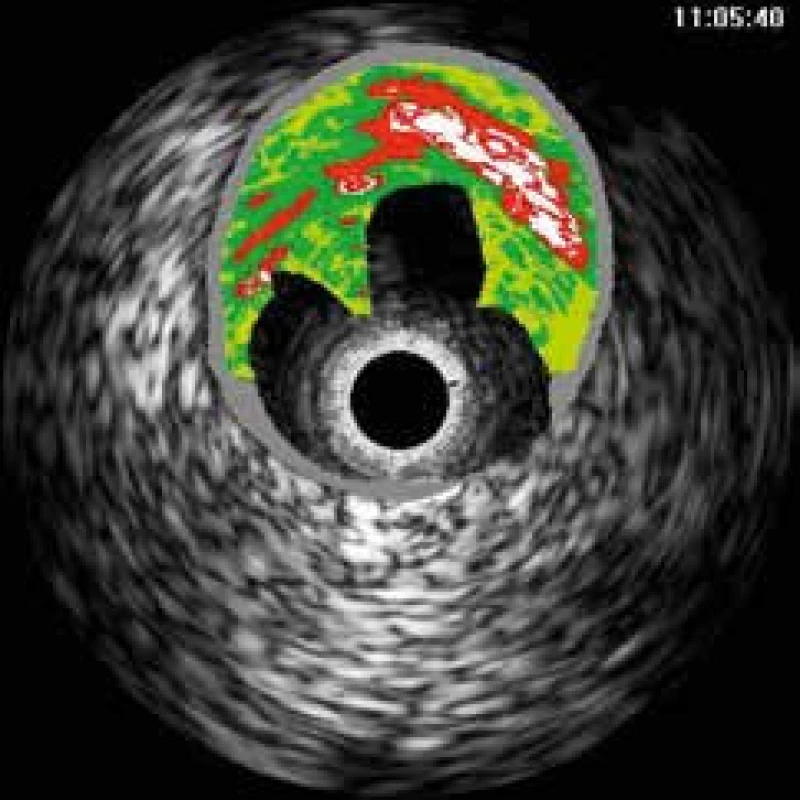
VH-IVUS využívá 20 MHz elektronickou sondu Eagle Eye nebo mechanickou 40 MHz sondu Revolution (obě od firmy Volcano Therapeutics). Další možností jak zpracovat RF signál je rychlá fourierovská transformace. Tuto metodu využívají 2 další typy virtuální histologie, a to i-MAP-IVUS (Boston Scientific), který pracuje s mechanickou rotující sondou s frekvencí 40 MHz, a tzv. integrated backscatter IVUS (IB-IVUS), který používá rovněž mechanickou rotující sondu s frekvencí 40 MHz. Všechny systémy detekují stejné 4 typy plátů, ale kódují je do různých barev. Větším problémem ovšem je, že všechny 3 systémy vznikaly jinou cestou a je stále nejasné, nakolik jsou jejich výsledky navzájem porovnatelné.
Při hodnocení zobrazovacích schopností intravaskulární ultrasonografie hovoříme o rozlišovací schopnosti. Jedná se o minimální vzdálenost 2 bodů, od které je systém schopen tyto body odlišit. Podle prostorové orientace dvou bodů existují různé druhy rozlišení:
- axiální (vzdálenost 2 bodů v ose ultrazvukového signálu) 80–120 µm
- laterální (vzdálenost 2 bodů v ose pohybu sondy, tj. v proximálně distálním směru) 200–250 µm
- cirkumferenciální (vzdálenost 2 bodů po obvodu příčného řezu, tj. jako na ciferníku hodinek), která je závislá na typu katétru a běžně se neudává
Dalším faktorem ovlivňujícím IVUS zobrazení je penetrace ultrazvukového signálu do tkáně. Penetrace je na straně zdroje ultrazvuku ovlivněna inverzně vlnovou délkou, čím větší je vlnová délka, tím menší je penetrace signálu. Na straně zobrazované tkáně je penetrace signálu ovlivněna složením plátu: kalcifikovaná tkáň představuje překážku šíření ultrazvuku. Obecně se udává nelimitovaná penetrace kolem 10 mm.
Indikace intravaskulární ultrasonografie
Využití intravaskulární ultrasonografie k intervenční kardiologii je široké a můžeme jej rozdělit následovně:
- hodnocení (nejen) aterosklerotického koronárního postižení (velikost plátů a jejich složení, riziková stratifikace koronárních plátů, nejasné angiografické nálezy, hodnocení lézí v oblasti kmene levé věnčité tepny a bifurkací).
- vedení koronárních intervencí (určení strategie výkonu, volba typu a velikosti instrumentária, diagnostika komplikací).
- využití intravaskulární ultrasonografie pro výzkumné účely (hodnocení vývoje aterosklerózy a různých postupů jejího ovlivnění, hodnocení efektu koronárních intervencí)
Hlavním argumentem proti používání intravaskulární ultrasonografie byl vždy nedostatek studií prokazujících jeho klinický benefit. Je s podivem, že se nikdy nepodařilo zorganizovat skutečně velkou prospektivní randomizovanou studii srovnávající IVUS s angiograficky vedenou implantaci stentů. V případě metalických stentů mají randomizované studie malý počet pacientů, a navíc i rozdílná kritéria pro optimální výsledek po implantaci stentů [5–8]. V posledních letech však bylo publikováno několik metaanalýz, které se snaží sumarizovat výsledky z těchto studií. Autoři jako Casella et al [9] a Parise et al [10] prokázali, že při metaanalýzách zahrnujících 2 972, resp. 2 193 pacientů je IVUS vedení implantací BMS spojeno s nižším výskytem in-stent restenózy, menší nutností opakovaných intervencí a menším výskytem kardiálních příhod. Použití intravaskulární ultrasonografie nemělo vliv na následný výskyt infarkt myokardů či na mortalitu pacientů.
V oblasti lékových stentů je počet publikovaných randomizovaných studií výrazně nižší. Jednou z nich je česká studie HOME DES IVUS [11], která randomizovala 210 pacientů. IVUS vedení implantace léky potahovaných stentů (drug eluting stents – DES) vedlo v této studii k častějšímu používání postdilatace, vyšším inflačním tlakům a používání větších balonů. Nicméně nebyl nalezen signifikantní rozdíl ve výskytu restenózy nebo klinických příhod. Dále byla publikována řada observačních studií srovnávajících implantaci lékových stentů při vedení intravaskulární ultrasonografií či pouze angiograficky. V těchto studiích je však použití intravaskulární ultrasonografie včetně kritérií úspěšné implantace ponecháno pouze na rozhodnutí operatéra. Proto byla opět publikována řada metaanalýz shrnujících tyto nálezy. Autoři Zhang et al [12], Jang et al [13] a Ahn [14] ve svých analýzách zahrnujících data od 19 619, 24 869 a 26 503 pacientů dokládají, že IVUS vedení implantace DES vede ke snížení mortality (OR 0,61–0,64), výskytu infarktu myokardu v oblasti intervenované tepny (OR 0,55–0,57), výskytu kardiálních příhod (0,68–0,79) a výskytu in-stent trombózy (0,59).
IVUS pod studie velkého projektu ADAPT-DES [15] (zkoumající vliv reziduální destičkového aktivity při duální antiagregační terapii na výskyt kardiálních příhod u nemocných s po implantaci lékového stentu) srovnávala výsledky IVUS vedení implantací DES u 3 349 pacientů a 5 234 pacientů s pouze angiograficky vedenou implantací. Nešlo opět o randomizovanou studii, výběr vedení intervence a rovněž tak i kritéria pro její úspěch byl ponechán čistě na operatérovi. Studie prokázala signifikantně nižší výskyt in-stent trombózy (0,55 % vs 1,16 % za 2 roky), infarktu myokardu, nutností revaskularizace u intervencí vedených intravaskulární ultrasonografie. Hazard ratio pro použití intravaskulární ultrasonografie ve vztahu k výskytu in-stent trombózy v průběhu 2 let bylo 0,46, pro výskyt infarktu myokardu 0,62 a pro výskyt kardiálních příhod 0,65.
Tyto výsledky již vedly k tomu, že byla změněna úroveň doporučení pro IVUS vedenou implantaci stentů do kategorie IIa, třída B v doporučeních Evropské kardiologické společnosti pro revaskularizaci myokardu z letošního roku.
Role intravaskulární ultrasonografie v době FFR, OCT a NIRS
V dnešní době je již všeobecně přijímaným názorem, že používání pouze angiografického hodnocení je nedostatečné pro zhodnocení koronárního postižení a vedení koronárních intervencí. Ve vyspělých zemích je dnes prakticky každé katetrizační pracoviště vybaveno jednou nebo několika dalšími diagnostickými metodami, které slouží jako doplněk angiografického vyšetření. Vedle intravaskulární ultrasonografie se používají ještě další morfologické metody, jako je zejména optická koherentní tomografie (OCT). Další morfologickou metodou, která se začíná v katlabech prosazovat, je spektroskopie využívající infračerveného světla (near-infra-red spectroscopy – NIRS).
OCT má ve srovnání s intravaskulární ultrasonografií vyšší rozlišovací schopnost, pro kterou je používána zejména k detailnímu hodnocení lézí (ruptury či fisury plátů, detekce TCFA), a pak zejména k hodnocení koronárních stentů (diagnostika malapozice, intrakoronární trombózy či fraktur stentu). Vzhledem ke krátkému času, který je zapotřebí pro OCT vyšetření, velmi dobrému automatickému hodnocení lumen v lézi a referenčních segmentech a snadnému měření vzdáleností je OCT velmi dobrým nástrojem pro vedení koronárních intervencí. Stejně jako po IVUS jsou i pro OCT vyvíjeny systémy pro koregistraci OCT a angiografických dat, které jsou velmi vítaným doplněním klasického angiografického vyšetření. OCT má na rozdíl od intravaskulární ultrasonografie malou penetraci do tkáně (1–1,5 mm), takže není možné hodnotit velikost plátů. Velikost tepny je však často měřitelná, neboť při převážně excentrickém charakteru koronárních lézí je alespoň část obvodu tepny zachována bez aterosklerotického postižení, a zde je poté možné i pomocí OCT měřit rozměr tepny. IVUS je ve srovnání s OCT superiorní, pokud jde o hodnocení velikosti plátů a jejich složení a hodnocení cévní remodelace, a jeho výhodou je, že není třeba během vyšetření zatěžovat pacienta kontrastní látkou. OCT naopak dominuje v možnostech detailního hodnocení a velmi dobrou automatickou analýzou.
Intravaskulární ultrasonografií je možno hodnotit složení plátů, a to buď na základě echogenity (referencí je echogenita fibrózní tkáně), nebo pomocí sofistikovanějších postupů, jakými je radiofrekvenční analýza signálu. Ta má však rovněž řadu omezení, a zřejmě není ideální metodou jak hodnotit složení plátů. Na její místo nastupují metody s lepšími fyzikálními principy hodnocení složení tkáně. Jedná se především o metody, které využívají spektroskopii. V klinickém používání je metoda zvaná NIRS, která kombinuje intravaskulární ultrasonografii s mechanickou rotační sondou o frekvenci 40 MHz se spektroskopií. Výsledkem je poté sumační obraz, který se skládá z intravaskulární ultrasonografie, do kterého je vložena informace a vyjádření pravděpodobnosti přítomnosti lipidové tkáně kódovaná do barvy. Ukázkou limitací IVUS-VH je práce Pu et al [16] srovnávající IVUS-VH a NIRS, u nichž je patrna korelace pouze u nekalcifikovaných plátů. V akustickém stínu za kalcifikací ultrasonografické hodnocení složení plátu selhává.
Další skupinou vyšetření, kterými dnes katetrizační laboratoře disponují, jsou metody hodnotící hemodynamickou významnost koronárních stenóz (zejména se jedná o měření tzv. frakční průtokové rezervy neboli FFR), tj. dopad dané léze na perfuzi v zásobované oblasti. Angiografické hodnocení hemodynamického dopadu stenóz u hraničních lézí (30–70% stenózy) nekoreluje s jejich funkčním hodnocením [17]. Během posledních 20 let byla publikována řada studií, která se snažila najít morfologický korelát k funkční významnosti koronárních stenóz. Ze studií srovnávajících IVUS s FFR [18] a IVUS se zátěžovou scintigrafií myokardu [19] se nejprve zdálo, že tímto magickým číslem by mohla být plocha lumen 4 mm2 v tepně o průměru 3 mm a více. Nicméně pozdější práce (především asijských autorů) přinesly úplně jiné hodnoty. Dnes se má za to, že v koronárních tepnách nelze detekovat hemodynamickou významnost na základě plochy lumen. Nicméně lze říci, že pokud má daná tepna lumen větší než 4 mm2, je s velkou pravděpodobností funkčně nevýznamná. Je třeba rovněž doplnit, že funkční významnost lézí je dána nejen tím, o kolik se zmenší plocha lumen, ale rovněž tím, jak velkou oblast myokardu daná tepna zásobuje. To je samozřejmě faktor, který nemůže být pomocí IVUS hodnocen.
Oblastí, ve které zůstává IVUS vhodným nástrojem k měření hemodynamické významnosti, je kmen levé věnčité tepny. Existují studie, které prokazují korelaci mezi IVUS a FFR [20], podle nichž hranicí pro funkční významnost je plocha lumen < 6 mm2. Ta byla následně verifikována multicentrickou prospektivní studií LITRO [21], ve které bylo prokázáno, že tato hodnota může být bezpečně použita k indikce koronární revaskularizace. IVUS je následně velmi dobrým nástrojem pro vedení perkutánních intervencí v této oblasti, a to zejména v případě distální části kmene levé věnčité tepny. Vzhledem k závažnému prognostickému dopadu kmene levé věnčité tepny by se dnes nemělo stávat, aby pacient odcházel z katetrizační laboratoře s diagnózou „hraniční stenóza kmene“, a rovněž tak, aby při prokázaném benefitu intravaskulární ultrasonografie [22] nebyla případná perkutánní koronární intervence prováděna za kontroly IVUS.
Další vývoj intravaskulární ultrasonografie
Intravaskulární ultrasonografie může být kombinován s jinými typy vyšetření (nejčastěji s angiografií, ale může jít i o OCT) a tyto kombinace mohou být podkladem vytvoření 3D rekonstrukcí koronárních tepen. Tento typ zobrazení přináší komplexní informaci o koronárních tepnách (velikost lumen, velikost tepny, objem plátu, složení plátu, angulace tepny), ale vzhledem ještě k poměrné časové náročnosti je vhodný spíše pro vědecké využití (obr. 3).
Image 3. Příklad 3D rekonstrukce koronární tepny. V barevné škále je vyjádřeno relativní zastoupení nekrotické tkáně v plátu. 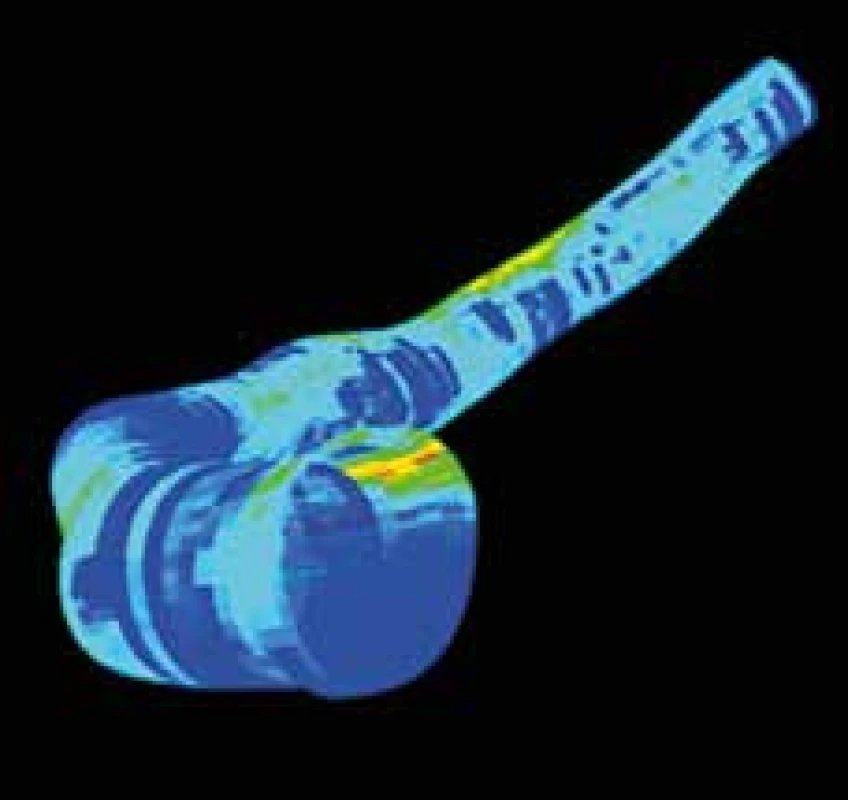
Další možností kombinace různých metod je koregistrace obou zobrazení v reálném čase, tak aby katetrizující měl lepší představu o koronární lézi v průběhu intervence a mohl lépe volit strategii intervence a umístění stentů, včetně kontroly finálního výsledku. Dalším stupněm bude kombinace tohoto systému a funkčního hodnocení významnosti stenóz, která umožní i predikci hemodynamického dopadu koronární intervence.
V současné době řada firem (ACIST, Boston Scientiphic, Volcano, Infra-redex) vyvíjí ultrasonografické sondy pro intrakoronarní ultrasonografii o vyšší frekvenci, než je dnes běžně používaná. Zřejmě nejdále ve vývoji je firma ACIST, která již prezentuje sondu s frekvencí 60 MHz, která má axiální rozlišovací schopnost 40 µm, laterální rozlišovací schopnost 90 µm při penetraci do tkáně > 2,5 mm (zřejmě až 5 mm). Tato rozlišovací schopnost se již výrazně blíží úrovni optické koherentní tomografie (optical coherence tomography – OCT) s axiální rozlišovací schopností 15 µm a laterální 40 µm. Firma rovněž připravuje významné urychlení vyšetření až na 10 mm/s s možností vyšetřit až 130 mm tepny. Tento typ katétru je schopen detekovat fibroaterom s tenkou fibrózní čepičkou (tzv. TCFA), přesněji hodnotit strukturu plátů či stentů i lepe diagnostikovat intraluminální tromby. Další inovací zřejmě bude katétr s „čelním zobrazováním“ (firma Volcano), který bude zobrazovat tepnu nikoliv kolem sebe, nýbrž před sebou. Hlavní indikací tohoto katétru bude navigace intrakoronárního vodiče při rekanalizaci chronických uzávěrů.
Intravaskulární ultrasonografie zůstává důležitou metodou pro hodnocení smykového tření v koronárních tepnách (tzv. wall shear stress), obr. 4.
Image 4. Hodnocení velikosti smykového tření 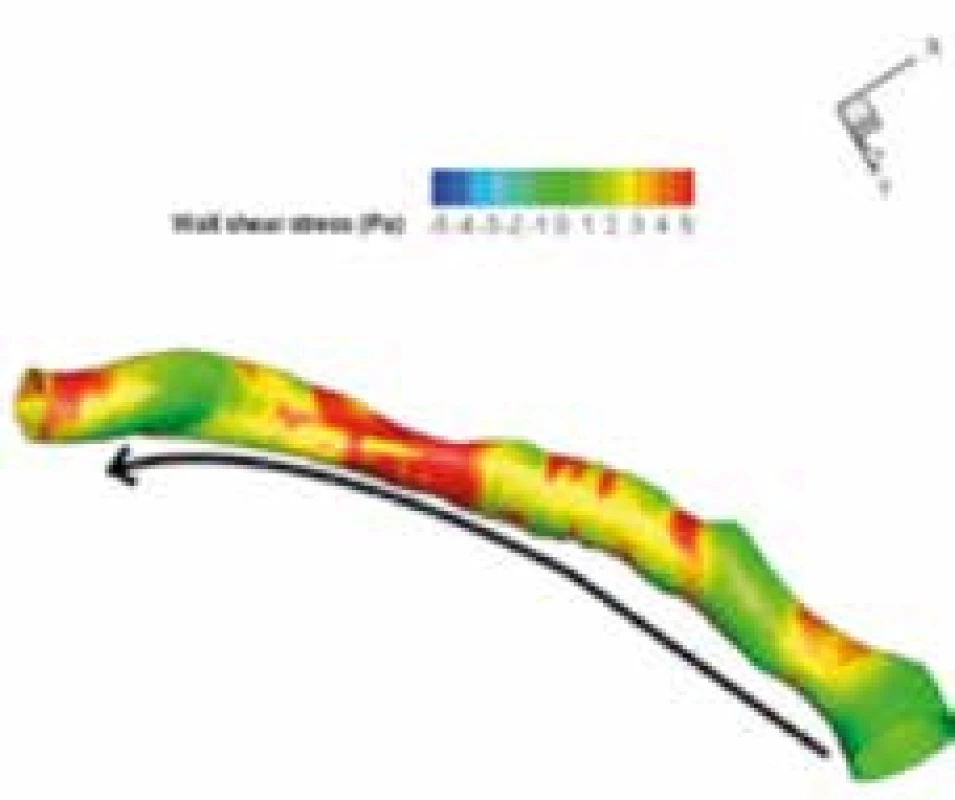
Z nových metod je intravaskulární ultrasonografie používán při hodnocení napětí v plátu (rizikový faktor pro rupturu plátu) [23] nebo při metodě zvané IVPA (intravascular ultrasound guided photoacustic imaging) [24] či případně její modifikaci sIVPA (spectroscopic intravascular photoacoustic imaging) [25], což jsou metody, které využívají fotoakustického fenoménu k detailnímu hodnocení složení plátů (zejména přítomnosti lipidů). Principem je ozáření plátu laserovým paprskem, které vede při absorpci světla ke vzniku akustického fenoménu zachytávanému ultrasonografickou sondou.
Závěr
Intravaskulární ultrasonografie patří jednoznačně do základního vybavení všech katetrizačních laboratoří, které provádějí koronární intervence. IVUS umožňuje zvýšit přesnost při hodnocení angiograficky nejasných nálezů. Dále může přinést cenné údaje při vedení koronárních intervencí, a to ve smyslu určení nejvhodnější strategie, určení správné velikosti instrumentária, kontroly výsledku a diagnostiky případných komplikací. V těchto indikacích se částečně překrývá s dalšími metodami, kterými jsou měření frakční průtokové rezervy a optické koherentní tomografie. FFR je jednoznačně přesnější než IVUS v hodnocení hemodynamické významnosti a OCT v detailním hodnocení povrchu plátů a hodnocení stentu. Nicméně IVUS poskytuje stále nejlepší možnosti při hodnocení velikost a složení plátu a dále při hodnocení velikosti tepny či cévní remodelace a nadále zůstává důležitou součástí nově vyvíjených metod, jakou je např. IPLA.
Správné zhodnocení intravaskulární ultrasonografie vyžaduje zkušenosti z častého používání této diagnostické techniky, neboť pouze tak může operatér využít všech možností, které tato stále aktuální metoda nabízí. Při jeho správném používání však IVUS přináší mnoho jinak nezjistitelných informací, které mohou zlepšit výsledky koronárních intervencí.
Tato práce byla podpořena grantem IGA 2012 NT/13224.
MUDr. Tomáš Kovárník, Ph.D.
Tomas.Kovarnik@vfn.cz
I. interní klinika kardiologie a angiologie 1. LF UK a FN, Praha
int2.lf1.cuni.cz
Doručeno do redakce 13 .10. 2014
Přijato po recenzi 21. 10. 2014
Sources
1. Aschermann A, Fergusson JJ. Současné možnosti využití intravaskulárního ultrazvukového vyšetření. Čas Lék Čes 1992; 131(17): 516–520.
2. Mintz GS. Intracoronary Ultrasound. Taylor &Francis: London 2005. ISBN 978–1841840475.
3. Garcia-Garcia H, Gogas BD, Serruys PW et al. IVUS-based imaging modalities for tissue characterization: similarities and differences. In J Cardiovasc Imaging 2011; 27(2): 215–224.
4. Nair A, Margolis P, Kuban B et al. Automated coronary plaque characterisation with intravascular ultrasound backscatter: ex vivo validation. EuroIntervention 2007; 3(1): 113–120.
5. de Jaegere P, Mudra H, Figulla H et al. Intravascular ultrasound-guided optimized stent deployment. Immediate and 6 months clinical and angiographic results from the Multicenter Ultrasound Stenting in Coronaries Study (MUSIC Study). Eur Heart J 1998; 19(8): 1214–1223.
6. Schiele F, Meneveau N, Vuillemenot A et al. Impact of intravascular ultrasound guidance in stent deployment on 6-month restenosis rate: a multicenter, randomized study comparing two strategies--with and without intravascular ultrasound guidance. RESIST Study Group. REStenosis after Ivus guided STenting. J Am Coll Cardiol 1998; 32(2): 320–328.
7. Mudra H, di Mario C, de Jaegere P et al. Randomized comparison of coronary stent implantation under ultrasound or angiographic guidance to reduce stent restenosis (OPTICUS study). Circulation 2001; 104(12): 1343–1349.
8. Gil RJ, Pawlowski T, Dudek D et al. Investigators of Direct Stenting vs. Optimal Angioplasty trial (DIPOL). Comparison of angiographically guided direct stenting technique with direct stenting and optimal balloon angioplasty guided with intravascular ultrasound: the multicenter, randomized trial results. Am Heart J 2007; 154(4): 669–675.
9. Casella G, Klauss V, Ottani F et al. Impact of intravascular ultrasound-guided stenting on long-term clinical outcome: a meta-analysis of available studies comparing intravascular ultrasound-guided and angiographically guided stenting. Catheter Cardiovasc Interv 2003; 59(3): 314–321.
10. Parise H, Maehara A, Stone GW et al. Meta-analysis of randomized studies comparing intravascular ultrasound versus angiographic guidance of percutaneous coronary intervention in pre-drug-eluting stent era. Am J Cardiol 2011; 107(3): 374–382.
11. Jakabcin J, Spacek R, Bystron M et al. Long-term health outcome and mortality evaluation after invasive coronary treatment using drug eluting stents with or without the IVUS guidance. Randomized control trial. HOME DES IVUS. Catheter Cardiovasc Interv 2010; 75(4): 578–583.
12. Zhang Y, Farooq V, Garcia-Garcia HM et al. Comparison of intravascular ultrasound versus angiography-guided drug-eluting stent implantation: a meta-analysis of one randomised trial and ten observational studies involving 19,619 patients. Eurointervention 2012; 8(7): 855–865.
13. Jang JS, Song YJ, Kang W et al. Intravascular ultrasound-guided implantation of drug-eluting stentts to improve outcome: a meta-analysis. JACC Cardiovasc Interv 2014; 7(3): 233–243.
14. Ahn JM, Kang SJ, Yoon SH et al. Meta-analysis of outcomes after intravascular ultrasound-guided versus angiography-guided drug-eluting stent implantation in 26,503 patients enrolled in three randomized trials and 14 observational studies. Am J Cardiol 2014; 113(8): 1338–1347.
15. Witzenbichler B, Maehara A, Weisz G et al. Relationship between intravascular ultrasound guidance and clinical outcomes after drug-eluting stents the assessment of dual antiplatelet therapy with drug-eluting stents (ADAPT-DES) Study. Circulation 2014; 129(4): 463–470.
16. Pu J, Mintz GS, Brilakis ES et al. In vivo characterization of coronary plaques: novel findings from comparing greyscale and virtual histology intravascular ultrasound and near-infrared spectroscopy. Eur Heart J 2012; 33(3): 372–383.
17. Park SJ, Kang SJ, Ahjn JM et al. Visual-functional mismatch between coronary angiography and fractional flow reserve. JACC Cardiol Interv 2012; 5(10): 1029–1036.
18. Briguori C, Anzuini A, Airoldi F et al. Intravascular ultrasound criteria for the assessment of the functional significance of intermediate coronary artery stenoses and comparison with fractional flow reserve. Am J Cardiol 2001; 87(2): 136–141.
19. Nishioka T, Amanullah A, Luo H et al. Clinical validation of intravascular ultrasound imaging for assessment of coronary stenosis severity. Comparison with stress myocardial perfusion imaging. J Am Coll Cardiol 1999; 33(7): 1870–1878.
20. Jasti V, Ivan E, Yalamanchili V et al. Correlation between fractional flow reserve and intravascular ultrasound in patients with an ambiguous left main coronary artery stenosis. Circulation 2004; 110(18): 2831–2836.
21. de la Torre Hernandez JM, Hernández Hernandez F, Alfonso F et al. Prospective application of pre-defined intravascular ultrasound criteria for assessment of intermediate left main coronary artery lesions results from the multicenter LITRO study. J Am Coll Cardiol 2011; 58(4): 351–358.
22. Puri R, Kapadia S, Nicholls S et al. Optimizing outcomes during left main percutaneous coronary intervention with intravascular ultrasound and fractional flow reserve. JACC Cardiovasc Interv 2012; 5(7): 697–707.
23. Akyildiz AC, Speelman L, van Brummelen H et al. Effects of intima stiffness and plaque morphology on peak cap stress. Biomed Eng Online 2011; 10 : 25. Dostupné z DOI: <http//dx.doi.org/10.1186/1475–925X-10–25>.
24. Jansen K, van Soest G, van der Steen AF Intravascular photoacoustic imaging: a new tool for vulnerable plaque identification. Ultrasound Med Biol 2014; 40(6): 1037–1048.
25. Jansen K, Wu M, van der Steen AF et al. Photoacoustic imaging of human coronary atherosclerosis in two spectral bands. Photoacoustic 2013; 2(1): 12–20.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 12-
All articles in this issue
-
Orientační běh od intervence k prevenci.
Prof. MUDr. Michael Aschermann slaví významné životní jubileum - Životní jubileum prof. MUDr. Michaela Aschermanna, DrSc., FESC, FACC
- Antikoagulační léčba v sekundární prevenci koronárních příhod
-
Anémie a nedostatek železa v interní praxi:
od gastroenterologie ke kardiologii a ještě dál - Embolizační ischemické cévní mozkové příhody
- Pomůže nám nový SGLT2 inhibitor empagliflozin snížit riziko hypoglykemie?
- Minulost a současnost problematiky plicní cirkulace ve Všeobecné fakultní nemocnici v Praze
- Katetrizační ablace fokálně spouštěné fibrilace komor u pacientů se strukturálním postižením srdce
- Současné postavení intravaskulární ultrasonografie v intervenční kardiologii
- Obezita a srdce
- Karotický stenting – vývoj, trendy a inovace
- Mají natriuretické peptidy novou šanci v léčbě srdečního selhání?
-
Renální denervace u pacientů s rezistentní hypertenzí:
je možné ji ještě resuscitovat? - Moderní léčba akutních iktů: příklad multidisciplinární spolupráce
- Katetrizační metoda léčby chronické mitrální regurgitace pomocí mitrální svorky (MitraClip)
- IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (studie IMPROVE-IT)
-
Orientační běh od intervence k prevenci.
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Katetrizační metoda léčby chronické mitrální regurgitace pomocí mitrální svorky (MitraClip)
-
Anémie a nedostatek železa v interní praxi:
od gastroenterologie ke kardiologii a ještě dál - Embolizační ischemické cévní mozkové příhody
- Obezita a srdce
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

