-
Medical journals
- Career
Metody vyšetřování mikrocirkulace kůže
: J. Tomešová 1; J. Gruberová 1; P. Brož 2; S. Lacigová 1; M. Krčma 1; Z. Rušavý 1
: Diabetologické centrum I. interní kliniky Lékařské fakulty UK a FN Plzeň, přednosta prof. MU Dr. Martin Matějovič, Ph. D. 2 Ústav klinické biochemie a hematologie Lékařské fakulty UK a FN Plzeň, přednosta prof. MU Dr. Jaroslav Racek, DrSc. 1
: Vnitř Lék 2013; 59(10): 895-902
: Review
Mikrocirkulace hraje významnou roli v patofyziologii řady závažných onemocnění. V dnešní době existuje mnoho technik, které umožňují hodnocení mikrovaskulární perfuze. Některé z nich našly své výzkumné a klinické uplatnění i v České republice. V posledním desetiletí pak lze najít články o jednotlivých metodách rovněž na stránkách časopisu Vnitřní lékařství. Cílem této práce je po krátké rekapitulaci anatomie a funkce mikrocirkulace podat ucelený přehled dosud využívaných metod vyšetření mikrocirkulace, jejich teoretické i praktické využití a výhody a nevýhody jednotlivých technik.
Klíčová slova:
mikrocirkulace – mikrovaskulární perfuze – Laser Doppler techniky – transkutánní oxymetrie – kapilaroskopieÚvod
Mikrocirkulace je část cévního řečiště, do které patří drobné arterioly, prekapilární svěrače, kapiláry a venuly. Řečiště je uspořádáno do 2 pletení. Povrchová, subpapilární pleteň je uložena asi 0,5 μm pod povrchem kůže a plní funkci výživnou. Hlubší, kožní pleteň je v hloubce asi 1,5 – 2 mm. Obě části jsou propojeny spojkami neboli arteriovenózními shunty (AVS), které mají funkci termoregulační. Plocha kapiláry (5 × 10 – 5 mm2) a rychlost proudění krve (přibližně 0,4 mm/ s) byly po dlouhou dobu problémem, znemožňujícím zkoumání této části cévního systému.
Mezi hlavní funkce mikrocirkulace kůže patří termoregulace (především pomocí arteriovenózních spojek), nutrice (přísun živin do tkání), odsun odpadních produktů metabolizmu (převážně povrchová pleteň) a vazomotorická reakce (regulace krevního tlaku).
Kapilární endotel leží na bazální membráně (šíře asi 250 nm). Krev se do kapilárního systému dostává nejmenšími arteriolami (velikost 10 – 15 μm). V ústí těchto arteriol je endotel tenčí a hladká svalovina ve stěně arterioly je nahrazena 2 nebo více buňkami reprezentujícími prekapilární sfinktery. Arterioly jsou zásobeny eferentními nemyelinizovanými vazokonstrikčními nervovými vlákny. Arteriovenózní anastomózy, zajišťující zejména termoregulaci, jsou ve velkém počtu přítomny zejména v terminálních částech těla (bříšcích prstů, nehtovém lůžku, dlani, plantě apod.). Jejich lokalizace je asi 1 – 1,5 mm pod povrchem pokožky. Většina krevního toku u tohoto typu kůže (papilární) probíhá právě v AVS spojkách [1]. Naproti tomu minimum AVS má tzv. nepapilární typ kůže a funkce mikrocirkulace je zde převážně nutritivní (dorsum nohy) [2].
Kožní mikrocirkulace je kontrolována několika mechanizmy:
- a) Kontrola autonomním nervovým systémem, který inervuje AVS a reguluje tak množství krve přitékající do arteriol. Při neuropatii s postižením sympatického nervového systému dochází k otevření těchto shuntů a redistribuci průtoku krve (nedostatečné zásobení koncových arteriol).
- b) Nerve ‑ axon reflex zprostředkovaná vazodilatace. Reakce skrze C nociceptivní vlákna, kdy při stimulaci dochází k antidromní stimulaci sousedních C vláken, a to vede k uvolnění vazodilatačních substancí, jako je substance P, bradykinin, adenozin analog ATP, kalcitonin generelated peptide (CGRP). Tato reakce je známá jako Lewis triple flare. Studie prokázala, že tato neurovaskulární odpověď zaujímá 1/ 3 z celkové – na endotelu závislé – vazodilatace u zdravých a diabetiků bez DN [3]. Tento mechanizmus je porušen při přítomnosti diabetické neuropatie [3 – 5].
- c) Sympaticky zprostředkovaný vazokonstrikční reflex (venoarteriální reflex – VAR), který je aktivován vlivem gravitace. Při vzpřímeném postoji je na DK vyšší hydrostatický tlak v cévách – to by rychle vedlo k edému tkáně. Zvýšení tlaku v žilách aktivuje nervová vlákna. Tento impuls vede antidromně podél postganglionového sympatického sudomotorického axonu do místa rozvětvení tepny a žíly a odtud ortodromně k arteriole, kde způsobí vazokonstrikci prekapilárního sfinkteru. Míra vazokonstrikce je přímo úměrná výšce hydrostatického tlaku. Snížení tohoto VAR lze pozorovat u diabetiků s autonomní neuropatií [6].
- d)Role endotelia – je známo, že endotel hraje důležitou roli v kontrole mikrovaskulárního tonu (syntéza vazodilatačních substancí – NO, prostacyklin, endotelium derived hyperpolarizing faktor, a vazokonstrikčních substancí – prostaglandiny, angiotenzin, endotelin) [4]. Při poruše endotelové funkce dochází k poruchám cévní relaxace, nedostatečné vazomotorické odpovědi na podněty závislé na endotelu a predispozici k vazokonstrikci [7]. Endotelová dysfunkce hraje důležitou roli v patogenezi různých chorob, v neposlední řadě také v komplikacích diabetu [8].
Mikrovaskulární dysfunkce je v dnešní době, na podkladě mnoha studií, spojována s řadou cévních onemocnění [9]. Jako reprezentativní cévní oblast k vyhodnocení a pochopení mechanizmu mikrovaskulární funkce a jejích poruch se považuje mikrocirkulace kůže [10]. Kožní mikrocirkulace se v posledních letech stala ukazatelem systémové mikrovaskulární funkce u řady nemocí. Patří sem hlavně hypertenze, dále ostatní kardiovaskulární rizikové faktory [11], diabetes mellitus [12], chronické selhání ledvin [13]. Využívá se ke sledování mikrocirkulace různých orgánových systémů během chirurgického výkonu, ke sledování funkce štěpu, u popálenin. Kožní mikrocirkulace se také využívá jako model mikrovaskulární funkce u experimentálního šoku [14].
Metody určené k vyšetření mikrocirkulace kůže můžeme rozdělit na techniky umožňující sledování morfologie cév (např. kapilaroskopie a od ní odvozené metody) nebo techniky, které nám dávají informaci o funkci mikrocirkulace (Laser Doppler metody při použití provokačních testů). Dále na metody, které umožňují přímé měření mikrocirkulace (laser systémy) nebo nepřímé měření (transkutánní tlak kyslíku, místní kapnometrie apod.).
Při měření mikrocirkulace je nutné dodržení určitých podmínek. Mikrocirkulaci ovlivňuje teplota, proto je nutné udržování stálé teploty ve vyšetřovací místnosti. Zvýšení teploty v místnosti o 3 °C signifikantně zvyšuje nejen bazální průtok, ale také výsledky provokačních testů, změny jsou nejvíce vyjádřeny při měření na prstech. Při měření na předloktí není tento jev tak markantní [15]. Další faktory ovlivňující měření jsou mentální stres a strach. Proto by měření mělo probíhat v místnosti se stálou teplotou, pacient by měl být v klidu a měření by mělo být zahájeno po předchozí aklimatizaci pacienta.
Je nutné vědět, že u všech metod hraje roli kožní rezistence [16]. Je nutné počítat také s inter ‑ individuální variabilitou, ale také s různou rezistencí na různých částech těla – ta závisí na hustotě potních žláz a vlasových folikulů [17]. Signál je dále významně ovlivněn pohybovými artefakty.
Metody vyšetřování mikrocirkulace kůže
Měření transkutánního tlaku kyslíku – transkutánní oxymetrie (tcpO2)
Jedná se o poměrně starou a v klinické praxi rozšířenou metodu, založenou na polarografickém principu, která sleduje obsah kyslíku difundujícího z kapilár skrze tkáň do povrchových vrstev kůže. Metoda poskytuje bezprostřední informaci o schopnosti tkáně uvolnit kyslík. Pro zvýšení permeability kůže je doporučeno zahřátí senzoru na teplotu 44 °C, při této teplotě je dosaženo maximální vazodilatace, a tím i maximální hyperemie. Vyšší teplota nevede k výraznější vazodilataci a navíc může být nepříjemná pro pacienta.
Sonda je těsně přiložena na kůži a elektroda se přes kontaktní roztok přímo dotýká povrchu kůže. Po určité době (v praxi asi 15 – 20 min) dojde k vyrovnání parciálních tlaků kyslíku na povrchu pokožky a ve tkáni bezprostředně pod ní, čehož se při tcpO2 využívá.
Používají se 2 sondy – jedna umístěná ve vyšetřované oblasti (převážně na dolních končetinách) a druhá (referenční sonda) umístěná pod klíček.
Jedná se metodu levnou, umožňující kontinuální monitoraci transkutánního tlaku kyslíku. Zachycuje i hlubší vrstvy pokožky, než je tomu např. u Lasser Doppler Flowmetrie. Metoda je dnes již poměrně rozšířená i v klinické praxi, data jsou dobře porovnatelná a vyhodnotitelná.
Technika je založená na nepřímém měření mikrocirkulace. Měření je nutné provádět pouze za standardních vnějších podmínek. Nevýhodou metody je relativní časová náročnost. Před každým měřením je nutná kalibrace sond a vyčkání přibližně 20 min k ustálení hladiny O2 v kontaktní kapalině. Celkově měření trvá 45 – 60 min. Proto není tato metoda vhodná pro emergentní situace. Jakékoliv poškození kůže (vyrážka, škrábnutí, zánět, recentní oholení kůže aj.) ovlivňuje měření a může být zdrojem chybných dat. Dále je metoda ovlivněna také systémovými faktory (plicní onemocnění, anemie, chronická ischemická choroba srdeční).
Použití v klinické praxi
TcpO2 je v dnešní době rutinně využívána a je schválena úhrada pojišťovnou.
Využívá se při stanovení stupně ischemické choroby dolních končetin [18]. Hodnoty v rozmezí 40 – 80 mm Hg se považují za fyziologické. TcpO2 pod 30 mm Hg je hranicí pro kritickou končetinovou ischemii s nízkou prognostickou hodnotou hojení [19].
Měření je výhodné zejména u diabetiků s mediokalcinózou, kde je diagnostika ischemie končetin pomocí např. dopplerovského ultrazvukového vyšetření nespolehlivá.
Dále se používá u pacientů s chronickými defekty ke zvážení indikace revaskularizace, ke zhodnocení úspěšnosti revaskularizace a časnému rozpoznání možné restenózy.
TcpO2 se také používá k posouzení viability a možnosti zhojení defektů před amputačními výkony, kdy při hodnotě pod 30 mm Hg je hojení defektu bez cévní intervence nepravděpodobné. Měřením tcpO2 lze určit optimální výši amputace končetiny.
Své využití má i v hyperbarické medicíně ke zjištění reaktivity tkání a předpokládané efektivity hyperbarické oxygenoterapie [20], při výzkumu syndromu spánkové apnoe (využití měření tkáňového CO2 na stejném principu), v intenzivní medicíně jako alternativa ke sledování saturace.
Skin Perfusion Pressure (SPP) – měření kožního perfuzního tlaku
Jedná se o neinvazivní metodu, která je založena na měření perfuzního tlaku. Po uvolnění řízené okluze končetiny manžetou dojde k obnovení perfuze v mikrocirkulaci. Laserový senzor je umístěn přímo v okluzní manžetě a snímá obnovený průtok. Metoda nám poskytuje informaci o reaktivitě mikrocirkulace.
Použití v klinické praxi
Stejně jako tcpO2 se využívá k určení pravděpodobnosti hojení rány [21], k diagnostice chronické končetinové ischemie a sledování efektu endovaskulární intervence [22].
Za fyziologickou se považuje hodnota perfuzního tlaku nad 50 mm Hg. Hodnota pod 30 mm Hg koreluje se zhoršenou prognózou hojení defektů a odpovídá kritické končetinové ischemii.
Jedná se o časově nenáročnou, neinvazivní metodu vyšetření mikrovaskulární reaktivity. Není ovlivněna lokálními faktory (otokem, otlakem, lokalizací defektu), anemií apod.
Kapilaroskopie
Kapilaroskopie je mikroskopická metoda, umožňující přímé, in vivo pozorování kožních kapilár. Jako jediná metoda umožňuje sledovat pouze nutritivní kapilární řečiště v hloubce přibližně 50 – 200 μm. Využívá mikroskopu s osvětlením pozorované plochy intenzivním zeleným světlem, čímž je dosaženo maximálního kontrastu s krevními elementy. V dnešní době je běžné propojení mikroskopu s videem a počítačové zpracování obrazu, což umožňuje podrobnější zhodnocení a porovnání nálezů – videokapilaroskopie. Vyšetřovat lze pouze kapiláry, které jsou umístěny rovnoběžně s kožním povrchem (nehtové lůžko). Při základní (nativní) kapilaroskopii se hodnotí počet a morfologie kapilár, stupeň stázy, počet otevřených kapilár a další. Dynamickou kapilaroskopií hodnotíme průtoky kapilárním řečištěm (blood flow velocity) (obr. 1).
1. Videokapilaroskop, mikroskop propojený s videem a počítačové zpracování obrazu. 
Dříve se využívala injekce barviva (fluoresceinu) k vyhodnocení transkapilární a intersticiální difuze. Fluorescein zlepšuje kontrast a poskytuje informace o kapilární propustnosti. Tato technika byla využívána ke studiím vlivu věku na mikrocirkulaci a u různých onemocnění, jako např. diabetes, systémová skleróza, psoriáza.
Tyto techniky jsou ale v dnešní době nahrazeny Orthogonal Polarization Spectral (OPS) nebo Sidestream Dark Field (SDF) zobrazením, které jsou bezpečnější, neinvazivní a poskytují lepší kontrast.
Mezi výhody patří relativně nízká cena. Umožní pozorování kapilárního systému v reálném čase, sledování morfologie kapilárního systému, denzity kapilár a průtoku kapilárním systémem. Změny v uvedených parametrech jsou charakteristické pro určité choroby. Výhodou metody je také možnost zpětného vyhodnocování a porovnávání záznamů. V neposlední řadě je třeba zmínit i relativně jednoduchou obsluhu přístroje.
Hlavní nevýhodou zůstává možnost zobrazení jen části cévního systému, který je uložen povrchově a rovnoběžně s povrchem kůže (nehtové lůžko). Metoda je relativně pracná, časová náročnost se odvíjí od zkušeností vyšetřujícího. Pigment pokožky silně absorbuje viditelné světlo, které je užito jako zdroj světla, což může činit vyšetření problematickým zejména u pacientů s vyšší pigmentací pokožky. Avšak fluorescentní videomikroskopie umožňuje monitoraci kapilárního systému i v těchto případech. Při použití fluorescentní látky se mohou vyskytnout její vedlejší účinky, jako např. urtika, zežloutnutí pacienta, proto je použití této metody limitováno a v praxi se používá zřídka.
Použití v klinické praxi
Tato metoda je rutinně využívána v klinické praxi – v angiologii, revmatologii, diferenciální diagnostika primárního a sekundárního Raynaudova syndromu [23] a dalších systémových onemocnění pojiva [24].
V diabetologii k posouzení mikrocirkulace u pacientů s defekty dolních končetin, ke stanovení závažnosti ischemie a rizika vzniku defektu (např. klasifikace podle Fagrella), dále jako doplňující vyšetření v různých oborech při onemocnění s možným vztahem k poškození mikrocirkulace.
Orthogonal Polarization Spectral (OPS) imaging
Metoda nabízí semikvantitativní analýzu mikrocirkulace. Lineárně polarizované světlo prochází přes dělič paprsků a dopadá na povrch tkáně. Světlo, které prochází do hloubky tkáně, kde dochází k vícečetnému rozptylu, je depolarizováno, prochází druhým polarizátorem a následně vytváří obraz na pozadí. Používá se vlnová délka 548 nm, při které je maximum absorpce rovnoměrně rozděleno mezi oxyhemoglobin a deoxyhemoglobin. Na vzniku obrazu se podílejí 2 fyzikální jevy: absorpce nezbytná pro dostatečný kontrast a rozptyl nezbytný k formování obrazu na pozadí (iluminaci). Dochází tak přímo k vizualizaci krevních cév mikrocirkulace.
Sidestream Dark Field (SDF) imaging
Jedná se o lehce odlišný princip citlivější metody. Diody (LEDs) emitující zelené světlo (540 ± 50 nm) jsou uspořádány do kruhu na konci optické sondy. Toto světlo přímo osvětluje tkáňovou mikrocirkulaci. Zdroj tohoto světla je opticky izolován od jádra sondy, kde prochází světlo emitované zpět tkání. Poskytuje zobrazení mikrocirkulace s větším rozlišením a kontrastem [25]. Je možné zřetelně pozorovat pohybující se erytrocyty (jako tmavé skvrny pohybující se proti světlejšímu – šedému pozadí) a obraz analytickým softwarem vyhodnotit. Se sondou je možno vyšetřovat přímo držením v ruce nebo lépe prostřednictvím nastavitelného fixátoru s flexibilním ramenem. Nejčastější je měření sublinguální sliznice.
Výhodou metod OPS/ SDF je přenosnost. Metoda umožňuje optimální rozlišení u orgánů, které mají pouze tenkou epiteliální vrstvu a nevyžaduje aplikaci fluoresceinu k zajištění dobrého kontrastu.
Nežádoucí je tlak sondy (OPS/ SDF) při kontaktu s tkání, laterální pohyb tkáně, který znesnadňuje fixaci obrazu [26]. Metoda nemůže být použita u fototypů IV, V, VI, protože melanin absorbuje světlo podobně jako hemoglobin [27]. OPS je celkem finančně náročná metoda.
Použití OPS/ SDF v klinické praxi
Metody jsou využívány pouze ve výzkumné činnosti. Největší zkušenosti jsou u kriticky nemocných se závažnou sepsí včetně efektu některých léčiv [28], nebo v časné postresuscitační péči [29]. OPS i SDF jsou dále používány v chirurgii k vyšetření mikrocirkulace různých orgánů: mozek [30], ledviny [31], játra [32], při sledování hojení popálenin [33] a u chronické žilní insuficience [34].
Laser Doppler Flowmetrie (LDF)
Tato metoda využívá Dopplerova principu, kdy je zaznamenáván odraz záření od jednotlivých pohybujících se krevních elementů. Součástí přístroje je světelný zdroj, fotodetektor k absorpci odraženého světla a přístroj se softwarem k vyhodnocení údajů. Hloubka měření je závislá na vlastnostech tkáně (absorpce světla), vlnové délce použitého světla (čím větší vlnová délka, tím větší dosah, ale menší přesnost) a na vzdálenosti optických vláken vysílače a přijímače. Čím větší je tato vzdálenost, tím hlubší je dosah sondy. Běžná hloubka měření je asi 1 – 2 mm. LDF tedy měří lokální průtok v celém cévním řečišti (kapiláry, arterioly, venuly i arteriovenózní shunty).
Absolutní velikost průtoku nelze přesně stanovit, naměřený frekvenční posun je závislý na vlastnostech tkáně a na pohybu ostatních součástí tkáně, které jsou u každého subjektu odlišné. Proto je průtok tkání měřen v perfuzních jednotkách (perfusion unit – PU), kde 1 PU je předem definovaná hodnota elektrického signálu v mV. Vzhledem k těmto skutečnostem se používá celá řada provokačních testů, kdy se měří změny perfuze v PU oproti bazálním hodnotám. Tyto provokační testy bychom mohli rozdělit na testy s použitím farmak a bez použití farmak.
Testy bez použití farmak: přechodná hyperemie (transient hyperemic response test), teplem indukovaná lokální hyperemie (local thermal hyperemia test – LTH), lokální chladový test (local cooling test) a postokluzivní reaktivní hyperemie (postocclusive hyperemia – PORH). Shrnutí nefarmakologických provokačních testů v tab. 1.
1. Nefarmakologické provokační testy. 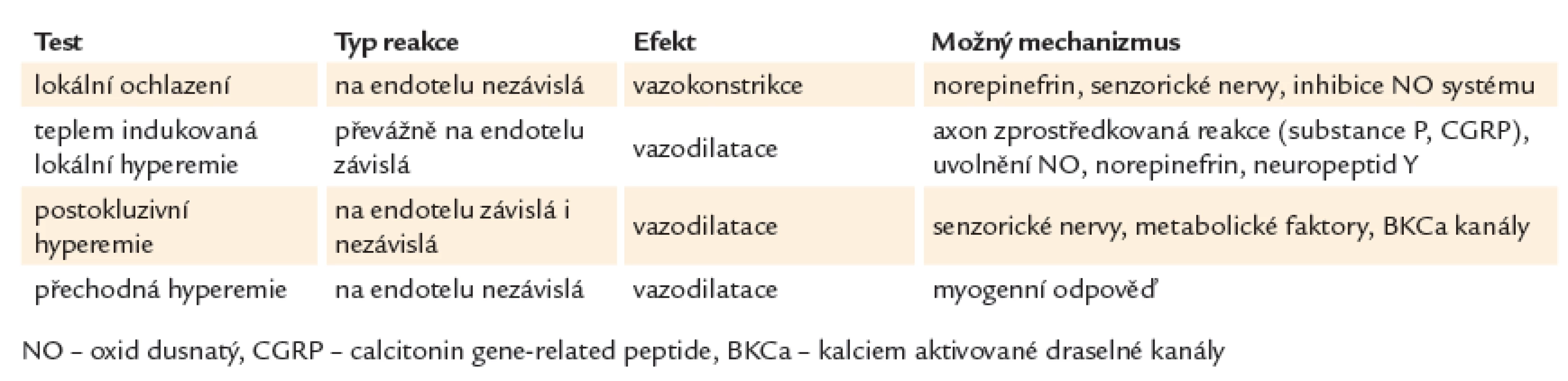
- Přechodná hyperemie: Jedná se o krátkou okluzi (20 s). Po uvolnění dojde ke zvýšení perfuze – endotel nezávislé vazodilataci, která je dána myogenní reakcí [35].
- Lokální ochlazení: Dříve se používalo např. ponoření ruky nebo prstu do studené vody, použití studených obkladů, náplastí nebo oxidu uhličitého. Tyto metody měly za následek vyvolání systémové sympatické aktivity, což může interferovat s místní mikrovaskulární odpovědí [36]. Proto se používá LDF sonda, která umožňuje pouze minimální místní ochlazení a vyhne se tak systémovému jevu [37]. Metoda se používá zejména u Raynaudova fenoménu [38]. Používají se teploty 15 – 24 °C. Nejlepší reproducibilita 30minutového ochlazení byla s teplotou 15 °C [37].
- Postokluzivní reaktivní hyperemie(PORH): Při tomto testu dochází ke zvýšení průtoku po uvolnění arteriální okluze. Nevýhoda je, že není konsensus optimálního trvání okluze, liší se různé protokoly od 1 do 15 min. Nejčastěji se používá okluze manžetou na suprasytolický tlak (30 – 50 mm Hg nad systolu) po dobu 3 min [39].
- Teplem indukovaná lokální hyperemie: Využívá zahřátí okrsku kůže k vyvolání maximální vazodilatace. I přesto, že bylo provedeno mnoho protokolů na stanovení optimální teploty, zdá se, že teplota 42 – 43 °C je dostačující k vyvolání maximální vazodilatace [40].
LDF je metoda relativně cenově dostupná. Při vytvoření skriptů na počítači pomocí softwaru se snižuje uživatelská náročnost metody. Vyznačuje se dobrým časovým rozlišením.
Vzhledem k vysoké variabilitě měření a velké citlivosti je metoda technicky náročná. Je nutné omezit rušivé vlivy, jako jsou vibrace, změny teploty, pohybové artefakty. Nevýhodou může být také hloubka měření, několik mm, což limituje použití LDF pro povrchové struktury jako kožní a mukózní povrchy [41].
Testy s použitím farmak: Sledování mikrocirkulace pod vlivem určité látky je možné pomocí mikrodialýzy a iontoforézy.
- Mikrodialýza: Semiinvazivní metoda používaná ke vpravení nebo odstranění léků či molekul do intersticiálního prostoru v kůži. Tato metoda je v naší oblasti zájmu v podstatě nahrazena iontoforézou.
- Laser Doppler Iontoforéza: Facilitovaný pohyb iontů přes membránu. Využívá elektrického náboje iontů a umožní jejich rychlejší průnik do tkáně. Používají se 2 elektrody. První s nábojem stejné polarity jako má použitý iont, který je touto elektrodou odpuzován a naopak přitahován k elektrodě druhé opačné polarity. Výsledkem je rychlejší a v čase konstantní vstřebávání zkoumané látky. Po aplikaci farmaka je pomocí LDF sledována perfuze tkáně. V závislosti na vybrané látce může a nemusí dojít ke změně perfuze. Velikost aplikovaného proudu se pohybuje mezi 100 – 150 μA. Vyšší proud by působil přímo na C vlákna, aktivoval je a mohl by zkreslit výsledky měření (obr. 2) [17,42].
2. Laser Doppler Iontoforéza – nalepená sonda která obsahuje zvolenou látku, 2 elektrody a dávkovač proudu. 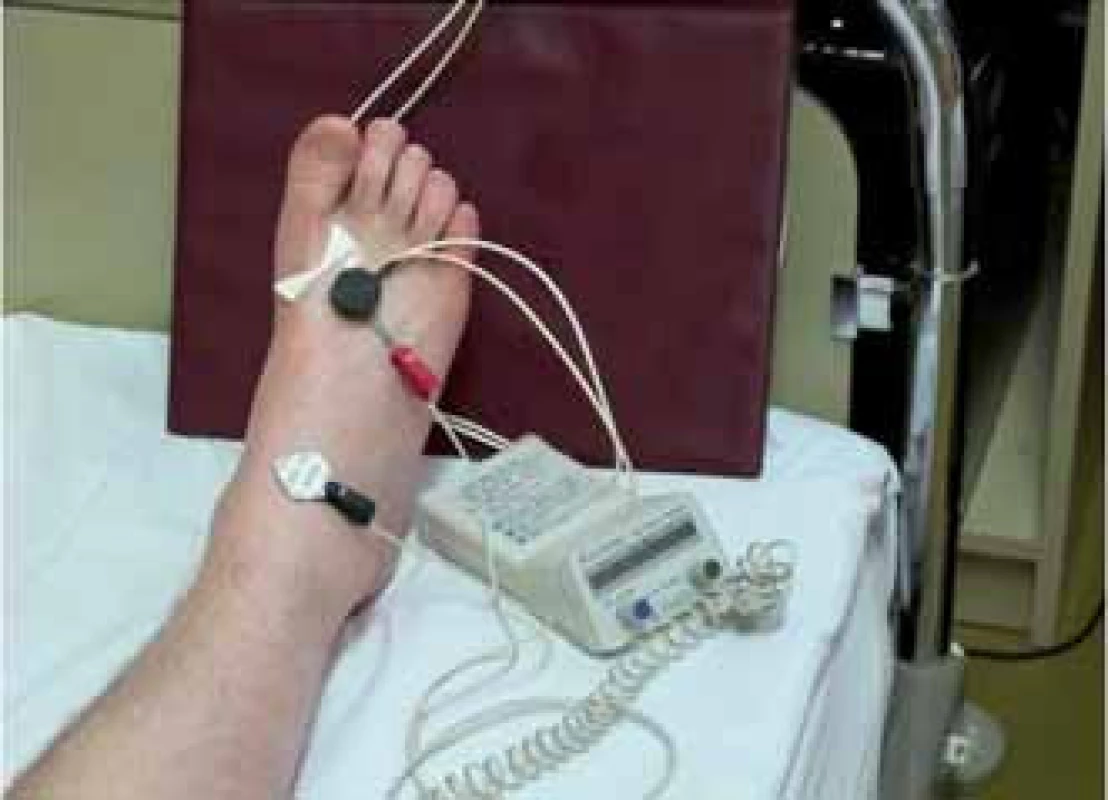
Metoda umožňuje bezpečné vpravení malého množství farmaka do cílové oblasti. Množství uvolněného farmaka závisí na intenzitě a délce použitého proudu. Existuje mnoho protokolů využívajících různou dobu působení proudu, počet stimulací, dobu před zahájením stimulace, intenzitu stimulace a dobu mezi stimulacemi [42].
Pro zkoumání mikrocirkulace kůže se používají následující látky působící na cévní řečiště: nejvíce používané jsou acetylcholin chlorid (ACH) a nitroprusid sodný (NPS) k vyvolání na endotelu závislé a nezávislé odpovědi [17]. Farmaka, která mohou být použita při iontoforéze, jsou uvedena v tab. 2.
2. Farmaka používaná při iontoforéze. 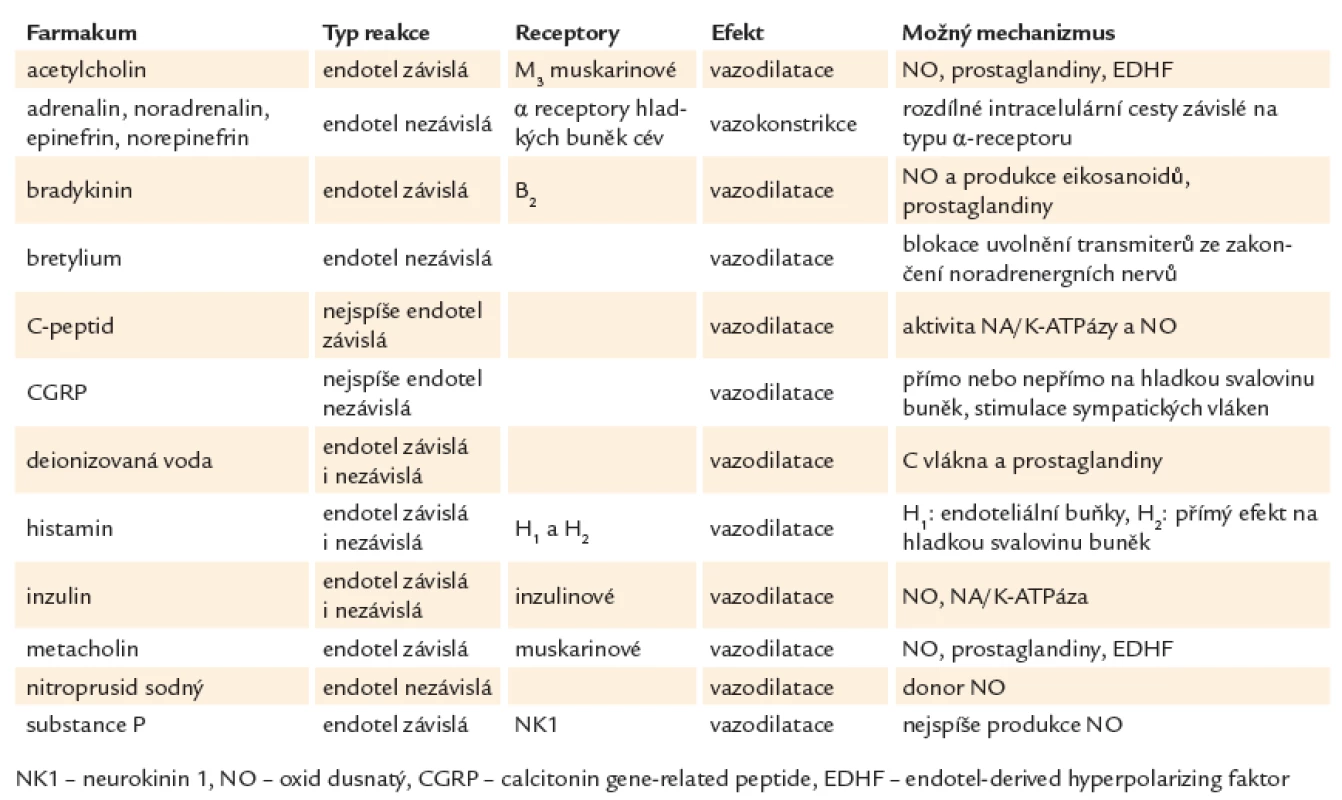
Nespornou výhodou iontoforézy je rozlišení vazodilatace na endotelu závislé a na endotelu nezávislé. Metoda je bezpečná a pro vyšetřované nenáročná. Na rozdíl od injekční aplikace není iontoforetická aplikace látky a vyšetření bolestivé, což zvyšuje compliance vyšetřovaných pacientů. Z těchto důvodů lze vyšetření opakovat a porovnávat výsledky. Metoda je prozatím využívána pouze pro výzkumné účely. Avšak vazodilatační efekt při iontoforéze se zvažuje jako nová terapie u nemocí postihujících mikrocirkulaci prstů, jako je systémová skleróza [43].
Vyšetření je delší a pro vyšetřující náročnější. Metoda vyžaduje aplikaci látky v přesně určených časových intervalech. Nedodržení časových odstupů bývá častým zdrojem chyb. Aplikace farmaka může u některých pacientů způsobit lokální iritaci pokožky, která sama vede k vazodilataci cestou nociceptivních vláken epidermis a tento jev může zkreslit výsledky měření. Tato komplikace závisí převážně na délce měření a množství aplikované látky. Mezi další faktory ovlivňující iontoforézu patří pH (kationty prostupují lépe než anionty), způsob aplikace látky (pulzní podání je více efektivní než aplikace kontinuální) a jako u všech metod biologické faktory (věk, pohlaví, tloušťka pokožky, hydratace pokožky, teplota pokožky). Mezi kontraindikace metody patří poškození kůže v místě měření (dermatitida, ulcerace), přítomnost implantátů citlivých na elektrické impulzy (kardiostimulátor, kardioverter) a alergická reakce na používané látky v anamnéze.
Použití LDF/ iontoforézy v klinické praxi
Tato metoda má i díky mnoha provokačním testům široké uplatnění ve výzkumné činnosti. Byla použita ke sledování mikrocirkulačních změn u chronické žilní insuficience a chronických bércových vředů [44]. Ubbink et al zkoumali použití LDF při stanovení závažnosti končetinové ischemie [45]. Další studie sledovala reaktivitu mikrocirkulace u obézních pacientů a prokázala zhoršení reaktivity oproti zdravým kontrolám [46]. Řada studií využívá LDF při vyšetřování kožní a svalové mikrocirkulace a reaktivity u kriticky nemocných [47]. Další využití v oborech: angiologie (Raynaudův fenomén), diabetologie (stanovení stupně kapilární ischemie a predikce rizika vzniku syndromu diabetické nohy) [48,49].
Metody odvozené od LDF – Laser Doppler Imaging (LDI) nebo také Laser Doppler Perfussion Imaging (LDPI)
Jde o bezkontaktní metodu, která zobrazuje průtok pokožkou. Zobrazuje perfuzi pokožky větší oblasti na rozdíl od LDF. Výsledkem je obrázek perfuze. Součásti přístroje je světelný zdroj (helium ‑ neonový laser o vlnové délce 670 nm), skener, optický detektor a počítač obsahující software k vyhodnocení výsledků. Doba potřebná k vyšetření je závislá na velikosti oblasti zájmu (např. vyšetření perfuze pokožky dlaně a prstů trvá asi 2 min).
Metoda je užívána v širokém spektru oborů. V praxi se s ní můžeme setkat při hodnocení kožních iritačních testů, při sledování procesu přihojování kožních štěpů u pacientů po popáleninách a při vyšetření stupně poškození pokožky při popáleninách (obr. 3).
3. Lasser Doppler Perfusion Imaging – světelný zdroj (helium-neonový laser), skener, optický detektor. Běžné je propojení s počítačem obsahující software k vyhodnocení výsledků. 
Metoda je uživatelsky jednoduchá, neinvazivní, bezkontaktní. Díky možnostem dodaného softwaru nejsou na uživatele kladeny žádné nároky ohledně analýzy výstupních dat. Velkou výhodou je možnost získání kvalitního, vysoce kontrastního barevného vyobrazení perfuze vyšetřované oblasti. Díky výpočetní technice je možno získané výsledky ukládat a zpětně porovnávat. Oproti LDF snižuje prostorovou variabilitu.
Metoda je časově náročnější než LDF, neumožňuje kontinuální monitoraci změn perfuze, nezachytí rychlé změny v perfuzi. Jedná se o metodu poměrně moderní, která najde v budoucnosti své místo.
Metody odvozené od LDF – Laser Speckle Contrast Imaging (LSCI)
Jedná se o novější techniku, která umožňuje nekontaktní, real time a neinvazivní monitoraci kožní mikrocirkulace [50]. Snímání je založené na změně zrnitých obrazců při použití laserového zdroje světla. Zrnění je způsobeno interferencí koherentního světla (světlo z laseru), ke kterému dochází po odrazu světla od nerovného povrchu. Tím, jak se světlo odráží od pohyblivých částic, dochází ke změnám zrnitého obrazu v čase. LSCI zobrazuje mapu perfuze jako 2D obraz. Měření je ovlivněno vzdáleností mezi detektorem a vyšetřovanou oblastí. Z vnějších podmínek je to proudění vzduchu a osvětlení – proudění vzduchu větší než 2,8 m/ s může zvyšovat hodnoty získané perfuze. Je nutné normální okolní osvětlení a stálost během měření.
LSCI je poměrně nová technika a k použití v každodenní praxi budou nutné další studie.
Jedná se o nekontaktní a real time techniku, která dramaticky snižuje variabilitu klinických měření při srovnání s LDF. Oproti LDF a LDPI zobrazuje LSCI pouze povrchové nutritivní kapiláry (LDF a LDPI zobrazuje i hlubší cévy). Závisí na vlnové délce a vlastnostech tkáně. Při použité vlnové délce 780 nm je hloubka měření u LDF asi 1 mm a u LSCI 300 μm [51].
Mezi další metody, kterými lze vyšetřovat mikrocirkulaci, patří blízko infračervená spektroskopie (near infrared spectroscopy – NIRS) a zobrazení magnetickou rezonancí (magnetic resonance imaging – MRI). Obě metody jsou využívány pro sledování mikrocirkulace pouze v experimentální medicíně a využití pro sledování kožní mikrocirkulace je velmi omezené.
Závěr
Tento článek slouží jako přehled neinvazivních metod používaných k vyšetření mikrocirkulace. Není možné říci, které vyšetření slouží ke zhodnocení mikrocirkulace lépe a které hůře. Důležité je, co je cílem vyšetřování.
Při zavádění nové metody je nutné brát zřetel na perzonální a finanční možnosti pracoviště a na skutečnost, zda bude metoda užívána pro vědecké účely či pro klinickou praxi.
Mikrocirkulace hraje bezpochyby významnou roli v patofyziologii řady závažných onemocnění. V posledním desetiletí se techniky k jejímu sledování zlepšily a rozšířily, přesto jsou možnosti vizualizace a kvantitativního vyhodnocení mikrocirkulace, zejména v klinické praxi, stále velmi omezené.
V klinické praxi se využívá jen 2 metod: transkutánní oxymetrie a kapilaroskopie. Ostatní metody jsou omezeny stále jen pro výzkumnou činnost.
Největší limitací spatřujeme v absenci vysoce standardizovaných postupů a protokolů měření. Těchto standardů je potřeba, aby bylo možné získaná data z různých pracovišť porovnat a dobře interpretovat. Jen tak lze v budoucnu tyto metody zařadit do rutinní klinické praxe.
Velice slibné výsledky při sledování mikrocirkulace přináší využití Laser Doppler Flowmetrie (a metod od ní odvozených), především pro možnost využití řady provokačních testů. Umožňuje nám sledovat funkční rezervu a reaktivitu mikrocirkulace kůže. Při použití iontoforézy s vazoaktivními substancemi jsme schopni odlišit jednotlivé patofyziologické cesty porušené mikrocirkulace.
Tento projekt byl podpořen Programem rozvoje vědních oborů Karlovy Univerzity (projekt P36).
MU Dr. Jitka Tomešová
www.fnplzen.cz
e‑mail: tomesovaj@fnplzen.cz
Doručeno do redakce: 22. 4. 2013
Přijato po recenzi: 17. 5. 2013
Sources
1. Freccero C, Holmlund F, Bornmyr S et al. Laser Doppler perfusion monitoring of skin blood flow at different depths in finger and arm upon local heating. Microvasc Res 2003; 66 : 183 – 189.
2. Flynn MD, Tooke JE. Microcirculation and the diabetic foot. Vasc Med Rev 1990; 1 : 121 – 138.
3. Hamdy O, Abou ‑ Elenin K, LoGerfo FW et al. Contribution of nerve ‑ axon reflex‑related vasodilation to the total skin vasodilation in diabetic patients with and without neuropathy. Diabetes Care 2001; 24 : 344 – 349.
4. Chao CY, Cheing GL. Microvascular dysfunction in diabetic foot disease and ulceration. Diabetes Metab Res Rev 2009; 25 : 604 – 614.
5. Caselli A, Rich J, Hanane T et al. Role of C ‑ nociceptive fibers in the nerve axon reflex‑related vasodilation in diabetes. Neurology 2003; 60 : 297 – 300.
6. Iwase M, Imoto H, Murata A et al. Altered postural regulation of foot skin oxygenation and blood flow in patients with type 2 diabetes mellitus. Exp Clin Endocrinol Diabetes 2007; 115 : 444 – 447.
7. Verma S, Buchanan MR, Anderson TJ. Endothelial function testing as a biomarker of vascular disease. Circulation 2003; 108 : 2054 – 2059.
8. Funk SD, Yurdagul A Jr, Orr AW. Hyperglycemia and endothelial dysfunction in atherosclerosis: lessons from type 1 diabetes. Int J Vasc Med 2012; 2012 : 569654.
9. Roustit M, Cracowski JL. Non ‑ invasive assessment of skin microvascular function in humans: an insight into methods. Microcirculation 2012; 19 : 47 – 64.
10. Holowatz LA, Thompson ‑ Torgerson CS, Kenney WL. The human cutaneous circulation as a model of generalized microvascular function. J Appl Physiol 2008; 105 : 370 – 342.
11. Levy BI, Schiffrin EL, Mourad JJ et al. Impaired tissue perfusion: a pathology common to hypertension, obesity, and diabetes mellitus. Circulation 2008; 118 : 968 – 976.
12. Yamamoto ‑ Suganuma R, Aso Y. Relationship between post‑occlusive forearm skin reactive hyperaemia and vascular disease in patients with Type 2 diabetes – a novel index for detecting micro ‑ and macrovascular dysfunction using laser Doppler flowmetry. Diabet Med 2009; 26 : 83 – 88.
13. Kruger A, Stewart J, Sahityani R et al. Laser Doppler flowmetry detection of endothelial dysfunction in end‑stage renal disease patients: correlation with cardiovascular risk. Kidney Int 2006; 70 : 157 – 164.
14. Engelberger RP, Pittet YK, Henry H et al. Acute endotoxemia inhibits microvascular nitric oxide ‑ dependent vasodilation in humans. Shock 2011; 35 : 28 – 34.
15. Roustit M, Blaise S, Millet C et al. Reproducibility and methodological issues of skin post‑occlusive and thermal hyperemia assessed by single‑point laser Doppler flowmetry. Microvasc Res 2010; 79 : 102 – 108.
16. Ramsay JE, Ferrell WR, Greer IA et al. Factors critical to iontophoretic assessment of vascular reactivity: implications for clinical studies of endothelial dysfunction. J Cardiovasc Pharmacol 2002; 39 : 9 – 17.
17. Turner J, Belch JJ, Khan F. Current concepts in assessment of microvascular endothelial function using laser Doppler imaging and iontophoresis. Trends Cardiovasc Med 2008; 18 : 109 – 116.
18. Urbanová R, Jirkovská A, Wosková V et al. Transcutaneous oximetry in the diagnosis of ischemic disease of the lower extremities in diabetics. Vnitř Lék 2001; 47 : 330 – 332.
19. Schaper NC. Specific Guidelines for the diagnosis and treatment of peripheral arterial disease in a patient with diabetes and ulceration of the foot 2011. Diabetes Metab Res Rev 2012; 28 (Suppl 1): 236 – 237.
20. Cechurová D, Rusavý Z, Lacigová S et al. Transcutaneous oxygen tension in hyperbaric condition as a predictor of ischaemia in non‑healing diabetic foot ulcers. Vnitř Lék 2002; 48 : 971 – 975.
21. Standards of medical care in diabetes – 2012 (position statement). Diabetes Care 2012; 35 (Suppl 1): 11 – 63.
22. Kawadara O. Assessment of macro ‑ and microcirculation in contemporary critical limb ischemie. Catheter Cardiovasc Interv 2011; 78 : 1051 – 1058.
23. Takáts A, Garai I, Papp G et al. Raynaud’s syndrome, 2011. Orv Hetil 2012; 153 : 403 – 409.
24. Li LG, Zhang JL, Liu XH et al. The diagnostic significance of naifold video ‑ capillaroscopy in systemic sclerosis. Zhonghua Nei Ke Za Zhi 2012; 51 : 362 – 365.
25. Bezemer R, Dobbe JG, Bartels SA et al. Rapid automatic assessment of microvascular density in sidestream dark field images. Med Biol Eng Comput 2011; 49 : 1269 – 1278.
26. Lindert J, Werner J, Redlin M et al. OPS imaging of human microcirculation: a short technical report. J Vasc Res 2002; 39 : 368 – 372.
27. Treu CM, Lupi O, Bottino DA et al. Sidestream dark field imaging: the evolution of real ‑ time visualization of cutaneous microcirculation and its potential application in dermatology. Arch Dermatol Res 2011; 303 : 69 – 78.
28. De Backer D, Creteur J, Dubois MJ et al. The effects of dobutamine on microcirculatory alterations in patients with septic shock are independent of its systemic effects. Crit Care Med 2006; 34 : 403 – 408.
29. Sakr Y, Dubois MJ, De Backer D et al. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock. Crit Care Med 2004; 32 : 1825 – 1831.
30. Pérez ‑ Bárcena J, Goedhart P, Ibáñez J et al. Direct observation of human microcirculation during decompressive craniectomy after stroke. Crit Care Med 2011; 39 : 1126 – 1129.
31. Schmitz V, Schaser KD, Olschewski P et al. In vivo visualization of early microcirculatory changes following ischemia/ reperfusion injury in human kidney transplantation. Eur Surg Res 2008; 40 : 19 – 25.
32. Puhl G, Schaser KD, Vollmar B et al. Noninvasive in vivo analysis of the human hepatic microcirculation using orthogonal polorization spectral imaging. Transplantation 2003; 75 : 756 – 761.
33. Kaiser M, Yafi A, Cinat M et al. Noninvasive assessment of burn wound severity using optical technology: a review of current and future modalities. Burns 2011; 37 : 377 – 386.
34. Virgini‑Magalhães CE, Porto CL, Fernandes FF et al. Use of microcirculatory parameters to evaluate chronic venous insufficiency. J Vasc Surg 2006; 43 : 1037 – 1044.
35. Beed M, O’Connor MB, Kaur J et al. Transient hyperaemic response to assess skin vascular reactivity: effects of heat and iontophoresed norepinephrine. Br J Anaesth 2009; 102 : 205 – 209.
36. Victor RG, Leimbach WN Jr, Seals DR et al. Effects of the cold pressor test on muscle sympathetic nerve activity in humans. Hypertension 1987; 9 : 429 – 436.
37. Roustit M, Maggi F, Isnard S et al. Reproducibility of a local cooling test to assess microvascular function in human skin. Microvasc Res 2010; 79 : 34 – 39.
38. Minson CT. Thermal provocation to evaluate microvascular reactivity in human skin. J Appl Physiol 2010; 109 : 1239 – 1246.
39. Tee GB, Rasool AH, Halim AS et al. Dependence of human forearm skin postocclusive reactive hyperemia on occlusion time. J Pharmacol Toxicol Methods 2004; 50 : 73 – 78.
40. Johnson JM, Kellogg DL Jr. Local thermal control of the human cutaneous circulation. J Appl Physiol 2010; 109 : 1229 – 1238.
41. Rajan V, Varghese B, van Leeuwen TG et al. Review of methodological developments in laser Doppler flowmetry. Lasers Mes Sci 2009; 24 : 269 – 283.
42. Tesselaar E, Sjöberg F. Transdermal iontophoresis as an in‑vivo technique for studying microvascular physiology. Microvasc Res 2011; 81 : 88 – 96.
43. Murray AK, Moore TL, King TA et al. Vasodilator iontophoresis a possible new therapy for digital ischaemia in systemic sclerosis? Rheumatology (Oxford) 2008; 47 : 76 – 79.
44. Sárník S, Hofírek I, Panovský R. Monitoring functional disorders of microcirculation using laser doppler flowmetry in patients with chronic venous insufficiency class 2 according to CEAP classification before and after varicose veins surgery. Vnitř Lék 2007; 53 : 1286 – 1295.
45. Ubbink DT, Jacobs MJ, Tangelder GJ et al. The usefulness of capillary microscopy, transcutaneous oximetry and laser Doppler fluxmetry in the assessment of the severity of lower limb ischaemia. Int J Microcirc Clin Exp 1994; 14 : 34 – 44.
46. Krsek M, Prázný M, Sucharda P et al. Changes in serum levels of IGF‑I and its binding proteins and their relation to microcirculation in obese patients. Vnitř Lék 2001; 47 : 847 – 851.
47. Luckner G, Dünser MW, Stadlbauer KH et al. Cutaneous vascular reactivity and flow motion response to vasopressin in advanced vasodilatory shock and severe postoperative multiple organ dysfunction syndrome. Crit Care 2006; 10: R40.
48. Hofírek I, Sochor O, Olsovský J. Assessment of changes in peripheral microcirculation in type I diabetics with laser doppler flowmetry. Vnitř Lék 2004; 50 : 836 – 841.
49. Jorneskog G. Why critical limb ischemia criteria are not applicable to diabetic foot and what the consequences are. Scand J Surg 2012; 101 : 114 – 118.
50. Mahé G, Humeau ‑ Heurtier A, Durand S et al. Assessment of skin microvascular function and dysfunction with laser speckle contrast imaging. Circ Cardiovasc Imaging 2012; 5 : 155 – 163.
51. O‘Doherty J, McNamara P, Clancy NT et al. Comparison of instruments for investigation of microcirculatory blood flow and red blood cell concentration. J Biomed Opt 2009; 14 : 034025.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 10-
All articles in this issue
- Prevalence of hyponatremia in patients on department of internal medicine
- The impact of a 14- day regular physical exercise regime on the concentration of the classes and sub‑classes of lipoprotein particles in young subjects with a sedentary lifestyle
- Ultra‑ high‑risk chronic lymphocytic leukemia – characteristics and treatment options
- Methods of skin microcirculation assessment
- The current approach to the treatment of the patients with metastatic colorectal cancer
- Management of dyslipidaemias – present and future. Guidelines of the Angiology Section of the Slovak Medical Chamber (2013)
- Tricuspid valve infective endocarditis in intravenous drug abuser
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Methods of skin microcirculation assessment
- Tricuspid valve infective endocarditis in intravenous drug abuser
- The current approach to the treatment of the patients with metastatic colorectal cancer
- Management of dyslipidaemias – present and future. Guidelines of the Angiology Section of the Slovak Medical Chamber (2013)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

